Область техники, к которой относится изобретение
Изобретение относится к способу диагностики конкретного заболевания, в частности к способу скрининга гена, обусловливающего связанное со спазмом коронарной артерии заболевание.
Предпосылки создания изобретения
Внутренний оксид азота (внутренний NO) представляет собой недавно обнаруженное in vivo соединение, которое, как было установлено, действует в качестве сосудорасширяющего фактора (18-25), нейромедиатора (11, 12) или иммунореактанта (13-17). Внутренний NO синтезируется из L-аргинина с помощью семейства ферментов, состоящего по крайней мере из трех синтаз оксида азота (NOSs), т.е. невральной NOS, эндотелиальной NOS и NOS макрофагов. Невральная NOS и эндотелиальная NOS характерна для соответствующих структур, а их активность усиливается в зависимости от концентраций внутриклеточного кальция. С другой стороны, NOS макрофагов не зависит от кальция и активируется при воспалении. Ранее рядом исследователей было изучено строение гена синтазы оксида азота эндотелиальных клеток (eNOS) и опубликованы данные о том, что ген eNOS локализован на хромосоме 7q35-36, состоит из 26 экзонов и имеет протяженность 21 т.п.н. (18-25).
Краткое описание изобретения
Известно, что спазм коронарной артерии является фактором, вызывающим различные ишемические заболевания сердца, такие, как коронарная спастическая стенокардия и вариантная стенокардия (1-6). Однако механизм коронарного спазма пока недостаточно понятен.
В связи с этим заявители по данной заявке провели исследование с целью выяснить механизм коронарного спазма, предполагая, что такие исследования могут способствовать разработке способов ранней диагностики и лечению ишемических заболеваний, связанных с коронарным спазмом. Следует отметить, что в большинстве предыдущих исследований было установлено, что наиболее важным патогенным механизмом коронарного спазма является гиперсократимость гладкой мышцы, а не повреждение эндотелия кровеносных сосудов (35).
Ацетилхолин обычно оказывает воздействие на гладкую мышцу, вызывая ее сокращение, однако через определенный промежуток времени ацетилхолин может вызвать расширение кровеносных сосудов в результате секреции оксида азота (NO), оказывающего воздействие на гладкую мышцу, в том случае, когда эндотелий не поврежден. Однако введение в коронарные сосуды пациентов, страдающих коронарной спастической стенокардией, определенной дозы ацетилхолина чаще вызывает коронарный спазм, а не расширение кровеносных сосудов (7,8). В соответствии с указанным фактом заявителями по данной заявке изобретения ранее уже было подтверждено, что основной уровень секреции NO, вызванный ацетилхолином, понижен у пациентов, страдающих коронарной спастической стенокардией (10).
Поскольку нитроглицерин и препараты на основе азотистой кислоты могут вызывать расширение кровеносных сосудов в процессе образования NO in vivo, основной уровень секреции NO может быть понижен в коронарной артерии пациентов, страдающих коронарной спастической стенокардией, что подтверждается тем фактом, что реакция сосуда, в котором происходит синтез NO, является подавленной, сверхчувствительной к препаратам на основе азотистой кислоты (9), а пациенты, страдающие коронарной спастической стенокардией, обладают повышенной чувствительностью к нитроглицерину. Эти результаты позволяют пересмотреть возможность наличия выраженной взаимосвязи между коронарным спазмом и NO, прежде всего в эндотелии, где происходит секреция NO. До настоящего времени не уделялось достаточного внимания изучению взаимосвязи между коронарным спазмом и эндотелием, где происходит секреция NO, за исключением известного факта о снижении основного уровня секреции NO.
Исходя из различных точек зрения, заявители по данной заявке предположили, что коронарный спазм может иметь генетическую основу в свете того факта, что коронарный спазм более часто встречается в Японии, чем в Соединенных Штатах Америки и в Европе (26, 27).
На основе вышеуказанных данных основное внимание было сконцентрировано на гене одного из ферментов семейства NOS, который продуцирует внутренний NO, а именно, синтазу оксида азота эндотелиальной клетки (eNOS), с целью выяснить, имеет ли развитие коронарного спазма генетическую основу, что и является предметом настоящего изобретения.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу скрининга гена, обусловливающего связанное со спазмом коронарной артерии заболевание, при этом способ включает выявление присутствия одной или нескольких нуклеотидных замен в гене эндотелиальной синтазы оксида азота (eNOS), причем эти замены выбирают из группы, включающей замены гуанина (G) на тимин (Т) в положении 894 и цитозина (С) на тимин (Т) в положении 774 последовательности кДНК гена eNOS и замены тимина (Т) на цитозин (С) в положении -786, аденина (А) на гуанин (G) в положении - 922 и тимина (Т) на аденин (А) в положении - 1468 5'-фланкирующей области гена eNOS, а также замены в соответствующих положениях в комплементарной ей цепи. В предпочтительном варианте настоящее изобретение относится к вышеуказанному способу, который включает выявление присутствия двух или более нуклеотидных замен, выбранных из любых нуклеотидных замен в гене eNOS и любых нуклеотидных замен в его 5'-фланкирующей области, и более предпочтительно оно относится к вышеуказанному способу, когда заболевание, связанное со спазмом коронарной артерии, представляет собой стенокардию, и наиболее предпочтительно оно относится к вышеуказанному способу, когда заболевание, связанное со спазмом коронарной артерии, представляет собой коронарную спастическую стенокардию.
Одним из объектов настоящего изобретения является способ скрининга гена с целью выявить вышеуказанные замены, который включает применение анализа полиморфизма длин рестрикционных фрагментов (ПДРФ), с помощью которого выявляют присутствие или отсутствие расщепления, вызванного рестриктазой. В частности, настоящее изобретение относится к способу, при осуществлении которого присутствие замен выявляют путем амплификации соответствующей области в экзоне 7 кДНК, кодирующей eNOS, с помощью ПЦР, расщепления амплифицированных фрагментов рестриктазой (ами) Ban II и/или Mbo I и электрофореза фрагментов, полученных в результате расщепления ферментом, а также к способу, при осуществлении которого присутствие замен в экзоне 6 выявляют путем обработки рестриктазой Fok I, к способу, при осуществлении которого присутствие замен в положении -786 5'-фланкирующей области гена eNOS выявляют путем обработки рестриктазой Msp I, и к способу, при осуществлении которого присутствие замен в положении -1468 5'-фланкирующей области гена eNOS выявляют путем обработки рестриктазой Mbo I.
Согласно настоящему изобретению предлагается также набор для осуществления способа по настоящему изобретению, в частности набор для диагностики заболевания, связанного со спазмом коронарной артерии, который включает олигонуклеотид, предназначенный для амплификации с помощью ПЦР соответствующей области экзона 7 кДНК, кодирующей eNOS, и рестриктазу(ы) Ban II и/или Mbo I; набор для диагностики заболевания, связанного со спазмом коронарной артерии, который включает олигонуклеотид, предназначенный для амплификации с помощью ПЦР соответствующей области экзона 6 кДНК, кодирующей eNOS, и рестриктазу Fok I; набор для диагностики заболевания, связанного со спазмом коронарной артерии, который включает олигонуклеотид, предназначенный для амплификации с помощью ПЦР области, включающей нуклеотид в положении - 786 5'-фланкирующей области гена eNOS, и рестриктазу Msp I; и набор для диагностики заболевания, связанного со спазмом коронарной артерии, который включает олигонуклеотид, предназначенный для амплификации с помощью ПЦР области, включающей нуклеотид в положении - 1468 5'-фланкирующей области гена eNOS, и рестриктазу Mbo I. Следует отметить, что олигонуклеотид, входящий в набор по настоящему изобретению, может представлять собой олигонуклеотид, отличный от таковых, перечисленных ниже в таблице 1, и может быть выбран из любых олигонуклеотидов, соответствующих геномной последовательности eNOS.
Далее в изобретении предлагается способ диагностики заболевания, связанного со спазмом коронарной артерии, который включает выявление присутствия любой одной или нескольких нуклеотидных замен в гене eNOS, как определено выше, которые обусловливают возникновение заболевания, связанного со спазмом коронарной артерии.
Краткое описание чертежей
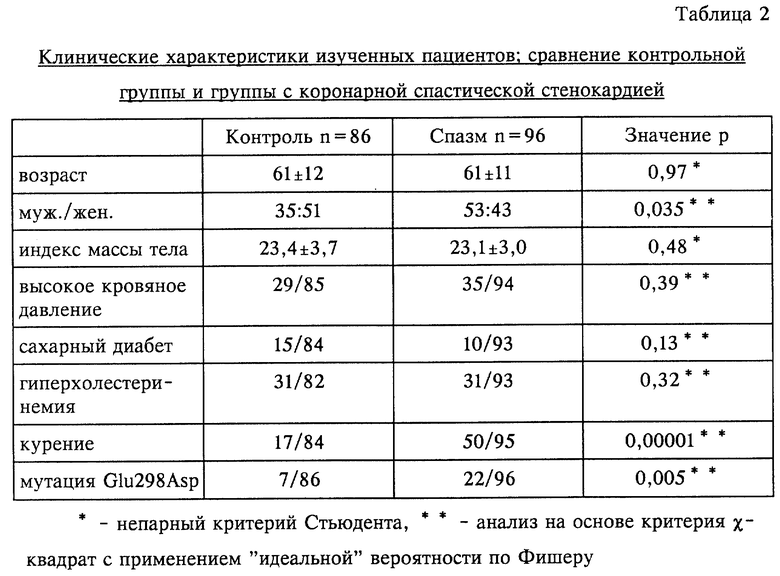
На фиг.1 представлена фотография, полученная в результате электрофореза на основе ПЦР-ОЦКП-анализа фрагментов ДНК, содержащих экзон 7 гена eNOS. Стрелкой показано смещение полос.
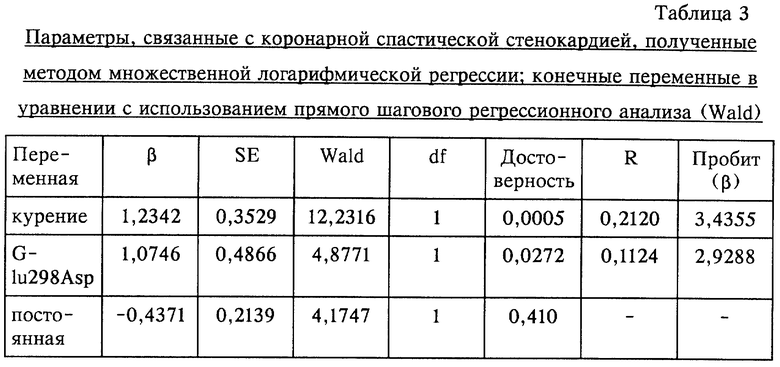
На фиг. 2 представлено графическое изображение прямого секвенирования фрагментов ДНК, содержащих экзон 7 гена eNOS, полученных как для случая мутации (мутантный тип), так и для случая без мутации (дикий тип). Мутантный тип представляет собой гетерозиготу.
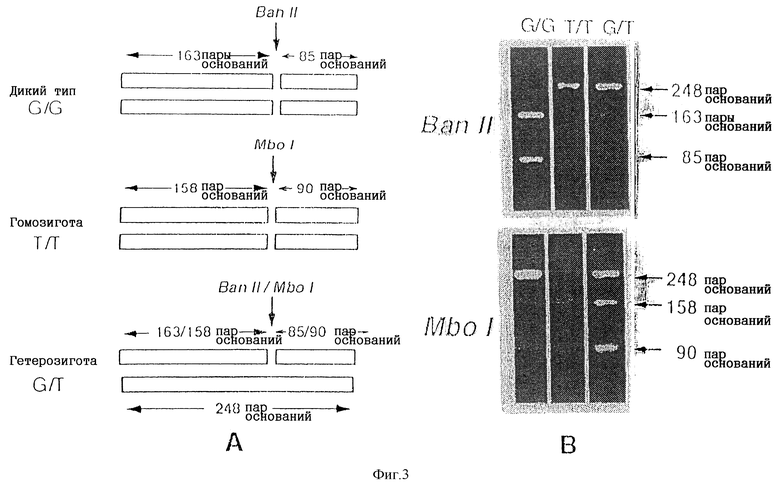
На фиг. 3 представлен результат скрининга содержащих экзон 7 гена eNOS фрагментов ДНК, полученный с помощью ПЦР-ПДРФ. Рестриктаза представляет собой Ban II и/или Mbo I. На фиг.3А представлена их рестрикционная карта. На фиг. 3Б представлена фотография, на которой показан реальный результат электрофореза.
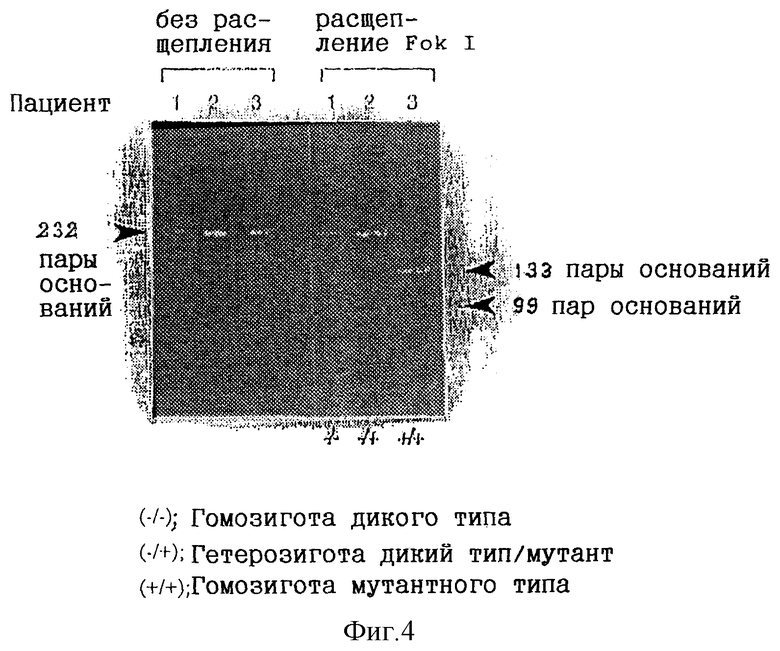
На фиг. 4 представлена фотография, которая получена в результате электрофореза путем скрининга с помощью ПЦР-ПДРФ фрагментов ДНК, содержащих экзон 6 гена eNOS. Рестриктаза представляет собой Fok I.
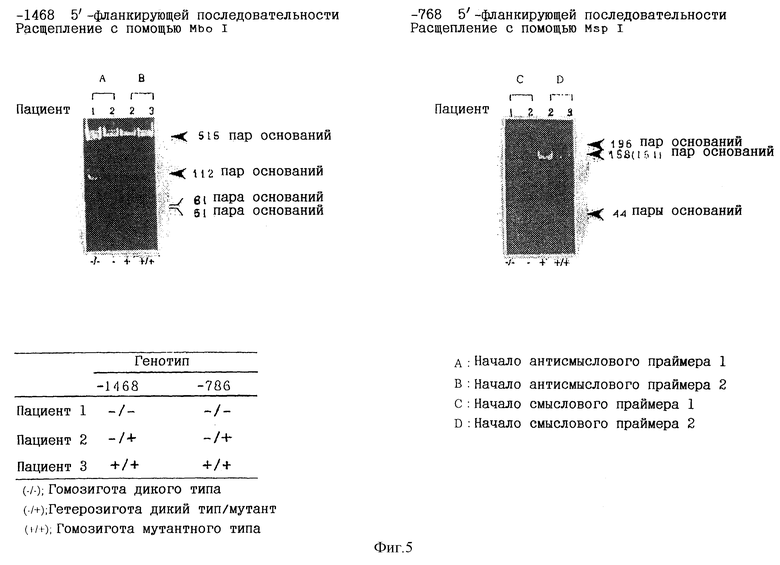
На фиг. 5 представлена фотография, которая получена в результате электрофореза путем скрининга с помощью ПЦР-ПДРФ фрагментов ДНК, содержащих нуклеотиды в положении -786 и -1468 5'-фланкирующей области гена eNOS. Фермент рестриктаза представляет собой Msp I в случае мутации в положении -786 и Mbo I в случае мутации в положении -1468.
Подробное описание изобретения
Как указано выше, согласно настоящему изобретению основное внимание заявителей было сконцентрировано на гене eNOS с целью выяснить, обусловливает ли этот ген развитие коронарного спазма, при этом были получены следующие результаты.
А) Мутации в экзонах гена eNOS
1) Мутации в экзоне 7: мутация, представляющая собой замену гуанина (G) в положении 894 кДНК, кодирующей eNOS на тимин (Т)
С помощью метода ПЦР-ОЦКП (полимеразная цепная реакция-анализ конформационного полиморфизма одноцепочечной ДНК) и метода прямого секвенирования была выявлена точковая мутация в экзоне 7 гена eNOS, выделенного у пациента, страдающего коронарной спастической стенокардией. Мутация представляет собой замену GAG на GAT, и она соответствует замене аминокислотного остатка глутаминовой кислоты на остаток аспарагиновой кислоты (Glu298Asp). При скрининге этой мутации, проведенном с использованием 96 пациентов, страдающих коронарной спастической стенокардией, и 86 контрольных пациентов, было обнаружено, что 22 больных человека и 7 контрольных соответственно имели эту мутацию.
2) Мутации в экзоне 6: мутация, представляющая собой замену цитозин (С) в положении 774 кДНК, кодирующей eNOS на тимин (Т)
С помощью метода ПЦР-ОЦКП установлено, что такая замена основания обнаружена у 4 из 10 пациентов, страдающих коронарной спастической стенокардией. С другой стороны, такой замены основания не обнаружено у 9 обследованных контрольных пациентов (Р=0,03). Такая замена основания не сопровождается аминокислотной заменой.
Б) Мутации в 5'-фланкирующей области гена eNOS
В 5'-фланкирующей области гена eNOS обнаружено несколько мутаций и была изучена взаимосвязь между этими мутациями и коронарными спастическими заболеваниями, при этом получены следующие результаты.
1) Мутация, представляющая собой замену тимина (Т) в 5'-фланкирующей области (-786) на цитозин (С)
С помощью метода ПЦР-ОЦКП установлено, что такая замена основания обнаружена у 34 из 123 (27,6%) пациентов, страдающих коронарной спастической стенокардией, тогда как это замена основания обнаружена только у 4 из 86 контрольных пациентов (4,7%) (Р<0,0001).
2) Мутация, представляющая собой замену аденина (А) в 5'-фланкирующей области (-922) на гуанин (G)
С помощью метода ПЦР-ОЦКП установлено, что такая замена основания обнаружена у 31 из 104 (29,1%) пациентов, страдающих коронарной спастической стенокардией, тогда как такая замена основания обнаружена только у 3 из 83 контрольных пациентов (3,6%) (Р<0,0001).
3) Мутация, представляющая собой замену тимина (Т) в 5'-фланкирующей области (-1468) на аденин (А)
С помощью метода ПЦР-ОЦКП установлено, что такая замена основания обнаружена у 26 из 98 (26,5%) пациентов, страдающих коронарной спастической стенокардией, тогда как такой замены основания не обнаружено у 26 контрольных пациентов (0%) (Р<0,0006).
Вышеуказанные мутации, связанные с геном eNOS, пригодны для диагностики заболеваний, связанных с коронарным спазмом.
Понятие "заболевание (я), связанное(ые) с коронарным спазмом" в контексте настоящего описания включает стенокардию, в частности коронарную спастическую стенокардию, вариантную стенокардию, нестабильную стенокардию, стенокардию напряжения, стенокардию покоя, острый инфаркт миокарда, микрососудистое заболевание и т.п.
Взаимосвязь между коронарным спазмом и мутациями, связанными с геном eNOS, подтверждена согласно настоящему изобретению и, следовательно, если у пациента, у которого предполагается наличие заболеваний, связанных с коронарным спазмом, выявлены эти мутации в гене eNOS или в его 5'-фланкирующей области, то можно предположить, что рассматриваемый пациент имеет фактор риска в отношении заболеваний, связанных с коронарным спазмом. В качестве индикатора заболеваний достаточно присутствия только одной из этих мутаций, а наличие двух или большего числа мутаций может служить еще лучшим индикатором. Кроме того, было обнаружено, что выявление мутаций как в области гена eNOS, так и в его 5'-фланкирующей области позволяет сделать вывод о серьезности заболеваний, связанных с коронарным спазмом.
Как описано выше, настоящее изобретение относится к способу скрининга гена, обусловливающего связанное со спазмом коронарной артерии заболевание. Этот способ предусматривает выявление присутствия одной или нескольких нуклеотидных замен в гене эндотелиальной синтазы оксида азота (eNOS), причем эти замены выбирают из группы, включающей замены гуанина (G) на тимин (Т) в положении 894, цитозина (С) на тимин (Т) в положении 774 последовательности кДНК гена eNOS и замены тимина (Т) на цитозин (С) в положении - 786, аденина (А) на гуанин (G) в положении - 922 и тимина (Т) на аденин (А) в положении - 1468 5'-фланкирующей области гена eNOS, а также замены в соответствующих положениях в комплементарной ей цепи.
Понятие "замены в соответствующих положениях в комплементарной ей цепи" означает, например, что в случае нуклеотидной замены гуанина (G) на тимин (Т) в положении 894 в кДНК гена eNOS происходит мутация, представляющая собой замену цитозина (С) на аденин (А) в положении комплементарной цепи, соответствующем положению 894.
Ниже описан способ выделения у пациента гена eNOS и 5'-фланкирующей последовательности.
В качестве образца для получения гена может применяться любая биопсия, при этом обычно используется образец лейкоцитов, а также дополнительно может использоваться биопсия печени. Образец обрабатывают протеиназой К-SDS с целью протеолизиса и денатурации, а затем экстрагируют фенолом/хлороформом, получая геномные ДНК(+РНК). При необходимости РНК могут быть удалены с помощью РНКазы.
Затем проводят ПЦР, используя для амплификации геномной ДНК любой из приведенных ниже праймеров. Далее присутствие мутаций подтверждают с помощью методов выявления мутации нуклеиновой кислоты, к которым относятся следующие:
1) Метод ПДРФ (анализ полиморфизма длин рестрикционных фрагментов).
2) Метод ПЦР-ОЦКП (анализ конформационного полиморфизма одноцепочечной ДНК).
3) Метод АСО-гибридизации (аллельспецифическая олигонуклеотидная гибридизация).
ПЦР-продукты блоттируют на подложке, такой, как найлоновый фильтр, и гибридизуют с синтетическим олигонуклеотидным зондом размером приблизительно 18-мер (звеньев), последовательность оснований которого включает мутацию, которая должна быть выявлена, и который с целью получения сигнала может помечен радиоизотопом или биотином. Затем, когда фильтр промывают в соответствием со значением tпл зонда, можно обнаружить ошибочное спаривание одной пары оснований, поскольку ошибочное спаривание может сделать гибрид плавким. Этот метод обычно используется в качестве метода выявления специфической мутации основания с помощью ПЦР.
4) Метод секвенирования.
5) Метод саузерн-блоттинга.
Этот метод представляет собой обычный метод выявления мутаций, который включает расщепление ДНК с помощью рестриктазы, проведение электрофореза и гибридизацию с зондом. Этот метод включает как саузерн-блоттинг геномной ДНК, так и методы ПЦР - саузерн-блоттинга.
Преимуществом последнего метода, который основан на тех же принципах, что и метод (3), является точность, с которой может быть получена информация о миграции.
6) ARMS (амплификационная система для идентификации мутаций).
При проведении ПЦР праймеры отжигают с ДНК-матрицы и затем с помощью ДНК-полимеразы получают комплементарную ДНК в направлении от 5'- к 3'-концу. ARMS основана на том принципе, что эффективность ПЦР-амплификации уменьшается, а ПЦР-продукты не могут быть обнаружены с помощью гель-электрофореза, когда 3'-конец праймера образует ошибочное спаривание с ДНК-матрицей. Когда для амплификации с помощью ПЦР применяют праймер, имеющий мутацию на его 3'-конце, которая должна быть выявлена, можно обнаружить мутацию, оценивая присутствие или отсутствие продуктов амплификации.
7) ЭГДГ (электрофорез в градиенте денатурирующего геля).
Этот метод основан на том принципе, что в ПЦР-продуктах гетеродуплекс, содержащий ошибочное спаривание, может более легко диссоциироваться, чем гомодуплекс. При использовании этого метода двухцепочечную ДНК, которая включает ошибочное спаривание, т.е. мутацию, выявляют по миграции в электрофоретическом геле благодаря тому, что миграция такой ДНК на геле является плохой из-за диссоциации и в дальнейшем ускоряется при повышении плотности градиента мочевины и формамида при проведении электрофореза в полиакриламидном геле.
8) Метод гидролиза РНКазой А.
РНКаза А (рибонуклеаза) представляет собой фермент, который не гидролизует двухцепочечную РНК или гибрид РНК/ДНК, а избирательно гидролизует одноцепочечную РНК. Поэтому, после того, как РНК-зонд, меченный с помощью 32Р, был гибридизован с образцом ДНК, который предварительно был денатурирован до одноцепочечной ДНК, гибрид обработан РНКазой А, а продукты подвергнуты электрофорезу, могут быть выявлены две полосы, поскольку одноцепочечная РНК, полученная из РНК-зонда после гибридизации с мутантной ДНК, гидролизуется РНКазой А.
9) Метод химического расщепления.
"С"-нуклеотид и "Т"-нуклеотид в сайте ошибочного спаривания гибридной ДНК модифицируют гидроксиламином и тетраоксидом осмия соответственно, а затем модифицированную ДНК обрабатывают пиперидином с целью отщепления остатка сахара. Для этого процесса используют гибрид, состоящий из меченого зонда и образца ДНК, и электрофоретическое разделение. Если в образце ДНК присутствует мутация, выбирают зонд меньшего размера. В случае, когда выявляют Glu298Asp, сайтом ошибочного спаривания является С-Т, и, следовательно, для выявления ошибочного спаривания также может применяться обратная последовательность дикого типа.
10) Лигазный метод.
Этот метод основан на том принципе, что два типа олигонуклеотидов не могут быть лигированы друг с другом с помощью ДНК-лигазы, когда ДНК-матрица имеет ошибочное(ые) спаривание(я) в сайте связывания.
I) LMGD (опосредованное лигазой выявление гена)
Например, один олигонуклеотид ДНК метят с помощью 32Р, а другой олигонуклеотид ДНК метят биотином. Их лигируют друг с другом и лигированный продукт собирают путем абсорбции на стрептавидине. Когда они соответствующим образом лигированы друг с другом, т.е., иными словами, не образовано никакого ошибочного спаривания, их затем можно выявить, поскольку радиоактивность 32Р становится более высокой.
II) ЛЦР (лигазная цепная реакция)
Повторяя вышеописанное лигирование, за исключением того, что используют термостабильную лигазу, олигонуклеотид ДНК отжигают с цепью ДНК аналогично тому, как это осуществляют при ПЦР, что способствует более высокой чувствительности при выявлении мутации.
Предпочтительный вариант осуществления изобретения
1. Мутация в экзоне 7
Мутация в экзоне 7, в частности мутация, представляющая собой замену гуанина (G) на тимин (Т) в положении 894 последовательности кДНК, кодирующей ген eNOS, представляет собой замену GAG на GAT с формированием для каждого различных сайтов рестрикции. Таким образом, присутствие мутации может быть выявлено с помощью рестриктазы. В частности, расщепление амплифицированных продуктов с помощью фермента рестриктазы либо Ban II, либо Mbo I позволяет выявить присутствие мутации. Иными словами, считается, что мутация присутствует, если рестриктаза Ban II может расщеплять представляющий интерес сайт, и наоборот, считается, что мутация отсутствует, если рестриктаза Mbo I может расщеплять представляющий интерес сайт.
В альтернативном варианте в связи с тем, что мутация, представляющая собой замену гуанина (G) на тимин (Т) в положении 894 последовательности кДНК, кодирующей ген eNOS, соответствует аминокислотной замене глутаминовой кислоты на аспарагиновую кислоту (Glu298Asp), изменение в аминокислотной последовательности гена eNOS, т.е. замена глутаминовой кислоты на аспарагиновую кислоту в положении 298, может служить соответствующим индикатором.
2. Мутация в экзоне 6
Мутация в экзоне 6, в частности мутация, представляющая собой замену цитозина (С) на тимин (Т) в положении 774 последовательности кДНК, кодирующей ген eNOS, приводит к появлению отличных друг от друга сайтов рестрикции, поэтому присутствие мутации может быть выявлено с помощью рестриктазы. В частности, расщепление амплифицированных продуктов рестриктазой Fok I позволяет выявить присутствие мутации. Иными словами, считается, что мутация присутствует, если продукты могут расщепляться рестриктазой Fok I, и наоборот, считается, что мутация отсутствует, если продукты не могут расщепляться рестриктазой Fok I.
3. Мутация в положении -786 в 5'-фланкирующей области
Мутация в 5'-фланкирующей области гена eNOS, в частности мутация, представляющая собой замену тимина (Т) на цитозин (С) в положении -786, также приводит к формированию отличных друг от друга сайтов рестрикции, поэтому присутствие мутации может быть выявлено с помощью рестриктазы. В частности, расщепление амплифицированных продуктов с помощью рестиктазы Msp I позволяет выявить присутствие мутации. Иными словами, считается, что мутация отсутствует, если фермент Msp I расщепляет амплифицированные продукты в одном сайте, и наоборот, считается, что мутация присутствует, если фермент Msp I может расщеплять амплифицированные продукты в двух сайтах.
4. Мутация в положении -1468 в 5'-фланкирующей области
Мутация в 5'-фланкирующей области гена eNOS, в частности мутация, представляющая собой замену тимина (Т) на аденин (А) в положении -1486, также приводит к формированию отличных друг от друга сайтов рестрикции, поэтому присутствие мутации может быть выявлено с помощью рестриктазы. В частности, расщепление амплифицированных продуктов с помощью рестриктазы Mbo I позволяет выявить присутствие мутации. Иными словами, считается, что мутация отсутствует, если фермент Моb I расщепляет амплифицированные продукты в одном сайте, и наоборот, считается, что мутация присутствует, если рестриктаза Mbo I может расщеплять амплифицированные продукты в двух сайтах.
Примеры
Пример 1
Выявление мутации в экзоне 7 гена eNOS
Исследования проводили на 96 пациентах, страдающих коронарной спастической стенокардией, и на 86 контрольных пациентах. Для всех пациентов, страдающих коронарной спастической стенокардией, был характерен внезапный приступ в состоянии покоя (53 мужчины, 43 женщины, средний возраст 61 год, возраст от 33 до 86 лет). У всех пациентов проводили обследование сердца с помощью катетера методом коронарной артериографии с целью подтверждения коронарного спазма, вызванного ацетилхолином или эргоновином, а также для подтверждения с помощью электрокардиограммы существенного изменения ST-T (7, 8). У всех пациентов в коронарной артерии не обнаружено значительного сужения (>75%).
Из 86 контрольных пациентов 61 составляли группу с острой грудной болью, 12 составляли группу с аномальной электрокардиограммой и 13 составляли группу пациентов, страдающих заболеванием клапана средней тяжести (35 мужчин, 51 женщина, средний возраст 61 год, возраст от 13 до 83 лет).
Коронарная артериография показала, что ни один из пациентов контрольной группы не имел значительных сужений. Когда с участием 61 пациента из группы с острой грудной болью и 12 пациентов с аномальной электрокардиограммой проводили спазм-индуцирующий тест с помощью коронарного введения ацетилхолина или эргоновина, все пациенты дали отрицательную реакцию. В контрольную группу не были включены пациенты, страдающие инфарктом миокарда, синдромом X, миокардиопатией и сердечной недостаточностью.
(1) Оценка мутации гена eNOS с помощью ПЦР-ОЦКП
I) Выделение ДНК
Брали периферическую венозную кровь у 10 пациентов, страдающих типичным коронарным спазмом, и у 9 контрольных и ДНК экстрагировали из клеток лейкоцитов (28), используя набор для экстракции ДНК DNAQUICH [DAINIPPON SEIYAKU].
II) Стадия ПЦР
В соответствии с ранее описанным строением гена eNOS (18-25) метод ПЦР-ОЦКП применяли для всех экзонов гена eNOS (29).
Все праймеры получали на основе последовательности интронов, фланкирующих каждый экзон. Все используемые на этой стадии праймеры приведены в таблице 1.
В каждую пробирку с раствором общим объемом 5 мкл, содержащим 50 ммолей/л КСl, 20 ммолей/л трис-НСl (рН 8,4), 0,75 ммоля/л MgCl2, 0,1 ммоля/л дНТФ, 0,2 мл α-[32Р]дЦТФ (0,2 мл), по 5 пмолей каждого праймера и 0,01 ед. полимеразы Taq (фирма GIBCO BRL, Life Technologies Inc., MD, США), добавляли по 30 нг ДНК пациента.
ПЦР осуществляли следующим образом: один цикл продолжительностью 2 минуты при 94oС; 30 циклов продолжительностью по 30 секунд при 94oС; 30 секунд при 55-58oС и одна минута при 72oС; и образовавшийся амплифицированный продукт хранили при 4oС. Амплификацию экзона 7 проводили при 57oС.
III) Стадия ОЦКП
Электрофорез проводили при трех различных условиях, первым из которых было использование 5%-ного глицеринового геля при комнатной температуре, а два остальных состояли в использовании 5% и 10% глицеринового геля при 4o С.
Глицериновые гели получали следующим образом:
1) готовили 5%-ный раствор, содержащий акриламид и N,N'-метиленбисакриламид в соотношении 49:1;
2) готовили 0,5-кратный ТБЭ (10-кратный ТБЭ разбавляют в 20 раз: 108 г трис(гидроксиметил)аминометана + 55 г борной кислоты + 40 мл 0,5М ЭДТК + вода, при смешении объемов всех ингредиентов получают общий объем 500 мл);
3) готовили гель, добавляя 160 мкл 10%-ного АРС (пероксодисульфид аммония) и 60 мкл TEMED (N,N,N',N'-тетраметилэтилендиамин) к раствору 5%-ного или 10%-ного глицерина.
IV) Результаты
Результаты, полученные при амплификации экзона 7, приведены на фиг.1. На этом чертеже видно смещение полосы фрагмента, включающего экзон 7, у 3 из 10 пациентов, страдающих коронарной спастической стенокардией. С другой стороны, у контрольной группы не обнаружено никакого смещения.
(2) Анализ мутантного гена методом прямого секвенирования
ДНК пациентов, в которых на стадии (1) методом ПЦР-ОЦКП обнаружена мутация, и ДНК контрольных пациентов, у которых не обнаружена мутация, вновь амплифицировали в таких же условиях, которые использовались на стадии (1), и аплифицированные продукты очищали с помощью системы для очистки ДНК типа Wizard PCR Preps (Wizard PCR Preps DNA Purification System, фирма Promega, США). Затем последовательность оснований определяли с помощью автоматического секвенатора, поставляемого фирмой ABI (США).
При анализе мутантной ДНК и ДНК дикого типа методом прямого секвенирования была обнаружена точковая мутация, представляющая собой замену гуанина (G) на тимин (Т) в положении 894 в экзоне 7 кДНК гена eNOS. Наличие указанной мутации было подтверждено у трех пациентов, имеющих мутацию. Точковая мутация представляет собой миссенс-мутацию, что соответствует замене глутаминовой кислоты на аспарагиновую кислоту (Glu298Asp). Результаты, полученные методом прямого секвенирования, приведены на фиг.2. На чертеже представлены результаты, полученные для не имеющего мутации дикого типа и для гетерозиготного типа.
(3) Скрининг мутации, представляющей собой замену "G" на "Т" с помощью ПЦР-ПДРФ
После того, как в экзоне 7 гена eNOS была обнаружена миссенс-мутация, соответствующая Glu298Asp, как описано для стадии (2), все 96 пациентов, страдающих коронарной спастической стенокардией, и 86 контрольных пациентов были подвергнуты скринингу в отношении этой мутации. Этот скрининг проводили с помощью ПЦР-ПДРФ (полимеразная цепная реакция-анализ полиморфизма длин рестрикционных фрагментов). С целью предотвратить любые ошибочные спаривания при неполном расщеплении рестрикционными ферментами использовали два типа ферментов рестриктаз Ban II и Mbo I (поставляемые фирмой TAKARA).
Экзон 7 гена eNOS из всех образцов амплифицировали в соответствии со способами (II), описанными для стадии (1). Протяженность амплифицированных фрагментов, содержащих экзон 7, составляла 248 пар оснований. Далее Ban II, либо Mbo I в соответствии с инструкциями производителя. Расщепленные продукты подвергали электрофорезу на 4%-ном агарозном геле типа Nusieve GTG, получая соответствующие полосы.
Результаты могут быть классифицированы в соответствии с тремя схемами, как показано на фиг. 3. На фиг.3А представлена рестрикционная карта, а на фиг.3Б представлено фотографическое изображение подлинных результатов электрофореза. Как видно на фиг.3Б, обработка Ban II приводит к образованию двух фрагментов, имеющих длину 163 пары оснований и 85 пар оснований, а обработка Mbo I приводит к образованию одной нерасщепленной полосы длиной 248 пар оснований в образце дикого типа, не имеющего мутации. Это свидетельствует о том, что дикий тип, несущий мутацию, имеет один сайт рестрикции Ban II, но не имеет сайта рестрикции Mbo I.
В случае гомозиготы, имеющей Т/Т в положении 894 кДНК гена eNOS, Ban II не приводит к расщеплению (248 пар оснований), в то время как Mbo I приводит к образованию двух фрагментов длиной 158 пар оснований и 90 пар оснований. Это свидетельствует о том, что гомозигота не имеет сайта рестрикции Ban II и имеет один сайт рестрикции Mbo I.
Обнаружено несколько случаев, в которых было получено три полосы длиной 248 пар оснований, 163 пары оснований и 85 пар оснований при использовании Ban II и 248 пар оснований, 158 пар оснований и 90 пар оснований при использовании Mbo I. Этот случай считается гетерозиготой (G/T), поскольку как Ban II, так и Mbo I приводят к появлению одного сайта расщепления в любой полосе.
На основе данных, полученных для трех пациентов, как описано выше, частоту мутации Glu298Asp в гене eNOS оценивали как для всех случаев коронарной спастической стенокардии, так и для контрольных групп. Во всех случаях проводили расщепление обоими ферментами. Результаты, полученные с использованием этих двух ферментов, оказались достоверными для всех случаев.
Мутация Glu298Asp обнаружена у 22 из 96 (23%) пациентов, страдающих коронарной спастической стенокардией, из которых один оказался гомозиготой по этому признаку, а 21 гетерозиготами. С другой стороны, мутация обнаружена у 7 из 86 (8%) контрольных пациентов, все из которых оказались гетерозиготами.
(4) Статистический анализ: взаимосвязь между коронарным спазмом и мутацией Glu298Asp или другими Факторами риска
Частоту мутации, выявленную на стадии (3), сравнивали с частотой факторов риска коронарного спазма, включающих возраст, пол, высокое кровяное давление, сахарный диабет, гиперхолестеринемию, индекс массы тела и курение, у контрольной группы и группы, страдающей коронарной спастической стенокардией, с помощью критерия χ -квадрат и непарного критерия Стьюдента с применением "идеальной" вероятности по Фишеру. Кроме того, с целью выяснить, какой из факторов в наибольшей степени коррелирует с коронарным спазмом, осуществляли многовариантный анализ (метод множественной логарифмической регрессии) с помощью программного обеспечения SPSS Advanced Statistics версия 6.1 для компьтера типа Macintosh (фирма SPSS Japan Inc., Япония). Условные бинарные переменные применяли в качестве всех независимых переменных следующим образом. Каждое численное значение представляло собой средние значение ±СО (стандартное отклонение).
Пол: 0 - мужчина, 1 - женщина
Возраст: 0 - до 60 лет, 1-60 или более лет
Индекс массы тела: 0 - до 26, 1 - 26 или более
Холестеринемия: 0 - норма, 1 - гиперхолестеринемия (порог, 260 м г/децилитр)
Курение: 0 - некурящий, 1 - курящий
Гипертензия: 0 - норма, 1 - высокая (порог, 160/95 мм ртутного столба)
Сахарный диабет: 0 - отсутствует, 1 - присутствует (порог, 140 мг/децилитр глюкозы в крови в голодном состоянии или 200 мг/децилитр OGTT (тест на толерантность к оральной глюкозе))
Результаты анализа с использованием критерия χ -квадрат и результаты анализа с использованием метода прямого шагового включения (Wald) представлены в таблицах 2 и 3 соответственно, где р=0,05 признается достоверным значением с точки зрения статистики.
Результаты статистического анализа
Оценка корреляции между коронарным спазмом и мутацией Glu298Asp или другими факторами риска, такими, как возраст, пол, высокое кровяное давление, сахарный диабет, гиперхолестеринемия, индекс массы тела и курение, показала достоверность данных для пола (р=0,035), курения (р=0,00001) и мутации Glu298Asp (р=0,005), что видно из таблицы 2.
Результаты многовариантного анализа (метод множественной логарифмической регрессии) приведены в таблице 3. Из таблицы 3 видно, что курение является первым фактором, который оказался ответственным за коронарный спазм (р= 0,0005), а мутация Glu298Asp является вторым фактором (р=0,0272). Методом множественной логарифмической регрессии не выявлено никакой достоверной корреляции между полом и коронарным спазмом.
Пример 2
Выявление мутации в экзоне 6 гена eNOS
Аналогично методам, описанным в примере 1, геномную ДНК выделяли у 10 пациентов, страдающих коронарной спастической стенокардией, и у 9 контрольных. ПЦР проводили, используя праймеры, описанные в таблице 1, а затем для выявления мутации в экзоне 6 проводили ОЦКП-анализ. Затем экзон 6 подвергали прямому секвенированию для выявления замены основания, представляющего собой цитозин (С) на тимидин (Т) в положении 774 кДНК гена eNOS.
Эта замена основания была выявлена у 4 из 10 пациентов, страдающих коронарной спастической стенокардией, но такой замены не обнаружено ни у одного из 9 контрольных пациентов (р=0,03). Эта замена не связана с изменением аминокислоты.
Пример 3
Выявление мутации в 5'-фланкирующей области гена eNOS (1)
В основном использовали методы, описанные в примере 1, за исключением того, что для выявления замены основания, представляющего собой тимин (Т) на цитозин (С) в 5'-фланкирующей области (-786), применяли следующие праймеры.
ПЦР-ОЦКП (-585 ~ -820 пар оснований; 236 пар оснований)
праймер 5'-конца:
5'-ATGCTCCCACCAGGGCATCA-3'
праймер 3'-конца:
5'-GTCCTTGAGTCTGACATTAGGG-3'
Эта замена основания обнаружена у 34 из 123 (27,6%) пациентов, страдающих коронарной спастической стенокардией, в то время как такая замена обнаружена только у 4 из 86 (4,7%) контрольных пациентов (Р<0,0001).
Пример 4
Выявление мутации в 5'-фланкирующей области гена eNOS (2)
В основном использовали методы, описанные в примере 1, за исключением того, что для выявления замены основания, представляющего собой аденин (А) на гуанин (G) в 5'-фланкирующей области (-922), применяли следующие праймеры.
ПЦР-ОЦКП (-801 ~ -1008 пар оснований; 208 пар оснований)
праймер 5'-конца:
5'-TCAGTCTCTGAGGTCTCGAA-3'
праймер 3'-конца:
5'-TGATGCCCTGGTGGGAGCAT-3'
Эта замена основания обнаружена у 31 из 104 (29,1%) пациентов, страдающих коронарной спастической стенокардией, в то время как такая замена обнаружена только у 3 из 83 (3,6%) контрольных пациентов (Р<0,0001).
Пример 5
Выявление мутации в 5'-фланкирующей области гена eNOS (3)
В основном использовали методы, описанные в примере 1, за исключением того, что для выявления замены основания, представляющего собой тимин (Т) на аденин (А) в 5'-фланкирующей области (-1468), применяли следующие праймеры.
ПЦР-ОЦКП (-1214 ~ -1490 пар оснований; 221 пара оснований)
праймер 5'-конца:
5'-CCATTAACTGGAACCTAGGAA-3'
праймер 3'-конца:
5'-AGCCTGGGCTTTGTCCCATGA-3'
Эта замена основания обнаружена у 26 из 98 (26,5%) пациентов, страдающих коронарной спастической стенокардией, в то время как такой замены не обнаружено у 26 (0%) контрольных пациентов (Р<0,0006).
Пример 6
Скрининг в отношении мутаций
Пять мутаций, выявленных в исследованиях, приведенных в предыдущих примерах, могут быть подвергнуты крупномасштабному скринингу, например, с помощью метода АСО-гибридизации (аллельспецифическая олигонуклеотидная гибридизация). Описание этого метода АСО-гибридизации для экстенсивного скрининга приведено ниже:
1) Осуществляют ПЦР так же, как и ОЦКП. В этом случае конечный объем составляет 20 мкл. Состав реакционной смеси и условия циклов такие же, что и в примере 1.
2) Растворяют аликвоту объемом 10 мкл из реакционной смеси ПЦР, иммобилизуют аликвоту объемом 100 мкл из 200 мкл, включающую 0,5М NaOH (1,5М NaCl + 25 мМ двунатриевая соль ЭДТК) на найлоновой мембране для дикого типа, а затем для мутантного типа иммобилизуют на найлоновой мембране остальные 100 мкл.
3) Каждую из иммобилизующих найлоновых мембран помещают в отдельный гибридизационный мешочек, добавляют в мешочки раствор для предварительной гибридизации (3-кратный SSPE, 5-кратный раствор Денхардта, 0,5%-ный ДСН, 1 мкг/мкл ДНК спермы сельди) и инкубируют мешочки при 65o С в течение 2 часов.
4) В один мешочек вносят нормальный зонд, меченный с помощью 32Р (5•10 распадов в мин/мл), и аномальный зонд, не имеющий никакой метки, в пятикратном объеме, в то время как в другой мешочек вносят аномальный зонд, меченный с помощью 32Р (5•10 распадов в мин/мл), и нормальный зонд, не имеющий никакой метки, в пятикратном объеме.
5) Инкубируют каждый из мешочков при 60o С в течение 30 мин и дополнительно инкубируют еще в течение 1 ч, понижая температуру с 60o С до температуры ХoС, где Х составляет 53o С в примере 3, 50o С в примере 4, 46o С в примере 5.
6) Найлоновые мембраны извлекают из мешочков и мембраны дважды инкубируют в 2-кратном SSPE (0,1% ДСН) при комнатной температуры в течение 10 мин, а затем инкубируют один раз в 5-кратном SSPE (0,1% ДСН) при температуре ХoС в течение 10 мин.
7) Найлоновые мембраны заворачивают в обертку из сарана, помещают их на рентгеновскую пленку и облучают рентгеновскими лучами (авторадиография).
Пример 7
Скрининг в отношении мутаций в экзоне 6 и 5'-фланкирующей области гена eNOS
С помощью метода прямого секвенирования, описанного в примерах 2, 3 и 5, выявляли замену основания, представляющего собой цитозин (С) на тимин (Т) в положении 774 последовательности кДНК гена eNOS, а также замену с тимина (Т) на цитозин (С) в положении -786 и тимина (Т) на аденин (А) в положении -1468 5'-фланкирующей области гена eNOS. Скрининг в отношении этих мутаций осуществляли с помощью метода ПЦР-ПДРФ. Олигонуклеотиды и условия амплификации при указанной ПЦР приведены в таблицах 4 и 5. (1) Мутация в экзоне 6
В соответствии со способами, описанными для стадии (2) из примера 1, экзон 6 гена eNOS в образце амплифицировали с использованием праймеров, приведенных в таблице 4, и условий амплификации, приведенных в таблице 5. Образовавшийся амплифицированный фрагмент (232 пары оснований) расщепляли с помощью Fok I в соответствии с инструкциями производителя, и продукты расщепления подвергали электрофорезу на 10%-ных полиакриламидных гелях с целью идентификации полос. Поскольку рестриктаза Fok I может расщеплять только мутантный ген, было установлено, что гомозигота, несущая С/С, образует полосу, соответствующую длине 232 пары оснований, гетерозигота, несущая С/Т, образует полосы, соответствующие длине 232 пары оснований, 133 пары оснований и 99 пар оснований, а гомозигота, несущая Т/Т, образует полосы, соответствующие длине 133 пары оснований и 99 пар оснований. Результаты скрининга с помощью ПЦР-ПДРФ приведены на фиг.4.
(2) Мутация в положении -786 5'-фланкирующей области
В соответствии со способами, описанными для стадии (2) из примера 1, в образце часть 5'-фланкирующей области гена eNOS, включающую мутацию в положении -786, амплифицировали с использованием праймеров, приведенных в таблице 4, и условий амплификации, приведенных в таблице 5. Образовавшийся амплифицированный фрагмент (354 пары оснований) расщепляли с помощью Msp I в соответствии с инструкциями производителя, и продукты расщепления подвергали электрофорезу на 10%-ных полиакриламидных гелях с целью идентификации полос. Msp I расщепляет гомозиготу гена дикого типа (Т) в одном сайте, что приводит к получению двух полос, соответствующих длине 196 пар оснований и 158 пар оснований. С другой стороны, Msp I расщепляет гомозиготу мутантного гена (G) в двух сайтах, что приводит к получению трех полос, соответствующих длине 158 пар оснований, 154 пары оснований и 44 пары оснований. Результаты скрининга с помощью ПЦР-ПДРФ приведены на фиг.5.
(3) Мутация в положении -1468 5'-фланкирующей области
В соответствии со способами, описанными для стадии (2) из примера 1, часть 5'-фланкирующей области гена eNOS образца, включающую мутацию в положении -1468, амплифицировали с использованием праймеров, приведенных в таблице 4, и условий амплификации, приведенных в таблице 5. Образовавшийся амплифицированный фрагмент (627 пар оснований) расщепляли с помощью Mbo I в соответствии с инструкциями производителя, и продукты расщепления подвергали электрофорезу на 10%-ных полиакриламидных гелях с целью идентификации полос. Mbo I расщепляет гомозиготу гена дикого типа (Т) в одном сайте, что приводит к получению двух полос, соответствующих длине 515 пар оснований и 112 пар оснований. С другой стороны, Mbo I расщепляет гомозиготу мутантного гена (А) в двух сайтах, что приводит к получению трех полос, соответствующих длине 515 пар оснований, 61 пара оснований и 41 пара оснований. Результаты скрининга с помощью ПЦР-ПДРФ приведены на фиг.5.
(4) Мутация в положении -922 5'-фланкирующей области
Эту мутацию выявляли с помощью ПЦР-СПП (праймера, специфического по отношению к последовательности). Применяли каждый из двух типов праймеров, обеспечивающих прямое и обратное удлинение (всего четыре вида), с целью удлинения от "А" или "G" в положении -922 в 3'-направлении. Эти праймеры представляют собой праймеры, приведенные в пунктах (б) и (в) в таблице 4. Пару, состоящую из смыслового и антисмыслового праймера (два вида), выбирают из указанных праймеров таким образом, чтобы подлежащая амплификации область содержала мутацию в положении -1468 и -786 соответственно. С помощью метода ПЦР подтверждено, что гомозигота, несущая А/А в положении -922, может быть амплифицирована только при использовании праймера, имеющего "А" или "Т" (комплементарная последовательность) на 3'-конце, в то время как гомозигота, несущая G/G может быть амплифицирована только при использовании праймера, имеющего "G" или "С" (комплементарная последовательность) на 3'-конце.
Образовавшиеся амплифицированные фрагменты соответствуют таковым, полученным выше в разделах (2) и (3). При оценке амплифицированных фрагментов в некоторых образцах было установлено, что амплифицированный фрагмент (354 пары оснований), полученный выше в разделе (2) и происходящий из аллели, несущей "А" в положении -922 (дикий тип), давал только дикий тип, несущий "Т" в положении -786, в то время как амплифицированный фрагмент (354 пары оснований), полученный выше в разделе (2) и происходящий из аллели, несущей "G" в положении -922 (мутантный тип), давал только мутантный тип, несущий "G" в положении -786. Аналогично этому амплифицированный фрагмент (627 пар оснований), полученный выше в разделе (3) и происходящий из аллели, несущей "А" в положении -922 (дикий тип), давал только дикий тип, несущий "Т" в положении -1468, в то время как амплифицированный фрагмент (627 пар оснований), полученный выше в разделе (3) и происходящий из аллели, несущей "G" в положении -922 (мутантный тип), давал только мутантный тип, несущий "А" в положении -1468. Эти данные показывают, что в соответствии с указанным вариантом осуществления все из вышеуказанных мутаций в 5'-фланкирующей области могут образовывать сцепление на этой же аллели, свидетельствуя о том, что когда выявлена любая одна из трех мутаций, то и две другие мутации могут присутствовать.
Заключение
Как описано выше, заявителями по данной заявке была высказана гипотеза о том, что мутации гена eNOS могут быть ответственны за снижение активности NOS, причем это снижение может индуцировать коронарный спазм, а также ими был проведен ряд экспериментов в поддержку этой гипотезы. Если гипотеза верна, это согласуется с фактом о том, что коронарный спазм не происходит только в одной ветви, а также и во многих ветвях (8). Как описано в примере 1, мутация Glu298Asp ранее была описана Marsden и др. (24), но в этой публикации не описано значение этой мутации.
Согласно примеру 1 установлено, что мутация Glu298Asp2 выявлена у 23% пациентов, страдающих коронарной спастической стенокардией, и только у 8% контрольных пациентов, свидетельствуя о том, что частота мутации в группе, страдающей стенокардией, существенно выше по сравнению с контрольной группой. Результаты многовариантного анализа показали, что корреляция между коронарным спазмом и мутацией Glu298Asp является достоверной.
Следует отметить, что поскольку частота этой мутации в группе с коронарным спазмом составляет только 23%, у остальных 77% пациентов коронарный спазм может быть вызван патогенными факторами, отличными от этой мутации. Согласно настоящему изобретению была высказана гипотеза о том, что мутации могут присутствовать в областях, включающих промотор и интроны, отличные от экзона 7 гена eNOS, что описано в примере 1, и проведен ряд экспериментов, позволивших получить результаты, которые подтверждают эту гипотезу (примеры 2-5). Таким образом, если проводить более специфическую оценку взаимосвязи между этими мутациями, то это может привести к более надежной диагностике заболеваний, связанных с коронарным спазмом.
В отличие от этого следует отметить, что коронарный спазм может быть вызван не только геном eNOS, но также и другими генами. Кроме того, следует отметить, что коронарный спазм может быть вызван не только генетическими факторами, но также и факторами окружающей среды у пациентов, имеющих такой тип коронарного спазма, для которого характерно небольшое количество случаев заболевания в семье. В примере 1 показано, что курение является одним из факторов риска возникновения коронарного спазма. Этот результат согласуется с более ранними публикациями (30, 31). Приведенные в настоящем описании результаты, полученные методом множественной логарифмической регрессии, показывают, что курение является наиболее доминирующим фактором среди всех факторов риска, включая мутацию, свидетельствуя о том, что факторы окружающей среды особенно важны в патогенезе коронарного спазма. Другие исследователи также выявили, что курение приводит к повреждениям эндотелия (32, 33).
Мутация Glu298Asp была обнаружена у 8% контрольных пациентов (786, пример 1). Этот факт не совсем понятен и, кроме того, при этом следует отметить, что поскольку шесть человек из семи, имеющих мутацию, являются некурящими, данные, полученные для этих шести человек, не согласуются с данными о том, что курение является важным фактором риска. Следует также принимать во внимание трудность диагностики коронарного спазма. В частности, коронарный спазм может быть не замечен по ряду причин, и случай, который должен соответствовать группе с коронарным спазмом, относят к контрольной группе по следующим причинам:
1) Приступ может быть не замечен, поскольку он часто происходит в промежуток времени от середины ночи до раннего утра и обычно не происходит в дневное время.
2) Введение ацетилхолина в коронарную артерию не всегда может вызывать коронарный спазм, и коронарный спазм часто зависит от интенсивности заболевания коронарной спастической стенокардией.
3) Свыше двух третей приступов коронарного спазма остается бессимптомными (субклиническими).
4) Если даже результат оценки не показывает наличия коронарной спастической стенокардии, стенокардия может иметь место в будущем. И наоборот, группа, страдающая коронарной спастической стенокардией, на которой проводили данное исследование, представляет собой набор случаев, для которых было точно, с помощью коронарной артериографии установлено, что они страдают коронарным спазмом.
Настоящее изобретение позволяет показать, что коронарный спазм вызывается генетическими факторами, а также в первую очередь факторами окружающей среды, поэтому согласно изобретению предложен улучшенный способ диагностики заболеваний, связанных с коронарным спазмом.
Литературные источники, на которые сделаны ссылки в данном описании, приведены ниже.
Литература
1) Hillis L. D. , Braunwald E. Coronary-artery spasm. N. Engl. J. Med. 1978; 299:695-702.
2) Conti C.R., Coronary artery spasm and myocardial infarction. N. Engl. J. Med. 1983; 309: 238-239.
3) Yasue H., Omote S., Takizawa A., Nagao M., Coronary arterial spasm in ischemic heart disease and its pathogenesis. A review. Circ. Res., 1983; 52 (Supple I): 147-152.
4) Maseri A. , Davies G., Hackett D., Kaski J.C. Coronary artery spasm and vasoconstriction. The case for a distinction. Circulation. 1990; 81: 1983-1991.
5) Yasue H., Nagao M., Omote S., Takizawa A., Miwa K., Tanaka S. Coronary artery spasm and Prinzmetal's variant form of angina induced by hyperventilation and tris-buffer infusion. Circulation. 1978; 58: 56-62.
6) Yasue H. , Omote S., Takizawa A., Nagao M., Miwa K., Tanaka S. Circadianvariation of exercise capacity in patients with Prinzmetal's variant angina. Role of exercise-induced coronary artery spasm. Circulation. 1979; 59: 938-948.
7) Yasue H., Horio Y., Nakamura N., Fujii H., Imoto N., Sonoda R., Kugiyama K., Obata K., Morikami Y., Kimura T. Induction of coronary artery spasm by acetylcholine in patients with variant angina: possible role of the parasympathetic nervous system in the pathogenesis of coronary artery spasm. Circulation. 1986; 74: 955-963.
8) Okumura K., Yasue H., Horio Y., Takaoka K., Matsuyama K., Kugiyama K. , Fujii H., Morikami Y. Multivessel coronary spasm in patients with variant angina: a study with intracoronary injection of acetylcholine. Circulation. 1988; 77: 535-542.
9) Moncada S. , Palmer P.M., Higgs E.A. Nitric oxide: physiology, pathophysiology and pharmacology. Pharmacol. Rev. 1991; 43: 109-142.
10) Yasue H. Pathogenesis and clinical features of coronary spasm. J. Jap. Soc. Intern. Med. 1995; 84: 1407-1415.
11) Bredt D.S., Hwang P.M., Glatt C.E., Lowenstein C., Reed R.R., Synder S.H. Cloned and expressed nitric oxide synthase structurally resembles cytochrome P-450 reductase. Nature. 1991; 351: 714-718.
12) Nakane M. , Schmidt H.H.W., Pollock J.S., Forstermann U., Murad F. Cloned human brain nitric oxide synthase is highly expressed in skeletal muscle. FEBS let. 1993; 316: 175-180.
13) Lyons C.R., Orloff G.J., Cunningham J.M. Molecular cloning and fuctional expression of an inducible nitric oxide synthase from a murine macrophage cell line. J. Biol. Chem. 1992; 267: 6370-6374.
14) Xie Q., Cho H.J., Calaycay J., Mumford R.A., Swiderek K.M., Lee T.D. , Ding A. , Troso Т., Nathan C. Cloning and characterization of inducible nitric oxide synthase from mouse macrophage. Science. 1992; 256: 225-228.
15) Lowenstein C. J. , Glatt C.S., Bredt D.S., Synder S.H. Cloning and expressed macrophage nitric oxide synthase contrasts with the brain enzyme. Proc. Natl. Acad. Sci. USA. 1992; 89: 6711-6715.
16) Geller D.A., Lowenstein C.J., Shapiro R.A., Nussler A.K., Di Silvio M. , Wang S.C., Nakayama D.K., Simmons R.L., Snyder S.H., Billiar T.R. Molecular cloning and expression of inducible nitric oxide synthase from human hepatocytes. Proc. Natl. Acad. Sci. USA. 1993; 90: 3491-3495.
17) Chartrain N.. Geller D., Koty P., Sitrin N.. Nussler A., Hoffmann E. , Billiar Т. , Hutchinson N., Mudgett J. Molecular cloning, structure and chromosomal localisation of the human inducible nitric oxide synthase gene. J. Biol. Chem. 1994; 269: 6765-6772.
18) Lamas S., Marsden P.A., Gordon K.L., Tempst P., Michel T. Endothelial nitric oxide synthase: Molecular cloning and characterization of distinct constitutive enzyme isoform. Proc. Natl. Acad. Sci. 1992; 89: 6348-6352.
19) Sessa W. C. , Harrison J.K., Barber C.M., Zeng D., Durieux M.E., D'Angelo D. D. , Lynch K.R., Peach M.J. Molecular cloning and expression of DNA encoding endothelial cell nitric oxide synthase. J. Biol. Chem. 1992; 267: 15274-15276.
20) Nishida К. , Harrison D.G., Navas J.P., Fisher A.A., Docery S.P., Uematsu M. , Nerem R.M., Alexander R.W., Murphy T.J. Molecular cloning and characterization of constitutive bovin aortic endothelial cell nitric oxide synthase. J. Clin. Invest. 1992; 90: 2092-2096.
21) Janssens S.P., Shimouchi A., Quetermous Т., Bloch D.B., Bloch K.D. Cloning and expression of cDNA encoding human endothelium-derived relaxing factor/nitric oxide synthase. J. Biol. Chem. 1992; 267: 14519-14522.
22) Marsden P.A., Schappert K.T., Chen H.S., Flowers M., Sundell C.L., Wilcox J. N., Lamas S., Michel T. Molecular cloning and characterization of human endothelial nitric oxide synthase. FEBS Lett. 1992; 307: 287-293.
23) Nadaud S., Bonnardeaux A., Lathop G.M., Soubrier F. Gene structure, polymorphism and mapping of human endothelial nitric oxide synthase gene. Biochem. Biophys. Res. Commun. 1994; 198: 1027-1033.
24) Marsden P. A., Heng H.H.Q., Scherer S.W., Stewart R.J., Hall A.V., Shi X. M., Tsui L.C., Schappert K.T. Structure and chromosomal localisation of the human constitutive endothelial nitric oxide synthase gene. J. Biol. Chem. 1993; 268: 17478-17488.
25) Miyahara К. , Kawamoto Т. , Sase К., Yui Y., Toda K., Yang L.X., Hattori R. , Aoyama Т., Yamamoto Y., Doi Y., Ogoshi S., Hashimoto K., Kawai C., Sasayama S., Shizuta Y.
Cloning and structural characterization of the human endothelial nitric-oxide-synthase gene. Eur. J. Biochem. 1994; 223: 719-726.
26) Yasue H. , Kugiyama K. Coronary artery spasm: Japaese view. Coronaryartery disease. 1990; 1: 668-673.
27) Bertrand M. E., LaBlanche J.M., Tilmant P.Y., Thieuleux F.A., Delforge M. R., Carre A.G., Asseman P.A., Berzin В., Libersa C., Laurent J. M. Frequency of provoked coronary arterial spasm in 1089 consecutive patients undergoing coronary arteriography. Circulation. 1982; 65: 1299-1306.
28) Saiki R.K., Scharf S., Faloona F., Mullis K.B., Horn G.T., Erlich H. A. , Arnheim N. Enzymatic amplification of β-globin genomic sequences and resrtiction site analysis for diagnosis of sikle ell anemia. Science. 1985; 230: 1350-1354.
29) Orita M. Suzuki Y., Sekiya Т., Hayashi K. Rapid ana senssitive detection of point mutation and DNA polymorphisms using polymerase chain reaction. Genomics. 1989; 5: 874-879.
30) Dennis G. Caralis, Ubeydullah Deligonul, Morton J. Kern, Jerome D. Cohen. Smoking is a rick factor for coronary spasm in young women. Circulation. 1992; 85:905-909.
31) Sugiishi M. , Takatsu F., Cigarette smoking is a major rick factor for coronary spasm. Circulation. 1993; 87: 76-79.
32) Celermajer D.S., Sorensen K.E., Georgakopoulos D., Bull C., Thomas O. , Robinson J., Deanfield J.E. Cigarette smoking is associated with dose-related and potentially reversible impairment of endothelium-dependent dilation in healthy young adults. Circulation. 1993; 88: 2149-2155.
33) Zeiher A.M., Schachinger V., Minners J. Long-term cigarette smoking impairs endothelium-dependent coronary arterial vasodilator function. Circulation. 1995; 92:1094-1100.
34) Yasue H. , Takizawa A., Nagao M., Nishida S., Horie M., Kubota J., Omote S., Takaoka K., Okumra K. Long-term prognosis for patients with variant angina and influential factors. Circulation. 1988; 78: 1-9.
35) Egashira К. и др. Preserved Endothelium-dependent Vasodilation at the Vasospastic Site in Patients with Variant Angina. Endothelial Function and Coronary Vasospasm., 1992, том 89: 1047-1052.


Изобретение относится к области медицины и касается способа выявления или определения пациентов, имеющих фактор риска в отношении заболеваний, связанных с коронарным спазмом. Сущность изобретения: способ включает выявление присутствия соответствующих нуклеотидных замен в гене эндотелиальной синтазы оксида азота, и по этим заменам выявляют пациентов, имеющих фактор риска в отношении заболеваний, связанных с коронарным спазмом. Преимущество изобретения заключается в выявлении механизма коронарного спазма и, следовательно, в ранней диагностике заболеваний, связанных с коронарным спазмом. 7 з.п.ф-лы, 5 табл., 5 ил.
Приоритет по пунктам:
13.11.1995 г. - признак замены гуанина (G) на тимин (Т) в положении 894 п. 1, а также пп. 3-5;
28.06.1996 г. - остальные признаки п. 1, а также п. 2;
13.11.1996 г. - по пп. 6-8.
| SU 1192787 А, 23.11.1985 | |||
| Способ прогнозирования инфаркта миокарда при сердечной недостаточности | 1985 |
|
SU1357845A1 |
| SUGIISHI M., TAKATSU F | |||
| Cigarette smoking a major risk factor for coronary spasm | |||
| - Circulation, 1993, v.87, рр | |||
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
Авторы
Даты
2002-07-20—Публикация
1996-11-13—Подача