Изобретение относится к микробиологической и медицинской промышленности, генной и белковой инженерии, биотехнологии. Конкретно - к получению корового антигена вируса гепатита B (HBcAg), с экспонированным на его поверхности эпитопом HBsAg.
Вирусные капсиды являются благодарным объектом для конструирования антигенов с заданными свойствами, поскольку жесткая фиксация и многократное повторение антигенных детерминант на поверхности вирусных капсидов обеспечивают их высокую антигенность и иммуногенность. Конструирование вирусных капсидов, экспонирующих чужеродные эпитопы, обещают стать перспективным направлением в создании эффективных вакцин [1]. Одним из наиболее многообещающих векторов экспонирования чужеродных детерминант является нуклеокапсидный белок вируса гепатита B человека (HBcAg) [2]. Он представляет собой капсид, состоящий из 180 одинаковых белковых субъединиц, способных к самоорганизации. Способность субъединиц к самосборке сохраняется как в эукариотических, так и в прокариотических системах экспрессии [3].
Химерные капсиды на основе HBcAg могут быть использованы в первую очередь как компоненты диагностикумов и вакцин. Последнее тем более перспективно, что HBcAg при иммунизации не только обеспечивает высокий уровень образования опосредованных B-клеточных иммунитетов антител, но и обладает ярко выраженным свойством стимулировать T-клеточный иммунный ответ как на собственные последовательности [4], так и на сопутствующие эпитопы [2].
В настоящее время в литературе описаны способы получения химерных частиц HBcAg, несущих эпитопы различных вирусов: вируса ящура (FMDV), риновируса человека (HRV2) [2] , вируса гепатита B [5, 7], вируса гепатита C [6]. Химерные частицы были способны индуцировать иммунный ответ на встроенный пептид при иммунизации лабораторных животных.
Известны конструкции HBcAg, несущие детерминанты HBsAg [5, 8], в которых preS1 и preS2 эпитопы встраивались в C-конец укороченного по 144 аминокислотный остаток кор-антигена вируса гепатита B. Такие химерные белки хорошо самоорганизовывались в частицы, подобные нативному кору, однако иммунный ответ на встроенную детерминанту был невысок (на три порядка ниже, чем на HBcAg).
Наиболее близким аналогом, выбранным в качестве прототипа, является рекомбинантная плазмида pFS14 [7, прототип], несущая полноразмерный ген HBcAg, содержащий последовательность эпитопа preS2 (133-140) в области, соответствующей 83 аминокислотному остатку корового белка.
К существенным недостаткам описанного аналога следует отнести низкий уровень экспрессии (1% суммарного клеточного белка). Встроенный эпитоп из области preS2 (133-140) представляет собой минорную антигенную детерминанту HBsAg, а основным протективным эпитопом, вызывающим появление противовирусных антител, является детерминанты "а" - главный нейтрализующий эпитоп HBsAg [9]. Поэтому, если предлагать использование гибридного HBcAg в качестве компонента диагностикумов или вакцин, то более подходящим является главный нейтрализующий эпитоп HBsAg (137-147).
Технической задачей изобретения является создание химерных частиц HBcAg, содержащих последовательность главного нейтрализующего эпитопа HBsAg (137-147) и бактериального штамма Escherichia coli - продуцента белка HBcAg с экспонированным на его поверхности эпитопом HBsAg (137-147).
Поставленная цель достигается конструированием плазмиды pKHBc-33 путем клонирования гена HBcAg, содержащего последовательность эпитопа HBsAg (137-147), в экспрессионный вектор pKK223-3. Полученная в результате плазмида pKHBc-33 состоит из:
фрагмента генома вируса гепатита B размеров 890 п.о., кодирующего HBcAg и содержащего уникальный рестрикционный сайт Xho I и эпитоп HBsAg (137-147);
плазмидного вектора, обеспечивающего экспрессию гена HBcAg-HBsAg (137-147), с молекулярной массой 3,03 Md (4585 п.о.).
В качестве фрагмента генома вируса гепатита B (ayw серотипа) используют BamHI фрагмент плазмиды p7,5C [10] длиной 890 п.о., содержащий С-ген вируса гепатита B, в котором делетированы первые 3 аминокислотных остатка.
В качестве олигонулеотида-мутагена, для введения мутации по методу [11], обеспечивающей появление уникального Xho I сайта, используют синтетический фрагмент ДНК:
5'-ctaggtccctcgagattggatc-3'.
В качестве фагового вектора, обеспечивающего встройку C-гена и необходимого для введения мутации, используют бактериофаг M13mp10 [12].
В качестве плазмидного вектора, обеспечивающего встройку C-гена и его экспрессию под контролем tac промотора, используют плазмиду pKK223-3 [13], а в качестве адаптора для соединения плазмиды с геном используют олигонуклеотид, который восстанавливает начало гена HBcAg:
5'-aattcatggacatt
gtacctgtaactag-5'
Для введения эпитопа HBsAg(137-147) в HBcAg, проводят клонирование соответствующего олигонуклеотида по введенному Xho I сайту. Олигонуклеотид, кодирующий пептид, имеет следующую последовательность;
5'-tcgatctgcaccaaaccgaccgatggcaactgc
agacgtggtttggctggctaccgttgacgagct-5'
Для получения штамма-продуцента кор антигена с экспонированным на его поверхности главным нейтрализующим эпитопом HBsAg, компетентные клетки бактерий Escherichia coli JM103 трансформируют сконструированной плазмидой pKHBc33. Полученный таким образом штамм E.coli JM103/pKHBc33 характеризуется следующими признаками:
Морфологические признаки. Клетки мелкие утолщенной палочковидной формы, грамотрицательные, неспороносные.
Культурные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" - колонии круглые, гладкие, прижатые, мутные, блестящие серые, край ровный. При росте в жидких средах (на минимальной среде с глюкозой или LB бульоне) образуют интенсивную ровную муть. Клетки растут при 37oC при оптимуме pH от 6,8 до 7,0.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (300 мкг/мл), обусловленную наличием плазмиды.
Штамм E. coli JM103/pKHBc33 обеспечивает индуцируемый ИПТГ синтез HBcAg-HBsAg (137-147) с уровнем экспрессии около 5% суммарного клеточного белка.
Полученный штамм депонирован во Всесоюзной коллекции промышленных микроорганизмов во ВНИИ генетики под номером ВКПМ В-6955.
Сущность изобретения заключается в том, что для экспрессии C-гена вируса гепатита B фрагмент BamHI клонируют по EcoRI сайту плазмиды pKK223-3 [13] с использованием синтетического линкера EcoRIBam HI. Затем проводят клонирование синтетического фрагмента ДНК, кодирующего последовательность эпитопа HBsAg, по Xho I сайту (Xho I сайт вводят предварительно с помощью олигонуклеотид-направленного мутагенеза, в область, соответствующую 81-82 аминокислотным остаткам HBcAg). В результате получают целую плазмиду pKHBc-33, кодирующую полноразмерный ген HBcAg, содержащий главный нейтрализующий эпитоп HBsAg (137-147).
Экспрессию гибридного HBcAg осуществляют в клетках E.coli JV103 с использованием индуктора ИПТГ. Индикацию экспрессии осуществляют с помощью белкового электрофореза и иммуноблоттинга. Рекомбинантный белок узнается антисывороткой, используемой в качестве положительного контроля в тест-системе "Векто-HBcAg антитела" (АО "Вектор Бест"; Россия) и моноклональными антителами к HBsAg. Уровень экспрессии определяют с помощью денситометрии полиакриламидного геля, окрашенного Кумасси. Уровень экспрессии составляет около 5% суммарного клеточного белка.
С помощью электронной микрофотографии показано, что продуцируемый белок собирается в частицы, по форме и морфологии подобные природному кору.
Таким образом, впервые получены плазмидная ДНК и штамм-продуцент, обеспечивающие экспрессию HBcAg с экспонированным на его поверхности главным нейтрализующим эпитопом HBsAg (137-147).
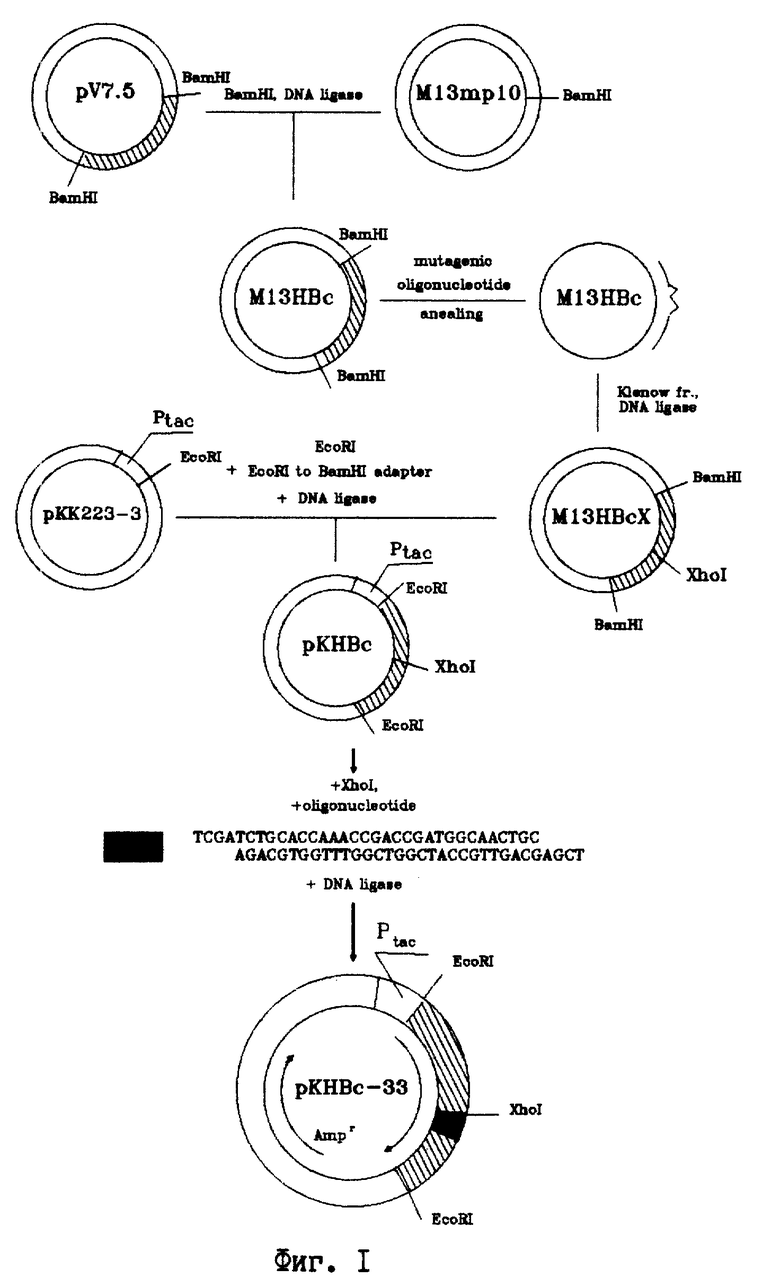
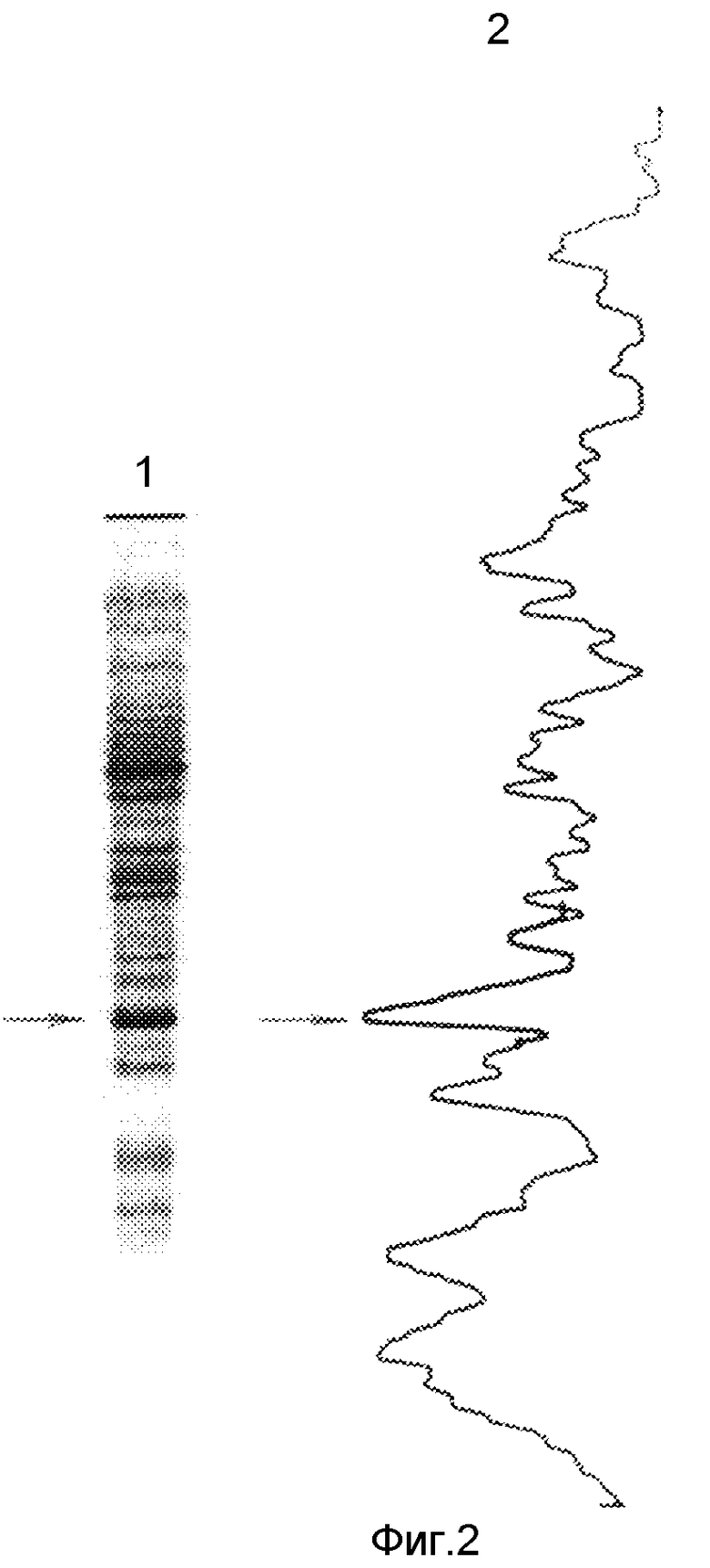
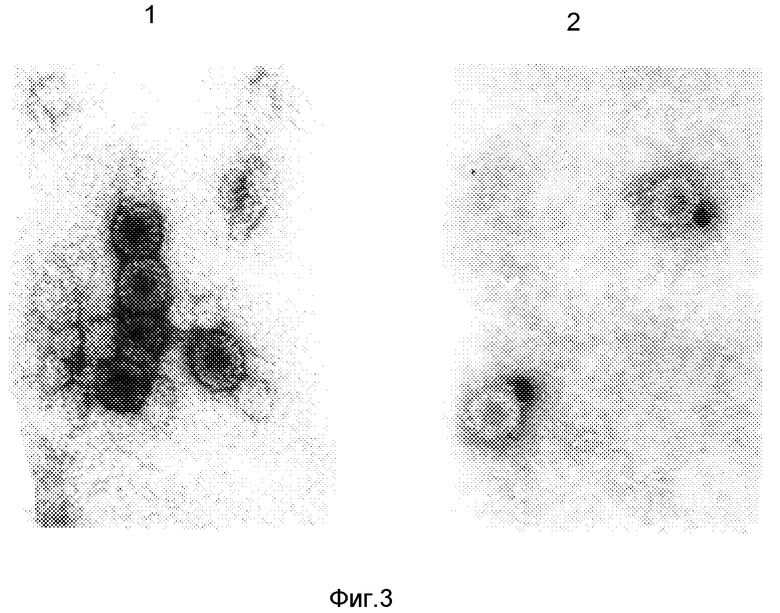
На фиг. 1 представлена схема плазмидной ДНК pKHBc-33 способа ее конструирования. BamHI, Xho I, EcoRI - сайты рестрикции; Klenov - фрагмент Кленова ДНК полимеразы I E.coli; ligase - ДНК-лигаза фага Т4; adapter - адаптор EcoRI-BamHI; --^^-- -олигонуклеотид-мутаген; Ptac - tac промотор; Amp - ген устойчивости к ампициллину; oligonuc-leotide - олигонуклеотид, кодирующий последовательность эпитопа HBsAg (137-147). На фиг. 2 - анализ клеточного лизата штамма E.coli JM103, несущего плазмиду pKHBc-33 в 12%-ном полиакриламидном геле и денситометрия геля. 1 - лизат клеток E.coli, трансформированных плазмидой pKHBc-33; 2 - денситограмма геля (стрелкой указан пик, соответствующий белку HBcAg-HBsAg (137-147). На фиг. 3 - электронная фотография рекомбинантного HBcAg и гибридного белка HBcAg-HBsAg (137-147), меченного иммунным золотом. Частицы предварительно инкубируются с моноклональными антителами к HBsAg, а затем конъюгатом анти-IgG с золотом. Далее препараты готовят методом негативного контрастирования 2%-ным раствором фосфорновольфрамовой кислоты и исследуют в электронном микроскопе. 1 - рекомбинантный HBcAg; 2 - гибридный белок HBcAg-HBsAg (137-147).
Пример 1. Способ конструирования плазмиды pKHBc-33. 1.1. Способ введения уникального Xho I сайта в область 81 аминокислотного остатка HBcAg.
В качестве источника C-гена используют плазмиду p7,5C [9], содержащую BamHI фрагмент ДНК (890 п.о.) вируса гепатита B, субтипа ayw.
50 мкг плазмиды p7,5C расщепляют BamHI эндонуклеазой в реакционной смеси, содержащей 100 ед. BamHI, 50 mM трис-HCl pH 7,6; 10 mM MgC12, 100 mM NaCl; 1 mM DTT. Реакцию ведут 1 ч при 37oC. После этого фрагмента ДНК длиной 890 п.о., содержащий C-ген с делетированными нуклеотидами, соответствующими первым трем аминокислотным остаткам HBcAg, выделяют методом электрофореза в агарозном геле с последующей электроэлюцией.
Отдельно расщепляют репликативную форму ДНК фага M13mp10 BamHI эндонуклеазой, инактивируют фермент прогреванием при 68oC 30 мин и лигируют с 1 мкг BamHI фрагмента плазмиды p7,5C в стандартных условиях. Полученной лигазной смесью транс-формируют компетентные клетки E.coli JM109(RecA-). С помощью рестрикционного анализа отбирают клоны, содержащие вставку и обозначаемые далее M13HBc. Отобранные клоны используют для наработки одноцепочечной ДНК и проведения мутагенеза по методу Золлера-Смита [11]. 1 пмоль одноцепочечной ДНК M13HBc смешивают с 20-кратным избытком олигонуклеотида, несущего запланированную мутацию в 10 мкл раствора, содержащего 20 мМ DTT. Пробирку с реакционной смесью нагревают до 75oC и постепенно охлаждают до комнатной температуры. Затем добавляют 10 мкл раствора, содержащего 20 мМ трис-HCl pH 7,5, 10 mM MgC12, 10 mM DTT, 1 mM ATP, 1 mM dATP, 1 mM dTTP, 1 mM dGTP, 1 mM dCTP, 4 ед.акт. ДНК-лигазы, 2 ед.акт. фрагмента Кленова ДНК-полимеразы I и инкубируют смесь в течение ночи при 10oC. Смесью трансформируют клетки E. coli JM103. Клоны, содержащие мутантный фаг, отбирают гибридизацией, с использованием в качестве зонда олигонуклеотида-мутагена. Отобранные фаговые ДНК, обозначенные M13HBcX, анализируют с помощью рестрикционного анализа и секвенирования по методу Сэнгера [14].
1.2. Конструирование рекомбинантной плазмиды pKHBc-33. Репликативную форму ДНК M13HBcX разрезают эндонуклеазой BamHI. Фрагмент ДНК, содержащий мутантный C-ген, несущий уникальный Xho I сайт, выделяют из агарозного геля с помощью электроэлюции. Плазмиду pKK223-3 расщепляют EcoRI нуклеазой, инактивируют фермент прогреванием при 68oC 30 мин, добавляют синтетический линкер EcoRI-BamHI (восстанавливающий начало гена HBcAg) и лигируют с 1 мкг BamHI фрагмента фага M13HBcX. Полученной лигазной смесью трансформируют компетентные клетки E.coli JM103. С помощью рестрикционного анализа отбирают клоны, содержащие вставку. Полученную плазмиду обозначают pKHBc. Затем плазмиду pKHBc разрезают эндонуклеазой Xho I и лигируют с синтетическим фрагментом, кодирующим последовательность эпитопа HBsAg (137-147). Полученную таким образом целевую плазмиду обозначают pКHBc-33. Схема плазмидной ДНК pKHBc-33 и способ ее конструирования представлены на фиг. 1.
Пример 2. Характеризация рекомбинантного белка HBcAg-HBsAg (137-147) - продукта плазмиды pKHBc-33.
Клетки E.coli JM103, содержащие плазмиду pKHBc-33, растят на среде LB до плотности 0,2 при D550, затем добавляют 0,1 mM ИПТГ (изопропил-β-D-галактопиранозид) и растят в течение ночи. Биомассу собирают центрифугированием и анализируют с помощью электрофореза по Лэммли и иммуноблоттинга с антисывороткой к HBcAg и моноклональными антителами к HBsAg. При сканировании полосы в полиакриламидном геле, соответствующей HBcAg, показан уровень продукции, составляющий 5% суммарного клеточного белка (фиг. 2).
Выделенные с помощью ультрацентрифугирования в градиенте сахарозы частицы гибридного HBcAg-HBsAg исследуют с помощью электронной микроскопии. В полученных препаратах обнаружены частицы по форме и морфологии аналогичные природному кору. Гибридные частицы инкубируют с моноклональными антителами к HBsAg, а затем конъюгатом анти-IgG с золотом. Электронная фотография белка HBcAg-HBsAg (137-147), меченного иммунным золотом (фиг. 3), показывает, что встроенный эпитоп HBsAg экспонирован на поверхности частицы.
Таким образом, впервые получены плазмидная ДНК и бактериальный штамм-продуцент, обеспечивающие экспрессию корантигена вируса гепатита B с экспонированным на его поверхности главным нейтрализующим эпитопом HBsAg (137-147).
Литература:
1. Филатов Ф.П. Экспозиционные (кассетные) векторы как подход к конструированию антигенных препаратов. // Успехи Соврем. Биолог. 1991, т. 111, с. 416-428.
2. Francis M.J., Hactings G.Z., Brown A.L., Grace K.G., Rowlands D.J., Brown F. , Clarke B.E. Immunological properties of hepatitis B core antigen fusion proteins. // Proc.Natl. Acad.Sci. USA. -1990. -V.87. -P2545-2549.
3. Грен Э.Я. Пумпен П.П. Рекомбинантные вирусные капсиды - новое поколение иммуногенных белков. // ЖВХО. 1988, т.33, 531-536.
4. Milich D.R., McLachlan A., Moriarty A., Thornton G.B. Immune response to hepatitis B virus core antigen (HBcAg): localization of T cell recognition sites within HBcAg/HBeAg.// J. Immunol. -1987. V.139. -P1223-1231.
5. Борисова Г.П., Берзинь И.Г., Цибиногин В.В., Лосева В.Я., Пушко П.М., Осе В.П., Дрейлиня Д.Э., Грен Э.Я. Кор-антиген вируса гепатита B в качестве носителя функционально активных эпитопов: экспонирование preS-участков на капсидах.// Доклады АН СССР, 1990, т.312, N 3, с.751-754.
6. Yoshikawa A., Tanaka T., Hochi Y., Kato N., Tachibana R., Iizuka H., Machida A. , Okamoto H., Yamasaki M., Miyakawa Y., Mayumi M. Chimeric Hepatitis B Virus Core particles with parts or copies of the Hepatitis C virus core protein.// J.Virol. -1993. -V.67. -P.6064-6070.
7. Schodel F. , Milich D. R. , Will H. Hepatitis B virus nucleocapsid/pre-S2 fusion proteins expressed in attenuated Salmonella for oral vaccination.// J. Immunol. - 1990. -V.145, N12. -P.4317-4321.
8. Авторское свидетельство СССР N 1713930, кл. C 12 N 15/51 опубл. БИ N 7 от 23.02.92.
9. Waters J.A., Brown S.E., Steward M.W., Howard C.R., Thomas H.C. Analysis of the antigenic epitopes of hepatitis B surface antigen involved in induction of a protective antibody response. // Virus Research-1991. -V.22. -P.1-12.
10. Патент РФ N 1651555, кл. C 12 N 15/51, опубл. БИ N 10 от 30.05.94.
11. Zoller M. J., Smith M. Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13 vectors. In:Meth.Enzymol./Wu R., Grossman L., Moldave K., eds. N.Y., London: Acad.Press. -1983. -V.100. -P.468-500.
12. Vierra J., Messing J. The pUC plasmids, an M13mp7-derived system for insertion mutagenesis and sequencing with systhetic universal primers. //Gene. -1982. -V.19. -P259-265.
13. Brosius J. Toxicity of an overproduced foreign gene product in E. coli and use in plasmid vectors for the selection.// Gene. 1984. -V.27. -P. 161-169.
14. Sanger F., Coulson A.R., Barrel B.G. Cloning in singlestranded bacteriophage as an to rapid DNA sequensing.//J.Mol. -1980. -V.143. -P161-178.
Изобретение относится к микробиологической и медицинской промышленности, генной и белковой инженерии, в частности к получению рекомбинантной плазмидной ДНКpКНВc-33, содержащей ген корового антигена вируса гепатита B (НВcAg) с экспонированным на его поверхности главным нейтрализующим эпитопом поверхностного антигена вируса гепатита B (137-147) (HBsAg) и соответствующего штамма-продуцента. Плазмида содержит также конструктивные элементы, необходимые для обеспечения экспрессии гибридного белка в клетках штамма-продуцента. Для получения штамма-продуцента компетентные клетки бактерии Escherichia coli IM103 трансформируют плазмидой рКНВс-33. Полученный штамм E. coli IM103/рКНВс-33 обеспечивает индуцируемый синтез НВсАg-HBsAg (137-147) с уровнем экспрессии около 5% от суммарного клеточного белка. 2 с.п. ф-лы, 3 ил.
| Schodel F., Milich D.R., Will H | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| Заслонка для русской печи | 1919 |
|
SU145A1 |
| ПЕРЕНОСНЫЕ ПОДМОСТКИ ДЛЯ РЕМОНТА САМОЛЕТОВ | 1924 |
|
SU4327A1 |
Авторы
Даты
1998-05-27—Публикация
1995-10-24—Подача