Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям и их фармацевтически приемлемым солям, обладающим способностью ингибировать матричные металлопротеазы, в частности интерстициальные коллагеназы, и, следовательно, пригодным для лечения болезненных состояний у млекопитающих, облегчаемых в результате ингибирования таких матричных металлопротеаз.
Предпосылки создания изобретения
Матричные металлопротеазы представляют собой семейство протеаз, участвующих в разложении и реконструировании соединительных тканей. Представители этого семейства ферментов обладают многочисленными свойствами, в том числе цинк- и кальций-зависимостью, секрецией в виде проферментов и 40-50%-ной гомологией последовательности аминокислот.
Семейство матричных металлопротеаз включает интерстициальные коллагеназы, происходящие из фибробластов/макрофагов и нейтрофилов, которые катализируют начальное расщепление и расщепление с ограниченной скоростью нативного коллагена типов I, II, III и X.
Коллаген, главный структурный протеин у млекопитающих, является основным компонентом матрикса многих тканей, например хрящевой, костной, ткани сухожилий и кожи. Интерстициальные коллагеназы являются очень специфичными матричными металлопротеазами, которые расщепляют коллаген с получением при этом двух фрагментов, которые спонтанно денатурируют при физиологических температурах и поэтому становятся чувствительными к расщеплению менее специфическими ферментами. Поскольку расщепление с помощью коллагеназы приводит к потере структурной целостности ткани-мишени, оно представляет собой практически необратимый процесс и, следовательно, является хорошей мишенью для терапевтического вмешательства.
Помимо интерстициальных коллагеназ, ферменты, относящиеся к семейству матричных металлопротеаз, включают две различные, но очень близкие желатиназы: фермент 72 кДа, секретируемый фибробластами, и фермент 92 кДа, высвобождаемый из одноядерных фагоцитов. Эти желатиназы обладают способностью разлагать желатины (денатурированные коллагены), нативный коллаген типов IV и V, фибронектин и нерастворимый эластин.
Семейство матричных металлопротеаз также включает стромелизины 1 и 2, обладающие способностью расщеплять широкий спектр матричных субстратов, в том числе ламинин, фибронектин, протеогликаны и коллаген типов IV и IX в их негеликоидальных областях.
Матрилизин (мнимая металлопротеаза или МнМП) является недавно открытым представителем семейства матричных металлопротеаз. Матрилизин обладает способностью разлагать широкий спектр матричных субстратов, в том числе протеогликаны, желатины, фибронектин, эластин и ламинин. Его экспрессия была зафиксирована в одноядерных фагоцитах, эксплантатах матки крыс и в единичных случаях в опухолях.
Полагают, что ингибиторы матричных металлопротеаз пригодны для лечения артритов, болезней, связанных с резорбцией кости (таких, как oстеопороз), повышенной деструкции коллагена, связанной с диабетом, болезней периодонта, изъязвления роговицы, изъязвления кожи и метастазов опухолей. Конструкция и потенциальные возможности использования ингибиторов коллагеназ описаны, например, в J. Enzyme Inhibition (1987), т.2, с.1-22, и в Drug News & Prospectives (1990), т.3, 8, с.453-458. Ингибиторы матричных металлопротеаз также являются предметом различных патентов и заявок на патенты, например патентов США 5189178 (на имя Galardy) и 5183900 (на имя Galardy), европейских заявок 0438223 (на имя Beecham) и 0276436 (на имя F.Hoffmann-La Roche), международных заявок WO 92/21360 (на имя Merck), 92/06966 (на имя Beecham) и 92/09563 (на имя Glycomed).
Краткое изложение сущности изобретения
Изобретение относится к новым соединениям, которые могут использоваться в качестве ингибиторов матричных металлопротеаз, в частности интерстициальных коллагеназ, и которые эффективны для лечения болезненных состояний, обусловленных избыточной активностью матричных металлопротеаз.
Таким образом, один предмет изобретения относится к соединениям формулы (I) в виде отдельного стереоизомера или смеси стереоизомеров: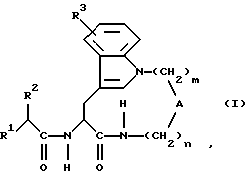
где m равно 2, 3, 4, 5 или 6 и
n равно 0, 1, 2, 3 или 4,
причем,
когда m равно 2,3 или 4, n равно 1,2,3 или 4 и
А обозначает -СН2-, -О- или -NR11 -, где R11 обозначает водород или алкил,
R1 обозначает
a) -CH2-R4, где R4 обозначает меркапто-, ацетилтио-, карбоксигруппу, аминокарбонил, N-гидроксиформиламиногруппу, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, бензилоксиаминокарбонил или группу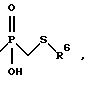
где R6 обозначает необязательно замещенный арил, причем арильная группа обозначает хинол-2-ил, нафт-1-ил, нафт-2-ил, пиридил или фенил,
б) -CHC(R7)-R8, где R7 обозначает алкил, гидрокси-, амино-, алкиламино-, ариламино-, алкилсульфониламино-, аралкилсульфониламиногруппу, алкоксикарбонил, аминокарбонил, аралкил или карбоксигруппу или же R7 обозначает -CH2NHR, где R обозначает водород, алкил, арил, 2-бензоксазол, -SO2Ra, -SO2NHRa, -SO2ORa, -C(O)Ra, -C(O)NHRa, -С(O)ORa, где Ra обозначает алкил, трифторметил, арил, аралкил, аралкенил или арилкарбониламиноалкиларил, и R8 обозначает карбоксигруппу, гидроксиаминокарбонил, алкоксикарбонил или аралкоксикарбонил, или
в) -NH-CH(R9)-R10, где R9 обозначает водород, алкил или аралкил и R10 обозначает карбоксигруппу, алкоксикарбонил или аралкоксикарбонил, фосфонил, диалкилфосфонил или метоксифосфонил,
R2 обозначает алкил, алкенил, трифторметилалкил, циклоалкил, циклоалкилалкил, гидроксиалкил, алкоксиалкил, аралкоксиалкил, арил, арилоксиалкил или аралкил и
R3 обозначает водород, гидроксигруппу, галоген, алкил, алкокси- или аралкоксигруппу,
когда n равно 0, m равно 4,5 или 6 и
А обозначает -CH(R12)-, где R12 обозначает карбоксигруппу, алкоксикарбонил или необязательно замещенный карбамоил и
R1, R2 и R3 имеют значения, указанные выше, или к их фармацевтически приемлемым солям.
Другой предмет изобретения относится к способам ингибирования активности матричных металлопротеаз у млекопитающих, причем эти способы включают введение млекопитающему при необходимости терапевтического количества соединения формулы (I) или его фармацевтически приемлемой соли.
Другой предмет изобретения относится к фармацевтическим композицииям, пригодным для ингибирования активности матричных металлопротеаз у млекопитающего, причем композиция включает терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, и фармацевтически приемлемый эксципиент.
Изобретение относится далее к способам получения соединения формулы (I).
Подробное описание изобретения
Определения
В контексте данного изобретения и в прилагаемой ниже формуле изобретения, если не указано иное, следующие понятия имеют указанные ниже значения.
"ВОС" обозначает третбутоксикарбонил.
"КБЗ" обозначает бензилоксикарбонил (карбобензилокси).
"ДМФ" обозначает N,N-диметилформамид.
"ЭДКИ" обозначает N-этил-N'-(3-диметиламинопропил)карбодиимид.
"ГОБТ" обозначает 1-гидроксибензтриазол.
"EtOAc" обозначает этилацетат.
"ТГФ" обозначает тетрагидрофуран.
"ДЦК" обозначает 1,3-дициклогексилкарбодиимид.
"ДМАП" обозначает 4-диметиламинопиридин.
"Pht" обозначает фталимид.
"Ацетилтио" обозначает радикал -SС(O)СН3.
"Галоген" обозначает бром, хлор или фтор.
"Алкил" обозначает одновалентный радикал с прямой или разветвленной цепью, состоящий только из углерода и водорода, имеющий от одного до шести атомов углерода и не содержащий ненасыщенных связей, например метил, этил, н-пропил, 2-метилпропил (изобутил), 1-метилэтил (изопропил), 1,1-диметилэтил (третбутил), и т.п.
"Алкенил" обозначает радикал с прямой или разветвленной цепью, содержащий по крайней мере одну ненасыщенную связь, например этенил, пент-4-енил и т.п.
"(Низший) алкил" обозначает радикал с прямой или разветвленной цепью, содержащий 1-4-атома углерода.
"Алкиламино" обозначает радикал формулы -NHRa, где Ra обозначает алкил, как определено выше, например метиламино, этиламино, н-пропиламино и т.п.
"Алкилен" в контексте данного описания обозначает двухвалентный углеводородный радикал с прямой или разветвленной цепью, содержащий 1-6 атомов углерода, такой, как метилен, этилен, пропилен, 2-метилпропилен, 1,2- диметилпропилен, гексилен и т.п.
"Алкокси" обозначает радикал формулы -ORa, где Ra обозначает алкил, как определено выше, например метокси, этокси, н-пропокси, изопропокси, 1-метилэтокси, н-бутокси, третбутокси и т.п., который необязательно замещен гидрокси-, алкоксигруппой, арилом, амино-, алкиламино-, диалкиламиногруппой, диалкиламинокарбонилом или N- метилпиперидин-3-илом.
"Аминокарбонил" обозначает радикал формулы -C(O)-NH2, где аминогруппа необязательно может быть замещена одной или двумя группами, выбранными из ряда, включающего гидроксигруппу, аралкил, аралкоксигруппу, алкиламиноалкил и диалкиламиноалкил, такой, как гидроксиаминокарбонил.
"Арил" обозначает одновалентный ненасыщенный ароматический карбоциклический радикал, имеющий одно или два кольца, такой, как фенил, нафтил, инданил или бифенил, либо одновалентный ненасыщенный ароматический гетероциклический радикал, такой, как хинолил, дигидроизоксазолил, фуранил, имидозолил, пиридил, фталимидо или тиенил, необязательно замещенный арилом, как определено выше. Арил может быть моно-, ди- или тризамещен, при этом заместители независимо друг от друга представляют собой галоген, гидроксигруппу, (низший) алкил, алкоксигруппу, трифторметил, арилокси-, аминогруппу, арил, ацетамидо- и/или цианогруппу, например 6-нитрохинол-2-ил, 6-фторхинол-2-ил, 6-гидроксихинол-2-ил, 6-метоксихинол-2-ил, 6-нитронаф-1-ил, 6-хлорнафт-1-ил, 6- гидроксинаф-1-ил, 6-метоксинафт-1-ил, 6-нитронафт-2-ил, 6-хлорнафт- 2-ил, 6-гидроксинафт-2- ил, 6-метоксинафт-2-ил, 6-нитрофенил, 6- хлорфенил, 6-гидроксифенил, 6-метоксифенил, бифенил, 3-метилпиридил, 4-этилпиридил, 4-хлорфенил, 4-феноксифенил, 2-пирролидин-1- илэтоксифенил, 4-цианфенил, нафтален-2-ил, 4-гидрокси-3-метилфенил и т.п.
"Арилокси" обозначает радикал формулы -ORb, где Rb, обозначает арил, как определено выше, например фенокси, хинол-2-илокси, нафт-1-илокси или нафт-2-илокси и т.п.
"Аралкил" обозначает радикал формулы -RcRb, где Rс обозначает алкилен, как определено выше, и Rb обозначает арил, как определено выше, например бензил, фенилэтилен, 3-фенилпропил и т.п.
"Аралкокси" обозначает радикал формулы -ORcRb, где Rc обозначает алкилен, как определено выше, и Rb обозначает арил, как определено выше, например бензилокси, 3-нафт-2-илпропокси и т.п.
"Алкоксикарбонил" обозначает радикал формулы -С(O)ORb, где Rb обозначает алкил, как определено выше, или Rb обозначает насыщенное карбоциклическое кольцо, содержащее один или более гетероатомов, например метоксикарбонил, этоксикарбонил, третбутоксикарбонил, N-мeтилпипepид-4-илоксикарбонил и т.п.
"Аралкоксикарбонил" обозначает радикал формулы -С(O)Rd, где Rd обозначает аралкоксигруппу, как определено выше, например бензилоксикарбонил, нафтил-2-илэтоксикарбонил и т.п.
"Бензилоксиаминокарбонил" обозначает радикал формулы - C(O)NHOCH2Ph, где Ph обозначает фенил.
"Карбамоил" обозначает радикал -C(О)NH2.
"Карбокси" обозначает радикал -С(О)ОН.
"Циклоалкил" обозначает одновалентный насыщенный карбоциклический радикал, не содержащий ненасыщенных связей и имеющий от трех до шести атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил.
"Циклоалкилалкил" обозначает радикал формулы -(CH2)pRe, где Re обозначает циклоалкил, как определено выше, и р обозначает целое число от 1 до 6, например циклопентилпропил, циклопропилметил, циклобутилметил, циклогексилбутил.
"Диалкиламино" обозначает радикал формулы -NRfRg, где Rf и Rg независимо обозначают алкил, как определено выше, или Rf и Rg вместе образуют кольцо, например морфолинил, пиперидинил или пирролидинил и т.п.
"Гидроксиамино" обозначает радикал -NHOH.
"Гидроксиаминокарбонил" обозначает радикал -C(О)NHOH.
"N-гидроксиформиламино" обозначает радикал -N(OH)C(О)H.
"Меркапто" обозначает радикал -SH.
"Сульфонил" обозначает радикал=S(О)2.
"Фосфонил" обозначает радикал -РO(OH)2.
"Необязательный" или "необязательно" обозначает, что последовательно описанные действия или обстоятельства могут иметь место или их может не быть и что описание включает ситуации, когда указанные действия или обстоятельства имеют место, и ситуации, когда они отсутствуют. Например, "необязательно замещенный хинол-2-ил" обозначает, что радикал хинол-2-ил может быть замещенным или может быть незамещенным и что определение включает как замещенные радикалы хинол-2-ил, так и радикалы хинол-2-ил, не имеющие замещения.
"Необязательно замещенный карбамоил" обозначает карбамоильный радикал, необязательно замещенный по атому азота одним или несколькими заместителями, выбранными из группы, состоящей из алкила, моно- и диалкиламиноалкила и аралкила.
"Аминозащитная группа" в контексте настоящего описания обозначает органические группы, предназначенные для защиты атомов азота от нежелательных реакций во время процессов синтеза, и включает, но не ограничена ими, бензил, ацил, ацетил, бензилоксикарбонил (карбобензилокси), параметоксибензилоксикарбонил, паранитробензилоксикарбонил, третбутоксикарбонил и т.п.
"Фармацевтически приемлемая соль" включает как фармацевтически приемлемые кислотно-аддитивные соли, так и соли присоединения оснований.
"Фармацевтически приемлемая кислотно-аддитивная соль" обозначает такие соли, которые сохраняют биологическую активность и свойства свободных оснований, которые не являются нежелательными по биологическим или иным причинам и которые образуются при добавлении к свободному основанию неорганических кислот, таких, как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., либо органических кислот, таких, как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, паратолуолсульфоновая кислота, салициловая кислота и т.п..
"Фармацевтически приемлемая соль присоединения основания" обозначает такие соли, которые сохраняют биологическую активность и свойства свободных кислот, которые не являются нежелательными по биологическим или иным причинам. Эти соли получают при добавлении неорганического или органического основания к свободной кислоте. Соли, образованные неорганическими основаниями, включают, но не ограничены ими, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, образованные из органических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включающих встречающиеся в естественных условиях замещенные амины, циклические амины и основные ионобменные смолы, такие, как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диметиламиноэтанол, 2- диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминные смолы и т.п. Особенно предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин.
"Млекопитающие" включают людей и всех домашних и диких животных, в том числе, но не ограничиваясь ими, крупный рогатый скот, лошадей, свиней, овец, коз, собак, кошек и т.п.
"Терапевтически эффективное количество" относится к такому количеству соединения формулы (I), которое, будучи при необходимости назначенным млекопитающему, является достаточным для осуществления лечения, как определено ниже, болезненных состояний, облегчаемых в результате игибирования активности матричной металлопротеазы, в частности активности интерстициальной коллагеназы. Количество соединения формулы (I), которое составляет "терапевтически эффективное количество", будет изменяться в зависимости от соединения, состояния болезни и ее серьезности, а также от млекопитающего, подвергающегося лечению, однако оно может быть определено общепринятым образом обычным специалистом в данной области техники, полагаясь на его собственные знания и данное описание.
Понятия "лечение" или "лечить" в контексте настоящего описания охватывают лечение болезненного состояния у млекопитающего, прежде всего у человека, которое облегчается путем ингибирования активности матричной металлопротеазы, в частности активности интерстициальной коллагеназы и т.п., и включает:
(I) предупреждение наступления болезненного состояния у млекопитающего, в частности, если указанное млекопитающее предрасположено к болезненному состоянию, но еще не установлено, что таковое наступило;
(II) ингибирование болезненного состояния, т.е. прекращение его развития;
или
(III) облегчение болезненного состояния, т.е. обеспечение регрессии болезненного состояния.
"Изомеры" представляют собой различные соединения, которые имеют одинаковую молекулярную формулу.
"Стереоизомеры" представляют собой изомеры, отличающиеся только по ориентации их атомов в пространстве.
"Энантиомеры" представляют собой пару стереоизомеров, которые являются несовмещаемыми зеркальными отображениями друг друга. Смесь 1:1 пары энантиомеров представляет собой "рацемическую" смесь.
"Диастереомеры" представляют собой стериоизомеры, которые не являются зеркальными отображениями друг друга.
Используемая в настоящем описании номенклатура в основном представляет собой модифицированную форму номенклатуры ИЮПАК (Международного союза теоретической и прикладной химии), согласно которой соединения по изобретению названы как производные фосфиновой или алкановой кислот, имеющие трициклический заместитель. Соединения формулы (I) имеют в своей структуре по крайней мере два асимметричных атома углерода, а именно, в точке присоединения заместителя R2 и индолилметильной группы. Соединения формулы (I) и их фармацевтически приемлемые соли, следовательно, могут существовать в виде отдельных энантиомеров, рацематов, диастериомеров и в виде смесей энантиомеров и диастереомеров. Все указанные отдельные стереоизомеры, рацематы, диастереомеры и их смеси включены в объем настоящего изобретения.
При обозначении отдельных стереоизомеров соединений формулы (I) абсолютный дескриптор R или S может быть отнесен к хиральным атомам углерода в соответствии с методикой "Правила последовательности" Кана, Ингольда и Прелога.
Например, следующее соединение формулы (I), в котором n равно 2, m равно 3, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает -C(О)NHOH, R2 обозначает 2-метилпропил и R3 обозначает водород, т.е. соединение следующей формулы: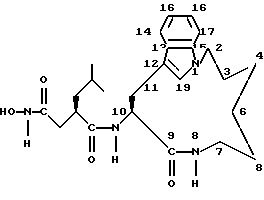
названо в данном описании (3R,10S)-N-гидрокси-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил) гексанамидом.
Другим примером является следующее соединение формулы (I), в котором m равно 2, n равно 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает карбоксигруппу, R обозначает 3-(4- пиридинил)пропил и R3 обозначает водород, т.е. соединение следующей формулы: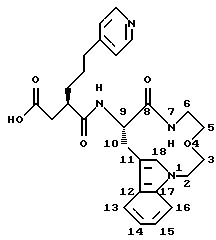
которое названо (3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановой кислотой.
Применение и назначение
А. Применение
Соединения формулы (I) могут использоваться в качестве ингибиторов матричных металлопротеаз млекопитающих, в частности интерстициальных коллагеназ млекопитающих, и, таким образом, предотвращают разложение коллагена в организме млекопитающего. Следовательно, соединения пригодны для лечения болезненных состояний, обусловленных повышенной активностью матричных металлопротеаз, в частности повышенной активностью интерстициальной коллагеназы, таких, как артрит и остеоартрит, метостазы опухоли, болезнь периодонта и изъязвления роговицы (см., например, в Arthritis and Reumatism (1993), т. 36, 2, с. 181-189; Arthritis and Reumatism (1991), т. 34, 9, с.1073-1075; Seminars in Arthritis and Reumatism (1990), т. 19, 4, Suplement 1 (февраль), с. 16-20; Drug of the Future (1990), т. 15, 5, с. 495-508; и в J. Enzyme Inhibition (1987), т. 2, с. 1-22).
Б. Исследования
Способность соединений формулы (I) ингибировать активность матричной металлопротеазы, в частности активность интерстициальной коллагеназы, может быть продемонстрирована различными опытами in vitro и ex vivo, известными обычным специалистам в данной области техники. Например, активность отдельной металлопротеазы может быть продемонстрирована в опыте in vitro, который описан в Anal. Biochem. (1985), т. 147, с. 437, или с помощью его модификаций. Физиологические воздействия, полученные в результате ингибирования матричных металлопротеаз, могут быть продемонстрированы методом ех vivo с использованием хрящевого эксплантата быка, описанным в Methods of Enzymology (1987), т. 144, с. 412-419, либо с помощью его модификаций, или методом ех vivo с использованием длинной кости крысиного эмбриона, описанным в Proc. Natl. Acad. Sci. USA (1988), т. 85, с. 8761-8765, либо с помощью его модификаций, или в J. Clin. Invest. (1965), т. 44, с. 103-116, либо с помощью его модификаций.
Способность ингибировать активность коллагеназы-1,-2 и -3, стромелизина-1, желатиназ А и В и матрилизина может быть продемострирована методами, описанными в статье ММР Enzymatic Assay (ферментативный анализ ММП (матричных металлопротеаз)) в FEBS, 296, 263 (1992), либо с помощью их модификаций. Способность соединений формулы (I) ингибировать медиируемые ММП процессы in vivo может быть изучена методом с использованием стимулированного интерлейкином-1 хрящевого эксплантата и методом с использованием имплантированного хрящевого штифта.
В. Общее назначение
Введение соединений формулы (I) или их фармацевтически приемлемых солей в чистом виде или в виде соответствующей фармацевтической композиции может быть осуществлено с помощью любых приемлемых способов введения или агентов, используемых для подобных целей. Таким образом, введение может осуществляться, например, оральным, назальным, парентеральным, местным, трансдермальным или ректальным путем в виде твердых, полутвердых дозируемых форм, лиофилизированного порошка или в виде жидких дозируемых форм, например, таких, как таблетки, суппозитории, пилюли, желатиновые капсулы с мягкой эластичной или твердой оболочкой, порошки, растворы, суспензии или аэрозоли и т.п., предпочтительно в виде унифицированных дозируемых форм, пригодных для простого введения с точной дозировкой. Композиции могут включать обычный фармацевтический носитель или эксципиент и соединение формулы (I) в качестве действующего вещества, а также другие лекарственные средства, фармацевтические средства, носители, адъюванты и т.д.
Обычно в зависимости от назначаемого способа введения фармацевтически приемлемые композиции могут содержать от приблизительно 1 мас.% до приблизительно 99 мас.% соединения(ий) формулы (I) или его(их) фармацевтически приемлемой (ых) соли (ей) и от 99 до 1 мас.% фармацевтически пригодного эксципиента. Предпочтительно композиция должна содержать от приблизительно 5 мас. % до приблизительно 75 мас.% соединения (ий) формулы (I) или его (их) фармацевтически приемлемой (ых)соли (ей), при этом остальное приходится на долю фармацевтически приемлемых эксципиентов.
Предпочтительным путем введения является оральный с использованием обычной суточной схемы приема, которая может корректироваться в зависимости от серьезности подлежащего лечению болезненного состояния. Для такого орального введения фармацевтически приемлемую композицию, содержащую соединение(я) формулы (I) или его(их) фармацевтически приемлемую (ые) соль(и), получают путем включения любых обычно используемых эксципиентов, таких, как, например, фармацевтически чистые маннит, лактоза, крахмал, предварительно желатинизированный крахмал, стеарат магния, натрийсахарин, тальк, эфирные производные целлюлозы, глюкоза, желатин, сахароза, цитрат, пропилгаллат и т.п.. Такие композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, порошков, композиций с непрерывным высвобождением лекарства и т.п.
Предпочтительно такие композиции должны иметь форму капсулы, капель или таблетки и, следовательно, должны включать разбавитель, такой, как лактоза, сахароза, дифосфат кальция и т.п., агент, способствующий дезинтеграции, такой, как натрийкроскармелоза или ее производные, замасливатель, такой, как стеарат магния и т.п., и связующее вещество, такое, как крахмал, смола акации, поливинилпирролидон, желатин, эфирные производные целлюлозы и т.п.
Соединения формулы (I) или их фармацевтически приемлемые соли могут также быть приготовлены в форме суппозитория с использованием, например, от приблизительно 0,5% до приблизительно 50% действующего вещества, распределенного в медленно растворяющемся внутри организма носителе, например в полиоксиэтиленгликолях и полиэтиленгликолях (ПЭГ), например ПЭГ 1000 (96%) и ПЭГ 4000 (4%).
Жидкие композиции, предназначенные для фармацевтических целей, могут, например, быть приготовлены путем растворения, диспергирования и т.д. соединения (ий) формулы (I) (от приблизительно 0,5% до приблизительно 20%) или его фармацевтически приемлемой (ых) соли (ей) и необязательно фармацевтических адъювантов в носителе, таком, как, например, вода, физиологический раствор, водная декстроза, глицерин, этанол и т.п., для получения раствора или суспензии.
При необходимости фармацевтическая композиция по изобретению может также содержать небольшие количества добавочных веществ, таких, как смачивающие или эмульгирующие агенты, забуферивающие рН агенты, антиоксиданты и т.п., такие, как, например, лимонная кислота, сорбитанмонолаурат, триэтаноламинолеат, бутилированный гидрокситолуол и т.д.
Практические способы получения таких дозируемых форм известны или очевидны для специалистов в данной области техники, например, см. в Remington's Pharmaceutical Sciences, 18-е издание, (Mack Publishing Company, Easton, Pennsylvania, 1990). Применяемая композиция в любом случае должна содержать терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли для лечения болезненного состояния, которое может быть облегчено в результате ингибирования активности матричной металлопротеазы в соответствии с рекомендациями настоящего изобретения.
Соединения формулы (I) или их фармацевтически приемлемые соли применяют в терапевтически эффективном количестве, которое в значительной степени должно зависеть от различных факторов, включающих активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия соединения, возраст, вес тела, общее состояние здоровья, пол пациента, диету, режим и время введения, скорость экскреции, комбинацию лекарств, серьезность конкретного болезненного состояния и терапию, которой подвергается пациент. Обычно терапевтически эффективная суточная доза составляет от приблизительно 0,14 мг до приблизительно 14,3 мг/кг веса тела в день для соединения формулы (I) или его фармацевтически приемлемой соли, предпочтительно от приблизительно 0,7 мг до приблизительно 10 мг/кг веса тела в день и наиболее предпочтительно от приблизительно 1,4 мг до приблизительно 7,2 мг/кг веса тела в день. Например, при назначении человеку весом 70 кг диапазон доз может варьироваться от приблизительно 10 мг до приблизительно 1,0 г соединения формулы (I) или его фармацевтически приемлемой соли в день, предпочтительно от приблизительно 50 мг до приблизительно 700 мг в день и наиболее предпочтительно от приблизительно 100 мг до приблизительно 500 мг в день.
Предпочтительные варианты осуществления изобретения
Первым предпочтительным классом соединений формулы (I) являются таковые, в которых n равно 1,2 или 3, m равно 3 и А обозначает -СН2-. Предпочтительным подклассом соединений этого класса являются такие соединения, в которых n равно 1 или 2 и в которых R1 обозначает -CH2-R4 и R3 обозначает водород, прежде всего в которых R2 обозначает 2-метилпропил, бифенилпропил, тиен-2-илэтил, циклопентил, циклопропилметил или циклопентилметил и R4 обозначает ацетилтио, меркапто, карбокси, алкоксикарбонил, N-гидроксиаминокарбонил или N-гидроксиформиламино.
Предпочтительной подгруппой соединений этой группы являются такие соединения, в которых R2 обозначает 2-метилпропил или циклопентилметил и R4 обозначает ацетилтио, меркапто, карбокси, N-гидроксиаминокарбонил или N-гидроксиформиламино.
Другая предпочтительная подгруппа включает такие соединения, в которых R1 обозначает
где R6 обозначает необязательно замещенный арил, причем арильная группа обозначает хинол-2-ил, нафт-1-ил, нафт-2-ил, пиридил или фенил. Предпочтительным подкласом соединений этого класса являются такие соединения, в которых R6 обозначает хинол-2-ил.
Другой предпочтительной подгруппой соединений являются такие соединения, в которых R1 обозначает -CH(R7)-R8, где R7 обозначает -CH2NHR, где R прежде всего обозначает водород, R2 обозначает 2-метилпропил или циклопентилметил, R3 обозначает водород и R8 обозначает карбоксигруппу. Особенно предпочтительными являются такие соединения, в которых R обозначает метоксикарбонил, метансульфонил или этилуреидо.
Другой предпочтительной подгруппой соединений являются такие соединения, в которых R1 обозначает -СH(R7)-R8-R8, где R7 обозначает алкил, алкоксикарбонил или карбоксигруппу, R2 обозначает 2-метилпропил или циклопентилметил, R3 обозначает водород и R8 обозначает карбоксигруппу или гидроксиаминокарбонил. Особенно предпочтительными являются такие соединения, в которых R7 обозначает метоксикарбонил.
Другой предпочтительной подгруппой соединений являются такие соединения, в которых R1 обозначает -NH-CH(R9)-R10, где R9 обозначает водород, алкил или аралкил и R обозначает карбоксигруппу, алкоксикарбонил или аралкоксикарбонил.
Другим предпочтительным классом являются такие соединения, в которых n равно 2 или 3, m равно 4, А обозначает -N(R11)-, где R11 обозначает водород или алкил, R2 обозначает алкил и R3 обозначает водород. Предпочтительным подклассом соединений этого класса являются такие соединения, в которых n равно 2, R2 обозначает 2-метилпропил и R11 обозначает метил.
Еще одним предпочтительным классом являются такие соединения, в которых тип оба равны 2, А обозначает кислород, R4 обозначает карбоксигруппу или гидроксиаминокарбонил и R2 обозначает арил, аралкил или аралкоксиалкил.
Таким образом, наиболее предпочтительными соединениями формулы (I) являются следующие:
(3R, 10S)-N-гидрокси-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18], нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексанамид;
(3R, 11S)-N-гидрокси-5-метил-3-(10-оксо-1,9-диазатрициклo[11.6.1.014.19] эйкoзa-13(20),14(19),15,17-тeтpaeн-11-илкapбaмoил)гeкcaнaмид;
(3R, 9S)-N-гидрокси-5-метил-3-(8-оксо-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)гексанамид;
(3R, 9S)-5-метил-3-(8-оксо-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)гексановая кислота;
(3R, 9S)-4-циклопентил-3-(8-оксо-1,7-диазатрицикло[9.6.1.0.12.17]октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)бутановая кислота;
(3R, 9S)-4-циклобутил-3-(8-оксо-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12(17),13,15-тетраен-9-илкарбамоил)бутановая кислота и ее метиловый или этиловый эфир;
(3R,9S)-3-(8-оксо-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18),12(17), 13,15-тетраен-9-илкарбамоил)6-пиридин-4-илгексановая кислота;
(3R, 9S)-4-(3-метокси-4,5(R, S)-дигидроизоксазол-5-ил)-3-(8-оксо-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12(17),13,15-тетраен-9-илкарбамоил)бутановая кислота;
(3R, 9S)-4-(3-гидрокси-4,5(R,S)-дигидроизоксазол-5-ил)-3-(8-оксо-1,7-диазатрицикло [9.6.1.012.17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)бутановая кислота;
(3R, 9S)-4-(3-бром-4,5(R, S)-дигидроизоксазол-5-ил)-3-(8-оксо-1,7-диазатрицикло [9,6.1.012.17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)бутановая кислота;
(2S, 3R,9S)-2-гидрокси-5-метил-3-(8-оксо-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12(17), 13,15-тетраен-9-илкарбамоил)гексановая кислота;
(2R, 3R, 9S)-2-(этоксикарбониламинометил-5-метил-3-(8-оксо-1,7-диазатрицикло [9.6.1.012.17] октадека-11(18), 12(17), 13,15-тетраен-9-илкарбамоил)гексановая кислота;
(3R, 9S)-5-(4-хлорфенокси)-3-(8-оксо-1,7-диазатрицикло [9.6.1.012.17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)гексановая кислота;
(2R, 3RР, 9S)-2-(метансульфонамидометил)-4-циклопентил-3-(8-оксо-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11(18), 12(17),13,15-тетраен-9-илкарбамоил)бутановая кислота;
(10S)-2-меркаптометил-4-метил-N-(9-оксо-1.8-диазатрицикло [10.6.1.013.18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)пентанамид;
(10S)-[4-метил-2-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)пентил] (хинолин-2-илтиометил)фосфиновая кислота;
(10S)-2-ацетилтиометил-4-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013.18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)пентанамид;
(3R, 10S)-N-гидрокси-5-метил-2-метоксикарбонил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013.18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексанамид;
(3S, 10S)-4-циклопентил-3-(9-оксо-1,8- диазатрицикло [10.6.1.013.18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)бутановая кислота;
этиловый эфир (3R, 10S)-4-циклопентил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты;
1-(2-диметиламиноэтил)амид(3R, 10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты;
1-метилпиперидин-4-иловый эфир (3R, 10S)-5-метил-3-(9-оксо-1,8-10 диазатрицикло[10.6.1.013.18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты;
(3R, 10S)-3-циклопентил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013.18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил) пропионовая кислота;
(3R,10S)-4-циклoпpoпил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013.18]нoнaдека-12(19),13(18),14,16-тетраен-10-илкарбамоил)бутановая кислота;
(3R,10S)-6-(бифенил-4-ил) -3-(9-оксо-1,8-диазатрициклo[10.6.1.013.18]нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановая кислота;
(3R, 10S)-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013.18] нoнaдeкa-12(19), 13(18),14,16-тетраен-10-илкарбамоил)-5-(тиофен-2-ил)пентановая кислота;
(3R,10S)-2-(аминометил)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановая кислота;
(3R, 10S)-N-гидpoкcи-N-фopмилaминo-5-мeтил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013.18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановая кислота;
(3R, 10S)-2-(метоксикарбониламинометил)-5-метил-3-(9-оксо-1,8-диaзaтpициклo[10.6.1.013.18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановая кислота;
(3R, 10S)-6-пиридин-4-ил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12,(19),13(18),14,16-тетраен-10-илкарбамоил)гексановая кислота;
(3R, 10S)-2-(метансульфонамидометил)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18]нонадека-12,19,13(18),14,16-тетраен-10-илкарбамоил)гексановая кислота;
(3R, 10S)-2-(3-этилуреидометил)-5-метил-3-(9-оксо-1,8-диазатрициклo[10.6.1.013.18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановая кислота;
(3R, 10S)-N-гидрокси-N-формиламино-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013.18]нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил) гексиламин;
(2S, 3R, 9S)-N-гидрокси-2-гидрокси-5-метил-3-(8-оксо-1,7-диaзaтpициклo[9.6.1.012.17]oктaдeкa-11(18),12(17),13,15-тeтpaeн-9- илкарбамоил)гексанамид;
(3R,9S)-5-мeтил-3-(8-oкco-4-oкca-l,7-диaзaтpициклo[9.6.1.012.17]oктaдека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота;
(3R,9S)-3-циклобутилметил-N-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11,(18),12,14,16-тетраен-9-илкарбамоил)сукцинамовая кислота;
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-5-феноксипентановая кислота;
(3R,9S)-5-(4-хлорфенокси)-3-(8-оксо-4-окса-1,7-диазатрициклo[9.6.1.012.17] oктaдeкa-11(18), 12,14, l6-тeтpaeн-9-илкapбaмoил)пeнтaнoвaя кислота;
этиловый эфир (3R,9S)-5-(4-хлорфенокси)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0.12.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)пентановой кислоты;
этиловый эфир (3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0.12.17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-5-феноксипентановой кислоты;
(3R, 9S)-6-(4-гидроксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота;
(3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановая кислота;
(3R, 9S)-6-[4-(3-гидроксипропокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11 (18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота;
(3R,9S)-3-(8-oкco-4-oкca-1,7-диaзaтpициклo[9.6.1.012.17]oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-5-(4-феноксифенил)пентановая кислота;
(3R,9S)-6-[4-(2-гидроксиэтокси)фенил] -3-(8-оксо-4-окса-1,7- диазатрицикло[9.6.1.0. 12.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота;
(3R,9S)-3-(8-оксо4-окса-1,7-диазатрицикло[9.6.1.0.12.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(2-пирролидин-1-илэтокси) фенил] гексановая кислота;
(3R, 9S)-6-(4-метоксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.0. 12.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил) гексановая кислота;
(3R, 9S)-6-[4-(2-метоксиэтокси)фенил] -3-(8-оксо-4-окса-1,7-диaзaтpициклo[9.6.1.0. 12.17]oктaдeкa-11(18),12,14,16-тeтpaeн-9-илкapбaмoил) гексановая кислота;
(3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-5-фенилпентановая кислота;
(3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-6-фенилгексановая кислота;
(3R,9S)-6-(3-гидроксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.0. 12.17]oктaдeкa-11(18),12,14,16-тетраен-9-илкарбамоил) гексановая кислота;
(3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(3-пиперидин-1-илпропокси) фенил]гексановая кислота;
(3R, 9S)-6-[4-(3-диметиламинопропокси)фенил] -3-(8-оксо-4-окса-1,7- диазатрицикло[9.6.1.0. 12.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил) гексановая кислота;
(3R, 9S)-6-[4-(2-диметиламиноэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11, (18,12,14,16)тетраен-9-илкарбамоил)гексановая кислота;
(3R, 9S)-6-(4-цианфенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил) гексановая кислота;
(3R, 9S)-6-нафталин-2-ил-3-(8-оксо-4-окса-1,7- диазатрицикло [9.6.1.0. 12.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил) гексановая кислота;
(3R,9S)-3-(8-oкco-4-oкca-l,7-диaзaтpициклo[9.6.1.012.17]oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-(4-пиррол-1-илфенил) гексановая кислота;
(3R,9S)-6-(4-гидрокси-3-метилфенил)-3-(8-оксо-4-окса-1,7- диазатрицикло[9.6.1.012.17] oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил) гексановая кислота;
(3R, 9S)-6-(4-бензилоксифенил)-3-(8-оксо-4-окса-1,7 -диазатрицикло[9.6.1.0. 12.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил) гексановая кислота;
(3R, 9S)-6-[4-(4-аминобутокси)фенил] -3-(8-оксо-4-окса-1,7- диазатрицикло[9.6.1.0. 12.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил) гексановая кислота;
(3R,9S)-5-(4-метоксифенил)-3-(8-оксо-4-окса-1,7-диазатрициклo[9.6.1.012.17] oктaдeкa-11(18), 12,14,16-тeтpaeн-9-илкapбaмoил)пeнтaнoвaя кислота;
(3R, 9S)-6-(4-аминофенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота;
(3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-6-14-(пиридин-4-илметокси) фенил] гексановая кислота;
(3R, 9S)-6-(4-ацетиламинофенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17]октадека-11,(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота; и
этиловый эфир (3R, 9S)-6-[4-(3-гадроксипропокси)фенил]-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.0. 12.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановой кислоты.
Получение соединений формулы (I)
Соединения формулы (I) являются производными пептидов, которые могут быть получены из производного α--аминокислот, составляющих эти пептиды.
Стандартные способы образования пептидных связей приведены у М. Bodanszky и др., в The Practice of Peptide Synthesis (1984), Springer-Verlag; у М. Bodanszky, в Principles of Peptide Synthesis (1984), Springer-Verlag; у J. P. Greenstein и др., в Chemistry of the Amino Acids (1961), т. 1-3, John Wiley and Sons Inc.; у G.R. Pettit в Synthetic Peptides (1970), т. 1-2, Van Nostrand Reinhold Company.
Амидные сочетания, используемые для образования соединений формулы (I), обычно осуществляют с помощью карбодиимидного метода с такими реагентами, как дициклогексилкарбодиимид или N,-этил-N,-(3-диметилами-нопропил)карбодиимид (ЭДКИ), в присутствии 1-гидроксибензтриазола (ГОБТ) в инертном растворителе, таком, как диметилформамид (ДМФ). Другие способы образования амидной или пептидной связи включают способы синтеза с использованием хлорангидрида кислоты, ацилазида, смешанного ангидрида или активированного сложного эфира, такого, как нитрофениловый эфир, но не ограничены ими. Обычно амидные сочетания проводят в фазе раствора с пептидными фрагментами или без них.
Выбор защитных групп для концевых амино- или карбоксильных групп в соединениях, используемых для получения соединений формулы (I), частично определяется конкретными условиями амидного или пептидного сочетания, а частично компонентами аминокислоты и/или пептида, участвующими в сочетании. Обычно используемые аминозащитные группы включают таковые, хорошо известные в данной области техники, как, например, бензилоксикарбонил (карбобензилокси), параметоксибензилоксикарбонил, паранитробензилоксикарбонил, третбутоксикарбонил (ВОС) и т.п.Предпочтительно применять либо ВОС, либо бензилоксикарбонил (КБЗ) в качестве защитной группы для α-аминогруппы из-за относительной простоты ее удаления слабыми кислотами, например трифторуксусной кислотой (ТФК) или соляной кислотой в этилацетате, или с помощью каталитического гидрирования.
Индивидуальные стереоизомеры соединений формулы (I) можно отделять друг от друга способами, известными обычным специалистам в данной области техники, например, когда R1 обозначает карбоксигруппу, путем разделения (например, фракционированной кристаллизацией, хроматографией и/или способами, приведенными в описании) диастереомерных солей, образовавшихся при взаимодействии соединения формулы (I) с оптически активным основанием при температуре в интервале от 0oС до температуры дефлегмации растворителя, используемого для фракционированной кристаллизации. Примерами таких оптически активных оснований являются бруцин, стрихнин, хинин, хинидин, цинхонидин, эфедрин, 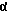 -метилбензиламин и т.п.
-метилбензиламин и т.п.
Комбинации заместителей и/или переменных в соединениях формулы (I) допустимы только тогда, когда такие комбинации приводят к получению стабильных соединений.
А. Получение промежуточных веществ: Соединения формулы (J)
Соединения формулы (J):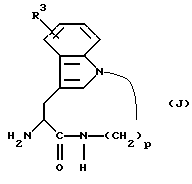
в которых R3 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", и р равно 5,6,7 или 8, пригодны для получения соединений формулы (I). Соединения формулы (J) получают согласно реакционной схеме 1, приведенной ниже, R3 и р имеют указанные значения, ВОС обозначает третбутоксикарбонил и R13 обозначает водород, мезил или тозил.
Соединения формул (В) и (F) являются коммерчески доступными, например, они поставляются фирмами Karl Industries, Inc. или Sigma соответственно, либо могут быть получены методами, известными специалистам в данной области техники.
Обычно соединения формулы (J) получают сначала этерификацией спирта формулы (В) уксусным ангидридом в присутствии основания, предпочтительно пиридина, с образованием соединения формулы (С), которое затем восстанавливают в присутствии уксусного ангидрида, получая соединение формулы (D). Соединение формулы (D) подвергают гидролизу в кислой среде, предпочтительно в присутствии соляной кислоты, с образованием соединения формулы (Е), которое затем подвергают сочетанию с соединением формулы (F) в стандартных условиях пептидного сочетания, например, с ЭДКИ в присутствии ГОБТ в ДМФ, получая соединение формулы (G), в котором R13 обозначает гидроксигруппу. Это соединение затем может быть обработано либо тозилхлоридом, либо мезилхлоридом с образованием соединения формулы (G), в котором R13 обозначает мезил или тозил. Циклизация полученных таким образом тозилатов с избытком NaH в инертном растворителе, предпочтительно в ТГФ, при сильном разбавлении и при комнатной температуре позволяет получить соединение формулы (Н). В другом варианте циклизация полученных таким образом тозилатов с концентрированным гидроксидом натрия в инертном растворителе, предпочтительно в CH2Cl2, в присутствии межфазного катализатора, предпочтительно бисульфата тетра-(н-бутил)аммония, позволяет получить соединения формулы (Н). Защитную группу в соединениях формулы (Н) удаляют в слабокислой среде, предпочтительно в присутствии трифторуксусной кислоты, получая соединения формулы (J).
Б. Получение соединений формул (Ia), (Ib), (Ic) и (Id)
Соединения формулы (Ia) представляют собой соединения формулы (I), в которых n равно 1,2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает алкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Ib) представляют собой соединения формулы (I), в которых n равно 1,2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает карбоксигруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Ic) представляют собой соединения формулы (I), в которых n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает бензилоксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Id) представляют собой соединения формулы (I), в которых n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает гидроксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формул (Iа), (Ib), (Ic) и (Id) получают согласно приведенной ниже реакционной схеме 2, где р равно 5,6,7 или 8, R14 обозначает алкил или бензил, R7a обозначает водород или алкоксикарбонил и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (К) получают способами, представленными в настоящем описании, либо они могут быть получены способами, известными специалистам в данной области техники.
Обычно соединения формул (Ia), (Ib) и (Iс) получают сначала сочетанием соединения формулы (J) с соединением формулы (К) в стандартных условиях пептидного сочетания с образованием соединения формулы (Iа). Защитную группу в соединении формулы (Iа) затем удаляют в слабокислой среде, получая соединение формулы (Ib).
Соединение формулы (Ib) затем подвергают сочетанию с 0-бензилгидроксиламином в стандартных условиях пептидного сочетания, получая соединение формулы (Iс). Бензильную защитную группу в соединении формулы (Iс) затем удаляют в условиях каталитического гидрирования, получая соединение формулы (Id).
В. Получение соединений формул (Iе) и (If)
Соединения формулы (Iе) представляют собой соединения формулы (I), в которых n равно 1,2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает ацетилтио, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (If) представляют собой соединения формулы (I), в которых n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает меркаптогруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формул (Iе) и (If) получают согласно приведенной ниже реакционной схеме 3, где R2 и R3 имеют указанные выше значения и р равно 5, 6, 7 или 8.
Соединения формулы (М) являются коммерчески доступными либо могут быть получены способами, известными специалистам в данной области техники.
Обычно соединения формул (Iе) и (If) получают сначала сочетанием соединения формулы (М) с соединением формулы (J) в стандартных условиях пептидного сочетания с образованием соединения формулы (Iе). Обработка соединений формулы (Iе) концентрированным NH4OH в метаноле позволяет получить соответствующие соединения формулы (If).
Г. Получение соединений формулы (К) и их индивидуальных стереоизомеров
Соединения формулы (К):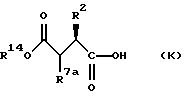
в которых R14 обозначает алкил или бензил и R обозначает водород, алкоксикарбонил, гидроксикарбамоил, карбоксигруппа или необязательно замещенный карбамоил, используют для получения соединений формулы (I). Индивидуальные стереоизомеры соединений формулы (К) используют для получения соответствующего стереоизомера соединений формулы (I). В частности, соединения нижеприведенной формулы (Ка):
в которых R7a обозначает водород, являются стереоизомерами соединения формулы (К), которые имеют R-конфигурацию. Соединения формулы (Ка) получают согласно приведенной ниже реакционной схеме 4, где R2 имеет указанные выше значения
Аналогичным способом, но заменяя сультам D-(-)-2,10-камфоры на сультам L-(+)-2,10-камфоры, получают соответствующие индивидуальные стереоизомеры с S-конфигурацией.
Соединения формулы (НН) являются коммерчески доступными или могут быть получены в соответствии со способами, известными обычным специалистам в данной области техники, например способом, описанным ниже в примере 11. Сультам L-(+)-2,10-камфоры и сультам D-(-)-2,10-камфоры являются коммерчески доступными, например, поставляются фирмой Aldrich.
Обычно соединения формулы (Ка) получают сначала путем конденсации соединения формулы (НН) с сультамом L-(+)-2,10-камфоры с образованием соединения формулы (N). После добавления в течение одного часа NaHMDS (гексаметилдисилазид натрия) для образования аниона реакцию прекращают с помощью третбутилбромацетата с образованием соответствующего сложного эфира формулы (Q). Затем удаляют камфорную группу в щелочной среде, получая индивидуальный стереоизомер соединения формулы (Ка), где углерод, к которому присоединен заместитель R, находится в R-конфигурации.
В другом варианте соединения формулы (Ка) могут быть получены в соответствии со следующей реакционной схемой 4А.
Соединение формулы (HH) сначала конденсируют с 4S-фенилметилоксазолидиноном в стандартных условиях, получая соответствующее соединение формулы (aa). К соединению формулы (aa) добавляют приблизительно эквимолярное количество гексаметилдисилазида натрия в инертном растворителе, таком, как ТГФ. Реакция протекает при температуре от -70 до -95oС в течение приблизительно 15 минут. К этой смеси добавляют избыток третбутилбромацетата и раствор перемешивают приблизительно в течение 2 часов при температуре от -90 до -60oС, получая в основном единственный стереоизомер формулы (bb), который очищают с использованием стандартных методов органической химии. Оксазолидиноновую группу соединения формулы (bb) удаляют в щелочной среде, получая индивидуальный стереоизомер формулы (Ка).
Соединения формулы (Kb):
в которых R7c обозначает алкоксикарбонил, могут быть получены согласно приведенной ниже реакционной схеме 5, где R2 и R7c имеют значения, указанные выше.
Соединения формул (R) и (Т) являются коммерчески доступными или могут быть получены в соответствии со способами, известными специалистам в данной области техники.
Обычно соединения формулы (Kb) получают сначала путем обработки соединения формулы (R) изобутеном и каталитически активным количеством концентрированной H2SO4 в метиленхлориде с последующей перегонкой и с получением третбутилового эфира формулы (S). Соединение формулы (S) затем подвергают взаимодействию с соединением формулы (Т) в присутствии третбутоксида калия, получая соединение формулы (U). После гидролиза соединения формулы (U) в кислой среде, предпочтительно в присутствии трифторуксусной кислоты при комнатной температуре, получают соединение формулы (Kb), в котором R7c обозначает алкоксикарбонил.
Соединения формулы (К), в которых R7a обозначает карбоксигруппу, могут быть получены из соединений формулы (Kb), в которых R7c обозначает алкоксикарбонил, способами, известными специалистам в данной области техники, например, гидролизом.
В дополнение к вышеописанным способам получения изомеров соединений формулы (К), соединения формулы (К), в которых R7a обозначает алкил, могут быть получены обработкой соединения формулы (К), в котором R7a обозначает водород, в апротонном растворителе, например, в ТГФ, в присутствии NaN(тетраметилсилана)2, галоидалканом, предпочтительно йодметаном, с получением соединения формулы (К), в котором R7a обозначает алкил.
Д. Получение соединений формулы (Ig)
Соединения формулы (Ig) представляют собой соединения формулы (I), в которых n равно 1,2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает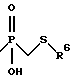
где R6 обозначает необязательно замещенный арил, причем арильная группа обозначает хинол-2-ил, нафт-1-ил, нафт-2-ил, пиридил или фенил, R2 обозначает алкил, и R3 обозначает водород. Соединения формулы (Ig) получают согласно приведенной ниже реакционной схеме 6, где р равно 5,6,7 или 8,R,R3 и R6 имеют указанные выше значения и R12a обозначает мезил или тозил.
Cоединения формулы (W) могут быть получены в соответствии со способами, известными специалистам в данной области техники, либо могут быть получены в соответствии со способом, описанным ниже в примере 19. Соединения формулы (Z) являются коммерчески доступными либо могут быть получены в соответствии со способами, известными специалистам в данной области техники.
Обычно соединения формулы (Ig) получают сначала путем обработки соединения формулы (W) формамидом с образованием соединения формулы (X). Соединение формулы (X) затем обрабатывают хлоридом тозила или мезила в щелочной среде с образованием соединения формулы (Y). Соединение формулы (Y) затем подвергают взаимодействию с солью соединения формулы (Z) (предпочтительно с натриевой солью, полученной в результате взаимодействия соединения формулы (Z) с гидридом натрия) с получением соединения формулы (АА). Соединение формулы (АА) затем подвергают гидролизу в щелочной среде с получением соединения формулы (ВВ). Соединение формулы (ВВ) затем подвергают сочетанию с соединением формулы (J) в стандартных для пептидов условиях, предпочтительно с 1,1,-карбонилдиимидазолом, получая соединение формулы (Ig).
Е. Получение соединений формул (Ih), (Ii) и (Ij)
Соединения формул (Ih), (Ii) и (Ij) представляют собой соединения формулы (Ib), формулы (Iс) и формулы (Id) соответственно, как описано выше в разделе Б, у которых индольное кольцо является полностью насыщенным. Их получают согласно приведенной ниже реакционной схеме 7, где R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", R7A обозначает водород и р равно 5,6,7 или 8.
Обычно соединения формул (Ih), (Ii) и (Ij) получают сначала путем восстановления соединения формулы (Ib) в условиях каталитического гидрирования с образованием соединения формулы (Ih). Соединение формулы (Ih) затем подвергают взаимодействию с O-бензилгидроксиламином в стандартных условиях пептидного сочетания, получая соединение формулы (Ii). Затем из соединения формулы (Ii) удаляют бензильную защитную группу в условиях каталитического гидрирования, получая соединение формулы (Ij).
Ж. Получение соединений формул (Ik),(Il),(Im) и (In)
Соединения формулы (Ik) представляют собой соединения формулы (I) с аллильной связью, в которых n равно 2 или 3, m равно 4, А обозначает -NR11, где R11 обозначает водород или алкил, R1 обозначает -CH2-R4, где R4 обозначает третбутоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Il) представляют собой соединения формулы (I) с аллильной связью, в которых n равно 2 или 3, m равно 4,А обозначает -NR11, где R11 обозначает водород или алкил, R1 обозначает -CH2-R4, где R4 обозначает карбоксигруппу, и R2 и R3- имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Im) представляют собой соединения формулы (I) с аллильной связью, в которых n равно 2 или 3, m равно 4,А обозначает -NR11, где R11 обозначает водород или алкил, R1 обозначает -CH2-R4, где R4 обозначает бензилоксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (In) представляют собой соединения формулы (I), в которых n равно 2 или 3, m равно 4,А обозначает -NR11, где R11 обозначает водород или алкил, R1 обозначает -CH2-R4, где R4 обозначает гидроксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формул (Ik), (Il), (Im) и (In) получают согласно приведенной ниже реакционной схеме 8, где n равно 2 или 3,R2,R3 и R11 имеют указанные выше значения, R14 обозначает алкил или бензил, R7a обозначает водород и ВОС обозначает третбутоксикарбонил.
Соединения формулы (F) получают способами, известными специалистам в данной области техники, либо способами, представленными в данном описании.
Обычно соединения формул (Ik), (II), (Im) и (In) получают сначала взаимодействием соединения формулы (F) с диаминалканом или моноалкилзамещенным диаминалканом в стандартных условиях пептидного сочетания, например, с ГОБТ и ЭДКИ, в инертном растворителе, например, в ДМФ, с образованием соединения формулы (DD). Соединение формулы (DD) затем подвергают взаимодействию с транс-1,4-дихлорбут-2-еном в щелочной среде, получая соединение формулы (ЕЕ). Аминозащитную группу соединения формулы (ЕЕ) затем удаляют в слабокислой среде, предпочтительно обработкой трифторуксусной кислотой, получая соединение формулы (FF).
Соединение формулы (FF) затем подвергают сочетанию с соединением формулы (К) в стандартных условиях пептидного сочетания, например, с ГОБТ и ЭДКИ, получая соединение формулы (Ik). Защитную группу соединения формулы (Ik) затем удаляют в слабокислой среде, предпочтительно обработкой трифторуксусной кислотой, получая соединение формулы (Il). Соединение формулы (Il) затем обрабатывают О-бензилгидроксиламином в стандартных условиях пептидного сочетания, получая соединение формулы (Im). Защитную группу соединения формулы (Im) затем удаляют в условиях каталитического гидрирования, получая соединение формулы (In).
З. Получение соединений формул (Io) и (Iр)
Соединения формулы (Iо) представляют собой соединения формулы (I), в которых n равно 1,2 или 3, m равно 3 или 4, А обозначает -СН2-,R1 обозначает -NH-CH(R9)-R10, где R9 обозначает водород, алкил или аралкил и R10 обозначает аралкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Iр) представляют собой соединениия формулы (I), в которых n равно 1, 2 или 3, m равно 3 или 4,А обозначает -СН2-, R1 обозначает -NH-CH-(R9)-R10, где R9 обозначает водород, алкил или аралкил и R10 обозначает карбоксигруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формул (Iо) и (Iр) получают согласно приведенной ниже реакционной схеме 9, где р равно 5,6,7 или 8, и R2,R3 и R9 имеют указанные выше значения.
Соединения формулы (JJ) получают способами, известными специалистам в данной области техники, либо способом, описанным ниже в примере 36.
Обычно соединения формул (Iо) и (Iр) получают сначала обработкой соединения формулы (JJ) трифлиновым ангидридом, а затем путем обработки соединения формулы (КК) в щелочной среде с образованием соединения формулы (LL). Затем соединение формулы (LL) подвергают гидролизу в слабокислой среде, предпочтительно обработкой трифторуксусной кислотой, получая соединение формулы (ММ). Затем соединение формулы (ММ) подвергают сочетанию с соединением формулы (J) в стандартных условиях пептидного сочетания, получая соединение формулы (Iо). Затем у соединения (Iо) удаляют защитную группу, получая соединение формулы (Iр).
И. Получение соединений формул (Iq) и (Ir)
Соединения формулы (Iq) представляют собой соединения формулы (I), в которых n равно 1,2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -СH(R7)-R8, где R7 обозначает -CH2NHR, где R обозначает водород и R8 обозначает карбоксигруппу, бензилоксикарбонил или алкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Ir) представляют собой соединения формулы (I), в которых n равно 1,2 или 3,m равно 3 или 4,А обозначает -СН2-, R1 обозначает -CH(R7)-R8, где R7 обозначает -CH2NHR, где R обозначает водород и R8 обозначает карбоксигруппу, и R, R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формул (Iq) и (Ir) получают согласно приведенной ниже реакционной схеме 10.
Соединения формул (J) получают приведенными ниже методами. Соединения формулы (NN) получают методами, хорошо известными специалистам в данной области техники, например, как описано в ЕР 575844.
Обычно соединения формул (РР) и (lq) получают сначала путем сочетания соединения формулы (J) с соединением формулы (NN) в стандартных условиях пептидного сочетания, получая соединение формулы (РР). Фталимидную группу соединения формулы (РР) затем превращают в амин стандартными методами, например, путем обработки гидразином, получая соединение формулы (Iq).
Соединение формулы (Iq) затем может быть превращено в соединение формулы (Ir) с помощью реакций, хорошо известных в данной области техники. Например, взаимодействие соединения формулы (Iq) с алкилсульфонилгалогенидом в присутствии основания с последующим гидролизом продукта в присутствии трифторуксусной кислоты позволяет получить соединение формулы (Ir), в котором R обозначает алкилсульфонил. Аналогично этому взаимодействие соединения формулы (Iq) с алкил-, арил- или аралкилхлорформиатом позволяет получить соответствующий карбамат, взаимодействие с ацилгалогенидом позволяет получить соответствующий амид, взаимодействие с соответствующим образом замещенным изоцианатом позволяет получить соответствующую мочевину и т.д.
К. Получение соединений формулы (I). в которых R1 обозначает -CH-R4. где R4 обозначает N-гидроксиформиламино
Для получения соединений формулы (I), в которых R1 обозначает -CH2-R4, где R4 обозначает N-гидроксиформиламино, соединение формулы (J) сначала подвергают взаимодействию в условиях пептидного сочетания, описанных выше, с соединением формулы:
Такие соединения могут быть получены согласно описанию к заявке на патент США 08/343158, полное описание которой включено в настоящее описание в виде ссылки.
Продукт этой реакции сочетания затем дебензилируют способом, аналогичным описанному выше на реакционной схеме 2, получая соединение формулы (I), в котором R1 обозначает -CH2-R4, где R4 обозначает N-гидроксиформиламино.
Л. Получение соединений формул (Is). (It) и (Iu)
Соединения формулы (Is) представляют собой соединения формулы (I), в которых m и n оба равны 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает третбутилоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (It) представляют собой соединения формулы (I), в которых m и n оба равны 2,А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает карбоксигруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Iu) представляют собой соединения формулы (I), в которых m и n оба равны 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает алкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формул (Is), (It) и (Iu) получают согласно приведенной ниже реакционной схеме 11.
Соединения формулы (Ka) могут быть получены в соответствии с данным описанием. Получение соединений формулы (ff) представлено ниже.
Обычно соединения формулы (Is) получают сначала путем сочетания соединения формулы (Ка) с соединением формулы (ff) в стандартных условиях пептидного сочетания, получая соединение формулы (Is).
Обработка соединений формулы (Is) в слабокислой среде позволяет получить соответствующие соединения формулы (It).
Соединения формулы (Is) также могут быть превращены в соединения формулы (Iu), в которых R1 обозначает -CH2-R4, где R4 обозначает алкоксикарбонил, отличный от третбутилкарбонила, способами, известными в данной области техники.
Кроме того, соединения формулы (I), в которых m и n равны 2,А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает гидроксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", могут быть получены в сответствии с методикой, описанной выше для получения соединений формулы (Id) из соединений формулы (Iс).
М. Получение соединения формулы (ff)
Получение соединения формулы (ff)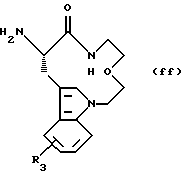
показано на следующей реакционной схеме 12.
Соединения формул (kk) и (ll) являются коммерчески доступными, например, поставляются фирмами Sigma и Aldrich соответственно, либо могут быть получены методами, известными специалистам в данной области техники.
Соединения формулы (ll), показанные на реакционной схеме 12, применяют для получения соединений формулы (I), в которых m и n оба равны 2. Очевидно, что процесс, приведенный на реакционной схеме 12, может быть осуществлен с любым из соединений, представленных формулой H2N(CH2)nO(CH2)mOH, в котором m и n имеют значения, указанные в разделе "Краткое изложение сущности изобретения". Эти соединения либо являются коммерчески доступными, либо могут быть получены методами, хорошо известными специалистам в данной области техники.
Обычно соединение формулы (ff) получают сначала путем сочетания соединения формулы (kk) с соединением формулы (ll) в стандартных условиях пептидного сочетания, например, с ДЦК в присутствии ГОБТ в ДМФ, с получением соединение формулы (mm). Это соединение формулы (mm) затем обрабатывают тозилхлоридом, получая соединение формулы (nn). Для этой реакции вместо тозилхлорида также может быть использован мезилхлорид. Циклизация полученного таким образом тозилата с избытком NaH в инертном растворителе, предпочтительно в ТГФ, при сильном разбавлении и при комнатной температуре позволяет получить соединение формулы (оо). В альтернативном варианте циклизация полученного таким образом тозилата с концентрированным гидроксидом натрия в инертном растворителе, предпочтительно в СН2Сl2, в присутствии межфазного катализатора, предпочтительно бисульфата тетра(н-бутил) аммония, позволяет получить соединение формулы (оо). Защитную группу ВОС соединения формулы (оо) удаляют в слабокислой среде, предпочтительно в присутствии трифторуксусной кислоты, получая соединение формулы (ff).
Н. Получение соединений формулы (Iv)
Соединения формулы (Iv) представляют собой соединения формулы (I), в которых m и n оба равны 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает карбоксигруппу или алкоксикарбонил, и R2 обозначает аралкил, в котором цепь алкилена представляет собой -(СН2)3-, и R3 имеет значения, указанные в разделе "Краткое изложение сущности изобретения".
Соединения формулы (Iv) получают согласно приведенной ниже реакционной схеме 13.
Соединение формулы (ff) может быть получено по методике, приведенной в данном описании.
Соединения формулы (gg) могут быть получены в соответствии в реакционной схемой 4А при условии замены соединения формулы (НН) оответствующим аллильным соединением, в котором группа, обозначенная как R2 в формуле (НН), представляет собой проп-2-енил.
Обычно соединения формулы (Iv) получают сначала путем сочетания соединения формулы (ff) с соединением формулы (gg) в стандартных условиях пептидного сочетания, получая соединение формулы (hh).
Введение арила группы R2 в аллильную цепь путем арилирования соединений формулы (hh) осуществляют в присутствии основания и палладиевого катализатора путем добавления арилгалогенида, предпочтительно бромида или йодида, и выдержки реакционной смеси в течение приблизительно 2-4 часов, предпочтительно 4 часов, при температуре около 100oС с получением соединения формулы (ii). Каталитическое гидрирование (Pd/C) аллильного соединения формулы (ii) позволяет получить соответствующие соединения формулы (Iv').
Соединения формулы (Iv') могут быть превращены в соответствующие соединения, в которых R1 обозначает -CH2-R4, где R4 обозначает карбоксигруппу или другие алкоксикарбонильные группы, с использованием методик, которые описаны для получения соединений формул (It) и (Iu).
В другом варианте арилирование может быть осуществлено сначала для соединений формулы (gg) по описанным выше методикам, а образовавшееся соединение формулы (Ка) затем подвергают сочетанию с соединением формулы (ff).
О. Получение соединений формулы (Iw)
Соединения формулы (Iw) представляют собой соединения формулы (I), в которых R2 обозначает аралкил, в котором арил замещен алкоксигруппой (арил-O-R2, и m, n, R1 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Эти соединения могут быть получены путем модификации заместителей на арильном кольце, такой, как O-алкилирование фенольной группы (т.е. R''обозначает водород.)
Соли соединений формулы (I)
Кроме того, все соединения формулы (I), существующие в форме свободного основания, могут быть превращены в их фармацевтически приемлемые соли путем обработки соответствующей неорганической или органической кислотой. Соли соединений формулы (I) могут быть также превращены в форму свободного основания или в другую соль.
Таким образом, соединения формулы (I) получают:
1) взаимодействием соединения формулы (К), в котором R7a обозначает водород или алкоксикарбонил, R14 обозначает алкил или бензил и R2 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с соединением формулы (J), где р равно 5, 6, 7 или 8 и R3 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с получением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает алкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
2) превращением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает алкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R обозначает -СН2-R4, где R4 обозначает карбоксигруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
3) обработкой соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R* обозначает -CH2-R4, где R4 обозначает карбоксигруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", O-защищенным гидроксиламином, таким, как O-бензилгидроксиламин, с получением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -СН2-R4, где R4 обозначает бензилоксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
4) превращением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает бензилоксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает гидроксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
5) взаимодействием соединения формулы (M), в котором R2 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с соединением формулы (J), в котором р равно 5, 6, 7 или 8 и R3 обозначает водород, с получением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает ацетилтио, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
6) превращением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает ацетилтиогруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -СН2-R4, где R4 обозначает меркаптогруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
7) взаимодействием соединения формулы (ВВ), в котором R2 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", и R6 обозначает необязательно замещенный арил, причем арильная группа обозначает хинол-2-ил, нафт-1-ил, нафт-2-ил, пиридил или фенил, с соединением формулы (J), в котором р равно 5, 6, 7 или 8 и R имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с получением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH2-R4, где R4 обозначает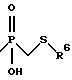
где R6 обозначает необязательно замещенный арил, причем арильная группа обозначает хинол-2-ил, нафт-1-ил, нафт-2-ил, пиридил или фенил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
8) превращением соединения формулы (Im), в котором n равно 2 или 3, m равно 4, А обозначает -NR11, где R11 обозначает водород или алкил, R1 обозначает -CH2-R4, где R4 обозначает бензилоксиаминокарбонил, R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором n равно 2 или 3, m равно 4, А обозначает -NR11, где R11 обозначает водород или алкил, R1 обозначает -CH2-R4, где R4 обозначает гидроксиаминокарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
9) взаимодействием соединения формулы (ММ), в котором R9 обозначает водород, алкил или аралкил и R2 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с соединением формулы (J), в котором р равно 5, 6, 7 или 8 и R имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с получением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает NH-CH(R9)-R10, где R9 обозначает водород, алкил или аралкил и R10 обозначает аралкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
10) превращением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает NH-CH(R9)-R10 где R9 обозначает водород, алкил или аралкил и R10 обозначает аралкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает NH-CH(R9)-R10, где R9 обозначает водород, алкил или аралкил и R10 обозначает карбоксигруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
11) превращением соединения формулы (РР), в котором р равно 5, 6, 7 или 8, R14 обозначает гидроксигруппу, бензил или алкил и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH(R7)-R8, где R7 обозначает -CH2NHR, где R обозначает водород и R8 обозначает карбоксигруппу, бензилоксикарбонил или алкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
12) превращением соединения формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH(R7)-R8, где R7 обозначает -CH2NHR, где R обозначает водород и R8 обозначает бензилоксикарбонил или алкоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложениеи сущности изобретения", в соединение формулы (I), в котором n равно 1, 2 или 3, m равно 3 или 4, А обозначает -СН2-, R1 обозначает -CH(R7)-R8, где R7 обозначает -CH2NHR, где R обозначает водород и R8 обозначает карбоксигруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
13) взаимодействием соединения формулы (Ка), в котором R2 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с соединением формулы (ff), в котором R3 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с получением соединения формулы (I), в котором m и n оба равны 2, А обозначает кислород, R1 обозначает -СН2-R4, где R4 обозначает третбутилоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложениие сущности изобретения", или
14) гидрированием соединения формулы (ii), в котором R3 имеет значения, указанные в разделе "Краткое изложение сущности изобретения", с получением соединения формулы (I), в котором m и n оба равны 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает третбутоксикарбонил, и R2 обозначает аралкил (арил-(СН2)3-), а R3- имеет значения, указанные в разделе "Краткое изложение сущности изобретения", или
15) превращением соединения формулы (I), в котором m и n оба равны 2, А обозначает кислород, R обозначает -CH2-R4, где R4 обозначает третбутилоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором m и n оба равны 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает карбоксигруппу, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
16) превращением соединения формулы (I), в котором m и n оба равны 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает карбоксигруппу или третбутилоксикарбонил, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором m и n оба равны 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает алкоксикарбонил, отличный от третбутилоксикарбонила, и R2 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", или
17) превращением соединения формулы (I), в котором R2 обозначает гидроксиарилалкил, и m, n, R1 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения", в соединение формулы (I), в котором R2 обозначает алкоксиарилалкил и m, n, R1 и R3 имеют значения, указанные в разделе "Краткое изложение сущности изобретения".
Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем.
Пример 1
Соединение формулы (Е)
А. 6-циан-1-гексанол (7,1 г, 55,8 ммоля) растворяли в 30 мл уксусного ангидрида в атмосфере аргона. К этому продукту добавляли по каплям 5,3 мл (65,4 ммоля) пиридина и смесь перемешивали в течение 2 часов. Содержимое колбы затем сливали в химический стакан, содержащий 50 мл ледяной воды, и продукт перемешивали в течение 15 минут. Смесь переносили в делительную воронку объемом 250 мл и добавляли простой эфир (100 мл). После встряхивания эфирную фазу выделяли, а водную фазу дважды промывали простым эфиром (2х100 мл). Объединенную эфирную фазу промывали соляным раствором, сушили (MgSO4) и фильтровали. После упаривания (роторный испаритель и вакуумный насос) получали 6-циан-1-ацетоксигексан (соединение формулы (С), которое немедленно использовали на следующей стадии.
Б. 6-циан-1-ацетоксигексан (55,8 ммоля) растворяли в приблизительно 100 мл уксусного ангидрида в реакционном сосуде Парра (объемом 500 мл). К этой смеси добавляли уксусную кислоту (0,5 мл), а затем оксид платины (100 мг). Сосуд помещали в аппарат для гидрирования Парра и заряжали газообразным водородом (40 фунт/кв. дюйм). Продукт встряхивали в течение 12 часов, фильтровали через целит (для удаления катализатора), заряжали свежим оксидом платины (100 мг) и водородом (40 фунт/кв.дюйм) и встряхивали еще в течение 24 часов. Продукт фильтровали через целит и все летучие компоненты удаляли при пониженном давлении (роторный испаритель). Требуемый 1-ацетокси-7-ацетамидогептан был достаточно чистым для использования на следующей стадии (выход 11,8 г).
В. 1-ацетокси-7-ацетамидогептан (11,8 г, 54,3 ммоля) растворяли в 20 мл метанола в 200 мл круглодонной колбе. К этой смеси добавляли 50 мл 40%-ной водной соляной кислоты и смесь кипятили с обратным холодильником в течение 60 часов. Все летучие компоненты удаляли при пониженном давлении. Требуемый 7-амино-1-гептанол получали в виде кристаллической гидрохлоридной соли с tпл 74-81oС, МС: 131 (МН +).
Пример 2
Соединения формулы (G)
А. N-метилморфолин (2,2 мл, 19,7 ммоля) добавляли по каплям при перемешивании и при комнатной температуре к гидрохлориду 7-амино-1- гептанола (3,3 г, 19,7 ммоля) в 50 мл безводного ДМФ в атмосфере аргона. После перемешивания в течение 5 минут добавляли следующие соединения: N-третбутоксикарбонил-L-триптофан (5 г, 16,45 ммоля), 1-гидроксибензотриазол (2,52 г, 16,45 ммоля) и гидрохлорид ЭДКИ (4,73 г, 24,7 ммоля). Смесь перемешивали в течение 2 часов и затем ДМФ удаляли при пониженном давлении. Остаток растворяли в холодной 2,5%-ной НСl (100 мл) и этилацетате (3х100 мл) и переносили в делительную воронку. Органическую фазу выделяли и последовательно промывали холодной 2,5%-ной НСl (100 мл), а затем соляным раствором (100 мл). Этилацетатную фазу сушили (MgSO4), фильтровали и концентрировали, получая N-третбутоксикарбонил-L-триптофан- (7-гидроксигептил)амид;
ИК: (чистый): 3300, 2921, 1685, 1645, 1490, 1356, 1157 см-1;
1Н-ЯМР (80 МГц, СDС13): δ 0,98-1,62 (m, 10Н,  ), 1,45 (s, 9H, третбутил), 2,86-3,32 (m, 4Н, СН-
), 1,45 (s, 9H, третбутил), 2,86-3,32 (m, 4Н, СН- HN-
HN-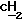 ), 3,68 (t, 2H, J=5,6 Гц, -
), 3,68 (t, 2H, J=5,6 Гц, -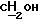 ), 4,22-4,55 (m, 1H,
), 4,22-4,55 (m, 1H, 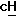 ), 5,12-5,32 (широкий d, 1H,
), 5,12-5,32 (широкий d, 1H, 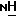 -CH), 5,65-5,9 (широкий t, 1H,
-CH), 5,65-5,9 (широкий t, 1H,  -CH2), 6,98-7,92 (m, 5H,
-CH2), 6,98-7,92 (m, 5H,  ), 8,63 (широкий s, индол
), 8,63 (широкий s, индол 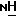 ).
).
Б. Раствор N-третбутоксикарбонил-L-триптофан-(7-гидроксигептил)амида (8,2 г) в 150 мл безводного пиридина охлаждали при 0oС (ледяная баня). В виде одной порции к раствору добавляли паратолуолсульфонилхлорид (4,7 г) и охлажденную смесь оставляли перемешиваться в течение 7 часов. Реакцию прекращали, добавляя 50 мл ледяной воды и удаляя все летучие компоненты при пониженном давлении. Продукт, N-третбутоксикарбонил-L-триптофан-(N'-(7-(4'-метилфен-1-ил)сульфонилокси)гептил)амид, выделяли с помощью колоночной хроматографии с силикагелем, используя в качестве элюента от 10 до 40% этилацетата/гексан. Этот продукт кристаллизовался при выстаивании, МС: 572 (МН+).
В. В другом варианте к раствору, содержащему N-третбутоксикарбонил-L-триптофан (5,0 г, 16,45 ммоля), 6-амино-1-гексанол (2,31 г, 19,74 ммоля) и 1-гидроксибензотриазол•Н2О (2,52 г, 16,45 ммоля) в безводном ДМФ (50 мл), при комнатной температуре в атмосфере аргона добавляли ЭДКИ (4,73 г, 24,68 ммоля). После перемешивания в течение ночи ДМФ удаляли в глубоком вакууме. Остаток распределяли между этилацетатом (150 мл) и 1н. НСl (75 мл). Органический слой дополнительно промывали 1н. НСl (75 мл), насыщенным раствором бикарбоната натрия (2х75 мл) и в завершение соляным раствором (50 мл). Органический слой сушили (MgSO4) и упаривали досуха, получая 6,45 г (97%) N-третбутоксикарбонил-L-триптофан-N'-(6-гидроксигексил)амид в виде белой пены,
МС: 404,3 (М+Н)+. Чистота продукта подтверждена с помощью аналитической ЖХВР.
Г. Далее к N-третбутоксикарбонил-L-триптофан-N'-(6-гидроксигексил)амиду (5,5 г, 13,64 ммоля) в 150 мл безводного пиридина при 0oС в атмосфере аргона добавляли 3,9 г (20,46 ммолей) паратолуолсульфонилхлорида. Гомогенный раствор перемешивали при этой температуре в течение ночи. Реакцию прекращали добавлением 25 мл воды и избыток пиридина удаляли при пониженном давлении. Остаток растворяли в этилацетате (120 мл) и промывали 1н. HCl (2х50 мл), насыщенным раствором NaHCOg (50 мл) и соляным раствором (50 мл). Органический слой сушили (MgSO4) и упаривали, получая N-третбутоксикарбонил-L-триптофан-(N'-(6-(4'-метилфен-1-ил)сульфонилокси)гексил)амид в виде масла бледно-желтого цвета (5,77 г, 76%), МС: 558,3 (М+Н)+.
Д. К 5-гидрокситриптофану (3,5 г, поставлямый фирмой Sigma), триэтиламину (5,6 мл) в воде (25 мл) и тетрагидрофурану (50 мл) добавляли BOC-ON (2- (третбутоксикарбонилоксиимино) -2-фенилацетонитрил). Через 2,5 часа тетрагидрофуран удаляли, добавляли 10%-ный Na2CO3 (20 мл) и смесь распределяли с помощью простого эфира (50 мл). Водную фракцию далее экстрагировали простым эфиром (20 мл) и затем подкисляли холодной 10%-ной HCl в двухфазной системе, содержащей этилацетат (100 мл). Этилацетатную фракцию отделяли и промывали водой (30 мл), соляным раствором, сушили над безводным MgSO4 и концентрировали, получая сироп. Сироп подвергали взаимодействию с 6-амино-1-гексанолом способом, аналогичным описанному выше в примере 1В, получая N-третбутоксикарбонил-L-(5-гидрокси)триптофан-N'-(6-гидроксигексил)амид. Половину этого продукта растворяли в 40 мл ДМФ и обрабатывали при комнатной температуре в течение ночи К2СО3 (5 г) и йодметаном (1,2 г). Затем реакционную смесь распределяли между водой (50 мл) и этилацетатом (80 мл), органическую фракцию далее промывали водой (2х20 мл), соляным раствором, сушили над безводным MgSO4 и концентрировали, получая масло. Затем продукт, N-третбутоксикарбонил-L-(5-метокси)триптофан-N'-(6-гидроксигексил)амид, очищали с помощью хроматографии на силикагеле;
1Н-ЯМР δ (СDС13): 0,9-1,6 (m, CH2 8H); 1,45 (s, 9H); 2,7-3,3 (m, 5H); 3,6 (t, 2H); 3,85 (s, 3Н); 4,35 (m, 1H); 5,3 (широкий d, 1H); 5,85 (широкий t, 1H); 6,75-8,3 (m,4H); 8,73 (широкий s, 1H).
Е. Аналогичным способом получали следующие соединения:
N-третбутоксикарбонил-L-(5-этокси)триптофан-N'-(6-гидроксигексил)амид;
N-третбутоксикарбонил-L-(5-пропокси)триптофан-N'-(6-гидроксигексил)амид;
N-третбутоксикарбонил-L-(5-этил)триптофан-N'-(6-гидроксигексил)амид; и
N-третбутоксикарбонил-L-(4-метил)триптофан-N'-(6-гидроксигексил)амид.
Пример 3
Соединения формулы (Н)
А. N-третбутоксикарбонил-L-триптофан-(N'-(4'-метилфен-1-ил)сульфонилоксигептил)амид (6,78 г) добавляли порциями к раствору NaH (60%-ный в масле, 1,9 г) в 1,1 литре безводного тетрагидрофурана и оставляли перемешиваться в течение ночи. Реакционную смесь концентрировали и растворяли в воде (150 мл) и СН2Сl2 (150 мл). Водную фазу слегка подкисляли 2,5%-ной HCl (рН 3-4), органическую фазу выделяли (3х150 мл) и промывали последовательно холодной 2,5%-ной HCl (150 мл), 5%-ным NaHCO3 (150 мл) и соляным раствором (150 мл). Органическую фазу сушили (MgSO4), фильтровали и концентрировали, получая полутвердый продукт желто-зеленого цвета. Путем очистки с помощью хроматографии на силикагеле получали (11S)-11-N'-(третбутоксикарбонил)амино-10-оксо-1,9-диaзaтpициклo[11.6.1.014.19] эйкoзa-13(20), 14(19), 15,17-тетраен, tпл 208-209oС, МС: 400 (М+Н)+.
Б. В другом варианте к N-третбутоксикарбонил-L-триптофан-(N'-(6-(4'-метилфен-1-ил)сульфонилокси)гексил)амиду (5 г, 8,97 ммоля) в одном литре безводного ТГФ при 0oС в атмосфере аргона небольшими порциями в течение 10 минут добавляли 4 эквивалента 60%-ного NaH (1,44 г, 36 ммолей). Затем смесь перемешивали в течение ночи при комнатной температуре. Образовавшуюся смесь желтого цвета упаривали до -200 мл и затем добавляли 1 литр дистиллированной воды. Затем смесь подкисляли 1н. HCl при интенсивном перемешивании. Желтый осадок собирали путем фильтрации и сушили над Р2О5 в глубоком вакууме в течение ночи. Сухой неочищенный продукт (8 г) хроматографировали на силикагеле 60, элюировали 30%-ным этилацетатом в CH2Cl2, получая 1,2 г (35%) (10S)-10-N'-(третбутилоксикарбонил)амино-9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13,(18),14,16-тетраена в виде порошка белого цвета, МС: 386 (М+Н)+, tпл 222-223oС.
В. В другом варианте к раствору N-третбутоксикарбонил-L-триптофан-(N'-(6-(4'-метилфен-1-ил)сульфонилокси)гексил)амида (1,21 г, 2,17 ммолей) в 45 мл химически чистого метиленхлорида добавляли 15 мл 40%-ного водного КОН и 0,3 эквивалента бензилтриэтиламмонийхлорида (0,65 ммоля, 148 мг). Двухфазную смесь интенсивно перемешивали при комнатной температуре в течение ночи. Органический слой отделяли и водный слой экстрагировали 25 мл метиленхлорида. Объединенный органический слой промывали водой (25 мл), сушили (MgSO4) и упаривали досуха. Остаток перемешивали в 10%-ном простом эфире в петролейном эфире при 0oС в течение 15 минут и фильтровали, получая 792 мг (93%) (10S)-10-N'-(третбутилоксикарбонил)амино-(9-оксо-1,8-диазатрицикло[10.6.1.013.18]нонадека-12(19),13(18),14,16-тетраена в виде порошка белого цвета.
Пример 4
Соединения формулы (J)
A. (11S)-11-N'-(третбутилоксикарбонил)амино-10-оксо-1,9-диaзaтpициклo[11.6.1.014.19] эйкoзa-13(20),14(19),15,17-тeтpaeн (850 мг) растворяли в 5 мл раствора 10%-ной трифторуксусной кислоты (ТФК) в метиленхлориде и перемешивали в течение 1 часа. Летучие компоненты удаляли при пониженном давлении. Остаток растворяли в СН2Сl2 (40 мл) и 1н. NaOH (40 мл) и переносили в делительную воронку. Органическую фазу выделяли и промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали, получая 654 мг (11S)-11-амино-(10-оксо-1,9-диазатрициклo[11.6.1.014.19] эйкoзa-13(20), 14(19), 15,17-тетраена.
Б. В другом варианте (10S)-10-N'-(третбутилоксикарбонил)амино-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12(19), 13(18), 14,16-тетраен (0,5 ммоля, 193 мг) перемешивали в смеси 20% ТФК/СН2Сl2 (10 мл) при комнатной температуре в течение 2 часов. Избыток ТФК и растворителя удаляли при пониженном давлении. Остаток растворяли в этилацетате (30 мл) и промывали 1н. HCl (25 мл), соляным раствором (10 мл) и сушили (MgSO4). После упаривания досуха получали 140 мг (количественный выход) (10S)-10-aминo-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12(19), 13(18), 14,16-тетраена в виде белой пены, tпл 157-160oС, МС: 286,2 (М+Н)+.
Пример 5
Соединения формулы (Iа)
А. К перемешиваемому раствору, содержащему (11S)-11-амино-(10-оксо-l, 9-диaзaтpициклo[11.6.1.014.19] эйкoзa-13(20), 14(19), 15,17-тетраен (654 мг) и рацемическую 4-метил-2-третбутоксикарбонилметилпентановую кислоту (800 мг) в 30 мл безводного ДМФ, добавляли в атмосфере аргона 1-гидроксибензотриазол (360 мг), а затем ЭДКИ (940 мг). Смесь оставляли перемешиваться в течение ночи и затем удаляли ДМФ при пониженном давлении. Остаток растворяли в смеси, состоящей из CH2Cl2 (100 мл) и 1,5%-ной холодной HCl (100 мл), и переносили в делительную воронку. Органическую фазу выделяли и промывали последовательно 1,5%-ной HCl (100 мл), 5%-ным NaHCO3 (100 мл) и соляным раствором (100 мл). СН2Сl2-фазу сушили (MgSO4), фильтровали и концентрировали, получая полукристаллический продукт, третбутиловый эфир (11S)-5-метил-3-(10-оксо-1,9-диазатрицикло[11.6.1.014.19] эйкоза-13(20), 14(19), 15,17-тетраен-11-илкарбамоил)гексановой кислоты. Два индивидуальных стереоизомера этого соединения разделяли с помощью хроматографии на силикагеле с этилацетатом/гексаном в качестве элюента. Менее полярный стереоизомер имел температуру плавления 154-157oС, [α]
Б. В другом варианте к раствору, содержащему (2R)-4-метил-2-(третбутоксикарбонилметил)пентановую кислоту, полученную по описанной выше методике, (2,39 г, 10,4 ммолей), HOBt•H2O (2,5 г, 1 экв.), N-метилморфолин (2,3 мл, 2 экв.) и (10S)-10- амино-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен (2,96 г, 1 экв.) в безводном ДМФ (200 мл), в атмосфере аргона, добавляли ЭДКИ (3,96 г, 2,0 экв.). Образовавшуюся смесь перемешивали в течение ночи, а затем на следующее утро удаляли ДМФ при 35oС в глубоком вакууме. Остаток распределяли между CH2Cl2 (150 мл)/водой (75 мл), затем органический слой промывали 0,5н. HCl (2х75 мл), насыщенным МаНСО3 (2х75 мл) и в завершение соляным раствором (1х75 мл). После сушки СН2Сl2-слоя над Na2SO4 его фильтровали и упаривали досуха. После очистки с помощью колоночной хроматографии (с использованием от только петролейного эфира до смеси 30% этилацетата/петролейный эфир) получали третбутиловый эфир (3R, 10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18]нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты (3,24 г, 62,7%).
В. Аналогичным способом получали следующие соединения формулы (Iа):
третбутиловый эфир (3R,10S)-4-фенил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты, МС: 532 (М+Н)+;
третбутиловый эфир (3R, 10S)-4-циклогексил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты, МС: 538 (М+Н)+;
третбутиловый эфир (3R,10S)-6-фенил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты, МС: 560 (М+Н)+;
третбутиловый эфир (3R,10S)-3-(9-оксо-1,8-диазатрициклo[10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексановой кислоты, МС: 484 (М+Н)+;
бензиловый эфир (3R, 10S)-2-метоксикарбонил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013.18] нонадека-12, (19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты, МС: 590 (М+Н)+;
третбутиловый эфир (3R, 10S)-4-циклопентил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты;
метиловый эфир (3R, 10S)-4-циклопентил-3-(9-оксо-1,8-диазатрицик- ло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты, МС: 496 (М+Н)+;
третбутиловый эфир (3R, 10S)-4-циклопропил-3-(9-оксо-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты;
этиловый эфир (3R,9S)-4-циклобутил-3-(8-оксо-1,7-диазатрициклo[9.6.1.012,17]oктaдeкa-11(18),12(17),13,15-тeтpaeн-9-илкapбaмoил)бyтaнoвoй кислоты;
этиловый эфир (3R, 9S)-6-пиридин-4-ил-3-(8-оксо-1,7-диазатрицикло[9.6.1.012,17]октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)гексановой кислоты;
этиловый эфир (3R,9S) -5- (4-хлорфенокси) -3- (8-оксо-1,7-диазатрицикло[9.6.1.012,17]октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)пентановой кислоты;
третбутиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты;
этиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты;
изопропиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тeтpaeн-10-илкapбaмoил)гексановой кислоты;
этиловый эфир (3R, 10S)-5-метил-3-(15-фтор-9-оксо-1,8-диазатрициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты;
этиловый эфир (3R, 10S)-4-циклопентил-3-(15-фтор-9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты;
третбутиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты; и
изопропиловый эфир (3R, 10S)-4-циклопентил-3-(15-фтор-9-оксо-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты.
Аналогичным способом получали следующее соединение:
(3R, 10S)-N-бензилокси-N-формил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-, 12(19), 13(18), 14,16-тетраен-10-илкарбамоил) гексиламин.
Г. В альтернативном варианте могут быть получены следующие метиловые эфиры из соответствующих третбутиловых эфиров при условиях, описанных в примере 56:
метиловый эфир (3R,9S-4-циклобутил-3-(8-оксо-1,7-диазатрицикло[9.6.1.012,17]oктaдeкa-11(18),12(17),13,15-тeтpaeн-9-илкapбaмoил)бyтaнoвoй кислоты;
метиловый эфир (3R, 9S-5-(4-хлорфенокси)-3-(8-оксо-1,7-диазатрицикло[9.6.1.012,17]октадека-11(18),12(17),13,15-тетраен-9 илкарбамоил)пентановой кислоты; и
метиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты.
Д. В другом варианте к (2R)-4-метил-2-(третбутоксикарбонилметил)пентановой кислоте (1 г, 4,34 ммоля) в безводном ТГФ (100 мл) при -78oС в атмосфере аргона добавляли по каплям NaN (тетраметилсилан)2 (1,0 М в ТГФ, 10,9 мл, 2,5 экв.) и смесь перемешивали в течение 1 часа. Добавляли йодметан (0,33 мл, 1,2 экв.) и образовавшуюся смесь перемешивали в течение ночи при температуре от -78oС до комнатной. На следующий день реакцию прекращали добавлением воды (100 мл). После экстракции простым эфиром (3х100 мл) водный слой объединяли с этилацетатным и при перемешивании добавляли 4н. HCl до рН 2. Также добавляли до насыщения хлорид натрия и водный слой экстрагировали этилацетатом (3х100 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали, получая (2R)-4-метил-2-((1-метил-1-третбутоксикарбо-нил) метил)пентановую кислоту в виде масла темно-коричневого цвета (1 г). К этому неочищенному продукту реакции (500 мг) и (10S)-10-амино-(9-оксо-1,8-диазатрицикло[10.6.1.013,18]нонадека-12(19), 13(18), 14,16-тетраен (399 мг, 0,7 экв. ) в безводном ДМФ при 0oС в атмосфере аргона добавляли ГОБТ.Н/) (1,1 экв. , 234 мг), а затем ЭДКИ (663 мг, 2,5 экв). Образовавшуюся смесь перемешивали в течение ночи при температуре от 0oС до комнатной. Большую часть ДМФ удаляли с помощью перегонки под вакуумом при 65oС. Затем остаток распределяли между CH2Cl2 (150 мл). После промывки 0,5н. HCl (2х75 мл), насыщенным NаНСО3 (2х75 мл) и соляным раствором (1х75 мл) органический слой сушили над Na2SO4, фильтровали и упаривали досуха. Неочищенный продукт очищали с помощью быстрой колоночной хроматографии на кремнеземе, элюируя 30%-ным этилацетатом в петролейном эфире с получением смеси трех соединений, двух индивидуальных стереоизомеров: третбутилового эфира (3R,10S)-2-метил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты и третбутилового эфира (3R, 105)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты. Дальнейшей очисткой разделяли три соединения; третбутиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты (13 мг) в виде белого твердого вещества; смесь 1: 1 стереоизомеров (5 мг) в виде белого твердого вещества и менее полярный стереоизомер третбутилового эфира (3R,10S)-2-метил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] 12(19), 13(18), 14,16-тетраен-10- илкарбамоил)гексановой кислоты (15 мг); 1Н ЯМР в СDС13, 300 МГц (менее полярный диастереомер): δ (-0,2)-(-0,05) (m, 1Н); 0,5-0,7 (m, 1Н); 0,9 (dd, J= 4 Гц, J=6,7 Гц, 6Н); 1,15 (d, J=8,4 Гц, 3Н); 1,18-1,4 (m, 3Н); 1,41 (s, 9H); 1,45-1,73 (m, 4H); 1,75-1,8 (m, 2H); 2,5-2,7 (m, 3H); 2,89 (dd, J=10,9 Гц, J= 15 Гц, 1H); 3,34-3,5 (m, 2H); 3,95-4,1 (m, 1H); 4,25-4,4 (m. 1H); 4,72-4,82 (m, 1H); 5,22-5,3 (m, 1H); 6,52 (d. J=7,5 Гц, 1H); 6,91 (s, 1H); 7,13 (dd, J= 6,7 Гц, J=8,4 Гц, 1H); 7,22 (dd, J=5 Гц, J=7,1 Гц, 1H); 7,34 (d, J= 8,4 Гц, 1Н); 7,84 (d, J=8,4 Гц, 1H).
Пример 6
Соединения формулы (Ib)
А. К менее полярному стереоизомеру третбутилового эфира (11S)-5-мeтил-3-(10-oкco-l, 9-диaзaтpициклo[11.6.1.014.19] эйкoзa-13(20), 14(19), 15,17- тетраен-11-илкарбамоил)гексановой кислоты (300 мг) добавляли 5 мл раствора, содержащего смесь 10% трифторуксусной кислоты/метиленхлорид, и перемешивали. Через 2,5 часа хроматография в тонком слое (ТСХ) показала, что реакция закончена. Все летучие компоненты удаляли при пониженном давлении. Остаток растворяли в CH2Cl2 (40 мл), переносили в делительную воронку и последовательно промывали 0,5%-ной HCl (40 мл) и соляным раствором (40 мл). Органическую фазу сушили (MgSO4), фильтровали и концентрировали, получая менее полярный стереоизомер (11S)-5-метил-3-(10-oкco-1,9-диaзaтpициклo[11.6.1.014,19]эйкoзa-13(20),14(19),15,17-тeтpaeн-11-илкарбамоил)гексановой кислоты.
Б. Аналогичным способом более полярный стереоизомер третбутилового эфира (11S)-5-метил-3-(10-оксо-1,9-диазатрицикло[11.6.1.014,19] эйкоза-13(20), 14(19),15,17-тетраен-11-илкарбамоил)гексановой кислоты подвергали гидролизу, получая более полярный стереоизомер (11S)-5-метил-3-(10-оксо-1,9-диaзaтpициклo[11.6.1.014,19] эйкoзa-13(20), 14(19), 15,17-тетраен-11-илкарбамоил)гексановой кислоты.
В. В другом варианте третбутиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты (3,24 г, 6,5 ммоля) растворяли в 95%-ной ТФК (водной) (30 мл) при 0oС и затем перемешивали в течение 20 минут.
Затем удаляли ледяную баню и смесь перемешивали еще один час. После концентрирования до получения масла остаток растворяли в этилацетате (250 мл) и промывали водой (7х150 мл). Органический слой сушили над Na2SO4, фильтровали и упаривали досуха, получая отдельный стереоизомер (3R,10S)-5-метил-3-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты в виде белого порошка, 2,83 г (выход: 98,4%); МС: 442 (М+Н)+.
Г. Аналогичным способом, но заменяя третбутиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19),13(18)14,16-тетраен-10-илкарбамоил)гексановой кислоты на соответствующее соединение формулы (Iа), получали следующие соединения формулы (Ib):
(3R, 10S)-4-фенил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановую кислоту, МС: 474 (М-Н)-;
(3R, 10S)-4-циклoгeкcил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18]нoнa-дека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановую кислоту, МС: 482 (М+Н)+;
(3R,10S)-3-циклогексил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18]нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)пропановую кислоту, МС: 468 (M+H)+;
(3R, 10S)-6-фенил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:502 (М- Н)-;
(3R, 10S)-3-(9-oкco-1,8-диaзaтpициклo[10.6. l. 013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:426 (М-Н)-;
(3R,10S)-2-aминo-5-мeтил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18]нoнадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС: 457 (М+Н)+;
(3R, 10S)-2-гидрокси-5-метил-3-(9-оксо-1,8-диазатрициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС: 458 (М+Н) +;
(3R,10S)-2-аминометил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-5-метил-3-(15-метокси-9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12,(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-2-метил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-2-карбокси-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 9S)-5-метил-3-(8-оксо-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)гексановую кислоту;
(3R, 10S)-4-циклопентил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)бутановую кислоту, МС: 509;
(3R,10S)-3-циклопентил-3-(9-оксо-1,8-диазатрициклo[10.6.1.013,18]нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил)пропионовую кислоту, МС: 454;
(3R,10S)-3-циклопропил-3-(9-оксо-1,8-диазатрициклo[10.6.1.013,18]нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил)бутановую кислоту, МС: 439;
(3R, 10S)-6-(бифенил-4-ил)-3-(9-оксо-1,8-диазатрициклo[10.6.1.013,18]нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС: 579; и
(3R, 10S)-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)-5-(тиофен-2-ил)пентановую кислоту, МС: 496,3 (М+Н)+.
Аналогичным образом получали:
(3R, 10S)-4-циклопропил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил)бутановую кислоту;
(3R, 9S)-4-циклобутил-3-(8-оксо-1,7-диазатрициклo[9.6.1.012,17] oктaдeкa-11(18),12(17),13,15-тeтpaeн-9-илкapбaмoил)бyтaнoвyю кислоту;
(3R, 9S)-4-(3-метокси-4,5(RS)-дигидроизоксазол-5-ил)-3-(8-оксо-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)бутановую кислоту;
(3R, 9S)-4-(3-гидрокси-4,5(РЗ)-дигидроизоксазол-5-ил)-3-(8-оксо-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12(17),13,15-тетраен-9-илкарбамоил)бутановую кислоту;
(3R, 9S)-4-(3-бром-4,5(RS)-дигидроизоксазол-5-ил)-3-(8-оксо-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12(17), 13,15-тетраен-9-илкарбамоил)бутановую кислоту;
(3R, 9S)-5-(4-xлopфeнoкcи)-3-(8-oкco-l, 7-диaзaтpициклo [9.6.1.012'17] oктадека-11(18),12(17), 13,15-тетраен-9-илкарбамоил)пентановую кислоту;
(3R, 9S)-5-метокси-3-(8-оксо-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)пентановую кислоту;
(3R, 9S)-6-мeтoкcи-3-(8-oкco-l, 7-диaзaтpициклo[9.6.1.012,17]oктaдeкa-15 11(18),12(17),13,15-тетраен-9-илкарбамоил)гексановую кислоту;
(3R, 9S)-7-фeнил-3-(8-oкco-l, 7-диaзaтpициклo[9.6. l. 012,17] oктaдeкa-11(18),12(17),13,15-тетраен-9-илкарбамоил)гептановую кислоту;
(3R, 10S)-3-(15-фтор-9-оксо-1,8-диазатрицикло [10.6.1.0]нонадека-11(19), 12(18),14,16-тетраен-10-илкарбамоил)-5-метилгексановую кислоту;
(3R, 10S)-фенил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-11(19),12(18),14,16-тетраен-10-илкарбамоил)пентановую кислоту;
(3R, 10S)-3-циклогексил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-11(19),12(18),14,16-тетраен-10-ил)сукцинамовую кислоту;
(3R, 10S)-3-циклопентил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-11(19),12(18),14,16-тетраен-10-ил)сукцинамовую кислоту;
(3R,10S)-3-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-11(19),12(18), 14,16-тетраен-10-илкарбамоил)-5-метилгекс-5-еновую кислоту;
(3R, 10S)-2(R)-aминoмeтил-3-(9-oкco-1,8-диaзaтpициклo[10.6. l.013,18]нoнадека-11(19), 12(18), 14,16-тетраен-10-илкарбамоил)-5-метилгексановую кислоту;
(3R,10S)-3-(15-бензилокси-9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека- 11(19),12(18),14,16-тетраен-10-илкарбамоил)-5-метилгексановую кислоту;
(3R 10S)-3-(15-гидрокси-9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-11(19),12(18),14,16-тетраен-10-илкарбамоил)-5-метилгексановую кислоту;
(3R, 10S)-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-11(19), 12(18),14,16-тетраен-10-илкарбамоил)октановую кислоту;
(3R, 10S)-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-11(19), 12(18),14,16-тетраен-10-илкарбамоил)-7-гидроксигептановую кислоту;
(3R,10S)-3-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-11(19),12(18), 14,16-тетраен-10-илкарбамоил)-7-бензилоксигептановую кислоту;
(3R,10S)-4-(3-тиофенил)-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-11(19),12(18),14,16-тетраен-10-илкарбамоил)бутановую кислоту;
(3R, 10S)-6-трифторметил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,8]нонадека-11(19),12(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R,10S)-5-(2-тиофенил)-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нoнадека-11(19),12(18),14,16-тетраен-10-илкарбамоил)пентановую кислоту;
(3R, 10S)-7-(4-бифенилокси)-3-(9-оксо-1,8 -диазатрицикло [10.6.1.013,18] нонадека-11 (19), 12(18), 14,16-тетраен-10-илкарбамоил)гептановую кислоту;
(3R, 10S)-7-фeнoкcи-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18]нoнaдeкa-11(19),12(18),14,16-тетраен-10-илкарбамоил)гептановую кислоту;
(3R, 10S) (3-фуранил)-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-11(19), 12(18), 14,16-тетраен-10-илкарбамоил)бутановую кислоту;
(3R, 10S)-6-(3-пиридил)-3-(9-оксо-1,8-диазатрицикло110.6.1.013,18] нонадека-11(19), 12(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-6-(3-пиридил)-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-11(19),12(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R,10S)-3-(4-фенилимидазол-1-ил)-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-11(19), 12(18), 14,16-тетраен-10-ил) янтарную кислоту;
(3R, 10S)-4-циклобутил-3-(9-oксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-11(19),12(18),14,16-тетраен-10-илкарбамоил)бутановую кислоту; и
(3R, 10S)-4-бензилокси-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-11(19),12(18),14,16-тетраен-10-илкарбамоил)бутановую кислоту.
Д. (3R, 10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18]нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту (183 мг)растворяли в 40 мл безводного CH2Cl2 и при 0oС добавляли этанол (0,5 мл, 5 экв. ), а затем N,N-диметиламинопиридин (0,1 экв., 5 мг) и в завершение ЭДКИ (209 мг, 5 экв.). Образовавшийся раствор перемешивали в течение ночи при температуре от 0oС до комнатной. Дополнительно добавляли СН2Сl2 (100 мл) и смесь промывали 0,5н. HCl (2х50 мл), насыщенным NаНСО3 (2х50 мл) и окончательно соляным раствором (1х50 мл). Органический слой сушили над Na2SO4, фильтровали и упаривали досуха. После перекристаллизации из этилацетата и петролейного эфира получали этиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты в виде белого твердого вещества (выход: 108 мг, 55%), МС:470 (М+Н)+.
Аналогичным образом получали:
этиловый эфир (3R, 10S)-4-циклопентил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановой кислоты; МС:496 (М+Н) +;
диэтилкарбамоилметиловый эфир (3R,9S)-5-(4-хлорфенокси)-3-(8-оксо-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18), 12(17),13,15-тетраен-9-илкарбамоил)пентановой кислоты;
индан-5-иловый эфир (3R, 10S)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты;
морфолинилэтиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-25 диaзaтpициклo[10.6.1.013, 18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты;
1-метил-4-пиперидиниловый эфир (3R, 10S)-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексановой кислоты, МС: 539,51 (M+S+); и
1-метил-3-пиперидинилметиловый эфир (3R,10S)-5-метил-3-(9-оксо-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексановой кислоты.
Е. В другом варианте менее полярный стереоизомер третбутилового эфира (3R, 10S)-2-метил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты (15 мг), полученного согласно описанной выше в примере 5Г методике, растворяли в CH2Cl2 (2,4 мл) и ТФК (0,6 мл) и образовавшуюся смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель удаляли при пониженном давлении при 35oС. Затем добавляли этилацетат и раствор промывали водой (3х10 мл). Органический слой сушили над Nа2SO4, фильтровали и упаривали досуха. После перекристаллизации из этилацетата/петролейного эфира получали (3R, 10S)-2-метил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19),13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту в виде белого твердого вещества (7 мг), МС: 456,3 (М+Н)+.
Ж. Аналогичным способом смесь 1:1 стереоизомеров третбутилового эфира (3R, 10S)-2-метил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты (5 мг) (полученную согласно приведенному выше примеру 5Г) гидролизовали, получая 3 мг белого твердого вещества; 1Н ЯМР в СDСl3, 300 МГц: δ (-0,5)-(-0,3) (m, 1Н); 0,6-0,8 (m, 1Н); 0,8-1,05 (m, 6Н); 1,05-1,22 (m, 2Н); 1,35(3Н, dd, J=9 Гц); 1,4-1,7 (m, 3Н); 1,7-1,95 (m, 3Н); 2,3-2,48 (m, 1Н); 2,54-2,73 (m, 1Н); 2,8-3,0 (m, 2Н); 3,38-3,5 (,m, 1Н); 3,52-3,72 (m, 1Н); 3,8-3,98 (m, 1Н); 4,34-4,45 (m, 1Н); 4,7-4,84 (m, 1Н); 5,0-5,08 (m, 1Н); 6,8 (d, 1Н); 7,15-7,25 (m, 1Н); 7,25-7,32 (m, 1Н); 7,35 (d, J=8,4 Гц, 1Н); 7,88(d, J=8,4 Гц).
З. В другом варианте бензиловый эфир (3R,10S)-2-метоксикарбонил-5-мeтил-3-(9-oкco-1,8-диазатpициклo[10.6.1.013,18] нoнaдека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты растворяли в этаноле (35 мл, требовалось некоторое нагревание) и добавляли формиат аммония (1642 мг, 3 экв. ), а затем добавляли 10%-ный Pd на активированном угле (100 мг). После перемешивания в атмосфере аргона при комнатной температуре в течение 3 часов реакция была завершена. Смесь фильтровали вакуум-фильтрацией через слой целита (1 см), затем концентрировали, добавляли МеОН и полученный продукт фильтровали через ватную пробку. После концентрирования к остатку добавляли CH2Cl2 и полученный продукт интенсивно перемешивали и затем фильтровали. Фильтрат концентрировали и перекристаллизовывали из этилацетата/петролейного эфира, получая (3R, 10S)-2-метоксикарбонил-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту в виде белого твердого вещества (выход: 140 мг), МС: 500,3 (М+Н)+.
И. (3R, 10S)-2-метоксикарбонил-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18]12(19) нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил) гексановую кислоту растворяли в этаноле (25 мл) и затем добавляли по каплям 1н. LiOH (0,3 мл, 3 экв.). Образовавшийся гомогенный раствор перемешивали при комнатной температуре в течение 3 часов. Большую часть этанола удаляли при пониженном давлении и при 30oС. Затем при перемешивании добавляли воду (5 мл) и этилацетат (30 мл), а также добавляли 4н. НСl до получения значения рН 2. Затем этилацетатный слой промывали соляным раствором, сушили над Na2SO4, фильтровали и упаривали досуха. Очисткой с помощью ЖХВР с обращенной фазой получили 47 мг (3R,10S)-2-1 карбокси-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты в виде белого твердого вещества, МС: 484,5 (М-Н)-.
Пример 7
А. Смесь дибензилфумарата (5,3 г, 0,018 моля) и 4-бифенил-4-ил-1Н-имидазола (3,94 г, 0,018 моля) выдерживали при температуре 110-115oС в течение 4 часов. Затем смесь растворяли в простом эфире и промывали 0,05%-ной HCl, 0,01н. NaOH и соляным раствором и сушили. После удаления эфира полученный неочищенный продукт очищали с помощью колоночной хроматографии (60%-ный EtOAc/гексан), получая 5,75 г дибензилового эфира 2-(4-бифенил-4-илимидазол-1-ил)янтарной кислоты, МС: 517,3 (М+Н)+.
Аналогичным образом получали следующие соединения:
дибензиловый эфир 2-(4-фенилимидазол-1-ил) янтарной кислоты;
дибензиловый эфир 2-(4-(4-метоксифенил)имидазол-1-ил)янтарной кислоты; и
дибензиловый эфир 2-(4-(4-феноксифенил)имидазол-1-ил)янтарной кислоты.
Б. Суспензию дибензилового эфира 2-(4-бифенил-4-илимидазол-1-ил) янтарной кислоты (551 мг) в 10 мл Н2О кипятили с обратным холодильником в течение ночи и охлаждали до комнатной температуры. Водный слой удаляли и оставшиеся твердые продукты сушили на лиофилизаторе, получая 4-бензиловый эфир 2-(4-бифенил-4-илимидазол-1-ил)янтарной кислоты (437 мг), МС: 426 (М+).
Аналогичным образом получали следующие соединения:
4-бензиловый эфир 2-(4-фенилимидазол-1-ил)янтарной кислоты;
4-бензиловый эфир 2-(4-(4-метоксифенил)имидазол-1-ил)янтарной кислоты; и
4-бензиловый эфир 2-(4-(4-феноксифенил)имидазол-1-ил)янтарной кислоты.
В. Смесь 4-бензилового эфира 2-(4-бифенил-4-илимидазол-1-ил)янтарной кислоты (450 мг, 1,05 ммоля), (10S)-10-амино-9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраена (284 мг, 0,95 ммоля), ЭДКИ (302 мг, 1,5 ммоля), ГОБТ (142 мг, 1,05 ммоля), N-метилморфолина (0,14 мл) и ДМАП (50 мг) в ДМФ (10 мл) перемешивали при комнатной температуре в течение ночи. Раствор разбавляли 100 мл EtOAc, промывали соляным раствором и насыщенным NaHCO3 и сушили. Неочищенный продукт, полученный после удаления растворителей, очищали с помощью колоночной хроматографии, получая бензиловый эфир (3RS,10S)-3-(4-бифенил-4-илимидазол-1-ил)-N-(9-оксо-1,8-диазатрицикло[10.6.1.013,1] нонадека-12(19), 13(18), 14,16-тетраен-10-илсукцинамовой кислоты.
Аналогичным образом получали следующие соединения:
бензиловый эфир (3RS, 10S)-3-(4-фенилимидазол-1-ил)-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илсукцинамовой кислоты;
бензиловый эфир (3RS,10S)-3-(4-(4-метоксифенил)имидазол-1-ил)-N-(9-oкco-l, 8-диaзaтpициклo[10.6. l. 013,18]нoнaдeкa-12(19),13(18),14,16-тeтpaeн-10-илсукцинамовой кислоты; и
бензиловый эфир (3RS,10S)-3-(4-(4-феноксифенил)имидазол-1-ил)-N-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илсукцинамовой кислоты.
Г. Раствор бензилового эфира (3RS,10S)-3-(4-бифенил-4-илимидазол-1-ил)-N-(9-oкco-1,8-диaзaтpициклo[10.6. l. 013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илсукцинамовой кислоты (190 мг) в ТГФ/ЕtOН (5/1, 20 мл) гидрировали с 10%-ным Pd/C (170 мг) в течение 8 часов, пока ТСХ не показала, что исходное соединение прореагировало. Раствор фильтровали через подушку из целита. Фильтрат упаривали и перекристаллизовывали (ТГФ/ЕtOАс), получая 147 мг (3RS, 10S)-3-(4-бифенил-4-илимидазол-1-ил)-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илсукцинамовой кислоты, tпл:222-226oС, МС: 604,2 (М+Н) +.
Аналогичным образом получали следующие соединения:
(3RS,10S)-3-(4-фенилимидазол-1-ил)-N(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18) 14,16-тетраен-10-илсукцинамовую кислоту, tпл: 184-187oС, МС: 528,3 (М+Н)+;
(3RS, 10S)-3-(4-(4-метоксифенил)имидазол-1-ил)-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илсукцинамовую кислоту tпл: 186-190oС, МС: 558,3 (М+Н)+;
(3RS, 10S)-3-(4-(4-феноксифенил)имидазол-1-ил)-N-(9-оксо-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19),13(18),14,16-тетраен-10-илсукцинамовую кислоту, МС: 620,12 (М+Н)+; и
(3RS,10S)-3-(3-фенилпиразол-1-ил)-N-(9-оксо-1,8-диазатрицик-ло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илсукцинамовую кислоту, МС: 568,4 (М+Н)+.
Пример 8
А. Карбоновые кислоты, полученные в соответствии с примером 6, кроме того, могут быть превращены в соответствующие амиды путем взаимодействия кислот с соответствующими аминами в присутствии агентов сочетания, таких, как ЭДКИ и ГОБТ. Эти методы хорошо известны специалистам в данной области техники.
В соответствии с этим получали следующие соединения:
(3RS, 10S)-3(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-иикарбамоил)-5-метилгексанамид; и
(3RS, 10S)-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-иикарбамоил)-5-метил-N-(N,N-диметиламино-5 этил)гексанамид, МС: 512,49 (М+Н)+.
Б. В соответствии с методом, описанным в патенте США 4412994, получали следующее соединение:
(3RS, 10S)-3(9--оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-иикарбамоил)-5-метил-N-гидрокси-N- морфолинметилгексанамид.
Пример 9
Соединения формулы (Iс)
А. Раствор менее полярного стереоизомера (11S)-5-метил-3-(10-оксо-1,9-диaзaтpициклo[11.6.1.014,19] эйкoзa-13(20), 14(19), 15,17-тетраен-11-илкарбамоил) гексановой кислоты (210 мг) и моногидрата 5-гидроксибензотриазола (109 мг) в безводном ДМФ (20 мл) охлаждали в атмосфере аргона до 0oС (в ледяной бане). К этой смеси добавляли ЭДКИ (282 мг) и перемешивание продолжали в течение 0,5 ч. Затем к раствору добавляли O-бензилгидроксиламин (0,27 мл) и реакционной смеси давали нагреться до комнатной температуры в течение ночи. Все летучие компоненты удаляли при пониженном давлении. Остаток растворяли в СН2Сl2 (100 мл) и 20%-ной НСl (100 мл) и переносили в делительную воронку. Органическую фазу выделяли и водную фазу промывали CH2Cl2 (2х100 мл). Органические продукты затем промывали последовательно 5%-ным NaHCO3, соляным раствором, сушили (MgSO4), фильтровали и концентрировали, получая (11S)-N-бензилокси-5-мeтил-3-(10-oкco-1,9-диaзaтpициклo[11.6.1.014,19] эйкoзa-13(20), 14(19), 15,17-тетраен-11-илкарбамоил)гексанамид в виде кристаллического вещества. Продукт далее очищали с помощью колоночной хроматографии с силикагелем с последующей кристаллизацией из горячей смеси этилацетат/СН2Сl2, получая более полярный стереоизомер соединения с температурой плавления 232-233oС и менее полярный стереоизомер соединения с температурой плавления 251-253oС.
Б. В другом варианте к раствору, содержащему (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту (2,5 г, 5,82 ммоля), ГОБТ•Н2О (0,89 г, 1 экв. ) и O-бензилгидроксиламин (2,2 мл, 3 экв.) в ДМФ (200 мл), при 0oС добавляли ЭДКИ (2,77 г, 2,5 экв.). Образовавшуюся смесь затем перемешивали в течение ночи. ДМФ удаляли перегонкой под вакуумом при 65oС. К остатку затем добавляли метанол (14 мл) и далее простой эфир (140 мл). При 0oС и при перемешивании добавляли 0,5н. HCl (140 мл), а затем петролейный эфир (140 мл). Смесь перемешивали при 0oС в течение 15 минут, затем белое твердое вещество фильтровали вакуум-фильтрацией и последовательно промывали водой (100 мл), а затем смесью 1:1 простой эфир/петролейный эфир (100 мл). После сушки под вакуумом (Р2О5) в течение 3 часов получали (3R,10S)-N-бензилокси-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексанамид в виде белого твердого вещества (2,7 г, 84,9%).
В. Аналогичным способом, но заменяя (3R,10S)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту на соответствующее замещенное соединение формулы (Ib), получали следующие соединения формулы (Iс):
(3R, 10S)-N-бензилокси-2-метоксикарбонил-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексанамид, МС: 605,3 (М+Н)+;
(3R,10S)-N-бензилокси-6-фенил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил) гексанамид, МС: 609 (М+Н)+;
(3R, 10S)-N-бензилокси-3-(9-оксо-1,8-диазатрицикло [10.6.1.013'18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексанамид, МС: 533 (М+Н)+.
Г. Аналогичным способом, но заменяя O-бензилгидроксиламин на 2-диметиламиноэтиламин или на 1-метил-4-гидроксипиперидин, получали следующие производные соединения формулы (I):
1-(2-диметиламиноэтил)амид (3R,10S)-5-метил-3-(9-oкco-l,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановой кислоты, МС: 512,49 (М+Н)+; и
1-метилпиперидин-4-иловый эфир (3R, 10S)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановой кислоты, МС:539,51 (М+Н)+.
Пример 10
Получение соединений формулы (Id)
А. К раствору более полярного стереоизомера (11S)-N-бензилокси-5-мeтил-3-(10-oкco-l, 9-диaзaтpициклo[11.6.1.014,19]эйкoзa-13(20),14(19),15,17-тетраен-11-илкарбамоил) гексанамида (90 мг) в смеси этанол/тетрагидрофуран (350 мл; 2:1) добавляли 10%-ный паладий на угле (30 мг). Смесь перемешивали, пропуская через нее постоянный барботирующий поток газообразного водорода. Через 3 часа ТСХ (10% СН3ОН/СН2Сl2) показала, что реакция завершена. Продукт трижды фильтровали через слой целита и концентрировали при пониженном давлении до получения почти сухого остатка. Добавляли метиленхлорид (15 мл) и продукт вновь концентрировали при пониженном давлении до получения почти сухого остатка и затем повторяли процедуру вновь. К остатку добавляли 3-4 капли метанола, а затем добавляли метиленхлорид (15 мл). Продукт перемешивали при охлаждении (ледяная баня) и добавляли простой эфир (5 мл), а затем гексан (2 мл). Медленно образующийся кристаллический материал собирали путем фильтрации, получая 50 мг более полярного стереоизомера (11S)-N-гидрокси-5-метил-3-(10-оксо-1,9-диазатрицикло [11.6.1.014,19] эйкоза-13(20), 14(19), 15,17-тетраен-11-илкарбамоил)гексанамида с температурой плавления 197-201oС,
[α]
Б. Аналогичным способом, но заменяя более полярный стереоизомер (11S)-N-бензилокси-5-метил-3-(10-оксо-1,9-диазатрицикло[11.6.1.0 14,19] эйкоза-13(20), 14(19), 15,17-тетраен-11-илкарбамоил)гексанамида менее полярным, получали менее полярный стереоизомер (11S)-N-гидрокси-5-метил-3-(10-oкco-l, 9-диaзaтpициклo[11.6.1.014,19] эйкoзa-13(20), 14(19), 15,17-тетраен-11-илкарбамоил)гексанамида, tпл 212-216oС, [α]
В. В другом варианте (3R,10S)-N-бензилокси-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексанамид (1,0 г, 1,83 ммоля) растворяли в 20%-ном растворе ТГФ в этаноле (500 мл) и затем порциям добавляли Pd на активированном угле (200 мг). Образовавшуюся суспензию перемешивали, пропуская через раствор слегка барботирующий его газообразный Н2. Через 4 часа реакционную смесь фильтровали вакуумо-фильтраций через слой целита (1,5 см), фильтрат концентрировали и затем растворяли в метаноле (30 мл) и фильтровали через ватную пробку. После перекристаллизации из смеси метанол/этилацетат/эфир/петролейный эфир получали (3R, 10S)-N-гидрокси-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексанамид (768 мг, 92%), МС: 455(М-Н)+.
Г. Аналогичным способом, но заменяя (3R,10S)-N-бензилокси-5-метил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18]нoнaдeкa-12(19),13(18),14,16-тeтpaeн-10-илкарбамоил)гексанамид на соответствующее соединение формулы (Iс), получали следующие соединения формулы (Id):
(3R, 10S)-N-гидрокси-2-метоксикарбонил-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексанамид, МС:515(М+Н)+;
(3R, 10S)-N-гидрокси-6-фенил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексанамид, МС:517(М-Н)-;
(3R, 10S)-N-гидрокси-2-аминокарбонил-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексанамид, МС:483(МН)+-Н2О;
(3R,10S)-N-гидрокси-3-(9-оксо-1,8-диазатрициклo[10.6.1.013'18] нoнaдeкa- 12(19),13(18),14,16-тетраен-10-илкарбамоил)гексанамид, МС: 443 (МН+);
(3R, 9S)-N-гидрокси-5-метил-3-(8-оксо-1,7-диазатрициклo [9.6.1.012,17] oктaдeкa-11(18),12(17),13,15-тeтpaeн-9-илкapбaмoил)гeкcaнaмид;
(2S, 3R, 9S)-N-гидрокси-2-гидрокси-5-метил-3-(8-оксо-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил)гексанамид;
(3RS, 10S)-N-гидрокси-N-формил-5-метил-3-(9-оксо-1,8-диазатрициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексиламин, МС: 455 (М-Н)-;
(3R,9S)-N-гидрокси-6-пиридин-4-ил-3-(8-оксо-1,7-диазатрициклo [9.6.1.012'17]oктaдeкa-11(18),12(17),13,15-тeтpaeн-9-илкapбaмoил)гeкcaнaмид;
(3R,9S)-N-гидрокси-2-гидрокси-5-метил(8-оксо-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18),12(17),13,15-тетраен-9-илкарбамоил) гексанамид;
(3R, 10S)-N-гидрокси-5-метил-3-(15-метокси-9-оксо-1,8-диазатрициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тeтpaeн-10-илкapбaмoил)гексанамид;
(3R, 10S)-N-гидрокси-2-ацетил-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил) гексанамид;
(3R, 10S)-N-гидрокси-6-фенил-3-(9-оксо-1,8-диазатрицик-лo[10.6.l.013,18] нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил) гексанамид;
(3R, 10S)-N-гидpoкcи-3-(9-oкco-1,8-диaзaтpициклo [10.6.1.013,18] нoнaдeка-12(19),13(18),14,16-тетраен-10-илкарбамоил) гексанамид;
(3R, 10S)-N-гидрокси-5-фенил-3-(9-оксо-1,8-диазатрициклo[10.6.1.013,18] нoнaдeкa-12(19),13(18),14,16-тeтpaeн-10-илкapбaмoил)пентанамид;
(3S, 10R)-N-гидрокси-5-метил-3-(9-оксо-1,8-диазатрициклo [10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил) гексанамид;
(3R,10RS)-N-гидрокси-5-метил-3-(9-оксо-1,8-диазатрициклo [10.6.l.013,18] нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил) гексанамид;
(3R, 10RS)-N-гидрокси-5-метил-3-(15-фтор-9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексанамид; и
(3R, 10S)-N-гидрокси-2-аминокарбонил-5-метил-3-(15-фтор-9-оксо-1,8-5 диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил) гексанамид.
Пример 11
Соединения формулы (Iе)
А. К раствору, содержащему 4-метил-2-ацетилтиометилпентановую кислоту (612 мг, 3 ммоля), (10S)-10-амино-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен (427 мг, 1,5 ммоля) и ГОБТ•Н2О, (230 мг, 1,5 ммоля) в безводном ДМФ (30 мл), в атмосфере аргона при комнатной температуре в виде одной порции добавляли ЭДКИ (863 мг, 4,5 ммоля). После перемешивания в течение ночи ДМФ удаляли при 30oС в глубоком вакууме, получая желтоватое полутвердое вещество. Его растворяли в этилацетате (50 мл), промывали 1н. HCl (30 мл), 5%-ным раствором NаНСО3 (30 мл) и в завершение соляным раствором (30 мл). Органический слой сушили (MgSO4) и упаривали досуха. Образовавшееся масло светло-желтого цвета перемешивали в 50%-ном простом эфире-петролейном эфире (40 мл), получая 600 мг (85%) (10S)-2-ацетилтиометил-4-метил-N-(9-оксо-1,8-диазатрицикло [10.6. 1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-ил)пентанамида в виде смеси стереоизомеров 1: 1. Смесь стереоизомеров разделяли с помощью быстрой колоночной хроматографии (типа LPS-2), элюируя 20%-ным этилацетатом в петролейном эфире с получением менее полярного стереоизомера с tпл 226oС и более полярного стереоизомера с tпл 220oС.
Пример 12
Соединения формулы (If)
А. К раствору менее полярного стереоизомера (10S)-2-ацетилтиометил-4-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18), 14,16-тетраен-10-ил)пентанамида (50 мг, 0,106 ммоля) в 10 мл метанола при 0oС в атмосфере аргона добавляли 0,5 мл концентрированного NН4ОН. Реакционную смесь перемешивали при температуре от 0oС (ледяную баню удаляли после добавления NH4OH) до комнатной температуры и далее выдерживали при комнатной температуре в течение 1 часа. Избыток метанола удаляли при пониженном давлении, получая белый твердый остаток. Остаток распределяли между этилацетатом (30 мл) и 0,1н. HCl (15 мл). Органический слой промывали соляным раствором (15 мл), сушили (MgSO4) и упаривали досуха. Твердый остаток перемешивали в смеси 50% простого эфира/петролейный эфир и фильтровали, получая более полярный стереоизомер (10S)-2-меркаптометил-4-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-ил)пентанамида в виде белого порошка, 41 мг (90%), tпл 224oC.
Пример 13
Соединения формулы (НН)
А. К 4-метилпентановой кислоте (25 г, 0,215 ммоля) медленно добавляли в водяной бане при 25oС тионилхлорид (20,4 мл, 1,3 г). Затем смесь выдерживали при 50oС в атмосфере аргона в течение 3 часов (до тех пор, пока не прекращалось выделение газа). Неочищенную реакционную смесь перегоняли при атмосферном давлении, получая 4-метилпентаноилхлорид (25,3 г, 87,3%), tкип 143oС.
Б. Аналогичным способом, но заменяя 4-метилпентановую кислоту на 5-фенилпентановую кислоту (5 г), получали 5-фенилпентаноилхлорид (4,4 г) в виде бесцветной жидкости, tкип 91-93oС.
Пример 14
Соединения формулы (N)
А. К суспензии 60%-ного NaH (836 мг, 1,5 экв.) в толуоле (200 мл) при комнатной температуре в атмосфере аргона добавляли по частям сультам L-(+)-2,10-камфоры (3,0 г, 3,9 ммоля). Смесь интенсивно перемешивали при комнатной температуре в течение одного часа. Затем к раствору осторожно по каплям при 0oС добавляли 4-метилпентаноилхлорид. После перемешивания реакционной смеси при комнатной температуре в течение 3 часов реакцию прекращали с помощью 10 мл воды и добавляли 70 мл простого эфира. Реакционную смесь сначала промывали 0,5н. НСl (2х50 мл), затем 5%-ным К2СО3 (3х50 мл) и в завершение соляным раствором (1х50 мл). Органический слой сушили над MgSO4, фильтровали и упаривали досуха. После очистки с помощью колоночной хроматографии (смесь 1:6 этилацетат/петролейный эфир в качестве элюента) получали сультам N-4-метилпентаноил-L-(+)-2,10-камфоры (3,39 г, 78%).
Б. Аналогичным способом, но заменяя 4-метилпентаноилхлорид на соответствующий хлорид, получали следующие соединения формулы (N):
сультам N-3-фенилпропаноил-L-(+)-2,10-камфоры, МС: 347 (М+);
сультам N-5-фенилпентаноил-L-(+)-2,10-камфоры, МС: 375 M+;
сультам N-пентаноил-L-(+)-2,10-камфоры, МС: 300 (М+Н)+.
Пример 15
Соединения формулы (Q)
А. К раствору сультама N-4-метилпентаноил-L-(+)-2,10-камфоры (3,39 г, 10,8 ммоля) в 75 мл безводного ТГФ при -78oС в атмосфере аргона добавляли по каплям в течение примерно 5 минут NаN (тетраметилсилан)2 (1,0 М в ТГФ, 11,34 мл, 1,05 экв.). После перемешивания при -78oС в течение 1 часа к смеси добавляли гексаметилфосфорамид (5 мл), далее третбутилбромацетат (5,2 мл, 3 экв. ), а затем в виде одной порции добавляли 400 мг йодида тетра-н-бутиламмония. Полученный раствор выдержали при -78oС в атмосфере аргона в течение ночи. На следующее утро реакцию прекращали добавлением воды (100 мл) и затем экстрагировали простым эфиром (3х100 мл). Объединенные эфирные слои промывали соляным раствором, затем сушили над Na2SO4, фильтровали и концентрировали. После очистки с помощью колоночной хроматографии (смесь от 5: 95 этилацетат/петролейный эфир до 10:90 этилацетат/петролейный эфир в качестве элюента) получали сультам N-(4-метил-2-третбутоксикарбонилметил)пентаноил-L-(+)-2,10-камфоры (4 г, 86,5%).
Б. Аналогичным способом, но заменяя сультам N-4-метилпентаноил-L-(+)-2,10-камфоры соответствующим соединением формулы (N), получали следующие соединения формулы (Q):
сультам N-(3-фенил-2-третбутоксикарбонилметил)пропаноил-L-(+)-2,10-камфоры, МС:461 М+;
сультам N-(5-фенил-2-третбутоксикарбонилметил)пентаноил-L-(+)-2,10-камфоры, МС:490 (М+Н)+ и
сультам N-(2-третбутоксикарбонилметил)пентаноил-L-(+)-2,10-камфоры, МС: 414 (М+Н)+.
Пример 16
Соединения формулы (Ка)
А. К перемешиваемому раствору сультама N-(4-метил-2-третбутоксикарбонилметил)пентаноил-L-(+)-2,10-камфоры (5,45 г, 12,7 ммоля) в 50%-ном водном ТГФ (150 мл) при 0oС в атмосфере аргона добавляли кристаллы LiOH•H2O (2,14 г, 4 экв.), а затем 30%-ную Н2О2 (11,5 мл).
Затем ледяную баню удаляли и образовавшуюся эмульсию перемешивали в течение 3 часов до тех пор, пока она не станет прозрачной. Большую часть ТГФ удаляли при пониженном давлении при 35oС. Затем добавляли CH2Cl2 (150 мл) и при перемешивании добавляли 4н. HCl до получения значения рН 2. После добавления NaCl водный слой вновь экстрагировали СН2Сl2 (3х150 мл). СН2Сl2 удаляли при пониженном давлении и при 35oС и после этого остаток растворяли в этилацетате (150 мл). Этот раствор затем экстрагировали 5%-ным К2СО3 (3х50 мл) и объединенные экстракты промывали простым эфиром (50 мл). Затем к водному слою добавляли CH2Cl2, при перемешивании с NaCI водный слой экстрагировали CH2Cl2 (3х70 мл) и объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали, получая (2R)-4-метил-2-третбутоксикарбонилметилпентановую кислоту в виде бесцветного масла (2,95 г, количественный выход).
Б. Аналогичным способом, но заменяя сультам N-(4-метил-2-третбутоксикарбонилметил) пентаноил-L-(+)-2,10-камфоры на соответствующее соединение формулы (Q), получали следующие соединения формулы (Ка):
(2R)-3-фенил-2-третбутоксикарбонилметилпропановую кислоту, МС: 265 (М+Н)+;
(2R)-5-фенил-2-третбутоксикарбонилметилпентановую кислоту, МС: 293 (М+Н)+
(2R)-2-третбутоксикарбонилметилпентановую кислоту (бесцветное масло, 1,09 г).
В. (2R)-3 -фенил- 2-третбутоксикарбонилметилпропановую кислоту (55 мг) растворяли в ледяной уксусной кислоте (20 мл) и добавляли PtO2 (25 мг) в уксусной кислоте. Затем химический стакан помещали в сосуд высокого давления Парра, создавали вакуум и заряжали Н2 под давлением 100 фунт/кв. дюйм. После перемешивания в течение 3 дней смесь фильтровали вакуум-фильтрацией через слой целита (1 см). Затем фильтрат концентрировали, получая в виде масла желтого цвета (2R-3-циклогексил-2-третбутоксикарбонилметилпропановую кислоту (56 мг), МС:269 (М-Н)-.
Пример 17
Соединение формулы (R)
К раствору D-лейцина (50 г, 0,381 моля) в 570 мл 3н. НВr (вод.) при 0oС в течение 1 часа 15 минут добавляли порциями нитрит натрия (42 г, 1,6 экв.). Далее реакционную смесь перемешивали в течение 3 часов при 0oС, а затем экстрагировали простым эфиром (1000 мл). После промывки эфирного слоя водой (2х500 мл) его сушили над MgSO4 и концентрировали. После этого сироп красного цвета упаривали вместе с хлороформом (3х200 мл) до исчезновения окраски и затем отсасывали, получая (2R)-2-бром-4-метилпетановую кислоту в виде бесцветного масла с постоянным весом 71,3 г.
Пример 18
Соединение формулы (S)
В дихлорметане (80 мл) конденсировали изобутен до двойного объема (при -50oС, СНCl3/сухой лед). К этому раствору добавляли (2R)-2-бром-4-метилпетановую кислоту (28 г, 143,6 ммоля) и, поддерживая температуру на уровне между -40 и -50oС, по каплям добавляли концентрированную серную кислоту (1 мл). Реакционной смеси далее давали нагреться до комнатной температуры в течение 20 часов. Затем раствор концентрировали перед добавлением дополнительной порции метиленхлорида (300 мл) и последовательно промывали насыщенным NaHCO3 (2х100 мл), а затем водой (2х100 мл). После сушки над Na2SO4 органический слой отфильтровывали и концентрировали, получая масло желтого цвета. Продукт перегоняли, получая 23 г третбутилового эфира (2R)-2-бром-4-метилпетановой кислоты в виде прозрачного бесцветного масла.
Пример 19
Соединение формулы (U)
К бензилметилмалонату (2,13 мл, 1 экв.) и третбутоксиду калия (1,36 г, 1 экв. ) в безводном ДМФ (100 мл) при 0oС по каплям в течение 1 часа добавляли третбутиловый эфир (2R)-2-бром-4-метилпетановой кислоты (2,89 г, 11,5 ммоля) в 50 мл ДМФ. Образовавшийся раствор затем перемешивали при 0oС в течение 3 дней. Далее реакционную смесь распределяли между простым эфиром (150 мл) и насыщенным хлоридом аммония (80 мл). Образовавшуюся смесь фильтровали вакуум-фильтрацией через целит и разделяли две фазы. Затем водный слой дополнительно экстрагировали простым эфиром (3х100 мл), а объединеннные эфирные экстракты промывали водой (6х100 мл). После сушки над MgSO4 органический слой фильтровали и упаривали досуха. После очистки с помощью быстрой колоночной хроматографии (элюирование смесью 4:96 этилацетат/петролейный эфир) получали третбутиловый эфир (2R)-2-[(1-метоксикарбонил-1-бензилоксикарбонил) метил] -4-метилпентановой кислоты (2,55 г) в виде прозрачного бесцветного масла, МС: 322 (М-ацетон) +.
Пример 20
Соединение формулы (Kb)
третбутиловый эфир (2R)-2- [(1-метоксикарбонил-1-бензилоксикарбонил) метил] -4-метилпентановой кислоты растворяли в 5 мл 80%-ной ТФК (вод.) при комнатной температуре и перемешивали в течение 1,5 ч, контролируя с помощью ТСХ. Реакция оказалась завершенной только на 30%, поэтому добавляли дополнительную порцию ТФК (10 мл). Через 0,5 ч реакция была завершена. ТФК удаляли в глубоком вакууме при 45oС и остаток растворяли в этилацетате и промывали водой (5х30 мл). После сушки над Nа2SO4 этилацетный слой отфильтровывали и концентрировали под вакуумом, получая (2R)-2-[(1-метоксикарбонил-1-бензилоксикарбонил)метил]-4-метилпентановую кислоту в виде твердого вещества (1,68 г), МС: 322 (М+).
Пример 21
Соединение формулы (W)
Кристаллическую фосфиновую кислоту (8,4 г, 0,13 моля) перемешивали в чистом триэтилортоформиате (22 мл, 0,20 мл) в течение 90 минут при комнатной температуре. Затем эту смесь переносили через канюлю к перемешиваемому раствору этилизобутилакрилата (8 г, 0,036 моля) и тетраметилгуанидина (4,5 мл, 0,036 моля), охлажденному до 0oС в течение 10 минут. Ледяную баню удаляли и реакционную смесь перемешивали в течение 4 часов. Смесь разбавляли 200 мл диэтилового эфира, раствор промывали 1н. HCl (100 мл), водой (4х100 мл), соляным раствором (100 мл) и сушили над сульфатом магния. После упаривания при пониженном давлении получали 8,15 г этилового эфира 2-(этокси)-фосфиноилметил-4-метилпентановой кислоты в виде масла светло-желтого цвета, МС: 349 (М-Н2О)+.
Пример 22
Соединение формулы (X)
Неочищенный этиловый эфир 2-(этокси)-фосфиноилметил-4-метилпентановой кислоты (26 г) растворяли в 600 мл ТГФ/СН2Сl2 (50/50) и охлаждали до 0oС. Затем к раствору добавляли диизопропилэтиламин (32 мл) и 90,8 мл бис(триметилсилил)ацетамида и образовавшуюся смесь перемешивали в течение 20 минут, после чего добавляли параформальдегид (5,5 г). Температуру раствора доводили до комнатной и выдерживали при 37oС в течение 18 часов. Растворитель удаляли путем выпаривания и образовавшееся масло растворяли в 200 мл этилацетата. Раствор промывали 50 мл 1н. HCl (2 раза), 50 мл соляного раствора (2 раза), сушили над MgSO4, фильтровали и упаривали, получая 19,3 г этилового эфира 2-(этокси)(гидроксиметил)фосфиноилметил-4-метилпентановой кислоты в виде желтоватого масла, МС: 281 (МН+).
Пример 23
Соединения формулы (Y)
А. Этиловый эфир 2-(этокси)(гидроксиметил)фосфиноилметил-4-метилпентановой кислоты (5 г) растворяли в 20 мл СН2Сl2 и охлаждали до -20oС (с дублированием). К раствору по каплям добавляли метансульфонилхлорид (1,5 мл) и триэтиламин (3,0 мл). Через 15 минут баню удаляли и реакционную смесь выдерживали при комнатной температуре в течение 3,5 часов. Затем каждый раствор промывали 10 мл холодной 2%-ной HCl, 10 мл NaHCO3 (насыщенного), 10 мл соляного раствора, сушили над MgSO4, фильтровали и упаривали, получая 12,8 г (объединенный выход) этилового эфира 2- (этокси) (метансульфонилоксиметил)фосфиноилметил-4-метилпентановой кислоты.
Б. Аналогичным способом, но заменяя метансульфонилхлорид на паратолуолсульфонилхлорид, получали этиловый эфир 2- (этокси) (паратолуолсульфонилоксиметил) фосфиноилметил - 4 - метилпентановой кислоты.
Пример 24
Соединения формулы (АА)
Гидрид натрия (1,52 г, (60%-ный)) и 6 г 2-хинолинтиола перемешивали совместно при 0oС в 50 мл ДМФ. После прекращения начального выделения Н2 смесь перемешивали при комнатной температуре в течение 2,5 часов. Затем смесь охлаждали до 0oС и через канюлю добавляли этиловый эфир 2-(этокси)(метансульфонилоксиметил)фосфиноилметил-4-метилпентановой кислоты (12,8 г) в 10 мл ДМФ и образовавшуюся смесь затем перемешивали в течение 18 часов, медленно нагревая до комнатной температуры. ДМФ удаляли путем выпаривания, остаток растворяли в 50 мл этилацетата и промывали 50 мл Н2О (2 раза), соляным раствором (50 мл), сушили над MgSO4 и упаривали, получая полутвердое вещество желтого цвета. После очистки с помощью быстрой хроматографии с использованием для элюирования смеси от 10% этилацетата/гексан до 80% этилацетата/гексан, получали 10 г этилового эфира 2-(этокси) (хинолин-2-илтиометил) фосфиноилметил-4-метилпентановой кислоты (Rf=0,35 в смеси 80% этилацетата/гексан), МС:424(МН+).
Б. Аналогичным способом, но заменяя 2-хинолинтиол на 1-нафталинтиол, 2-нафталинтиол или тиофенол, получали следующие соединения формулы (АА):
этиловый эфир 2-(этокси) (нафт-1-илтиометил)фосфиноилметил-4-метилпентановой кислоты;
этиловый эфир 2-(этокси) (нафт-2-илтиометил)фосфиноилметил-4-метилпентановой кислоты; и
этиловый эфир 2-(этокси) (фенилтиометил)фосфиноилметил-4-метилпентановой кислоты.
Пример 25
Соединения формулы (ВВ)
А. Этиловый эфир 2-(этокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентановой кислоты (4,5 г) растворяли в 100 мл ТГФ и добавляли 12,5 мл 2н. NaOH вместе с достаточным количеством метанола для получения гомогенного раствора. Через 18 часов ТГФ удаляли путем выпаривания, остаток растворяли в 50 мл Н2О и промывали 50 мл этилацетата. Затем водную фазу подкисляли до рН 4 и продукт экстрагировали 50 мл этилацетата (2 раза). Этилацетатную фазу промывали 20 мл соляного раствора, сушили над MgSO4 и упаривали, получая 3,8 г 2-(гидрокси) (хинолин-2-илтиометил)фосфиноилметил-4-метилпентановой кислоты в виде масла желтого цвета, МС:368(МН+).
Б. Аналогичным способом получали следующие соединения формулы (ВВ):
2- (гидрокси) (нафт-1 -илтиометил)фосфиноилметил-4-метилпентановую кислоту;
2-(гидрокси) (нафт-2-илтиометил)фосфиноилметил-4-метилпентановую кислоту; и
2- (гидрокси) (фенилтиометил)фосфиноилметил-4-метилпентановую кислоту.
Пример 26
Разделение соединения формулы (ВВ)
2- (гидрокси) (хинолин-2-илтиометил)фосфиноилметил-4-метилпентановую кислоту (5,3 г) растворяли в 50 мл теплого этанола (абс.) и добавляли 4,2 г (-)-цинхонидина. Через 30 минут при комнатной температуре начинала осаждаться соль. Колбу покрывали фольгой и выдерживали в течение 2 дней. Затем соль удаляли путем вакуум-фильтрации и фильтрат упаривали до желтой пены. Соль и фильтрат растворяли в 100 мл этилацетата и промывали последовательно 1%-ной HCl для удаления цинхонидина, поддерживая при этом значение рН выше 4. Оба раствора сушили по отдельности над MgSO4 и упаривали, получая 2,4 г одного выделенного стереоизомера [α]
Пример 27
Соединение формулы (Ig)
Выделенный стереоизомер 2-(гидрокси)(хинолин-2-илтиометил)фосфиноилметил-4-метилпентановой кислоты (300 мг, 0,81 ммоля) и 1,1'-карбонилдиимидазол (174 мг, 1,0 ммоль) перемешивали при 0oС в 6 мл ТГФ в течение 1,5 ч. К раствору добавляли (10S)-10-амино-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен (270 мг, 0,95 ммоля), образовавшейся смеси давали нагреться до комнатной температуры и затем перемешивали в течение 18 часов. ТГФ удаляли путем выпаривания и остаток растворяли в 60 мл этилацетата. Этилацетатный раствор промывали 10 мл Н2О, 10 мл соляного раствора, сушили над MgSO4 и упаривали, получая (10S)-[4-метил-2-(9-оксо-1,8-диазатрицикло [10.6.1.013'18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)пентил] (хинолин-2-илтиометил)фосфиновую кислоту в виде желтого масла. Очистку осуществляли с помощью ЖХВР с обращенной фазой, используя в качестве элюентов градиент ацетонитрила и 50 мМ NН4OАс-буфер. Более полярный стереоизомер (30 мг) выделяли при 41%-ном ацетонитриле, а менее полярный стереоизомер (10 мг) выделяли при 43%-ном ацетонитриле. Фракции лиофилизировали с получением беловатого порошка, МС:635(МН+).
Пример 28
Соединение формулы (Ih)
(3R, 10S)-5-мeтил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту (200 мг, 0,45 ммоля) растворяли в 10 мл ледяной уксусной кислоты и гидрировали при давлении Н2 100 фунт/кв. дюйм в присутствии Pt2O (60 мг) в реакторе Парра при комнатной температуре в течение 15 часов. Реакционную смесь барботировали газообразным аргоном в течение 15 минут и отфильтровывали катализатор (Pt2O) (через воронку с целитом). Прозрачный фильтрат упаривали досуха и далее дважды проводили совместное упаривание с толуолом, получая (3R,10S)-метил-5-3(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадекан-10-илкарбамоил)гексановую кислоту в виде белого твердого вещества, количественный выход, МС: 448(М-Н)-.
Пример 29
Соединение формулы (Ii)
К (3R, 10S)-5-мeтил-3-(9-oкco-1,8-дизатрициклo [10.6.1,013,18] нoнaдеканилкарбамоил)гексановой кислоте и O-бензилгидроксиламину (5 экв., 2,25 ммоля, 277 мг) в 10 мл безводного ДМФ при комнатной температуре добавляли 1 гидроксибензотриазол•Н2О (2 экв. , 0,9 ммоля, 122 мг) и ЭДКИ (5 экв., 2,25 ммоля, 431 мг). Образовавшуюся прозрачную реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в глубоком вакууме при комнатной температуре и остаток распределяли между этилацетатом (15 мл) и 1н. НСl (15 мл). Этилацетатный слой далее экстрагировали 1н. НСl (15 мл). Объединенные водные экстракты подщелачивали с помощью 4н. NaOH до рН 10, насыщали NaCl и экстрагировали CH2Cl2 (3х15 мл). Объединенный СН2Сl2-экстракт сушили (MgSO4), фильтровали и упаривали досуха, получая полутвердый продукт. Этот полутвердый продукт перемешивали в простом эфире (10 мл) при 0oС в течение 30 минут и фильтровали, получая 85 мг (34%) (3R, 10S)-N-бензилокси-5-метил-3-(9-оксо-1,8-диазатрицикло[10.6.1.013, 18 ] нонадеканилкарбамоил)гексанамида, в виде белого порошка, МС:555(М+Н)+.
Пример 30
Соединение формулы (Ij)
(3R,10S)-N-бензилокси-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадекан-10-илкарбамоил) гексанамид (75 мг, 0,135 ммоля) гидрировали при давлении Н2 1 атм в абсолютном этаноле (5 мл) в присутствии 10%-ного Pd/C (35 мг) в течение 2 часов. Реакционную смесь барботировали газообразным аргоном в течение 10 минут и фильтровывали через воронку с целитом. Далее катализатор на целите промывали 5 мл этанола. Объединенный фильтрат упаривали досуха, получая твердый остаток. Твердый остаток перемешивали в 10 мл 5%-ного МеОН в простом эфире при 0oС в течение 30 минут и фильтровали, получая 57 мг (91%) (3R,10S)-N-гидрокси-5-метил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкaн-10-илкapбaмoил)гексанамида в виде беловатого порошка, МС: 465(М+Н)+.
Пример 31
Соединение формулы (DD)
К N-третбутоксикарбонилтриптофану (3 ммоля, 914 мг) и N-метилэтандиамину (3,6 ммоля, 0,27 г, 0,32 мл) в безводном ДМФ (15 мл) добавляли 1-гидроксибензотриазол•Н2O (3 ммоля, 459 мг) и ЭДКИ (4,5 ммоля, 863 мг). Смесь перемешивали при комнатной температуре в течение ночи в атмосфере аргона и избыток растворителя (ДМФ) удаляли в глубоком вакууме при 35oС. Остаток растворяли в этилацетате (40 мл) и аддукт экстрагировали 1н. HCl (3х25 мл). Объединенный водный экстракт подщелачивали твердым К2СО3 и экстрагировали этилацетатом (3х25 мл).
Объединенный органический экстракт промывали соляным раствором (30 мл) и сушили (MgSO4). После упаривания досуха получали 920 мг (85%) чистого по данным ЖХВР продукта, а именно, N-((метил)аминоэтил)амида N,-третбутоксикарбонилтриптофана в виде белой пены.
Пример 32
Соединение формулы (ЕЕ)
К интенсивно перемешиваемому раствору N-((метил)аминоэтил)амида N'-третбутоксикарбонилтриптофана (2 г, 5,55 ммоля) и транс- 1,4-дихлорбут-2-ена (8,32 моля, 1,04 г, 0,88 мл) в метиленхлориде (75 мл) и 40%-ном КОН (50 мл) добавляли 0,3 экв. бензилтриэтиламмонийхлорида (1,66 ммоля, 378 мг). После перемешивания при комнатной температуре в течение ночи желтоватый органический слой отделяли и водный слой затем экстрагировали 30 мл CH2Cl2. Объединенный метиленхлоридный экстракт промывали соляным раствором и сушили (MgSO4). Остаток растворяли в 10 мл МеОН и при 0oС добавляли при перемешивании 50 мл простого эфира. Образовавшийся желтый твердый продукт отфильтровывали. Фильтрат упаривали досуха, получая 1,12 г чистого по данным ЖХВР продукта, а именно, 11-N'-(третбутоксикарбонил)амино-10-оксо-1,6,9-тpиaзa-6-мeтил-тpициклo[11.6.1.014,19] эйкoзa-3(4), 13(20), 14(19),15,17-пентаена в виде светло-желтого порошка, МС:413(М+Н)+.
Пример 33
Соединение формулы (FF)
11-N'-(третбутоксикарбонил)амино-10-оксо-1,6,9-триаза-6-метил-тpициклo[11.6.1.014,19] эйкoзa-3(4), 13(20),14(19),15,17-пентаен (414 мг, 1 ммоль) перемешивали в 40%-ной ТФК в CH2Cl2 (10 мл) при комнатной температуре в течение 1 часа. Избыток ТФК и растворителя удаляли при пониженном давлении. Остаток растворяли в метиленхлориде (30 мл) и промывали 5%-ным раствором К2СО3 (2х15 мл) и соляным раствором (15 мл). Органический слой сушили (MgSO4) и упаривали, получая 240 мг (76%) 11- амино-10-оксо-1,6,9-триаза-6-метил-трицикло[11.6.1.014,19] эйкоза-3(4), 13(20), 14(19),15,17-пентаена в виде светло-желтой пены, МС:313(М+Н)+
Пример 34
Соединения формулы (Ik)
11-амино-10-оксо-1,6,9-триаза-6-метилтрицикло[11.6.1.014, 19]эйкоза-3(4), 13(20), 14(19), 15,17-пентаен (161 мг, 0,7 ммоля) и (2R)-4-метил-2-третбутоксикарбонилметилпентановую кислоту (220 мг, 0,7 ммоля) перемешивали в безводном ДМФ (15 мл) в присутствии ГОБТ (0,7 ммоля), ЭДКИ (1,4 ммоля, 268 мг) и N-метилморфолина (1,4 ммоля, 0,15 мл) в атмосфере аргона при комнатной температуре в течение ночи. Избыток ДМФ удаляли при пониженном давлении. Остаток растворяли в метиленхлориде (30 мл) и промывали водой (30 мл). Водную фракцию экстрагировали СН2Сl2 (30 мл). Объединенный метиленовый экстракт сушили (MgSO4) и упаривали, получая светло-коричневое масло. Это светло-коричневое масло очищали с помощью ЖХВР с обращенной фазой (C18-колонка; градиент СН3СN-50 мМ NH4-OH). Требуемую фракцию лиофилизировали, получая 148 мг (40%) третбутилового эфира (3R,11S)-5-метил-3-(10-оксо-1,6,9-триаза-6-метилртицикло [11.6.1.014,19] -эйкоза-3(4),13(20),14(19), 15,17-пентан-11-илкарбамоил)гексановой кислоты в виде светло-желтого порошка, МС:525,2(М+Н)+.
Пример 35
Соединение формулы (Il)
третбутиловый эфир (3R, 11S)-5-метил-3-(10-оксо-1,6,9-триаза-6-мeтил-тpициклo[11.6.1.014,19] эйкoзa-3(4), 13(20),14(19),15,17-пeнтaeн-11-илкарбамоил)гексановой кислоты (0,228 ммоля, 120 мг) перемешивали в 20%-ной ТФК в СН2Сl2 (5 мл) при комнатной температуре в течение 1 часа. Избыток растворителя удаляли при пониженном давлении (роторный испаритель при 30oС), получая неочищенную (3R, 11S)-5-метил-3-(10-оксо-1,6,9-тpиaзa-6-мeтил-тpициклo[11.6.1.014,19] эйкoзa-3(4), 13(20), 14(19), 15,17-пентаен-11-илкарбамоил)гексановую кислоту в виде светло-коричневого масла. После очистки с помощью ЖХВР с обращенной фазой при элюировании в градиенте смеси СН3СN-NН4OАс-буфер получали 90 мг (75%) кислоты в виде светло-желтого порошка, МС: 469,1(М+Н)+.
Пример 36
Соединение формулы (Im)
(3R,11S)-5-метил-3-(10-оксо-1,6,9-триаза-6-метилтрицикло [11.6.1.014,19] эйкoзa-3(4), 13(20), 14(19), 15,17-пентаен-11-илкарбамо-ил)гексановую кислоту и O-бензилгидроксиламин (5 экв., 2,5 ммоля, 308 мг) перемешивали в безводном ДМФ (30 мл) в присутствии ГОБТ (2 экв., 1 ммоль, 135 мг), ЭДКИ (5 экв., 2,5 ммоля, 479 мг) и N-метилморфолина (10 экв., 5 ммолей, 0,55 мл) при комнатной температуре в атмосфере аргона в течение 15 часов. Растворитель удаляли в глубоком вакууме при комнатной температуре. Остаток растворяли в дистиллированной воде (35 мл) и экстрагировали 10%-ным этилацетатом в петролейном эфире для удаления менее полярных примесей. Ожидаемый продукт затем экстрагировали из водного слоя с помощью CH2Cl2 (2х35 мл). Органический экстракт промывали соляным раствором (25 мл), сушили (MgSO4) и упаривали, получая желтое масло (330 мг). Неочищенный продукт очищали с помощью ЖХВР с обращенной фазой (градиент CH3CN-NН4ОАс-буфера) и лиофилизировали, получая 175 мг (61%) (3R,11S)-N- бензилокси-5-метил-3-(10-оксо-1,6,9-триаза-6-метил-трициклo[11.6.1.014,19] эйкoзa-3(4), 13(20), 14(19), 15,17-пентаен-11-илкарбамо-ил)гексанамида в виде беловатого порошка, МС: 572 (М-Н)-.
Пример 37
Соединение формулы (In)
Смесь (3R, 11S)-N-бензилокси-5-метил-3-(10-оксо-1,6,9-триаза-6-мeтилтpициклo[11.6.1.014,19] эйкoзa-3(4), 13(20), 14(19),15,17-пeнтaeн-11-илкарбамоил)гексанамида (40 мг, 0,07 ммоля) и 10%-ного Pd/C (10 мг) перемешивали в растворе 3%-ной НСООН в этаноле (5 мл) при комнатной температуре в течение 1 часа. Смесь фильтровали через воронку с целитом и концентрировали в вакууме. К твердому остатку в 1 мл смеси 50% АсОН/МеОН при перемешивании одной порцией добавляли 5 мл простого эфира. Беловатый порошок затем собирали с помощью фильтрации, получая 26 мг (68%) (3R,11S)-N-гидрокси-5-метил-3-(10-оксо-1,6,9-триаза-6-метил-тpициклo [11.6.1.014,19] эйкoзa-3(4), 13(20), 14(19), 15,17-пентаен-11-илкарбамоил)гексанамида, МС:488,5(МН+).
Аналогичным способом получали следующее соединение:
(2S, 3R, 9S)-(N, 2)-дигидрокси-5-метил-3-(8-оксо-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил) гексанамид.
Пример 38
Соединения формулы (JJ)
А. К раствору натриевой соли (±)-2-гидроксибутановой кислоты (2,54 г, 20,1 ммоля) в безводном ДМФ (30 мл) добавляли бензилбромид (2,9 мл, 1,2 экв. ) и безводный KI (330 мг, 0,1 экв.). Суспензию выдерживали при 100oС в течение 24 часов и ДМФ отгоняли при пониженном давлении. Остаток растворяли в простом эфире, промывали водой и насыщенным Nа2S2О3, сушили (MgSO4) и концентрировали. После перегонки оставшегося масла получали 3,7 г (95%) бензил-(±)-2-гидроксибутаноата в виде бесцветного масла, tкип 95oC (0,45 торр).
Б. В другом варианте к холодной (0oС) суспензии NaH (3,8 г, 60 мас.%-ная дисперсия в минеральном масле, 95,0 ммолей) в ТГФ (50 мл) по каплям через канюлю добавляли раствор гликолевой кислоты (7,2 г, 95 ммолей) в ТГФ (50 мл). Образовавшийся раствор нагревали до 25oС и концентрировали в вакууме. Образовавшуюся соль суспендировали в ДМФ (100 мл) и обрабатывали KI (1,57 г, 0,1 экв.) и бензилбромидом (12,3 мл, 1,1 экв.). Смесь выдерживали при 100oС в течение 23 часов в атмосфере аргона и выпаривали ДМФ. Остаток растворяли в простом эфире, промывали водой, насыщенным Nа2S2О3 и соляным раствором и сушили над MgSO4. После перегонки получали бензилгликолят (8,5 г, 54%) в виде бесцветного масла, tкип 85-87oC (0,5 торр).
Пример 39
Соединения формулы (LL)
А. К холодному (0oС) раствору бензил-(±)-2-гидроксибутаноата (1,75 г, 9,01 ммоля) в СН2Сl2 (50 мл) добавляли 2,6-лутидин (1,2 мл, 1,1 экв.), после чего по каплям добавляли трифлиновый ангидрид (1,7 мл, 1,1 экв.). Через 10 минут по каплям при 0oС добавляли раствор третбутилового эфира L-лейцина (1,7 г, 1 экв.) и диизопропилэтиламина (1,7 мл, 1,1 экв.) в CH2Cl2 (30 мл). Раствор выдерживали при 25oC в течение 36 часов, разбавляли CH2Cl2 и промывали насыщенным NаНСО3 (50 мл). После сушки (Na2SO4) и концентрации в вакууме оставшееся масло подвергали быстрой хроматографии (кремнезем, 5%-ный этилацетат/гексан) для разделения диастереомеров. Менее полярный диастериомер третбутиловый эфир (1R)-N-(2-бензилоксикарбонил)пропил-L-лейцина (Rf 0,22; 5%-ный этилацетат/гексан) и более полярный диастериомер третбутиловый эфир (1S)-N-(2-бензилоксикарбонил)пропил-L- лейцина (Rf 0,13) далее очищали по отдельности с помощью ЖХВР (5%-ный этилацетат/гексан), получая 1,1 г более полярного диастериомера и 0,78 г менее полярного диастериомера, МС (FAB):364(МН+).
Б. Аналогичным способом из бензилгликолята (379 мг, 2,7 ммоля), третбутилового эфира L-лейцина (435 мг, 2,7 ммоля), 2,6-лутидина (0,35 мл, 2,8 ммоля), диизопропилэтиламина (0,53 мл, 0,28 ммоля) и трифлинового ангидрида (0,51 мл, 2,8 ммоля) получали 383 мг (50%) третбутилового эфира N-бензилоксикарбонилметил-L-лейцина в виде бесцветного масла, МС (FAB):336(МН+).
Пример 40
Соединения формулы (Iо)
А. К раствору третбутилового эфира (1S)-N-(2-бензилоксикарбонил) пропил-L-лейцина (143 мг, 0,393 ммоля) в СН2Сl2 (3 мл) при 0oС добавляли ТФК (0,5 мл). Раствор перемешивали при 25oC в течение 4 часов и затем концентрировали в вакууме, получая соль (1S)-N-(2-бензилоксикарбонил)пропил-L-лейцина (соединение формулы (ММ)), которую затем растворяли в ДМФ (3 мл) с (10S)-10-амино-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраеном (124 мг, 1,1 экв.) и ГОБТ (80 мг, 1,5 экв.). После охлаждения до 0oС добавляли N-метилморфолин (60 мл, 1,5 экв.) и ЭДКИ (113 мл, 1,5 экв.). Реакционную смесь выдерживали при 25oC в течение 18 часов, после чего разбавляли 10 мл этилацетата, промывали насыщенным NаНСО3 (3х10 мл) и водой (2х10 мл), сушили (Na2SO4) и концентрировали. Остаток хроматографировали с помощью быстрой хроматографии (кремнезем, 1%-ный MeOH/CH2Cl2) и собирали фракции с Rf 0,5 (5%-ный MeOH/CH2Cl2), С помощью ЖХВР с обращенной фазой получали (2R, 1'S, 10S)-2- [N-(1-бензилоксикарбонил)пропиламино] -4-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-ил)пентанамид (46 мг), МС (FAB): 575 (МН+).
Б. Аналогичным способом, но заменяя третбутиловый эфир (1R)-N-(2-бензилоксикарбонил) пропил-L-лейцина (270 мг) на третбутиловый эфир (1S)-N-(2-бензилоксикарбонил)пропил-L-лейцина, получали (2R,1'R,10S)-2- [N-(1-бензилоксикарбонил)пропиламино]-4-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-ил)пентанамид (175 мг), МС (FAB):575(МН+).
Пример 41
Соединения формулы (Ip)
А. К раствору (2R,1S,10S)-2-[N-(1-бензилоксикарбонил)пропиламино]-4-мeтил-N-(9-oкco-1,8-диaзaтpициклo [10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-ил)пентанамида (46 мг) в ТГФ/МеОН (1:1, 2 мл) в атмосфере аргона добавляли 1 М гидроксид бария (0,3 мл). После выдержки при 25oC в течение 24 часов через раствор пропускали СО2 и образовавшийся осадок карбоната бария отфильтровывали. Растворитель удаляли при пониженном давлении и значение рН водного остатка доводили до 5,5 с помощью 1М HCl. После удаления воды с помощью ЖХВР с обращенной фазой получали (2R,1'S,10S)-2- [N'-(1-карбокси)пропиламино] -4-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-ил)пентанамид в виде белого твердого продукта, МС (FAB):483(М-Н)-.
Аналогичным способом получали:
(2RS, 10S)-2- [карбоксиметиламино] -2-циклогексил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-ил)ацетамид, МС:497(М+Н)+;
(2RS, 10S)-2- [карбоксиметиламино] -3-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-ил)пентамид, МС: 471(М+Н)+; и
(2RS, 10S)-2-[фосфонилметиламино] -4-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-ил)пентамид.
Б. Аналогичным способом из (2R, 1'R, 10S)-2-[N'-(1-бензилоксикарбонил)пропиламино] -4-метил-М-(9-оксо-1,8-диазатрицикло[10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-ил)пентанамида получали (2R,1'S,10S)-2-[N'-(1-карбокси)пропиламино]-4-метил-N-(9-оксо-1,8-диазатрициклo [10.6.1.013,18] нoнaдeкa-l2(19), 13(18), 14,16-тетраен-10-ил)пентанамид (16 мг), МС (FAB):483(М-Н)- .
В. В соответствии с описанной выше методикой получения соединения формулы (Iо) из третбутилового эфира N-[(бензилоксикарбонил) метил] -L-лейцина (156 мг, 0,465 ммоля), ГОБТ (94 мг, 1,5 экв.), ЭДКИ (134 мг, 1,5 экв.), N-метилморфолина (77 мкл) и (10S)-10-амино-(9-оксо-1,8-диaзaтpициклo [10.6.1.013,18] нoнaдeкa-12(19),13(18),14,16-тетраена (133 мг, 1 экв.) после быстрой хроматографии (3%-ный MeOH/CH2Cl2) получали неочищенный бензиловый эфир. Неочищенный бензиловый эфир растворяли в ТГФ/МеОН (1:1, 6 мл) и гидролизовали с помощью 1 М гидроксида бария (0,9 мл) в течение ночи. Через раствор пропускали двуокись углерода и образовавшийся осадок отфильтровывали. Фильтрат концентрировали и значение рН водного остатка доводили до 5,5 с помощью 1 М HCl. С помощью ЖХВР с обращенной фазой получали (2R,10S)-N'-(карбоксиметил)амино-4- метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-ил)пентанамид (17 мг) в виде белого твердого продукта, МС (FAB):457(МН+).
Пример 42
Соединения формулы (6)
4-метил-2-метиленпентановая кислота
А. К чистому этилизобутилмалонату (25 г, 0,13 моля) при 0oС медленно добавляли охлажденный на льду диэтиламин (15,1 мл, 0,15 моля). После перемешивания в течение 15 минут по каплям добавляли формалин (11,1 мл, 37%-ный водный формальдегид). Смесь выдерживали при перемешивании и при 25oC в течение 3 дней. Затем реакционную смесь обрабатывали раствором, содержащим 20 г К2СО3 в 40 мл воды, и экстрагировали простым эфиром (2х100 мл). Эфирные экстракты объединяли, промывали соляным раствором, сушили над MgSO4 и концентрировали при пониженном давлении и при 20oC. Полученный неочищенный этил-4-метил-2-метиленпентаноат, содержавший некоторое количество простого эфира, растворяли в абсолютном этаноле (250 мл) и обрабатывали ацетонитрилом (250 мл) и 1М LiOH (9,7 г в 250 мл воды, 0,23 моля). После перемешивания в течение ночи органические растворители выпаривали при пониженном давлении и водный остаток экстрагировали этилацетатом (2х150 мл). Объединенные экстракты промывали соляным раствором, сушили над MgSO4 и концентрировали при пониженном давлении, получая 10,5 г 4-метил-2-метиленпентановой кислоты в виде бесцветного масла.
Б. Аналогичным способом получали следующие соединения формулы (Gd):
4-фенил-2-метиленбутановую кислоту;
3-циклогексил-2-метиленпропановую кислоту;
5-фенил-2-метиленпентановую кислоту;
2-метиленпентановую кислоту; и
3,3-диметил-2-метиленбутановую кислоту.
Пример 43
Соединение формулы (Id) (обращенный гидроксамат)
А. Раствор 4-метил-2-метиленпентановой кислоты (3,5 г) и O-бензилгидроксиламина выдерживали при 120oC в течение 8 часов. Реакционную смесь затем распределяли между 50 мл 1.0н. NaOH и 50 мл диэтилового эфира. Водную фракцию отделяли, подкисляли до рН 3 с помощью 10%-ной НСl и промывали 50 мл простого эфира. С помощью ионообменной хроматографии (модель Dowex-50W) при элюировании 20%-ным пиридином/водой получали 2-(бензилоксиаминометил)-4-метилпентановую кислоту.
1H-ЯМР, в СDСl3, 300 МГц: δ 0,9-1,0 (dd, 6H, СН3); 1,25-1,35 (m, 1H, CH); 1,6-1,75 (m, 2H, СH2); 2,8-2,9 (m, 1H, Сa-Н); 3,0-3,2 (ABq, 2H, CN2N); 4,7-4,75 (ABq, 2H, СН2О); 7.3-7,4 (m, 5H, Ph).
Б. Формилирование 2-(бензилоксиаминометил)-4-метилпентановой кислоты осуществляли в дихлорметане с помощью муравьиной кислоты/уксусного ангидрида, получая N-формил-2-(бензилоксиаминометил)-4-метилпентановую кислоту.
Сочетание с соединением формулы (J): к N-формил-2-(бензилоксиаминометил)-4-метилпентановой кислоте (175 мг) и соединению формулы J) (230 мг) в смеси 5% пиридина/дихлорметан (30 мл) при комнатной температуре добавляли 4-диметиламинопиридин (ДМАП) (200 мг) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЭДКИ). Реакционную смесь перемешивали в течение 8 часов, а затем концентрировали и распределяли между 30 мл этилацетата и 30 мл 20%-ной HCl. Органическую фракцию промывали водой (20 мл), 5%-ным NaHCO3 (20 мл) и соляным раствором, сушили над MgSO4 и концентрировали. После очистки на силикагеле с элюированием смесью 50% этилацетата/гексан получали продукт в виде смеси двух изомеров. Гидрогенолизом в метаноле с использованием 10%-ного Pd/C получили (2RS,10S)-2-[N-формил,N-гидроксиаминометил]-4-метил-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,6-тетраен-10-ил)пентамид в виде смеси двух изомеров, МС: 455(М-Н)- (соединение 6).
Аналогичным способом получали:
(2RS,10S)-2-1изопропоксикарбонилметил]-4-метил-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,6-тетраен-10-ил)пентамид, МС: 455(М+Н)+; и
(2RS, 10S)-2- [морфолинкарбэтоксиметил] -4-метил-(9-оксо-1,8-диазатрицикло [10.6.1.013'18] нoнaдeкa-12(19), 13(18), 14,6-тетраен-10-ил)пентамид, МС:555(М+Н)+.
Пример 44
Соединение формулы (Iq)
А. Получение соединения формулы (РР)
К смеси, содержащей третбутиловый эфир 2-(фталимид-2-илметил)-3(R)-изобутилянтарной кислоты (3,4 г), N-метилморфолин (1,92 мл), 1-гидроксибензотриазол (1,3 г) и (10S)-10-амино-(9-оксо-1,8-диазатрициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18),14,16-тетраен (2,49 г) в безводном ДМФ (200 мл), при 0oС в атмосфере аргона добавляли ЭДКИ (3,34 г). Образовавшуюся смесь перемешивали в течение ночи, температуре давали смеси подняться до температуры окружающей среды и затем растворитель удаляли при 45oC в глубоком вакууме. Остаток интенсивно перемешивали со смесью этилацетата (300 мл) и 0,5н. соляной кислоты (150 мл). Органический слой промывали 0,5н. HCl (2х150 мл), насыщенным NaHCO4 (2х150 мл) и в завершение соляным раствором (1х150 мл). После сушки органического слоя над MgSO4 его фильтровали и упаривали досуха. После очистки остатка с помощью быстрой колоночной хроматографии (смесь 10% этилацетата/метиленхлорид) получали третбутиловый эфир (3R, 10S)-2-(фталимид-2-илметил)-5-метил-3-(9-oкco-1,8-диaзaтpициклo [10.6.1.013,18] нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановой кислоты (4,81 г). Это соединение получали в виде менее полярного диастереоизомера (2,96 г), более полярного диастереоизомера (1,05 г) и смеси обоих изомеров (0,8 г).
Б. Получение соединения формулы (Iq)
К раствору менее полярного изомера соединения формулы (РР) (2,96 г), полученного согласно примеру 42А, в метаноле (50 мл) и метиленхлориде (50 мл) при комнатной температуре добавляли гидразин (2,8 мл). Смесь перемешивали в течение ночи, после чего добавляли дополнительно 200 мл метиленхлорида и 300 мл метанола, а затем силикагель. Растворитель удаляли при пониженном давлении, а остаток силикагеля, на котором адсорбировался продукт, загружали в колонку с силикагелем и подвергали быстрой хроматографии. Элюируя 4%-ным метанолом/метиленхлоридом, получали 2,01 г третбутилового эфира (3R,10S)-2-(аминометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановой кислоты
В. С помощью гидролиза эфира трифторуксусной кислотой, как описано ниже, получали (3R, 10S)-2-(аминометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:471(МН+).
Пример 45
Соединение формулы (Ir)
А. К раствору третбутилового эфира (3R,10S)-2-(аминометил)-5-метил-3-(9-oкco-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19,13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты (363 мг) и триэтиламина (0,54 мл) в безводном метиленхлориде (20 мл) при 0oС добавляли метансульфонилхлорид (77 мкл). Образовавшуюся смесь перемешивали в течение 2 часов, температуре смеси давали подняться до температуры окружающей среды, а затем при интенсивном перемешивании добавляли метиленхлорид (100 мл) и 0,5н. соляную кислоту (50 мл). Затем водный слой экстрагировали метиленхлоридом (2х75 мл), после чего объединенные органические слои промывали соляным раствором (100 мл). После сушки органического слоя над MgSO4 его фильтровали и упаривали досуха. После очистки остатка с помощью быстрой колоночной хроматографии (смесь от 10 до 30% этилацетата/метиленхлорид) получали третбутиловый эфир (3R,10S)-2-(метилсульфонамидоаминометил)-5-мeтил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановой кислоты в виде белого твердого вещества (211 мг).
Б. К раствору соединения (180 мг), полученного в параграфе А, в метиленхлориде (4 мл) при 0oС добавляли трифторуксусную кислоту (2 мл). Образовавшуюся смесь перемешивали в течение 5 часов и температуре смеси давали подняться до температуры окружающей среды. Растворитель удаляли при пониженном давлении, к остатку добавляли этилацетат и раствор промывали водой (7х30 мл). После сушки органического слоя над MgSO4 его фильтровали и упаривали досуха. После кристаллизации остатка из метанола/этилацетата/гексана получали (3R, 10S)-2-(метилсульфонамидоаминометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту в виде белого твердого вещества (129 мг).
В. Аналогичным образом получали следующие соединения формулы (Ir):
(3R, 10S) -2- (метоксикарбониламинометил) -5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:527,5(М-Н+);
(3R, 10S)-2-(этоксикарбониламинометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:541,5 М-Н+);
(3R, 10S)-2-(метансульфонамидометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:549,2(М-Н+);
(3R, 10S)-2-(этансульфонамидометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:563(М-Н+);
(3R, 10S)-2-(трифторметансульфонамидометил)-5-метил-3-(9-оксо-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тeтpaeн-10-илкарбамоил)гексановую кислоту, МС:603,3(М-Н+);
(3R, 10S)-2-(фенилсульфонамидометил)-5-метил-3-(9-оксо-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:611,1(М-Н+);
(3R, 10S)-2-(бензилсульфонамидометил)-5-метил-3-(9-оксо-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:625,2(М-Н+);
(3R, 10S)-2- [5-(2-пиридил)тиофен-2-илсульфонамидометил]-5-метил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19),13(18),14,16-тeтpaeн-10-илкарбамоил)гексановую кислоту, МС:692,4(М-Н+);
(3R, 10S)-2-(тиен-2-илсульфонамидометил)-5-метил-3-(9-оксо-1,8-диaзaтpициклo [10.6.1.013,18] нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:617,5(М-Н+);
(3R, 10S)-2-(2-фенилвинилсульфонамидометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:637,6(М-Н+);
(3R, 10S)-2-(1 -азанафтиридин-8-илсульфонамидометил) -5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,18-тетраен-10-илкарбамоил)гексановую кислоту, МС:549,2(М-Н+);
(3R, 10S)-2-(3-этилуреидометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:542,34(М-Н+); и
(3R, 10S)-2-(ацетиламинометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту, МС:512(М-Н+);
(3R, 10S)-2-(8-хинолинсульфониламинометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.0l3,18] нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-2-(5-бензоиламинометилтиен-2-ил)сульфониламинометил-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-2-(N-метилимидазол-2-илсульфониламинометил)-5-метил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013, 18] нoнaдeкa-12(19), 13(18),14,16-тeтpaeн-10-илкарбамоил)гексановую кислоту, МС:612,7(М-Н)-;
(3R, 10S)-2-(5-пиридин-2-илтиен-2-илсульфониламинометил)-5-метил-3-(9-oкco-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-2-(бензиламинометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-2-(фталимид-2-илметил-4-циклопентил) -3-(9-оксо-1,8-диaзaтpициклo[10.6.1.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)бутановую кислоту;
(3R, 10S)-2-(N-фталимид-2-илметил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту;
(3R, 10S)-2-(метансульфониламинометил)-4-циклопентил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)бутановую кислоту; и
(3R, 10S)-2-(фенилэтилсульфониламинометил)-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексановую кислоту.
Аналогично получали:
(3R,9S)-2-(метансульфонамидометил)-4-циклопентил-3-(8-окco-диазатрицикло [9.6.1.013,15] тетраен-9-илкарбамоил)бутановую кислоту.
Пример 46
Соединение формулы (mm)
К раствору, содержащему N-третбутоксикарбонил-L-триптофан (128 г, 0,42 моля), 2-(2-аминоэтокси)этанол (46,42 г, 0,44 моля), 1-гидроксибензот-риазол (60,0 г, 0,44 моля) в 700 мл ДМФ, при 0oС добавляли ДЦК (100 г, 0,48 моля). После перемешивания при 0oС в течение 15 минут смесь перемешивали при комнатной температуре в течение ночи. Белый твердый продукт отфильтровывали и промывали EtOAc. Фильтрат концентрировали при пониженном давлении. Остаток растворяли в простом эфире и небольшом количестве EtOAc, промывали 1%-ной HCl (3х500 мл), насыщенным NаНСО3 (3х500 мл) и соляным раствором (3х500 мл). Органический слой сушили (MgSO4), фильтровали и концентрировали, получая 2-(8)-третбутоксикарбо-ниламино-N- [2-(2-гидроксиэтокси)этил] -3-(1Н-индол-3-ил)пропионамид, 150 г (выход 91%), МС:392,2(М+Н)+.
Пример 47
Соединение формулы (nn)
К соединению, полученному в примере 46 (50 г, 0,128 моля), и N,N-диметилпиридину (200 мг, 1%) в 250 мл триэтиламина/дихлорметана (1/4) при 0oС добавляли 29 г (0,15 моля) паратолуолсульфонилхлорида. Смесь перемешивали при 0oС в течение 4 часов. Растворитель удаляли при 0oС и при пониженном давлении. Остаток растворяли в EtOAc и 1н. HCl и переносили в делительную воронку. Органический слой выделяли и промывали 2%-ной HCl, повторяя процедуру, пока значение рН водного слоя не становилось равным приблизительно 2, а также промывали насыщенным NаНСО3 и соляным раствором, органическую фазу сушили и упаривали, получая 60 г (86%) 2-(S)-трет - бутоксикарбониламино -2-N-[2-(2-4,- метилфенилсульфонилокси) это к -си)этил] -3-(1Н-индол-3-ил)пропионамида, МС:545(М+).
Пример 48
Соединение формулы (оо)
К соединению, полученному в примере 47 (30 г, 0,055 моля), в СН2Сl2 (700 мл) добавляли 50%-ный NaOH (200 мл) и бисульфат тетра-н-бутиламмония (20,54 г, 0,06 моля). Смесь интенсивно перемешивали при комнатной температуре в течение 1 часа. Затем смесь переносили в делительную воронку. Органическую фазу выделяли и промывали соляным раствором и сушили. После удаления растворителя неочищенный продукт далее очищали с помощью колоночной хроматографии (смесь 5% ацетона/EtOAc) и затем перекристаллизовывали из простого эфира/гексана, получая 4,4 г (21%) третбутоксикарбониламино-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-8-она, МС: 374(М+Н)+, tпл 177,5-178oC, [α]D=-0,852 (МеОН, с=0,983 г/100 мл).
Пример 49
Соединение формулы (ff)
К соединению, полученному в примере 48 (15 г, 0,04 моля), при 0oС добавляли смесь 40% ТФК/СН2Сl2 (50 мл). Полученную смесь перемешивали при комнатной температуре в течение 3,5 ч. Растворители удаляли при пониженном давлении. К полученному остатку добавляли толуол (50 мл) и растворитель вновь удаляли. Эту процедуру повторяли дважды. Остаток сушили в вакууме в течение ночи и распределяли между ЕtOАс/1н. NaOH. Разделяли два слоя. Водный слой экстрагировали EtOAc (3х100 мл), а объединенную ЕtOАс-фазу промывали 1н. NaOH (3х100 мл) и соляным раствором (1х100 мл). Раствор сушили (MgSO4) и упаривали, получая 11 г (100%) 9-(S)-амино-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-8-она.
Пример 50
Соединение формулы (gg)
А. К 4-пентеновой кислоте (28 г, 0,28 моля) в 1 л безводного ТГФ при -78oC добавляли Еt3N (52,6 мл, 0,38 моля). По каплям добавляли пивалоилхлорид (42,5 мл, 0,32 моля). По завершении добавления реакционую смесь нагревали до 0oС и перемешивали в течение еще 1 часа при 0oС и затем охлаждали до -78oC. В делительную колбу, содержащую (S)-4-бензил-2-оксазолидинон (43 г, 0,24 моля) в безводном ТГФ (1 л), при -78oC добавляли трифенилметан (20 мг) в качестве индикатора. По каплям добавляли раствор н-бутиллития в гексане (1,6 М) до получения стабильного желтой окраски. Раствор перемешивали еще в течение 30 минут. Затем этот раствор медленно добавляли к полученному выше смешанному ангидриду и перемешивали в течение 1 часа. Реакцию прекращали добавлением 500 мл разбавленного раствора NH4Cl. ТГФ удаляли и оставшийся раствор экстрагировали простым эфиром (3х500 мл). Объединенные эфирные экстракты сушили над MgSO4 и концентрировали, получая 64,9 г (S)-4-бензил-3-пент-4-еноилоксазолидин-2-она, МС:259(М+).
Б. К (S)-4-бензил-3-пент-4-еноилоксазолидин-2-ону (64,9 г, 0,25 моля) в безводном ТГФ (700 мл) при -78oC по каплям добавляли бис(триметилси-лил)амид натрия в ТГФ (1,0 М, 275 мл, 0,28 моля). После перемешивания в течение еще 1 часа при -78oC по каплям добавляли третбутилбромацетат (44,3 мл, 0,30 моля). Смесь перемешивали в течение 4 часов при -78oC и затем реакцию прекращали с помощью разбавленного раствора NH4Cl (200 мл). После удаления ТГФ водный слой экстрагировали простым эфиром (3х300 мл). Эфирные слои промывали соляным раствором (200 мл), сушили и упаривали, получая 109,7 г неочищенного продукта. После очистки с помощью хроматографии на колонках (смесь 5% ацетона/гексан) получали 41,3 г чистого третбутилового эфира (R)-3-(S-4-бензил-2-оксооксазолидин-3-карбонил)гекс-5-еновой кислоты, МС:373(М+).
В. К третбутиловому эфиру (R)-3-(3-4-бензил-2-оксооксазолидин-3-карбонил)гекс-5-еновой кислоты (25 г, 0,067 моля) в 300 мл ТГФ/воды (1/1) при 0oС добавляли гидроксид лития (11,5 г, 0,268 моля) и перекись водорода (30%-ная, 31,1 мл, 0,268 моля). После перемешивания при 0oС в течение 20 минут реакционную смесь перемешивали при комнатной температуре в течение 2 часов. ТГФ удаляли и оставшийся раствор подкисляли до рН 2, насыщали NaCl и экстрагировали EtOAc (2х150 мл). Объединенные ЕtOАс-экстракты экстрагировали 10%-ным К2СО3 (4х30 мл). Объединенные К2СО3-слои промывали Et2O (2х100 мл). К оставшемуся К2СО3- раствору добавляли EtOAc (200 мл) и раствор при 0oС подкисляли до рН 2. После насыщения NaCl два слоя разделяли. Водный слой экстрагировали EtOAc (3х100 мл). Объединенные EtOAc-растворы сушили и упаривали, получая чистый третбутиловый эфир 2-(R)-аллилянтарной кислоты, МС:215(М+Н+).
Пример 51
Соединение формулы (hh)
К раствору, содержащему третбутиловый эфир 2-(R)-аллилянтарной кислоты (5 г, 0,00234 моля) и 9-(S)-амино-4-окса-,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-8-он (6,38 г, 0,00234 моля) в 50 мл ДМФ, добавляли ГОБТ (3,47 г, 0,026 моля), ДМАП (80 мг), N-метилморфолин (2,84 г, 0,028 моля) и ЭДКИ (6,69 г, 0,035 моля). Смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь разбавляли EtOAc (300 мл) и промывали соляным раствором (2х100 мл), насыщенным NaHCO3 (2х100 мл) и соляным раствором (1х100 мл) и сушили (MgSO4). После удаления растворителей получали 9 г неочищенного продукта. После очистки с помощью колоночной хроматографии (смесь 50% EtOAc/CH2Cl2) получали 7,5 г чистого третбутилового эфира (3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гекс-5-еновой кислоты, МС:469(М+).
Пример 52
Соединение формулы (ii)
Соединение, полученное в примере 51 (1,5 г, 3,2 ммоля), мета-йодфенол (0,70 г, 3,2 ммоля), NaHCO3 (0,672 г, 8 ммолей), н-тетрабутиламмонийхлорид (0,89 г, 3,2 ммоля) и Рd(ОАс)2 (72 мг) в 10 мл ДМФ выдерживали при 90oС в течение 15 минут. Раствор разбавляли 50 мл EtOAc и промывали соляным раствором (4х25 мл), сушили и упаривали. Неочищенный продукт очищали с помощью колоночной хроматографии (смесь 50% EtOAc/CH2Cl2), получая 1,5 г третбутилового эфира (3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-(3-гидроксифенил)гекс-5-еновой кислоты, МС:562,4 (М+Н)+.
Пример 53
Соединения формулы (Iv')
Полученное в примере 52 соединение (1,5 г) в 40 мл ЕtOH гидрировали с 1,4 г Pd/C (10%-ный) в течение 12 часов. Раствор фильтровали через подушку из целита и промывали ЕtOН (10 мл). Фильтрат упаривали, получая 1,34 г (89%) третбутилового эфира (3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] oктадека-11(18),12,14,16-тетраен-9-илкарбамоил)-6-(3-гидроксифенил) гексановой кислоты, МС:564,2(М+Н)+.
Пример 54
Соединения формулы (Iv)
Полученное в примере 53 соединение (1,34 г, 0,0024 моля) и тиоанизол (2,58 г, 0,024 моля) в 15 мл смеси 30% ТФК/СН2Сl2 перемешивали при комнатной температуре в течение 1,5 часа. Растворители удаляли. К полученному остатку добавляли толуол (50 мл), который затем удаляли при пониженном давлении. Процедуру повторяли несколько раз для удаления всех остатков ТФК. Образовавшийся твердый остаток перемешивали в горячем EtOAc (10 мл) в течение 10 минут, охлаждали до комнатной температуры, фильтровали и промывали простым эфиром, получая 400 мг чистой (3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-6-(3-гидроксифенил)гексановой кислоты, МС:508,2(М+Н)+.
По описанным в примерах 51-54 методикам аналогичным образом получали следующие соединения:
(3R,9S)-6-(4-гидроксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил) гексановую кислоту, МС:562,2(М-Н-);
(3R,9S)-6-(4-метоксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановую кислоту, МС:520,1(М+);
(3R,9S)-3-(8-oкco-4-oкca-l,7-диaзaтpициклo[9.6.1.012,17]oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(3-пиперидин-1-илпропокси)фенил] гексановую кислоту, МС:631,1(М-Н+);
(3R, 9S)-6-[4-(3-диметиламинопропокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1. 12,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановую кислоту, МС:591,1(М-Н+);
(3R, 9S)-6-[4-(2-диметиламиноэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановую кислоту, МС:577,1(М-Н+);
(3R, 9S)-6-(4-цианфенил)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.0. 12,17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановую кислоту, МС: 515,1(М-Н+);
(3R,9S)-6-нафталин-2-ил-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил) гексановую кислоту, МС:542,3(М+Н+);
(3R, 9S)-3-(8-oкco-4-oкca-l, 7-диaзaтpициклo [9.6.1.012,17] oктaдeкa-11(18),12,14,16-тетраен-9-илкарбамоил)-6-(4-пиррол-1-илфенил) гексановую кислоту, МС:557(М+Н+);
(3R, 9S) -6- (4-гидрокси-З-метилфенил) -3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил) гексановую кислоту, МС:522,3(М+Н+);
(3R,9S)-6-(4-аминофенил)-3-(8-оксо-4-окса-1,7-диазатрициклo [9.6.1.012,17] oктaдeкa-11(18), 12,14,16-тeтpaeн-9-илкapбaмoил)гeкcaнoвyю кислоту, МС:505,1(М-Н+);
(3R, 9S)-6-(4-ацетиламинофенил)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил) гексановую кислоту, МС:547,8(М-Н-);
(3К, 9S)-6-[4-(2-гидроксиэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012,17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановую кислоту, МС:550,1(М-Н-); и
(3R,9S)-3-(8-oкco-4-oкca-l,7-диaзaтpициклo[9.6.1.012,17]oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(2-пирролидин-1-илэтокси)фенил] гексановую кислоту, МС:605,5(М+Н+).
Пример 55
Соединения формул (Is) и (It)
К раствору, содержащему 4-третбутиловый эфир 2-(R)-изобутилянтарной кислоты (317 мг, 1,45 ммоля) и 9-амино-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-8-он (330 мг, 1,21 ммоля) в 30 мл ДМФ, добавляли ГОБТ (163 мг, 1,2 ммоля), ДМАП (50 мг), N-метилморфолин (0,16 мл, 1,45 ммоля) и ЭДКИ (348 мг, 1,8 ммоля). Смесь перемешивали при комнатной температуре в течение ночи. После удаления ДМФ при пониженном давлении остаток растворяли в EtOAc (60 мл) и соляном растворе (20 мл). Органический слой промывали соляным раствором (2х50 мл) и насыщенным NаНСО3 (2х50 мл) и сушили. После удаления растворителя полученный таким образом неочищенный продукт очищали с помощью колоночной хроматографии (смесь от 30 до 50% EtOAc/CH2Cl2), получая 466 мг чистого третбутилового эфира (3R,9S)-5-метил-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановой кислоты.
Б. Полученный на предыдущей стадии третбутиловый эфир (460 мг, 0,9 ммоля) перемешивали при комнатной температуре в течение ночи в 15 мл раствора трифторуксусной кислоты/метиленхлорида. Растворители удаляли. К полученному остатку добавляли метиленхлорид, который затем удаляли. Эту процедуру повторяли несколько раз для удаления любых остатков ТФК. Образовавшийся остаток кристаллизовали из ЕtАс/СН2Сl2/гексана (4:1:3), получая 100 мг (3R, 9S)-5-метил-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил гексановой кислоты, tпл 193-194oС.
Аналогичным образом получали следующие соединения:
(3R,9S)-3-циклобутилметил-N-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-ил)сукцинамовую кислоту, МС:456,2(М+Н+);
(3R,9S)-3-(8-oкco-4-oкca-l,7-диaзaтpициклo[9.6.1.012+17]oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-5-феноксипентановую кислоту, МС:493(M+);
(3R,9S)-5-(4-хлорфенокси)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)пентановую кислоту, МС:526,3(М-Н-);
(3R,9S)-3-(8-oкco-4-oкca-l,7-диaзaтpициклo[9.6.1.012,17]oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановую кислоту, tпл 190-193oС.
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012,17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-5-фенилпентановую кислоту, МС:478,3(M+H+);
(2R,9S)-3-(8-oкco-4-oкca-l,7-диaзaтpициклo[9.6.1.012,17]oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-фенилгексановую кислоту, МС:492,3(М+Н+); и
(3R,9S)-5-(4-метоксифенил)-3-(8-оксо-4-окса-1,7-диазатрициклo[9.6.1.012,17] oктaдeкa-11(18), 12,14,16-тeтpaeн-9-илкapбaмoил)пeнтaнoвyю кислоту, МС:508(М+Н+).
Пример 56
Соединения формулы (Iu)
третбутиловый эфир (3R,9S)-6-[4-(3-гидроксипропокси)фенил]-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановой кислоты (1,56 г, 2,5 ммоля) растворяли в 50 мл EtOH, насыщенного HCl. Смесь перемешивали при комнатной температуре в течение ночи. Затем растворитель удаляли и неочищенный продукт очищали с помощью колоночной хроматографии (смесь от 50 до 80% EtOAc/метиленхлорид), получая 0,88 г (59%) чистого этилового эфира (3R,9S)-6-[4-(3-гидроксипропoкcи)фeнил] -3-(8-oкco-4-oкca-1,7-диaзaтpициклo[9.6.1.012,17] oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановой кислоты, МС:594,0(М+Н+).
Аналогично получали следующие соединения:
этиловый эфир (3R,9S)-5-(4-хлорфенокси)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)пентановой кислоты, МС:556,3(М+); и
этиловый эфир (3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикo [l9.6.1.012,17] oктaдeкa-11(18),12,14,16-тeтpaeн-9-илкapбaмoил)-5-феноксипентановой кислоты, МС:521(М+).
Пример 57
Соединения формулы (Iw)
А. К третбутиловому эфиру (3R,9S)-6-(4-гидроксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановой кислоты (1,0 г, 1,72 ммоля) в ДМФ (20 мл) при 0oС добавляли 3-йодпропанол (363 мг, 1,95 ммоля) и карбонат цезия (636 мг, 1,95 ммоля). Затем смесь перемешивали при комнатной температуре в течение 2,5 ч. ДМФ удаляли при пониженном давлении. Полученный остаток растворяли в EtOAc (70 мл) и соляном растворе (40 мл). Слой EtOAc промывали соляным раствором и сушили (MgSO4). После удаления растворителей получали чистый третбутиловый эфир (3R, 9S)-6-[4-(3-гидроксипропокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил гексановой кислоты (1,1 г, 100%), МС:622,4(М+Н+).
Б. Соединение, полученное на вышеуказанной стадии, затем превращали в соответствующую кислоту, а именно, (3R,9S)-6-[4-(3-гидроксипропокcи)фeнил] -3-(8-окco-4-oкca-l,7-диазатрицикло [9.6.1.012,17]oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановую кислоту, по методике, описанной в примере 55Б. Полученное соединение имело МС:564,9(М-Н-) и 566,1(М+Н+).
Аналогично получали следующие соединения:
(3R,9S)-6-[4-(2-метоксиэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановую кислоту, МС:564,2(М-Н-);
(3R, 9S)-6-(4-бензилоксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановую кислоту, МС:598,3(М+Н+);
(3R,9S)-6-[4-(4-аминобутокси)фенил]-3-(8-оксо-4-окса-1,7-5 диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил) гексановую кислоту, МС:579,3(М+Н+); и
(3R, 9S)-3-(8-oкco-4-oкca-l, 7-диaзaтpициклo [9.6.1.012,17] oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(пиридин-4-илметокси)фенил] гексановую кислоту, МС:599,2(М+Н+), tпл 169,5-171,2oС.
Пример 58
Соединения формулы (I), в которых m и n равны 2, А обозначает кислород, R1 обозначает -CH2-R4, где R4 обозначает гидроксиаминокарбонил
(3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановую кислоту подвергали сочетанию с O-бензилгидроксиамином по методике, описанной в примере 36, получая (3R, 9S)-N-бензилокси-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексанамид. Согласно методу, описанному в примере 37, это соединение далее превращали в (3R,9S)-N-гидрокси-3-(8-оксо-4-окса-1,7- диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексанамид, МС:506(М+Н+), tпл 224-225oC.
Пример 59
Соли соединений формулы (I)
(3R, 9S)-3-оксо-4-окса-и-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановую кислоту превращали в соответствующую соль трифторуксусной кислоты, перемешивая соединение в смеси 15% трифторуксусной кислоты/метиленхлорид в течение 10 минут. Растворители удаляли. К остатку добавляли метиленхлорид. Затем растворитель удаляли. Эту процедуру повторяли несколько раз для удаления любых следов трифторуксусной кислоты. Полученный продукт имел температуру плавления 158-160oС.
Аналогично получали следующие соединения:
трифторацетат (3R, 9S)-3-(8-оксо-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановой кислоты;
трифторацетат (3R,10S)-3-(9-оксо-1,8-диазатрициклo [10.6.l.013,18] нoнaдeкa-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)-6-пиридин-3-илгексановой кислоты; и
трифторацетат (3R, 10S)-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил-6-пиридин-4-илгексановой кислоты.
Пример 60
Превращение солей соединений формулы (I) в соответствующее свободное основание
Гидрохлорид (3R,9S)-этил-3-(8-оксо-4-окса-1,7 -диазатрицикло [9.6.1.012,17] oктaдeкa-11(18),12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексаноата перемешивали в CH2Cl2/насыщенном Na2CO3 в течение 10 минут. Органический слой отделяли, сушили и упаривали. Неочищенный продукт кристаллизовали из СН2Сl2/гексана, получая (3R,9S)-этил-3-(8-оксо-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексаноат, tпл 203-205oС.
Пример 61
В данном примере представлено получение репрезентативных фармацевтических композиций для орального применения, содержащих соединение формулы (I) или его фармацевтически приемлемую соль, например, (3R,10S)-N-гидрокси-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)гексанамид:
А. Ингредиенты - мас.%
соединение формулы (I) - 20,0
лактоза - 79,5
стеарат магния - 0,5
Вышеуказанные ингредиенты смешивают и заполняют ими желатиновые капсулы с твердой оболочкой, каждая из которых содержит по 100 мг композиции, одна капсула должна включать приблизительно полную суточную дозу.
Б. Ингредиенты - мас.%
соединение формулы (I) - 20,0
стеарат магния - 0,9
крахмал - 8,6
лактоза - 79,6
ПВП (поливинилпирролидин) - 0,9
Вышеуказанные ингредиенты, за исключением стеарата магния, смешивают и гранулируют, используя воду в качестве жидкости для гранулирования. Затем состав сушат, смешивают со стеаратом магния и с помощью соответствующей таблетирующей машины формуют таблетки.
B. Ингредиенты - г
соединение формулы (I) - 0,1
пропиленгликоль - 20,0
полиэтиленгликоль 400 - 20,0
полисорбат 80 - 1,0
вода - q.s. до 100 мл
Соединение формулы (I) растворяют в пропиленгликоле, полиэтиленгликоле 400 и полисорбате 80. Затем при перемешивании добавляют воду в количестве, достаточном для получения 100 мл раствора, который фильтруют и разливают во флаконы.
Г. Ингредиенты - мас.%
соединение формулы (I) - 20,0
арахисовое масло - 78
Спан 60 - 2,0
Вышеуказанные ингредиенты расплавляют, перемешивают и заполняют ими мягкие эластичные капсулы.
Пример 62
В данном примере представлено получение репрезентативной фармацевтической композиции для парентерального введения, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, например, (3R,11S)-N-гидрокси-5-метил-3-(10-оксо-1,9-диазатрициклo [11.6.1.014,19] эйкоза-13(20), 14(19),15,17-тетраен-11-илкарбамоил)гексанамид:
Ингредиенты - г
соединение формулы (I) - 0,02
пропиленгликоль - 20,0
полиэтиленгликоль 400 - 20,0
Полисорбат 80 - 1,0
0,9%-ный физиологический раствор - q.s. до 100 мл
Соединение формулы (I) растворяют в пропиленгликоле, полиэтиленгликоле 400 и полисорбате 80. Затем при перемешивании добавляют 9%-ный физиологический раствор в количестве, достаточном для получения 100 мл раствора для внутривенного вливания, который фильтруют через мембранный фильтр с размером пор 0,2 мкм и фасуют в стерильных условиях.
Пример 63
В данном примере представлено получение репрезентативной фармацевтической композиции в форме суппозитория, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, например, (10S)-2-меркаптометил-4-метил-N-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18), 14,16-тетраен-10-илкарбамоил)пентанамид:
Ингредиенты - мас.%
соединение формулы (I) - 1,0
полиэтиленгликоль 1000 - 74,5
полиэтиленгликоль 4000 - 24,5
Ингредиенты расплавляют вместе, смешивают в паровой бане и разливают в формы, содержащие 2,5 г общего веса.
Пример 64
В данном примере представлено получение репрезентативной фармацевтической композиции для инсуфляции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, например, (10S)-4-метил-2-(9-оксо-1,8-диазатрицикло [10.6.1.013,18] нонадека-12(19), 13(18),14,16-тетраен-10-илкарбамоил)пентил(хинолин-2-илтиометил)фосфиновую кислоту:
Ингредиенты - мас.%
тонкоизмельченное соединение формулы (I) - 1,0
тонкоизмельченная лактоза - 99,0
Ингредиенты измельчают, смешивают и упаковывают в инсуфлятор, снабженный дозирующим насосом.
Пример 65
В данном примере представлено получение репрезентативной фармацевтической композиции для распыления, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, например, (3R,10S)-N-гидрокси-5-метил-3-(9-оксо-1,8-диазатрицикло [10.6.1.013,18]нонадека-12(19),13(18),14,16-тетраен-10-илкарбамоил)гексанамид:
Ингредиенты - мас.%
соединение формулы (I) - 0,005
вода - 89,995
этанол - 10,000
Соединение формулы (I) растворяют в этаноле и смешивают с водой. Затем композицию упаковывают в распылитель, снабженный дозирующим насосом.
Пример 66
В данном примере представлено получение репрезентативной фармацевтической композиции в аэрозольной форме, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, например, (3R,11S)-N-гидрокси-5-метил-3-(10-oкco-l, 9-диaзaтpициклo[11.6. l. 014,19] эйкoзa-13(20), 14(19), 15,17-тетраен-11 -илкарбамоил)гексанамид:
Ингредиенты - мас.%
соединение формулы (I) - 0,10
пропеллент 11/12 - 98,90
олеиновая кислота - 1,00
Соединение формулы (I) диспергируют в олеиновой кислоте и препеллентах. Затем образовавшуюся смесь заливают в аэрозольный контейнер, снабженный мерным клапаном.
Пример 67
Анализ in vitro
Коллагеназу типа I фибробласта очищали от бессывороточной среды для культивирования клеток GM0010A, стимулированной форболмеристатацетатом (ФМА), с помощью гепариновой и цинк-хелатирующей сефарозных колонок с последующей жидкостной экспресс-хроматографией белков (колонка типа MONO S). Фермент активировали путем инкубации с трипсином.
Коллагеназу типа IV очищали от содержащей сыворотку среды для культивирования клеток фибробласта (GM0010A) с помощью цинк-хелатирующей и желатин-сефарозной колонок с последующей жидкостной экспресс-хроматографией белков (колонка типа MONO S). Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ПААГ-ДСН) показал, что фермент является гомогенным. Фермент активировали путем инкубации с 1 ммолем аминофенилацетата ртути (АФАР) в течение 1 ч при 35-37oС.
Соединения формулы (I) растворяли в ДМСО и добавляли в кювету, содержащую 0,2 мкг коллагеназы типа I или 0,03 мкг коллагеназы типа IV в 1 мл ТС-буфера (20 мМ Трис, 5 мМ СаС12, рН 7,5) (конечная концентрация ДМСО 2%). Концентрации соединений формулы (I) выбирали таким образом, чтобы для каждых 20% изменения активности иметь по крайней мере одну экспериментальную точку. Ферменту и соединению давали возможность пройти предварительную 3-минутную инкубацию при 37oС. Для инициирования реакции к каждым 20 нМ добавляли N-(7-диметиламино-4-метил)кумаринил ("DACM") (фирма Sigma) и тиопептид (Ac-Pro-Leu-Gly-S-"Leu"-Leu-Gly-OEt, фирма Bachem Bioscience Inc.). Флуоресценцию регистрировали при длинах волн возбуждения и эмиссии 395 и 485 нм соответственно. Каждую экспериментальную точку получали осреднением по двукратному эксперименту. Для определения значения IC50 с помощью программы Enzfitter использовали по крайней мере шесть экспериментальных точек, показывающих зависимость изменения флуоресценции в минуту от концентрации соединения.
Этот анализ подтверждает, что соединения формулы (I) обладают способностью ингибировать коллагеназы.
Пример 68
Анализ in vitro
Этот анализ позволяет определить, обладают ли соединения формулы (I) способностью ингибировать выход 35S-меченных гликозаминогликанов (GAG) из хрящевых эксплантатов.
Небольшие хрящевые эксплантаты (3 мм в диаметре) получали из коленных суставов свежеумервщленных быков и метили с помощью 35S4.35S-меченные гликозаминогликаны (GAG) выходят в питательную среду в ответ на добавление rhIL-1-альфа, индуцирующего экспрессию хондроцитных матричных металлопротеаз (ММП), включая стромелизин и коллагеназу. Процент ингибирования меченых GAG был скорректирован с учетом спонтанного выхода при отсутствии rhIL-1-альфа. Результаты для каждой группы представляют собой средние значения ± среднеквадратичная ошибка по пяти эксплантатам.
Соединения формулы (I) при тестировании этим методом проявили способность ингибировать выход 35S-меченных GAG из хрящевых эксплантатов.
Пример 69
Анализ in vitro
Для изучения in vitro влияния соединений формулы (I) на резорбцию кости в качестве модели использовали длинную кость крысиного эмбриона. Для индуцирования резорбции кости in vitro использовали бычий паращитовидный гормон (ПЩГ). Влияние на резорбцию кости определяли по количеству 45Са, вышедшего в питательную среду из предварительно 45Са-меченных длинных костей крысиных эмбрионов. Ингибирующее действие соединений формулы (I) по отношению к индуцируемой бычьим ПЩГ резорбции кости выражали в виде среднего процента ингибирования ± среднеквадратичная ошибка.
Предварительно 45Са-меченные длинные кости крысиных эмбрионов (из предплечья) рассекали и культивировали в чашках Linbro при 37oС в течение ночи в среде BGJb с добавлением 1 мг/мл БСА. В каждой группе использовали по пять пар костей. Соединения формулы (I) предварительно растворяли в этаноле, затем разбавляли до различных концентраций и добавляли в первый день одновременно с бычьим ПЩГ (1-34) в концентрации 1х10-8М в первый день. Концентрации этанола в растворах соединений были ниже 0,05%, что не оказывало влияния на анализ. Анализ заканчивали на шестой день с одной заменой среды на третий день.
В конце каждой замены среды подсчитывали количество 45Са, присутствующее в среде для культивирования. Оставшиеся кости разлагали с помощью 0,1н. НСl и также подсчитывали количество 45Са, присутствующее в продукте разложения кости. Результаты выражали в виде процентов по отношению к общему количеству 45Са, вышедшему из каждой пары костей. Бычий ПЩГ в концентрации 1x10-8M индуцирует резорбцию кости до максимального уровня, который принимается за 100%, и эту концентрацию использовали в качестве стандарта. За 0% принимали уровень базисной линии резорбции кости в присутствии только среды. Все обработанные соединением группы сравнивали с таковыми, обработанными бычьим ПЩГ (1-34) в концентрации 1х10-8М. Концентрации, при которых соединение ингибировало резорбцию кости на 50%, обозначали как IC50.
Соединения формулы (I) при тестировании этим методом проявили способность ингибировать резорбцию кости, индуцируемую бычьим ПЩГ.
Пример 70
Анализ in vitro
А. Выделение ММП для анализов
Каталитический домен коллагеназы-1 человека экспрессировали в виде слитого с убиквитином протеина в Е. coli (Gehring E.R. и др., J. Biol. Chem., 270, 22507, (1995)). После очистки от слитого протеина каталитический домен коллагеназы-1 фибробласта выделяли с помощью обработки в течение 1 часа при 37oС 1 мМ аминофенилацетатом ртути (АФАР) и очистки цинк-хелатирующей хроматографией.
Коллагеназу-2 и желатиназу В человека выделяли в активной форме из лейкоцитарных пленок (Mookhtiar К.А. и др., Biochemistry, 29, 10620, (1990)).
Пропептид и участок каталитического домена коллагеназы-3 человека экспрессировали в Е. coli в виде N-концевого протеина, слитого с убиквитином. После очистки каталитический домен получали с помощью обработки в течение 1 часа при 37oС 1 мМ АФАР и очистки цинк-хелатирующей хроматографией.
Коллагеназу-3 крысы очищали в активной форме из питательной среды клеток гладкой мышцы матки (Roswit W.T. и др., Arch. Biochem. Biophys., 225, 285-295, (1983)).
Каталитическую и фибронектин-подобную часть прожелатиназы А человека экспрессировали в Е. coli в виде протеина, слитого с убиквитином. Опыты проводили на автолитически активизированном материале. Прожелатиназу А крысы выделяли из питательной среды кератиноцитов, стимулированных интерлейкином-1 и активированных с помощью обработки в течение 1 часа при 37oС 1 мМ АФАР с последующим диализом для удаления избытка АФАР.
Простромелизин-1 человека выделяли из питательной среды синовиальных фибробластов с помощью аффинной хроматографии, используя иммобилизованное моноклональное антитело. Зимоген активировали с помощью обработки трипаином (1,5 мкг/мл) в течение 1 часа при 23oС, получая смесь видов с молекулярной массой 45 и 28 кДа.
Каталитический домен стромелизина человека получали путем экспрессии и выделения простромелизина-1 из Е. coli и активации 1 мМ АФАР в течение 1 часа при 37oС с последующим диализом. Простромелизин-1 крысы экспрессировали в клетках яичника китайского хомячка и выделяли из питательной среды. Его активировали 1 мМ АФАР в течение 1 часа при 37oС и очищали с использованием цинк-хелатирующей хроматографии.
Проматрилизин человека экспресировали и выделяли из клеток яичника китайского хомячка (Barnett J. и др., Prot. Expres. Pur., 5, 27, (1994)). Зимоген активировали с помощью обработки 1 мМ АФАР в течение 1 часа при 37oС и очищали с использованием цинк-хелатирующей хроматографии.
Соединения формулы (I) при тестировании этим методом проявили способность ингибировать коллагеназы.
Б. Методика анализа in vitro
Опыты проводили в буфере для анализа (50 мМ Трицин, рН 7,5, 200 мМ хлорид натрия, 10 мМ хлорид кальция, 0,005% среда Brij-35), содержащем 2,5% диметилсульфоксида (ДМСО), поскольку в нем растворяли субстрат и ингибитор. Маточные растворы ингибиторов готовили в 100%-ном ДМСО.
Маточные растворы субстрата готовили в 100%-ном ДМСО в концентрации 2 мМ.
Метод анализа базировался на гидролизе MCA-Pro-Leu-Gly-Leu-DPA-Ala-Arg-NH2 (фирма Bachem, Inc.) при 37oС (Knight C.G. и др., FEBS, 296, 263-266, (1992)). Изменения флуоресценции измеряли с помощью спектрофлуориметра LS-50B фирмы Perkin-Elmer при длине волны возбуждения 328 нм и длине волны эмиссии 393 нм. Используемая в опытах концентрация субстрата [S] составляла 10 мкМ. Для опытов ингибитор разбавляли из раствора в 100%-ном ДМСО и контроли замещали равным объемом ДМСО так, чтобы конечная концентрация ДМСО, полученная при использовании разбавлений ингибитора и субстрата, во всех опытах составляла 2,5%.
Результаты по ингибированию выражали в виде концентрации ингибитора, вызывающей 50%-ное ингибирование (IC50) активности по отношению к контрольной (неингибируемой) реакции.
Соединение - I50, нМ
А - 8,8
Б - 4,2
В - 0,7
Г - 3,9
Д - 4,8
Е - 0,9
А: (3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановая кислота;
Б: (3R,9S)-3-(8-oкco-)1,7-диазатрицикло [9.6.1.012,17] oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановая кислота;
В: (3R,9S)-6-[4-(2-метоксиэтокси)фенил]-3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота;
Г: (3R, 9S)-6-(4-метоксифенил)-3-(8-оксо-4-окса-1,7-диазатрициклo [9.6.1.012,17] oктaдeкa-11(18), l2,14,16-тeтpaeн-9-илкарбамоил)гeкcaнoвaя кислота;
Д: (3R, 9S)-6- [4-(2-гидроксиэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло [9.6.1.012, 17] oктaдeкa-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота;
Е: (3R, 9S)-6-[4-(3-гидроксипропокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло [9. 6.1.012, 17октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота.
Пример 71
Анализ in vitro
Этот анализ позволяет определить, обладают ли соединения формулы (I) способностью ингибировать разложение коллагенового матрикса (на основе данных по высвобождению гидроксипролина) и протеогликана (на основе данных по выходу -S- меченных гликозаминогликанов) из хрящевых эксплантатов.
Небольшие хрящевые эксплантаты (3 мм в диаметре) получали из коленных суставов свежеумерщвленных быков и метили с помощью 35SO4. 35S-меченные гликозаминогликаны (GAG) и фрагменты коллагена выходят в питательную среду в ответ на добавление rhIL-1-альфа, индуцирующего экспрессию хондроцитных матричных металлопротеаз (ММП), включая стромелизин и коллагеназу. Процент ингибирования гидроксипролина и высвобождаемых GAG был скорректирован с учетом спонтанного выхода в отсутствии rhIL-1-альфа.
Соединения формулы (I) при тестировании этим методом проявили способность ингибировать выход как фрагментов коллагена, так и 35S-меченных GAG из хрящевых эксплантатов.
Пример 72
Анализ in vitro
Метод на основе использования имплантации хрящевого штифта позволяет оценить деструкцию коллагенового матрикса хрящевого штифта, имплантированного крысе (Bishop J. и др., J. Pharm. Tox. Methods, 30, 19, (1993)).
Предварительно замороженные хрящевые штифты из назальной области быка весом приблизительно 20 мг вставляли в поливиниловые губки, импрегнированные Mycobacterium tuberculosis, и имплантировали подкожно самкам крыс линии Lewis. Введение препаратов начинали через 9 дней после имплактации и штифты вынимали приблизительно через неделю. Штифты взвешивали, гидролизовали и определяли содержание гидроксипролина. Эффективность определяли путем сравнения группы, обработанной соединением, с группой, обработанной контролем.
Соединения формулы (I) при тестировании этим методом проявили способность ингибировать разложение хрящевых штифтов.
Пример 73
Токсикология
Самкам крыс вводили орально (3R, 9S)-3-(8-оксо-4-окса-1,7-трицикло [9.6.1.012,17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановую кислоту в дозах 75 и 200 мг/кг/день в течение 10
При введении любой из указанных доз не обнаружено никаких патологических изменений, связанных с обработкой.
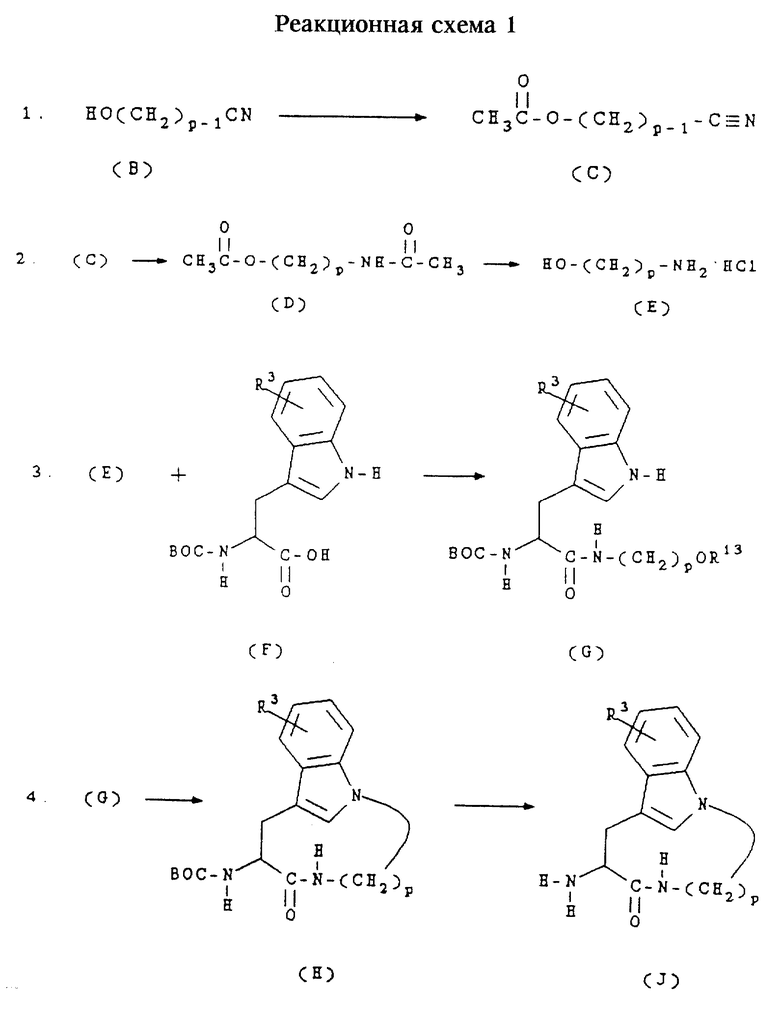
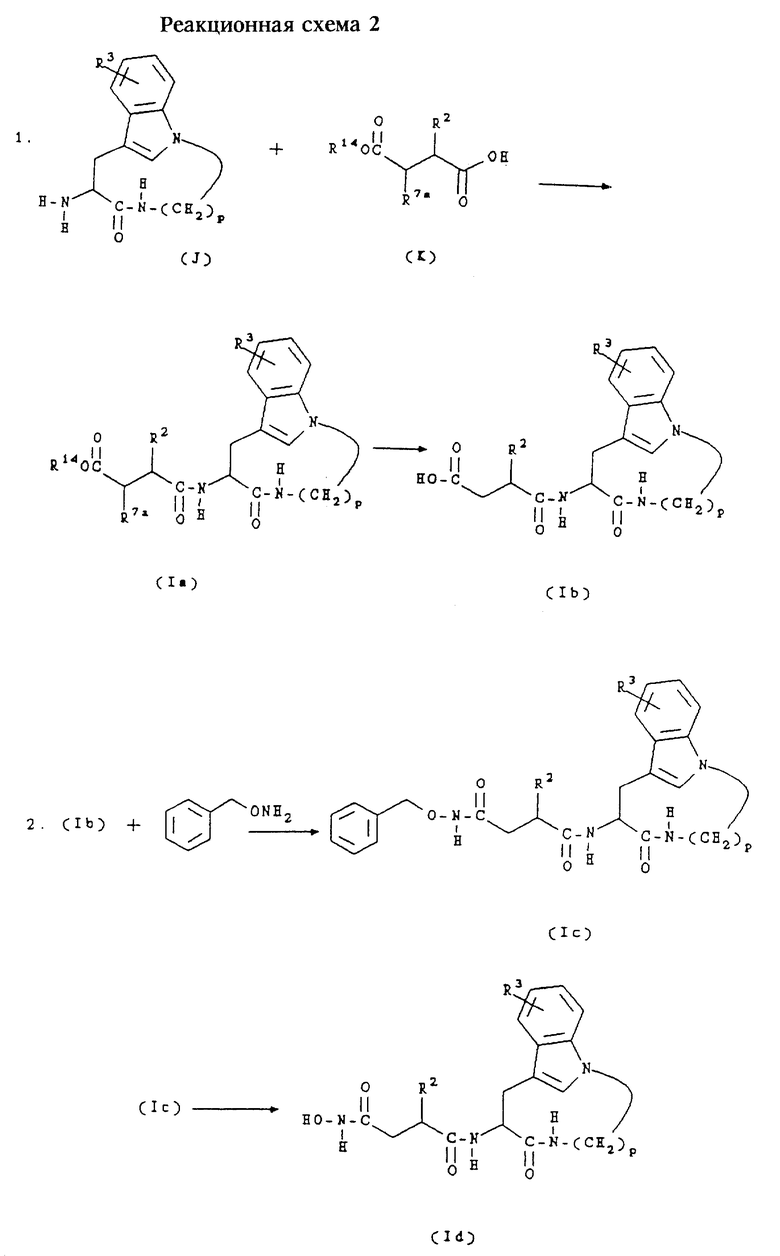
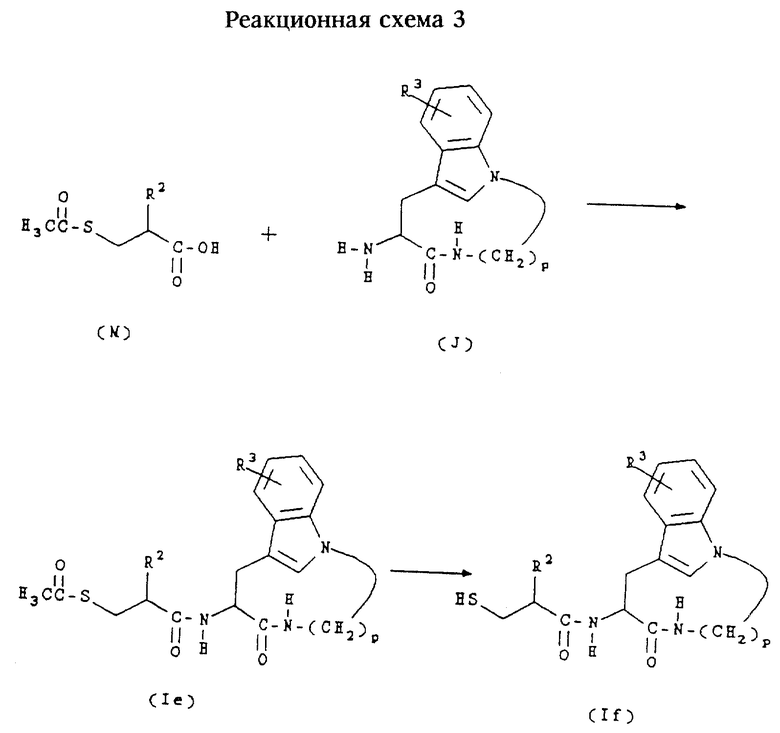
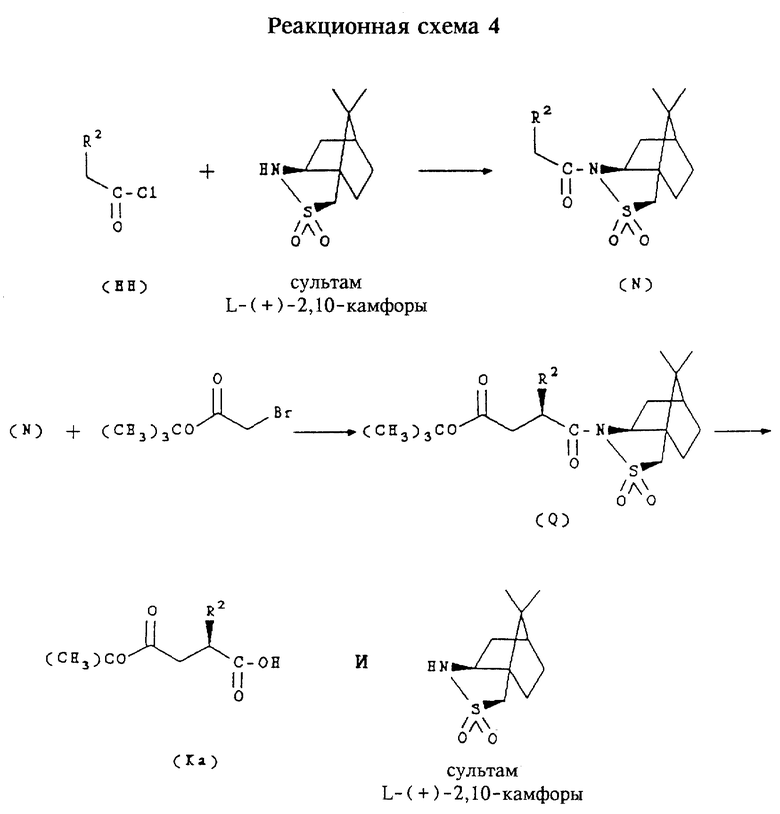
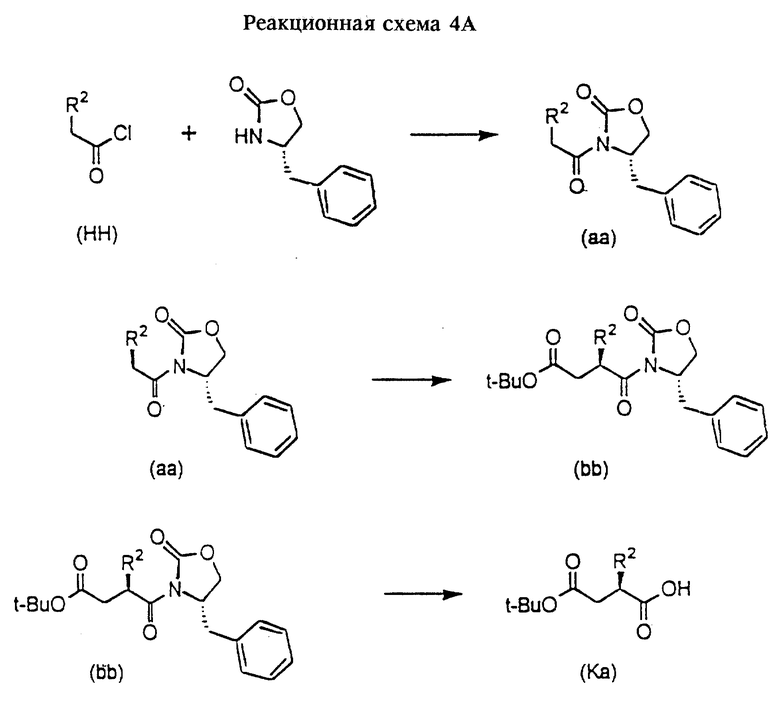
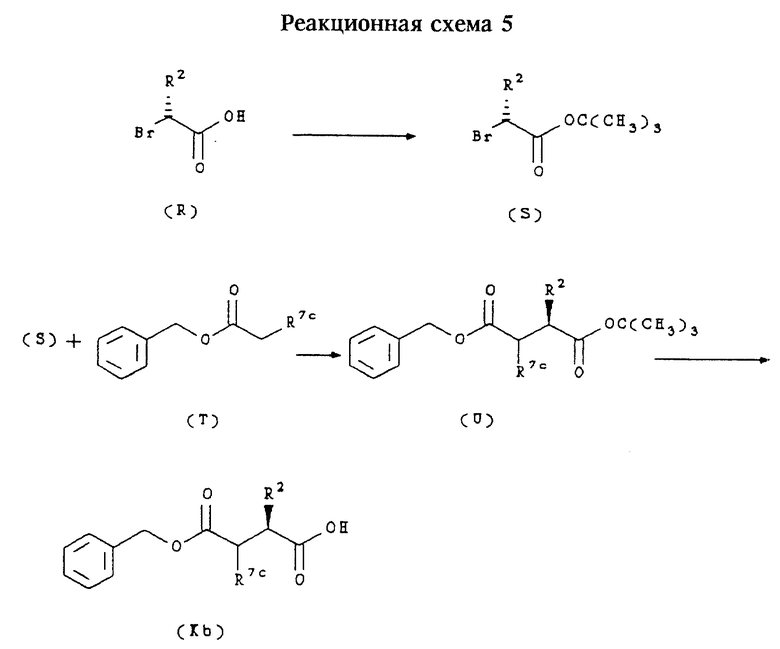
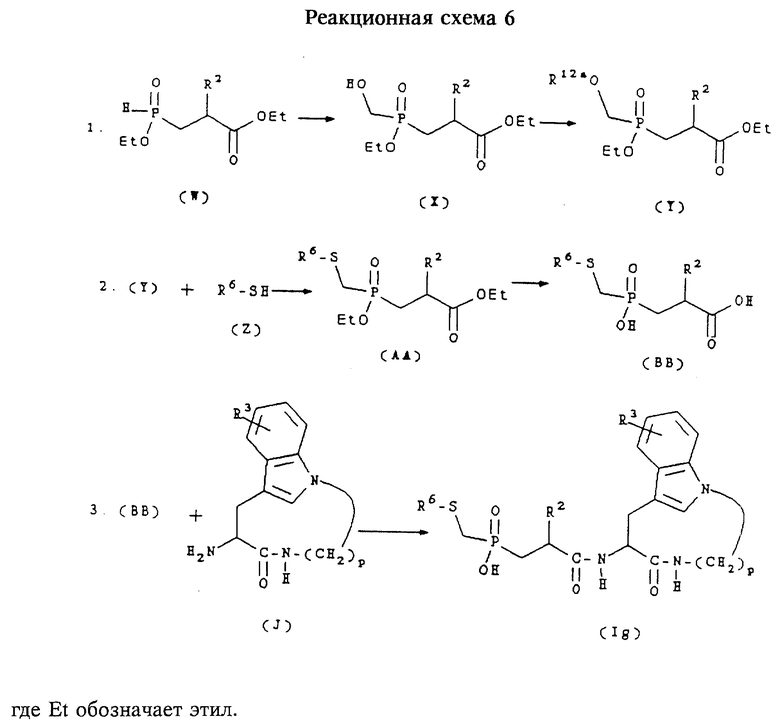
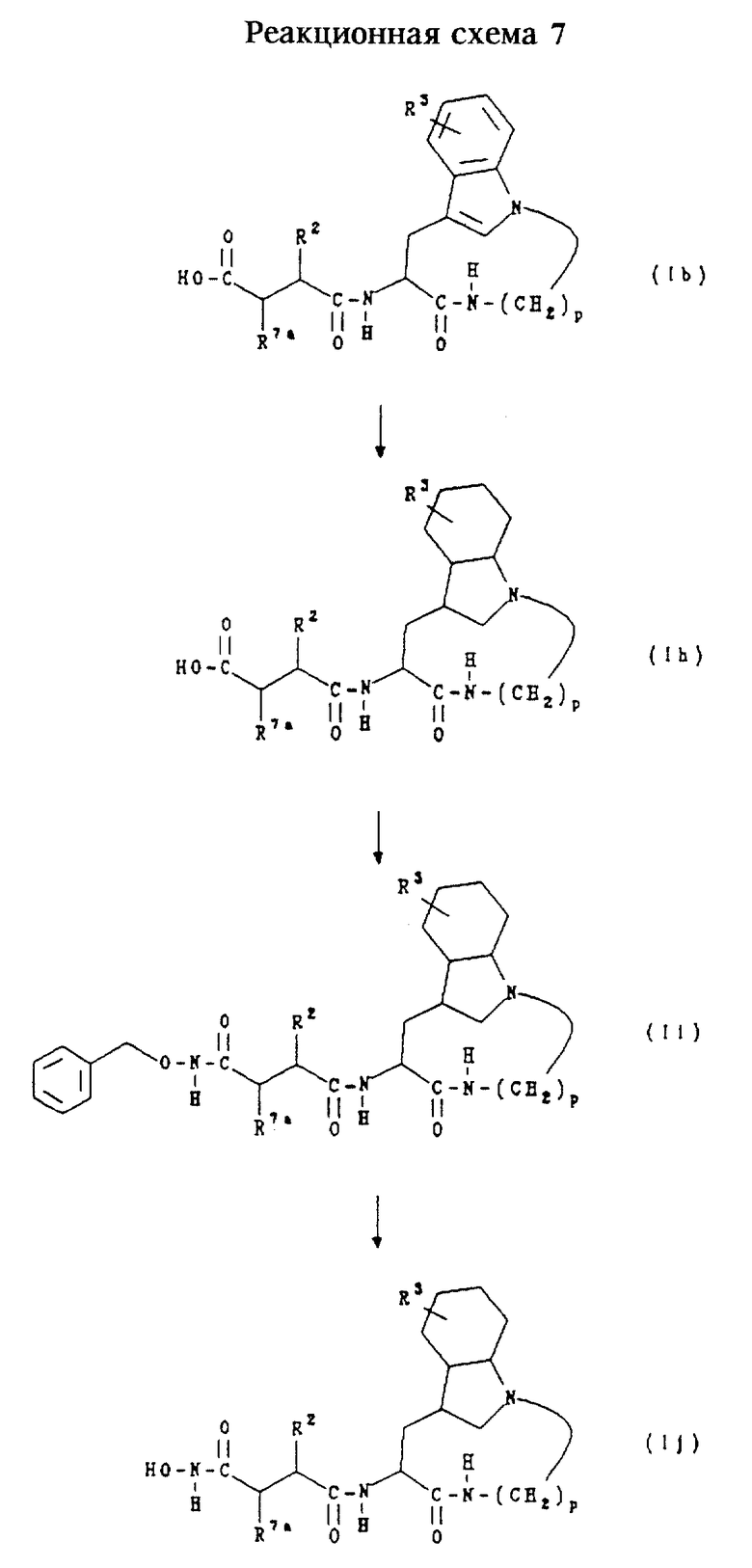
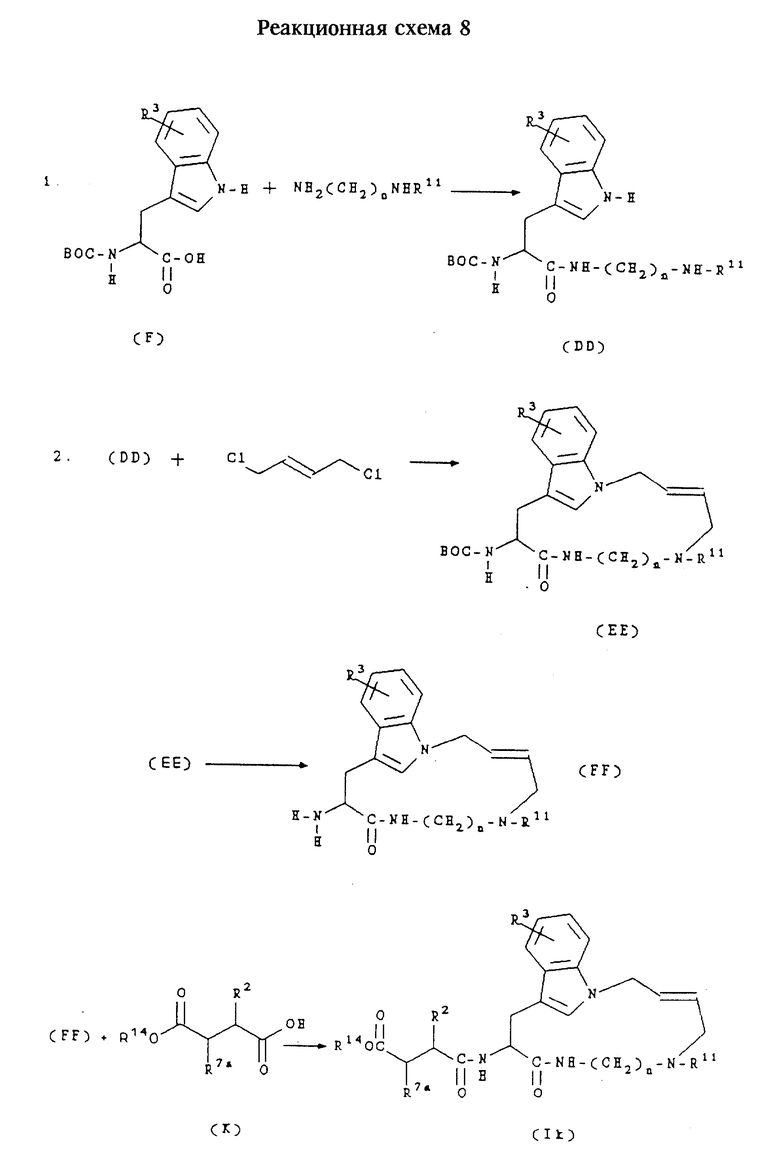
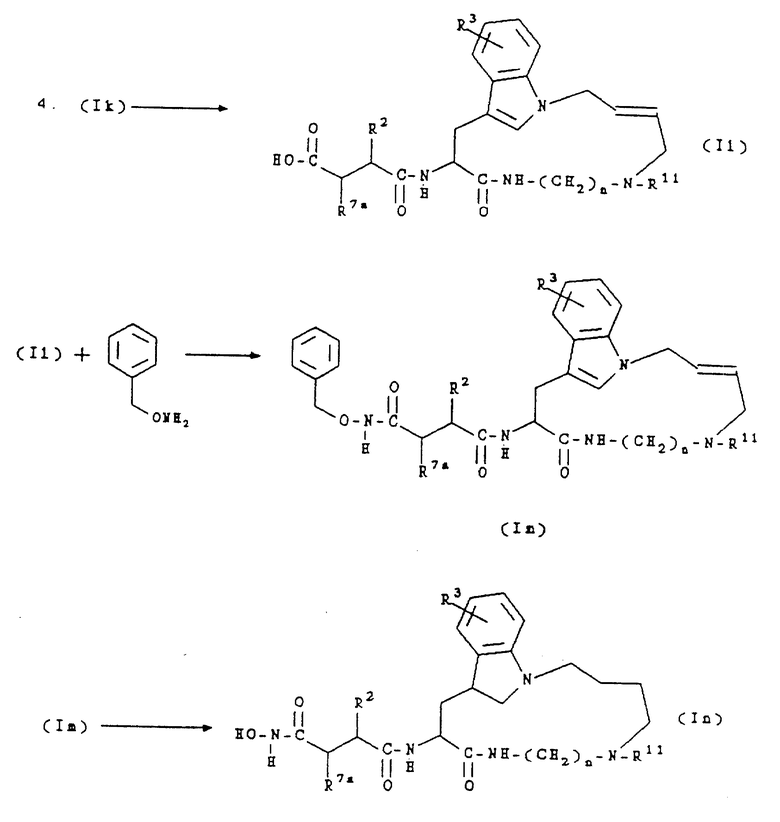

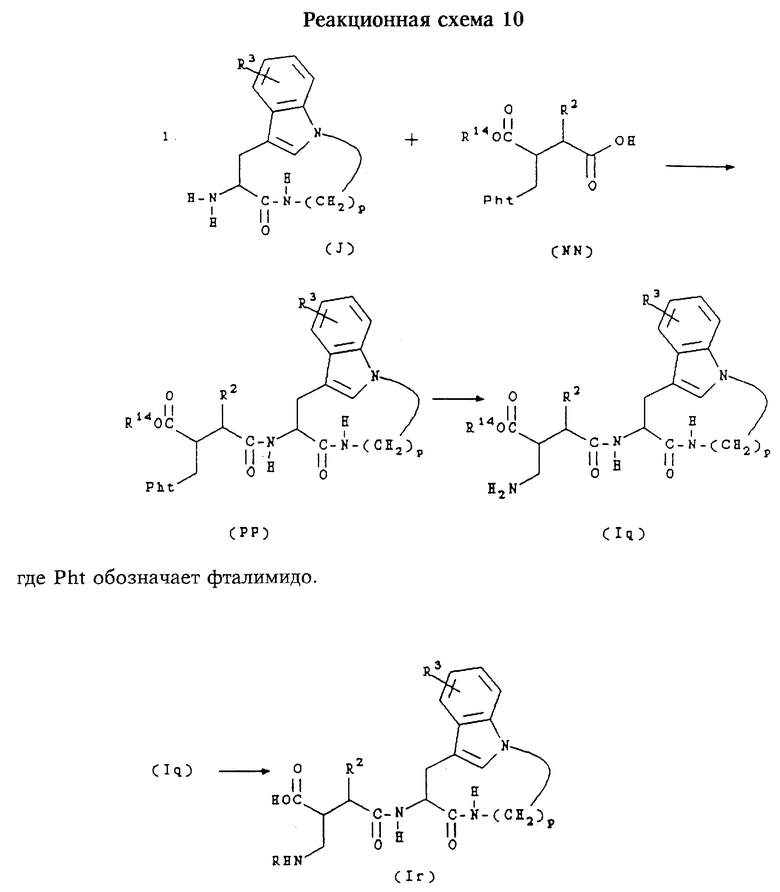
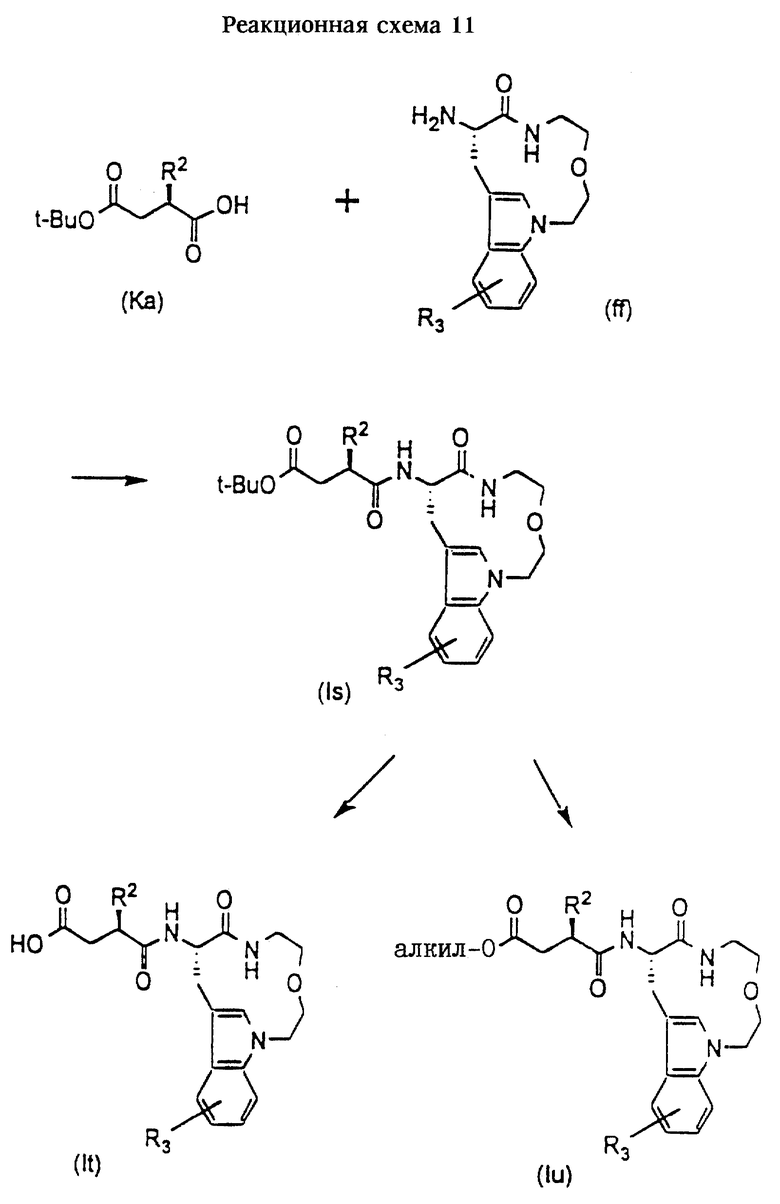

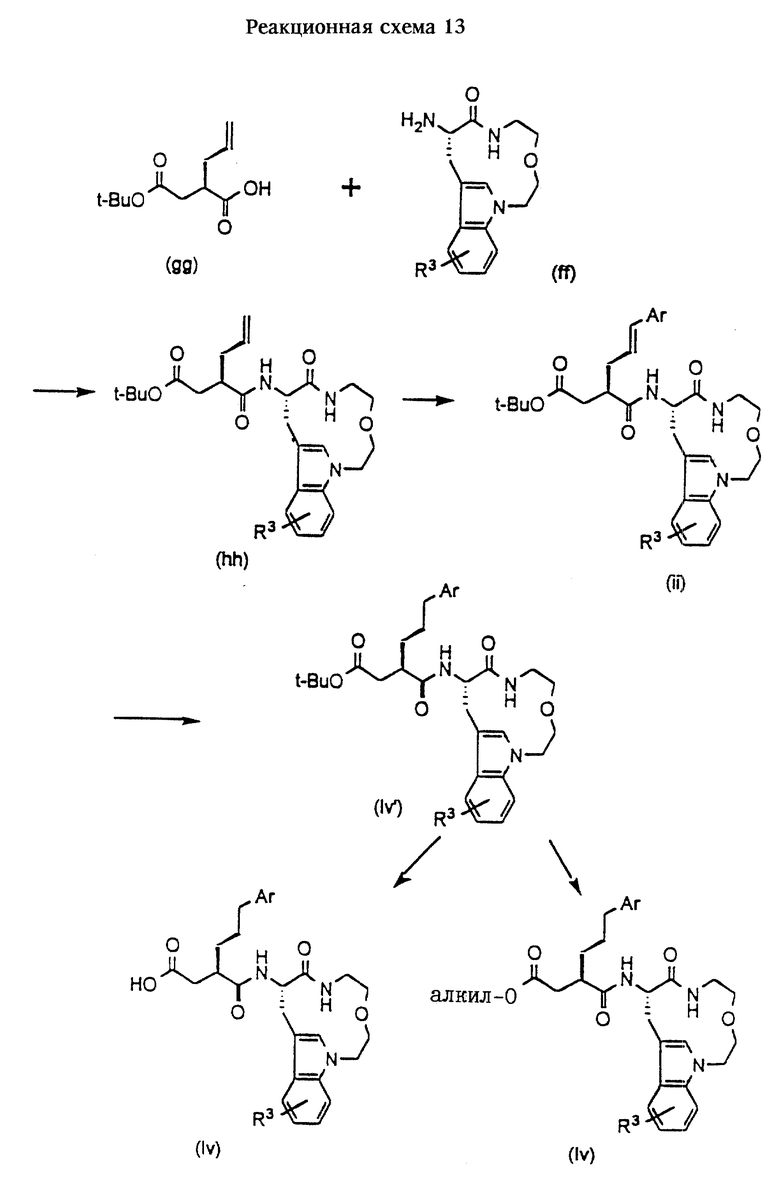
В настоящем изобретении описываются соединения формулы (I), где заместители имеют указанные в описании значения, в виде отдельных стереоизомеров или их смесей и их фармацевтически приемлемые соли, которые ингибируют матричные металлопротеазы, такие, как интерстициальные коллагеназы, и пригодны для лечения болезненных состояний у млекопитающих, облегчаемых при ингибировании таких матричных металлопротеаз, например артритов или болезней, связанных с резорбцией кости, таких, как остеопороз. Описывается также получение фармацевтической композиции, содержащей в качестве активного вещества соединение формулы (I) и фармацевтически приемлемую добавку. 2 c. и 21 з.п.ф-лы.
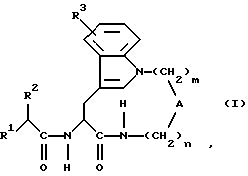
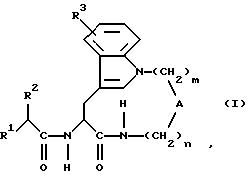
где А обозначает -СН2-, -О- или -NR11-, где R11 обозначает водород или алкил;
m равно 2,3 или 4;
n = 1,2,3 или 4;
R1 обозначает а)-СН2-R4, где R4 обозначает меркапто-, ацетилтио-, карбоксигруппу, аминокарбонил, гидроксиаминокарбонил, N-гидроксиформиламино, алкоксикарбонил, бензилоксикарбонил, бензилоксиаминокарбонил или группу
где R6 обозначает хинол-2-ил; б)-СН(R7)-R8, где R7 обозначает -СН2NHR, где R обозначает водород, -SO2Rа, -С(О)Rа или -С(О)ОRа, где Rа обозначает алкил, трифторметил, фенил, бензил, имидазолил, тиенил, азанафтиридинил или алкиламинокарбонил;
R8 обозначает карбоксигруппу или N-гидроксиаминокарбонил;
R2 обозначает алкил, циклоалкил, циклоалкилалкил, бифенилалкил, пиридинилалкил, нафталенилалкил, тиофенилалкил, феноксиалкил, у которого феноксигруппа может быть замещена галогеном, или фенилалкил, у которого фенильная группа может быть замещена группами, выбранными из гидрокси, алкокси, алкила, пиперидилалкокси, диалкиламиноалкокси, циано, амино, гидроксиалкокси, пирролидинилалкокси, алкоксиалкокси, аминоалкокси, фенил, замещенный пирролилом, ацетиламином, бензилокси или пиридинилалкоксилом;
R3 обозначает водород;
при условии, что когда А обозначает -СН2- или N(R11), R2 не обозначает алкил, циклоалкил или циклоалкилалкил;
или его фармацевтически приемлемая соль.
(3R,9S)-6-(4-гидроксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановая кислота,
(3R, 9S)-6-[4-(3-гидроксипропокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R, 9S)-6-[4-(2-гидроксиэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(2-пирролидин-1-илэтокси)фенил] гексановая кислота,
(3R,9S)-6-(4-метоксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R, 9S)-6-[4-(2-метоксиэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-5-фенилпентановая кислота,
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-фенилгексановая кислота,
(3R,9S)-6-(3-гидроксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(3-пиперидин-1-илпропокси)фенил] гексановая кислота,
(3R, 9S)-6-[4-(3-диметиламинопропокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R, 9S6-[4-(2-диметиламиноэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-6-(4-цианфенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-6-нафталин-2-ил-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] окта-дека-11(18),12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-(4-пиррол-1-ил)гексановая кислота,
(3R, 9S)-6-(4-гидрокси-3-метилфенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R, 9S)-6-(4-бензилоксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R, 9S)-6-[4-(4-аминобутокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-5-(4-метоксифенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)пентановая кислота,
(3R,9S)-6-(4-аминофенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота,
(3R,9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(пиридин-4-илметокси)фенил] гексановая кислота,
(3R, 9S)-6-(4-ацетиламинофенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановая кислота соответственно
или их фармацевтически приемлемые соли, такие, как ацетат, трифторацетат или гидрохлорид.
ацетат (3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17]октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-[4-(2-пирролидин-1-илэтокси)фенил]гексановой кислоты, или
трифторацетат (3R,9S)-6-[4-(3-диметиламинопропокси)фенил]-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановой кислоты, или
трифторацетат (3R, 9S)-6-[4-(2-диметиламиноэтокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановой кислоты, или
трифторацетат (3R, 9S)-6-[4-аминобутокси)фенил] -3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)-гексановой кислоты, или
ацетат (3R, 9S)-6-(4-аминофенил)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановой кислоты, или
трифторацетат (3R, 9S)-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил-6-[4-(пиридин-4-илметокси)фенил]гексановой кислоты.
этиловый эфир (3R, 9S)-6-[4-(3-гидроксипропокси)фенил]-3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] октадека-11(18), 12,14,16-тетраен-9-илкарбамоил)гексановой кислоты,
этиловый эфир (3R,9S)- 3-(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012.17] окта-дека-11(18), 12,14,16-тетраен-9-илкарбамоил)-6-пиридин-4-илгексановой кислоты соответственно
или их фармацевтически приемлемые соли.
| ФОРМА ДЛЯ ЛИТЬЯ ПОД ДАВЛЕНИЕМ В ВАКУУМЕ | 0 |
|
SU210728A1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТЕОПОРОЗА | 1992 |
|
RU2112515C1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| EP 0438223 А1, 08.01.1991 | |||
| US 5189178 А, 23.02.1993 | |||
| US 5183900 А, 02.02.1993. | |||
Авторы
Даты
2002-10-27—Публикация
1996-02-02—Подача