Изобретение относится к катализаторам, носителю катализатора и способам очистки отходящих газов от NOx в окислительных условиях в присутствии различных C2-C16 углеводородов для очистки газов, включая дымовые газы ТЭС, выхлопные газы автомобилей, а также в производстве азотной кислоты.
Процесс каталитической очистки отходящих газов от NOx состоит в каталитическом восстановлении оксида азота до молекулярного азота в избытке кислорода в присутствии углеводорода. При этом углеводород должен реагировать селективно с оксидом азота, а не с адсорбированным кислородом или кислородом катализатора. Эффективность процесса очистки определяется также природой восстановительных компонентов в отходящих газах.
Для процессов каталитической очистки отходящих газов от NOx в присутствии восстановителя (углеводорода) с избытком кислорода предлагаются каталитические системы, содержащие, как правило, оксиды переходных металлов: меди, кобальта, никеля, железа, галлия, олова или металлы: платина, палладий, серебро, золото, нанесенные либо на оксидные системы: оксид алюминия, Al-Si-O, ZrO2, либо на цеолиты (М. Iwamoto. Air pollution abatement through heterogeneous catalysis. in Stud. Surf. Sci. Catal. Ed: A. Corma, F.V. Melo, S. Mendioroz, J.L.G. Fierro. Vol. 130A. p.23-47).
Наиболее активным катализатором в области температур, близкой к реальным температурам работы автомобильных двигателей, является Cu-ZSM-5 (A. Shichi, K. Katagi, A. Satsuma, T. Hattori. Influence of intracrystalline diffusion on the selective catalytic reduction of NO by hydrocarbon over Cu-MFI zeolite. Applied Catalysis B: Ennvironmental. 24 (2000) 97-105). Однако подобные системы обладают рядом весомых недостатков, приводящих к ограничениям по использованию данных систем, в том числе и для широкого круга углеводородов:
1. Присутствие СО в продуктах реакции для ряда катализаторов из-за неполного окисления углеводорода при испытаниях в области низких температур.
2. Наличие диффузионных ограничений уже при использовании в качестве восстановителя С2-С3 углеводородов.
3. Необратимая дезактивация катализаторов, обусловленная взаимодействием алюминия из каркаса цеолита с активным компонентом, приводящая к образованию поверхностных соединений, значительно менее активных в области низких температур.
Согласно литературным данным в реакции селективного восстановления оксидов азота углеводородами в избытке кислорода заметную активность в области низких температур проявляют цирконийсодержащие системы, содержащие оксиды переходных металлов, например оксидов меди, кобальта, никеля (K.A. Betheke, M.C. Kung, B. Yang, M. Shah, D. Alt, C. Li, H.H. Kung. Metal oxide catalysts for lean NOx reduction. Catalysis Today. 26 (1995) 169-183).
Известен катализатор и способ восстановления оксида азота в присутствии пропана на медь-цирконийсодержащем катализаторе (J. Pasel, V. Speer, C. Albrecht, F. Richter, H. Papp. Metal doped sulfated ZrO2 as catalyst for the selective catalytic reduction (SCR) of NO with propane. Applied Catalysis. B: Environmental. 25 (2000) 105-113). Катализатор получают методом пропитки по влагоемкости раствором нитрата меди ZrO2, представляющего собой смесь фаз моноклинной и тетрагональной модификаций с поверхностью 58 м2/г.
Так, для катализатора, содержащего 1,3 мас.% CuО на ZrO2, при использовании в качестве восстановителя пропана и составе смеси 0,1% NO,0,0827% С3Н6, 10,0% O2, остальное гелий, максимальная конверсия оксида азота в азот составляет 19% при 450oС при объемной скорости 7600 час-1. При снижении температуры реакции до 300-350oС конверсия оксида азота уменьшается до 4%.
При замене восстановителя в процессе восстановления оксида азота с пропана на пропилен вследствие более высокой реакционной способности последнего (по сравнению с пропаном), как правило, наблюдаются различные закономерности для восстановления оксидов азота, которые будут определяться химическим составом катализатора и условиями проведения процесса.
Известен катализатор и способ восстановления оксидов азота пропиленом на оксидном никель-цирконийсодержащем катализаторе (K.A. Bethke, D. Alt, M.C. Kung. NO reduction by hydrocarbones in an oxidizing atmospere over transition metal-zirconium mixed oxides. Catalysis Letters. 25 (1994) 37-48). Катализатор готовят методом совместного соосаждения нитратных солей никеля и циркония. Осадок отфильтровывают и сушат при 100oС, а затем прокаливают при 350oС в течение 3 ч. Так, на катализаторе, содержащем 7,7 мас.% NiO на ZrO2, при составе очищаемого газа 0,1% NO, 0,1% С3Н6, 1% О2, остальное - гелий и объемной скорости 13300 час-1 конверсия оксида азота в азот составляет 61,9%, а пропилена до диоксида углерода и воды - 84,1% при 328oС.
При очистке отходящих газов от оксидов азота с использованием в качестве восстановителя насыщенного углеводорода с большой длиной углеродной цепи, например декана, закономерности процесса для С3-углеводородов не могут быть перенесены однозначно для С10-углеводородов.
Известно, что для реакции каталитического восстановления оксида азота в присутствии восстановителя декана заметное образование молекулярного азота наблюдается для медь- и олово-кобальтсодержащих систем (G. Delahay, E. Ensuque, B. Coq, F. Figueras. Selective catalytic reduction of nitric oxide by n-decane on Cu/sulfated-zirconia catalysts in oxygen rich atmosphere. Effect of sulfur and copper content. J. Catalysis. 175 (1998) 7-15), (C.C. Cheung, M. C. Kung. Influence of homogeneous decane oxidation on the catalytic performance of lean NOx catalysts. Catalysis Letters. 61.(1999) 131-138).
Так, для катализатора 6,3 мас.% SnO2, 6,3 мас.% СоО/Аl2О3 максимальная конверсия оксида азота в азот 37% достигается при температуре 525oС при составе очищаемого газа: 0,104% NO, 0,03% С10Н22, 11% O2, 7% H2O и объемной скорости 57900 час-1 (C.C. Cheung, M.C. Kung. Influence of homogeneous decane oxidation on the catalytic performance of lean NOx catalysts. Catalysis Letters. 61. (1999) 131-138). Катализатор получают пятикратной пропиткой по влагоемкости γ-Аl2О3 нитратом кобальта с промежуточной стадией прокаливания при 500 и 800oС после каждой пропитки. Приготовленный таким способом катализатор пропитывают этанольным раствором дихлорида олова. Образец сушат и прокаливают при 500oС.
Известен катализатор, содержащий 4,6 мас.% CuO на ZrO2. Катализатор получают посредством нанесения ацетилацетоната меди на диоксид циркония с поверхностью 134 м2/г, представляющий смесь фаз моноклинной и тетрагональной модификации. Катализатор сушат при 120oС и прокаливают при 500oС 3 ч. Удельная поверхность диоксида циркония при нанесении оксида меди не изменяется. Для данного катализатора максимальная конверсия оксида азота в азот 22% наблюдается при 300oС при объемной скорости 70000 ч-1 и следующем составе смеси: 0,1% NO, 0,03% н-C10Н22, 9% О2, остальное - гелий (G. Delahay, E. Ensuque, B. Coq, F. Figueras. Selective catalytic reduction of nitric oxide by n-decane on Cu/sulfated-zirconia catalysts in oxygen rich atmosphere. Effect of sulfur and copper content J. Catalysis. 175 (1998) 7-15).
При очистке выхлопных газов автомобильных двигателей в процессе в широком интервале варьируются температура, объемные скорости, концентрация кислорода и соотношение углеводород/оксид азота. Это создает дополнительные требования к качеству катализатора:
1. Устойчивость активного компонента катализатора и носителя при изменении температуры процесса в интервале 300-800oС.
2. Отсутствие диффузионного торможения при работе с углеводородами, особенно с большой длиной цепи, типа декана - компонента дизельных двигателей.
В связи с этим носитель для подобного рода процессов должен быть не только термически стабильным, но обладать достаточно развитой пористой структурой при наличии транспортных пор (мезо- и макропор). В этом плане представляет интерес использование в качестве носителя ZrO2. Диоксид циркония может быть получен в виде различных полиморфных модификаций, из которых наиболее термодинамически устойчивой фазой является моноклинная структура. Однако эта фаза характеризуется низкой удельной поверхностью (10-30 м2/г), что требует большего количества катализатора для получения необходимой степени очистки от оксида азота. Более перспективной является низкотемпературная, стабилизированная катионами щелочноземельных металлов кубическая модификация ZrO2 [A.S. Ivanova, G.M. Alikina, L.P. Solovyova, V.P. Ivanov, S.N. Trukhan, V. A. Sadykov. MO-ZrO2 catalysts for nitrogen oxides reduction by hydrocarbons in oxygen excess. Preparation and properties. React. Kinet. Catal. Lett. 59. (1996) 125-133]. Диоксид циркония получают либо методом соосаждения при постоянных рН и температуре из водных растворов солей при добавлении основания, либо из смеси соответствующих гидроксидов с последующей прокалкой при температуре 700-900oС. Однофазные образцы, представляющие кубическую фазу диоксида циркония с параметром решетки а=  образуются после прокаливании при 700oС составов, содержащих не менее 10 мол.% СаО и 25 мол.% SrO. Однофазный образец, содержащий 5 мол.% SrO, можно приготовить только при 900oС. Удельная поверхность носителя с такой структурой может достигать 80-100 м2/г. При меньшем содержании промотирующей добавки или при использовании оксида бария основными фазами являются диоксид циркония моноклинной или тетрагональной модификаций. Эти системы позволяют селективно восстанавливать NOx, но при высоких температурах (выше 550oС).
образуются после прокаливании при 700oС составов, содержащих не менее 10 мол.% СаО и 25 мол.% SrO. Однофазный образец, содержащий 5 мол.% SrO, можно приготовить только при 900oС. Удельная поверхность носителя с такой структурой может достигать 80-100 м2/г. При меньшем содержании промотирующей добавки или при использовании оксида бария основными фазами являются диоксид циркония моноклинной или тетрагональной модификаций. Эти системы позволяют селективно восстанавливать NOx, но при высоких температурах (выше 550oС).
Наиболее близким к заявляемому по технической сущности является катализатор и способ восстановления оксида азота в присутствии пропана на цирконийсодержащих системах (Патент РФ N 2043146, B 01 J 23/02, 10.09.95). Катализатор на основе ZrO2, содержащий 1,7≤МеО<10 мас.%, где МеО=Са, Sr, Ва, Al, Y, Се, селективно превращает оксид азота в молекулярный азот в области высоких температур при использовании в качестве восстановителя пропана. Катализаторы получают либо осаждением компонентов, либо их смешением с последующими стадиями формования, сушки и прокаливания при соответствующих температурах. Наилучшие показатели достигаются при использовании в качестве модифицирующей добавки оксида стронция. Так при составе очищаемого газа 0,1% NO, 0,13% С3Н8, 1% О2 (об.%), остальное - гелий и объемной скорости подачи смеси 4000 ч-1 для образца, содержащего 1,7 мас.% SrO при 500oС конверсия оксида азота в азот составляет 49,0%, а при 590oС - 95,0%. При введении 4,2 мас. % SrO при 500 и 550oС конверсия оксида азота в азот составляет 73,4 и 93,0% соответственно.
В предлагаемом изобретении усовершенствованный катализатор используют в качестве носителя.
Изобретение решает задачу эффективного удаления оксидов азота при низких температурах при использовании в качестве восстановителя углеводородов C2-C16.
Задача решается предлагаемым катализатором для очистки отходящих газов от оксидов азота каталитическим восстановлением углеводородами в окислительной атмосфере, содержащим в качестве носителя стабилизированный оксидами щелочноземельных металлов диоксид циркония в виде низкотемпературной кубической модификации с удельной поверхностью не ниже 160 м2/г, при этом катализатор дополнительно содержит оксид переходного металла и/или благородный металл и представляет собой композицию состава. мас.%: nMe1 m Ме2О/носитель, где Me1 - благородный металл; Me2 - переходным металл; при n - 0-2,0, m - 0-6,0; носитель - остальное, при условии, если n и m одновременно не равны 0.
Носитель представляет собой низкотемпературную кубическую модификацию диоксида циркония, стабилизированную оксидами кальция, стронция, бария или их смесью, в количестве 1,0-3,5 мас.%, с удельной поверхностью не ниже 160 м2/г. В качестве благородного металла используют серебро, платину или их смесь, в качестве оксида переходного металла используют оксид меди, кобальта, никеля или их смесь.
Задача решается также способом приготовления носителя катализатора для очистки отходящих газов от оксидов азота каталитическим восстановлением углеводородами в окислительной атмосфере. Носитель готовят путем добавления водного раствора аммиака к смешанному раствору азотнокислых солей цирконила и щелочноземельного металла, содержащему определенное количество поверхностно-активного вещества (ПАВ), с последующим выдерживанием суспензии при повышенной температуре в течение 72-120 ч. В качестве ПАВ используют 1% раствор поливинилового спирта (ПВС) или полиэтиленоксида (ПЭО). Полученные суспензии отфильтровывают, осадки промывают дистиллированной водой до отсутствия нитратов в фильтрате, а на завершающей стадии осадки промывают этиловым спиртом. Синтезированные осадки сушат вначале на воздухе, затем в сушильном шкафу при 110oС в течение 12-14 ч, после чего прокаливают в токе осушенного воздуха в интервале температур 600-700oС в течение 4 ч. При этом получают низкотемпературную кубическую модификацию диоксида циркония, стабилизированную оксидами щелочноземельных металлов, в количестве 1,0-3,5 мас.% с величиной удельной поверхности не менее 160 м2/г.
Задача решается также способом приготовления катализатора для очистки отходящих газов от оксидов азота каталитическим восстановлением углеводородами в окислительной атмосфере либо путем фотонанесения на носитель, представляющий собой низкотемпературную модификацию диоксида циркония, стабилизированную оксидами щелочноземельных металлов, оксида переходного металла и благородного металла, при этом получают катализатор вышеуказанного состава.
Либо катализатор готовят путем автоклавирования раствора соли переходного металла, соединения благородного металла и носителя, представляющего собой низкотемпературную модификацию диоксида циркония, стабилизированную оксидами щелочноземельных металлов, в щелочной среде при температуре не менее 100oС, при этом получают катализатор вышеуказанного состава.
Либо готовят методом пропитки по влагоемкости солями переходных металлов, соединения благородного металла и носителя, представляющего собой низкотемпературную модификацию диоксида циркония, стабилизированную оксидами щелочноземельных металлов, при этом получают катализатор вышеуказанного состава.
Задача решается также способом очистки отходящих газов от оксидов азота каталитическим восстановлением углеводородами в окислительной атмосфере в присутствии вышеуказанных цирконийсодержащих катализаторов при температуре 240-525oС. В качестве углеводородов используют C2-C16 углеводороды.
Предлагаемые катализаторы испытывают в процессе восстановления NOx в присутствии пропана, пропилена или декана в окислительной атмосфере. Тестирование проводят в проточном реакторе, в который загружают необходимый объем катализатора и с определенной объемной скоростью подают очищаемый газ. Продукты реакции анализируют методом газовой хроматографии или с использованием ИК- и хемилюминесцентных анализаторов. Эффективность процесса характеризуют степенью превращения NOx в N2. Для катализаторов селективного превращения оксида азота в присутствии пропана и пропилена также определяют превращение углеводорода в оксиды углерода.
Испытания в реакции каталитического восстановления NO пропаном в избытке кислорода проводят при составе очищаемого газа: 0,1 об.% NO, 0,13 об.% С3Н8, 1,0 об. % О2, остальное до 100% - гелий при объемной скорости 4000 и 12500 час-1.
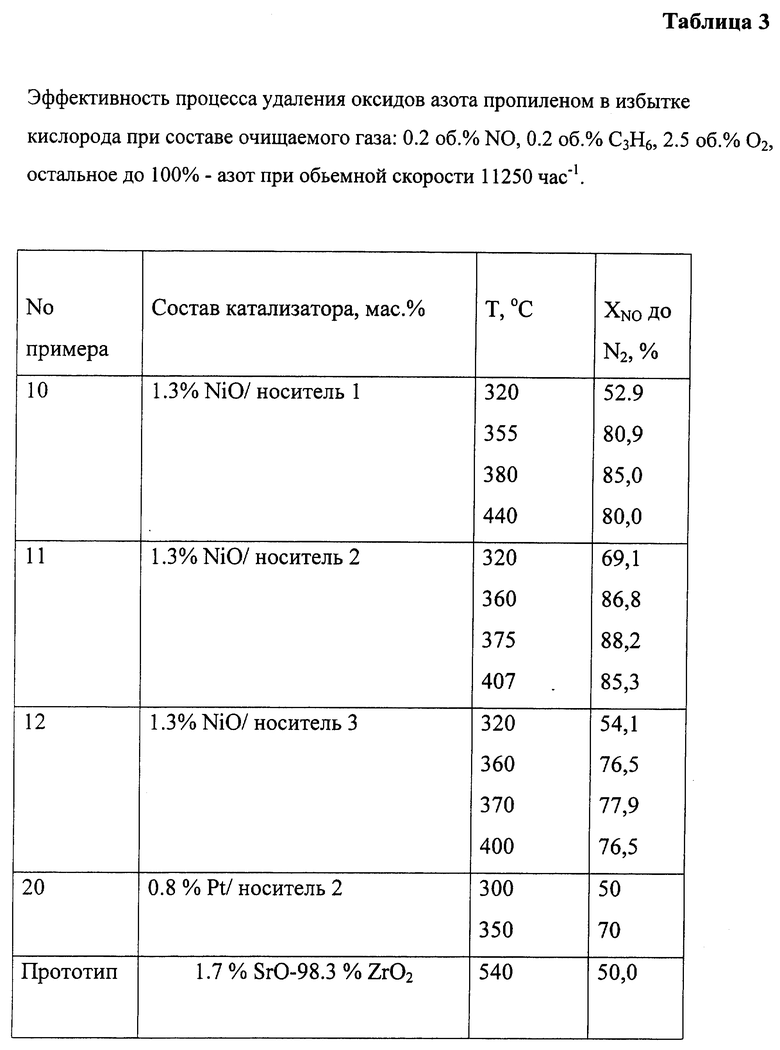
Испытания в каталитическом восстановлении NO пропиленом в избытке кислорода проводят при следующем составе очищаемого газа: 0,2 об.% NO, 0,2 об.% С3Н8, 2,5 об.% О2, остальное до 100% - азот при объемной скорости 18000 час-1.
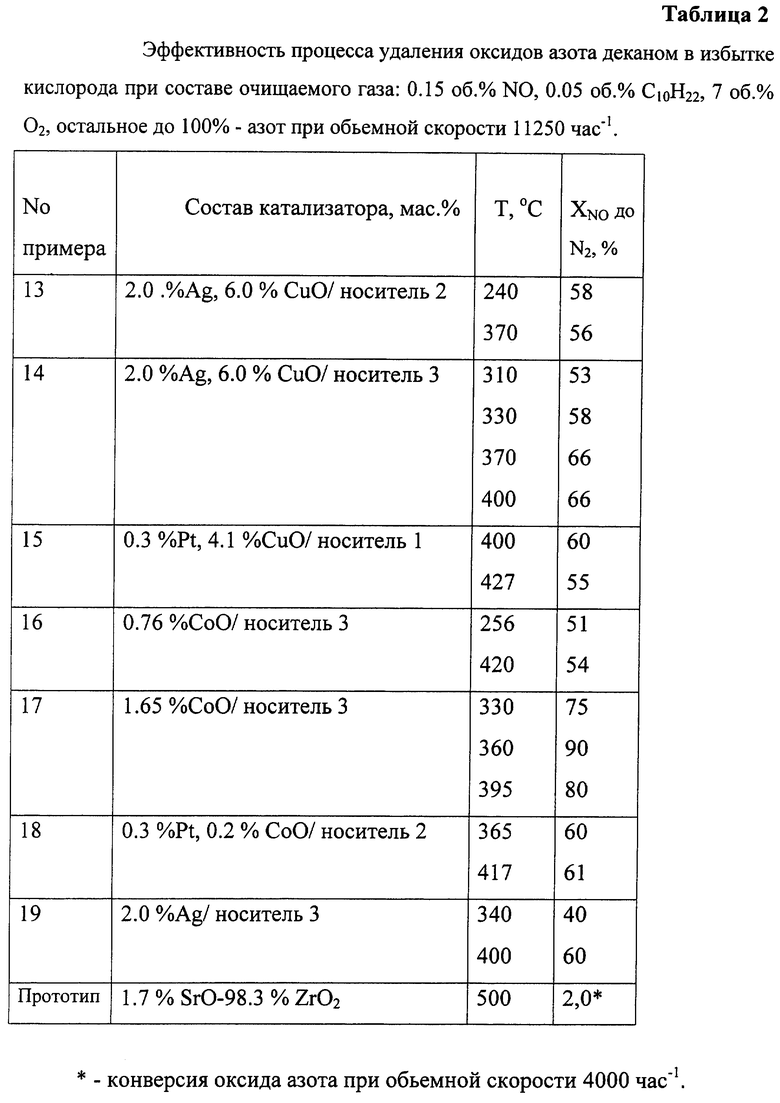
Тестирование процесса удаления оксидов азота деканом в избытке кислорода проводят при составе очищаемого газа: 0,15 об.% NO, 0,05 об.% С10Н22, 7 об.% О2, остальное до 100% - азот при объемной скорости 11250 час-1.
Ниже приведены примеры, иллюстрирующие изменение показателей процесса очистки от NOx в зависимости от условий проведения процесса (температуры реакции и вида углеводорода), природы катализаторов и способов их приготовления. Основные характеристики процесса и применяемых катализаторов приведены в таблицах 1-3.
Примеры 1-3 иллюстрируют приготовление носителя.
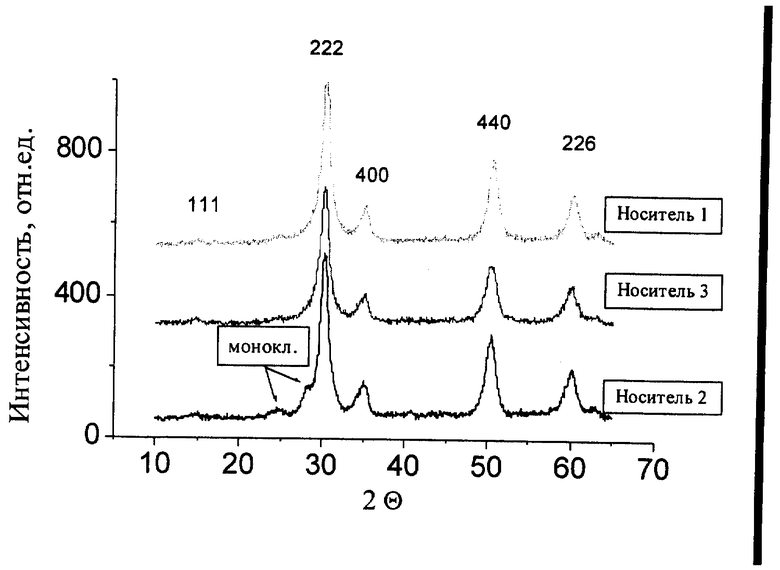
Чертеж иллюстрирует рентгенограммы носителей 1-3. Съемка рентгенограмм выполнена на дифрактометре HZG-4C с использованием Cu Kα-излучения.
Пример 1. Раствор солей, полученный смешением 15 мл раствора Ca(NO3)2, 285 мл раствора ZrO(NO3)2 и 15 мл 1% раствора ПВС, осаждают раствором аммиака с последующим выдерживанием суспензии при повышенной температуре в течение 72-120 ч. Суспензию отфильтровывают, осадок промывают дистиллированной водой до отсутствия нитратов в фильтрате, затем осадок промывают этиловым спиртом. Полученный осадок сушат на воздухе, а затем в сушильном шкафу при 110oС в течение 12-14 ч, после чего прокаливают в токе осушенного воздуха при 600-700oС в течение 4 ч. Полученный носитель имеет состав, мас.%: 1,5 СаО - 98,5 ZrO2 (носитель 1).
Рентгенограмма носителя 1 (чертеж) соответствует кубической модификации диоксида циркония с параметром решетки а= 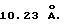 Удвоенный параметр решетки в данном случае обусловлен искажениями в решетке диоксида циркония вследствие присутствия Me2+ катионов, что отражается в появлении сверхструктурного дифракционного максимума (111). Удельная поверхность носителя 1 равна 180 м2/г.
Удвоенный параметр решетки в данном случае обусловлен искажениями в решетке диоксида циркония вследствие присутствия Me2+ катионов, что отражается в появлении сверхструктурного дифракционного максимума (111). Удельная поверхность носителя 1 равна 180 м2/г.
Пример 2. Аналогичен примеру 1. Отличие состоит в том, что на осаждение подают смесь растворов солей, в которой вместо соли азотнокислого кальция взят раствор азотнокислого стронция. Полученный носитель имеет состав, мас. %: 2,6 SrO - 97,4 ZrO2 (носитель 2).
Рентгенограмма носителя 2 (фиг.1) соответствует кубической модификации диоксида циркония с параметром решетки а=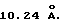 Удвоенный параметр решетки в данном случае также обусловлен искажениями в решетке диоксида циркония вследствие присутствия Ме2+ катионов, что отражается в появлении сверхструктурного дифракционного максимума (111). Кроме того, для этого носителя наблюдаются следовые количества моноклинной модификации диоксида циркония. Удельная поверхность носителя 2 равна 170 м2/г.
Удвоенный параметр решетки в данном случае также обусловлен искажениями в решетке диоксида циркония вследствие присутствия Ме2+ катионов, что отражается в появлении сверхструктурного дифракционного максимума (111). Кроме того, для этого носителя наблюдаются следовые количества моноклинной модификации диоксида циркония. Удельная поверхность носителя 2 равна 170 м2/г.
Пример 3. Аналогичен примеру 1. Отличие состоит в том, что на осаждение подают смесь растворов солей, в которой вместо соли азотнокислого кальция взят раствор азотнокислого бария. Полученный носитель имеет состав, мас.%: 3,3 ВаО - 96,7 ZrO2 (носитель 3).
Рентгенограмма носителя 3 (чертеж) соответствует кубической модификации диоксида циркония с параметром решетки а= Удвоенный параметр решетки в данном случае обусловлен искажениями в решетке диоксида циркония вследствие присутствия Ме2+ катионов, что отражается в появлении сверхструктурного дифракционного максимума (111). Удельная поверхность носителя 3 равна 160 м2/г.
Удвоенный параметр решетки в данном случае обусловлен искажениями в решетке диоксида циркония вследствие присутствия Ме2+ катионов, что отражается в появлении сверхструктурного дифракционного максимума (111). Удельная поверхность носителя 3 равна 160 м2/г.
Примеры 4-20 иллюстрируют приготовление катализатора.
Пример 4. 13 г носителя 1 пропитывают по влагоемкости 7 мл водного раствора Cu(NO3)2 (1,75 М), затем сушат на воздухе с периодическим перемешиванием в течение 5 ч при комнатной температуре и при 100oС 10 часов. Конечная температура прокаливания 400oС/2 ч. Состав катализатора соответствует формуле, мас.%: 6,0 CuO/носитель 1.
Пример 5. Приготовление катализатора по примеру 4, для которого используют носитель 2. Состав катализатора соответствует формуле, мас.%: 6,0 CuO/носитель 2.
Пример 6. Приготовление катализатора по примеру 4, для которого используют носитель 3. Состав катализатора соответствует формуле, мас.%: 6,0 CuO/носитель 3.
Пример 7. 0,877 г ацетата меди растворяют в 80 мл дистиллированной воды в кварцевом стакане. В раствор при перемешивании вводят 3,48 г носителя 1. Через 0,5 ч включают ртутную лампу типа ДРЛ-250, излучение которой направлено на стакан, расстояние между лампой и стаканом составляет 5 см. Суспензию носителя в растворе ацетата меди перемешивают при действии УФ/видимого света в течение 1,5 ч. Затем осадок отфильтровывают и промывают четырехкратным объемом воды. Полученный осадок высушивают под ИК-лампой в течение 10 ч и затем прокаливают при 400oС/2 ч.
0,219 г азотнокислого серебра растворяют в 80 мл воды в кварцевом стакане при перемешивании, к этому раствору добавляют 3,5 г порошка с нанесенным оксидом меди, прокаленным при 400oС/2 ч. Через 0,5 ч включают ртутную лампу ДРЛ-250 и содержимое стакана перемешивают при действии УФ/видимого света в течение 10 мин. Затем осадок отфильтровывают и промывают четырехкратным объемом воды. Полученный осадок высушивают под ИК-лампой в течение 10 ч и затем прокаливают при 400oС/2 ч. Состав катализатора соответствует формуле, мас.%: 0,2 Ag, 3,9 CuO/носитель 1.
Пример 8. Образец получают аналогично примеру 7 с той разницей, что 1,706 г ацетата меди растворяют в 150 мл воды и добавляют 8,9 г носителя 2. Для нанесения серебра 0,562 г азотнокислого серебра растворяют в 200 мл воды и добавляют 9,0 г порошка с нанесенным оксидом меди. Состав катализатора соответствует формуле, мас.%: 0,2 Ag, 3,1 CuO/носитель 2.
Пример 9. Образец получают аналогично примеру 7 с той разницей, что 2,244 г ацетата меди растворяют в 200 мл воды и добавляют 8,9 г носителя 3. Для нанесения серебра 0,561 г азотнокислого серебра растворяют в 200 мл воды и добавляют 9,0 г порошка с нанесенным оксидом меди. Состав катализатора соответствует формуле, мас.%: 0,8 Ag, 3,8 CuO/носитель 3.
Пример 10. 3,24 г носителя 1 и 130 мл никелирующего раствора, содержащего 33 мл воды, 65 мл 24% водного раствора аммиака, 30,94 г NiCl2 6 Н2О, помещают в автоклав. Автоклав нагревают до 100oС и выдерживают при этой температуре 48 ч. Затем образец промывают 0,1 М раствором аммиака, высушивают при 110oС и прокаливают при 500oС/5 ч. Катализатор имеет состав, мас.%: 1,3 NiO/носитель 1.
Пример 11. Получение образца по примеру 10, для которого взят носитель 2. Катализатор имеет состав, мас.%: 1,3 NiO/носитель 2.
Пример 12. Получение образца по примеру 10, для которого взят носитель 3. Катализатор имеет состав, мас.%: 1,3 NiO/носитель 3.
Пример 13. Приготовление катализатора по примеру 5. 10 г порошкообразного образца пропитывают 5 мл раствора азотнокислого серебра (0,37 М), затем сушат при комнатной температуре 5 ч, при 100oС - 10 ч и прокаливают 400oС/2 ч. Прокаленный катализатор дополнительно пропитывают 6 мл раствора азотной кислоты с концентрацией 23 мас.%. Затем катализатор сушат при 100oС/5 ч и прокаливают при 400oС/2 ч. Состав катализатора соответствует формуле, мас.%: 2,0 Ag, 6,0 CuO/носитель 1.
Пример 14. Для приготовления берут образец из примера 6, приготовление катализатора по примеру 13. Состав катализатора соответствует формуле, мас. %: 2,0 Ag, 6,0 CuO/носитель 2.
Пример 15. Приготовление катализатора по примеру 7 с той разницей, что 10 г носителя 1 при перемешивании вводят в 200 мл водного раствора ацетата меди (0,06 М). Отличие от примера 7 также в том, что вместо соли азотнокислого серебра берут 0,38 мл раствора H2PtCl6 (0,035 г Pt/мл). В 100 мл воды вводят раствор платинохлористоводородной кислоты и добавляют 5 г порошка с нанесенным оксидом меди. Перед облучением УФ/видимым светом в раствор вводят 1,2 мл метанола. Время облучения 1,5 ч. Состав катализатора соответствует формуле, мас.%: 0,2 Pt, 4,1 CuO/носитель 1.
Пример 16. Для приготовления катализатора 10 г порошка носителя 3 пропитывают по влагоемкости 5 мл раствора нитрата кобальта (0,20 М). Порошок сушат при 100oС/10 ч и прокаливают при 400oС/2 ч. Состав катализатора соответствует формуле, мас.%: 0,76 СоО/носитель 3.
Пример 17. Приготовление как в примере 16, с той лишь разницей, что для приготовления катализатора используют раствор нитрата кобальта с концентрацией 0,44 М. Состав катализатора соответствует формуле, мас. %: 1,65 СоО/носитель 3.
Пример 18. Приготовление катализатора по примеру 15, для которого используют 15 г образца из примера 2. Вместо раствора соли ацетата меди используют 250 мл раствора нитрата кобальта с концентрацией 0,06 М. Для нанесения платины используют 0,43 мл раствора Н2РtСl6 (0,035 г Pt/мл). Состав катализатора соответствует формуле, мас.%: 0,3 Pt, 0,2 СоО/носитель 2.
Пример 19. Приготовление, как в примере 16, с той лишь разницей, что для приготовления катализатора используют раствор нитрата серебра с концентрацией 0,37 М. Состав катализатора соответствует формуле, мас.%: 2,0 Ag/носитель 3.
Пример 20. Приготовление, как в примере 16, с той лишь разницей, что для приготовления катализатора используют носитель 2 и раствор H2PtCl6 (0,016 г Pt/мл). Состав катализатора соответствует формуле, мас.%: 0,8 Pt/носитель 2.
Как видно из приведенных примеров и таблиц, предлагаемые катализаторы позволяют решить задачу эффективного удаления оксидов азота при низких температурах при использовании в качестве восстановителя углеводородов C2С16.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР И СПОСОБ ОЧИСТКИ ОТХОДЯЩИХ ГАЗОВ ОТ ОКСИДОВ АЗОТА (ВАРИАНТЫ) | 2001 |
|
RU2194573C1 |
| КАТАЛИЗАТОР, НОСИТЕЛЬ КАТАЛИЗАТОРА, СПОСОБ ИХ ПРИГОТОВЛЕНИЯ (ВАРИАНТЫ) И СПОСОБ ОЧИСТКИ ОТХОДЯЩИХ ГАЗОВ ОТ ОКСИДОВ АЗОТА | 2001 |
|
RU2199389C1 |
| КАТАЛИЗАТОР РАЗЛОЖЕНИЯ УГЛЕВОДОРОДОВ НА ВОДОРОД И УГЛЕРОДНЫЙ МАТЕРИАЛ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1994 |
|
RU2064831C1 |
| КАТАЛИЗАТОР ПОЛУЧЕНИЯ ЗАКИСИ АЗОТА И СПОСОБ | 2002 |
|
RU2214306C1 |
| КАТАЛИЗАТОР, СПОСОБ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРА И СПОСОБ ОЧИСТКИ ОБОГАЩЕННЫХ ВОДОРОДОМ ГАЗОВЫХ СМЕСЕЙ ОТ ОКСИДА УГЛЕРОДА | 2001 |
|
RU2191070C1 |
| КАТАЛИЗАТОР И СПОСОБ ПОЛУЧЕНИЯ ЗАКИСИ АЗОТА | 2002 |
|
RU2214305C1 |
| КАТАЛИЗАТОР И СПОСОБ ПОЛУЧЕНИЯ ФЕНОЛА ИЗ БЕНЗОЛА | 2002 |
|
RU2205688C1 |
| СПОСОБ ОЧИСТКИ ОТХОДЯЩИХ ГАЗОВ ОТ ОКСИДОВ АЗОТА | 1995 |
|
RU2088316C1 |
| КАТАЛИЗАТОР ДЛЯ БЕСПЛАМЕННОГО СЖИГАНИЯ ПРИРОДНОГО ГАЗА | 1995 |
|
RU2086298C1 |
| КАТАЛИЗАТОР ДЛЯ ГЛУБОКОГО ОКИСЛЕНИЯ УГЛЕВОДОРОДОВ | 1992 |
|
RU2054318C1 |

Изобретение относится к катализаторам, носителю катализатора, способам их получения и способам очистки отходящих газов от NОх, включая дымовые газы ТЭС, выхлопные газы автомобилей, а также в производстве азотной кислоты. Описываются состав катализатора для очистки отходящих газов от оксидов азота каталитическим восстановлением углеводородами в окислительной атмосфере, содержащий в своем составе модифицированный диоксид циркония, представляющий собой композицию состава, мас.%: n Ме1 m Ме2О/носитель, где Ме1 - благородный металл; Ме2 - оксид переходного металла; при n = 0-2,0, m = 0-6,0, при условии, если n и m одновременно не равны 0, и носитель, который представляет собой низкотемпературную кубическую модификацию диоксида циркония, стабилизированную оксидами кальция, стронция, бария или их смесью, в количестве не ниже 1,0 мас.%, с удельной поверхностью не ниже 160 м2/г. В качестве благородного металла используют серебро, платину или их смесь, в качестве оксида переходного металла используют оксид меди, кобальта, никеля или их смесь. Описываются также способы их получения и способ очистки отходящих газов от оксидов азота. Технический результат - эффективное удаление оксидов азота при низких температурах при использовании в качестве восстановителя углеводородов С2-С16. 7 с. и 4 з.п.ф-лы, 3 табл., 1 ил.
n Ме1 m Ме2О/носитель,
где Ме1 - благородный металл;
Ме2 - переходный металл;
n = 0-2,0, m = 0-6,0;
носитель - остальное, при условии, если n и m одновременно не равны 0.
| КАТАЛИЗАТОР ВОССТАНОВЛЕНИЯ ОКСИДОВ АЗОТА УГЛЕВОДОРОДАМИ В ОКИСЛИТЕЛЬНОЙ АТМОСФЕРЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2043146C1 |
| КАТАЛИЗАТОР СЕЛЕКТИВНОГО ВОССТАНОВЛЕНИЯ ОКСИДОВ АЗОТА МЕТАНОМ | 1995 |
|
RU2080177C1 |
| КАТАЛИЗАТОР ДЛЯ ОЧИСТКИ ГАЗОВ ОТ ОКСИДОВ АЗОТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1997 |
|
RU2132227C1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Сепаратор для щелочного аккумулятора | 1975 |
|
SU687495A1 |
| A.S | |||
| JVANOVA et al | |||
| MO-ZrO catalyst for nitrogen oxides reduction by hydrocarbons in oxygen excess | |||
| Preparation and properties | |||
| React | |||
| Kinet | |||
| Catal | |||
| Lett | |||
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
Авторы
Даты
2002-11-10—Публикация
2001-04-05—Подача