Изобретение является частичным продолжением рассматриваемой заявки США, серийный номер 08/707776 от 4 сентября 1996 г.
Область техники, к которой относится изобретение
Изобретение относится к новым полусинтетическим макролидам, обладающим антибактериальной активностью, фармакологическим композициям, включающим эти соединения, и способам лечения такими препаратами. В частности, изобретение относится к кетолидным производным 6-O-замещенного эритромицина, композициям, включающим эти соединения, и способам лечения бактериальных инфекций.
Уровень техники
Эритромицины A-D, представленные формулой I,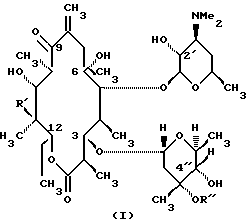
Эритромицин - R' R''
A - -OH -CH3
B - -H CH3
C - -OH -H
D - -H -H
хорошо известные и эффективные антибиотики, находят широкое применение для лечения и профилактики бактериальных инфекций. Однако, как и в случае других антибактериальных агентов, известны штаммы, устойчивые или малочувствительные к эритромицину. Кроме того, эритромицин А обладает низкой активностью в отношении грамотрицательных бактерий. Следовательно, существует постоянная необходимость в новых производных эритромицина с более высокой антибактериальной активностью, к которым не столь быстро развивается привыкание, обладающих активностью в отношении грамотрицательных бактерий или таких, которые обладали бы неожиданной избирательностью в отношении микроорганизмов-мишеней. Поэтому многими исследователями ведутся работы по синтезу химических производных эритромицина с целью получить аналоги с модифицированными или улучшенными профилями антибиотической активности.
Патент США 5444051 содержит описание производных 6-O-замещенного 3-оксоэритромицина А, в которых заместители выбирают из следующих групп: алкил, -CONH2, -СОNНС(O)алкил и -СОNНSО2алкил. Международная заявка WO 97/10251, опубликованная 20 марта 1997 г., содержит описание производных 6-O-метил 3-декладинозоэритромицина.
Европейская патентная заявка 596802, опубликованная 11 мая 1994 г., содержит описание производных бициклического 6-O-метил-3-оксоэритромицина А.
Международная заявка WO 92/09614, опубликованная 11 июня 1992 г., раскрывает производные трициклического 6-O-метилэритромицина А.
Сущность изобретения
Настоящее изобретение относится к новому классу производных 6-O-замещенного эритромицина А, обладающих более высокой устойчивостью в кислой среде по сравнению с эритромицином А и 6-O-метилэритромицином А, а также повышенной активностью в отношении грамотрицательных бактерий и штаммов грамположительных бактерий, резистентных к макролидным антибиотикам.
Одно из воплощений настоящего изобретения относится к соединениям, выбранным из группы, состоящей из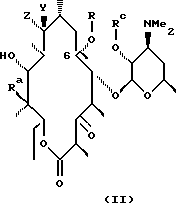
или фармацевтически допустимых солей, сложных эфиров или предшественников лекарств на их основе, где Y и Z вместе определяют группу X, причем Х выбирают из группы, состоящей из
(1) =O
(2) =N-OH
(3) =N-O-R1, где R1 выбран из группы, включающей
(a) незамещенный С1-С12-алкил,
(b) С1-С12-алкил с заместителем в виде арильной группы,
(4) = N-O-C(R5)(R6)-O-R1, где R1 определен ранее, а R5 и R6 вместе с атомом, к которому они присоединены образуют С3-С12-циклоалкил;
Ra - гидроксил;
Rb - гидроксил, -O-С(O)-имидазолил;
Rc - водород или защитная группа для гидроксила;
L - карбонил;
Т выбирают из группы -О-, -NH-, -N(W-Rd)-, где W может отсутствовать или представлять собой -NH-; и
Rd выбирают из группы, включающей
(1) водород
(2) С1-С6-алкильную группу, которая может быть замещена NR7R8, где R7 и R8 представляют собой С1-С6-алкильную группу;
R выбирают из группы, включающей
(1) замещенный метил, где заместитель представляет собой CN, арильную группу, замещенную арильную группу, гетероарильную группу, замещенную гетероарильную группу,
(2) С2-С10-алкил,
(3) замещенный С2-С10-алкил с по меньшей мере одним заместителем, который выбирают из группы, состоящей из
- гидроксила,
- оксо,
- арила,
- гетероарила,
- NR13R14, где R13 и R14 выбирают из группы, состоящей из водорода и С1-С12-алкила, замещенного арильной или гетероарильной группой, или группой СО2СН3,
- = N-O-R10, где R10 - водород, С1-С3-алкил или С1-С3-алкил с заместителем в виде арильной или гетероарильной группы, или арил,
- =NNHC(O)R10, где группа R10 определена ранее,
(4) С3-алкенил, который может быть замещен арилом, замещенным арилом, гетероарилом или замещенным гетероарилом,
(5) С3-алкинил; и
(6) С3-алкинил с заместителем, выбранным из арила, замещенного арила, гетероарила и замещенного гетероарила, а А, В, D и Е являются водородом.
Настоящее изобретение представляет также фармацевтические композиции, обладающие антибактериальной активностью, содержащие терапевтически эффективное количество описанных в данном контексте производных эритромицина в сочетании с фармацевтически приемлемым носителем.
Изобретение также относится к способу лечения бактериальных инфекций путем регулирования бактериальной инфекции в организме хозяина-млекопитающего, нуждающегося в таком лечении, включающий введение в организм млекопитающего терапевтически эффективной фармацевтической композиции, содержащей описанное здесь производное эритромицина.
Далее в настоящем изобретении предложен способ получения производных 6-O-замещенных макролидов формулы (II), (III), (IV) и (V).
Сведения, подтверждающие возможность осуществления изобретения
Одним из воплощений настоящего изобретения являются соединения формулы II, где X, Y, R, Ra и Rc описаны ранее.
Представителем соединений формулы II является вещество формулы (II) при Ra = ОН, Rc = бензоил, R = аллил.
В предпочтительном воплощении изобретения в соединениях формулы II согласно изобретению Ra - гидроксил и Rc - водород.
В более предпочтительным варианте соединения формулы II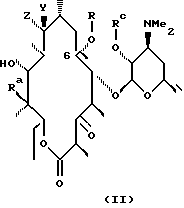
согласно изобретению имеют формулу VIII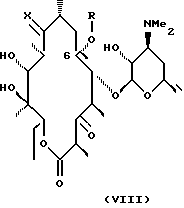
где Х - О или NOH, a R определены выше.
Соединения, представляющие такой вариант, включают следующие соединения, но не ограничиваются ими:
соединение формулы (VIII), где Х = О, R = аллил;
соединение формулы (VIII), где Х = NOH, R = аллил;
соединение формулы (VIII), где Х = О, R = пропил;
соединение формулы (VIII), где Х = О, R = -СН2СНО;
соединение формулы (VIII), где Х = О, R = -CH2CH=NOH;
соединение формулы (VIII), где Х = NOH, R = -CH2CH=NOH;
соединение формулы (VIII), где Х = О, R = -CH2CN;
соединение формулы (VIII), где Х = О, R = -CH2CH2NH2;
соединение формулы (VIII), где Х = О, R = -СН2СН2NНСН2-фенил;
соединение формулы (VIII), где X = О, R = -СН2СH2NНСН2СН2-фенил;
соединение формулы (VIII), где Х = О, R = -СН2СН2NНСH(СО2СН3)CН2-фенил;
соединение формулы (VIII), где Х = О, R = -СН2СН2NНСН2-(4-пиридил);
соединение формулы (VIII), где Х = О, R = -СН2СН2NНСН2-(4-хинолил);
соединение формулы (VIII), где Х = О, R = -СН2СН=CН-фенил;
соединение формулы (VIII), где Х = О, R = -СН2СН2СН2-фенил;
соединение формулы (VIII), где Х = О, R = -СН2СН=СН-(4-метоксифенил);
соединение формулы (VIII), где Х = О, R = -СН2СН=СН-(4-хлорфенил);
соединение формулы (VIII), где Х = О, R = -СН2СН=СН-(3-хинолил);
соединение формулы (VIII), где Х = О, R = -СН2СН2СН2ОН;
соединение формулы (VIII), где Х = О, R = -СН2С(O)ОН;
соединение формулы (VIII), где Х = О, R = -СН2СН2NНСН3;
соединение формулы (VIII), где Х = О, R = -СН2СН2N(СH3)2;
соединение формулы (VIII), где Х = О, R = -СН2СН2-(1-морфолинил);
соединение формулы (VIII), где Х = О, R = -CH2C(O)NH2;
соединение формулы (VIII), где Х = О, R = -СН2СН3;
соединение формулы (VIII), где Х = О, R = -СН2СН2CH(СН3)CН3;
соединение формулы (VIII), где Х = О, R = -СН2СН2СНО;
соединение формулы (VIII), где Х = О, R = -С(O)СН2СН2СH3;
соединение формулы (VIII), где Х = О, R = -СН2-(4-нитрофенил);
соединение формулы (VIII), где Х = О, R = -СН2-(4-хлорфенил);
соединение формулы (VIII), где Х = О, R = -СН2-(4-метоксифенил);
соединение формулы (VIII), где Х = О, R = -СН2-(4-цианофенил);
соединение формулы (VIII), где Х = О, R = -СН2-(2-пиридил);
соединение формулы (VIII), где Х = О, R = -СН2-(3-пиридил);
соединение формулы (VIII), где Х = О, R = -СН2-(4-пиридил);
соединение формулы (VIII), где Х = О, R = -СН2-(4-хинолил);
соединение формулы (VIII), где Х = О, R = -СН2С(O)-фенил;
соединение формулы (VIII), где Х = О, R = -СН2С(O)СН2СН3;
соединение формулы (VIII), где Х = О, R = -СН2СН=СН-(4-хинолил);
соединение формулы (VIII), где Х = О, R = -СН2СН2СН2-(4-хинолил);
соединение формулы (VIII), где Х = О, R = -СН2СН=СН-(5-хинолил);
соединение формулы (VIII), где Х = О, R = -СН2СН2СН2-(5-хинолил);
соединение формулы (VIII), где Х = О, R = -СН2СН=СН-(4-бензоксазолил);
соединение формулы (VIII), где Х = О, R = -СН2СН=СН-(4-бензимидазолил);
соединение формулы (VIII), где Х = О, R = -СН2-(3-иодфенил);
соединение формулы (VIII), где Х = О, R = -СН2-(2-нафтил) и
соединение формулы (VIII), где Х = О, R = -СН2СН=СН-(4-фторфенил).
Предпочтительные соединения формулы (VIII) выбирают из группы:
соединение формулы (VIII): Х - О, R - аллил;
соединение формулы (VIII): Х - О, R - -СН2СН=CН-фенил; и
соединение формулы (VIII): Х - О, R - -СН2СН=СН-(3-хинолил).
Одним из воплощений изобретения является способ получения производных эритромицина формулы (II)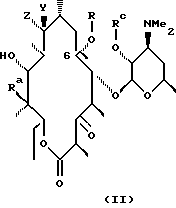
где Y, Z, Ra, Rc и R определены ранее. Способ заключается в том, что вещество формулы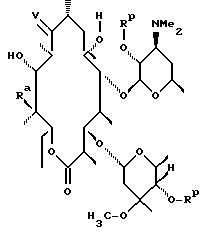
где Rp защитная группа гидроксила, а V - =N-O-R1 или =N-O-C(R5)(R6)-O-R1, обрабатывают основанием в апротонном растворителе и затем алкилирующим агентом с образованием соединения формулы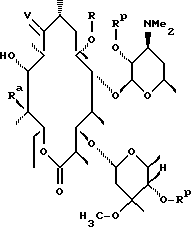
где Ra и Rp определены ранее, V - =N-O-R1 или =N-O-C(R5)(R6)-O-R1, где R1, R5, R6 определены ранее, a R - "алкильная группа", введенная с помощью указанного алкилирующего агента, удаляют защитные группировки с 2'- и 4"-гидроксильных групп с образованием соединения формулы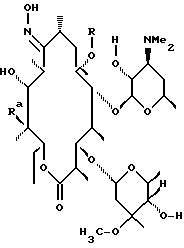
где Ra определен ранее, а R - "алкильная группа", введенная с помощью указанного алкилирующего агента, проводят деоксимирование в присутствии кислоты в подходящем растворителе с образованием целевого промежуточного соединения формулы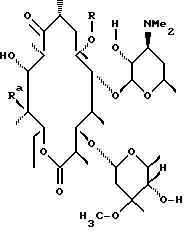
отщепляют остаток кладинозы кислотным гидролизом и проводят защиту 2'-гидроксильной группы путем обработки соответствующим реагентом с образованием 3-гидроксиэритромицина следующей формулы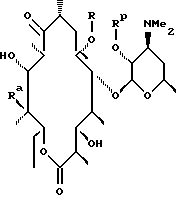
затем окисляют 3-гидроксильную группу, необязательно удаляют защиту с 2'-гидроксильной группы и выделяют целевой продукт.
В предпочтительном воплощении вышеуказанного способа в качестве основания используют соединение из группы, включающей гидроокись калия, гидроокись цезия, гидроокись тетраалкиламмония, гидрид натрия, гидрид калия, изопропоксид калия, трет-бутоксид калия, изобутоксид калия, в качестве алкилирующего агента используют соединение из группы, включающей бромистый аллил, бромистый пропаргил, бромистый бензил, 4-нитробензилбромид, 4-хлорбензилбромид, 4-метоксибензилбромид, α-бром-п-толунитрил, циннамилбромид, 1-бром-2-пентан, 2-пиколил хлорид, 3-пиколил хлорид, 4-пиколил хлорид, 4-бромметилхинолин, бромацетонитрил, бромацетамид, 2-бромацетофенон, 1-бром-2-бутанон, аллил O-тозилат, 3-фенилпропил-O-трифторметансульфонат, н-бутил-O-метансульфонат, а обработку алкилирующим агентом проводят при температуре от -15oС до 50oС в период времени от 0,5 часа до 10 суток, удаление защитных групп проводят уксусной кислотой в воде и ацетонитриле, в качестве деоксимирующего агента используют неорганические нитриты в присутствии кислоты, такие как нитриты натрия и калия, а в качестве растворителя используют воду, метанол, этанол, пропанол, изопропанол, триметилсилан или их смесь, в качестве реагента для защиты гидроксильной группы используют триалкилсилилгалоген, ангидриды или ацилгалогениды карбоновых кислот, в качестве окислителя используют N-хлорсукцинимид-диметилсульфид и карбодиимид-диметилсульфоксид, а удаление защиты проводят путем перемешивания в метаноле.
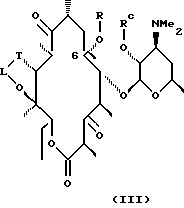
Другим воплощением настоящего изобретения являются соединения формулы III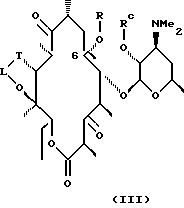
где R, Rc, L и Т описаны ранее.
Предпочтительные производные эритромицина формулы III выбирают из группы, состоящей из
соединения формулы III: Rc = ацетил, L = СО, Т = NH, R = -СН2СH=СH2;
соединения формулы III: Rc = ацетил, L = СО, Т = NH, R =
-СН2СН=СН-(3-хинолил);
соединения формулы III: Rc = бензоил, L = СО, Т = NH, R =
-СН2СН=СН-(3-хинолил);
соединения формулы III: Rc = пропаноил, L = СО, Т = NH, R =
-СН2СН=СН-(3-хинолил);
соединения формулы III: Rc = этилсукциноил, L = СО, Т = NH, R = -СН2СН= СН-(3-хинолил).
В более предпочтительном воплощении изобретения соединения формулы III имеют формулу IX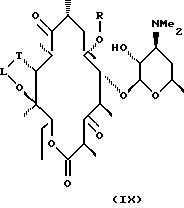
где L, Т и R определены выше.
Соединения, представляющие такой вариант, включают следующие соединения, но не ограничиваются ими:
соединение формулы (IX), где L = СО, Т = О, а R = -CH2CH=CH2;
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=CН-фенил;
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2СН2-фенил;
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=СН-(4-хлорфенил);
соединение формулы (IX), где L= СО, Т = О, а R = -СН2СН=СН-(3-хинолил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2СН3;
соединение формулы (IX), где L = СО, Т = О, а R = -CH2CH2NH2;
соединение формулы (IX), где L = СО, Т = О, а R = -CH2CH=NOH;
соединение формулы (IX), где L = СО, Т = О, а R = -CH2CH2CH2OH;
соединение формулы (IX), где L = СО, Т = О, а R = -CH2F;
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2-фенил;
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2-(4-пиридил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2-(4-хинолил);
соединение формулы (IX), где L = СО, Т = О, a R = -CH2CH(OH)CN;
соединение формулы (IX), где L= СО, Т = О, а R = -СН(С(O)ОСН3)СН2-фенил;
соединение формулы (IX), где L = СО, Т = О, а R = -CH2CN;
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=СН-(4-метоксифенил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=CН-(4-фторфенил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=СН-(8-хинолил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2NНСН2-фенил;
соединение формулы (IX), где L = СО, Т = О, а R = -СН2-фенил;
соединение формулы (IX), где L = СО, Т = О, а R = -СН2-(4-пиридил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2-(4-хинолил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=СН-(4-пиридил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2СН2-(4-пиридил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=СН-(4-хинолил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2СН2-(4-хинолил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=СН-(5-хинолил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН2СН2-(5-хинолил);
соединение формулы (IX), где L = СО, Т = О, а R = -CH2CH=CH-(4-бензоксазолил);
соединение формулы (IX), где L = СО, Т = О, а R = -СН2СН=СН-(4-бензимидазолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=CН2;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=CН-фенил;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2СН3;
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2NH2;
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NOH;
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2CH2OH;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2-фенил;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2-(4-пиридил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2-(4-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CN;
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(4-хлорфенил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=CН-(4-фторфенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2CH2-(4-метоксифенил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=CН-(4-метоксифенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-хлор-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2NHCH2CH2-(2-хлорфенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-фенил;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-(4-пиридил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-(4-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(4-пиридил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2СН2-(4-пиридил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-фтор-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2СН2-(4-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-циано-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2СН2-(5-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(4-бензоксазолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=CН-(4-бензимидазолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-метокси-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-(2-нафтил);
соединение формулы (IX), где L = СО, Т = N(CH3), a R = -CH2CH=CH2;
соединение формулы (IX), где L = СО, Т = N(СН3), а R = -СН2СН=СН-(3-хинолил);
соединение формулы (IX), где L = СО, Т = N(СН2СН2N(СН3)2), а R = -СН2СН= СН2;
соединение формулы (IX), где L = СО, Т = N(CH2CH2N(CH3)2), a R = -СН2СН= СН-(3-хинолил);
соединение формулы (IX), где L = СО, Т = N(СН2СH=СH2), а R = -СН2СН=СН2;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-пиридил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(2-нафтил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(4-изохинолинил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(3,4-метилендиоксифенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(8-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(5-индолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-хлор-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(3,4-этилендиоксифенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-нитрофенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-нитрохинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(5-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(2-метил-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, Rc =ацетил, а R = -СН2СН= СН-(3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(5-изохинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(7-нитро-6-хиноксалинил);
соединение формулы (IX), где L= СО, Т = NH, a R = -СН2СН=СН-(6-амино-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(1,8-нафтиридин-3-ил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-(ацетиламино)-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-карбазолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(5-бензимидазолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(-3-гидрокси-2-(N-(2-(метоксифенил)амидо)-7-нафтил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-хиноксалинил);
соединение формулы (IX), где L= СО, Т = NH, a R = -СН2СН=СН-(6-гидрокси-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-метокси-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(5-нитро-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(8-нитро-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(2-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2 СН=СН-(4-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2 СН=СН-(4-карбоксил-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-фтор-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-метоксикарбонил-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-аминокарбонил-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-циано-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-бром-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2С(O)Н;
соединение формулы (IX), где L = СО, Т = NH, а R = -СН2СН2NНСН2фенил;
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2NHCH2CH2фeнил;
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2NHCH2CH2CH2фенил;
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2NHCH2CH2CH2CH2фeнил;
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2NHCH2CH2CH2(3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2NНСH2(3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH2NHCH2-(6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NO(фeнил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NOCH2(4-NO2-фенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NOCH2(4-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NOCH2(2-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NOCH2(3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NOCH2-(6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NOCH2-(1-нафтил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NOCH2(2-нафтил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2С(O)-фенил;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2С(O)-(4-F-фенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2CH=NNHC(O)фeнил;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН2СН2-(3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2-C≡C-H;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(6-нитро-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-фенил;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-нафтил;
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(2-нафтил);
соединение формулы (IX), где L= СО, Т = NH, a R = -СН2-С≡С-(6-метокси-2-нафтил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(6-хлор-2-нафтил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(2-метил-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH, a R = -CH2-C≡C-(5-(N-(2-пиридил)амино)карбонил)фуранил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(1-фенилэтенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2-(2,2-диметил-1,3-диоксолан-4-ил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН(ОН)-фенил;
соединение формулы (IX), где L = СО, Т = NH, а R = -СH2СН(ОН)СН2ОH;
соединение формулы (IX), где L = СО, Т = NHNH2, a R = -CH2CH=CH2;
соединение формулы (IX), где L = СО, Т = NHNH2, a R = -CH2CH=CH-(3-хинолил);
соединение формулы (IX), где L = СО, Т = NHNH2, a R = -CH2CH2CH2-(3-хинолил);
соединение формулы (IX), где L = СО, Т = NH2, a R = -СН2СН=СН-нафтил;
соединение формулы (IX), где L = СО, Т = NН2, а R = -СН2СН=СН-(3-(2-фуранил)-6-хинолил);
соединение формулы (IX), где L = СО, Т = NН2, а R = -СН2СН=СН-(8-хлор-3-хинолил);
соединение формулы (IX), где L = СО, Т = NH2, a R = -СН2СН=СН-(4-хлор-2-трифторметил-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(9-фторенон-2-ил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(6-бензоил-2-нафтил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(7-метокси-2-нафтил);
соединение формулы (IX), где L = СО, Т = NH2, a R = -СН2СН=СН-(3-фенил-6-хинолил);
соединение формулы (IX), где L = СО, Т = NН2, а R = -СН2СН=СН-(3-(2-пиридил)-6-хинолил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(3-(2-тиофенил)-6-хинолил);
соединение формулы (IX), где L = СО, Т = NН2, а R = -СН2СН=СН-(4-метилнафтил);
соединение формулы (IX), где L = СО, Т = NH2, a R = -CH2CH=CH-(6-β-D-галактопиранозил-2-нафтил);
соединение формулы (IX), где L = СО, Т = NH2, a R = -СН2СН=СН-(7-хинолил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(4-фторнафтил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(3-бифенил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(5-нитронафтил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(4-пирролилфенил);
соединение формулы (IX), где L= СО, Т = NH2, a R = -СН2СН=СН-(6-метокси-2-нафтил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(3,5-дихлорфенил);
соединение формулы (IX), где L = СО, Т = NH2, a R = -СН2-(3-йодфенил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2-(3-(2-фуранил)фенил);
соединение формулы (IX), где L = СО, Т = NН2, а R = -СН2СН=СН-(6-гидрокси-2-нафтил);
соединение формулы (IX), где L = СО, Т = NH2, а R = -СН2СН=СН-(6-(2-бромэтокси)-2-нафтил);
соединение формулы (IX), где L = СО, Т = NН2, а R = -СН2СН=СН-(6-(2-(тетразолил)этокси-2-нафтил);
соединение формулы (IX), где L = СО, Т = NH2, a R = -СН2СН=CН-нафтил;
соединение формулы (IX), где L = СО, Т = NH, а R = -CH2CH=CH-(5-(3-изоксазолил)-2-тиофенил);
соединение формулы (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(1,3-диметил-2,4-диоксо-5-пиримидинил); и
соединение формулы (IX), где L = СО, Т = NH, a R = -СH2СН=СH-(5-(2-пиридил)аминокарбонил-2-фуранил).
Предпочтительные соединения формулы IX выбирают из группы, состоящей из следующих:
Соединение по формуле (IX), где L = СО, Т = О, а R = -CH2CH=CH2;
Соединение по формуле (IX), где L = СО, Т = О, а R = -СН2СН=CН-фенил;
Соединение по формуле (IX), где L = СО, Т = О, а R = -СН2СН=СН-(3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -CH2CH=CH2;
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=CН-фенил;
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(3-хинолил);
Соединение по формуле (IX), где L = СО, Т = N(СН3), а R = -СН2СН=CН2;
Соединение по формуле (IX), где L = СО, Т = N(СН3), а R = -СН2СН=СН-(3-хинолил);
Соединение по формуле (IX), где L = СО, Т = N(СН2СН2(СН3)2), а R =-СН2СН=СН2;
Соединение по формуле (IX), где L = СО, Т = N(СН2СН2N(СН3)2), а R =-СН2СН=СН-(3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-пиридил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(2-нафтил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(4-изохинолинил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(3,4-метилендиоксифенил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(8-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-нитрохинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(5-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-амино-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(1,8-нафтиридин-3-ил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-(ацетиламино)-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(6-хиноксалинил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-гидрокси-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-метокси-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(5-нитро-3-хинолил);
Соединение по формуле (IX), где L= СО, Т = NH, a R = -СН2СН=СН-(8-нитро-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(2-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(4-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2СН=СН-(4-карбоксил-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-фтор-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-метоксикарбонил-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(6-аминокарбонил-3-хинолил);
Соединение по формуле (IX), где L= СО, Т = NH, a R = -СН2СН=СН-(6-циано-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2СН=СН-(3-бром-6-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -CH2CH2CH2-(3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2-(2-(3-хинолил)циклопропил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2-С≡С-Н;
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(3-хинолил);
Соединение по формуле (IX), где L= СО, Т = NH, a R = -СН2-С≡С-(6-нитро-3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2-С≡С-фенил;
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2-С≡С-нафтил;
Соединение по формуле (IX), где L= СО, Т = NH, a R = -СН2-С≡С-(2-нафтил);
Соединение по формуле (IX), где L= CO, T= NH, a R= -СН2-С≡С-(6-метокси-2-нафтил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -СН2-С≡С-(6-хлор-2-нафтил);
Соединение по формуле (IX), где L = СО, Т = NH, a R = -CH2-C≡C-(6-хинолил);
Соединение по формуле (IX), где L = СО, Т = N(NH2), a R = -СH2СH=СH2;
Соединение по формуле (IX), где L = СО, Т = N(NH2), a R = -CH2CH=CH-(3-хинолил);
Соединение по формуле (IX), где L = СО, Т = N(NH2), a R = -CH2CH2CH2-(3-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH2, a R = -СН2СН=CН-нафтил; Соединение по формуле (IX), где L = СО, Т = NH2, a R = -СН2СН=СН-(3-(2-пиридил)-6-хинолил);
Соединение по формуле (IX), где L = СО, Т = NH2, a R = -СН2СН=СН-(7-хинолил); и
Соединение по формуле (IX), где L = СО, Т = NH, а R = -СН2-СН=СН-(5-(3-изоксазолил)-2-тиофенил).
Другим воплощением изобретения является способ получения производного эритромицина формулы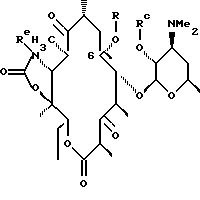
имеющих заместители R и Rp, причем R выбирают из группы, включающей
(1) замещенный метил, где заместитель представляет собой CN, арильную группу, замещенную арильную группу, гетероарильную группу, замещенную гетероарильную группу,
(2) С2-С10-алкил,
(3) замещенный С2-С10-алкил с по меньшей мере одним заместителем, который выбирают из группы, состоящей из
- гидроксила,
- оксо,
- арила,
- гетероарила,
- NR13R14, где R13 и R14 выбирают из группы, состоящей из водорода и С1-С12-алкила, замещенного арильной или гетероарильной группой, или группой СО2СН3,
- = N-O-R10, где R10 - водород, С1-С3-алкил или С1-С3-алкил с заместителем в виде арильной или гетероарильной группы, или арил,
- =NNHC(O)R10, где группа R10 определена ранее,
(4) С3-алкенил, который может быть замещен арилом, замещенным арилом, гетероарилом или замещенным гетероарилом,
(5) С3-алкинил; и
(6) С3-алкинил с заместителем, выбранным из арила, замещенного арила, гетероарила и замещенного гетероарила,
Re является Н или W-Rd, причем W отсутствует или представляет собой -NH-, a Rd выбирают из группы, включающей водород, С1-С6-алкильную группу, которая может быть замещена NR7R8, где R7 и R8 представляют собой С1-С6-алкил. Способ заключается в том, что соединение формулы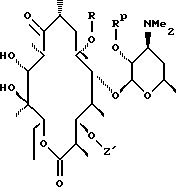
где R определен ранее, Rp - гидроксилзащитная группа, a Z' - остаток кладинозы с защищенной 4"-гидроксигруппой, обрабатывают гексаметилдисилазидом натрия и карбонилдиимидазолом с образованием соединения формулы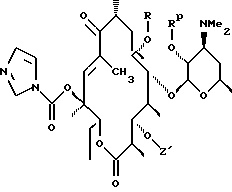
которое обрабатывают реагентом, выбранным из группы: аммиак, Re-NH2, гидразин, замещенный гидразин, с образованием соединения формулы где Re = Н или W-Rd, причем W отсутствует или представлен -NH-, a Rd определен ранее, последнее полученное соединение необязательно подвергают одному из следующих взаимодействий: если Re = Н, то соединение обрабатывают алкилирующим агентом формулы Rd-галоген, где
Rd определен ранее, с образованием соединения формулы последнего полученного соединения, где Re = W-Rd причем W отсутствует, a Rd определен ранее, если Re = W-Rd а W = -NH-, Rd = Н, то соединение обрабатывают алкилирующим агентом формулы Rd-галоген, где Rd определен ранее, с образованием соединения формулы последнего полученного соединения, где Re = W-Rd W = -NH-, a Rd указан выше, остаток кладинозы отщепляют кислотным гидролизом с образованием соединения формулы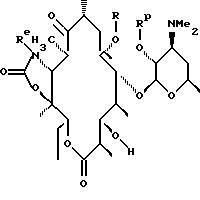
проводят окисление 3-гидроксильной группы, необязательно удаляют защитную группу и выделяют целевое соединение.
В предпочтительном воплощении описанного выше способа R является замещенной аллильной или пропаргильной группами, заместители в которых выбирают из следующих: 2-хлорфенил, 2-флуоренил-(2-фторенил), 2-метил-6-хинолил, 2-нафтил, 2-фенилэтенил, 2-хинолил, 3-(2-фуранил)-6-хинолил, 3-(2-пиридил)-6-хинолил, 3-хинолил, 3-(2-тиофенил)-6-хинолил, 3-бифенил, 3-бром-6-хинолил, 3-карбазолил, 3-хлор-6-хинолил, 3-циано-6-хинолил, 3-фтор-6-хинолил, 3-гидрокси-2-(N-(2-метоксифенил)амидо)-7-нафтил, 3-иодфенил, 3-метокси-6-хинолил, 3-нитрофенил, 3-фенил-6-хинолил, 3-хинолил, 4-бензоксазолил, 4-карбокси-3-хинолил, 4-хлор-2-трифторметил-6-хинолил, 4-хлорфенил, 4-фторнафтил, 4-фторфенил, 4-изохинолинил, 4-метоксифенил, 4-метилнафтил, 4-пиридил, 4-пирролилфенил, 4-хинолил, 5-(2-пиридил)аминокарбонил-2-фуранил, 5-(3-изоксазолил)-2-тиофенил, 5-бензимидазолил, 5-индолил, 5-изохинолил, 5-нитро-3-хинолил, 5-нитронафтил, 5-(N-(2-пиpидил)aминo)кapбoнил)фypaнил, 5-хинолил, 6-(ацетиламино)-3-хинолил, 6-(2-(тетразолил)этокси-2-нафтил, 6-(2-бромэтокси)-2-нафтил, 6-амино-3-хинолил, 6-аминокарбонил-3-хинолил, 6-β-D-галактопиранозил-2-нафтил, 6-бензоил-2-нафтил, 6-циано-3-хинолил, 6-фтор-3-хинолил, 6-гидрокси-2-нафтил, 6-гидрокси-3-хинолил, 6-метокси-2-нафтил, 6-метокси-3-хинолил, 6-метоксикарбонил-3-хинолил, 6-нитрохинолил, 6-хинолил, 6-хиноксалинил, 7-метокси-2-нафтил, 7-нитро-6-хиноксалинил, 7-хинолил, 8-хлор-3-хинолил, 8-нитро-3-хинолил, 8-хинолил, 9-оксофлуорен-2-ил, 1,3-диметил-2,4-диоксо-5-пиримидинил, 1,8-нафтиридин-3-ил, 3,4-метилендиоксифенил, 3,5-дихлорфенил, нафтил и фенил, в качестве реагента для обработки используют аммиак и Re-NH2, необязательные взаимодействия не проводят, в качестве окислителя используют N-хлорсукцинимид-диметилсульфид и карбодиимид-диметилсульфоксид, а необязательное удаление защитных группировок проводят при перемешивании в метаноле.
В более предпочтительном воплощении описанного выше способа R является замещенными аллильными или пропаргильными группами, заместители в которых выбирают из следующей группы: 2-метил-6-хинолил, 2-хинолил, 3-(2-фуранил)-6-хинолил, 3-(2-пиридил)-6-хинолил, 3-хинолил, 3-(2-тиофенил)-6-хинолил, 3-бром-6-хинолил, 3-хлор-6-хинолил, 3-циано-6-хинолил, 3-фтор-6-хинолил, 3-метокси-6-хинолил, 3-фенил-6-хинолил, 4-карбокси-3-хинолил, 4-хлор-2-трифторметил-6-хинолил, 4-изохинолинил, 4-хинолил, 5-изохинолил, 5-нитро-3-хинолил, 5-хинолил, 6-(ацетиламино)-3-хинолил, 6-амино-3-хинолил, 6-аминокарбонил-3-хинолил, 6-циано-3-хинолил, 6-фтор-3-хинолил, 6-гидрокси-3-хинолил, 6-метокси-3-хинолил, 6-метоксикарбонил-3-хинолил, 6-нитрохинолил, 6-хинолил, 7-хинолил, 8-хлор-3-хинолил, 8-нитро-3-хинолил и 8-хинолил.
Другим воплощением изобретения является способ получения соединения формулы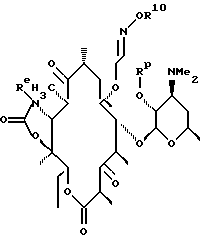
где Re = Н или W-Rd, причем W отсутствует или представляет собой -NH-, a Rd выбирают из группы, включающей водород, C1-C6-алкильную группу, которая может быть замещена NR7R8, где R7 и R8 представляют собой С1-С6-алкильную группу, а R10 = Н, С1-С3-алкил или С1-С3-алкил с заместителями в виде арила или гетероарила. Способ заключается в том, что соединение формулы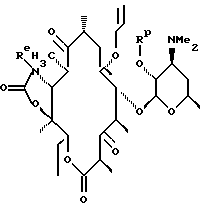
обрабатывают озоном с образованием соединения формулы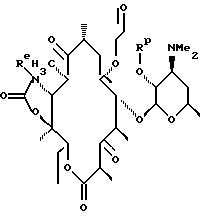
которое обрабатывают гидроксиламином формулы NH2-O-R10, где R10 определен ранее, по выбору удаляют защитную группу и выделяют целевое соединение.
В предпочтительном воплощении указанного выше способа Re = Н.
Другим воплощением изобретения является способ получения производного эритромицина формулы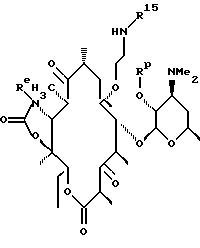
где Re = Н или W-Rd причем W отсутствует или представляет собой -NH-, Rd выбран из группы, включающей водород, С1-С6-алкильную группу, которая может быть замещена NR7R8, где R7 и R8 представляют собой С1-С6-алкильную группу, а R15 выбран из группы, включающей С1-С12-алкил с заместителем в виде арильной группы и С1-С12-алкил с заместителем в виде гетероарильной группы. Способ заключается в том, что осуществляют восстановительное аминирование соединения формулы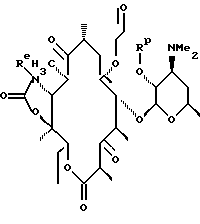
путем обработки его амином формулы NH2-R15, где R15 определен ранее, необязательно удаляют защитную группу и выделяют целевое соединение.
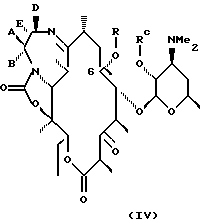
Другим воплощением изобретения является способ получения производного эритромицина IV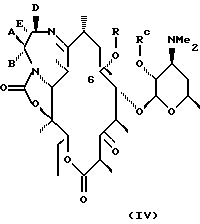
где Rc - водород или гидроксилзащитная группа,
R выбирают из группы, включающей
(1) замещенный метил, где заместитель представляет собой CN, арильную группу, замещенную арильную группу, гетероарильную группу, замещенную гетероарильную группу,
(2) С2-С10-алкил,
(3) замещенный С2-С10-алкил с по меньшей мере одним заместителем, который выбирают из группы, состоящей из
- гидроксила,
- оксо,
- арила,
- гетероарила,
- NR13R14, где R13 и R14 выбирают из группы, состоящей из водорода и С1-С12-алкила, замещенного арильной или гетероарильной группой, или группой СО2СН3,
- = N-O-R10, где R10 - водород, С1-С3-алкил или С1-С3-алкил с заместителем в виде арильной или гетероарильной группы, или арил,
- =NNHC(O)R10, где группа R10 определена ранее,
(4) С3-алкенил, который может быть замещен арилом, замещенным арилом, гетероарилом или замещенным гетероарилом,
(5) С3-алкинил и
(6) С3-алкинил с заместителем, выбранным из арила, замещенного арила, гетероарила и замещенного гетероарила,
а А, В, D и Е являются водородом. Способ заключается в том, что соединение формулы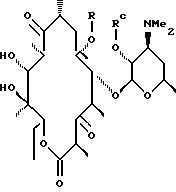
где R определен ранее, a Rc - гидроксилзащитная группа, обрабатывают ангидридом метансульфокислоты в пиридине и полученное метансульфонильное производное обрабатывают свободным амином с образованием соединения формулы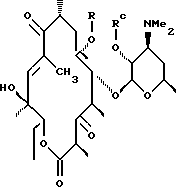
которое обрабатывают гидридом щелочного металла и карбонилдиимидазолом с образованием соединения формулы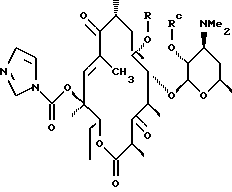
полученное соединение обрабатывают диамином формулы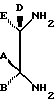
где А, В, D и Е определены ранее, с образованием соединения формулы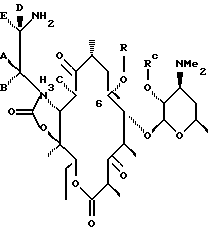
которое подвергают циклизации путем обработки разбавленной минеральной или органической кислотой, затем необязательно удаляют защитную группировку и выделяют целевое соединение.
В изобретении представлен также другой вариант способа получения производного эритромицина формулы IV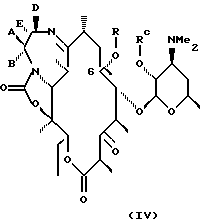
определенного выше, заключающийся в том, что соединение формулы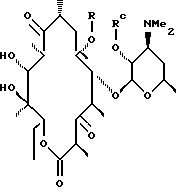
где R определен ранее, a Rc - гидроксилзащитная группа, обрабатывают ангидридом метансульфокислоты в пиридине и полученное метансульфонильное производное обрабатывают свободным амином с образованием соединения формулы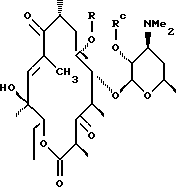
которое обрабатывают гидридом щелочного металла и карбонилдиимидазолом с образованием соединения формулы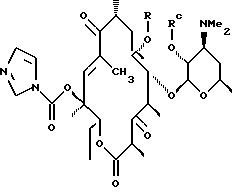
полученное соединение обрабатывают амином формулы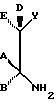
где А, В, D и Е определены выше, a Y - гидроксильная группа, с образованием соединения формулы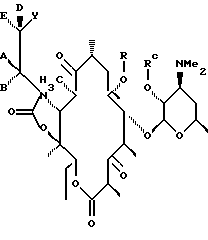
которое подвергают взаимодействию с трифенилфосфином, дифенилфосфорилазидом или этилазодикарбоксилатом в тетрагидрофуране с образованием соединения, в котором Y - N3, и отщепляют защитную группировку с образованием соединения, где Y - N3, a Rc - Н,
полученное соединение обрабатывают восстанавливающим агентом, диалкилалюмогидридом с образованием соединения формулы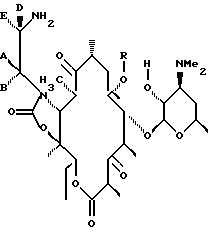
которое подвергают циклизации путем обработки разбавленной минеральной или органической кислотой и выделяют целевое соединение.
В более предпочтительном воплощении изобретения соединения формулы IV имеют формулу VII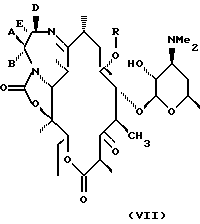
где А, В, D, Е, R определены выше.
Типичные производные эритромицина формулы VII включают, например,
соединение формулы (VII), где A,B,D,E = Н, а R = аллил;
соединение формулы (VII), где A,B,D,E = Н, а R = СН2СН2СН3;
соединение формулы (VII), где A,B,D,E=Н, a R=CH2CH2NH2;
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=NОН;
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН2СН2ОН;
соединение формулы (VII), где A,B,D,E=Н, а R=CH2CN;
соединение формулы (VII), где A,B,D,E=Н, а R=СН2-фенил;
соединение формулы (VII), где A,B,D,E=Н, а R=СН2-(4-пиридил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2-(4-хинолил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=СН-(4-пиридил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=СН-(4-хлорфенил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=СН-(4-фторфенил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=СН-(4-метоксифенил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН2СН2-фенил;
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=СН-(4-пиридил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН2СН2-(4-пиридил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=СН-(4-хинолил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН2СН2(4-хинолил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=СН-(5-хинолил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН2СН2-(5-хинолил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН-CН-(4-бензоксазолил);
соединение формулы (VII), где A,B,D,E=Н, а R=CH2-CH=CH-(4-бензимидазолил);
соединение формулы (VII), где A,B,D,E=Н, а R=СН2СН=СН-(8-хинолил);
соединение формулы (VII), где A,B,D,E=H, a R=-СН2СН2NНСН2-фенил;
соединение формулы (VII), где А,В,D,Е=H, а R=-СН2СН2NHСН2-(4-пиридил);
соединение формулы (VII), где A,B,D,E=H, а R=-СН2СН2NНСН2-(4-хинолил);
соединение формулы (VII), где A, B, D, E=H, a R=-CH2CH2NHCH2CH2-(2-хлорфенил);
соединение формулы (VII), где A,E,B,D=H, а R=аллил;
соединение формулы (VII), где А=метил, B,D,E=H, a R=аллил;
соединение формулы (VII), где A,B,D,E=H, a R=-СН2СН=СН-(3-хинолил) и
соединение формулы (VII), где A,B,D,E=H, a R=3-(3-хинолил)пропил.
Предпочтительные соединения формулы VII выбирают из группы:
соединение по формуле (VII), где A,B,D,E=H, a R=аллил;
соединение по формуле (VII), где А,В,D,Е=H, a R=СН2СН=СН-(3-хинолил);
и соединение по формуле (VII), где A,B,D,E=H, а R=CH2CH2CH2-(3-хинолил).
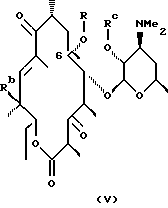
Другим воплощением настоящего изобретения являются соединения формулы V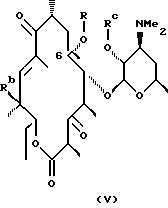
где R, Rc и Rd определены ранее.
Предпочтительным воплощением соединений формулы V согласно изобретению являются соединения формулы VI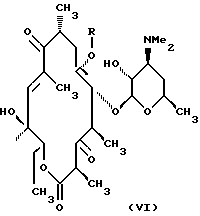
где R определен ранее.
Типичные представители соединений формулы VI включают, но не ограничиваются ими, следующие:
Соединение формулы (VI), где R=CH2CH2CH3;
Соединение формулы (VI), где R=СН2СН=СН;
Соединение формулы (VI), где R=СН2CH=CH-фенил;
Соединение формулы (VI), где R=СН2СН2СН2-фенил;
Соединение формулы (VI), где R=CH2CH=NOH;
Соединение формулы (VI), где R=CH2CH2NH2;
Соединение формулы (VI), где R=СН2СН2NHСН2-фенил;
Соединение формулы (VI), где R=СН2СН2NHСН2-(4-пиридил);
Соединение формулы (VI), где R=СН2СН2NНСН2-(4-хинолил);
Соединение формулы (VI), где R=СН2СН2NНCH(CО2CH3)CH2-фенил;
Соединение формулы (VI), где R=CH2CN;
Соединение формулы (VI), где R=СН2СН=СН-(4-метоксифенил);
Соединение формулы (VI), где R=СН2СН=СН-(4-хлорфенил);
Соединение формулы (VI), где R=СН2СН=СН-(4-фторфенил);
Соединение формулы (VI), где R=СН2СН=СН-(3-хинолил);
Соединение формулы (VI), где R=СН2СН=СН-(8-хинолил); и
Соединение формулы (VI), где R=СН2СН2NНСН2СН2-(2-хлорфенил).
Другим воплощением изобретения является способ получения соединения формулы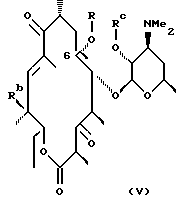
где Rb - гидроксил или -O-С(O)-имидазолил,
Rc - водород или гидроксилзащитная группа,
а R выбирают из группы, включающей:
(1) замещенный метил, где заместитель представляет собой CN, арильную группу, замещенную арильную группу, гетероарильную группу, замещенную гетероарильную группу,
(2) С2-С10-алкил,
(3) замещенный С2-С10-алкил с по меньшей мере одним заместителем, который выбирают из группы, состоящей из
- гидроксила,
- оксо,
- арила,
- гетероарила,
- NR13R14, где R13 и R14 выбирают из группы, состоящей из водорода и С1-С12-алкила, замещенного арильной или гетероарильной группой, или группой СО2СН3,
- = N-O-R10, где R10 - водород, С1-С3-алкил или С1-С3-алкил с заместителем в виде арильной или гетероарильной группы, или арил,
- =NNHC(O)R10, где группа R10 определена ранее,
(4) С3-алкенил, который может быть замещен арилом, замещенным арилом, гетероарилом или замещенным гетероарилом,
(5) С3-алкинил; и
(6) С3-алкинил с заместителем, выбранным из арила, замещенного арила, гетероарила и замещенного гетероарила. Способ заключается в том, что соединение формулы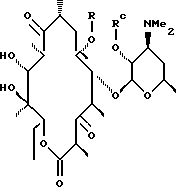
где Rc гидроксилзащитная группа, а R определен ранее, подвергают одной из следующих комбинаций реакций: проводят обработку гидридом щелочного металла и фосгенсодержащим реагентом, который выбирают из фосгена, дифосгена и трифосгена, в безводной среде, а затем водным основанием, катализирующим реакцию декарбоксилирования, либо проводят реакцию с ангидридом метансульфокислоты в пиридине с последующей обработкой амином и получают соединение формулы V, где Rb=гидроксил, необязательно обрабатывают соединение формулы V гидридом щелочного металла и карбонилдиимидазолом с образованием соединения формулы V, где Rb=-O-С(O)-имидазолил, затем необязательно удаляют защитную группировку и выделяют целевое соединение.
Определение используемых терминов и сокращений.
Используемые в описании и прилагаемой формуле изобретения термины и сокращения имеют следующие значения.
Терминами "С1-С3-алкил", "С1-С6-алкил", "С1-С12-алкил" в тексте заявки названы радикалы - производные насыщенных линейных или разветвленных углеводородов, содержащих в цепи 1-3, 1-6, 1-12 атомов углерода соответственно, образованные путем удаления у них одного атома водорода. Примерами С1-С3-алкильных групп (радикалов) являются метил, этил, пропил, изопропил; примеры С1-С6-алкильных радикалов включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, неопентил (амил) и н-гексил, но не ограничиваются ими. Примеры С1-С12-алкильных радикалов включают наряду с уже приведенными группировками, н-гептил, н-октил, н-нонил, н-децил, н-ундецил, н-додецил, но не ограничиваются ими.
Термином "C1-C6-алкокси" в тексте заявки названы "С1-С6-алкилы" определенные ранее присоединенные к основной части молекулы через атом кислорода. Примерами С1-С6-алкоксигрупп являются метокси-, этокси-, пропокси-, изопропокси-, н-бутокси-, трет-бутокси-, неопентокси (н-амилокси-), н-гексокси-, но не ограничиваются ими.
Термином "С1-С12-алкенил" принято обозначать моновалентные углеводородные цепи, содержащие от 1 до 12 атомов углерода и имеющие по крайней мере одну двойную связь между двумя атомами углерода. Алкенильные группы включают, например, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил и т.п.
Термином "С1-С12-алкинил" в тексте заявки названы моновалентные группы - производные углеводородов, содержащих от 1 до 12 атомов углерода и имеющих по крайней мере одну тройную связь между двумя атомами углерода, образованные отщеплением одного атома водорода. В качестве примера алкинильных групп можно привести этинил, 2-пропинил (пропаргил), 1-пропинил и т.п.
Термин "алкилен" обозначает двухвалентную группу, образованную из насыщенного углеводорода с линейной или разветвленной углеродной цепью, при отщеплении двух атомов водорода, например метилен, 1,2-этилен, 1,1-этилен, 1,3-пропилен, 2,2-диметилпропилен и т.п.
Термином "С1-С3-алкиламино" в тексте заявки обозначаются определенные ранее С1-С3-алкильные группы, присоединенные к основной части молекулы через атом азота. Примерами С1-С3-алкиламиногрупп являются метиламино-, диметиламино-, этиламино-, диэтиламино-, пропиламиногруппы, но не ограничиваются ими.
Термин "оксо" принят для обозначения алкильной группы, определенной выше, у которой на одном из углеродных атомов 2 атома водорода замещены одним атомом кислорода (например, карбонильная группа).
Термином "апротонный растворитель" в тексте заявки принято называть растворители с относительно слабой активностью протонов, т.е. не выступающих в реакции в качестве доноров протонов. Не ограничивающими примерами таких растворителей являются углеводороды, такие как гексан и толуол, например галогенированные углеводороды, такие как хлористый метилен, хлористый этилен, хлороформ и т.п., гетероарилы (гетероциклические соединения), например тетрагидрофуран и N-метилпирролидинон, эфиры, например, диэтиловый эфир, бис-метоксиметиловый эфир. Для специалистов эти растворители являются общеизвестными и представляется вполне очевидным, что эти растворители порознь или в смеси могут оказаться предпочтительными для конкретного вещества и конкретных условий реакции, в зависимости, например, от таких факторов, как растворимость реагентов, их реакционная способность и предпочтительный интервал температур. Более подробно свойства апротонных растворителей обсуждаются в учебниках по органической химии или в специальных монографиях, например в книге Organic Solvents Physical Properties and Methods of Purification, 4-ое издание, под редакцией John A.Riddick и других, Vol.II, in the Techniques of Chemistry Series, John Wiley & Sons, NY, 1986.
Термином "арил" в тексте заявки обозначаются моно- или бициклические карбоциклические системы, имеющие один или два ароматических кольца, включая, но не ограничиваясь, фенил, нафтил, тетрагидронафтил, инданил, инденил и т.п. Арильные группы (включая бициклические арильные группы) могут не иметь заместителей или могут иметь один, два или три заместителя, которые независимо выбирают из низших алкилов, замещенных низших алкилов, галогенированных алкилов, алкокси-, тиоалкокси-, амино-, алкиламино-, диалкиламино-, ациламино-, циано-, гидрокси-, галогено-, меркапто-, нитро-, карбоксальдегидов, карбокси-, алкоксикарбонильных и карбоксамидных групп. В дополнение к этому замещенные арильные группы включают тетрафторфенил и пентафторфенил.
Термином "С3-С12-циклоалкил" обозначают моновалентную группу, полученную из моноциклических и бициклических насыщенных карбоциклических соединений, при отщеплении одного атома водорода. Примеры могут включать циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2.2.1]гептил и бицикло[2.2.2] октил.
Термином "гало" или "галоген" в контексте заявки определяются атомы, выбранные их фтора, хлора, брома и йода.
Термином "алкиламино" обозначаются группы -NHR', где R'=алкил, как указано ранее. Примерами алкиламинов являются метиламино-, этиламино-, изопропиламино- и т.п. группы.
Термин "диалкиламино" относится к группам, имеющим строение -NR'R", где R' и R" независимо выбираются из алкильных групп, определенных ранее. Кроме того, R' и R" взятые вместе могут по выбору быть -(СН2)k-, где k целое число от 2 до 6. Примеры диалкиламиногрупп включают диметиламино-, диэтиламинокарбонил, метилэтиламино-, пиперидино- и т.п.
Термином "галоалкил" обозначена алкильная группа, определенная выше, к которой присоединены один, два или три атома галогенов, примером которой могут быть такие группы, как хлорметильная, бромэтильная, трифторметильная и т.п.
Термин "алкоксикарбонил" относится к сложноэфирной группе, в том числе к алкоксигруппе, присоединенной к основной части молекулы через карбонильную группу, например метоксикарбонил, этоксикарбонил и т.п.
Термин "тиоалкокси" относится к алкильной группе, определенной ранее, присоединенной к основной части молекулы через атом серы.
Термин "карбоксальдегид", используемый в контексте заявки, относится к группе -СНО.
Термин "карбокси", используемый в контексте заявки, относится к группе -СО2Н.
Термин "карбоксамид", как использован в тексте заявки, относится к группе -CONHR'R", где R' и R" независимо выбирают из водорода или алкила, или R' и R" взятые вместе необязательно могут представлять собой -(СН2)k-, где k целое число от 2 до 6.
Термин "гетероарил", как указано в тексте заявки, относится к циклическому ароматическому радикалу, имеющему от 5 до 10 атомов в кольце, причем один из них представлен S, О и N; циклы могут включать или не включать дополнительные один или два гетероатома, которые независимо могут быть S, О и N; остальные атомы в цикле представлены атомом углерода; такой радикал может быть присоединен к основной части молекулы через любой из атомов цикла. Примерами таких радикалов являются пиридил, пиразинил, пиримидинил, пирролил, пиразолил, имидазолил, тиазолил, оксазолил, изооксазолил, тиадиазолил, оксадиазолил, тиофенил, фуранил, хинолинил, изохинолинил и т.п.
Термин "гетероциклоалкил", как указано в тексте заявки, относится к неароматической частично ненасыщенной или полностью насыщенной 3-10-членной циклической системе (структуре), которая включает одиночные циклы размером от 3 до 8 атомов и ди- или трициклические системы, которые могут включать ароматические шестичленные арильные или гетероарильные кольца, конденсированные (слитые) с неароматическими кольцами. Эти гетероциклоалкильные кольца включают такие, которые имеют от 1 до 3 гетероатомов, независимо выбранных из атомов кислорода, серы и азота, причем атомы азота и серы выборочно могут быть окислены, а атом азота может, но необязательно, присутствовать в виде четвертичного основания.
Типичные гетероциклы включают пирролидинил, пиразолинил, пиразолидинил, имидазолинидил, пиперидинил, пиперазинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, тетрагидрофурил.
Характерные гетероциклоалкильные конденсированные системы, используемые при синтезе соединений, согласно изобретению включают: 3-метил-4-(3-метилфенил)пиперазин, 3-метилпиперидин, 4-(бис-(4-фторфенил)метил)пиперазин, 4-(дифенилметил)пиперазин, 4-(этоксикарбонил)пиперазин, 4-(этоксикарбонилметил)пиперазин, 4-(фенилметил)пиперазин, 4-(1-фенилэтил)пиперазин, 4-(1,1-диметилэтоксикарбонил)пиперазин, 4-(2-(бис(2-пропенил)амино)этил)пиперазин, 4-(2-(диэтиламиноэтил)этил)пиперазин, 4-(2-хлорфенил)пиперазин, 4-(2-цианофенил)пиперазин, 4-(2-этоксифенил)пиперазин, 4-(2-этилфенил)пиперазин, 4-(2-фторфенил)пиперазин, 4-(2-гидроксиэтил)пиперазин, 4-(2-метоксиэтил)пиперазин, 4-(2-метоксифенил)пиперазин, 4-(2-метилфенил)пиперазин, 4-(2-метилтиофенил)пиперазин, 4-(2-нитрофенил)пиперазин, 4-(2-фенилэтил)пиперазин, 4-(2-пиридил)пиперазин, 4-(2-пиримидинил)пиперазин, 4-(2,3-диметилфенил)пиперазин, 4-(2,4-дифторфенил)пиперазин, 4-(2,4-диметоксифенил)пиперазин, 4-(2,4-диметилфенил)пиперазин, 4-(2,5-диметилфенил)пиперазин, 4-(2,6-диметилфенил)пиперазин, 4-(3-хлорфенил)пиперазин, 4-(3-метилфенил)пиперазин, 4-(3-трифторметилфенил)пиперазин, 4-(3,4-дихлорфенил)пиперазин, 4-(3,4-диметоксифенил)пиперазин, 4-(3,4-диметилфенил)пиперазин, 4-(3,4-метилендиоксифенил)пиперазин, 4-(3,4,5-триметоксифенил)пиперазин, 4-(3,5-дихлорфенил)пиперазин, 4-(3,5-диметоксифенил)пиперазин, 4-(4-(фенилметокси)фенил)пиперазин, 4-(4-(1,1-диметилэтил)фенилметил)пиперазин, 4-(4-хлор-3-трифторметилфенил)пиперазин, 4-(4-хлорфенил)-3-метилпиперазин, 4-(4-хлорфенил)пиперазин, 4-(4-хлорфенилметил)пиперазин, 4-(4-фторфенил)пиперазин, 4-(4-метоксифенил)пиперазин, 4-(4-метилфенил)пиперазин, 4-(4-нитрофенил)пиперазин, 4-(4-трифторметилфенил)пиперазин, 4-циклогексилпиперазин, 4-этилпиперазин, 4-гидрокси-4-(4-хлорфенил)метилпиперидин, 4-гидрокси-4-фенилпиперидин, 4-гидроксипирролидин, 4-метилпиперазин, 4-фенилпиперазин, 4-пиперидинилпиперазин, 4-((2-фуранил)карбонил)пиперазин, 4-((1,3-диоксолан-5-ил)метил)пиперазин, 6-фтор-1,2,3,4-тетрагидро-2-метилхинолин, 1,4-диазациклогептан, 2,3-дигидроиндолил, 3,3-диметилпиперидин, 4,4-этилендиоксипиперидин, 1,2,3,4-тетрагидро-изохинолин, 1,2,3,4-тетрагидро-хинолин, азациклооктан, декагидрохинолин, пиперазин, пиперидин, пирролидин, тиоморфолин, триазол.
Термин "гетероарилалкил", как указано в тексте заявки, относится к гетероарильной группе, определенной выше, присоединенной к основной части молекулы через алкиленовую группу, причем эта группа включает от 1 до 4 атомов углерода.
Термин "защитная группа гидроксила", как использовано в тексте заявки, относится к легко отщепляемой группе, которая, как известно из уровня техники, защищает гидроксильную группу от побочных реакций по ходу синтеза и которая должна удаляться избирательно. Использование защитных групп гидроксила является общеизвестным способом защиты гидроксила от побочных реакций при выполнении синтезов. Известно множество защитных группировок, см., например, в книге T. H. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2-ое издание, John Wiley & Sons, NY (1991). Защитные группировки гидроксила включают, но не ограничиваются, метилтиометил, трет-диметилсилил, трет-бутилдифенилсилил, простые эфиры, такие как метоксиметиловый, сложные эфиры, включающие ацетил, бензоил и т.п.
Термин "защитная группировка кетона", используемая в контексте заявки, относится к легко удаляемым группам, которые известны в уровне техники как защищающие кетогруппу от побочных реакций при выполнении синтезов и которые должны сниматься избирательно. Использование защитных групп кетона является общеизвестным способом защиты кетонных группировок от побочных реакций в ходе синтезов. Известно множество защитных группировок, см., например, в книге T. H. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2-ое издание, John Wiley & Sons, NY (1991). Примеры кетонзащитных группировок включают, но не ограничиваются этими, кетали, оксимы, O-замещенные оксимы, например O-бензилоксим, O-фенилтиометилоксим, 1-изопропоксициклогексилоксим и т.п.
Термин "защищенная гидроксильная группа" относится к гидроксильной группе, несущей защитную группировку гидроксила, определенную выше, включая, например, бензоил-, ацетил-, триметилсилил-, триэтилсилил-, метоксиметил- и др. группы.
Термин "протогенный органический растворитель", как используется в контексте заявки, относится к растворителям, которые могут служить донорами протонов, таким как спирты, например метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол и т.п. Такие растворители хорошо известны специалистами и представляется вполне очевидным, что эти растворители порознь или в смеси могут оказаться предпочтительными для конкретного вещества и конкретных условий реакции в зависимости, например, от таких факторов, как растворимость реагентов, их реакционная способность и предпочтительный температурный режим. Более детально свойства протогенных растворителей обсуждаются в учебниках по органической химии или в специальных монографиях, например, в книге Organic Solvents Physical Properties and Methods of Purification, 4-ое издание, под ред. John A. Riddick и других, Vol.II, in the Techniques of Chemistry Series, John Wiley & Sons, NY, 1986.
Термин "замещенный арил", используемый в контексте заявки, относится к определенной в тексте арильной группе, в которой один, два или три атома водорода могут быть независимо замещены на Cl, Br, F, I, ОН, CN, C1-С3-алкил, С1-С6-алкоксигруппу, С1-С6-алкоксигруппу, замещенную арилом, галогеналкилом, тиоалкокси, амино, алкиламино, диалкиламино, меркапто, нитро, карбоксальдегидо, карбокси, алкоксикарбонильной и карбоксамидной группами. Дополнительно любой из заместителей может быть арильной, гетероарильной или гетероциклоалкильной группой. Замещенные арильные группы также включают тетрафторфенил и пентафторфенил.
Термин "замещенный гетероарил", используемый в контексте заявки, относится к определенной в тексте гетероарильной группе, в которой один, два или три атома водорода могут быть независимо замещены на Cl, Br, F, I, ОН, CN, С1-С3-алкил, C1-C6-алкоксигруппу, C1-C6-алкоксигруппу, замещенную арилом, галогеналкилом, тиоалкокси, амино, алкиламино, диалкиламино, меркапто, нитро, карбоксальдегидо, карбокси, алкоксикарбонильной и карбоксамидной группами. Дополнительно любой из заместителей может быть арильной, гетероарильной или гетероциклоалкильной группой.
Термин "замещенный гетероциклоалкил", используемый в контексте заявки, относится к определенной в тексте гетероциклоалкильной группе, в которой один, два или три атома водорода могут быть независимо замещены на Cl, Br, F, I, ОН, CN, С1-С3-алкил, С1-С6-алкоксигруппу, С1-С6-алкоксигруппу, замещенную арилом, галогеналкилом, тиоалкокси, амино, алкиламино, диалкиламино, меркапто, нитро, карбоксальдегидо, карбокси, алкоксикарбонильной и карбоксамидной группами. Дополнительно любой из заместителей может быть арильной, гетероарильной или гетероциклоалкильной группой.
В соединениях согласно изобретению могут присутствовать многочисленные асимметричные центры. За исключением случаев, в которых отмечено иначе, в настоящем изобретении исследуются различные стереоизомеры и смеси изомеров. Соответственно, всякий раз когда химическая связь изображается волнистой линией, это означает, что речь идет о смеси стереоизомеров или об индивидуальном изомере с установленной или неустановленной ориентацией.
Как указано в тексте заявки, термин "фармацевтически приемлемые соли" относится к тем солям настоящего изобретения, которые в рамках врачебного здравого смысла безопасны при контакте с тканями человека и животных, т.е. нетоксичны, не вызывают раздражения, аллергической реакции и т.п., и соизмеримы с разумным соотношением польза/риск.
Фармацевтически приемлемые соли известны специалистам. Подробно эти соли описаны, например, в статье S.M. Berge с соавт., J. Pharmaceutical Sciences, 66: 1-19 (1977), введенной в качестве ссылки в текст заявки. Соли могут быть приготовлены in situ на последней стадии выделения и очистки целевого вещества, или они могут быть приготовлены специально путем взаимодействия свободного основания с подходящей органической кислотой.
Примерами фармацевтически приемлемых, нетоксичных солей, полученных при добавлении кислоты, являются соли, образованные аминогруппой с неорганическими кислотами, такими как соляная, бромистоводородная, фосфорная, серная и хлорная кислоты, или с органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, лимонная, янтарная или малоновая кислоты. Соли могут быть получены с помощью других известных в уровне техники методов, например ионным обменом. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и т.п. соли. Типичными солями щелочных или щелочноземельных металлов являются соли натрия, лития, калия, кальция, магния и т.п. Другие фармацевтически приемлемые соли включают, когда подходящими катионами являются нетоксичный аммоний, четвертичный аммоний и амин, такие, что образованы с использованием противоионов таких, как галогены, гидроокиси, карбоксилаты, сульфаты, фосфаты, нитраты, низшие алкилсульфонаты и арилсульфонаты.
Как использовано в контексте заявки, термин "фармацевтически приемлемые эфиры" относится к эфирам, которые могут гидролизоваться in vivo и включают те соединения, которые легко расщепляются в организме человека с образованием действующего вещества или его соли. Подходящие эфирные группы включают, например, те, которые образованы фармацевтически приемлемыми алифатическими карбоновыми кислотами, в особенности алкановыми, алкеновыми, циклоалкановыми и алкандионовыми, в которых каждый остаток алкила или алкенила предпочтительно содержит не более 6 атомов углерода. Примеры таких эфиров включают формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты.
Используемый в контексте заявки термин "фармацевтически приемлемые предшественники лекарств" относится к таким предшественникам соединений настоящего изобретения, которые в рамках врачебного здравого смысла безопасны при контакте с тканями человека и животных, т.е. нетоксичны, не вызывают раздражения, аллергической реакции и т.п., соизмеримы с разумным соотношением польза/риск и эффективны при целевом применении, так же как и амфотерные ионные формы, где это возможно, соединений в соответствии с настоящим изобретением. Термин "пролекарство" (предшественник лекарства) относится к соединениям, которые быстро трансформируются in vivo с образованием активного соединения указанной выше формулы, например, посредством гидролиза в крови. Подробное обсуждение дано в статье T.Higuchi, V.Stella, Pro-drugs as Novel Delivery Systems, vol. 14, A.C.S. Symposium Series и в книге под редакцией Edward В. Roche, Bioreversible Carriers in Drug Design, Am. Pharm. Ass. and Pergamon Press, 1987. Оба источника введены в качестве ссылок в текст заявки.
Антибактериальная активность
Представители соединений настоящего изобретения испытывались на антибактериальную активность in vitro следующим образом. Готовили 12 чашек Петри, содержащих по 10 мл стерилизованного Brain Heart Infusion (BHI) агара (Difco 0418-01-5), куда добавляли образцы тестируемых веществ при последовательном разведении водой. Каждый планшет засевали с помощью блока Стира (Steer) для нанесения с использованием до 32 различных микроорганизмов при разведении 1: 100 (или 1: 10 для медленно растущих штаммов, таких как Micrococcus и Streptococcus). Инокулированные планшеты инкубировали 20-24 ч при 35-37oС. Одновременно в начале и конце каждого теста готовили и инкубировали контрольный планшет с BHI агаром, но без тестируемого вещества.
Для более надежного контроля, а также с целью контроля за воспроизводимостью результатов, готовили и инкубировали дополнительный планшет, содержащий вещество с известным спектром действия на тестируемые микроорганизмы, принадлежащее к тому же классу анитибиотиков, что и тестируемые вещества. Для этой цели использовали эритромицин А.
После инкубации каждый планшет просматривали визуально. Минимальную ингибирующую концентрацию (МIС) определяли как самую низкую концентрацию тестируемого вещества в мкг/мл, при которой тормозился рост тест-микроорганизма, образовывались мутные или рассеянные колонии по сравнению с ростом в контроле. Результаты тестирования, приведенные в табл.1 (MIC, мкг/мл), демонстрируют антибактериальную активность веществ согласно изобретению.
Фармацевтические композиции
Фармацевтические композиции настоящего изобретения представляют собой терапевтически эффективное количество соединения настоящего изобретения смешанного с одним или более фармацевтически приемлемых носителей. Как указано в контексте заявки, термин "фармацевтически приемлемый носитель" означает нетоксичный, инертный, твердый, полутвердый или жидкий наполнитель, разбавитель, капсулирующий материал или вспомогательный компонент любого типа. Примером материалов, которые могут служить как фармацевтически приемлемые носители, являются сахара, такие как лактоза, глюкоза и сахароза; крахмал, например, кукурузный и картофельный; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза (натриевая соль), этилцеллюлоза, ацетилцеллюлоза; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как кокосовое масло и свечной воск; масла, такие как арахисовое, хлопковое, подсолнечное, кунжутное, оливковое, кукурузное и соевое; спирты, такие как пропиленгликоль; сложные эфиры, такие как этиллаурат; агар; забуферивающие агенты, такие как гидроокиси магния и алюминия; альгиновая кислота; апирогенная вода; изотонический хлористый натрий; раствор Рингера; этиловый спирт и фосфатный буфер; композиция может включать также другие нетоксичные совместимые смазочные материалы, такие как лаурилсульфат натрия и стеарат магния; а также красители, освобождающие агенты, капсулирующие агенты, подсластители, вкусовые и ароматизирующие агенты, консерванты и антиоксиданты в соответствии с прописью изготовителя. Фармацевтические композиции настоящего изобретения могут вводиться людям и другим животным орально, ректально, парентерально, внутриполостно, интравагинально, внутрибрюшинно, местно (как порошки, мази или капли), интрабуккально (внутриротовым способом), или ингаляционно орально или интраназально.
Жидкие формы для орального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным компонентам жидкие формы могут содержать обычные инертные разбавители, например воду или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в особенности хлопковое, арахисовое, кукурузное, из зародышей пшеницы, оливковое, касторовое, кунжутное), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и эфиры жирных кислот с сорбитом и смеси из них. Кроме инертных разбавителей, оральные композиции могут также включать адьюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, вкусовые и ароматизирующие агенты. Препараты для инъекций, например вводимые в стерильных условиях водные и масляные суспензии, могут быть приготовлены согласно известным прописям с использованием диспергирующих или смачивающих и суспендирующих агентов. Стерильные инъекционные препараты могут также быть приготовлены в виде стерильного раствора, суспензии, или эмульсии в нетоксичном парентерально допустимом разбавителе или растворителе, например в 1,3-бутандиоле. Допустимые связующие вещества и растворители, которые могут быть использованы для этих целей, включают воду, раствор Рингера, U.S.Р. и изотонический раствор хлористого натрия. Дополнительно в качестве растворителя или суспендирующей среды традиционно используются стерильные жирные масла. Для этих целей могут использоваться любые слабые жирные масла, включая синтетические моно- и диглицериды. Кроме того, для приготовления инъекционных препаратов могут использоваться жирные кислоты, например олеиновая кислота.
Инъекционные составы могут быть стерилизованы, например, фильтрованием через бактериальный фильтр или путем включения стерилизующих агентов в виде стерильных твердых композиций, которые перед использованием могут быть растворены или диспергированы в воде или другой стерильной инъекционной жидкости.
Для того чтобы пролонгировать действие препарата часто бывает желательно замедлить его абсорбцию при подкожной и внутримышечной инъекции. Это достигается за счет использования суспензии кристаллического или аморфного материала, плохо растворимого в воде. В этом случае скорость абсорбции препарата зависит от скорости его растворения в воде, которая в свою очередь зависит от кристаллической формы и размеров кристаллов. Замедленная абсорбция лекарственной формы для парентерального введения достигается путем растворения и суспендирования препарата в масле. Инъекционные депонированные формы готовятся путем микрокапсулирования препарата в биодеградируемые полимеры, такие как полилактид-полигликолид. Скорость высвобождения препарата регулируется в зависимости от соотношения препарат/полимер и природы используемого полимера. Примеры других биодеградируемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депонированные инъекционные формы также готовятся путем включения препарата в липосомы или микроэмульсии, совместимые с тканями организма.
Композиции для ректального и вагинального введения представляют собой главным образом суппозитории (свечи), которые готовят путем смешивания соединений согласно настоящему изобретению с подходящими, не вызывающими раздражения наполнителями или носителями, такими как кокосовое масло, полиэтиленгликоль или свечной воск, который находится в твердом состоянии при комнатной температуре, но жидким при температуре тела, т.е. плавится в ректальной и вагинальной полости, освобождая активное вещество.
Твердые формы для орального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких формах активное вещество находится в смеси по крайней мере с одним инертным, фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или дикальций фосфат, и/или
а) носителями и наполнителями, такими как крахмал, лактоза, сахароза, глюкоза, маннит, кремниевая кислота,
б) связующими агентами, такими, например, как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь,
в) увлажнителями, такими как глицерин,
г) дезинтегрирующими агентами, такими как агар-агар, карбонат кальция, крахмал из картофеля и тапиоки, альгиновая кислота, некоторые силикаты, карбонат натрия,
д) агентами, тормозящмими растворение, такими как парафин,
е) ускорителями абсобции, такими как четвертичные аммонийные основания,
ж) смачивающими агентами такими как цетиловый спирт и глицерин моностеарат,
з) абсорбентами, такими как каолин и бентонитовая глина,
и) смазочными материалами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и смеси из перечисленных материалов. В случае капсул, таблеток и пилюль лекарственная форма может включать буферные агенты.
Твердые композиции подобного типа могут также использоваться в качестве наполнителей мягких и твердых желатиновых капсул с применением таких наполнителей как лактоза и молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
Активные компоненты могут быть также приготовлены в виде микрокапсулированных форм в смеси с одним из наполнителей перечисленных выше. Такие формы в виде таблеток, драже, капсул, пилюль и гранул могут быть приготовлены с покрытиями и в оболочках, таких как энтеральная оболочка, облочка с контролируемым освобождением активного вещества и другими типами покрытий, подробно описанным в фармацевтических руководствах. В таких формах активное вещество может находиться в смеси по крайней мере с одним из инертных наполнителей, таких как сахароза, лактоза или крахмал. Как показывает обычная практика, такие формы могут включать дополнительные вещества, такие как другие инертные наполнители, в том числе смазочные материалы и др. вспомогательные материалы, такие как стеарат магния и микрокристаллическая целлюлоза.
В случае капсул, таблеток и пилюль лекарственная форма может включать буферные агенты. Они могут также содержать непроницаемые агенты или могут быть также такими композициями, которые освобождают активные ингредиенты только, или предпочтительно в определенных отделах желудочно-кишечного тракта, или же как вариант высвобождают активные вещества замедленно (пролонгированное действие). Примером внедряемых в композиции материалов являются полимерные вещества и воски.
Формы для местного и трансдермального введения соединений настоящего изобретения включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляционные композиции или пластыри. Активный компонент смешивается в стерильных условиях с подходящим носителем и по мере необходимости с любым необходимым консервантом или буфером. Настоящее изобретение также включает композиции для офтальмологии, такие как глазные и ушные капли.
Кроме соединений согласно настоящему изобретению, мази пасты, кремы и гели могут включать наполнители, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк, окись цинка и смеси из указанных материалов.
Кроме соединений согласно настоящему изобретению, порошки и спреи могут включать наполнители, такие как лактоза, тальк, кремниевая кислота, гидроокись алюминия, силикаты кальция, полиамид в виде порошка и смеси из указанных материалов. Спреи могут дополнительно включать обычные летучие вещества, такие как хлорфторуглеводороды.
Трансдермальные пластыри обладают тем дополнительным преимуществом, что они обеспечивают контролируемую доставку активного соединения. Такие формы могут быть приготовлены путем растворения или диспергирования активного вещества в подходящей среде. Для облегчения прохождения активного вещества через кожу в таких формах могут использоваться также вещества, содействующие абсорбции. Скорость абсорбции может регулироваться либо с помощью мембраны, либо путем диспергирования вещества в полимерном матриксе или геле.
Согласно настоящему изобретению способ лечения заключается в том, что бактериальные инфекции лечатся или предупреждаются у пациентов, например людей или др. млекопитающих, путем введения пациенту терапевтически эффективной дозы (количества) соединения согласно изобретению в таком количестве и за такое время, которое необходимо для достижения желаемого результата. "Терапевтически эффективная доза (количество)" соединения согласно изобретению означает количество вещества, достаточное для подавления бактериальной инфекции, в пределах разумного соотношения польза/риск, применимое для любого вида лечения. Следует однако понимать, что общая суточная доза соединений и композиций согласно настоящему изобретению будет определяться лечащим врачом в рамках здравого смысла. Уровень специфической терапевтически эффективной дозы для того или иного пациента будет зависеть от множества факторов, включающих характер и опасность заболевания, возраст, вес тела, состояние здоровья, пол, характер диеты, время введения препарата, место введения, скорость выведения активного начала из организма, продолжительность лечения, использование лекарственного препарата в сочетании или одновременно с другими специальными веществами и тому подобных факторов, хорошо известных медицинским работникам. Общая суточная доза соединений согласно изобретению, вводимых человеку или животному однократно или отдельными порциями, может составлять, например, от 0,01 до 50 мг/кг веса тела, но обычно эта величина составляет 0,1-25 мг/кг веса тела. Разовые дозы лекарственных форм могут содержать такие количества или субколичества активного начала, которые составляют суточную дозу. В целом график (режим) лечения согласно настоящей заявке на изобретение заключается в том, что при соответствующем показании пациенту ежесуточно вводят от 10 до 2000 мг соединения согласно изобретению, причем введение может быть однократным или в виде нескольких отдельных доз.
Список сокращений.
В описании схем синтеза и в примерах использованы следующие сокращения:
IBN - азобисизобутиронитрил;
Bu3SnH - гидрид трибутил-олова;
CDI - карбонилдиимидазол;
DBU - 1,8-диазабицикло[5.4.0]ундец-7-ен;
DEAD - диэтилазодикарбоксилат;
DMF - диметилформамид (ДМФ);
DMSO - диметилсульфоксид (ДМСО);
DPPA - дифенилфосфорил азид;
Et3N - триэтиламин (ТЭА);
EtOAc - этилацетат;
Et2O - диэтиловый эфир;
EtOH - этанол;
НОАс - уксусная кислота;
МеОН - метанол;
NaN(TMS)2 - бис(триметилсилил)амид натрия;
NMMO - N-оксид N-метилморфолина;
TEA - триэтиламин (ТЭА);
THF - тетрагидрофуран (ТГФ);
ТРР - трифенилфосфин (ТФФ).
Методы синтеза
Чтобы облегчить восприятие соединений и способов, описанных в настоящей заявке на изобретение, в конце описания приводятся схемы синтеза 1-8 (подробное описание дано на последующих страницах), которые подробно иллюстрируют методы, с помощью которых могут быть получены соединения согласно изобретению. При отсутствии специальных пояснений преполагается, что расшифровка групп А, В, D, Е, W, X, Y, Z, Ra, Rb, Rc, Rd дана в предшествующих разделах.
Получение соединений согласно изобретению формулы VIII исходя из эритромицина приведено на схемах 1а и 1b. Получение эритромицина А с защитными группами описано в следующих патентах США: US 4990602; US 4331803; US 4680368; US 4670549, которые введены в качестве ссылки в текст заявки. В качестве ссылки включена также европейская патентная заявка ЕР 260938. В общем С-9-карбонильная группа соединения 1 защищается путем превращения в оксим (V=N-O-R3 или N-O-C(R8)(R9)-O-R3, где R3 указан выше, a R8 и R9 каждый независимо могут быть (а) водородом, (b) незамещенным С1-С12-алкилом, (с) С1-С12-алкилом с заместителем в виде арильной группы, (d) С1-С12-алкилом с заместителем в виде замещенной арильной группы, или R9 и R10, взятые вместе в атомом углерода, к которому они присоединены, образуют С3-C12-циклоалкильное кольцо). Особенно предпочтительной карбонилзащитной группой V является O-(1-изопропоксициклогексил)оксим.
2'- и 4"-гидроксильные группы в соединении 2 защищают с помощью подходящих гидроксилзащитных реагентов, описанных в книге Т.W. Green, P.G.M. Wuts, Protective Groups in Organic Synthesis, 2-ое издание, John Wiley & Sons, Inc., 1991, которая введена в качестве ссылки в текст заявки. Защитные группировки гидроксильных групп включают, например, уксусный ангидрид, бензойный ангидрид, бензилхлорформиат, гексаметилдисилазан, триалкилсилилхлорид в апротонном растворителе. Примерами апротонных растворителей являются хлористый метилен (дихлор метан), хлороформ, ДМФ, ТГФ, N-метилпирролидинон, диметилсульфоксид, диэтилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, триамид гексаметилфосфорной кислоты и смеси из них или смеси одного из перечисленных растворителей с одним из нижеприведенных растворителей, таких как диэтиловый эфир, ТГФ, 1,2-диметоксиэтан, ацетонитрил, этилацетат, ацетон и т.п. Апротонные растворители, не оказывающие неблагоприятного воздействия на реакцию и предпочтительно включают дихлорметан, хлороформ, ДМФ, ТГФ, N-метилпирролидинон или смеси из них. Защита 2'- и 4"-гидроксильных групп в 2 может проводиться последовательно или одновременно, приводя к образованию 3, где Rp - гидроксильная группа с защитной группировкой. Предпочтительной защитной группой Rp является триметилсилил.
6-Гидроксильная группа в соединении 3 алкилируется в реакции с алкилирующим агентом в присутствии основания с образованием соединения 4. Алкилирующие агенты включают хлористые, бромистые и йодистые алкилы или алкил сульфонаты. Специфическими примерами алкилирующих агентов являются аллилбромид, пропаргилбромид, бензилбромид, 2-фторэтилбромид, 4-нитробензилбромид, 4-хлорбензилбромид, 4-метоксибензилбромид, α-бром-п-толунитрил, циннаминбромид, метил-4-бромоктан, кротилбромид, 1-бром-2-пентан, 3-бром-1-пропенил фенилсульфон, 3-бром-1-триметилсилил-1-пропин, 3-бром-2-октин, 1-бром-2-бутин, 2-пиколилхлорид, 3-пиколилхлорид, 4-пиколилхлорид, 4-бромметилхинолин, бромацетонитрил, эпихлоргидрин, бромфторметан, бромнитрометан, метилбромацетат, метоксиметилхлорид, бромацетамид, 2-бромацетофенон, 1-бром-2-бутанон, бромхлорметан, бромметилфенилсульфон, 1,3-дибром-1-пропан, и т.п. Примерами алкилсульфонатов являются: аллил-O-тозилат, 3-фенилпропил-О-трифторметансульфонат, н-бутил-О-метансульфонат и т.п. Примерами растворителей, используемых в качестве апротонных являются, диметилсульфоксид, диэтилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, триамид гексаметилфосфорной кислоты и смеси из них или смеси одного из перечисленных растворителей с одним из нижеприведенных растворителей, таких как диэтиловый эфир, ТГФ, 1,2-диметоксиэтан, ацетонитрил, этилацетат, ацетон и т.п. Примеры оснований, которые могут быть использованы, включают гидроокись калия, гидроокись цезия, гидроокись тетраалкил аммония, гидрид натрия, гидрид калия, изопропоксид калия, трет-бутоксид калия, изобутоксид калия, и т. п.
Удаление защитных групп 2'- и 4"-гидроксильных групп проводят согласно методикам описанным в литературе, например в книге T.W. Greene, P.G.M. Wuts, Protective Groups in Organic Synthesis. 2-ое издание, John Wiley & Sons, Inc. , 1991, которая введена в качестве ссылки в текст заявки. Условия, в которых проводится снятие защитных группировок, обычно приводят к конверсии Х в =N-ОН. (Например, гидролиз уксусной кислотой в водном ацетонитриле приводит к отщеплению защитных групп с 2'- и 4"-гидроксильных групп с конверсией Х = =N-O-R3 или =N-O-C(R8)(R9)-O-R3, где R3, R8, R9 указаны выше, в группу = N-O-Н). В противном случае конверсия проводится в виде отдельной стадии.
Реакция деоксимирования может проводиться как описано в литературе, например в книге Т.W. Greene (см. ссылку выше). Примерами деоксимирующих реагентов являются неорганические производные оксидов серы, такие как гидросульфит натрия, пиросульфат натрия, тиосульфат натрия, сульфат натрия, сульфит натрия, метабисульфит натрия, дитионат натрия, тиосульфат калия, метабисульфит калия и т.п. Примерами протонных растворителей, которые могут использоваться в этой реакции, являются вода, метанол, этанол, пропанол, изопропанол, триметилсилан или смеси из них. Реакцию деоксимирования удобно проводить в присутствии органических кислот, таких как муравьиная, уксусная и трифторуксусная кислоты. Кислота берется в количестве от 1 до 10 эквивалентов на 1 эквивалент соединения 5. В предпочтительном воплощении изобретения деоксимирование проводится в присутствии органической кислоты, такой как муравьиная, в водном этаноле, и приводит к образованию целевого соединения 6.
Конверсия производного 6-замещенного эритромицина в 6-замещенный кетолид приведена не схеме 1b. Остаток кладинозы макролида 6 отщепляется мягким кислотным гидролизом или ферментативным гидролизом с образованием вещества 7. Типичные кислоты включают разбавленные соляную, серную, (пер)хлорную, хлоруксусную, дихлоруксусную или трифторуксусную кислоты. Подходящие растворители включают метанол, этанол, изопропанол, бутанол и т.п. Продолжительность реакции обычно составляет 0,5-24 часа. Предпочтительная температура реакции - 10oС-35oС. 2'-Гидроксильную группу в соединении 7 защищают с использованием подходящего реагента, например уксусного ангидрида, бензоилангидрида, бензилхлорформиата или триалкилсилилхлорида в апротонном растворителе, как определено выше, предпочтительно в хлористом метилене, хлороформе, ДМФ, тетрагидрофуране (ТГФ), N-метил пирролидиноне или смеси из них. Наиболее предпочтительной защитной группой Rр является бензоат. В случае необходимости стадии отщепления кладинозы и защиты гидроксильной группы могут проводиться в обратном порядке, что не оказывает влияния на конечный выход процесса.
3-гидроксильную группу в соединении 8 окисляют до кетогруппы с образованием соединения 9, используя модифицированный способ окисления Сверна (Swern). Подходящим окислительным агентом является N-хлорсукцинимид-диметилсульфид или карбодиимид-диметилсульфоксид. В типичном примере соединение 8 прибавляют к предварительно полученному комплексу N-хлорсукцинимида и диметилсульфида в галогенсодержащем растворителе, например в хлористом метилене, при температуре - 10oC-25oC. После перемешивания в течение 0,5-4 часов в реакционную смесь вносят третичный амин, например триэтиламин или основание Ханига (Hunig), что приводит к образованию кетона. Затем по стандартной методике отщепляют защитную группировку 2'-гидроксильной группы соединения 9 с образованием целевого кетолида VIII. Если Rp представляет собой сложный эфир, например ацетат или бензоат, защитную группу отщепляют в метаноле или этаноле. Триалкилсилильную группу отщепляют фтористым соединением в ТГФ или ацетонитриле.
Производные оксима могут быть получены при взаимодействии соединения VIII, где Х=О, с хлоргидратом гидроксиламина в присутствии основания, или с гидроксиламином в присутствии кислоты, как описано в патенте США N 5274085, с образованием соединения, где R1=Н. Реакция с замещенным гидроксиламином R1ONH2 приводит к образованию соединений, в которых R1=Н. С другой стороны, соединения, в которых R1=Н, могут быть получены путем образования незамещенного оксима, как описано выше, с последующей реакцией с R1X', где X' - подходящая для последующего отщепления группа, например, галоген.
Получение соединений формулы IX настоящего изобретения, у которых L=СО, а Т= -NH- или -N(W-Rd)-, приведено на схемах 1с и 4. Согласно схеме 1с, в 6-O-замещенном соединении 6 сначала защищают гидроксильную группу подходящей защитной группировкой по описанной выше методике с образованием соединения 6A, которое затем обрабатывают гексаметилдисилазидом натрия и карбонилдиимидазолом для получения соединения 6B. В частном случае, взаимодействие соединения 6B с водным аммиаком приводит к образованию циклического карбамата 6C, где Re= Н. Аналогичным образом, при взаимодействии 6B с амином формулы H2N-W-Rd образуется циклический карбамат, в котором Re обозначает -W-Rd.
Для получения соединений формулы IX, в которых L=СО, а Т=-N(W-Rd)- могут использоваться альтернативные или дополнительные приемы. Например, взаимодействие соединения 6C, где Re=Н, с алкилирующим агентом формулы Rd-галоген, где Rd определен ранее, дает соединение 6C, где Re=W-Rd причем W отсутствует, a Rd определен ранее.
Реакция соединения 6B с производными гидразина формулы H2N-NH-Rd приводит к образованию циклического карбамата, давая в итоге соединения 6C, где Re=W-Rd, причем W=-NH-, a Rd определен выше. Когда в качестве реагента используется незамещенный гидразин, конечным продуктом является соединение 6С, где Re=-N(W-Rd)-, a W-Rd=NН2.
Взаимодействие соединения 6С, где Re=-N(W-Rd)-, a W-Rd=NH2, с алкилирующим агентом формулы Rd-галоген, где Rd определен ранее, приводит к образованию соединения 6С, где Re=W-Rd, причем W=-NH-, а Rd определен ранее.
Взаимодействие соединения 6С с ацилирующим агентом, который может быть Rd-С(СО)-галоген или (Rd-C(CO)-O)2 дает соединение 6С, где Re=W, причем W= -NH-CO-, а Rd определен ранее.
Взаимодействие соединения 6С, где Re=-N(W-Rd)-, причем (W-Rd)= (NН2), с альдегидом Rd-CHO, где Rd определено ранее, дает соединение 6С, где W=-N= CH-, а группа Rd определена ранее.
Взаимодействие соединения формулы IX, где L=СО, а Т=-N[W-Rd)-, причем (W-Rd)= (NH2), с алкилирующим агентом формулы Rd-галоген, где Rd определен ранее, дает соединение формулы IX, где L=СО, Т=-N(W-Rd)-, причем W отсутствует, a Rd определен выше.
Реакция соединения 6В с производными гидроксиламина формулы H2N-O-Rd приводит к образованию циклического карбамата, в котором Re=-O-Rd.
Отщепление остатка кладинозы кислотным гидролизом, как описано ранее, дает соединение 6D, где Z'=H. Затем соединение 6D окисляют с образованием 6Е по модифицированному способу Сверна, описанному ранее на схеме 1b, для последующей конверсии соединения 8 в кетон 9.
Отщепление защитной группы 2'-гидроксильной группы по приведенной выше методике приводит с получению целевого кетолида IX.
Согласно альтернативной методике, приведенной на схеме 1d, соединение 2А, которое является 9-оксимом эритромицина А, подвергают кислотному гидролизу разбавленной минеральной или органической кислотой по приведенной ранее методике с целью отщепления остатка кладинозы и получения соединения 7А. Затем из оксима соединения 7А взаимодействием с соответствующим защитным реагентом получают защищенный оксим, соединение 7В, где V = =N-O-R1 (показан на схеме) или =N-O-C(R5)(R6)-O-R1, где R1, R5 и R6 определены ранее. Далее, по описанной выше методике, защищают 3 и 2'-гидроксильные группы соединения 7В, предпочтительно триметилсилильной группой, получая соединение 7С. Соединение 7С алкилируют по методике, приведенной на схеме 1а, с образованием соединения 7D, последнее сначала деоксимируют по методике, приведенной на схеме 1а, а затем деоксимированное промежуточное соединение конвертируют в соединение 7Е по методике, использованной для получения 6С из 6А (см. схему 1с). Затем у соединения 7Е по описанной выше методике отщепляют защитные группировки и окисляют до 3-кетолида, производного соединения формулы IX, где Х=О, L=СО, а Т=-NH- или -N(W-Rd)-.
Получение соединений формулы IX настоящего изобретения, у которых L=СО, а Т=О, и соединений формулы VI приведено на схеме 2. Синтез, приведенный на схеме 2, проводится как описано в статье Baker с соавт., J. Org. Chem., 1988, 53, 2340, которая введена в качестве ссылки в текст заявки. В частности, 2'-защищенное кетолидное производное соединения 9, полученное по схеме 1, конвертируется в циклический карбонат 10 в реакции с карбонилдиимидазолом и гексаметилдисилазидом натрия. Снятие защитных групп по вышеописанной методике дает соединение IX, где L - СО, а Т - О.
Соединения формулы VI получают из соединения 9 реакцией с гидридом натрия или гидридом лития и фосгеном, дифосгеном или трифосгеном в безводной среде с последующим декарбоксилированием в водной среде в присутсвии основания. По альтернативной схеме соединение 9 конвертируется в соответствующий мезилат в реакции с ангидридом метансульфокислоты в пиридине. Затем мезилат переводят в соединение 11 под действием амина, например DBU или диметиламинопиридина в ацетоне или ацетонитриле. 2'-защитную группировку отщепляют как описано выше, получая соединение VI.
Соединения формулы VI также получают из соединения 10 обработкой азотистым основанием, например, 1,8-диазобицикло[5.5.0]ундец-7-еном (DBU) или 4-диметиламинопиридином (ДМАП) в таком растворителе, как бензол или ацетонитрил, или в реакции с гидридами натрия и лития в тетрагидрофуране или N,N-диметилформамиде (ДМФ) с образованием соединения 11, и после снятия защитной группировки получают целевое соединение.
Соединения формулы VII получают согласно схемам 3a и 3b. Согласно схеме 3a кетолид 11, полученный по схеме 2, превращают в соединение 12 в реакции с карбодиимидазолом и гидридом щелочного металла, например, гидридом натрия, лития или калия в подходящем апротонном растворителе при температуре от 0oС до комнатной температуры. Соединение 12 можно также получить из диола 9 или циклического карбоната 10, полученных по схеме 2, в реакции с карбодиимидазолом и гидридом натрия или лития в аналогичных условиях. Затем соединение 12 взаимодействует с диамином 13, имеющее в качестве заместителей А, В, D и Е, как определено выше, в подходящем растворителе, например водном ацетонитриле, ДМФ или водном ДМФ, с образованием бициклического соединения 14. Затем соединение 14 циклизуют обработкой разбавленной кислотой, например, уксусной или соляной в подходящем органическом растворителе, например этаноле, пропаноле, и после снятия защитных группировок по приведенной выше методике получают трициклический кетолид VII. По альтернативной методике, 2'-защитная группа бициклического кетолида 14 может быть удалена до циклизации с помощью способов, описанных на схеме 1. Соединения IV или VII могут быть восстановлены в соединения формулы IVA обработкой восстанавливающим агентом, выбранным из следующих: водорода в присутствии палладиевого катализатора, алкилборгидрида и алюмогидрида лития, в подходящем органическом растворителе.
На схеме 3b приведена альтернативная методика получения соединений формулы VII. Исходное соединение 12 вступает в реакцию с бета-аминоспиртом 15 (Y - ОН) в подходящем растворителе, например водном ацетонитриле, ДМФ или водном ДМФ при 0-70oС, с образованием соединения 16, которое затем превращают в азид по реакции Мицунобу (Mitsunobu), обрабатывая трифенилфосфином, дифенилфосфорилазидом и DEAD в тетрагидрофуране. По альтернативной методике, гидроксильную группу в соединение 16 активируют обработкой сульфонилхлоридом, алкил или арилсульфоангидридом или трифторметансульфоангидридом в апротонном растворителе. Затем активированную гидроксильную группу переводят в соответствующий азид реакцией с азидом лития или азидом натрия в апротонном растворителе. 2'-защитную группировку отщепляют как указано выше, после чего азидную группу восстанавливают до амина 17. Подходящими восстанавливающими агентами являются трифенилфосфин+вода, водород в присутствии катализатора, боргидрид натрия, диалкилалюмогидрид в подходящем для этой реакции растворителе в соответствии с известными методиками. Затем соединение 17 циклизуют, как показано на схеме 3a.
Соединения формулы IX, где L - СО, а Т - NH или N-W-Rd получают как указано на схеме 4. Синтез проводится как описано в статье Baker с соавт., J. Org.Chem., 1988, 53, 2340, которая введена в качестве ссылки в текст заявки. В частности, обработка соединения 12, полученного по схеме 3, водным аммиаком приводит в образованию циклического карбамата 18, где Re - Н. Аналогичным образом, взаимодействие соединения 12 с амином формулы H2N-W-Rd приводит к образованию циклического карбамата, в котором Re - -W-Rd.
Отщепление защитной группировки 2'-гидроксильной группы по приведенной выше методике приводит к целевому кетолиду IX. В частности, обработка соединения 6В водным аммиаком приводит к образованию циклического карбамата 6С, в котором Re - Н. Аналогичным образом взаимодействие соединения 6В с амином формулы H2N-W-Rd приводит к получению циклического карбамата, в котором Re - -W-Rd.
Целевое 6-O-замещенное соединение может быть получено непосредственно, как описано выше, или же путем химической модификации первоначально полученного 6-O-замещенного соединения. Типичные примеры дальнейших модификаций в 6-положении приведены на схеме 5. Например, соединение 20, где R является 6-O-CH2CH=CH2, а М' представляет макролидную циклическую систему, может быть подвергнуто дальнейшей модификации. Двойная связь аллилсодержащего соединения может быть (а) восстановлена в присутствии катализатора с образованием 6-O-пропилпроизводного 27; (b) окислена четырехокисью осмия в 2,3-дигидроксипропил-производное 31, которое в свою очередь может быть модифицировано, например этерифицировано, с помощью ацилирующих агентов, например хлорангидридами или ангидридами карбоновых кислот (ацилгалогенами и ацилангидридами), по каждому из атомов кислорода с образованием 32; (с) окислено м-хлорпероксибензойной кислотой в апротонном растворителе в эпоксиметилпроизводное 29, которое после раскрытия эпоксигруппы нуклеофильными соединениями, например аминами и N-содержащими гетероарильными соединениями, с образованием производного 30 с N-содержащими боковыми цепями; (d) окислено в условиях Ваккера (Wacker), как описано Henry в книге "Palladium Catalyzed Oxidation of Hydrocarbons", Reidel Publishing Co., Dordrecht, Holland (1980), с образованием 6-O-СН2-С(O)-СН3-производного, соединения 28; (е) озонировано с образованием альдегида 21, который в свою очередь может быть (1) превращен в оксимы 22 и 24 при взаимодействии соответственно с H2NOR3 или H2NOH; или (2) подвергнут восстановительному аминированию, например, подходящим амином в присутствии боргидрида в качестве восстановителя или путем перевода в имин и последующего восстановления в присутствии катализатора, с образованием амина 23. Реакция оксима 24 с диизопропилкарбодиимидом в апротонном растворителе в присутствии CuCl приводит к нитрилу 25. Реакция 20 с арилгалогенидом в условиях, предложенных Хеком (Heck) (в присутствии Pd(II) или Pd(O), фосфина и амина или неорганического основания, см. Organic Reactions, 1982, 27, 345-390), приводит к образованию соединения 26. Восстановление двойной связи в 26, например Н2 в присутствии палладия на угле, приводит к соединению 33.
На схеме 6 приведен альтернативный путь получения соединений формулы XI, где L = СО, Т = -NH- или -N(W-Rd)-, a R - замещенный алкенил. 6-O-аллил-эритромицин, соединение 33, превращают в соединение формулы XI, где L = CO, T = -NH- или -N(W-Rd)-, а R - аллил, путем отщепления кладинозы и окисления 3-гидроксильной группы, как показано на предшествующих схемах. Последующее взаимодействие соединения формулы XI, где L = CO, T = -NH- или -N(W-Rd)-, а R - аллил, с соединением формулы R**-галоген, где R** является арильной, замещенной арильной, гетероарильной или замещенной гетероарильной группой, в условиях, предложенных Хеком (Heck), в присутствии Pd(II) или Pd(0), фосфина и амина или неорганического основания (см. Organic Reactions, 1982, 27, 345-390) приводит к образованию целевого соединения формулы XI, где L = CO, T = N(Rd), а R - замещенный алкенил.
По альтернативной методике соединение 33 превращают в 6-O-(замещенный алкенил) - производное формулы 34 путем реакции с арилгалогеном, замещенным арилгалогеном, гетероарилгалогеном или замещенным гетероарилгалогеном в условиях Хека в присутствии Pd(II), Pd(O), фосфина, и амина или неорганического основания, как описано выше. Соединение 34 может быть затем конвертировано в целевое соединение формулы XI, где L=СО, Т=-NH- или -N(W-Rd)-, a R - замещенный алкенил, путем отщепления кладинозы и окисления 3-гидроксигруппы, как показано на предшествующих схемах.
Типичные примеры дальнейших модификаций в 6-положении приведены на схеме 7. Целевое 6-O-замещенное соединение может быть получено путем химической модификации первоначально полученного 6-O-пропаргилпроизводного. Например, соединение 35, где R является 6-О-СН2СН≡СН, а М' представляет макролидную циклическую ситему, может быть подвергнуто дальнейшей модификации. Тройная связь алкинсодержащего соединения 35 может вступить в реакцию с арилгалогенидом, гетероарилгалогенидом или замещенным гетероарилгалогенидом в присутствии Pd (трифенилфосфин)2Сl2 и CuI, а также органического амина, например триэтиламина, с образованием соединения 36. Соединение 35 может быть также введено в реакцию с производным борной кислоты HB(ORZZ), где RZZ - Н или С1-С10 алкил, в апротонном растворителе при температуре от 0oС до комнатной, с образованием соединения 37, которое затем вводят в реакцию с Pd(трифенилфосфин)4 и арилгалогенидом, замещенным арилгалогенидом, гетероарилгалогенидом или замещенным гетероарилгалогенидом в условиях реакции Сузуки (Suzuki) с образованием соединения 38. Соединение 35 может быть также обработано N-галогенсукцинимидом в уксусной кислоте с образованием соединения 39. Кроме того, при реакции соединения 35 с замещенным алкенилгалогеном, например Ar-СН=СН-галоген, где Ar - арил, замещенный арил, гетероарил или замещенный гетероарил, в присутствии Pd(трифенилфосфин)2Сl2 и CuI, а также органического амина, например триэтиламина, образуется соответствующее производное соединение 41. Более того, соединение 36 может быть избирательно восстановлено в соответствующее цис-олефиновое соединение 40 путем каталитического гидрирования в этаноле при атмосферном давлении в присутствии 5% Pd/BaSO4 и хинолина (Rao с соавт., J.Org.Chem., (1986), 51: 4158-4159).
На схеме 8 приведен альтернативный путь синтеза соединений формулы XI, где L= СО, Т= -NH- или -N(W-Rd)-, a R - замещенный алкинил. 6-O-пропаргил эритромицин, соединение 42, может быть конвертировано в соединения формулы XI, где L=СО, Т=N(Rd), а R - пропаргил, путем
отщепления кладинозы и окисления 3-гидроксильной группы, как показано на предшествующих схемах. Последующее взаимодействие соединения формулы XI, где L= СО, Т=N(Rd), a R - пропаргил, с соединением формулы R**-галоген, где R** является арильной, замещенной арильной, гетероарильной или замещенной гетероарильной группой, в присутствии Pd(трифенилфосфин)2Сl2 и CuI, a также органического амина, например триэтиламина, приводит к образованию целевого соединения формулы XI, где L=СО, Т=-NH- или -N(W-Rd)-, а R - замещенный алкинил.
Соединение 42 превращают в 6-O-(замещенный алкинил)-производное формулы 43 по реакции с соединением формулы R**-галоген, где R** является арильной, замещенной арильной, гетероарильной или замещенной гетероарильной группой, в присутствии Pd(трифенилфосфин)2Сl2 и CuI, a также органического амина, например триэтиламина, как описано выше. Затем соединение 43 конвертируют в целевой продукт формулы XI, где L=СО, Т=-NH- или -N(W-Rd)-, a R - замещенный алкинил, путем отщепления кладинозы и окисления 3-гидроксильной группы, как показано на предшествующих схемах.
Для лучшего понимания вышеизложенного ниже приведены следующие примеры, которые иллюстрируют предмет изобретения, но не ограничивают объем изобретения.
Пример 1
Соединение Формулы VIII: Х - О, R - аллил.
Стадия 1а: Соединение 4, схема 1а: V - N-О-(1-изопропоксициклогексил), R - аллил, Rp - триметилсилил.
Свежеперегнанный аллилбромид (0,73 мл, 2,00 ммоль) добавляют к охлажденному до 0oС раствору 2',4"-бис-O-триметилсилилэритромицин А 9-[O-(1-изопропоксициклогексил)оксима] (1,032 г, 1,00 ммоль), приготовленного по способу, описанному в патенте США N 4990602, в 5 мл ДМСО и 5 мл ТГФ. Приблизительно через 5 мин к смеси прикапывают раствор трет-бутоксида калия (1 М 2,0 мл) в 5 мл ДМСО и 5 мл ТГФ в течение более 4 часов. Реакционную смесь переносят в этилацетат и отмывают водой и соляным раствором. Органическую фазу концентрируют в вакууме и получают конечное соединение (1,062 г) в виде белого пенообразного продукта.
Стадия 1b: Соединение 5, схема 1а. V - NOH, R - аллил
9 мл уксусной кислоты добавляют при температуре окружающей среды к раствору соединения, полученного на стадии 1а (1,7 г), в 17 мл ацетонитрила и 8,5 мл воды. После инкубирования при температуре окружающей среды в течение нескольких часов реакционную смесь разбавляют 200 мл толуола и концентрируют в вакууме. Так как было показано, что полученный остаток содержит непрореагировавшие исходные соединения, то к нему добавляют еще 15 мл ацетонитрила, 70 мл воды и 2 мл уксусной кислоты. Через 2 часа добавляют дополнительно 1 мл уксусной кислоты. Приблизительно через 3 часа реакционную смесь помещают в морозильник и выдерживают в течение ночи. Затем реакционную смесь нагревают до температуры окружающей среды, разбавляют 200 мл толуола и концентрируют в вакууме. Остаток дважды промывают толуолом и высушивают до постоянного веса (1,524 г).
Стадия 1с: Соединение 6, схема 1а: R - аллил
Соединение, полученное на стадии 1b, (1,225 г) в 16 мл смеси этанол-вода 1:1 обрабатывают NаНСО3 (700 мг) и муравьиной кислотой (141 мкл) и нагревают при 86oС в течение 2,5 часов. Реакционную смесь охлаждают до температуры окружающей среды, разбавляют 5-6 мл воды, подщелачивают 1 N NaOH до рН 9-10 и экстрагируют этилацетатом. Объединенные органические экстракты дважды промывают соляным раствором, высушивают над MgSO4, отфильтровывают и концентрируют в вакууме. Полученный продукт очищают путем колоночной хроматографии, элюируют 1% МеОН в метиленхлориде, содержащем 1% гидроксида аммония, и получают 686 мг (57%) конечного соединения.
13С ЯМР(СDСl3) δ 219,3 (C-9), 174,8 (С-1), 135,5 (С-17), 116,3 (С-18), 101,9 (С-1'), 95,9 (С-1"), 79,7 (С-5), 78,8 (С-6), 78,5 (С-3), 74,1 (С-12), 72,4 (С-3"), 70,6 (С-11), 68,1 (С-5'), 65,5 (С-16), 65,1 (С-2'), 49,0 (С-3" O-СН3), 45,0 (С-2), 44,1 (С-8), 39,7 (NMe2), 37,9 (С-4), 37,1 (С-10), 34,6 (С-2"), 28,4 (С-4'), 21,0, 20,6 (С-3" СН3, С-6' СН3), 20,8 (С-14), 18,3 (С-6"), 18,1 (С-8 СН3), 15,7, 15,6 (С-2 СН3, С-6 СН3), 11,9 (С-10 СН3), 10,1 (С-15), 8,9 (С-4 СН3). Масс-спектрометрия(МС)(FAB, бомбардировка быстрыми атомами (ББА))+m/e 774 (М+Н)+, 812 (М+К)+.
Стадия 1d: Соединение 7, схема 1b: R - аллил
1 М водный раствор (18 мл) HCl добавляют в течение 10 мин к суспензии соединения, полученного на стадии 1с (7,73 г, 10,0 ммоль), в 25 мл этанола и 75 мл воды. Реакционную смесь перемешивают при температуре окружающей среды в течение 9 часов и затем оставляют в холодильнике в течение ночи. Добавляют 2 М водный раствор NaOH (9 мл, 18 ммоль), при этом выпадает белый осадок. Смесь разбавляют водой и отфильтровывают. Твердый осадок промывают водой и высушивают в вакууме, получают дезкладинозил 7 (3,11 г).
Стадия 1е: Соединение 8, схема 1b: R - аллил, Rp - бензоил
Бензангидрид (98%, 1,46 г, 6,48 ммоль) и триэтиламин (0,90 мл, 6,48 ммоль) добавляют к раствору продукта, полученного на стадии 1d (2,49 г, 4,05 ммоль), в 20 мл дихлорметана и суспензию белого цвета перемешивают при температуре окружающей среды в течение 26 часов. Добавляют 5% водный раствор карбоната натрия и смесь перемешивают в течение 20 минут. Смесь экстрагируют дихлорметаном. Органическую фазу промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия и концентрируют в вакууме до образования белого пенообразного остатка. После хроматографии на силикагеле (30% ацетон-гексан) получают конечный продукт (2,46 г) в виде белого осадка.
Стадия 1f: Соединение 9, схема 1b: R - аллил, Rр - бензоил; аналогичное соединению формулы II, Ra - ОН, Rc - бензоил
Диметилсульфид (0,43 мл, 5,92 ммоль) добавляют в течение 5 минут к раствору N-хлорсукцинимида (0,68 г, 5,07 ммоль) в 20 мл дихлорметана, охлажденному до -10oС в атмосфере азота. Полученную суспензию белого цвета перемешивают при -10oС в течение 20 минут и затем добавляют соединение, полученное на стадии 1е (2,43 г, 3,38 ммоль), в 20 мл дихлорметана, и реакционную смесь перемешивают при от -10 до -5oС в течение 30 минут. Затем добавляют по каплям триэтиламин (0,47 мл, 3,38 ммоль) в течение 5 минут, и реакционную смесь перемешивают при 0oС в течение 30 минут. Реакционную смесь экстрагируют дихлорметаном. Органическую фазу дважды промывают 5% водным раствором бикарбоната натрия и один раз соляным раствором, высушивают над сульфатом натрия и концентрируют в вакууме до образования белого пенообразного остатка. После хроматографии на силикагеле (30% ацетон-гексан) получают конечный продукт (2,27 г) в виде белого осадка.
Стадия 1g: Соединение формулы VIII: Х - О, R = аллил
Раствор соединения, полученного на стадии 1f (719 мг, 1,0 ммоль), в 20 мл метанола перемешивают при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на силикагеле (дихлорметан-метанол-аммиак 95:5:0,5), получают конечный продукт (577 мг) в виде белого пенообразного остатка.
13С ЯМР (CDCl3) δ 219,2 (С-9), 206,0 (С-3), 169,8 (С-1), 135,3, 117,5, 102,8, 78,4, 78,0, 75,9, 74,4, 70,3, 69,5, 69,0, 65,9, 64,6, 50,6, 45,4, 45,1, 40,2, 38,6, 37,8, 31,6, 28,4, 21,8, 21,3, 20,3, 18,1, 16,5, 14,7, 12,8, 12,3, 10,6. МС (ББА)+ m/e 614 (М+Н)+.
Пример 2
Соединение формулы VIII: Х - NOH, R - аллил
Гидрохлорид гидроксиламина (76 мг, 1,1 ммоль) и триэтиламин (56 мкл, 0,4 ммоль) добавляют к раствору соединения, полученного согласно примеру 1 (122 мг, 0,2 ммоль), в этаноле, и реакционную смесь перемешивают при 80oС в течение ночи. Реакционную смесь концентрируют и остаток переносят в этилацетат. Органическую фазу промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (дихлорметан-метанол-аммиак, 95: 5: 0,5), получают оксим Е (42 мг) и оксим Z (38 мг) в виде белого пенообразного остатка.
13С ЯМР (CDCl3) δ 206,3 (С-3), 170,1 (С-9), 169,8 (С-1), 136,1, 116,5, 102,7, 78,6, 78,2, 75,5, 74,1, 70,3, 70,2, 69,4, 65,9, 64,7, 50,6, 45,2, 40,2, 37,3, 33,1, 28,4, 25,4, 21,9, 21,3, 20,3, 18,6, 16,5, 14,9, 14,7, 12,8, 10,7. МС (ББА)+ m/e 629 (М+Н)+.
Пример 3
Соединение формулы VIII: X - О, R - пропил
Раствор соединения, полученного согласно примеру 1 (122 мг, 0,2 ммоль), в этаноле продувают азотом и добавляют 20 мг 10% палладия на углероде. Смесь продувают водородом и перемешивают в течение ночи при повышенном давлении водорода. Реакционную смесь отфильтровывают и концентируют в вакууме до образования стеклообразного остатка. Остаток очищают хроматографией на силикагеле (дихлорметан-метанол-аммиак, 95:5:0,5) и получают конечный продукт в виде белого твердого остатка.
13С ЯМР (СDСl3) δ 220,2 (С-9), 206,5 (С-3), 169,9 (С-1), 102,7, 78,1, 77,7, 75,7, 74,1, 70,3, 69,4, 65,9, 64,5, 50,6, 45,4, 44,7, 40,2, 38,8, 37,5, 28.4, 22,3, 21,9, 21,3, 20,3, 18,3, 16,5, 14,9, 14,7, 12,4, 10,6, 10,2. МС (ББА)+ m/e 616 (М+Н)+.
Пример 4
Соединение формулы VIII: X - О, R - -СН2СНО
Стадия 4а: Соединение формулы VIII: Х - О, R - -СН2СНО N-оксид
Раствор соединения, полученного согласно примеру 1 (2,45 г, 4,0 ммоль), в 100 мл дихлорметана, охлажденного до -78oС, продувают озоном в течение 45 минут. Затем реакционную смесь продувают азотом в течение 10 минут. Добавляют диметилсульфид (1,46 мл, 20 ммоль) при -78oС, и реакционную смесь перемешивают при 0oС в течение 30 минут. Реакционную смесь концентрируют в вакууме и получают белый пенообразный продут (2,78 г), который используют без дальнейшей очистки.
Стадия 4b: Соединение формулы VIII: Х - О, R - -СН2СНО
Необходимое соединение получают нагреванием раствора соединения, полученного на стадии 4а (2,78 г, 4,0 ммоль), и трифенилфосфина (2,62 г, 10,0 ммоль) в 40 мл ТГФ при 55oС в течение 2,5 часов. Реакционную смесь концентрируют в вакууме и получают белый пенообразный продукт. Необходимый продукт очищают с помощью хроматографии на силикагеле (ацетон-гексан, 1:1, затем ацетон-гексан-триэтиламин, 75:25:0,5) и получают белый твердый продукт (1,29 г). МС (ББА)+ m/e 616 (М+Н)+.
Пример 5
Соединение формулы VIII: Х - О, R - -CH2CH=NOH
Триэтиламин (31 мкл, 0,225 ммоль) и гидроксиламин гидрохлорид (7,7 мг, 0,112 ммоль) добавляют к раствору соединения, полученного согласно примеру 4 (46 мг, 0,08 ммоль), в 5 мл метанола, и реакционную смесь перемешивают при температуре окружающей среды в течение 6 часов. Реакционную смесь переносят в этилацетат и промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия и концентрируют в вакууме, получают прозрачный стеклообразный продукт. С помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 95:5:0,5) получают конечный продукт (29 мг) в виде белого осадка. МС (ББА)+ m/e 631 (М+Н)+.
Пример 6
Соединение формулы VIII: Х - NOH, R - -СН2СН=NОН
Конечное соединение (7,0 мг) получают с помощью хроматографии, описанной в примере 5. МС (ББА)+ m/e 631 (М+Н)+. МС (ББА)+ m/e 645 (М+Н)+.
Пример 7
Соединение формулы VIII: Х - О, R - -CH2CN
Диизопропилкарбодиимид (83 мкл, 0,534 ммоль) и CuCl (2,7 мг, 0,027 ммоль) добавляют к раствору соединения, полученного согласно примеру 5 (168 мг, 0,267 ммоль), в 5 мл ТГФ в атмосфере азота, и реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь переносят в этилацетат и промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают прозрачный стеклообразный продукт. Конечное соединение (63 мг) в виде белого твердого осадка получают с помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 95:5:0,5).
13С ЯМР (CDCl3) δ 219,5 (С-9), 205,6 (С-3), 169,9 (С1-1), 103,4, 81,3, 78,2, 77,4, 77,1, 74,0, 70,2, 69,7, 69,1, 65,9, 51,1, 48,6, 46,7, 44,3, 40,2, 38,0, 37,6, 28,2, 23,5, 21,2 19,7, 17,8, 16,1, 14,4, 11,9, 10,5, 10,5. МС (ББА)+ m/e 613 (М+Н)+.
Пример 8
Соединение формулы VIII: X = О, R = -CH2CH2NH2
Ацетат аммония (212 мг, 2,76 ммоль) добавляют к раствору соединения, полученного согласно примеру 4 (170 мг, 0,276 ммоль), в 10 мл метанола, и реакционную смесь охлаждают до 0oС. Затем добавляют цианоборгидрид натрия (34 мг, 0,553 ммоль), и реакционную смесь перемешивают при 0oС в течение 30 часов. Реакционную смесь переносят в этилацетат и промывают 5%-водным раствором карбоната натрия, 2%-водным раствором трис(гидроксиметил)аминометана и соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме.
Конечное соединение (90 мг) в виде белого твердого осадка получают с помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 90:10:0,5).
13С ЯМР (СDCl3) δ 217,0 (С-9), 206,3 (С-3), 170,6 (С-1), 102,7, 78,9, 78,5, 75,1, 74,9, 70,3, 69,4, 67,8, 65,9, 63,1, 50,8, 45,8, 44,9, 41,7, 40,3, 38,8, 38,2, 28,4, 22,2, 21,3, 20,7, 19,2, 16,6, 14,9, 12,8, 12,4, 10,9. МС (ББА)+ m/e 617 (М+Н)+.
Пример 9
Соединение формулы VIII: Х = О, R = -СН2СН2NНСН2-фенил
Уксусную кислоту (114 мкл, 2,00 ммоль) и бензиламин (218 мкл, 2,00 ммоль) добавляют к охлажденному при 0oС раствору соединения, полученного согласно примеру 4 (121,3 мг, 0,200 ммоль), в 10 мл метанола, и реакционную смесь перемешивают в течение 10 минут. Затем добавляют цианоборгидрид натрия (24,8 мг, 0,400 ммоль), и реакционную смесь перемешивают в течение 16 часов. Добавляют дополнительное количество цианоборгидрида натрия (24,8 мг, 0,400 ммоль) и продолжают перемешивание в течение 5 часов.
Реакционную смесь переносят в этилацетат и промывают 5%-водным раствором карбоната натрия, 2%-водным раствором трис(гидроксиметил)аминометана и соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме.
Конечное соединение (82 мг) в виде белого пенообразного продукта получают с помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 95: 5: 0,5) и с последующей вторичной хроматорафией(ацетон-гексан-триэтиламин, 50:50:0,5).
13С ЯМР (СDСl3) δ 216,6 (С-9), 206,3 (С-3), 170,5 (С-1), 139,0, 128,6, 128,3, 126,9, 102,4, 78,9, 78,4, 75,1, 74,8, 70,2, 69,4, 67,8, 65,9, 61,7, 53,2, 50,7, 48,2, 45,6, 44,8, 40,2, 38,8, 38,0, 28,3, 21,9, 21,3, 20,6, 18,8, 16,6, 14,6, 12,6, 12,3, 10,7. МС (ББА)+ m/e 707 (М+Н)+.
Пример 10
Соединение формулы VIII: Х = О, R = -СН2СН2NСН2СН2-фенил
Уксусную кислоту (114 мкл, 2,00 ммоль) и фенэтиламин (218 мкл, 2,00 ммоль) добавляют к охлажденному до 0oС раствору соединения, полученного согласно примеру 4 (121,3 мг, 0,200 ммоль), в 10 мл метанола, и реакционную смесь перемешивают в течение 10 минут. Добавляют цианоборгидрид натрия (24,8 мг, 0,400 ммоль), и реакционную смесь перемешивают в течение 16 часов. Реакционную смесь переносят в этилацетат и промывают 5%-водным раствором карбоната натрия, 2%-водным раствором трис(гидроксиметил)аминометана и соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Конечное соединение (60,1 мг) в виде белого пенообразного продукта получают с помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 90:10:0,5). МС (ББА)+ m/e 721 (М+Н)+.
Пример 11
Соединение формулы VIII: Х = О, R = -СН2СН2NHCH(CO2CH3)CH2-фенил
Гидрохлорид метилового эфира L-фенилаланина (129 мг, 0,600 ммоль) добавляют к охлажденному до 0oС раствору соединения, полученного согласно примеру 4 (121,3 мг, 0,200 ммоль), в 10 мл метанола, и реакционную смесь перемешивают в течение 10 минут. Добавляют цианоборгидрид натрия (24,8 мг, 0,400 ммоль), и реакционную смесь перемешивают в течение 22 часов. Реакционную смесь переносят в этилацетат и промывают 5%-водным раствором карбоната натрия, 2%-водным раствором трис(гидроксиметил)аминометана и соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Конечное соединение (60,1 мг) в виде белого пенообразного продукта получают с помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 95:5: 0,5).
13С ЯМР (CDCl3) δ 217,8 (С-9), 206,4 (С-3), 170,5 (С-1), 170,4, 137,5, 129,4, 128,2, 126,4, 102,4, 78,8, 78,4, 75,2, 74,9, 70,2, 69,4, 68,5, 65,9, 63,1, 61,6, 51,4, 50,7, 47,1, 45,5, 44,7, 40,2, 39,2, 38,4, 28,4, 21,8, 21,2, 20,6, 18,7, 16,6, 14,7, 12,6, 12,2, 10,7. МС (ББА)+ m/e 779 (М+Н)+.
Пример 12
Соединение VIII: X = O, R = -СН2СН2NHСН2-(4-пиридил)
Конечное соединение получают согласно способу, указанному в примере 10, за исключением использования 4-аминометилпиридина вместо фенэтиламина.
13С ЯМР (СDСl3) δ 217,8 (С-9), 206,2 (С-3), 170,6 (С-1), 149,7, 148,2, 123,3, 102,5, 78,9, 78,4, 75,0, 74,9, 70,2, 69,5, 68,4, 65,9, 61,7, 52,4, 50,7, 48,7, 45,7, 44,8, 40,2, 39,2, 38,5, 38,2, 28,4, 21,8, 21,3, 20,6, 18,7, 16,6, 14,6, 12,6, 12,2, 10,7. МС (ББА)+ m/e 708 (М+Н)+.
Пример 13
Соединение VIII: X = О, R = -СН2СН2NНСН2-(4-хинолил)
4-хинолилкарбальдегид (23 мг, 0,15 ммоль), уксусную кислоту (8,6 мкл, 0,15 ммоль) и цианоборгидрид натрия (9,4 мг, 0,15 ммоль) добавляют к раствору соединения, полученного согласно примеру 8 (90 мг, 0,15 ммоль), в 2 мл метанола, и реакционную смесь перемешивают в течение 15 часов. Реакционную смесь переносят в этилацетат и промывают 5%-водным раствором карбоната натрия, 2%-водным раствором трис(гидроксиметил)аминометана и соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Конечное соединение (32 мг) в виде не совсем белого твердого осадка получают с помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 90:10: 0,5).
МС (ББА)+ m/е 758 (М+Н)+.
Пример 14
Соединение VIII: Х = О, R = -СН2СН=СН-фенил
Стадия 14а: Соединение 9, схема 2: Х = О, R = -СН2СН=СН-фенил, Rp - бензоил
Йодбензол (220 мкл, 2,00 ммоль) и триэтиламин (280 мкл, 2,00 ммоль) добавляют в атмосфере азота к раствору соединения, полученного согласно примеру 1, стадия 6 (717 мг, 1,00 ммоль), содержащего ацетат палладия (II) (22 мг, 0,100 ммоль) и трифенилфосфин (52 мг, 0,200 ммоль) в 5 мл ацетонитрила, и реакционную смесь охлаждают до -78oС, дегазируют и закупоривают. Затем реакционную смесь нагревают при 60oС в течение 0,5 часов и перемешивают при 80oС в течение 12 часов. Реакционную смесь переносят в этилацетат и промывают дважды 5%-водным раствором бикарбоната натрия, один раз 2%-водным раствором трис(гидроксиметил)аминометана и один раз соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Конечное соединение (721 мг) в виде не совсем белого пенообразного продукта получают с помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 95:5:0,5).
Стадия 14b: Соединение VIII: Х = О, R = -СН2СН=СН-фенил
Защитную группу в соединении, полученном на стадии 14а, удаляют нагреванием в метаноле, как указано в примере 1, стадия g.
13С ЯМР (CDCl3) δ 219,4 (С-9), 206,0 (С-3), 169,8 (С-1), 137,0, 132,6, 128,3, 127,3, 126,7, 126,6, 102,7, 78,4, 78,2, 75,9, 74,3, 70,3, 69,5, 69,1, 65,9, 64,2, 50,6, 45,4, 45,3, 40,2, 38,7, 37,7, 28,3, 21,9, 21,2, 20,3, 18,1, 16,5, 14,6, 13,0, 12,3, 10,8. МС (ББА)+ m/e 690 (M+H)+.
Пример 15
Соединение формулы VIII: X = О, R = -СН2СН2СН2-фенил
Раствор соединения, полученного согласно примеру 14 (170 мг, 0,247 ммоль), в 10 мл метанола продувают азотом, добавляют 10%-ный палладий на углероде (50 мг), реакционную смесь продувают водородом и перемешивают при повышенном давлении водорода в течение 18 часов. Реакционную смесь фильтруют через целлит и осадок промывают дихлорметаном. Фильтрат концентрируют в вакууме и получают безцветный стеклообразный продукт. Стеклообразный продукт переносят в эфир, добавляют гексан, растворители удаляют в вакууме и получают конечный продукт (67 мг) в виде белого осадка.
13С ЯМР (CDCl3) δ 220,2 (С-9), 206,5 (С-3), 170,0 (С-1), 142,3, 128,4, 128,1, 125,4, 102,6, 78,2, 78,0, 75,6, 74,2, 70,3, 69,5, 69,4, 65,9, 62,1, 50,6, 45,4, 44,6, 40,2, 38,8, 37,5, 32,1, 30,3, 28,4, 21,9, 21,3, 20,2, 18,4, 16,5, 14,9, 12,4, 10,6. МС (ББА)+ m/e 692 (М+Н)+.
Пример 16
Соединение формулы VIII: X = О, R = -СН2СН=СН-(4-метоксифенил)
Конечное соединение получают по методике, указанной в примере 14, за исключением использования 4-йоданизола вместо йодбензола.
МС (ББА) + m/e 720 (М+Н)+.
Пример 17
Соединение формулы VIII: Х = О, R = -СН2СН=СН-(4-хлорфенил)
Конечное соединение получают по методике, указанной в примере 14, за исключением использования 1-хлор-4-йодбензола вместо йодбензола.
13С ЯМР (CDCl3) δ 219,6 (С-9), 206,0 (С-3), 169,8 (С-1), 139,6, 135,5, 131,3, 128,5, 127,9, 127,3, 102,7, 78,4, 78,2, 75,9, 74,2, 70,3, 69,5, 69,2, 65,9, 64,1, 50,6, 45,4, 45,3, 40,2, 38,6, 37,6, 28,4, 21,8, 21,2, 20,3, 18,0, 16,5, 14,6, 13,0, 12,2, 10,8. МС (ББА)+ m/e 724 (М+Н)+.
Пример 18
Соединение формулы VIII: X = О, R = -СН2СН=СН-(3-хинолил)
Стадия 18а: Соединение 9, схема 2: Х = О, R = -СН2СН=СН-(3-хинолил), Rp - бензоил
Смесь соединения, полученного согласно примеру 1, стадия f, (1,80 г, 0,25 ммоль), ацетата палладия (II) (11 мг, 0,05 ммоль), три-о-толилфосфина (30 мг, 0,10 ммоль) и 3-бромхинолина (68 мкл, 0,5 ммоль) в 2 мл ацетонитрила охлаждают до -78oС, дегазируют и закупоривают. Реакционную смесь нагревают при 50oС в течение 2 часов и перемешивают при 80oС в течение 16 часов. Реакционную смесь переносят в этилацетат и промывают 5%-водным раствором карбоната натрия, 2%-водным раствором трис(гидроксиметил)аминометана и соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Конечное соединение (186 мг) в виде не совсем белого пенообразного остатка получают с помощью хроматографии на силикагеле (дихлорметан-метанол 98:2).
МС (ББА)+ m/e 845 (М+Н)+.
Стадия 18b: Соединение формулы VIII: Х = О, R = -СН2СН=СН-(3-хинолил)
Защитную группу в соединении, полученном на стадии 18а, удаляют нагреванием в метаноле, как указано в примере 1, стадия g.
13С ЯМР (CDCl3) δ 219,7 (С-9), 205,9 (С-3), 169,8 (С-1), 152,1, 150,0, 147,5, 140,2, 132,6, 130,0, 129,2, 129,1, 128,8, 128,1, 127,9, 126,5, 102,8, 78,5, 78,2, 75,9, 74,2, 70,2, 69,4, 69,2, 65,9, 64,1, 50,6, 45,4, 45,3, 40,2, 38,7, 37,6, 28,4, 21,8, 21,2, 20,3, 18,0, 16,5, 14,6, 13,0, 12,2, 10,8. МС (ББА)+ m/e 741 (М+Н)+.
Следующие соединения формулы VIII, где Х = О, могут быть получены с использованием методик, указанных в предыдущих примерах и схемах, а также с использованием известных в области синтетической органической химии способов. Эти соединения имеют формулу
и R-заместители, указанные в табл.A.
Пример 71
Соединение формулы IX: L = СО, Т = О, R = -СН2СН=СН2
Стадия 71 а: Соединение 10, схема 2: R = -СН2СН=СН2, Rp - бензоил
Гексаметилдисилазид натрия (1,0 М раствор в ТГФ, 5,5 мл, 5,5 ммоль) добавляют в токе азота к охлажденному до -35oС раствору соединения, полученного согласно примеру 1, стадия f (3,58 г, 5,00 ммоль), в 60 мл ТГФ, и полученную белую суспензию перемешивают в течение 30 минут. Раствор карбонилдиимидазола (4,05 г, 25 ммоль) в 40 мл ТГФ добавляют по каплям при -35oС в течение 20 минут, а затем охлаждающую баню удаляют, и реакционную смесь перемешивают в течение 30 минут. Реакционную смесь переносят в этилацетат, промывают 5% водным раствором бикарбоната натрия, соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Конечный продукт в виде белого пенообразного остатка (2,6 г) получают с помощью хроматографии на силикагеле (30% ацетон-гексан).
МС (ББА)+ m/e 744 (М+Н)+.
Стадия 71b: Соединение формулы IX: L = СО, Т = О, R = -СН2СН=СН2
Защитную группу в соединении, полученном на стадии 71а, удаляют путем нагревания в метаноле согласно методике, описанной в примере 1, стадия g.
13С ЯМР (CDCl3) δ 212,1 (С-9), 205,0 (С-3), 168,9 (С-1), 153,8, 134,4, 118,4, 103,1, 84,7, 80,5, 78,7, 77,1, 76,9, 70,3, 69,5, 65,9, 64,8, 50,8, 46,5, 44,1, 40,2, 38,8, 38,1, 28,4, 22,7, 21,2, 20,5, 18,3, 14,5, 13,6, 12,6, 10,6. МС (ББА)+m/e 640 (М+Н)+.
Пример 72
Соединение формулы IX: L = СО, Т = О, R = -СН2СН=CH-фенил
Стадия 72а: Соединение 10, схема 2: R = -СН2СН=CH-фенил, Rp - бензоил
Раствор соединения, полученного согласно примеру 14, стадия а (150 мг, 0,20 ммоль), в 5 мл ТГФ охлаждают до -35oС и продувают азотом. Гексаметилдисилазид лития (1,0 М раствор в ТГФ, 0,22 мл, 0,22 ммоль) добавляют при -35oС в течение 2 минут. Реакционную смесь перемешивают при -35oС в течение 10 минут и затем добавляют по каплям карбонилдиимидазол (162 мг, 1,00 ммоль) в 3 мл ТГФ в течение 2 минут. Охлаждающую баню удаляют, и реакционную смесь перемешивают в течение 30 минут. Реакционную смесь охлаждают до 0oС и добавляют 0,5 М раствор KH2PO4. Смесь экстрагируют этилацетатом и органическую фазу промывают соляным раствором, высушивают над сульфатом натрия и концентрируют в вакууме. Конечный продукт в виде белого остатка (87 мг) получают с помощью хроматографии на силикагеле (30% ацетон-гексан).
МС (ББА)+ m/e 820 (М+Н)+.
Стадия 72b: Соединение формулы IX: L = СО, Т = О, R = -СН2СН=СН-фенил
Защитную группу в соединении, полученном на стадии 72а, удаляют путем нагревания в метаноле согласно методике, описанной в примере 1, стадия g.
13С ЯМР (CDCl3) δ 212,4 (С-9), 205,2 (С-3), 168,3 (С-1), 153,3, 136,4, 134,9, 128,3, 127,6, 127,0, 124,7, 103,2, 84,5, 80,8, 78,7, 78,0, 70,3, 69,6, 65,9, 64,5, 50,9, 46,9, 44,4, 40,2, 39,1, 37,8, 28,3, 23,0, 21,2, 20,4, 18,1, 14,8, 14,4, 13,7, 12,6, 10,8. МС (ББА)+ m/e 716 (М+Н)+.
Пример 73
Соединение формулы IX: L = СО, Т = О, R = -СН2СН2СН2-фенил
Стадия 73а: Соединение 8, схема 1b: R = -СН2СН2СН2-фенил, Rp - бензоил
Конечное соединение получают при взаимодействии соединения, полученного согласно примеру 15, с бензангидридом в соответствии с методикой, указанной в примере 1, стадия е.
Стадия 73b: Соединение 10, схема 1b: R = -СН2СН2СН2-фенил, Rp - бензоил
Гексаметилдисилазид натрия (1,0 М раствор в ТГФ, 0,16 мл, 0,16 ммоль) добавляют в атмосфере азота в течение 1 минуты к охлажденному до -35oС раствору соединения, полученного на стадии 73а (104 мг, 0,13 ммоль), в 5 мл ТГФ. Реакционную смесь перемешивают в течение 10 минут при -35oС. Раствор карбонилдиимидазола (105 мг, 0,65 ммоль) в 3 мл ТГФ добавляют по каплям при -35oС в течение 1 минуты, а затем охлаждающую баню удаляют, и реакционную смесь перемешивают в течение 30 минут. Реакционную смесь экстрагируют этилацетатом, органическую фазу промывают 5% водным раствором бикарбоната натрия, соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают бесцветный стеклообразный продукт. Конечный продукт в виде белого осадка (63 мг) получают с помощью хроматографии на силикагеле (30% ацетон-гексан). МС (ББА)+ m/e 822 (М+Н)+.
Стадия 73с: Соединение формулы IX: L = СО, Т = О, R = -СН2СН2СН2-фенил
Защитную группу в соединении, полученном на стадии 73b, удаляют путем нагревания в метаноле согласно методике, описанной в примере 1, стадия g.
13С ЯМР (CDCl3) δ 211,8 (С-9), 205,1 (С-3), 169,6 (С-1), 153,6, 141,9, 128,5, 128,1, 125,5, 102,7, 84,6, 80,5, 78,3, 76,0, 70,2, 69,5, 65,9, 62,4, 50,7, 45,5, 44,5, 40,2, 38,6, 37,9, 31,9, 30,4, 28,4, 22,6, 21,2, 20,3, 18,5, 14,6, 13,4, 13,3, 12,6, 10,4. МС (ББА)+ m/e 718 (М+Н)+.
Пример 74
Соединение формулы IX: L = СО, Т = О, R = -СН2СН=СН-(4-хлорфенил)
Стадия 74а: Соединение формулы 10, схема 1b: R = -СН2СН=СН-(4-хлорфенил), Rp = бензоил
Раствор соединения формулы 10 (R = -СН2СН=СН-(4-хлорфенил), Rp - бензоил), полученного согласно примеру 17 (165 мг, 0,20 ммоль), в 5 мл ТГФ охлаждают до -35oС и продувают азотом. Гексаметилдисилазид лития (1 М раствор в ТГФ, 0,22 мл, 0,22 ммоль) добавляют при -35oС в течение 2 минут. Реакционную смесь перемешивают в течение 10 минут при -35oС. Раствор карбонилдиимидазола (105 мг, 0,65 ммоль) в 3 мл ТГФ добавляют по каплям в течение 2 минут, а затем охлаждающую баню удаляют, и реакционную смесь перемешивают в течение 30 минут. Реакционную смесь экстрагируют этилацетатом, промывают 5% водным раствором бикарбоната натрия, соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают бесцветный стеклообразный продукт (219 мг), который используют без дальнейшей очистки.
МС (ББА)+ m/e 854 (М+Н)+.
Стадия 74b: Соединение формулы IX: L = СО, Т = О, R = -CH2CH=CH-(4-хлорфенил)
Защитную группу в соединении, полученном на стадии 74а, удаляют путем нагревания в метаноле согласно методике, описанной в примере 1, стадия g.
13С ЯМР (CDCl3) δ 212,4 (С-9), 205,1 (С-3), 168,6 (С-1), 153,3, 135,0, 133,2, 128,5, 128,3, 125,5, 103,2, 84,5, 80,7, 78,8, 78,0, 70,3, 69,6, 66,0, 64,3, 50,9, 46,9, 44,4, 40,2, 39,1, 37,8, 28,4, 23,0, 21,2, 20,4, 18,1, 14,8, 14,4, 13,6, 12,6, 10,7. МС (ББА)+ m/e 750 (М+Н)+.
Пример 75
Соединение формулы IX: L = СО, Т = О, R = -СН2СН=СН-(3-хинолил)
Соединение формулы 10 (R = -СН2СН=СН-(3-хинолил), Rp - бензоил), полученное как указано в примере 18, превращают в конечное соединение с использованием способа, указанного в примере 71, стадии а и b.
13С ЯМР (СDСl3) δ 212,4 (С-9), 205,2 (С-3), 168,7 (С-1), 153,4, 150,3, 147,6, 132,7, 131,1, 129,6, 129,0, 128,9, 128,4, 128,1, 127,7, 126,6, 103,2, 84,5, 80,6, 78,9, 77,5, 77,0, 70,3, 69,6, 65,9, 64,3, 50,9, 46,9, 44,5, 40,3, 39,0, 37,8, 28,4, 22,8, 21,2, 20,4, 18,1, 14,7, 14,4, 13,5, 12,6, 10,6. МС (ББА)+ m/e 767 (М+Н)+.
Следующие соединения формулы IX, где L = СО и Т = О, могут быть получены с использованием методик, указанных в предыдущих примерах и схемах, а также с использованием известных в области синтетической органической химии способов. Эти соединения имеют формулу
и R-заместители, указанные в табл.Б.
Пример 102
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=СН2
Стадия 102а: Соединение 11, схема 2: R = -СН2СН=СН2, Rp - бензоил
1,8-диазабицикло[5,4,0] ундек-7-ен (DBU, 5,0 мл, 34 ммоль) добавляют к раствору соединения 10 (R = -CH2CH=CH2, Rp - бензоил), полученного согласно примеру 71, стадия а (2,59 г, 3,48 ммоль), в 100 мл бензола. Реакционную смесь продувают азотом, нагревают до 80oС и перемешивают в течение 3,5 часов. Реакционную смесь охлаждают до 0oС и добавляют 0,5 М водный раствор NaH2PO4 (100 мл). Реакционную смесь дважды экстрагируют этилацетатом и объединенные органические слои промывают соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают белый пенообразный продукт. С помощью хроматографии на силикагеле (30% ацетон-гексан) получают конечный продукт (1,74 г) в виде белого твердого осадка.
МС (ББА)+ m/e 700 (M+H)+.
Стадия 102b: Соединение 12, схема 3а: R = -СН2СН=СН2, Rp - бензоил
Раствор соединения, полученного на стадии 102а (1,74 г, 2,49 ммоль), в 30 мл ТГФ охлаждают до -10oС и продувают азотом. Добавляют гидрид натрия (80% в минеральном масле, 150 мг, 5,00 ммоль), и реакционную смесь перемешивают в течение 10 минут. Раствор карбонилдиимидазола (1,22 г, 7,50 ммоль) в 20 мл ТГФ добавляют в течение 10 минут при -10oС. Охлаждающую баню удаляют, и реакционную смесь перемешивают в течение 1 часа. Реакционную смесь экстрагируют этилацетатом и органическую фазу промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают белый пенообразный продукт. С помощью хроматографии на силикагеле (30% ацетон-гексан) получают конечный продукт (1,58 г) в виде белого твердого осадка.
МС (ББА)+ m/e 794 (М+Н)+.
Стадия 102с: Соединение 18, схемы 4: R = -СН2СН=СН2, Rp - бензоил
Соединение, полученное на стадии 102b (1,19 г, 1,5 ммоль), растворяют в 2 мл ТГФ и 20 мл ацетонитрила и раствор продувают азотом. Добавляют водный раствор гидроксида аммония (28%, 21 мл), и реакционную смесь перемешивают в токе азота в течение 24 часов. Реакционную смесь экстрагируют этилацетатом и органическую фазу промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают белый пенообразный продукт. С помощью хроматографии на силикагеле (30% ацетон-гексан) получают конечный продукт (0,56 г) в виде белого твердого осадка.
МС (ББА)+ m/e 743 (M+H)+.
Стадия 102d: Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=СН2
Конечное соединение получают путем удаления защитной группы в соединении, полученном на стадии 102с, нагреванием в метаноле согласно методике, как указано в примере 1, стадия g.
13С ЯМР (CDCl3) δ 216,9 (С-9), 205,3 (С-3), 169,5 (С-1), 158,0, 134,4, 118,2, 102,8, 83,7, 78,4, 77,1, 76,1, 70,2, 69,5, 64,7, 57,8, 50,8, 45,9, 45,1, 40,2, 38,9, 37,3, 28,3, 22,6, 21,2, 20,2, 18,1, 14,5, 13,8, 13,7, 10,6. МС (ББА)+ m/e 639 (M+H)+.
Пример 103
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=CH-фенил
Необходимое соединение получают, как указано в примере 18, за исключением использования соединения, полученного согласно примеру 102, стадия с (которое является соединением 18, схема 4, где R является аллилом и Rр - бензоилом), вместо соединения, полученного согласно примеру 1, стадия f и использованного в указанном примере, а также за исключением использования йодбензола вместо 3-бромхинолина.
13С ЯМР (CDCl3) δ 217,1 (С-9), 205,3 (С-3), 169,5 (С-1), 157,4, 136,5, 133,7, 128,6, 127,8, 126,5, 125,4, 102,9, 83,4, 78,4, 77,7, 76,4, 70,3, 69,5, 65,9, 64,3, 58,2, 50,9, 46,3, 45,1, 40,2, 39,1, 37,3, 31,5, 28,3, 22,8, 21,2, 20,3, 18,1, 14,4, 14,2, 13,7, 10,8. МС (ББА)+ m/e 715 (М+H)+.
Пример 104
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=СН-(3-хинолил)
Необходимое соединение получают, как указано в примере 18, за исключением использования соединения, полученного согласно примеру 102, стадия с (которое является соединением 18, схема 4, где R является аллилом и Rp - бензоилом), вместо соединения, полученного согласно примеру 1, стадия f и использованного в указанном примере.
13С ЯМР (CDCl3) δ 217,4 (С-9), 205,3 (С-3), 169,5 (С-1), 157,7, 149,7, 147,6, 132,5, 129,9, 129,6, 129,2, 129,1, 128,6, 128,1, 126,7, 102,9, 83,5, 78,8, 77,5, 76,5, 70,2, 69,5, 65,9, 64,3, 58,2, 50,9, 46,3, 45,1, 40,2, 39,1, 37,4, 28,2, 22,6, 21,2, 20,2, 18,1, 14,4, 14,2, 13,7, 10,7. МС (ББА)+ m/e 766 (M+H)+.
Следующие соединения формулы IX, где L = СО и Т = NH, могут быть получены с использованием методик, указанных в предыдущих примерах и схемах, а также с использованием известных в области синтетической органической химии способов. Эти соединения имеют формулу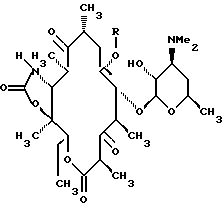
и R-заместители, указанные в табл.В.
Пример 134
Соединение формулы VII: А, В, D и Е являются Н, R - аллилом
Стадия 134а: Соединение формулы 14 (Схема 3а): А, В, D и Е являются Н, R - аллилом, Rp - бензоилом
Этилендиамин (291 мг, 4,85 ммоль) добавляют в токе азота к раствору соединения формулы 12 (R - аллил, Rp - бензоил, 385 мг, 0,485 ммоль), полученного согласно примеру 102, стадия b, в ацетонитриле, и реакционную смесь перемешивают в течение 67 часов. Реакционную смесь экстрагируют этилацетатом и органическую фазу промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают конечный продукт (401 мг) в виде бесцветного масла, который используют без дальнейшей очистки.
Стадия 134b: Соединение формулы VII: А, В, D и Е являются Н, R - аллилом
Неочищенный препарат, полученный на стадии 134а, растворяют в 5 мл метанола, добавляют 60 мкл уксусной кислоты, и реакционную смесь перемешивают при температуре окружающей среды в течение 15 часов. Реакционную смесь экстрагируют этилацетатом и органическую фазу промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают соединение в виде светложелтого, стеклообразного продукта (347 мг). Это соединение очищают с помощью хроматографии на силикагеле (дихлорметан-метанол-аммиак, 95:5:0,5) и получают конечное соединение (126 мг) в виде белого пенообразного продукта.
МС (ББА)+ m/e 664 (М+Н)+.
Следующие соединения формулы VII, где А, В, D и Е являются водородом, могут быть получены с использованием методик, указанных в предыдущих примерах и схемах, а также с использованием известных в области синтетической органической химии способов. Эти соединения имеют формулу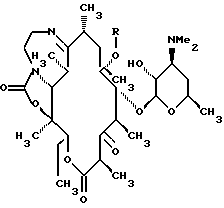
и R-заместители, указанные в табл.Г.
Пример 164
Соединение формулы VII: А, В и Е являются Н, D - бензил, R - аллил
Стадия 164а: 2-(R)-(ВОС-амино)-3-фенил-1-пропанол
(R)-2-амино-3-фенил-1-пропанол (3,0 г, 19,8 ммоль, Aldrich) добавляют к 5,2 г (23,8 ммоль)ди-трет-бутилдикарбоната, растворенного в 20 мл метиленхлорида и выдержанного при 0oС, и реакционную смесь перемешивают при комнатной температуре в течение 1,5 часов. Растворитель удаляют и остаток высушивают в высоком вакууме и непосредственно используют на следующей стадии.
Стадия 164b: 2-(R)-(ВОС-амино)-1-О-метансульфонилокси-3-фенилпропан
Продукт, полученный на стадии 164а, растворяют в 20 мл метиленхлорида и 5 мл ТГФ, раствор охлаждают до 0oС. Добавляют триэтиламин (4,1 мл, 29,4 ммоль), затем медленно добавляют метансульфонилхлорид (1,9 мл, 24,5 ммоль). Смесь перемешивают при комнатной температуре в течение 45 минут, затем удаляют растворители в вакууме. Остаток растворяют в этилацетате и раствор промывают водой и соляным раствором, высушивают над Na2SO4 и фильтруют. Конечное соединение (6,38 г) получают после удаления растворителя в вакууме.
МС m/z (М+Н)+: 330, МС m/z (М+NН4)+: 347.
Стадия 164с: 1-азидо-2-(R)-(ВОС-амино)-3-фенилпропан
Соединение, полученное на стадии 164b, (6,36 г, 193 ммоль) растворяют в 25 мл ДМФ и добавляют 2,5 г (38 ммоль) NaN3. Реакционную смесь перемешивают при 62oС в течение 24 часов. Раствор охлаждают до комнатной температуры, затем экстрагируют этилацетатом. Органический экстракт промывают водой и соляным раствором, высушивают над Na2SO4 и фильтруют. Конечное соединение (4,34 г) получают после удаления растворителя в вакууме.
МС m/z (М+Н)+: 277, МС m/z (M+NH4)+: 294.
Стадия 164d: 1-азидо-2-(R)-амино-3-фенилпропан
Соединение, полученное на стадии 164с (4,3 г, 15,6 ммоль), растворяют в 30 мл 4 N HCl в этаноле, реакционную смесь перемешивают при комнатной температуре в течение 1,5 часов. Растворитель отгоняют и остаток промывают эфиром. Остаток растворяют в воде, добавляют NaCl и смесь экстрагируют этиловым эфиром, который отбрасывают. рН водного слоя доводят до 12
с помощью раствора К2СО3, насыщенного NaCl, затем экстрагируют СНСl3. Органический экстракт промывают соляным раствором, высушивают над Na2SO4 и отфильтровывают. Конечное соединение (2,17 г) получают после удаления растворителя в вакууме.
МС m/z (М+Н)+: 177, МС m/z (М+NH4)+: 194.
Стадия 164е: 1,2-(R)-диамино-3-фенилпропан
Образец соединения, полученного на стадии 164d (1,2 г, 6,8 ммоль), гидрируют при 4 атм в этаноле над 1,2 г 10% Pd/C при комнатной температуре в течение 21,5 часа. Смесь отфильтровывают для удаления катализатора и конечное соединение (1,055 г) получают после удаления растворителя в вакууме.
МС m/z (М+Н)+: 151, МС m/z (M+NH4)+: 168.
Стадия 164f: Соединение 14, схема 3а: А, В и Е являются Н, D - бензил, R-аллил, Rр - бензоил
Необходимое соединение получают при перемешивании раствора соединения, полученного согласно примеру 102, стадия b (которое является соединением 12, схема 3а, где R - аллил, Rр - бензоил), с раствором 1,2-(R)-диамино-3-фенилпропана, полученного на стадии 164е, в водном ацетонитриле в течение времени, достаточного для практически полного превращения исходных веществ.
Стадия 164g: Соединение 14, схема 3а: А, В и Е являются Н, D - бензил, R - аллил, Rp - Н
Конечное соединение получают путем удаления защитной группы в соединении, полученном на стадии 164f, нагреванием в метаноле согласно методике, как указано в примере 1, стадия g.
Стадия 164h: Соединение формулы VII: А, В и Е являются Н, D - бензил, R - аллил
Необходимое соединение получают нагреванием раствора соединения, полученного на стадии 164g, в смеси этанол-уксусная кислота.
Пример 165
Соединение формулы VII: А - бензил, В, D и Е являются Н, R - аллил
Стадия 165а: Соединение 16, схема 3b: А - бензил, В, D и Е - Н, Y - ОН, R - аллил, Rp - бензоил
Необходимое соединение получают по способу согласно примеру 164, стадия f, за исключением использования (S)-2-амино-3-фенил-1-пропанола (фирмы Aldrich Chemical Co.) вместо 1,2-(R)-диамино-3-фенилпропана.
Стадия 165b: Соединение 16, схема 3b: А - бензил, В, D и Е - Н, Y - N3, R - аллил, Rp - бензоил
Необходимое соединение получают путем обработки раствора соединения, полученного на стадии 165а, в ТГФ трифенилфосфином, диэтилазодикарбоксилатом и дифенилфосфорилазидом.
Стадия 165с: Соединение 16 из схемы 3b: А - бензил, В, D и Е - Н, Y - N3, R - аллил, Rp - Н
Необходимое соединение получают путем удаления защитной группы в соединении, полученном на стадии 165b, нагреванием в метаноле по методике, указанной в примере 1, стадия g.
Стадия 165d: Соединение 17, схема 3b: R - аллил
Необходимое соединение получают при кипячении с обратным холодильником раствора продукта, полученного на стадии 165с, в ТГФ и трифенилфосфина.
Стадия 165е: Соединение формулы VII: А - бензил, В, D и Е являются Н, R - аллил
Необходимое соединение получают нагреванием раствора соединения, полученного на стадии 165d, в смеси этанол-уксусная кислота.
Пример 166
Соединение формулы VII: А и Е - фенил, В и D - Н, R - аллил
Необходимое соединение получают согласно способу, указанному в примере 164, стадии f-h, за исключением использования 1,2-дифенил-1,2-этилендиамина (фирмы Aldrich Chemical Co.) вместо 1,2-(R)-диамино-3-фенилпропана.
Пример 167
Соединение формулы VII: А - метил, В, D и Е - Н, R - аллил
Необходимое соединение получают по способу, указанному в примере 165, за исключением использования (S)-2-амино-1-пропанола (фирмы Aldrich Chemical Co.) вместо (S)-2-амино-3-фенил-1-пропанола.
Пример 168
Соединение формулы VII: А и D - метил, В и Е - Н, R - аллил
Стадия 168а: мезо-2,3-бис(метансульфонилокси)бутан
Мезо-2,3-бутандиол (10 г, 111 ммоль, Aldrich) и триэтиламин (92,8 мл, 666 ммоль) растворяют в метиленхлориде. Раствор охлаждают до -78oС и добавляют по каплям метансульфонилхлорид (25,8 мл, 333 ммоль), при этом образуется осадок. Смесь разбавляют дополнительным количеством метиленхлорида и перемешивают при -78oС в течение 20 минут и при 0oС в течение 2 часов. Реакционную смесь нагревают до комнатной температуры, разбавляют дополнительным количеством растворителя и промывают водой, водным раствором NаНСО3 и водным раствором NaCl. Органическую фазу высушивают над MgSO4, растворитель удаляют и получают конечный продукт (25,01 г).
1Н-ЯМР (300 МГц, CDCl3): δ 4,91 (q, 2H), 3,10 (s, 6H), 1,45 (d, 6H).
Стадия 168b: мезо-2,3-диазидобутан
Соединение, полученное на стадии 168а (25 г), растворяют в 250 мл ДМФ и добавляют 40 г NaN3. Смесь интенсивно перемешивают при 85oС в течение 24 часов, затем охлаждают до комнатной температуры. Смесь разбавляют 800 мл эфира, промывают водой, водным раствором NаНСО3 и водным раствором NaCl, затем высушивают над MgSO4. Раствор отфильтровывают, концентрируют и получают конечное соединение (13,00 г).
1Н-ЯМР (300 МГц, CDCl3): δ 3,50 (m, 2H), 1,30 (d, 6H).
Стадия 168с: мезо-2,3-бутандиамин
Соединение, полученное на стадии 168b (13,0 г, 125 ммоль), растворяют в этаноле и гидрируют при 4 атм над 10% Pd/C при комнатной температуре в течение 20 часов. Катализатор удаляют фильтрованием, растворитель удаляют в вакууме и получают конечное соединение.
1H-ЯМР (300 МГц, CDCl3): δ 2,70 (m, 2H), 1,45 (br., 4H), 1,05 (d, 6H). MC m/z: 89 (М+Н)+.
Стадия 168d: Соединение формулы VII: А и D - метил, В и Е - Н, R - аллил
Необходимое соединение получают согласно способу, указанному в примере 164, стадии c-h, за исключением использования мезо-2,3-бутандиамина, полученного как указано на стадии 168с, вместо 1,2-(R)-диамино-3-фенилпропана.
Пример 169
Соединение формулы VII: А и Е, взятые вместе, объединены -СН2СН2СН2-, В и D - Н, R - аллил
Необходимое соединение получают по методике, указанной в примере 168, за исключением использования 1,2-циклопентандиола (Aldrich Chemical Со.) вместо мезо-2,3-бутандиола.
Пример 170
Соединение формулы VII: А, В, D и Е являются Н, R = -СН2СН=СН-(3-хинолил)
Необходимое соединение получают при конденсации 3-бромхинолина с продуктом, полученным согласно примеру 134, в соответствии со способом, указанным в примере 18.
МС (ББА)+ m/e 791 (М+Н)+.
Пример 171
Соединение формулы VII: А, В, D и Е являются Н, R = -CH2CH2CH2-(3-хинолил)
50 мг 10% Pd/C добавляют к раствору соединения, полученного согласно примеру 170 (110 мг), в 10 мл метанола, который предварительно продувают азотом, и смесь перемешивают при давлении водорода, равном 1 атм, при комнатной температуре в течение 16 часов. Смесь отфильтровывают, концентрируют и остаток очищают путем хроматографии на силикагеле, при элюировании смесью дихлорметан/метанол/диметиламин в соотношении от 95:5:0,5 до 90:10:0,5 и получают конечное соединение (106 мг).
МС высокого разрешения (МСВР) m/e (M+H)+ paccчитaнo для C44H64N4O9: 793,4752, найдено 793,4766.
Пример 172
Соединение формулы VIII: X является О, R = СН2-(3-йодфенил)
Конечное соединение получают согласно способам, указанным в примере 1, за исключением использования 3-йодбензилбромида вместо аллилбромида, использованного на стадии 1а.
МС (ББА)+ m/e 949 (М+Н)+.
Пример 173
Соединение формулы VIII: Х является О, R = CH2-(2-нафтил)
Конечное соединение получают согласно способам, указанным в примере 1, за исключением использования (2-нафтил)метилбромида вместо аллилбромида, использованного на стадии 1а, и уксусного ангидрида вместо бензангидрида, использованного на стадии 1е.
МС (ББА)+ m/e 714 (М+Н)+.
Элементный анализ, рассчитано для C40H59NO10: С 67,30, Н 8,33, N 1,96; найдено: С 66,91, Н 8,29, N 1,64.
Пример 174
Соединение формулы VIII: Х является О, R = СН2СН=СН-(4-фторфенил)
Конечное соединение получают согласно способам, указанным в примере 172, за исключением использования 4-фтор-1-йодбензола вместо йодбензола, использованного на стадии 14а.
Пример 175
Соединение формулы VIII: Х является О, R = СН2-CH(OH)-CN
Конечное соединение получают путем хроматографического выделения из реакционной смеси, полученной согласно примеру 8.
МС (ББА)+ m/e 643 (М+Н)+.
Пример 176
Соединение формулы IX: L является СО, Т=NH, R = -СН2-(2-нафтил)
Стадия 176а. Соединение 6, схема 1а: R = -СН2-(2-нафтил)
Конечное соединение получают согласно способам, указанным в примере 1, стадии а-с, за исключением использования (2-нафтил)метилбромида вместо аллилбромида, использованного на стадии 1а.
МС (ББА)+ m/e 874 (М+Н)+.
Стадия 176b. Соединение 6А, схема 1с: R = СН2-(2-нафтил), Rp - ацетил
Соединение, полученное на стадии 176а (2,0 г), обрабатывают согласно способу, указанному в примере 1, стадия е, за исключением ипользования уксусного ангидрида вместо бензангидрида.
МС (ББА)+ m/e 958 (М+Н)+.
Стадия 176с. Соединение 6В, схема 1с: R = СН2-(2-нафтил), Rp - ацетил
Соединение, полученное на стадии 176b (500 мг), обрабатывают NaH и карбонилдиимидазолом согласно способу, указанному в примере 102, стадия b, и получают конечное соединение (58 мг).
МС (ББА)+ m/e 1034 (М+Н)+.
Стадия 176d. Соединение 6С из схемы 1с: R = СН2-(2-нафтил), Rp - ацетил, Rd - Н
Соединение, полученное на стадии 176с (58 мг), обрабатывают аммиаком в ацетонитриле согласно способу, указанному в примере 102, стадия с, и получают конечное соединение.
МС (ББА)+ m/e 983 (М+Н)+.
Стадия 176е. Соединение формулы IX: L является СО, Т = NH, R = CH2-(2-нафтил)
Соединение, полученное на стадии 176d, согласно способам, указанным в примере 1, стадии 1d, 1f, 1g, и получают конечное соединение.
МС (ББА)+m/e 739 (М+Н)+.
Пример 177
Соединение формулы III: Rc является ацетилом, L = СО, Т = NH, R = СН2СН= СН2
Стадия 177а. Соединение 6А, схема 1с: R = -СН2СН=СН2, Rp - ацетил
Диметиламинопиридин (0,488 г, 4 ммоль) и уксусный ангидрид (3,39 мл, 36 ммоль) добавляют к раствору соединения, полученного согласно примеру 1, стадия с (405,2 г, 528 ммоль), в 20 мл дихлорметана, и реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Смесь разбавляют метиленхлоридом, затем промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над Na2SO4. Остаток высушивают и перекристаллизовывают из ацетонитрила, получают конечный продукт (491 г).
МС (ББА)+ m/e 857 (М+Н)+.
Стадия 177b. Соединение 6В, схема 1с: R = -CH2CH=CH2, Rp - ацетил
Раствор соединения, полученного на стадии 177а (85,8 г, 100 ммоль), в 500 мл сухого ТГФ охлаждают до -40oС и продувают азотом, затем добавляют бис(триметилсилил)амид натрия (125 мл, 125 ммоль) в течение 20 минут, и реакционную смесь перемешивают при -40oС в течение 40 минут. К полученной смеси добавляют раствор карбонилдиимидазола (3,65 г, 22,56 ммоль) в 800 мл смеси ТГФ/ДМФ 5:3 в токе азота при -40oС в течение 30 минут, и смесь перемешивают при -20oС в течение 30 минут. Затем реакционную смесь перемешивают при комнатной температуре в течение 27 часов, разбавляют этилацетатом. Смесь промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над Na2SO4, концентрируют и получают конечное соединение (124 г), которое используют непосредственно на следующей стадии.
Стадия 177с. Соединение 6С, схема 1с: R = -СН2СН=СН2, Rp - ацетил, Rd - Н
Соединение, полученное на стадии 177b (124 г), растворяют в 1100 мл смеси ацетонитрил/ТГФ 9:1 и добавляют гидроксид аммония (28%, 200 мл), реакционную смесь перемешивают при комнатной температуре в токе азота в течение 8 дней. Растворитель удаляют и остаток растворяют в этилацетате. Этот раствор промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над Na2SO4, концентрируют и получают конечное соединение.
МС (ББА)+ m/e 882 (М+Н)+.
Стадия 177d. Соединение 6D, схема 1с: R = -СН2СН=СН2, Rp - ацетил, Rd - Н
Соединение, полученное на стадии 177с (69,0 г, 78,2 ммоль), суспендируют в 200 мл этанола и разбавляют 400 мл воды, затем по каплям добавляют HCl (0,972 N, 400 мл) в течение 20 минут. Смесь перемешивают в течение 4 часов и добавляют еще 100 мл HCl (4 N) в течение 20 минут. Смесь перемешивают в течение 18 часов, охлаждают до 0oС, затем добавляют NaOH (4 N, 200 мл) в течение 30 минут до рН приблизительно 9. Конечное соединение (35,56 г) получают фильтрованием.
Стадия 177е. Соединение 6Е, схема 1с: R = -СН2СН=СН2, Rp - ацетил, Rd - Н (Соединение формулы III: Rc является ацетилом, L = СО, Т = NH, R = -СН2СН= СH2)
Диметилсульфид (1,52 мл, 20,8 ммоль) добавляют в течение 5 минут в токе азота к раствору N-хлорсукцинимида (2,37 г, 17,8 ммоль) в 80 мл дихлорметана, охлажденному до -10oС. Полученную суспензию белого цвета перемешивают при -10oС в течение 10 минут и добавляют раствор соединения, полученного на стадии 177d (8,10 г, 11,9 ммоль), в 60 мл дихлорметана. Реакционную смесь перемешивают в течение 30 минут при температуре от -10oС до -5oС. Триэтиламин (1,99 мл, 14,3 ммоль) добавляют по каплям в течение 10 минут и реакционную смесь перемешивают при 0oС в течение 1 часа. Реакционную смесь экстрагируют дихлорметаном. Органическую фазу промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия, концентрируют в вакууме и получают белый пенообразный продукт. Конечное соединение получают в виде белого пенообразного продукта (8,27 г) после хроматографии на силикагеле (элюирование смесью ацетон/гексан/гидроксид аммония, 50:50: 0,5.
Элементный анализ, рассчитано для C35H56N2O11: С 61,75, Н 8,29, N 4,11; найдено: С 62,25, Н 8,50, N 4,28.
Пример 178
Альтернативный способ получения соединения формулы IX: L является СО, Т = NH, R = -СН2СН=СН-(3-хинолил)
Стадия 178а. (Соединение формулы III: Rc - ацетил, L = СО, Т = NH, R = -СН2СН=СН-(3-хинолил))
Смесь соединения, полученного согласно примеру 177 (46,36 г, 68,2 ммоль), ацетата палладия (II) (3,055 г, 13,6 ммоль) и три-о-толилфосфина (8,268 г, 27,2 ммоль) в 400 мл ацетонитрила продувают азотом. К полученному раствору с помощью шприца добавляют 3-бромхинолин (18,45 мл, 136 ммоль) и триэтиламин (18,92 мл, 13,6 ммоль). Реакционную смесь нагревают при 50oС в течение 1 часа и перемешивают при 90oС в течение 4 дней. Реакционную смесь переносят в этилацетат и промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют в вакууме. После хроматографии на силикагеле (элюирование смесью ацетон/гексан/гидроксид аммония, 50:50:0,5) получают конечное соединение в виде белого пенообразного продукта (46,56 г).
МС m/e 808 (М+Н)+.
Стадия 178b. Соединение формулы IX: L является СО, Т = NH, R = -СН2СН= СН-(3-хинолил)
В соединении, полученном на стадии 178а (42,43 г), удаляют защитные группы при перемешивании в метаноле в течение ночи согласно способу, указанному в примере 1, стадия g, и получают конечное соединение (32,95 г).
МС m/e 766 (М+Н)+.
Пример 179
Соединение формулы IX: L является СО, Т = N(СН3), R = -СН2СН=СН2
Стадия 179а. Соединение 18, схема 4: R* - метил, R = -СН2СН=СН2, Rp - бензоил
Соединение, полученное согласно примеру 102, стадия 102b (соединение 12, схема 3a; R = -CH2CH=CH2, Rp - бензоил) (320 мг, 0,400 ммоль), растворяют в 10 мл ацетонитрила и раствор продувают азотом. Добавляют водный раствор метиламина (40%, 0,344 мл), и реакционную смесь перемешивают в токе азота в течение 4 дней. Реакционную смесь экстрагируют этилацетатом и промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над сульфатом натрия, отфильтровывают, концентрируют в вакууме и получают белый пенообразный продукт. После хроматографии на силикагеле (30% ацетон-гексан) получают конечный продукт (277 мг) в виде белого твердого осадка.
МС m/e 757 (М+Н)+.
Стадия 179b. Соединение формулы IX: L является СО, Т = N(CH3), R = СН2СН=СН2
В соединении, полученном на стадии 179а (110 мг), удаляют защитные группы при перемешивании в метаноле в течение ночи согласно способу, указанному в примере 1, стадия g, и получают конечное соединение (48 мг).
Элементный анализ, рассчитано для C34H56N2O10: С 62,56, Н 8,65, N 4,29; найдено: С 62,23, Н 8,72, N 4,13.
Пример 180
Соединение формулы IX: L является СО, Т = N(СН3), R = -СН2СН=СН-(3-хинолил)
Конечное соединение получают согласно способу, указанному в примере 178, за исключением использования соединения, полученного согласно примеру 179, стадия а, вместо исходного соединения, использованного в примере 177.
Пример 181
Соединение формулы IX: L = СО, Т = N(CH2CH2N(CH3)2), R = -СН2СН=СН2
Стадия 181а. Соединение 18, схема 4; R* = 2-(диметиламино)этил, R = -СН2СН=СН2, Rp - бензоил
Конечное соединение (285 мг) получают согласно способам, указанным в примере 179, за исключением использования N,N-диметилэтилендиамина вместо метиламина.
МС m/e 814 (M+H)+.
Стадия 181b. Соединение формулы IX: L = СО, Т = N(СН2СН2N(СН3)2), R = -СН2СН=СН2
В соединении, полученном на стадии 181а (110 мг), удаляют защитные группы при перемешивании в метаноле при нагревании в течение ночи согласно способу, указанному в примере 1, стадия g, и получают конечное соединение (28 мг).
Пример 182
Соединение формулы IX: L = СО, Т = N(CH2CH2N(CH3)2), R = -СН2СН=СН-(3-хинолил)
Конечное соединение (33,4 мг) получают согласно примеру 178 за исключением использования соединения, полученного согласно примеру 181, стадия а (162 мг), вместо исходного соединения, использованного в указанном примере (полученного согласно примеру 177).
Пример 183
Соединение формулы IX: L = СО, Т = N(CH2CH=CH2), R = -CH2CH=CH2
Стадия 183а. Соединение 18, схема 4; R* = -СН2СН=СН2, R = -СН2СН=СН2, Rp - бензоил
Конечное соединение получают согласно способам, указанным в примере 179, за исключением использования аллиламина вместо метиламина.
Стадия 183b. Соединение формулы IX: L = СО, Т = N(СН2СН=CH2), R = -CH2CH=CH2
В соединении, полученном на стадии 183а (78 мг), удаляют защитные группы при нагревании в метаноле в течение ночи согласно способу, указанному в примере 1, стадия g, и получают конечное соединение (33 мг).
Пример 184
Соединение формулы IX: L = СО, Т = N(СН2СН=СН-(3-хинолил)), R = СН2СН= СН-(3-хинолил)
Конечное соединение получают согласно примеру 178 за исключением использования соединения, полученного согласно примеру 183, стадия а, вместо исходного соединения, использованного в указанном примере (полученное согласно примеру 177).
МСВР: рассчитано для C54H69N4O10: 933,5014; найдено: 933,5052.
Примеры 185-219
Соединения 185-219 получают с использованием способов, указанных в примере 178, за исключением использования приведенных ниже реагентов вместо трибромхинолина, использованного в примере 178. Указанные соединения 185-219 приведены в табл.2. Эти соединения формулы IX, где L = СО и Т = О, имеют формулу и R-заместители, показанные в табл.2.
Пример 220
Соединение формулы IX: L = СО, Т = NH, R = -СН2C(O)H
Соединение, полученное согласно примеру 102 (14,0 г), растворяют в 200 мл CH2Cl2, и раствор охлаждают до -78oС в атмосфере азота. Через раствор пропускают озон до устойчивой синей окраски. Затем реакционную смесь продувают N2 до обесцвечивания и добавляют 14 мл диметилсульфида, реакционную смесь нагревают до 0oС. После перемешивания в течение 90 минут реакционную смесь концентрируют при пониженном давлении и получают светло-желтый пенообразный продукт. Полученный материал растворяют в 300 мл ТГФ и обрабатывают трифенилфосфином (8 г) при кипячении с обратным холодильником в течение 6 часов. Затем реакционную смесь концентрируют при пониженном давлении. С помощью хроматографии (элюирование смесью ацетон/гексан 1:1 и ацетон/гексан 3: 1, содержащей 0,5% триэтиламина) получают конечное соединение (6,6 г) в виде не совсем белого пенообразного продукта.
МС (химическая ионизация (ХИ)) m/e 641 (М+Н)+.
Пример 221
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН2NНСН2-фенил
Соединение, полученное согласно примеру 220 (120 мг, 0,187 ммоль), и бензиламин (40 мкл, 0,366 ммоль, 2 экв.) растворяют в 3 мл сухого дихлорметана. Добавляют молекулярные сита  , и смесь перемешивают в течение ночи. Реакционную смесь отфильтровывают и концентрируют при пониженном давлении. Образующийся имин растворяют в 5 мл МеОН, добавляют каталитическое количество 10% палладия на углероде и реакционную смесь интенсивно перемешивают при давлении водорода, равном 1 атм, в течение 20 часов. Затем смесь фильтруют через слой целлита и раствор концентрируют при пониженном давлении. С помощью хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NН4ОН) получают необходимое соединение (84 мг) в виде белого твердого осадка.
, и смесь перемешивают в течение ночи. Реакционную смесь отфильтровывают и концентрируют при пониженном давлении. Образующийся имин растворяют в 5 мл МеОН, добавляют каталитическое количество 10% палладия на углероде и реакционную смесь интенсивно перемешивают при давлении водорода, равном 1 атм, в течение 20 часов. Затем смесь фильтруют через слой целлита и раствор концентрируют при пониженном давлении. С помощью хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NН4ОН) получают необходимое соединение (84 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 218,3, 205,6, 170,3, 157,9, 140,2, 128,2, 126,8, 102,4, 83,5, 78,2, 76,9, 75,1, 70,1, 69,5, 65,9, 62,0, 58,4, 53,8, 50,6, 48,2, 45,3, 44,8, 40,1, 39,0, 37,4, 28,2, 22,4, 21,2, 20,6, 18,3, 14,6, 13,6, 13,5, 12,7, 10,3. МС (ХИ) m/e 732 (М+Н)+.
Пример 222
Соединение формулы IX: L = CO, Т = NH, R = -СН2СН2NНСН2СН2-фенил
Конечное соединение получают с использованием в качестве исходных соединений соединения, полученного согласно примеру 220 (108 мг, 0,169 ммоль), и фенилэтиламина (42 мкл, 0,334 ммоль, 2 экв.) согласно способу, указанному в примере 221. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,5% NH4OH) получают конечное соединение (82 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 218,1, 205,5, 170,3, 158,0, 140,2, 128,8, 128,2, 125,8, 102,4, 83,6, 78,3, 76,9, 75,1, 70,1, 69,5, 65,9, 61,9, 58,3, 51,5, 50,6, 48,8, 45,2, 44,9, 40,1, 38,9, 37,4, 36,5, 28,2, 22,4, 21,2, 20,6, 18,3, 14,6, 13,6, 13,4, 12,8, 10,3. МС (ХИ) m/e 746 (М+H)+. Элемен. анализ, рассч. для С40Н63N3О10, найдено С 64,26, Н 8,47, N 5,43.
Пример 223
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН2NHСН2СН2СН2-фенил
Конечное соединение получают с использованием в качестве исходных соединений соединения, полученного согласно примеру 220 (100 мг, 0,156 ммоль), и 3-фенил-1-пропиламина (40 мкл, 0,282 ммоль, 1,8 экв.) согласно способу, указанному в примере 221. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,5% NH4OH) получают конечное соединение (45 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 218,6, 205,7, 170,4, 158,1, 142,3, 128,4, 128,2, 125,6, 102,4, 83,7, 78,3, 77,0, 75,2, 70,2, 69,5, 65,9, 62,0, 58,4, 50,6, 49,2, 49,0, 45,3, 44,9, 40,2, 39,0, 37,5, 33,7, 31,7, 28,2, 22,4, 21,2, 20,7, 18,3, 14,6, 13,6, 13,5, 12,8, 10,3. МС (ХИ) m/e 760 (М+Н)+. Элемен. анализ, рассч. для C41H65N3O10.
Пример 224
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН2NНСН2СН2СН2СH2-фенил
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (170 мг, 0,266 ммоль), и 4-фенил-1-бутиламина (68 мкл, 0,431 ммоль, 1,6 экв.) согласно способу, указанному в примере 221. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NН4ОН) получают конечное соединение (87 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 218,6, 205,6, 170,4, 158,1, 142,6, 128,4, 128,1, 125,5, 102,4, 83,7, 78,3, 77,0, 75,2, 70,2, 69,5, 65,9, 61,9, 58,4, 50,6, 50,0, 49,0, 45,3, 44,9, 40,2, 39,0, 37,5, 35,8, 29,7, 29,1, 28,2, 22,4, 21,2, 20,7, 18,3, 14,6, 13,6, 13,5, 12,7, 10,3. МС (ХИ) m/e 774 (М+Н)+. Элемен. анализ, рассч. для C42H67N3O10, найдено С 64,80, Н 8,63, N 5,35.
Пример 225
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН2NНСН2СН2СН2-(3-хинолил)
Соединение, полученное согласно примеру 220 (135 мг, 0,211 ммоль), и 3-(3-хинолил)-1-пропиламин (70 мг, 0,376 ммоль, 1,8 экв.) растворяют в 4 мл сухого дихлорметана. Добавляют молекулярные сита  , и реакционную смесь перемешивают в течение ночи. Затем реакционную смесь отфильтровывают и концентрируют при пониженном давлении. Образующийся имин растворяют в 5 мл МеОН и обрабатывают NaCNBH3 (приблизительно 100 мг) при добавлении АсОН до изменения цвета индикатора бромкрезолового зеленого (с синего цвета на желтый). После перемешивания в течение 4 часов реакционную смесь переливают в насыщенный раствор NаНСО3 и экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором NaHCO3, Н2О и соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении. После хроматографии (SiO2, от 5% МеОН/дихлорметан, содержащий 0,5% NH4OH, до 10% МеОН/дихлорметан, содержащий 1% NH4OH) получают конечное соединение (71 мг) в виде белого твердого осадка.
, и реакционную смесь перемешивают в течение ночи. Затем реакционную смесь отфильтровывают и концентрируют при пониженном давлении. Образующийся имин растворяют в 5 мл МеОН и обрабатывают NaCNBH3 (приблизительно 100 мг) при добавлении АсОН до изменения цвета индикатора бромкрезолового зеленого (с синего цвета на желтый). После перемешивания в течение 4 часов реакционную смесь переливают в насыщенный раствор NаНСО3 и экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором NaHCO3, Н2О и соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении. После хроматографии (SiO2, от 5% МеОН/дихлорметан, содержащий 0,5% NH4OH, до 10% МеОН/дихлорметан, содержащий 1% NH4OH) получают конечное соединение (71 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 218,8, 205,7, 170,5, 158,2, 152,2, 146,8, 135,0, 134,2, 129,1, 128,4, 128,2, 127,4, 126,4, 102,5, 83,8, 78,4, 77,2, 75,2, 70,2, 69,6, 65,9, 62,0, 58,4, 50,7, 49,5, 49,1, 45,4, 44,9, 40,2, 39,1, 37,6, 31,4, 30,9, 28,3, 22,6, 21,3, 20,7, 18,3, 14,7, 13,6, 13,5, 12,8, 10,3. МС (ХИ) m/e 811 (М+Н)+. Элемен. анализ, рассч. для C44H66N4O10, найдено С 65,50, Н 8,51, N 6,66.
Пример 226
Соединение формулы IX: L = CO, Т = NH, R = -СН2СН2NНСН2(3-хинолил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (150 мг, 0,234 ммоль), и 3-(аминометил)хинолина (100 мг, 0,633 ммоль, 2,7 экв.) согласно способу, указанному в примере 225. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,5% NH4OH) получают конечное соединение (82 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 218,8, 205,5, 170,4, 158,1, 151,6, 147,3, 134,5, 133,0, 129,0, 128,7, 128,0, 127,6, 126,3, 102,4, 83,7, 78,3, 76,9, 75,1, 70,1, 69,4, 65,8, 61,8, 58,4, 51,3, 50,5, 48,5, 45,3, 44,8, 40,1, 39,0, 37,4, 28,2, 22,3, 21,2, 20,6, 18,2, 14,6, 13,6, 13,4, 12,7, 10,2. МС (ХИ) m/e 783 (М+Н)+. Элемен. анализ, рассч. для C42H62N4O10, найдено С 64,32, Н 8,01, N 7,11.
Реагент 3-(аминометил)хинолин получают, как указано ниже:
Стадия 226а. 3-(гидроксиметил)хинолин
3-карбоксальдегид хинолина (1,0 г, 6,37 ммоль) растворяют в 20 мл EtOH и обрабатывают NaBH4 (70 мг). После перемешивания в течение 1 часа раствор обрабатывают 2 мл 1 N HCl и после перемешивания в течение 10 минут в реакционную смесь добавляют 1 N NaOH до щелочного значения рН. Реакционную смесь экстрагируют Et2O и органический слой промывают водой и соляным раствором. Органическую фазу высушивают над Na2SO4 и после концентрирования при пониженном давлении получают конечное соединение.
МС (ХИ) m/e 160 (М+Н)+.
Стадия 226b. 3-(азидометил)хинолин
3-(гидроксиметил)хинолин (0,36 г, 2,26 ммоль) и трифенилфосфин (621 мг, 2,37 ммоль, 1,05 экв.) растворяют в 10 мл сухого ТГФ и раствор охлаждают до 0oС. Реакционную смесь обрабатывают дифенилфосфорилазидом (570 мкл, 2,63 ммоль, 1,16 экв.) с последующим прикапыванием диэтилазодикарбоксилата (405 мкл, 2,57 ммоль, 1,14 экв.). Реакционную смесь нагревают до комнатной температуры в течение ночи. Реакционную смесь концентрируют при пониженном давлении. После хроматографии (SiO2, гексан/ЕtOАс, 2:1) получают необходимое соединение (350 мг) в виде бесцветного маслообразного продукта.
МС (ХИ) m/e 185 (М+Н)+.
Стадия 226с. 3-(аминометил)хинолин
3-(азидометил)хинолин (250 мг, 1,36 ммоль) и трифенилфосфин (880 мг, 3,36 ммоль, 2,5 экв.) растворяют в 10 мл ТГФ. Реакционную смесь обрабатывают 0,5 мл воды и кипятят с обратным холодильником в течение 6 часов. Реакционную смесь охлаждают и распределяют между Et2O и 1 N HCl. Водную фазу обрабатывают 1 N HCl до щелочного значения рН и экстрагируют этилацетатом. Органическую фазу высушивают над Na2SO4 и концентрируют при пониженном давлении, получают конечное соединение (104 мг) в виде коричневого маслообразного продукта.
МС (ХИ) m/e 159 (М+Н)+.
Пример 227
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН2NНСH2(6-хинолил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (116 мг, 0,181 ммоль), и 3-(аминометил)хинолина (40 мг, 0,25 ммоль, 1,4 экв.) согласно способу, указанному в примере 221. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,5% NH4OH) получают конечное соединение (62 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 218,7, 205,6, 170,4, 158,1, 149,8, 147,8, 138,9, 136,0, 130,3, 129,4, 128,3, 126,2, 121,0, 102,5, 83,7, 78,4, 77,0, 75,2, 70,2, 69,5, 65,9, 62,1, 58,5, 53,7, 50,6, 48,6, 45,4, 44,9, 40,2, 39,1, 37,5, 28,3, 22,4, 21,3, 20,7, 18,3, 14,7, 13,7, 13,5, 12,8, 10,3. МС (ХИ) m/e 783 (М+Н)+. Элемен. анализ, рассч. для C42H62N4O10.
Реагент 6-(аминометил)хинолин получают, как указано ниже:
Стадия 227а. 6-(гидроксиметил)хинолин
Хинолин 6-карбоновую кислоту (1,73 г, 10,0 ммоль) суспендируют в 40 мл ТГФ в токе азота при 0oС и обрабатывают N-этилморфолином (1,3 мл, 10,2 ммоль, 1,02 экв. ) с последующим прикапыванием этилхлорформиата (1,1 мл, 11,5 ммоль, 1,15 экв.). После перемешивания в течение 15 минут раствор отфильтровывают, и образующиеся соли промывают дополнительным количеством ТГФ. Фильтрат добавляют к интенсивно перемешиваемому раствору NaBH4 (760 мг, 20 ммоль) в 50 мл воды. После перемешивания в течение 20 минут реакционную смесь гасят насыщенным раствором NH4Cl и экстрагируют ЕtOАс (2•50 мл). Органическую фазу промывают соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении. После хроматографии (SiO2, гексан/ЕtOАс 1:3) получают необходимое соединение (1,03 г) в виде бесцветного маслообразного продукта.
МС (ХИ) m/e 160 (М+Н)+.
Стадия 227b 6-(азидометил)хинолин
6-(гидроксиметил)хинолин (0,51 г, 3,21 ммоль) и трифенилфосфин (880 мг, 3,36 ммоль, 1,05 экв.) растворяют в 15 мл сухого ТГФ и раствор охлаждают до 0oС. Реакционную смесь обрабатывают дифенилфосфорилазидом (0,81 мл, 3,74 ммоль, 1,16 экв.) с последующим прикапыванием диэтилазодикарбоксилата (0,57 мл, 3,62 ммоль, 1,13 экв.). Реакционную смесь нагревают до комнатной температуры в течение ночи. Реакционную смесь концентрируют при пониженном давлении. После хроматографии (SiO2, 30% ЕtOАс/гексан) получают необходимое соединение (320 мг) в виде бесцветного маслообразного продукта.
МС (ХИ) m/e 185 (М+Н)+.
Стадия 227с. 6-(аминометил)хинолин
6-(азидометил)хинолин (320 мг) и трифенилфосфин (880 мг) растворяют в 7 мл ТГФ. Реакционную смесь обрабатывают 0,5 мл воды и кипятят с обратным холодильником в течение 7 часов. Реакционную смесь охлаждают и распределяют между Et2O и 1 N HCl. Водную фазу обрабатывают 1 N NaOH до щелочного значения рН и экстрагируют EtOAc. Органическую фазу высушивают над Nа2SО4 и концентрируют при пониженном давлении, получают конечное соединение (70 мг) в виде коричневого маслообразного продукта.
МС (ХИ) m/e 159 (М+Н)+.
Пример 228
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NО(фенил)
Соединение, полученное согласно примеру 220 (200 мг, 0,313 ммоль), и O-фенилгидроксиламин-HCl (138 мг, 0,948 ммоль, 3,0 экв.) растворяют в 4 мл МеОН. Затем добавляют триэтиламин (118 мкл, 0,847 ммоль, 2,7 экв.) и реакционную смесь нагревают с обратным холодильником в течение 3 часов. Реакционную смесь охлаждают и гасят насыщенным раствором NaHCO3. Реакционную смесь экстрагируют дихлорметаном (2•25 мл) и объединенную органическую фазу промывают водой и соляным раствором. Органическую фазу высушивают над Na2SO4, концентрируют при пониженном давлении. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NH4OH) получают необходимое соединение (150 мг, смесь изомеров оксимов 3:2) в виде твердого продукта фиолетового цвета.
13С ЯМР (СDСl3) δ 218,1, 217,4, 205,0, 169,9, 169,8, 159,1, 159,1 157,9, 157,6, 152,9, 150,8, 129,1, 129,0, 122,2, 122,1, 114,8, 114,6, 103,2, 103,1, 83,5, 83,4, 79,8, 79,6, 77,1, 77,0, 76,9, 70,2, 69,6, 65,8, 60,3, 58,1, 58,0, 58,0, 50,9, 50,9, 46,6, 46,6, 44,8, 44,7, 40,1, 38,7, 38,5, 37,4, 37,4, 28,2, 22,2, 22,1, 21,1, 21,1, 20,5, 20,1, 18,0, 17,9, 14,6, 14,5, 14,5, 14,4, 13,5, 13,5, 10,4, 10,2. МС (ХИ) m/e 732 (М+Н)+. Элемен. анализ, рассч. для С38H57N3O11. Найдено С 62,30, Н 7,76, N 5,74.
Пример 229
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NОСН2(фенил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (201 мг, 0,314 ммоль), и О-бензилгидроксиламина-HCl (150 мг, 0,940 ммоль, 3,0 экв.) согласно способу, указанному в примере 228. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NH4OH) получают конечное соединение (170 мг, смесь изомеров оксима 2:1) в виде белого твердого осадка.
13С ЯМР (СDСl3) δ 218,1, 217,2, 205,1, 170,0, 169,8, 158,0, 157,9, 150,5, 147,8, 138,1, 137,8, 128,4, 128,0, 127,8, 103,3, 103,3, 83,7, 83,7, 79,6, 79,5, 77,5, 77,3, 77,0, 76,9, 76,1, 76,0, 70,4, 69,7, 66,0, 60,5, 58,2, 58,1, 58,0, 51,0, 51,0, 46,8, 46,5, 45,0, 44,9, 40,3, 38,9, 38,7, 37,6, 28,4, 22,5, 22,4, 21,3, 20,6, 20,2, 18,2, 18,1, 14,8, 14,7, 14,6, 14,4, 13,7, 13,7, 10,6, 10,5. МС (ХИ) m/e 746 (М+Н)+. Элемен. анализ, рассч. для C39H59N3O11. Найдено С 62,89, Н 8,04, N 5,42.
Пример 230
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NOCH2(4-NO2-фенил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (200 мг, 0,313 ммоль), и O-(4-нитробензил)гидроксиламина-НСl (192 мг, 0,938 ммоль, 3,0 экв.) согласно способу, указанному в примере 228. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NН4ОН) получают конечное соединение (184 мг, смесь изомеров оксима 2:1) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 218,2, 217,3, 205,0, 169,9, 169,7, 157,8, 151,2, 148,7, 147,4, 145,7, 145,5, 128,4, 128,1, 123,6, 123,5, 103,2, 83,6, 83,5, 79,6, 79,4, 77,1, 76,9, 76,8, 74,5, 74,3, 70,2, 69,6, 65,8, 60,2, 58,0, 57,9, 57,8, 51,0, 50,9, 46,8, 46,6, 44,9, 44,7, 40,2, 38,7, 38,5, 37,5, 37,4, 28,2, 22,4, 22,2, 21,2, 21,2, 20,5, 20,1, 18,1, 17,9, 14,8, 14,5, 14,4, 13,5, 10,5, 10,3. МС (ХИ) m/e 791 (М+Н)+.
Пример 231
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NОСН2(4-хинолил)
Соединение, полученное согласно примеру 220 (200 мг, 0,313 ммоль), и O-(4-хинолил)метилгидроксиламин (200 мг, 0,86 ммоль, 2,7 экв.) растворяют в 4 мл МеОН. Затем добавляют каталитическое количество pTSA.H2O (п-толуолсульфокислоты гидрат) и реакционную смесь кипятят с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают и гасят насыщенным раствором NаНСО3. Реакционную смесь экстрагируют дихлорметаном (2•25 мл), и объединенную органическую фазу промывают водой и соляным раствором. Органическую фазу высушивают над Na2SO4, концентрируют при пониженном давлении. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NН4ОН) получают необходимое соединение (226 мг, смесь изомеров оксимов 2:1) в виде твердого продукта белого цвета.
13С ЯМР (CDCl3) δ 218,1 217,3, 205,0, 205,0, 170,0, 169,8, 158,0, 157,9, 151,3, 150,3, 148,7, 148,0, 143,2, 143,2, 130,1, 130,0, 129,1, 129,1, 126,7, 126,2, 126,2, 123,4, 123,3, 119,9, 119,6, 103,2, 83,7, 83,6, 79,7, 79,5, 77,4, 77,2, 77,1, 77,0, 76,9, 72,6, 72,3, 70,3, 69,6, 65,8, 60,3, 58,1, 58,0, 57,9, 51,0, 50,9, 46,8, 46,6, 44,9, 44,8, 40,2, 38,8, 38,5, 37,5, 37,5, 28,2, 22,4, 22,2, 21,2, 21,2, 20,5, 20,2, 18,1, 18,0, 14,9, 14,6, 14,5, 13,6, 13,6, 10,6, 10,3. МС (ХИ) m/e 797 (М+Н)+. Элемен. анализ, рассч. для С42H60N4O11. Найдено С 63,46, Н 7,80, N 6,87.
Реагент O-(4-хинолил)метилгидроксиламин получают, как указано ниже:
Стадия 231а. N-(4-хинолил)метоксифталимид
4-(гидроксиметил)хинолин (1,20 г, 7,55 ммоль), трифенилфосфин (2,27 г, 8,66 ммоль, 1,15 экв.) и N-гидроксифталимид (1,42 г, 8,71 ммоль, 1,15 экв.) растворяют в 40 мл сухого ТГФ. Затем прикапывают диэтилазодикарбоксилат (1,44 мл, 9,15 ммоль, 1,21 экв.) и реакционную смесь перемешивают в течение ночи. Реакционную смесь разбавляют 50 мл Et2O и отфильтровывают. Образующийся твердый остаток растворяют в дихлорметане и промывают 1 N NaOH, H2O и соляным раствором. Органическую фазу сушат над Na2SO4, концентрируют при пониженном давлении и получают конечное соединение (2,03 г) в виде пушистого белого осадка.
МС (ХИ) m/e 305 (М+Н)+.
Стадия 231b. O-(4-хинолил)метилгидроксиламин
N-(4-хинолил)метоксифталимид (2,00 г) суспендируют в 95% EtOH и добавляют гидразин (0,30 мл). Реакционную смесь перемешивают в течение 3 часов и отфильтровывают. Фильтрат концентрируют при пониженном давлении и переносят в небольшое количество дихлорметана. Остаточное количество фталгидразида удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и получают конечное соединение (1,44 г) в виде желтого маслообразного продукта.
МС (ХИ) m/e 175 (М+Н)+.
Пример 232
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NOCH2(2-хинолил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (206 мг, 0,322 ммоль), и O-(2-хинолил)метилгидроксиламина (120 мг, 0,681 ммоль, 2,1 экв.) согласно способу, указанному в примере 231. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NH4OH) получают конечное соединение (185 мг, смесь изомеров оксима 3:1) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 217,9, 217,2, 204,9, 204,9, 169,9, 169,8, 159,0, 158,9, 157,8, 151,0, 148,7, 147,6, 136,5, 129,3, 129,2, 129,0, 127,5, 126,1, 126,0, 119,8, 119,6, 103,1, 83,5, 79,6, 79,4, 77,3, 77,0, 76,9, 76,9, 76,8, 76,7, 70,2, 69,5, 65,8, 60,4, 58,0, 58,0, 50,9, 46,5, 46,4, 44,8, 44,7, 40,1, 38,7, 38,5, 37,4, 37,4, 28,2, 22,3, 22,2, 21,2, 21,1, 20,5, 20,1, 18,1, 18,0, 14,5, 14,4, 14,3, 13,5, 10,4, 10,3. МС (ХИ) m/e 797 (М+Н)+.
Реагент O-(2-хинолил)метилгидроксиламин получают, как указано ниже:
Стадия 232а. N-(2-хинолил)метоксифталимид
2-(гидроксиметил)хинолин (1,20 г, 7,55 ммоль), трифенилфосфин (1,00 г, 6,29 ммоль, 1,05 экв.) и N-гидроксифталимид (1,08 г, 6,63 ммоль, 1,05 экв.) растворяют в 25 мл сухого ТГФ. Затем прикапывают диэтилазодикарбоксилат (1,09 мл, 6,93 ммоль, 1,10 экв.) и реакционную смесь перемешивают в течение ночи. Реакционную смесь отфильтровывают и получают белый осадок. Фильтрат концентрируют и вторую порцию материала извлекают путем растирания с Et2O. Полученный продукт объединяют с первым осадком и перекристаллизовывают из ЕtOН, получают необходимое соединение (1,53 г) в виде пушистого белого осадка.
МС (ХИ) m/e 305 (М+Н)+.
Стадия 232b. O-(2-хинолил)метилгидроксиламин
N-(2-хинолил)метоксифталимид (1,53 г) суспендируют в 95% ЕtOН и добавляют гидразин (0,30 мл). Реакционную смесь перемешивают в течение 5 часов и отфильтровывают. Фильтрат концентрируют при пониженном давлении и переносят в небольшое количество дихлорметана. Остаточное количество фталгидразида удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и получают конечное соединение (0,91 г) в виде желтого маслообразного продукта.
МС (ХИ) m/e 175 (М+Н)+.
Пример 233
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NОСН2(3-хинолил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (250 мг, 0,391 ммоль), и O-(3-хинолил)метилгидроксиламина (160 мг, 0,909 ммоль, 2,3 экв.) согласно способу, указанному в примере 231. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NН4ОН) получают конечное соединение (202 мг, смесь изомеров оксима 2:1) в виде белого твердого осадка.
13С ЯМР (СDСl3) δ 217,9, 217,1, 205,0, 169,9, 169,7, 157,9, 157,8, 151,0, 150,9, 150,8, 148,4, 147,8, 135,4, 135,2, 130,6, 130,5, 129,3, 129,2, 128,0, 127,9, 127,9, 126,6, 126,5, 103,2, 83,6, 83,5, 79,5, 79,4, 77,2, 76,9, 76,7, 73,7, 73,4, 70,3, 69,6, 65,9, 60,3, 58,1, 57,9, 51,0, 50,9, 46,7, 46,4, 44,9, 44,7, 40,2, 38,8, 38,6, 37,5, 28,2, 22,4, 22,2, 21,2, 20,4, 20,1, 18,1, 18,0, 14,7, 14,6, 14,4, 14,3, 13,6, 13,5, 10,5, 10,3. МС (ХИ) m/e 797 (М+Н)+. Элемен. анализ, рассч. для С42Н60N4О11. Найдено С 63,00, Н 7,56, N 6,79.
Реагент O-(3-хинолил)метилгидроксиламин получают, как указано ниже:
Стадия 233а. N-(3-хинолил)метоксифталимид
3-(гидроксиметил)хинолин (400 мг, 2,52 ммоль), трифенилфосфин 692 мг, 2,64 ммоль, 1,05 экв.) и N-гидроксифталимид (430 мг, 2,64 ммоль, 1,05 экв.) растворяют в 10 мл сухого ТГФ. Затем прикапывают диэтилазодикарбоксилат (0,44 мл, 2,80 ммоль, 1,11 экв.) и реакционную смесь перемешивают в течение ночи. Реакционную смесь помещают в морозильник на 2 часа и необходимое соединение (0,69 г) в виде пушистого белого осадка получают после фильтрования.
МС (ХИ) m/e 305 (М+Н)+.
Стадия 233b. O-(3-хинолил)метилгидроксиламин
N-(3-хинолил)метоксифталимид (0,69 г) суспендируют в 95% ЕtOН и добавляют гидразин (0,10 мл). Реакционную смесь перемешивают в течение ночи и отфильтровывают. Фильтрат концентрируют при пониженном давлении и переносят в небольшое количество дихлорметана. Остаточное количество фталгидразида удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и получают конечное соединение (0,42 г) в виде желтого маслообразного продукта.
МС (ХИ) m/e 175 (М+Н)+.
Пример 234
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NOCH2(6-хинолил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (120 мг, 0,186 ммоль), и O-(6-хинолил)метилгидроксиламина (92 мг, 0,529 ммоль, 2,8 экв.) согласно способу, указанному в примере 231. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NH4OH) получают конечное соединение (89 мг, смесь изомеров оксима 3:1) в виде белого твердого осадка.
13С ЯМР (СDСl3) δ 217,9, 217,1, 204,9, 169,8, 169,6, 157,8, 157,8, 157,7, 150,6, 150,1, 148,0, 147,8, 136,1, 136,1, 129,6, 129,4, 129,3, 128,0, 126,6, 126,3, 121,0, 103,0, 83,5, 83,4, 79,4, 79,3, 77,4, 77,0, 76,8, 76,7, 76,6, 75,5, 75,3, 70,1, 69,5, 65,7, 60,2, 58,0, 57,9, 57,8, 50,8, 46,6, 46,3, 44,8, 44,6, 40,1, 38,6, 38,4, 37,3, 28,1, 22,3, 22,1, 21,1, 20,4, 20,0, 18,0, 17,8, 14,7, 14,5, 14,3, 13,4, 10,4, 10,3. МС (ХИ) m/e 797 (М+Н)+. Элемен. анализ, рассч. для С42H60N4O11. Найдено С 63,03, Н 7,60, N 6,69.
Реагент O-(6-хинолил)метилгидроксиламин получают, как указано ниже:
Стадия 234а. N-(6-хинолил)метоксифталимид
6-(гидроксиметил)хинолин (520 мг, 3,27 ммоль), трифенилфосфин (900 мг, 3,44 ммоль, 1,05 экв.) и N-гидроксифталимид (560 мг, 3,43 ммоль, 1,05 экв.) растворяют в 25 мл сухого ТГФ. Затем прикапывают диэтилазодикарбоксилат (574 мкл, 3,63 ммоль, 1,11 экв.) и реакционную смесь перемешивают в течение ночи. Реакционную смесь отфильтровывают и получают белый осадок. Фильтрат концентрируют и вторую порцию материала извлекают путем растирания с Et2O. Полученный продукт объединяют с первым осадком и перекристаллизовывают из ЕtOН, получают необходимое соединение (782 мг) в виде пушистого белого осадка.
МС (ХИ) m/e 305 (М+Н)+.
Стадия 234b. O-(2-хинолил)метилгидроксиламин
N-(2-хинолил)метоксифталимид (782 мг) суспендируют в 95% ЕtOН и добавляют гидразин (0,15 мл). Реакционную смесь перемешивают в течение ночи и отфильтровывают. Фильтрат концентрируют при пониженном давлении и переносят в небольшое количество дихлорметана. Остаточное количество фталгидразида удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и получают конечное соединение (480 мг) в виде желтого маслообразного продукта.
МС (ХИ) m/e 175 (М+Н)+.
Пример 235
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NOCH2(1-нафтил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (117 мг, 0,183 ммоль), и O-(1-нафтил)метилгидроксиламина (80 мг, 0,462 ммоль, 2,5 экв.) согласно способу, указанному в примере 231. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,1% NH4OH) получают конечное соединение (112 мг, смесь изомеров оксима 2:1) в виде белого твердого осадка.
13С ЯМР (СDСl3) δ 217,8, 217,0, 205,0, 169,9, 169,7, 157,9, 157,8, 150,3, 147,7, 133,7, 133,1, 131,8, 128,7, 128,6, 128,4, 127,1, 126,8, 126,2, 125,6, 125,3, 124,1, 103,1, 103,1, 83,6, 79,5, 79,3, 77,2, 77,0, 76,9, 74,7, 74,3, 70,3, 69,6, 65,9, 60,5, 58,1, 58,0, 51,0, 50,9, 46,6, 46,3, 44,9, 44,8, 40,2, 38,8, 38,6, 37,5, 28,3, 22,4, 22,3, 21,2, 20,5, 20,0, 14,6, 14,5, 14,1, 13,6, 10,5, 10,3. МС (ХИ) m/e 796 (М+Н)+.
Элемен. анализ, рассч. для С43Н61N3О11. Найдено С 64,91, Н 7,80, N 5,06.
Реагент O-(1-нафтил)метилгидроксиламин получают, как указано ниже:
Стадия 235а. N-(1-нафтил)метоксифталимид
1-(гидроксиметил)нафталин (1,00 г, 6,33 ммоль), трифенилфосфин (1,73 г, 6,60 ммоль, 1,04 экв.) и N-гидроксифталимид (1,08 г, 6,63 ммоль, 1,05 экв.) растворяют в 25 мл сухого ТГФ. Затем прикапывают диэтилазодикарбоксилат (1,09 мл, 6,93 ммоль, 1,09 экв.) и реакционную смесь перемешивают в течение ночи. Реакционную смесь разбавляют 25 мл Et2O и помещают в морозильник на 2 часа. Реакционную смесь отфильтровывают и получают белый осадок. С помощью перекристаллизации из EtOH получают необходимое соединение (1,21 г) в виде белого осадка.
МС (ХИ) m/e 321 (М+Н)+.
Стадия 235b. O-(1-нафтил)метилгидроксиламин
N-(1-нафтил)метоксифталимид (1,21 г) суспендируют в 95% ЕtOН и добавляют гидразин (0,20 мл). Реакционную смесь перемешивают в течение ночи и отфильтровывают. Фильтрат концентрируют при пониженном давлении и переносят в небольшое количество дихлорметана. Остаточное количество фталгидразида удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и получают конечное соединение (480 мг) в виде бесцветного маслообразного продукта.
МС (ХИ) m/e 174 (M+H)+.
Пример 236
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=NOCH2(2-нафтил)
Конечное соединение получают с использованием в качестве исходных продуктов соединения, полученного согласно примеру 220 (122 мг, 0,191 ммоль), и O-(2-нафтил)метилгидроксиламина (62 мг, 0,358 ммоль, 1,9 экв.) согласно способу, указанному в примере 231. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,1% NН4ОН) получают конечное соединение (100 мг, смесь изомеров оксима 3:1) в виде белого твердого осадка.
13С ЯМР (СDСl3) δ 217,8, 217,0, 204,9, 169,8, 169,6, 157,8, 157,7, 150,3, 147,8, 135,4, 135,1, 133,2, 132,9, 128,0, 127,9, 127,9, 127,5, 127,0, 126,7, 126,1, 125,8, 125,7, 125,7, 125,6, 103,1, 83,5, 83,5, 79,4, 79,3, 77,1, 76,9, 76,8, 76,1, 75,9, 70,2, 69,5, 65,8, 60,3, 58,0, 57,9, 57,9, 50,9, 46,6, 46,3, 44,8, 44,7, 40,1, 38,7, 38,5, 37,4, 28,1, 22,3, 22,1, 21,1, 20,4, 20,0, 18,0, 17,9, 14,6, 14,5, 14,4, 14,2, 13,5, 10,4, 10,2. МС (ХИ) m/e 796 (М+Н)+.
Элемен. анализ, рассч. для С43Н61N3О11. Найдено С 64,59, Н 7,72, N 5,14.
Реагент O-(2-нафтил)метилгидроксиламин получают, как указано ниже:
Стадия 236а. N-(2-нафтил)метоксифталимид
2-(гидроксиметил)нафталин (1,00 г, 6,33 ммоль), трифенилфосфин (1,73 г, 6,60 ммоль, 1,04 экв.) и N-гидроксифталимид (1,08 г, 6,63 ммоль, 1,05 экв.) растворяют в 25 мл сухого ТГФ. Затем прикапывают диэтилазодикарбоксилат (1,09 мл, 6,93 ммоль, 1,09 экв.) и реакционную смесь перемешивают в течение ночи. Реакционную смесь помещают в морозильник на 2 часа. Реакционную смесь отфильтровывают, промывают Et2O и получают необходимое соединение (1,38 г) в виде белого осадка.
МС (ХИ) m/e 321 (М+Н)+.
Стадия 236b. O-(2-нафтил)метилгидроксиламин
N-(2-нафтил)метоксифталимид (1,38 г) суспендируют в 95% ЕtOН и добавляют гидразин (0,25 мл). Реакционную смесь перемешивают в течение ночи и отфильтровывают. Фильтрат концентрируют при пониженном давлении и переносят в небольшое количество дихлорметана. Остаточное количество фталгидразида удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и получают конечное соединение (821 мг) в виде бесцветного маслообразного продукта.
МС (ХИ) m/e 174 (М+Н)+.
Пример 237
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН2NHОСН2(фенил)
Соединение, полученное согласно примеру 229 (120 мг, 0,161 ммоль), растворяют в 5 мл МеОН и обрабатывают NaCNBH3 (приблизительно 120 мг) и достаточным количеством АсОН до изменения окрашивания индикатора бромкрезолового зеленого (с синего цвета на желтый). После перемешивания в течение 20 часов реакционную смесь выливают в насыщенный раствор NаНСО3 и экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором NaHCО3, Н2О и соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NH4OH) получают конечное соединение (51 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 219,0, 205,7, 170,5, 157,8, 138,3, 128,1, 127,5, 102,5, 83,6, 78,6, 77,0, 75,6, 75,2, 70,2, 69,5, 66,0, 58,8, 58,3, 51,4, 50,7, 45,3, 45,0, 40,2, 39,1, 37,7, 28,3, 22,4, 21,3, 20,7, 18,2, 14,7, 13,7, 13,5, 12,8, 10,3. МС (ХИ) m/e 748 (М+Н)+.
Пример 238
Соединение формулы IX: L = CO, Т = NH, R = -СН2СН2NHОСH2(4-NO2-фенил)
Соединение, полученное согласно примеру 230 (64 мг), растворяют в 3 мл МеОН и обрабатывают NaCNBH3 (приблизительно 100 мг) и достаточным количеством HCl до изменения окрашивания индикатора метилового оранжевого (до красного цвета). После перемешивания в течение 20 часов реакционную смесь выливают в насыщенный раствор NаНСО3 и экстрагируют дихлорметаном. Органическую фазу промывают Н2О и соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NH4OH) получают конечное соединение (35 мг) в виде белого твердого осадка.
13С ЯМР (СDСl3) δ 219,5, 205,5, 170,5, 157,8, 147,2, 146,8, 128,3, 123,4, 102,4, 83,6, 78,6, 76,8, 75,0, 74,3, 70,1, 69,5, 65,8, 58,4, 58,1, 51,3, 50,6, 45,3, 45,0, 40,1, 38,9, 37,7, 28,2, 22,2, 21,2, 20,7, 18,1, 14,6, 13,5, 13,3, 12,8, 10,2. МС (ХИ) m/e 793 (М+Н)+.
Пример 239
Соединение формулы IX: L = СО, Т = NH, R = -СН2С(O)-фенил
Стадия 239а. Соединение формулы IX: L = СО, Т = NH, R = -CH2C(OH)-фенил
Соединение, полученное согласно примеру 220 (550 мг, 0,87 ммоль), растворяют в 16 мл сухого ТГФ и охлаждают до 0oС в токе азота. Добавляют по каплям с помощью шприца фенилмагний бромид (3,0 М раствор в Et2O, 3,0 мл, 6,0 ммоль, 6,9 экв.). Реакционную смесь перемешивают в течение 50 мин, затем гасят добавлением насыщенного раствора NH4Cl. Реакционную смесь экстрагируют EtOAc и органическую фазу промывают водой и соляным раствором, высушивают над Na2SO4, концентрируют при пониженном давлении.
После хроматографии (SiO2, 5% МеОН/ дихлорметан, содержащий 0,2% NН4ОН) получают конечное соединение (295 мг) в виде белого твердого осадка.
МС (ХИ) m/e 719 (М+Н)+.
Стадия 239b. Соединение формулы 18, схема 4: R* - Н, Rp - Ac, R = -CH2C(OH)-фенил
Соединение, полученное на предыдущей стадии (180 мг, 0,250 ммоль), растворяют в 5 мл сухого дихлорметана и обрабатывают уксусным ангидридом (25 мкл, 0,269 ммоль, 1,08 экв.). После перемешивания в течение ночи реакционную смесь гасят добавлением насыщенного раствора NaHCO3. Реакционную смесь экстрагируют дихлорметаном и органическую фазу промывают соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении, получают необходимое соединение (160 мг) в виде белого осадка.
МС (ХИ) m/e 761 (M+H)+.
Стадия 239с. Соединение формулы 18, схема 4: R* - Н, Rp - Ac, R = -СН2C(O)-фенил
ДМСО (145 мкл, 2,04 ммоль, 14 экв.) добавляют к охлажденному (-78oС) раствору оксалилхлорида (145 мкл, 1,32 ммоль, 9 экв.) в 4 мл дихлорметана в атмосфере азота. Соединение, полученное на предыдущей стадии (113 мг, 0,149 ммоль), растворяют в 2 мл дихлорметана и добавляют в реакционную смесь в течение 15 мин с помощью пипетки. После перемешивания в течение 1 часа в реакционную смесь добавляют Et3N (0,37 мл, 2,65 ммоль, 18 экв.) и температуру медленно повышают до -20oС. Реакционную смесь гасят 5% раствором КН2РО4 и экстрагируют дихлорметаном. Органическую фазу промывают 5% KH2PO4, Н2О и соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении. После хроматографии (SiO2, ацетон/гексан, 1:1) получают конечное соединение (42 мг) в виде белого порошкообразного продукта.
МС (ХИ) m/e 759 (М+Н)+.
Стадия 239d. Соединение формулы IX: L = СО, Т = NH, R = -СН2С(O)-фенил
Соединение, полученное на предыдущей стадии, растворяют в 5 мл МеОН и перемешивают в течение ночи. Реакционную смесь концентрируют при пониженном давлении и получают конечное соединение (38 мг) в виде белого осадка.
13С ЯМР (CDCl3) δ 215,4, 206,1, 194,4, 169,6, 157,7, 135,5, 133,0, 128,5, 127,6, 103,0, 83,8, 79,6, 77,1, 77,1, 70,2, 69,5, 65,9, 65,4, 57,6, 50,9, 46,0, 44,6, 40,2, 38,9, 37,9, 28,4, 22,4, 21,3, 20,2, 18,9, 14,9, 13,9, 13,7, 13,6, 10,5. МС (ХИ) m/e 717 (М+Н)+.
Пример 240
Соединение формулы IX: L = СО, Т = NH, R = -СН2C(O)-(4-F-фенил)
Конечное соединение получают с использованием соединения, полученного согласно примеру 220, 4-фторфенилмагний бромида и последовательности реакций, указанной в примере 239.
13С ЯМР (CDCl3) δ 215,3, 206,0, 192,8, 169,6, 165,7, 157,7, 131,5, 130,2, 115,6, 103,1, 83,8, 79,7, 77,3, 76,8, 70,3, 69,6, 65,8, 65,1, 57,6, 50,9, 46,0, 44,6, 40,2, 38,8, 37,8, 28,3, 22,4, 21,3, 20,2, 18,8, 14,8, 13,9, 13,7, 13,5, 10,4. МС (ХИ) m/e 735 (М+Н)+.
Пример 241
Соединение формулы IX: L = СО, Т = NH, R = -CH2CH=NNHC(O)фенил
Соединение, полученное согласно примеру 220 (100 мг, 0,156 ммоль), и бензгидразид (50 мг, 0,370 ммоль, 2,4 экв.) растворяют в 3 мл сухого дихлорметана, добавляют молекулярные сита 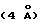 , и реакционную смесь перемешивают в течение ночи. Смесь отфильтровывают и фильтрат концентрируют при пониженном давлении.
, и реакционную смесь перемешивают в течение ночи. Смесь отфильтровывают и фильтрат концентрируют при пониженном давлении.
После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,2% NH4ОН) получают необходимое соединение (29 мг) в виде белого твердого осадка.
13С ЯМР (CDCl3) δ 216,9, 204,2, 169,6, 164,3, 159,0, 148,8, 133,4, 131,2, 128,0, 127,7, 103,2, 83,9, 79,6, 77,6, 76,5, 70,1, 69,5, 65,7, 62,7, 57,8, 50,8, 46,9, 44,4, 40,0, 38,4, 37,3, 28,1, 21,9, 21,1, 20,7, 17,8, 15,0, 14,2, 13,3, 13,1, 10,0. МС (ХИ) m/e 759 (М+Н)+.
Пример 242
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН2CH2(3-хинолил)
Смесь соединения, полученного согласно примеру 104 (230 мг), и 10% Pd/C (50 мг) в 30 мл метанола и 15 мл этилацетата продувают азотом и перемешивают в атмосфере водорода при 1 атм при комнатной температуре в течение 22 часов. Смесь отфильтровывают и фильтрат концентрируют при пониженном давлении. После хроматографии (SiO2, 5% МеОН/дихлорметан, содержащий 0,5% NH4ОН) получают необходимое соединение (175 мг) в виде белого твердого осадка.
Элемен. анализ, рассч. для C42H65N3O10: С 65,35; Н 8,49; N 5,44. Найдено С 65,73, Н 8,77, N 5,17.
Пример 243
Соединение формулы IX: L = СО, Т = NH, R = -СН2(2-(3-хинолил)циклопропил)
Раствор соединения, полученного согласно примеру 104 (153 мг, 0,200 ммоль), в 5 мл дихлорметана добавляют в токе азота при 0oС к раствору диазометана (0,64 М, 3,12 мл, 2,00 ммоль) в эфире. Затем добавляют небольшое количество ацетата палладия (2 мг) и смесь перемешивают в течение 20 минут. Добавляют еще одну порцию диазометана (3 мл) и смесь перемешивают еще один час. Растворители удаляют и осадок очищают с помощью хроматографии на силикагеле (5% МеОН/дихлорметан, содержащий 0,5% NН4ОН), получают необходимое соединение (100 мг) в виде белого твердого осадка.
Элемен. анализ, рассч. для С43Н61N3О10: С 66,22; Н 7,88; N 5,39. Найдено С 66,05, Н 8,08, N 5,02.
Пример 244
Соединение формулы III: Rс - пропаноил, L = СО, Т = NH, R = -СН2СН= СН(3-хинолил)
Пропионовый ангидрид (52 мкл) и триэтиламин (56 мкл) добавляют к раствору соединения, полученного согласно примеру 104 (152 мг), в дихлорметане и перемешивают в течение 24 часов при комнатной температуре. Смесь разбавляют этилацетатом и промывают 5% раствором NaHCO3 и соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (ацетон/гексан 1:1), получают необходимое соединение (119 мг) в виде белого пенообразного продукта.
Элемен. анализ, рассч. для С45Н63N3О11: С 65,75; Н 7,72; N 5,11. Найдено С 65,67, Н 7,92, N 4,77.
Пример 245
Соединение формулы III: Rc - этилсукциноил, L = СО, Т = NH, R = -СН2СН= СН(3-хинолил)
Этилсукцинилхлорид (29 мкл) и триэтиламин (56 мкл) добавляют к раствору соединения, полученного согласно примеру 104 (153 мг, 0,200 ммоль), в 10 мл дихлорметана при 0oС и перемешивают в течение 24 часов при комнатной температуре. Смесь разбавляют этилацетатом и промывают 5% раствором NаНСО3 и соляным раствором, высушивают над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (ацетон/гексан 1:1), получают необходимое соединение (110 мг) в виде белого пенообразного продукта.
Элемен. анализ, рассч. для C48H67N3O13 • H2O: С 63,21; Н 7,63; N 4,61. Найдено С 63,08, Н 7,50, N 4,20.
Пример 246
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-Н
Стадия 246а. Соединение 4, схема 1а: V - N-О-(1-изопропоксициклогексил), R = -CH2-C≡C-H, Rp - триметилсилил
Безводный ДМСО (200 мл) добавляют в токе азота к раствору 2',4"-бис-O-триметилсилилэритромицин А 9-[O-(1-изопропоксициклогексил)оксима] (100 г, 96,9 ммоль), полученного согласно способу, приведенному в патенте США 4990602, в 200 мл ТГФ и реакционную смесь охлаждают до 0oС. К полученному раствору, перемешиваемому в атмосфере азота, добавляют пропаргилбромид (27 мл, 240 ммоль, 80% (вес.) раствор в толуоле), затем раствор сухого КОН (13,6 г, 240 ммоль) в 300 мл безводного ДМСО в течение 25 минут и смесь интенсивно перемешивают при 0oС в течение 1 часа. Добавляют еще одну порцию КОН (10,9 г, 190 ммоль) и пропаргилбромида (21 мл, 190 ммоль) и смесь перемешивают в атмосфере азота при 0oС в течение 1,5 часов. Затем повторно добавляют указанные количества КОН и пропаргилбромида три раза через 1,5-часовые интервалы. Реакционную смесь экстрагируют этилацетатом, органическую фазу промывают водой и соляным раствором, высушивают над MgSO4. Удаляют растворитель в вакууме и получают неочищенный продукт (108 г), который используют непосредственно на следующей стадии.
Стадия 246b. Соединение 5, схема 1а: R = -CH2-C≡C-H
Воду (150 мл) и уксусную кислоту (лед., 200 мл) добавляют к раствору соединения, полученного на стадии 246а (108 г), в 300 мл СН3СN и смесь перемешивают при комнатной температуре в течение около 20 часов. Растворитель удаляют в вакууме при 40oС, остаток переносят в ЕtOАс и тщательно промывают 5% Nа2СО3 и соляным раствором. Органическую фазу высушивают над MgSO4, отфильтровывают и концентрируют, получают необходимое соединение (74 г) в виде коричневого пенообразного продукта, который непосредственно используют на следующей стадии.
Стадия 246с. Соединение 6, схема 1а: R = -СН2-С≡С-Н
Соединение, полученное на стадии 246b (74 г), растворяют в 550 мл этанола и разбавляют 550 мл воды. К полученному раствору добавляют нитрит натрия (33 г, 0,48 моль) и реакционную смесь перемешивают при комнатной температуре в течение 15 минут. Затем добавляют 4 М HCl (125 мл, 0,48 моль) при температуре окружающей среды в течение 15 минут, смесь нагревают до 70oС в течение 2 часов, затем охлаждают до комнатной температуры. Смесь экстрагируют этилацетатом, органическую фазу промывают 5% Na2CO3 и соляным раствором, высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью хроматографии на силикагеле, элюирование проводят 1% метанолом в дихлорметане, содержащем 0,5% гидроксида аммония. Продукт перекристаллизовывают из ацетонитрила и получают необходимое соединение (27 г).
Стадия 246d. Соединение 6А, схема 1с: Rр - ацетил, R = -СН2-С≡С-Н
4-диметиламинопиридин (105 мг) и триэтиламин (7,16 мл, 52 ммоль) добавляют к раствору 19 г (246 ммоль) соединения, полученного на стадии 246с, в 100 мл безводного дихлорметана. Смесь охлаждают до приблизительно 15oС в бане с холодной водой и добавляют уксусный ангидрид (5,5 мл, 59 ммоль) в течение 5 минут. После перемешивания при 15oС в течение 5 минут охлаждающую водяную баню удаляют, реакционную смесь перемешивают при температуре окружающей среды в течение 4 часов. Смесь разбавляют этилацетатом и тщательно промывают 5% водным раствором карбоната натрия (дважды), водой (дважды) и соляным раствором. Органические экстракты высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. Необходимое соединение (21 г) получают после высушивания продукта до постоянного веса в высоком вакууме.
Стадия 246е. Соединение 6В, схема 1с: Rp - ацетил, R = -СН2-С≡С-Н
1,1'-карбонилдиимидазол (14,3 г, 88,3 ммоль) добавляют к раствору соединения, полученного на стадии 246d (21 г, 24,5 ммоль), в 128 мл ТГФ и 48 мл ДМСО. После перемешивания в течение 5 минут порциями в атмосфере азота добавляют гидрид натрия (60% суспензия в минеральном масле, 1,3 г, 32,5 ммоль) в течение одного часа. После завершения добавления реагента охлаждающую баню удаляют и смесь перемешивают при температуре окружающей среды в течение 3,5 часов. Реакционную смесь снова охлаждают до 0oС, разбавляют этилацетатом (приблизительно 400 мл) и гасят 5% водным раствором бикарбоната натрия (50 мл). Объединенные органические фазы тщательно промывают водой и соляным раствором, высушивают над сульфатом магния. Раствор отфильтровывают, фильтрат концентрируют в вакууме, высушивают до постоянного веса и получают необходимое соединение (23 г), которое непосредственно используют на следующей стадии.
Стадия 246f. Соединение 6С, схема 1с: Rp - ацетил, R = -СН2-С≡С-Н
Раствор соединения, полученного на стадии 246е (23 г, 24 ммоль), в 250 мл ацетонитрила помещают в аппарат высокого давления и охлаждают до -78oС. Затем в аппарате конденсируют равный объем жидкого аммиака (250 мл), аппарат герметично закрывают и нагревают при перемешивании до температуры окружающей среды. Через 20 часов реакционную смесь снова охлаждают до -78oС, аппарат высокого давления открывают и нагревают до температуры окружающей среды при перемешивании. После испарения всего количества жидкого аммиака ацетонитрил упаривают в вакууме, остаток высушивают до постоянного веса и получают необходимое соединение (21 г).
Стадия 246g. Соединение 6D, схема 1с: Rp - ацетил, R = -СН2-С≡С-Н
4 М соляную кислоту (125 мл) добавляют к охлажденной до 0oС суспензии соединения, полученного на стадии 246f (21 г), в 200 мл смеси этанол/вода 1: 1 в течение 10 минут. После удаления охлаждающей бани реакционную смесь перемешивают при температуре окружающей среды в течение 26 часов. Смесь разбавляют водой, охлаждают до 0oС и подщелачивают 2 N раствором гидроксида натрия до рН 10. Затем смесь экстрагируют 400 мл этилацетата и органическую фазу промывают соляным раствором. Органические экстракты высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. Продукт высушивают до постоянного веса и получают 18 г неочищенного продукта, который перекристаллизовывают из смеси этилацетат/гексан, и получают необходимое соединение (8,5 г).
Стадия 246h. Соединение 6Е, схема 1с: Rp - ацетил, R = -СН2-С≡С-Н
Метилсульфид (1,47 мл, 0,021 моль) добавляют к охлажденному до -10oС раствору N-хлорсукцинимида (2,3 г, 0,017 моль) в 100 мл дихлорметана в течение 5 минут. Реакционную смесь перемешивают при -10oС в течение 10 минут. Затем добавляют раствор соединения, полученного на стадии 246g (8,3 г, 0,012 моль), в 100 мл дихлорметана в течение 30 минут и смесь перемешивают при -10oС в течение 25 минут. Затем добавляют триэтиламин (1,6 мл, 0,021 моль) в течение 5 минут и смесь перемешивают при -10oС в течение 50 минут. Реакционную смесь гасят 5% водным раствором бикарбоната натрия (50 мл) и экстрагируют дихлорметаном (300 мл). Органические экстракты промывают 5% водным раствором бикарбоната натрия с последующей промывкой соляным раствором, высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. Продукт очищают хроматографией на колонке с силикагелем, элюирование проводят последовательно смесью 30% ацетон/гексан и 50% ацетон/гексан, получают необходимое соединение (7,35 г).
Стадия 246i. Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-Н
Соединение, полученное на стадии 246h (72 мг), растворяют в 8 мл метанола и перемешивают при температуре окружающей среды в течение 18 часов. После концентрирования в вакууме и высушивания до постоянного веса в высоком вакууме получают 65 мг очищенного конечного соединения.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С33H53N2О10 637,3700. Найдено m/e 637,3718.
Пример 247
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-(3-хинолил)
Стадия 247а. Соединение 6Е, схема 1с: R = -СН2-С≡С-(3-хинолил)
Дихлорбис(трифенилфосфин)палладий (II) (6,2 мг), дегазированный триэтиламин (2,5 мл), дегазированный N,N-диметилформамид (0,5 мл), затем 3-бромхинолин (93 мкл) и соединение, полученное на стадии 246h (300 мг), и, наконец, йодид меди (II) (0,84 мг) загружают в пробирку высокого давления, снабженную мешалкой. Пробирку герметично закупоривают в атмосфере азота и нагревают до 60oС в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разбавляют смесью эфир/этилацетат, 1:1 и промывают три раза водой и соляным раствором. Органические экстракты высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. После высушивания в высоком вакууме получают 374 мг неочищенного продукта. С помощью хроматографии на силикагеле при элюировании смесью 30% ацетон/гексан получают очищенный продукт (280 мг, 78%).
МС (химическая ионизация при атмосферном давлении (ХИАД)+ m/e 806 (М+Н)+.
Стадия 247b. Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-(3-хинолил)
Соединение, полученное на стадии 247а (270 мг), растворяют в метаноле и перемешивают при температуре окружающей среды в течение 18 часов. После концентрирования в вакууме и высушивания до постоянного веса в высоком вакууме получают 260 мг неочищенного продукта. С помощью хроматографии на силикагеле при элюировании смесью дихлорметан/метанол/гидроксид аммония, 98:1: 1 получают 221 мг очищенного конечного соединения.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C42H58N3O10 764,4122. Найдено m/e 764,4121.
Пример 248
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-(6-нитро-3-хинолил)
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования 6-нитро-3-бромхинолина вместо 3-бромхинолина.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C42H57N4O12 809,3973. Найдено m/e 809,3966.
Пример 249
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-фенил
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования йодбензола вместо 3-бромхинолина.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C39H57N2O10 713,4013. Найдено m/e 713,3998.
Пример 250
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-нафтил
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования 1-йоднафталина вместо 3-бромхинолина.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C43H59N2O10 763,4170. Найдено m/e 763,4161.
Пример 251
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-(2-нафтил)
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования 2-бромнафталина вместо 3-бромхинолина.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С43Н59N2O10 763,4170. Найдено m/e 763,4150.
Пример 252
Соединение формулы IX: L = CO, T = NH, R = -СН2-С≡С-(6-метокси-2-нафтил)
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования 6-метокси-2-бромнафталина вместо 3-бромхинолина.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C44H61N2O11 793,4275. Найдено m/e 793,4256.
Пример 253
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-(6-хлор-2-нафтил)
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования 6-хлор-3-бромхинолина вместо 3-бромхинолина.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C42H57N3O10Cl 798,3732. Найдено m/e 798,3743.
Пример 254
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-(6-хинолил)
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования 6-бромхинолина вместо 3-бромхинолина.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C42H58N3O10 764,4122. Найдено: 764,4116.
Пример 255
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-(2-метил-6-хинолил)
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования 6-бром-2-метилхинолина вместо 3-бромхинолина.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C43H60N3O10 778,4279. Найдено: 778,4282.
Пример 256
Соединение формулы IX: L = СО, Т = NH, R = -CH2-C≡C-(5-(N-(2-пиридил)амино)карбонил)фуранил
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования 5-бром-фуран-2-карбокси-пиридин-2-ил амида вместо 3-бромхинолина.
МСВР (ББА): (М+Н)+ m/e 823.
Пример 257
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-(1-фенилэтенил)
Конечное соединение получают согласно способу, указанному в примере 247, за исключением использования α-бромстирола вместо 3-бромхинолина.
МС (ионизация электроспрей (ИЭС)): (М+Н)+ m/e 739.
Пример 258
Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-Br
Стадия 258а. Соединение 6Е, схема 1с: R = -СН2-С≡С-Br
Уксусную кислоту (8,4 мкл) добавляют к раствору соединения, полученного согласно примеру 246, стадия h (100 мг), в 1 мл ацетона в атмосфере азота при температуре окружающей стреды. Готовят второй раствор, содержащий 39 мг N-бромсукцинимида и 2,5 мг нитрата серебра в 1 мл ацетона, полученный раствор перемешивают при комнатной температуре в атмосфере азота в течение 10 минут и охлаждают до 0oС. Затем первый раствор в одну порцию добавляют ко второму раствору, удаляют охлаждающую баню и полученную реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 2 часов. Реакционную смесь разбавляют этилацетатом, добавляют водный насыщенный раствор бикарбоната натрия и смесь перемешивают при комнатной температуре в течение ночи. Органическую фазу отделяют, промывают соляным раствором и высушивают над MgSO4. Растворитель удаляют и остаток очищают хроматографией на силикагеле при элюировании смесью 40% ацетон/гексан, получают конечное соединение (50 мг, 46%).
Стадия 258b. Соединение формулы IX: L = СО, Т = NH, R = -СН2-С≡С-Br
Соединение, полученное на стадии 258а (35 мг), растворяют в 2 мл метанола и перемешивают при температуре окружающей среды в течение 16 часов. Растворитель удаляют и остаток очищают хроматографией на силикагеле при элюировании смесью метанол/дихлорметан/1% NН4ОН, 5:94:1, получают конечный продукт (32 мг, 26%).
МС (ИЭС): (М+Н)+ m/e 715.
Пример 259
Соединение формулы IX: L = СО, Т = NH, R = -СН2-(2,2-диметил-1,3-диоксолан-4-ил)
Стадия 259а. Соединение 6D, схема 1с: R = -СН2СН(OH)СН2ОН, Rp - ацетил
К раствору соединения, полученного согласно примеру 176, стадия d (5,0 г, 7,32 ммоль, соединение 6D, схема 1с, R - -CH2CH=CH2, Rp - ацетил), и N-метилморфолин N оксида (1,7 г, 14,5 ммоль) в 25 мл ТГФ добавляют при комнатной температуре OsO4 (4% раствор в воде, 0,090 мл, 0,0147 ммоль), и смесь перемешивают в течение 24 часов. Реакцию гасят при добавлении 1,5 г бисульфита натрия и 10 мл воды, растворители удаляют в вакууме. Остаток растворяют в этилацетате и промывают водным насыщенным раствором бикарбоната натрия, водой и соляным раствором, высушивают над Na2SO4. Растворитель удаляют и получают необходимое соединение (3,17 г).
Стадия 259b. Соединение 6D, схема 1с: R= -СН2-(2,2-диметил-1,3-диоксолан-4-ил), Rp - ацетил, Rd - Н
п-Толуолсульфокислоту (160 мг, 0,84 ммоль) добавляют к раствору соединения, полученного на стадии 259а (500 мг, 0,70 ммоль), и 2,2-диметоксипропана (0,26 мл, 2,1 ммоль) в 7 мл толуола, и реакционную смесь перемешивают при 55oС в течение 3 дней. Смесь разбавляют этилацетатом, полученный раствор промывают 10% раствором карбоната натрия, водой и соляным раствором. Органическую фазу высушивают над Na2SO4 и удаляют растворитель. Получают неочищенный продукт, который очищают хроматографией на силикагеле при элюировании смесью метанол/хлороформ/гидроксид аммония, 2: 97:1, получают необходимое соединение (363 мг).
Стадия 259с. Соединение 6Е, схема 1с: R= -СН2-(2,2-диметил-1,3-диоксолан-4-ил), Rр - ацетил, Rd - Н
Соединение, полученное на стадии 259b (356 мг, 0,47 ммоль), окисляют N-хлорсукцинимидом и диметилсульфидом согласно способу, указанному в примере 1, стадия f. Получают необходимое соединение (371 мг).
Стадия 259d. Соединение формулы IX: L = СО, Т = NH, R = -СН2-(2,2-диметил-1,3-диоксолан-4-ил)
Соединение, полученное на стадии 259с (100 мг, 0,13 ммоль), перемешивают в 4 мл метанола при комнатной температуре в течение ночи. Удаляют растворитель и остаток очищают хроматографией на силикагеле при элюировании смесью метанол/хлороформ/гидроксид аммония, 0,9:98:1, получают необходимое соединение (87 мг).
МС (M+H)+ m/e 713.
Пример 260
Соединение формулы IX: L = СО, Т = NH, R = -CH2CH(OH)CH2OH
Соединение, полученное согласно примеру 259 (100 мг, 0,13 ммоль), перемешивают при кипячении с обратным холодильником с п-толуолсульфокислотой (35 мг, 0,18 ммоль) в 25 мл смеси ТГФ/вода 4:1 в течение 3 часов. Смесь разбавляют этилацетатом, полученный раствор промывают 10% раствором карбоната натрия, водой и соляным раствором. Органическую фазу высушивают над Na2SO4 и удаляют растворитель. Получают неочищенный продукт, который очищают хроматографией на силикагеле при элюировании смесью метанол/хлороформ/гидроксид аммония, 2:97:1, получают необходимое соединение (61 мг).
МС (М+Н)+ m/e 689.
Пример 261
Соединение формулы IX: L = СО, Т = NH, R = -CH2CH(OH)-фенил
Раствор фенилмагний бромида (3,0 М раствор, 2,0 мл, 6,0 ммоль) в эфире добавляют по каплям при 0oС в атмосфере азота к раствору соединения, полученного согласно примеру 220 (550 мг, 0,87 ммоль), в 16 мл сухого ТГФ. Смесь перемешивают в течение 1 часа и реакцию гасят насыщенным раствором хлорида аммония. Смесь экстрагируют этилацетатом, полученный раствор промывают водой и соляным раствором, высушивают над Na2SO4. Растворитель удаляют и остаток очищают хроматографией на силикагеле при элюировании смесью метанол/хлороформ/гидроксид аммония, 10:90:0,5, получают необходимое соединение (235 мг) в виде двух изомеров.
Изомер А: МС (М+H)+ m/e 719. Изомер В: МС (M+H)+ m/e 719.
Пример 262
Соединение формулы IX: L = СО, Т = N(NH2), R = -СН2СН=СН2
Гидразин (85% водный раствор, 0,50 мл, 10,0 ммоль) добавляют к раствору соединения, полученного согласно примеру 102, стадия b (793 мг, 1,0 ммоль), в 10 мл смеси ацетонитрил/вода, 9:1, и смесь перемешивают в атмосфере азота при комнатной температуре в течение 4 дней. Смесь разбавляют этилацетатом, органическую фазу промывают водой и соляным раствором, высушивают над Na2SO4. Растворитель удаляют и остаток очищают хроматографией на силикагеле при элюировании смесью метанол/дихлорметан/гидроксид аммония, 5:95:0,5, получают необходимое соединение (91 мг).
МС (М+Н)+ m/e 654.
Пример 263
Соединение формулы IX: L = СО, Т = N(NH2), R = -СН2СН=СН-(3-хинолил)
Необходимое соединение получают с использованием способов, указанных в примере 178 за исключением использования соединения, полученного согласно примеру 262, вместо соединения, полученного согласно примеру 177.
МС (М+Н)+ m/e 781.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С42H59N3O10 781,4176. Найдено: 781,4188.
Пример 264
Соединение формулы IX: L = СО, Т = N(NH2), R = -СН2СН2СН2-(3-хинолил)
Необходимое соединение получают с использованием способов, указанных в примере 3, за исключением использования соединения, полученного согласно примеру 262, вместо соединения, полученного согласно примеру 3.
МС (M+H)+ m/e 768.
МСВР (ББА): рассчитанное m/e для (М+Н)+ С42Н61N3О10 768,4435. Найдено: 768,4437.
Пример 265
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-нафтил
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 1-бромнафталина вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 764.
Пример 266
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(3-(2-фуранил)-6-хинолил)
Смесь 2'-ацетилированного производного соединения, полученного согласно примеру 219 (ацетилирование проводят по методике, указанной в примере 177, стадия а) (177 мг, 0,200 ммоль), 2-(трибутилстанил)фурана (78 мкл, 0,200 ммоль) и Pd(трифенилфосфин)4 (23 мг, 0,020 ммоль) в сухом толуоле нагревают в запаянной пробирке при температуре от 60oС до 90oС в течение 20 часов. Смесь разбавляют этилацетатом, органическую фазу промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над Na2SO4. Растворитель удаляют и остаток очищают хроматографией на силикагеле при элюировании смесью ацетон/гексан, 1:1, получают ацетилированное конечное соединение. Полученный продукт перемешивают в метаноле в течение 48 часов, растворитель удаляют и остаток очищают хроматографией на силикагеле при элюировании смесью дихлорметан/метанол/диметиламин, 95:5:0,5. Получают конечное соединение (102 мг).
МС (M+H)+ m/e 832.
МСВР (ББА): рассчитанное m/e для (М+Н)+ C46H61N3O11 832,4384. Найдено: 832,4384.
Пример 267
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(8-хлор-3-хинолил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 8-хлор-3-бромхинолина вместо 3-бромхинолина, использованного в примере 178.
МС (M+H)+ m/e 800.
МСВР (ББА): рассчитанное m/e для (М+Н)+ C42H58ClN3O10 800,3889. Найдено: 800,3890.
Пример 268
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(4-хлор-2-трифторметил-6-хинолил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 6-бром-4-хлор-2-трифторметилхинолина вместо 3-бромхинолина, использованного в примере 178.
МС (M+H)+ m/e 868.
Пример 269
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(2-флуоренил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2-бромфлуорена вместо 3-бромхинолина, использованного в примере 178.
МС (M+Н)+ m/e 803.
Пример 270
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(9-(флуоренон-2-ил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2-йод-9-флуоренона (2-йод-9-фторенона) вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 817.
Элементный анализ для C46H60N2O11 С 67,63; Н 7,40; N 3,43. Найдено: С 68,11; Н 8,08; N 3,21.
Пример 271
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(6-бензоил-2-нафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 6-бензоил-(2- трифторметилсульфонилокси)нафталина (полученного при взаимодействии 6-бензоил-2-нафтола с ангидридом трифторметилсульфокислоты) вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 869.
Пример 272
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(7-метокси-2-нафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 7-метокси-2-(трифторметилсульфонилокси)нафталина (полученного при взаимодействии 7-метокси-2-нафтола с ангидридом трифторметилсульфокислоты) вместо 3-бромхинолина, использованного в примере 178.
МС (M+H)+ m/e 795.
Элементный анализ для С44Н62N2О11 • 0,5 Н2О: С 65,73; Н 7,90; N 3,48. Найдено: С 65,62; Н 8,06; N 3,49.
Пример 273
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(3-фенил-6-хинолил)
Смесь 2'-ацетилированного производного соединения, полученного согласно примеру 219 (ацетилирование проводят по методике, указанной в примере 177, стадия а) (177 мг, 0,200 ммоль), Pd(трифенилфосфин)4 (11,5 мг, 0,010 ммоль), CuBr (1,43 мг) и (трибутилстанил)бензола (78 мкл) в 2 мл диоксана нагревают в запаянной пробирке при температуре 100oС в течение 15 часов. Смесь разбавляют этилацетатом, органическую фазу промывают 5% водным раствором карбоната натрия и соляным раствором, высушивают над Na2SO4. Растворитель удаляют и остаток очищают хроматографией на силикагеле, получают ацетилированное конечное соединение (77 мг). Полученный продукт перемешивают в метаноле в течение 48 часов, растворитель удаляют и остаток очищают хроматографией на силикагеле. Получают конечное соединение (54,2 мг).
МС (М+Н)+ m/e 842.
Пример 274
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(3-(2-пиридил)-6-хинолил)
Необходимое соединение получают с использованием способов, указанных в примере 273, за исключением использования 2-(трибутилстанил)пиридина вместо 2-(трибутилстанил)бензола, использованного в примере 273.
МС (М+Н)+ m/e 841.
Пример 275
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(3-(2-тиофенил)-6-хинолил)
Необходимое соединение получают с использованием способов, указанных в примере 273, за исключением использования 2-(трибутилстанил)тиофена вместо 2-(трибутилстанил)бензола, использованного в примере 273.
МС (М+Н)+ m/e 848.
Пример 276
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(4-метилнафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 1-бром-4-метилнафталина вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 779.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С44Н62N2О10 = 779,4483. Найдено m/e = 779,4495.
Пример 277
Соединение формулы IX: L = СО, Т = NH2, R = -CH2CH=CH-(6-β-D-галактопиранозил-2-нафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 6-бром-2-нафтил-β-D-галактопиранозида (производства фирмы Sigma Aldrich) вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 943.
Пример 278
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(7-хинолил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 7-(трифторметилсульфонил)хинолина вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 766.
Пример 279
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(4-фторнафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 1-бром-4-фторнафталина вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 783.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С43Н59FN2O10 = 783,4227. Найдено m/e= 783,4223.
Пример 280
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(3-бифенил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 3-бромбифенила вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 791.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С45Н63N2O10 = 791,4483. Найдено m/e = 791,4492.
Пример 281
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(5-нитронафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 1-бром-5-нитронафталина вместо 3-бромхинолина, использованного в примере 178.
Пример 282
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(4-пирролилфенил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 1-(4-йодфенил)пиррола вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 780.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С43Н61N3О10 780,4430. Найдено m/e 780,4424.
Пример 283
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(6-метокси-2-нафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 2-бром-6-метоксинафталина вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 795.
МСВР (ББА): рассчитанное m/e для (М+Н)+: C44H62N2O11 795,4426. Найдено m/e 795,4426.
Пример 284
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(3,5-дихлорфенил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 1,3-дихлор-5-йодбензола вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 783. МСВР
(ББА): рассчитанное m/e для (М+Н)+: С39Н57Сl2N2О10 783,3390. Найдено m/e 783,3392.
Пример 285
Соединение формулы IX: L = СО, Т = NH2, R = -СН2-(3-йодфенил)
Необходимое соединение получают с использованием способов, указанных в примере 1, стадии a-f, за исключением использования 3-йодбензилбромида вместо аллилбромида, использованного в примере 1, стадия а, для получения соединения 9, схема 1b, где R = 3-йодфенилметил и Rp - бензоил, с последующей обработкой полученного производного согласно способам, указанным в примере 102.
МС (М+Н)+ m/e 815.
Пример 286
Соединение формулы IX: L = СО, Т = NH2, R = -СН2-(3-(2-фуранил)фенил)
Необходимое соединение получают с использованием способов, указанных в примере 266, за исключением использования соединения, полученного согласно примеру 285, вместо соединения, полученного согласно примеру 265.
МС (M+H)+ m/e 689.
Пример 287
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(6-гидрокси-2-нафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 2'-бензоилированного соединения, полученного согласно примеру 102, стадия с, вместо 2'-ацетилированного соединения, полученного согласно примеру 177, и за исключением использования 6-бром-2-нафтола вместо 3-бромхинолина, использованного в примере 178.
МС (М+Н)+ m/e 781.
Пример 288
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-(6-(2-бромэтокси)2-нафтил)
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 6-бром-2-(2-бромэтокси)нафталина вместо 3-бромхинолина, использованного в примере 178.
МС (M+H)+ m/e 887.
Пример 289
Соединение формулы IX: L = СО, Т = NН2, R = -СН2СН=СН-(6-(2-тетразолил)этокси-2-нафтил)
Тетразол (138 мг, 2 ммоль) и триэтиламин (0,556 мл, 4 ммоль) добавляют к раствору соединения, полученного согласно примеру 288 (371 мг, 0,4 ммоль), в 4 мл ацетонитрила и смесь нагревают в атмосфере азота при 60oС в течение ночи. Летучие соединения удаляют в вакууме и остаток растворяют в этилацетате. Раствор промывают 5% водным раствором бикарбоната натрия и соляным раствором, высушивают над Na2SO4 и концентрируют. Остаток очищают хроматографией на силикагеле при элюировании смесью дихлорметан/метанол/гидроксид аммония, 97: 3: 0,5. Полученный продукт перемешивают в метаноле при комнатной температуре в течение 2 дней, затем продукт очищают хроматографией на силикагеле при элюировании смесью дихлорметан/метанол/гидроксид аммония 99:1:0,5.
МС (М+Н)+ m/e 877.
Пример 290
Соединение формулы IX: L = СО, Т = NH2, R = -СН2СН=СН-нафтил
Необходимое соединение получают с использованием способов, указанных в примере 178, за исключением использования 1-бромнафталина вместо 3-бромхинолина, использованного в примере 178.
МС (M+H)+ m/e.
Пример 291
Соединение формулы IX: L = СО, Т = NH, R = -СН2С≡С-(2-фенилэтенил)
Необходимое соединение получают с использованием способов, указанных в примере 247, за исключением использования бета-бромстирола вместо 3-бромхинолина.
МС (M+H)+ m/e 739.
Пример 292
Соединение формулы IX: L= СО, Т = NH, R = -СН2СН=СН-(5-(3-изоксазолил)-2-тиофенил)
Стадия 292а. Соединение 37, схема 7, где RBB = ОН
2-метил-2-бутен (2,7 мл, 24 ммоль) добавляют к 11,8 мл (11,8 ммоль) комплекса боран-ТГФ (1 М раствор в ТГФ) при -10oС. Рекционную смесь перемешивают при 0oС в течение 2 часов и одной порцией добавляют предварительно приготовленный раствор, содержащий соединение, полученное согласно примеру 246, стадия h (соединение 6Е, схема 1с; Rp - ацетил, R = -CH2-C≡C-H, 2 г, 2,95 ммоль), в 10 мл ТГФ. Реакционную смесь перемешивают при 0oС в течение 1 часа и нагревают до температуры окружающей среды. Через три часа смесь снова охлаждают до 0oС и добавляют 5% водный раствор карбоната натрия. Смесь экстрагируют этилацетатом, органические экстракты промывают соляным раствором и высушивают над сульфатом магния. Раствор концентрируют и высушивают в вакууме, получают 3,6 г неочищенного продукта, который очищают хроматографией на силикагеле при элюировании смесью ацетон/гексан 1:1, получают необходимое соединение (0,85 г, 40%).
Стадия 292b. Соединение формулы IX: L = СО, Т = NH, Rc - ацетил, R = -СН2СН=СН-(5-(3-изоксазолил)-2-тиофенил)
100 мг (0,138 ммоль) соединения, полученного на стадии 292а, карбонат калия (42 мг, 0,3 ммоль), 2-бром-5-(изоксазол-3-ил)тиофен (48 мг, 0,21 ммоль), ацетат палладия (II) (0,15 мг, 0,7 ммоль), 0,75 мл ацетона и 0,75 мл воды загружают в пробирку высокого давления, снабженную мешалкой. Затем смесь дегазируют с использованием трех циклов замораживание - вакуумирование - оттаивание. Затем пробирку закупоривают в атмосфере азота и нагревают при 65oС в течение 2 часов. Смесь разбавляют этилацетатом, тщательно промывают водой и соляным раствором. Органические экстракты высушивают над сульфатом магния, концентрируют в вакууме и высушивают до постоянного веса в высоком вакууме, получают 140 мг неочищенного продукта.
Стадия 292с. Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=СН-(5-(3-изоксазолил)-2-тиофенил)
Соединение, полученное на стадии 292b (140 мг), растворяют в 5 мл метанола и раствор перемешивают при температуре окружающей среды в течение 20 часов. Раствор концентрируют в вакууме и высушивают до постоянного веса. Неочищенный продукт очищают хроматографией на силикагеле при элюировании смесью дихлорметан/метанол/гидроксид аммония, 98:1:1 и получают 34 мг необходимого соединения.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С40H58N3O11S 788,3792. Найдено m/e 788,3809.
Пример 293
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=СН-(1,3-диметил-2,4-диоксо-5-пиримидинил)
Необходимое соединение получают с использованием способов, указанных в примере 292, за исключением использования 5-бром-1,3-диметилурацила вместо 2-бром-5-(изоксазол-3-ил)тиофена.
МСВР (ББА): рассчитанное m/e для (М+Н)+: С39Н61N4O12 777,4286. Найдено m/e 777,4291.
Пример 294
Соединение формулы IX: L = СО, Т = NH, R = -СН2СН=СН-(5-(2-пиридил)аминокарбонил-2-фуранил)
Необходимое соединение получают с использованием способов, указанных в примере 292, за исключением использования 5-бром-фуран-2-карбокси-пиридин-2-ил амида вместо 2-бром-5-(изоксазол-3-ил)тиофена.
МС (ионизация электроспрей (ИЭС)) (М+Н)+ m/e 825.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ АЗЕТИДИНА, КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РАСТВОРИМОЙ ЭПОКСИДГИДРОЛАЗЫ | 2012 |
|
RU2615995C2 |
| СПОСОБ ПОТЕНЦИАЦИИ ПЕСТИЦИДНОЙ АКТИВНОСТИ ПЕСТИЦИДА, ПОЛУЧЕННОГО НА ОСНОВЕ БАКТЕРИЙ, ОТНОСЯЩИХСЯ К РОДУ BACILLUS | 1996 |
|
RU2192744C2 |
| УСОВЕРШЕНСТВОВАННЫЕ КОНЪЮГАТЫ N4 ХЕЛАТООБРАЗУЮЩИХ АГЕНТОВ | 2005 |
|
RU2360701C2 |
| ТРИЦИКЛИЧЕСКИЕ ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2293734C9 |
| КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ПЛАТИНЫ (II), СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2067099C1 |
| ПРОИЗВОДНЫЕ 3-Н-1,2,3-ТРИАЗОЛО-[4,5-D]ПИРИМИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2174518C2 |
| ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ ПЕСТИЦИДНОЙ АКТИВНОСТЬЮ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ПЕСТИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ КОНТРОЛИРОВАНИЯ ВРЕДИТЕЛЕЙ | 1996 |
|
RU2185064C2 |
| АГЕНТ, АКТИВИРУЮЩИЙ РЕЦЕПТОР, АКТИВИРУЕМЫЙ ПРОЛИФЕРАТОРАМИ ПЕРОКСИСОМ δ | 2007 |
|
RU2435764C2 |
| ПРОИЗВОДНЫЕ 6-АМИНОХИНАЗОЛИНА ИЛИ 3-ЦИАНОХИНОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА РЕЦЕПТОРНЫХ ТИРОЗИНКИНАЗ EGFR ИЛИ HER-2 | 2010 |
|
RU2536102C2 |
| ПРОЛЕКАРСТВА НА ОСНОВЕ ГИДРОГЕЛЯ | 2013 |
|
RU2647729C2 |
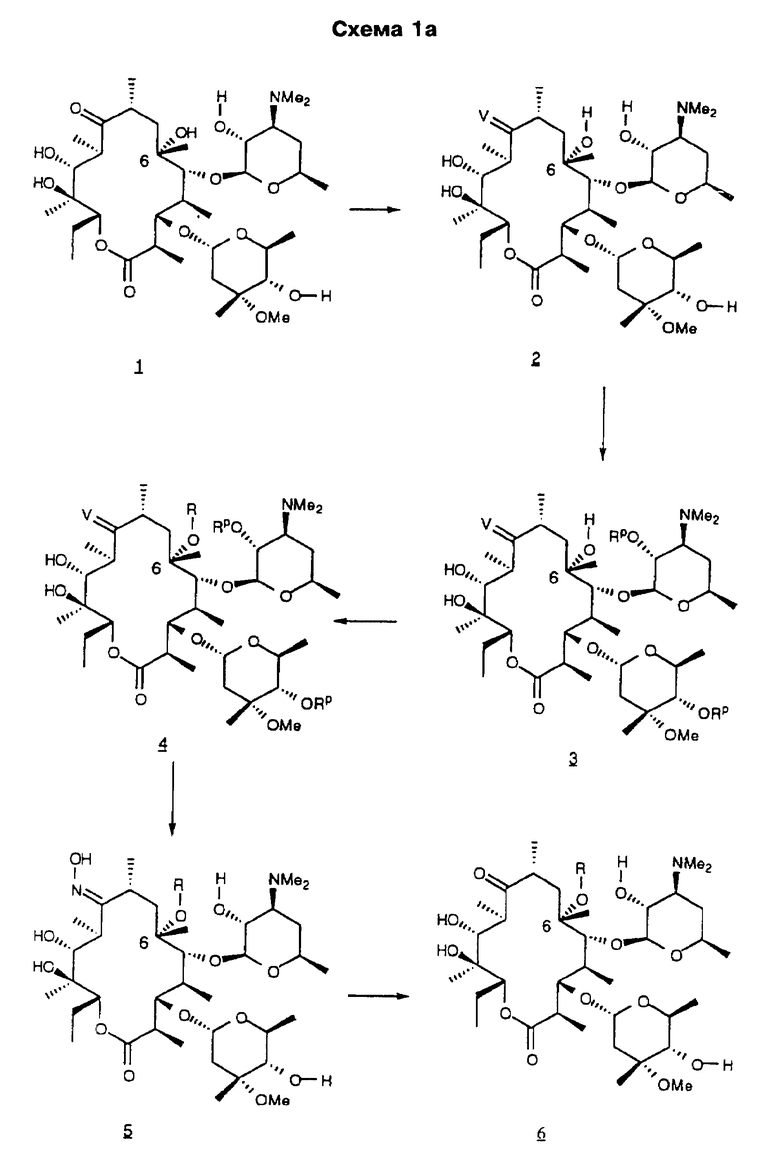
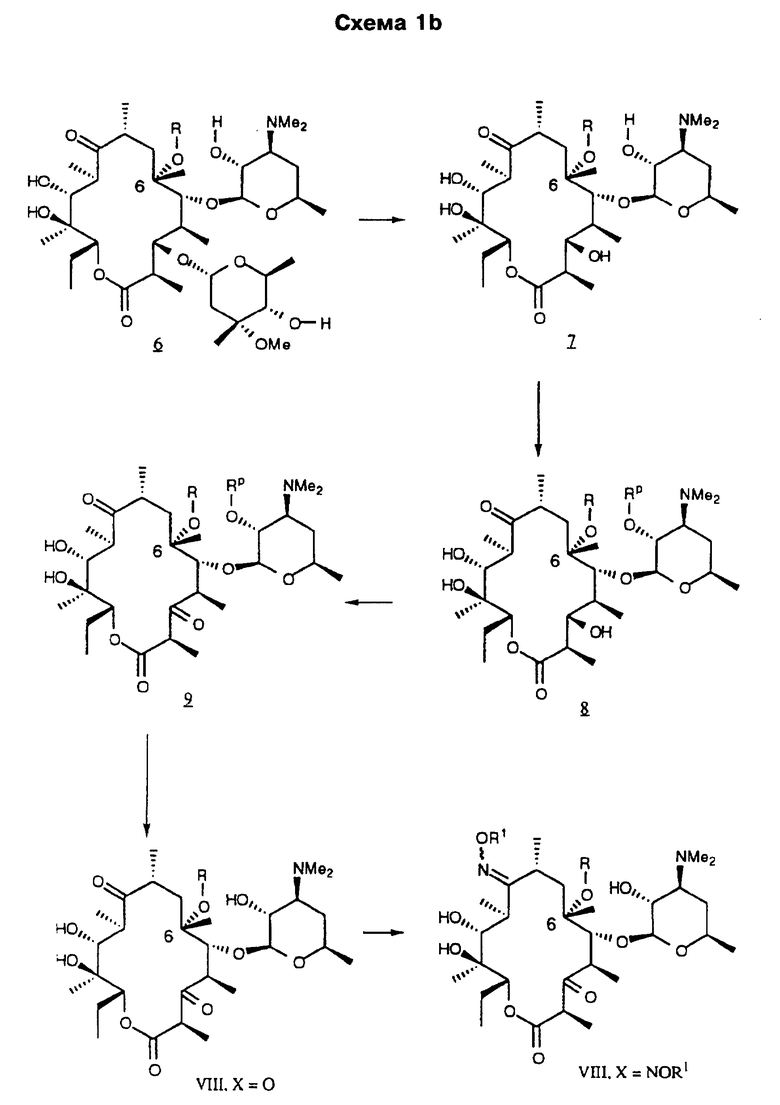
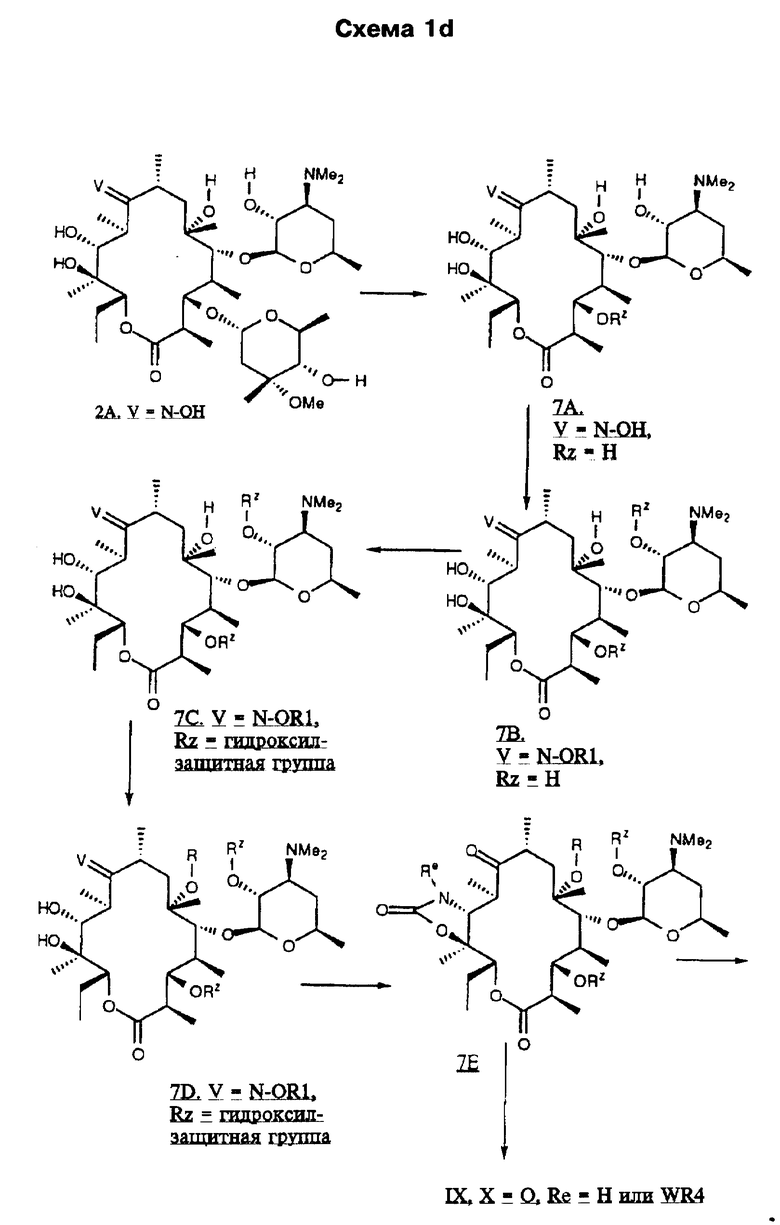
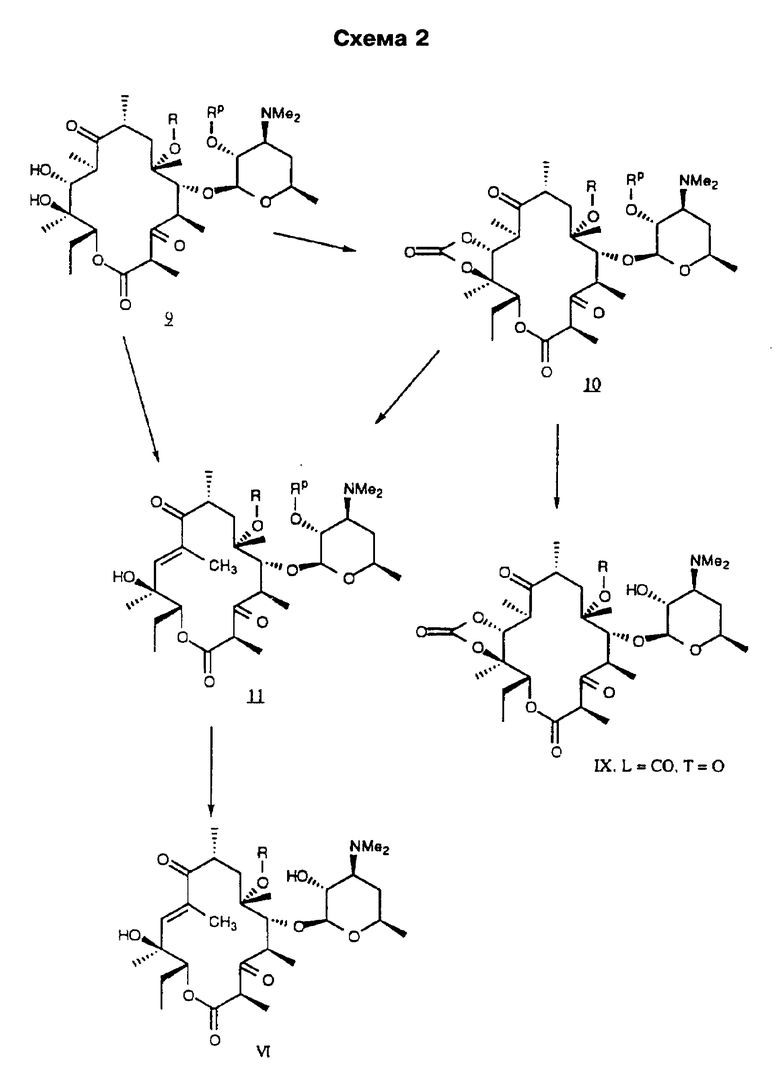
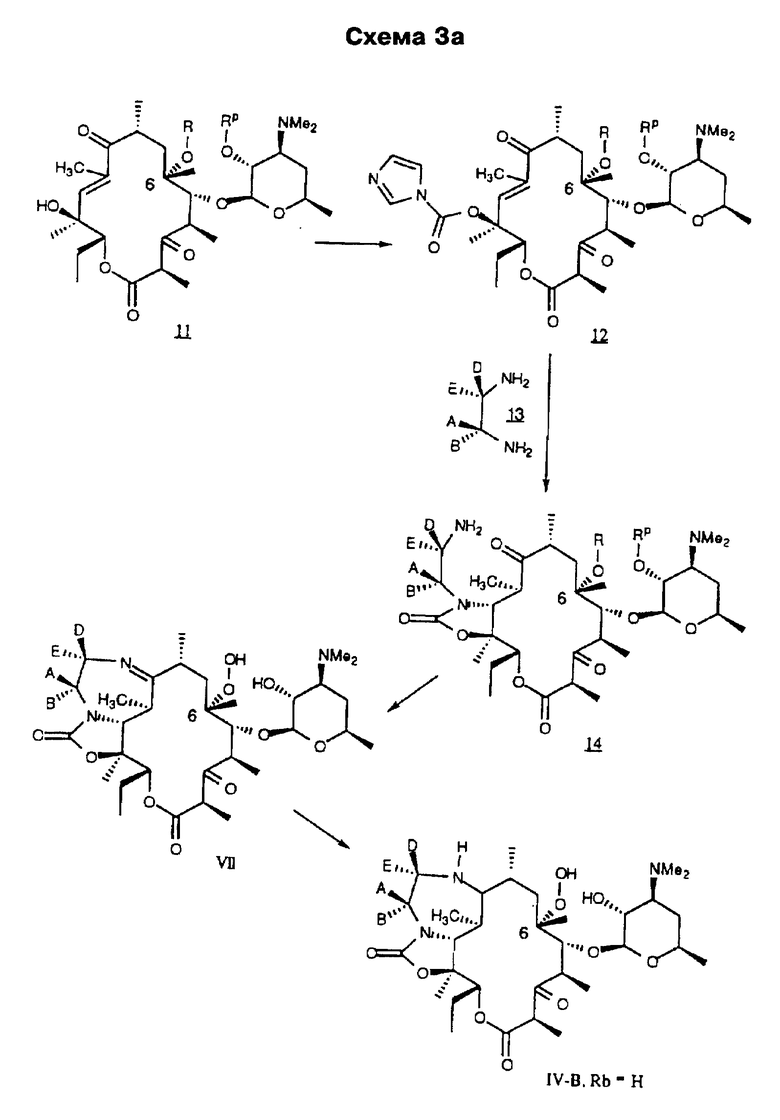

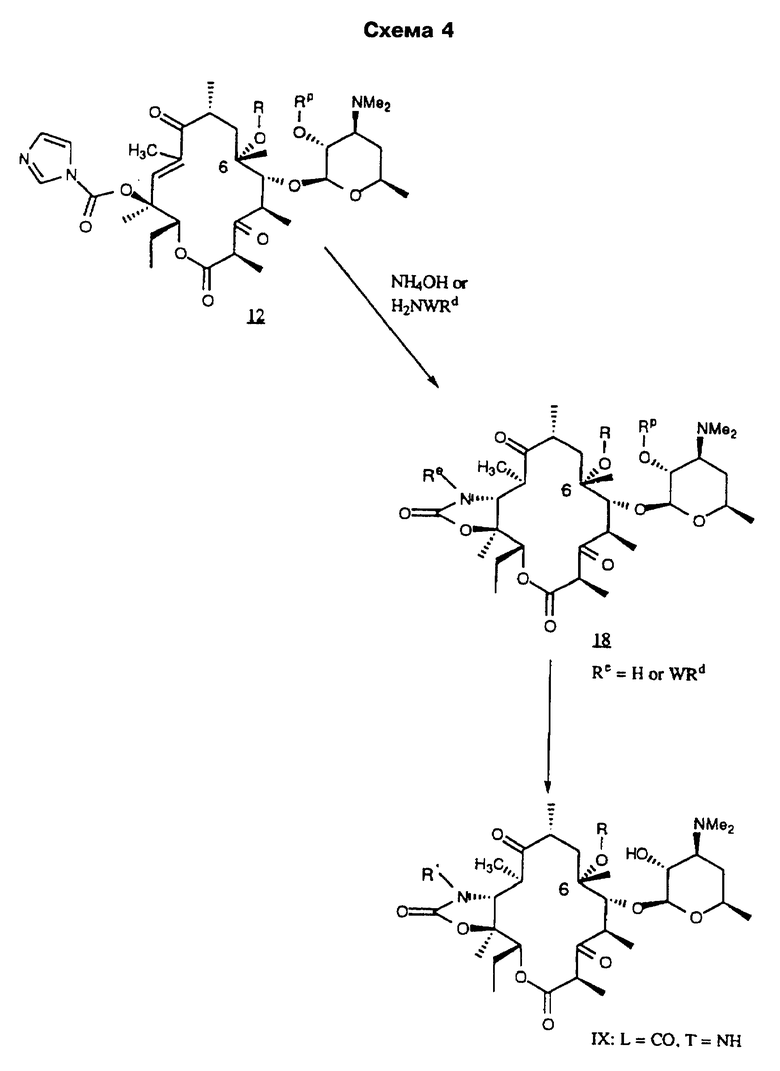
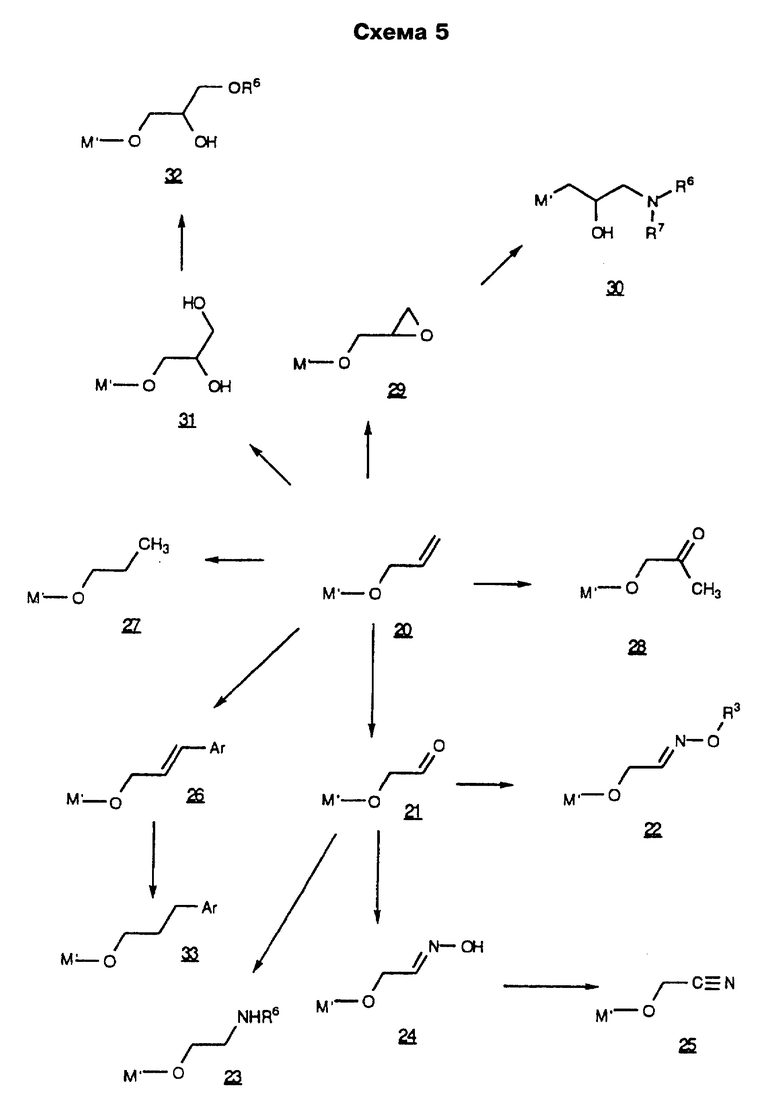
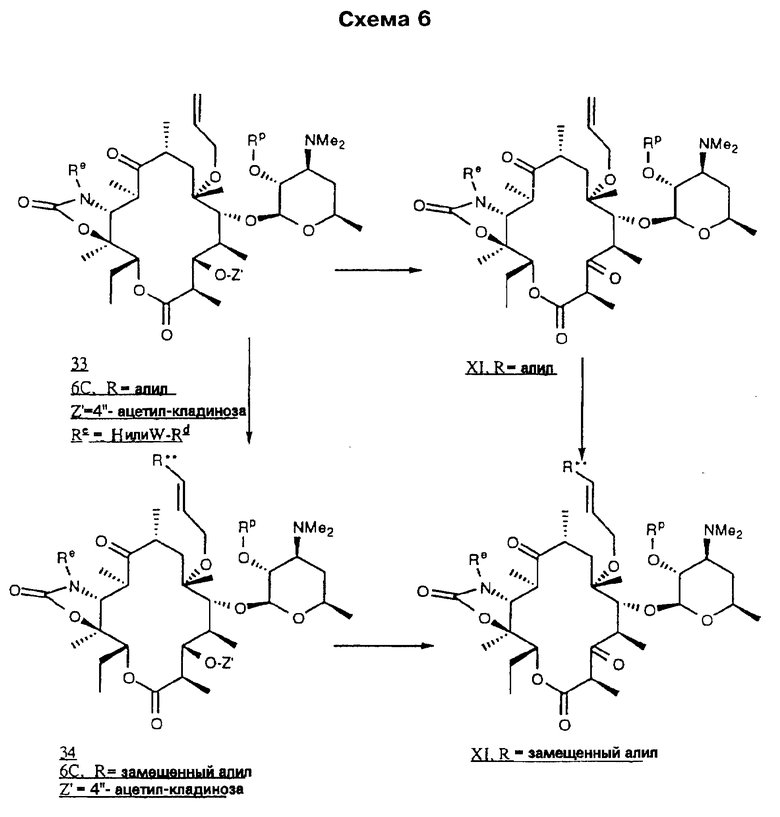
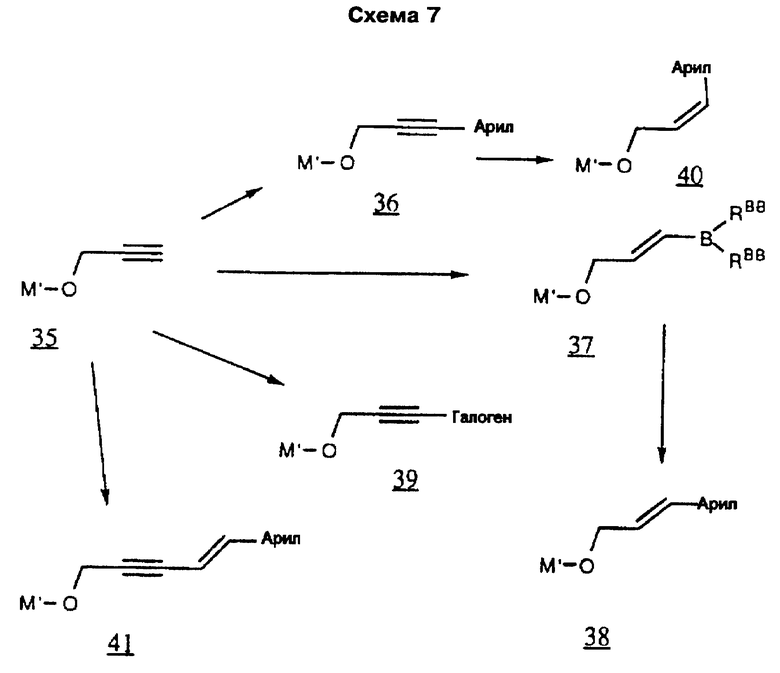
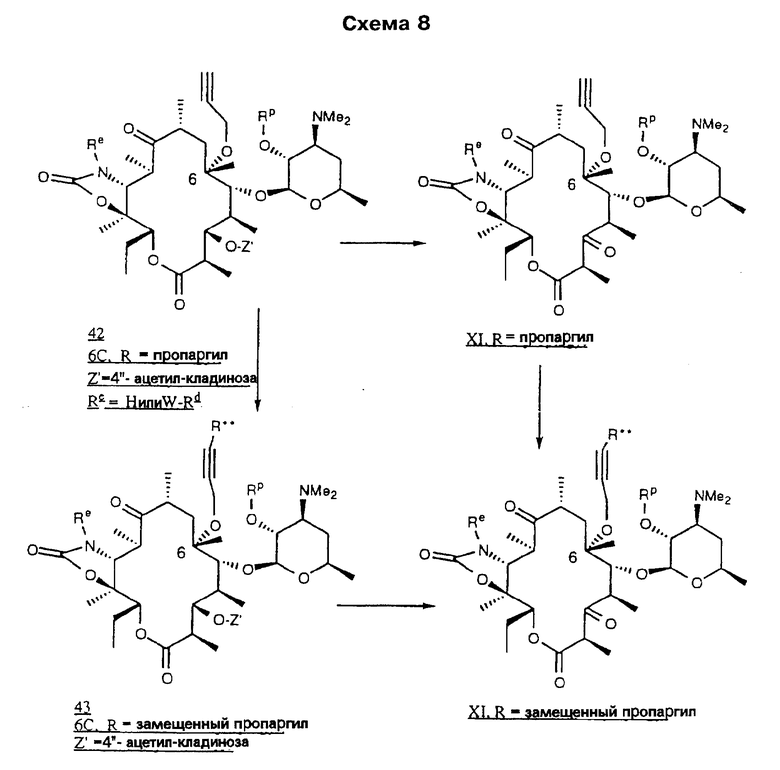
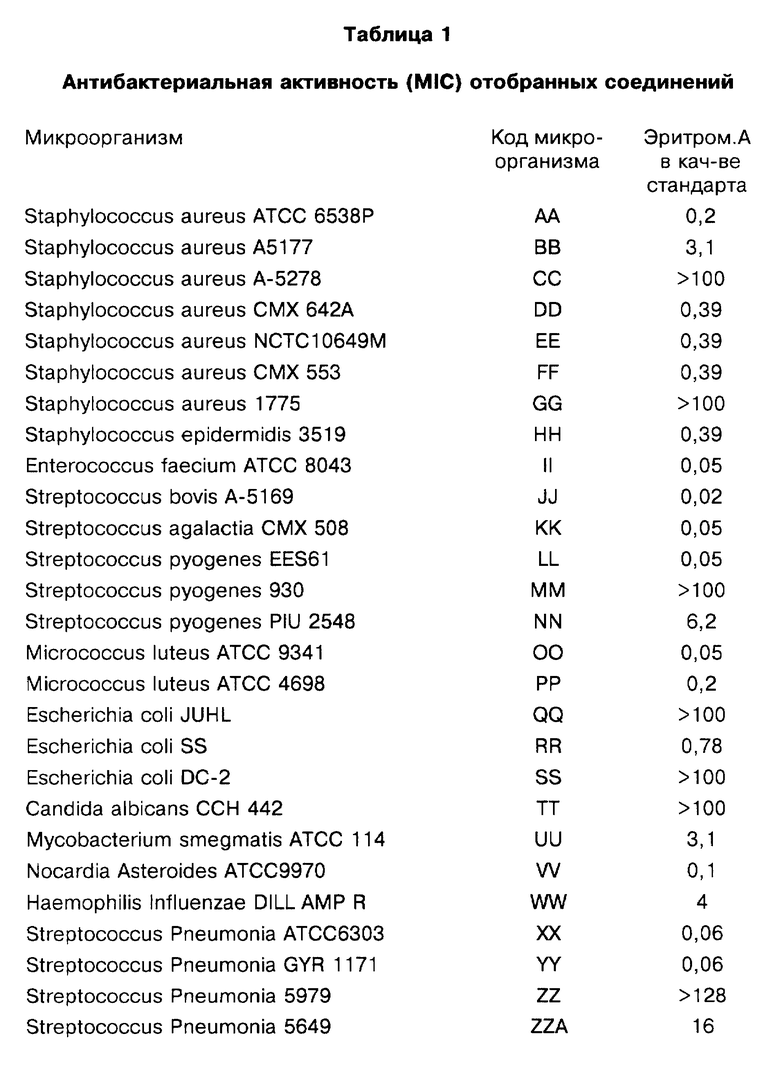
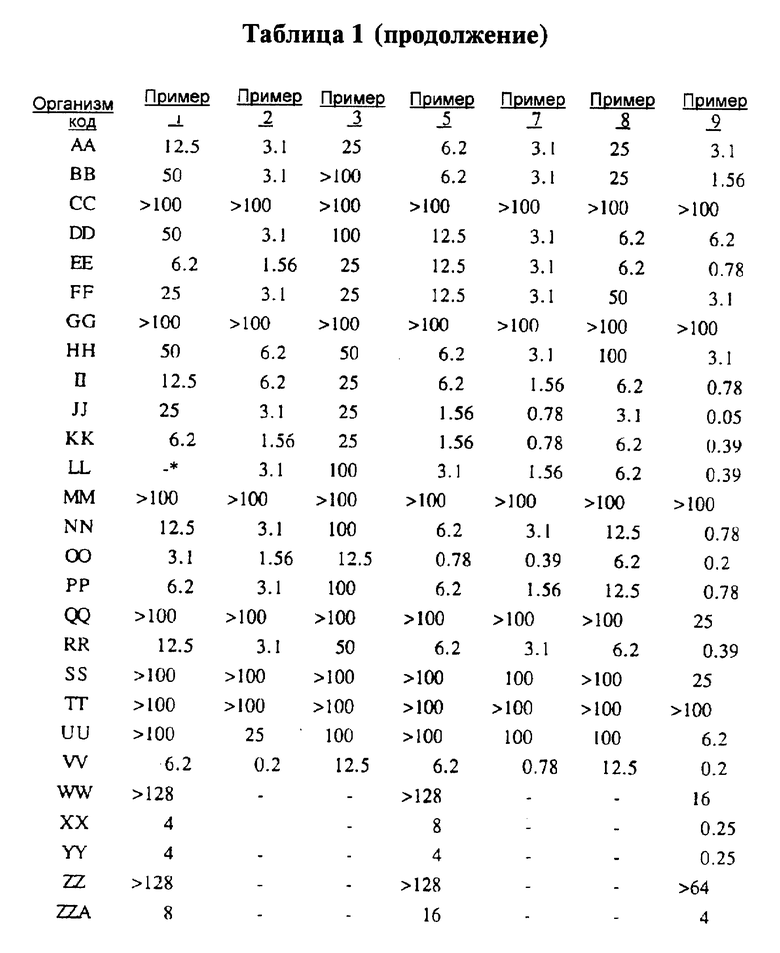
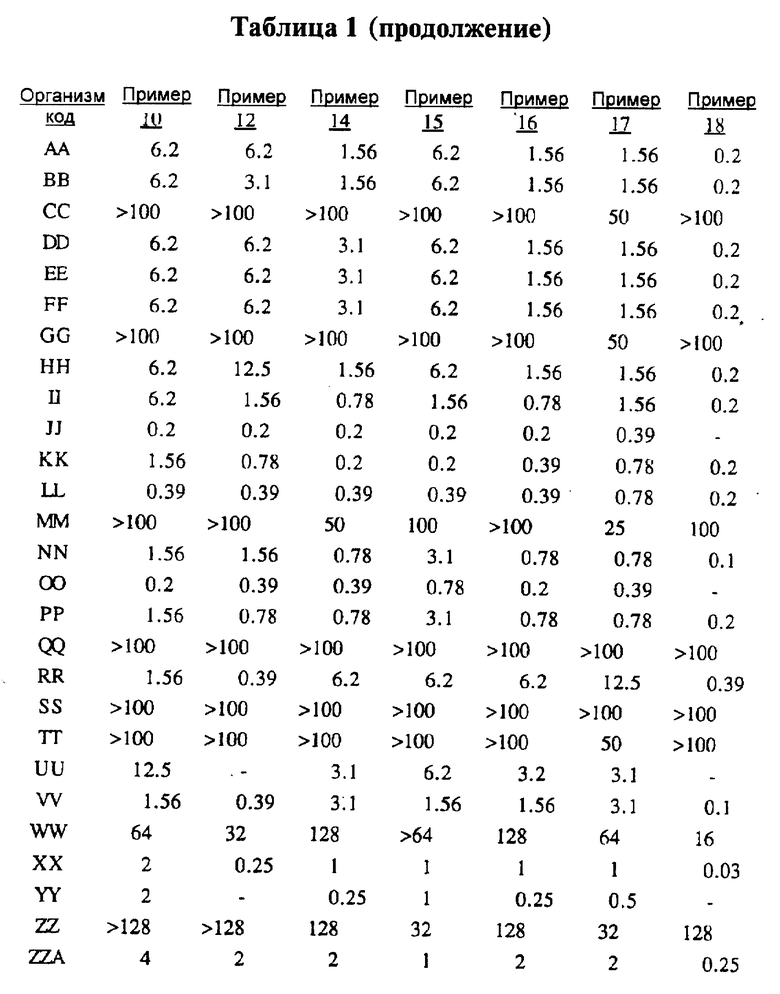

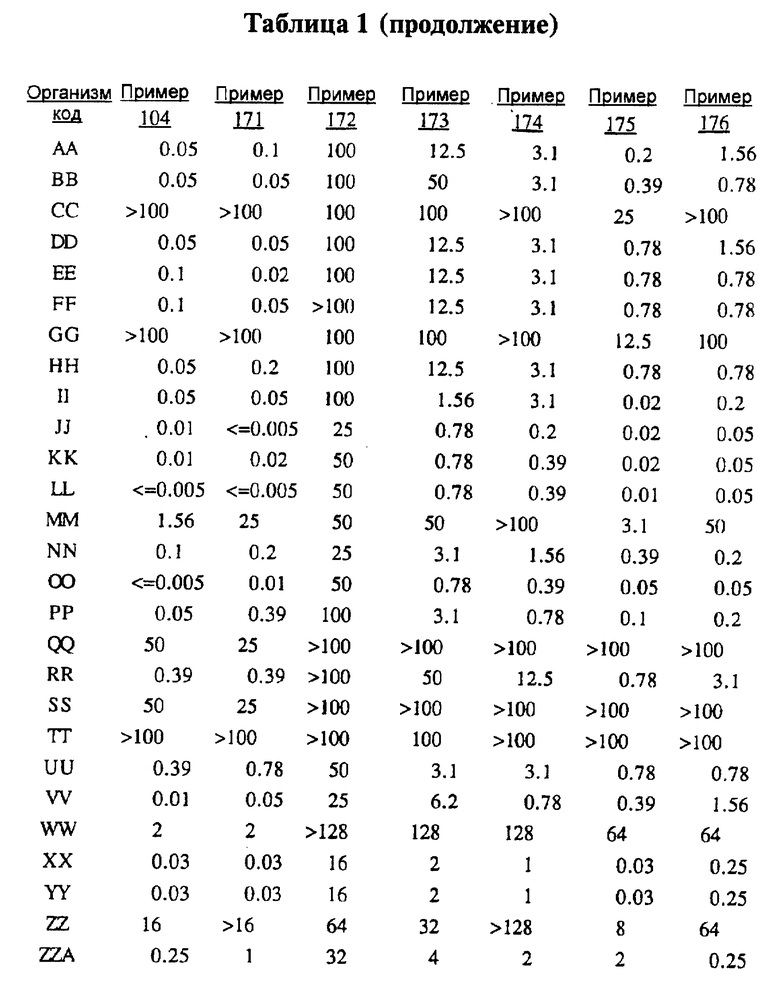
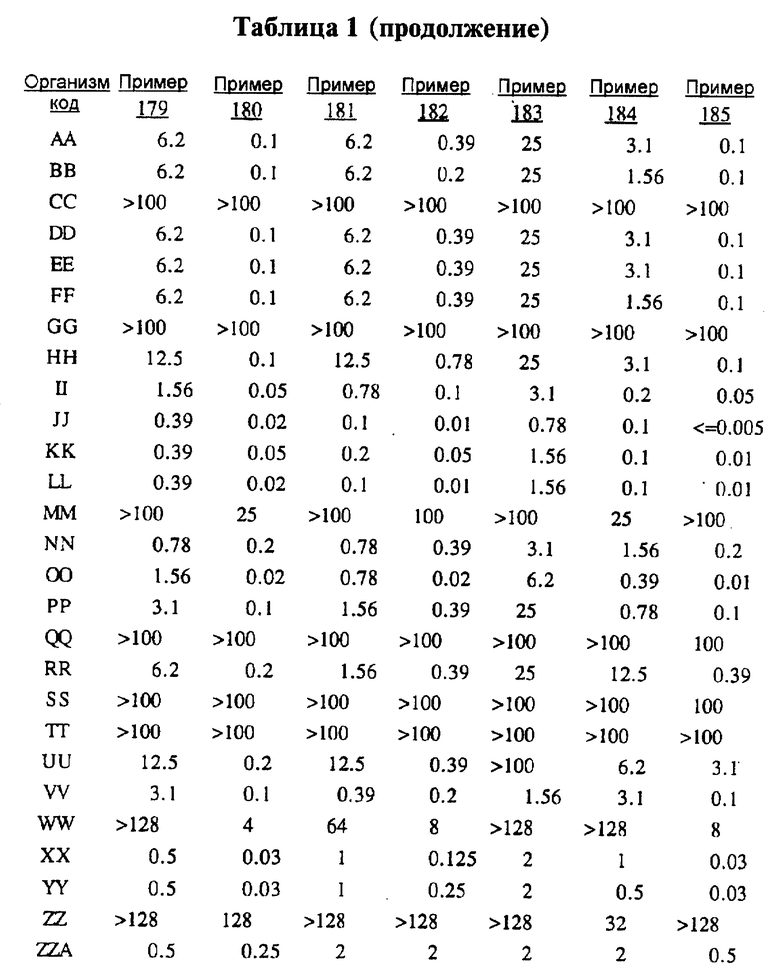
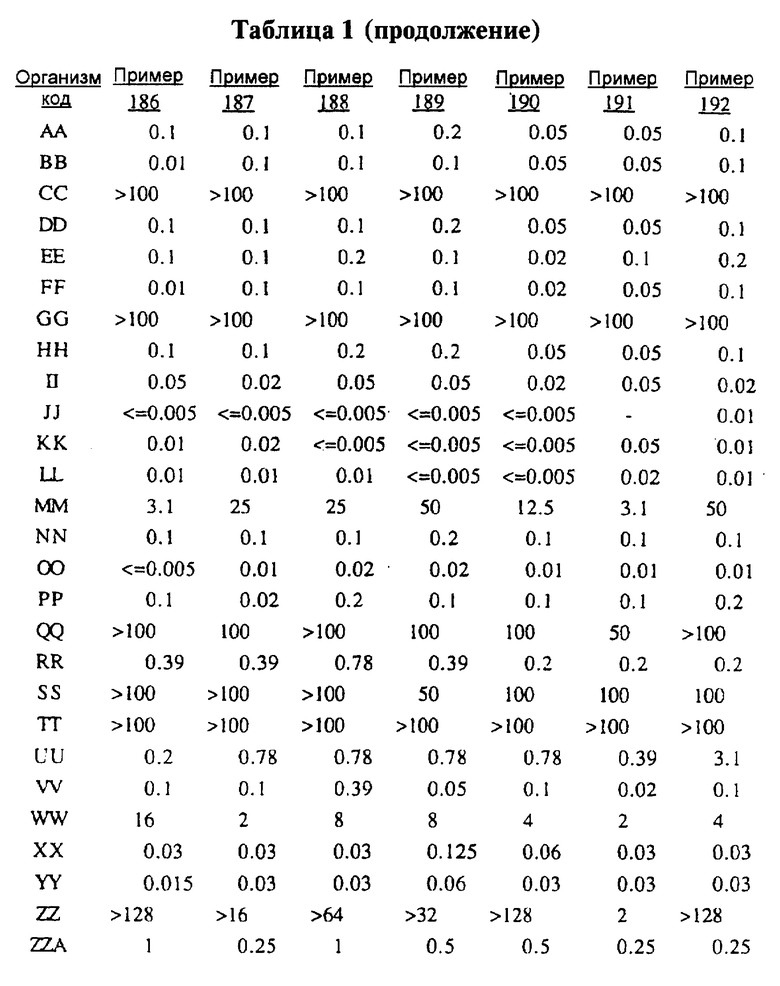
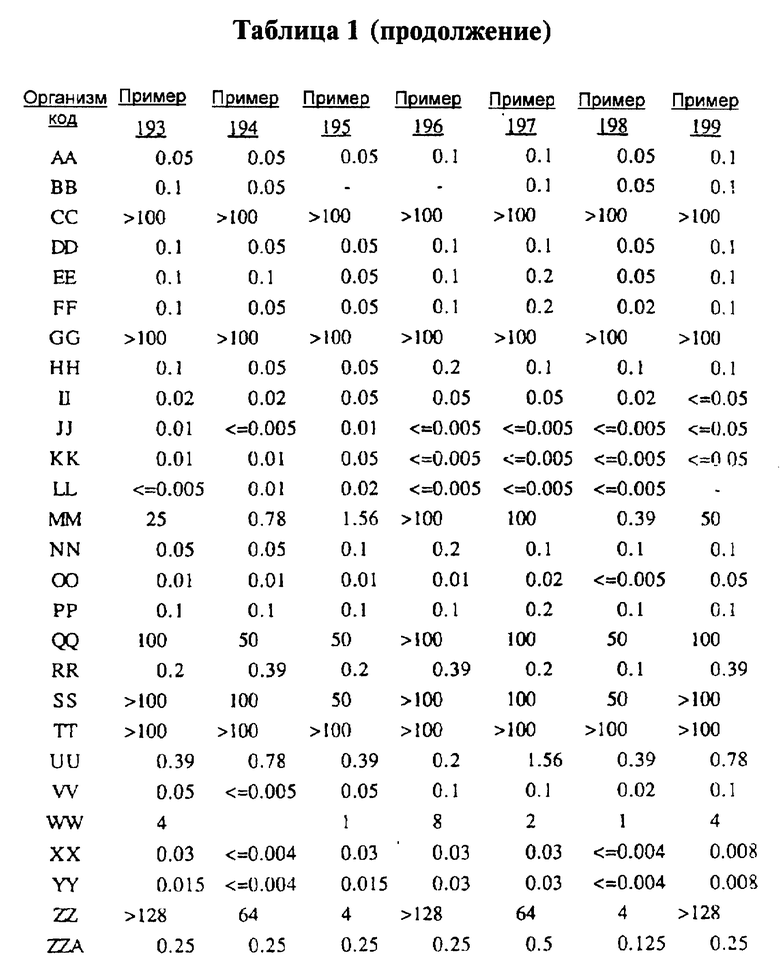
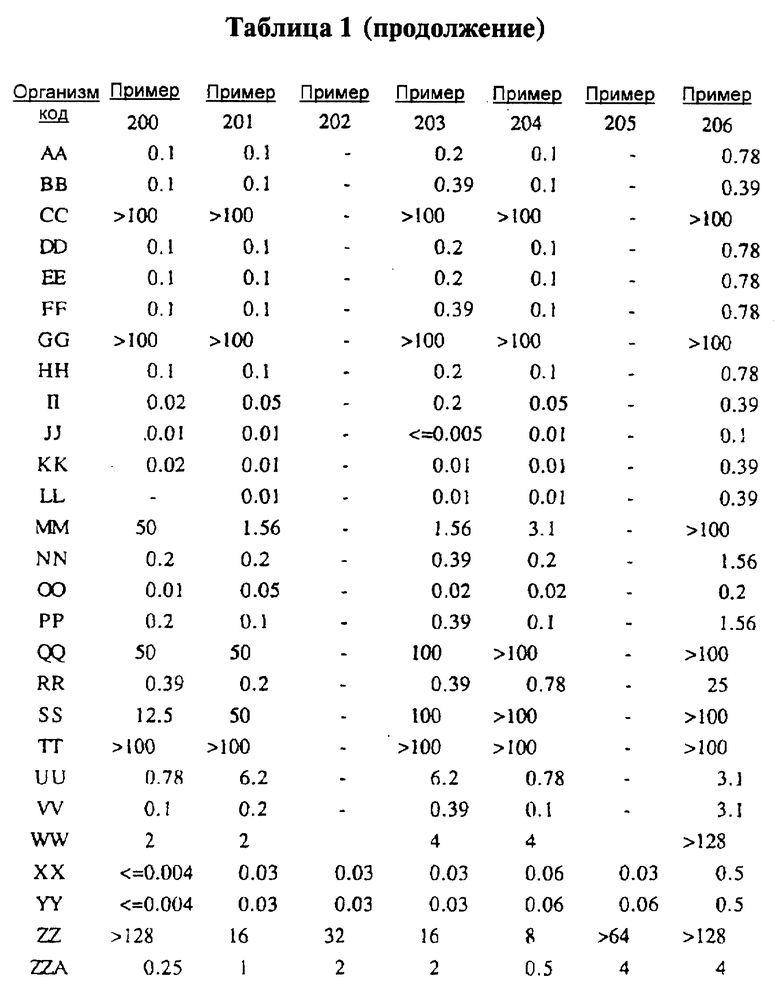
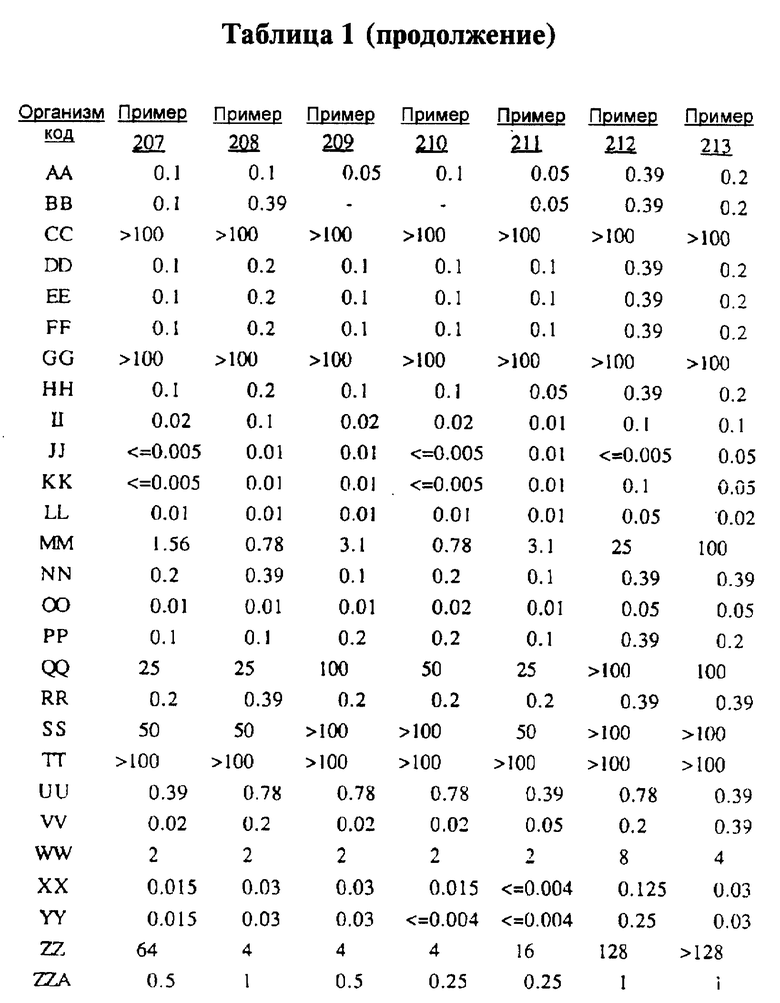
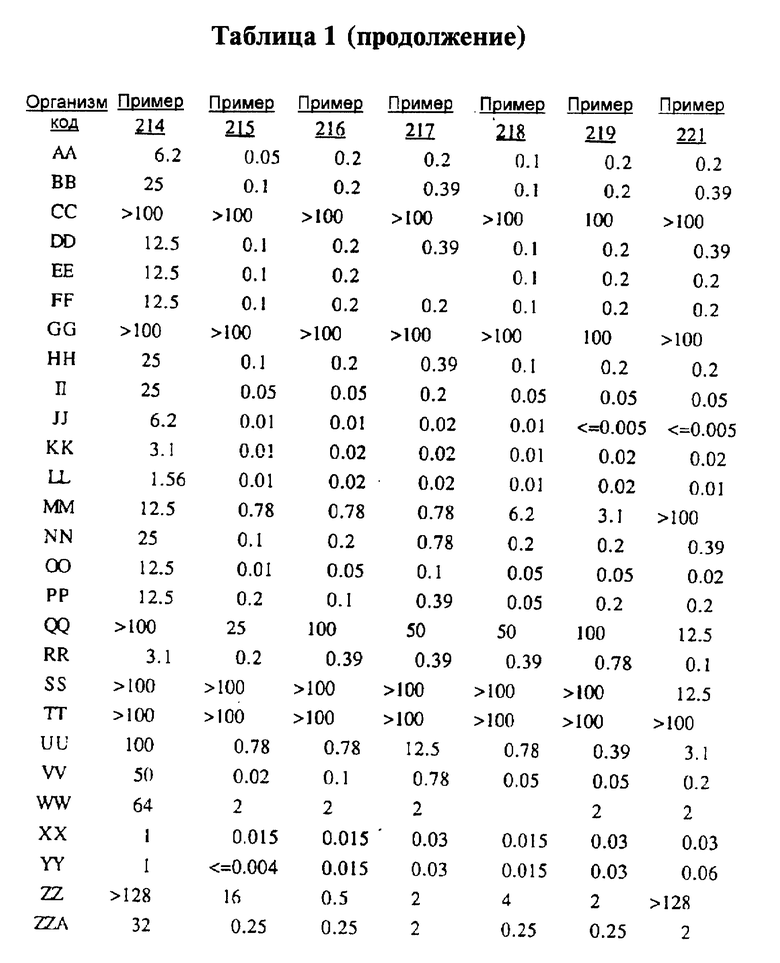
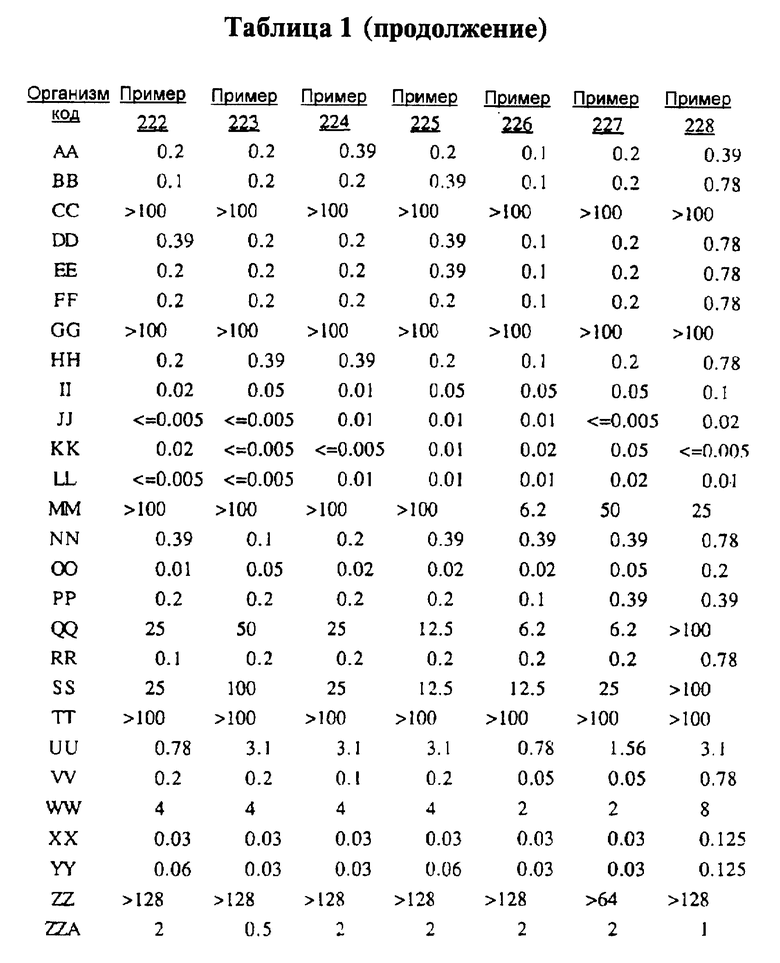
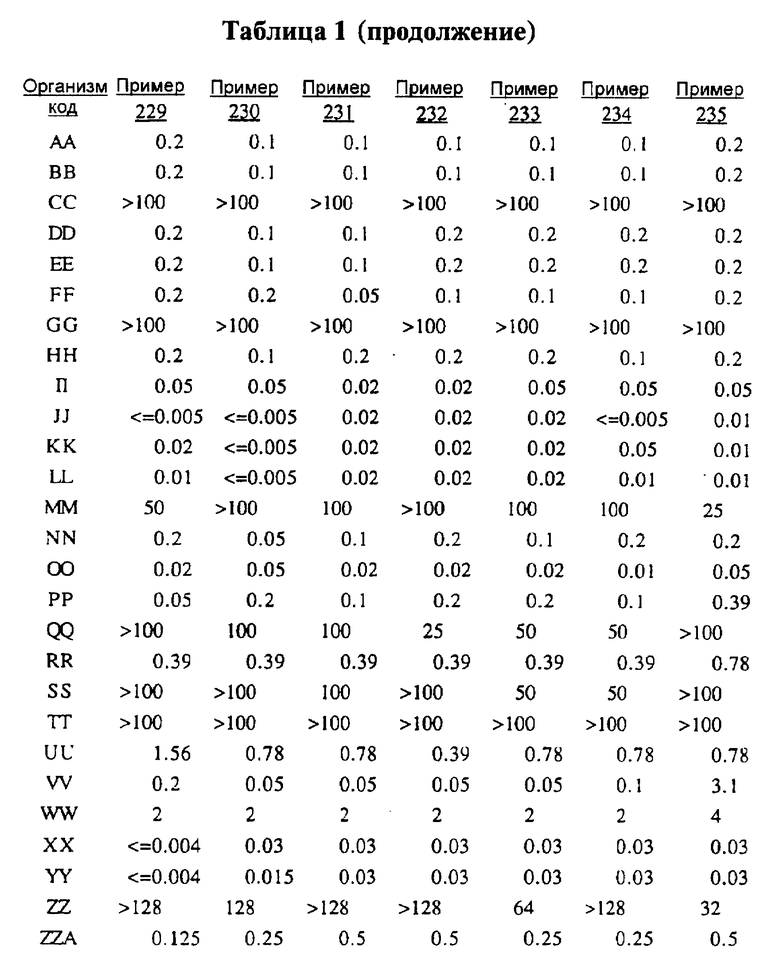
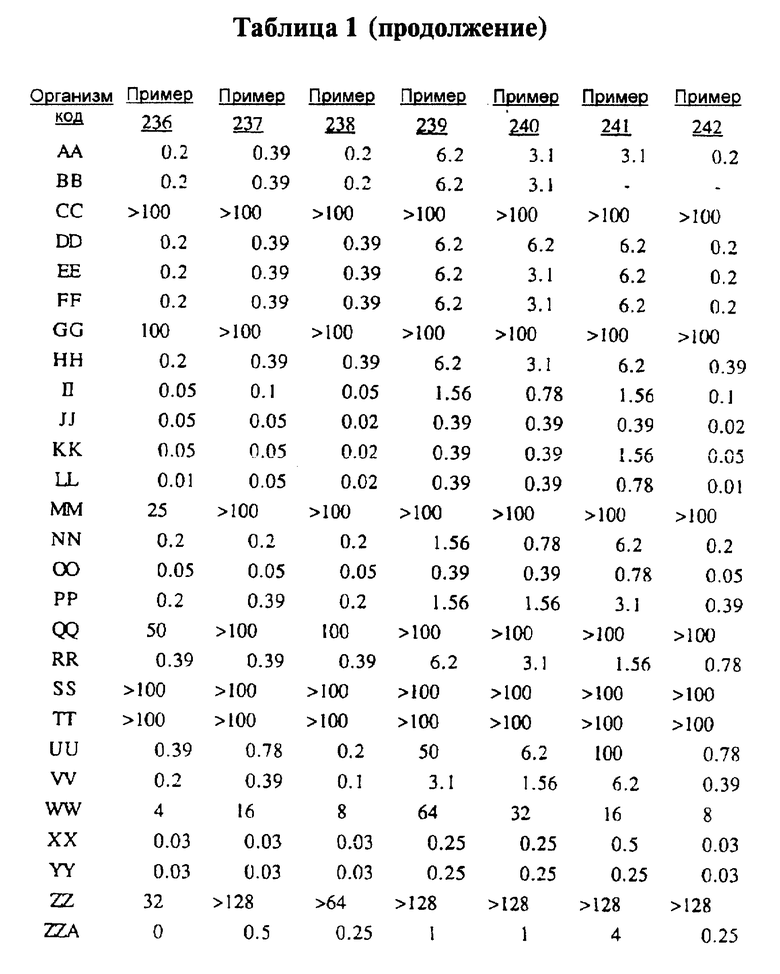
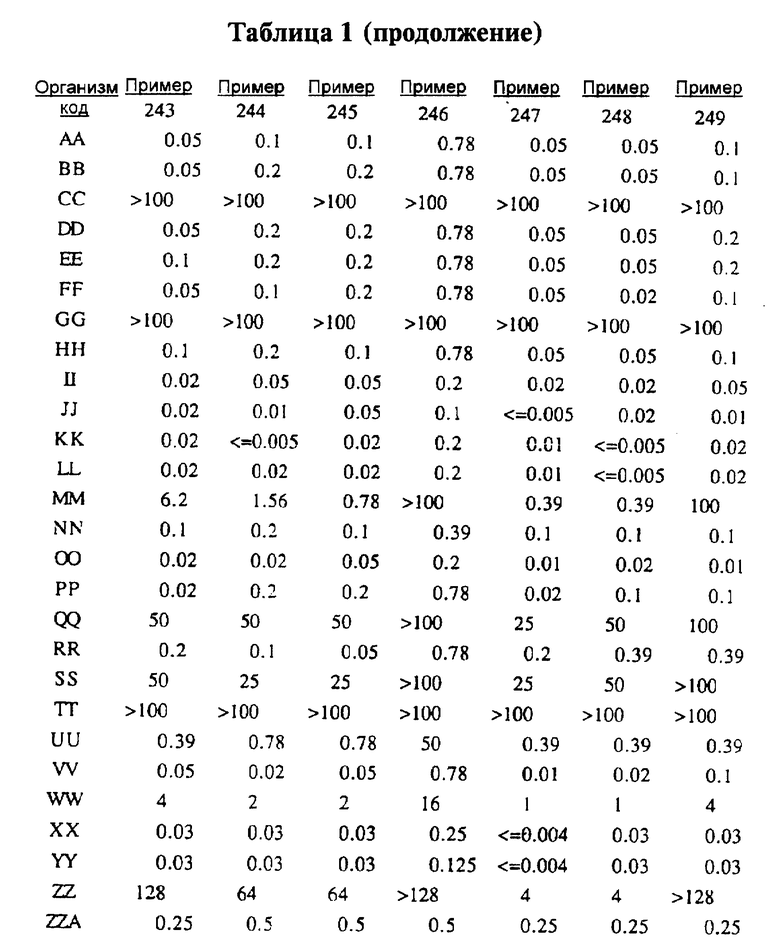
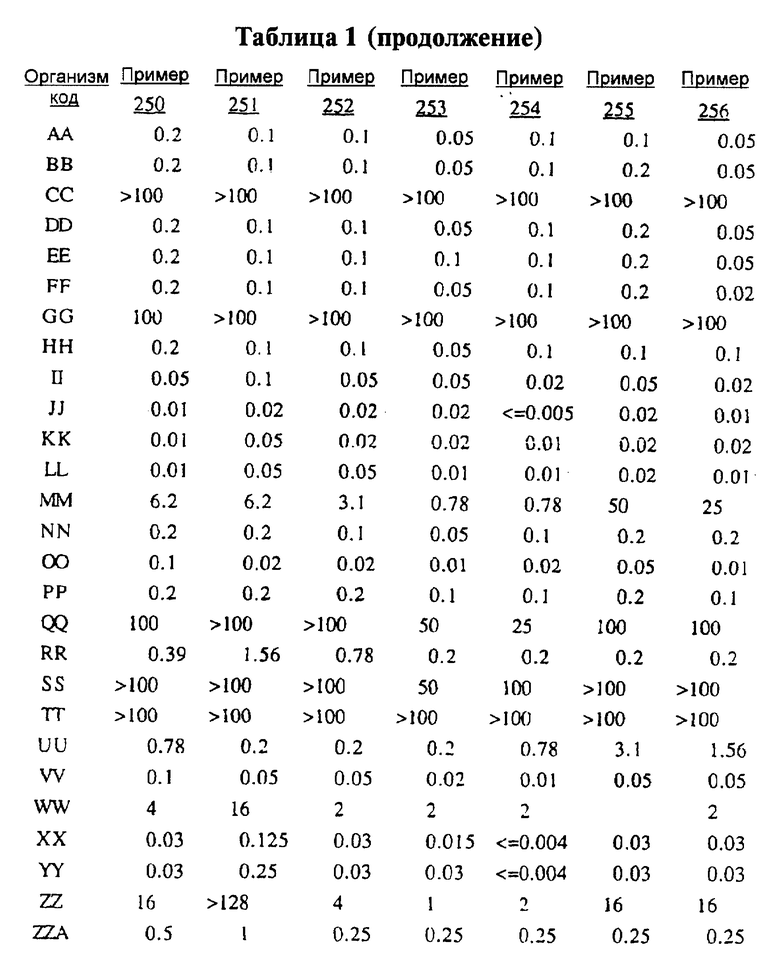

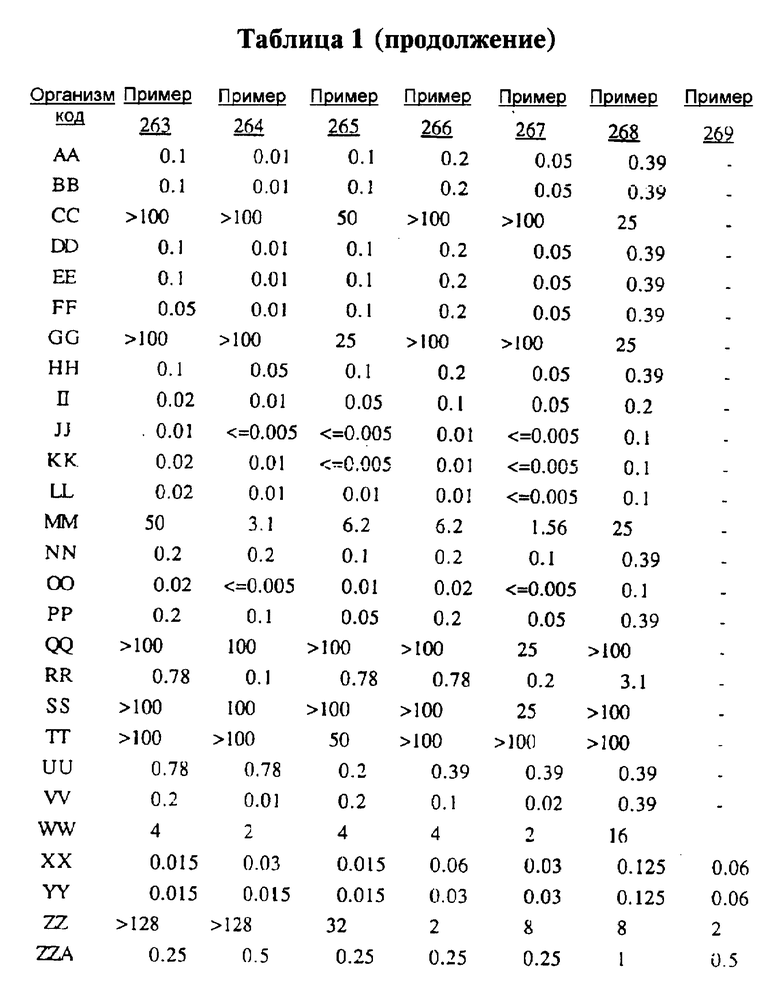
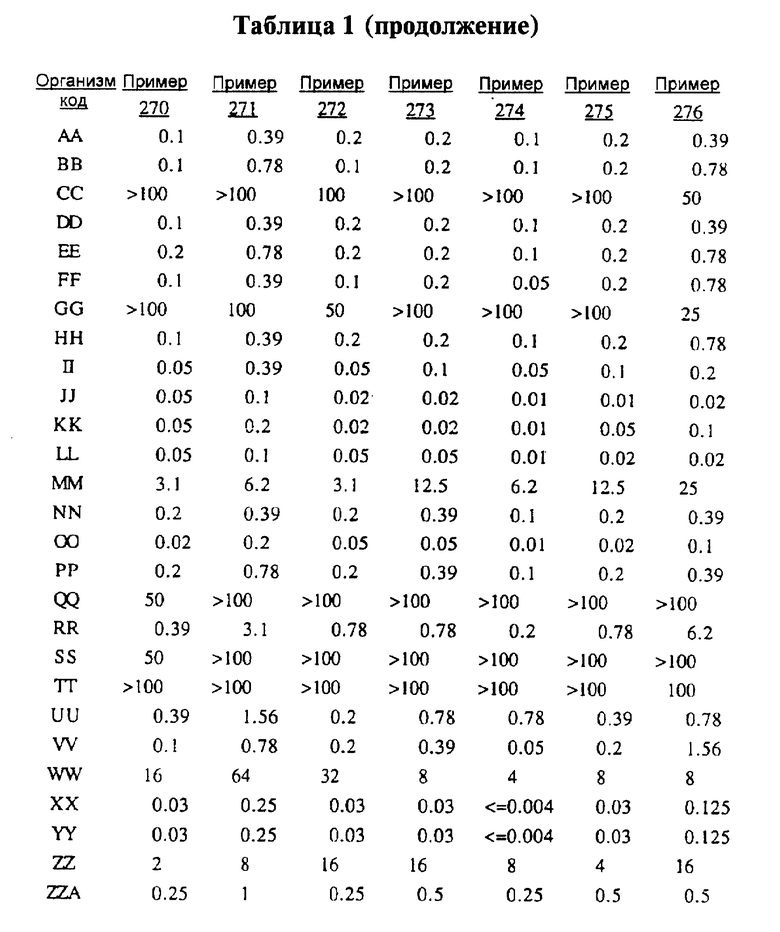
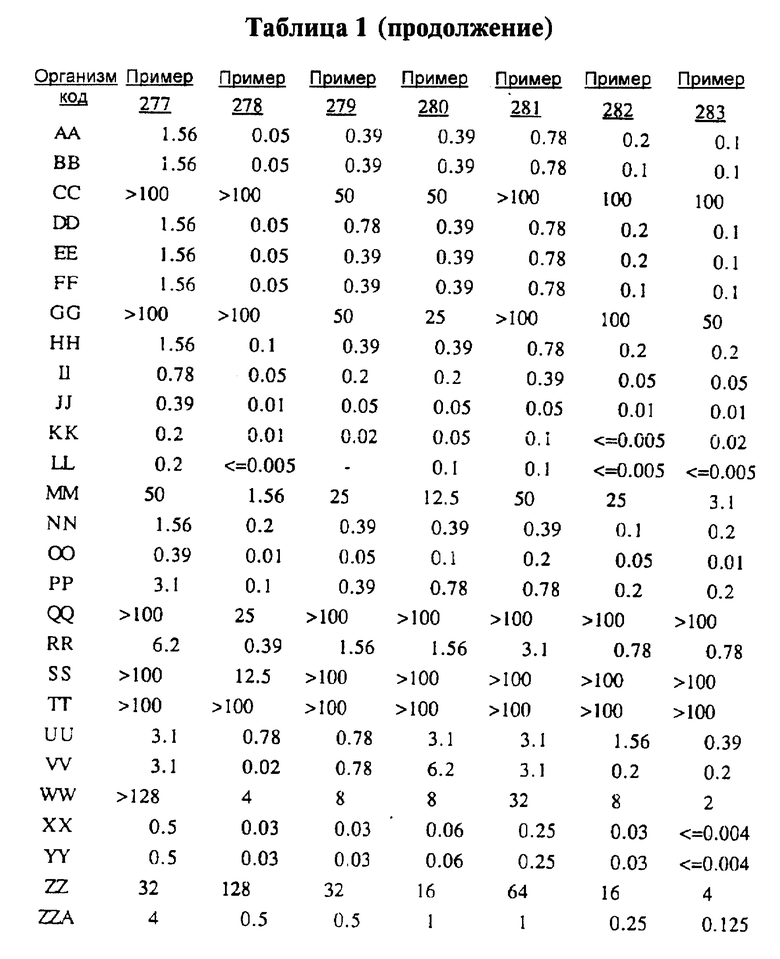
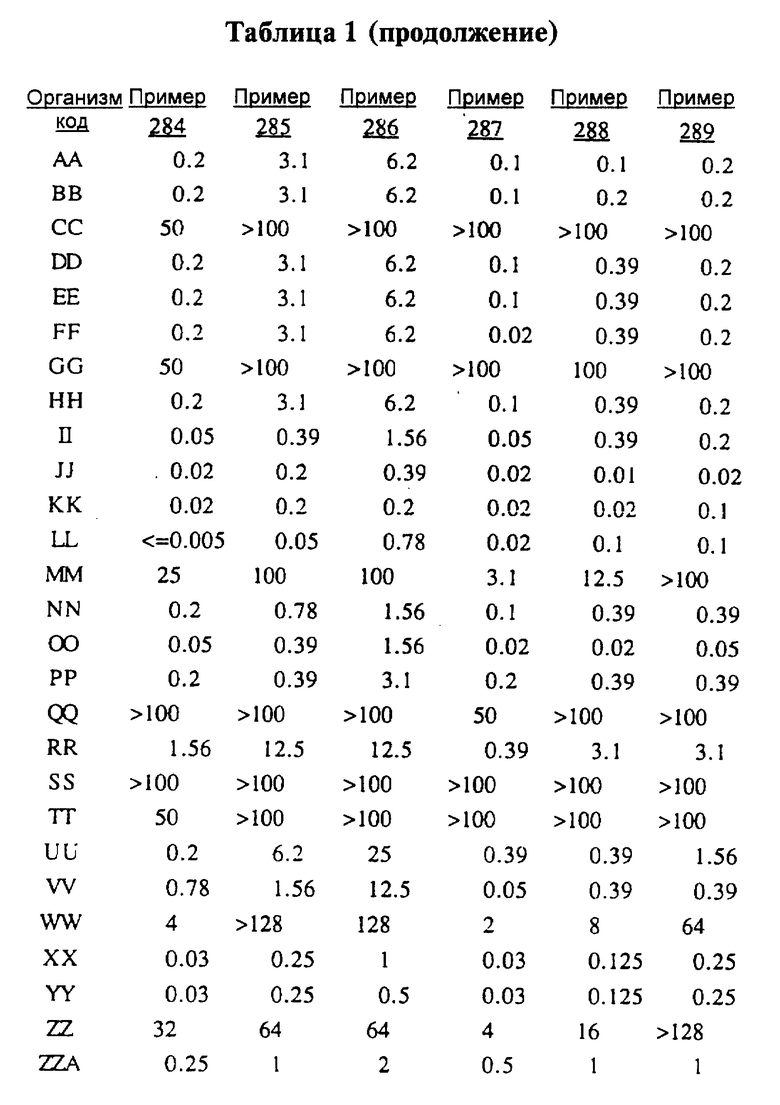
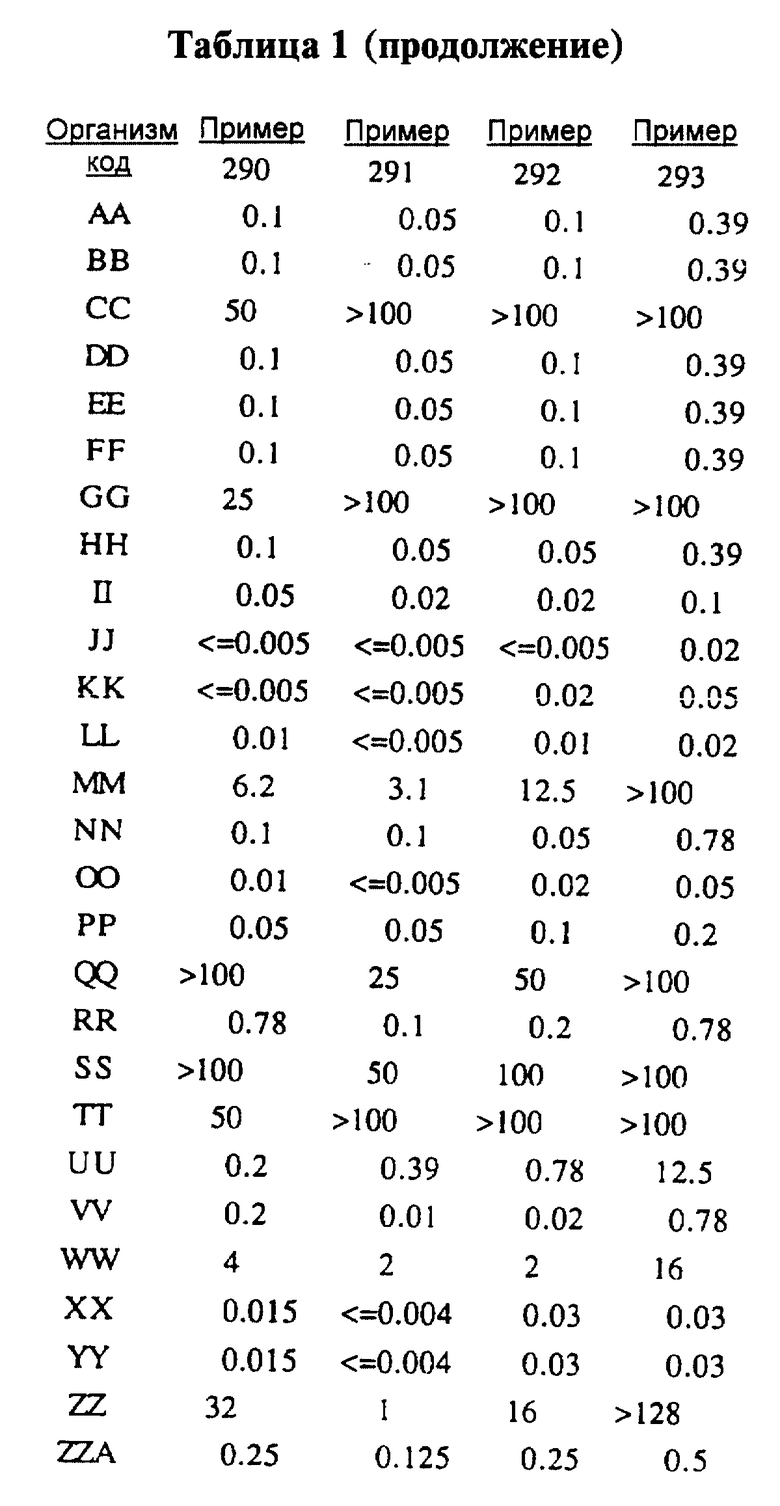
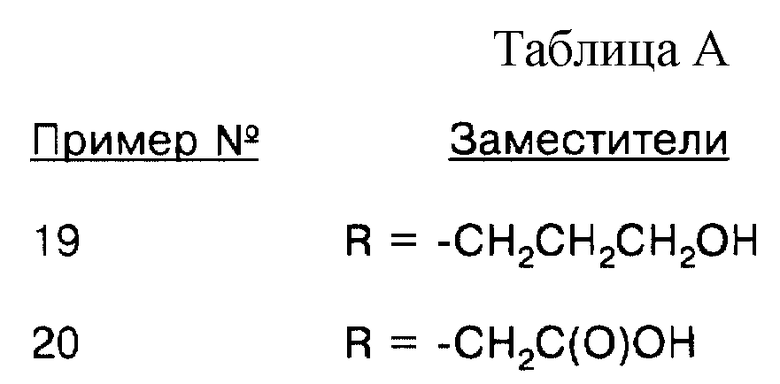
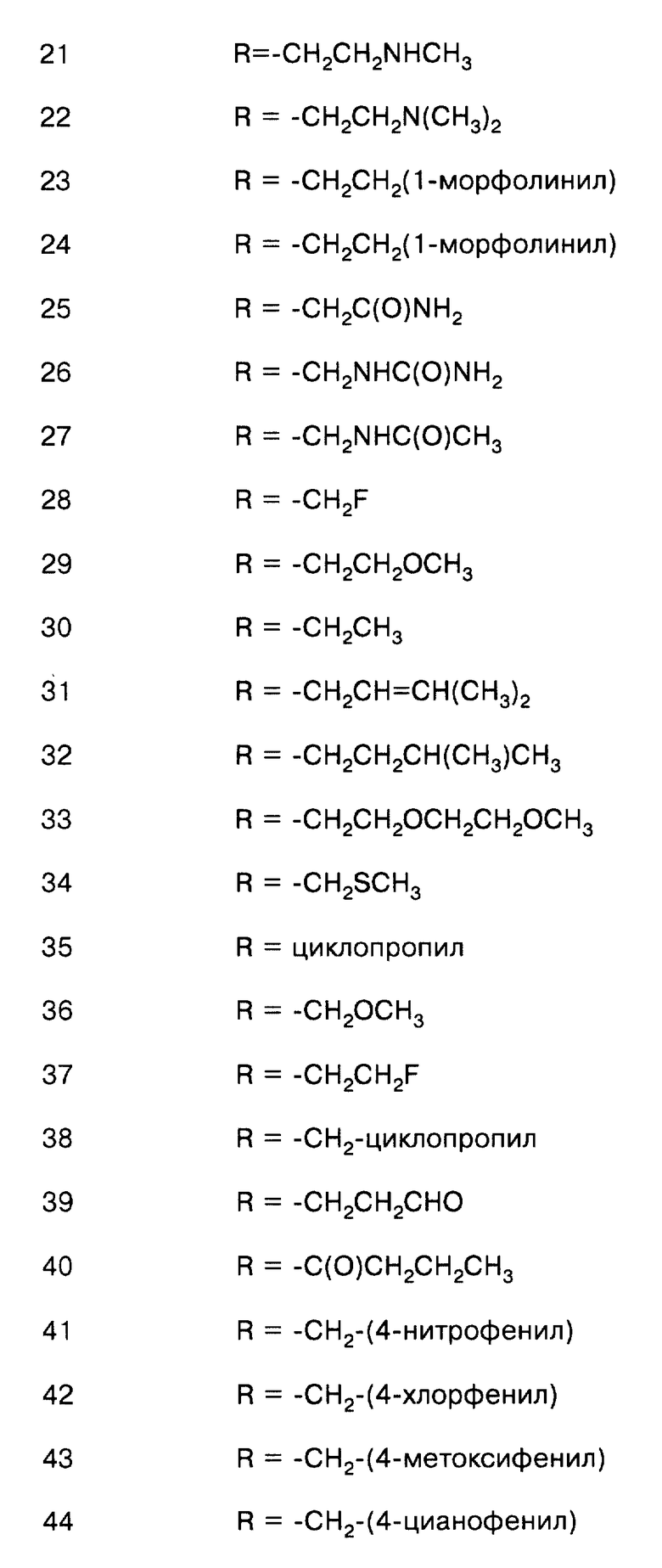
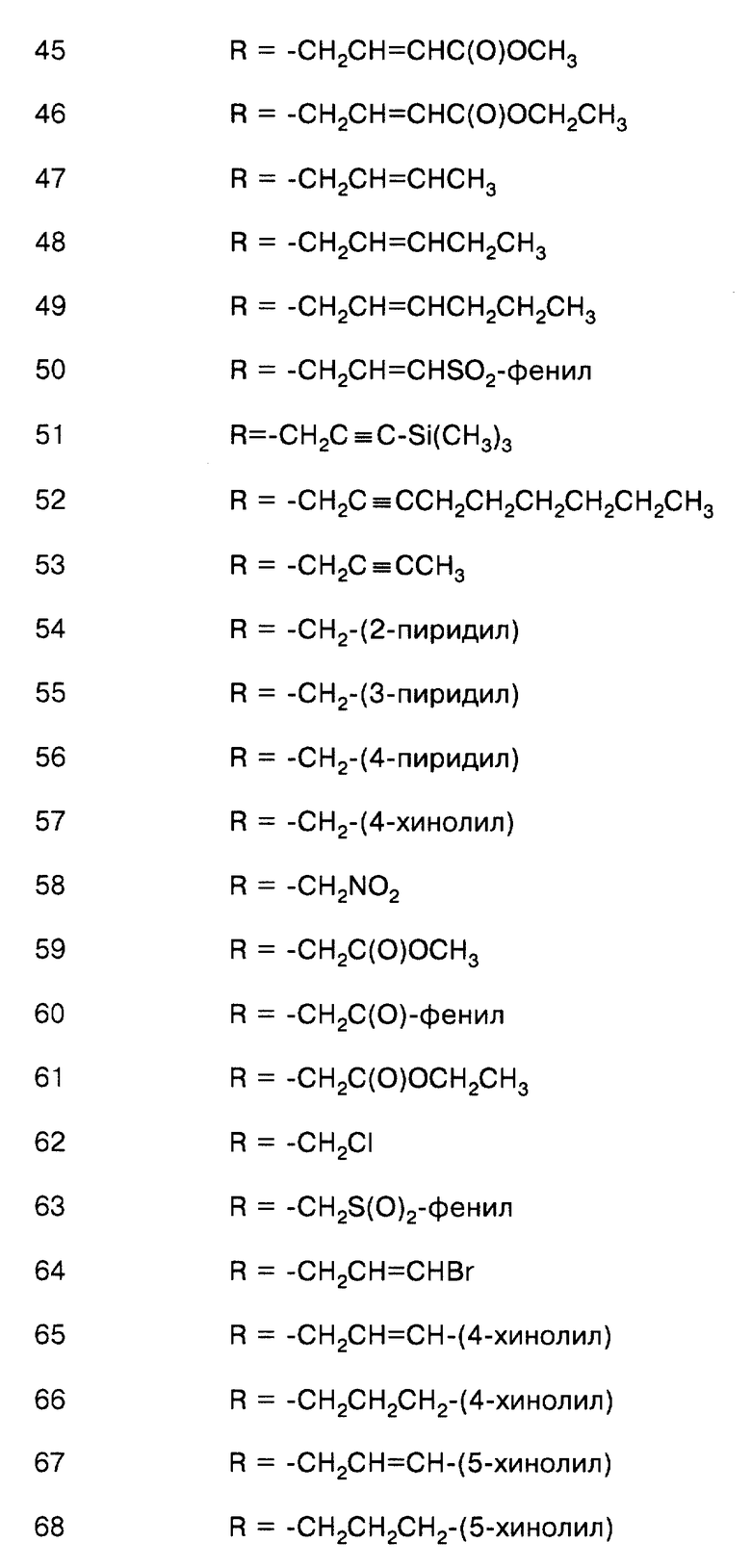
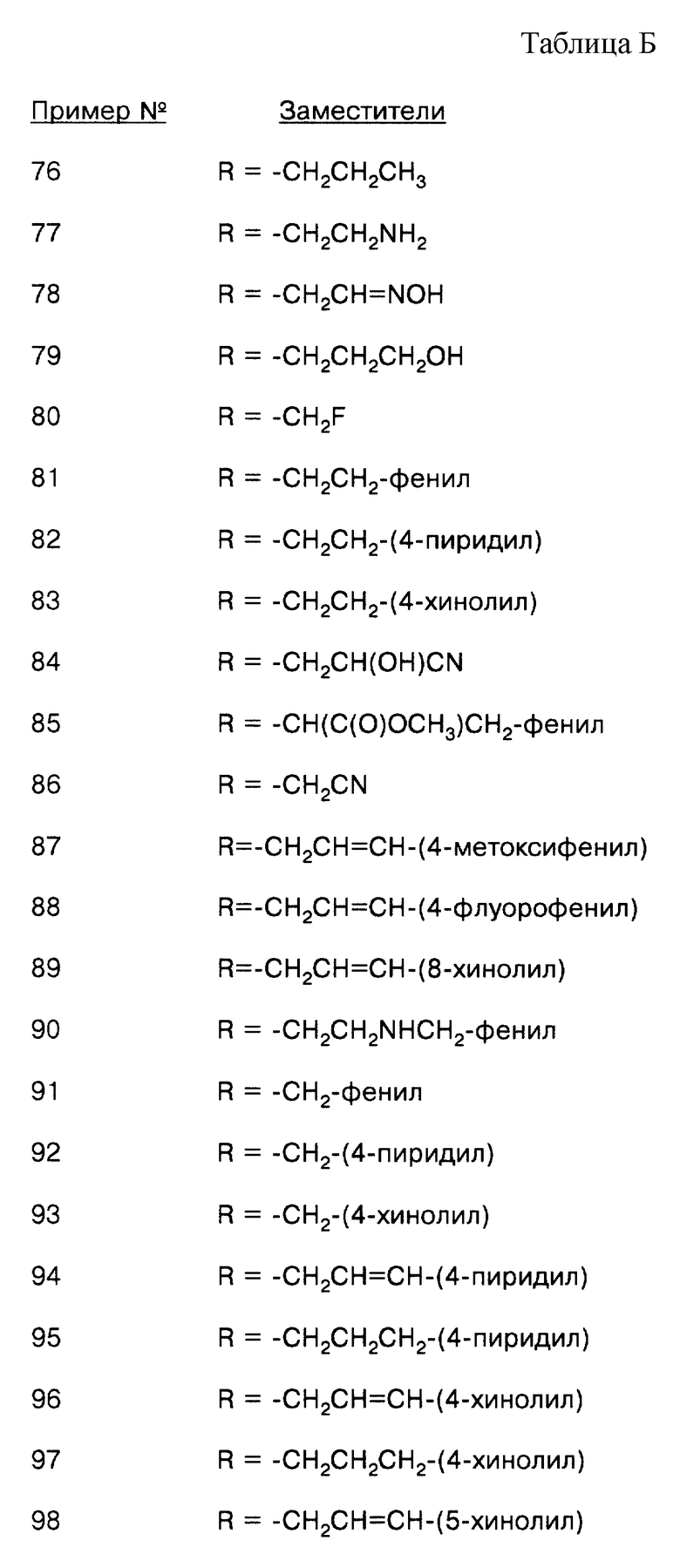
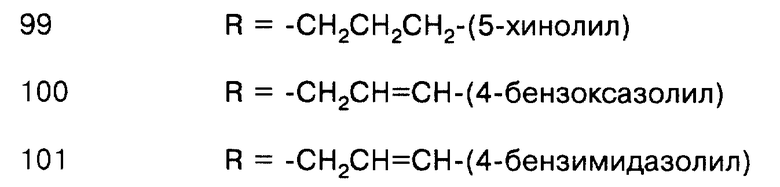
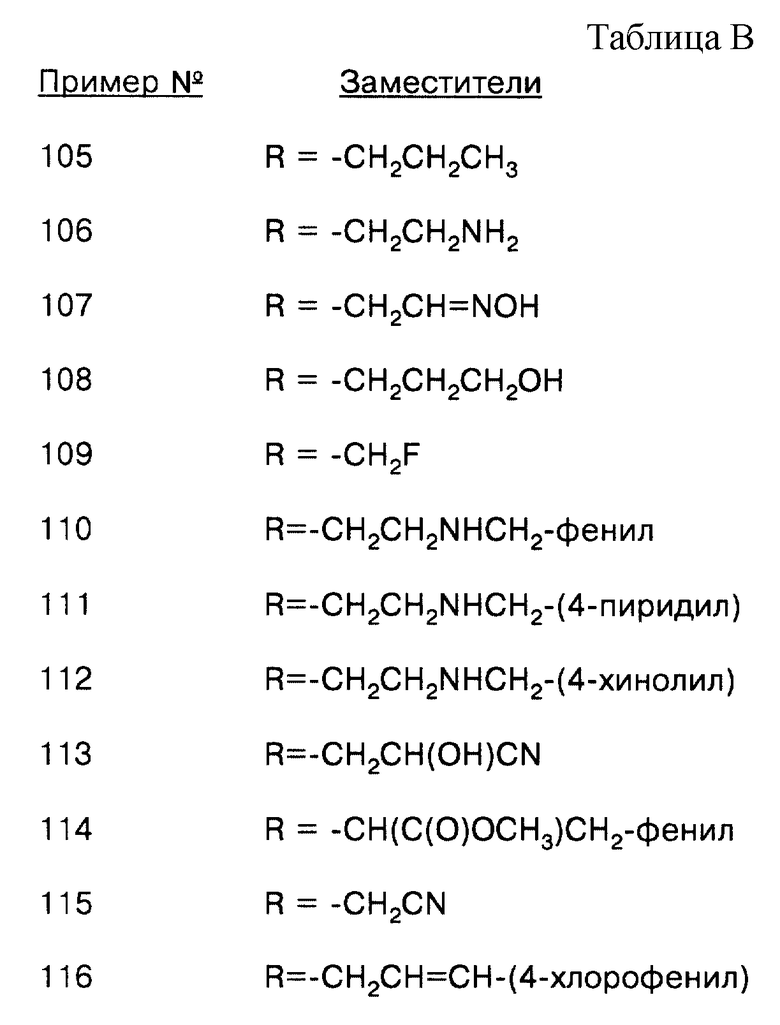
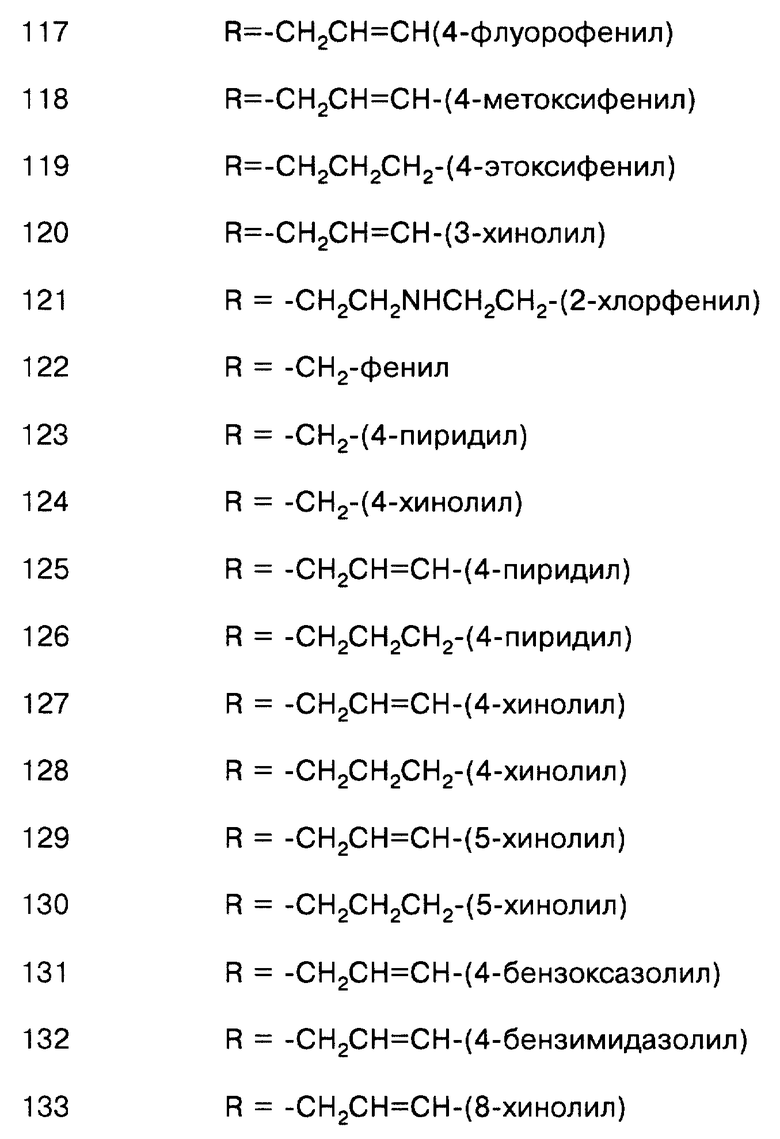
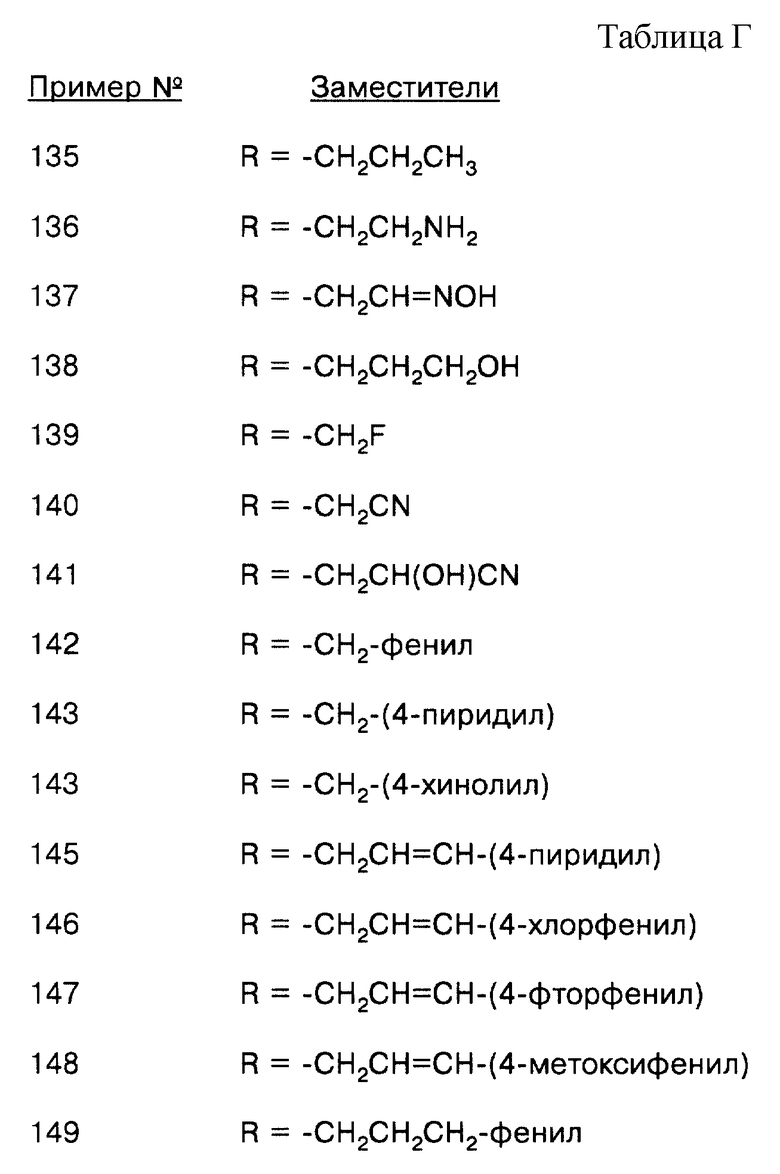
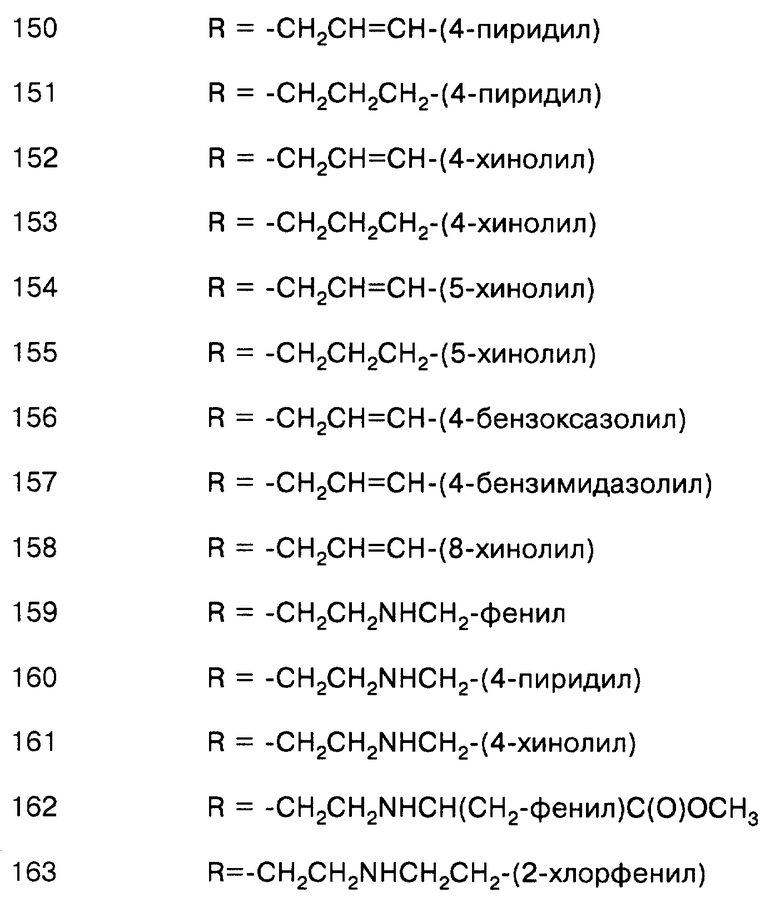
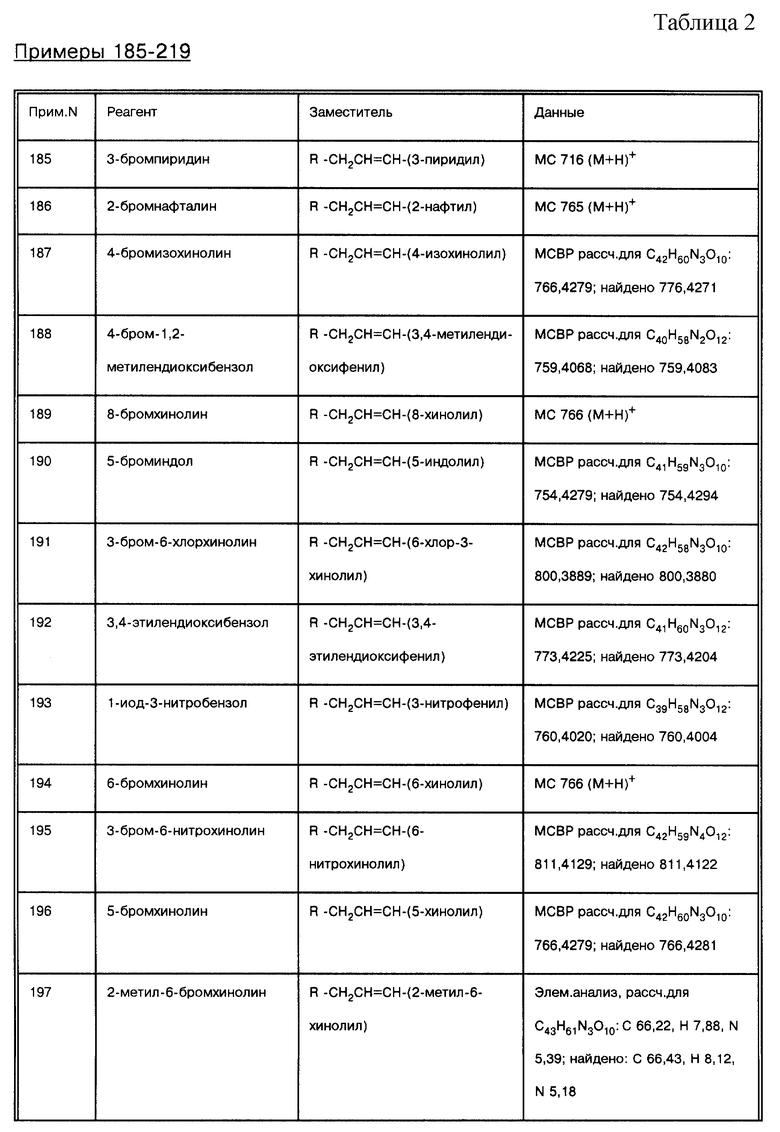
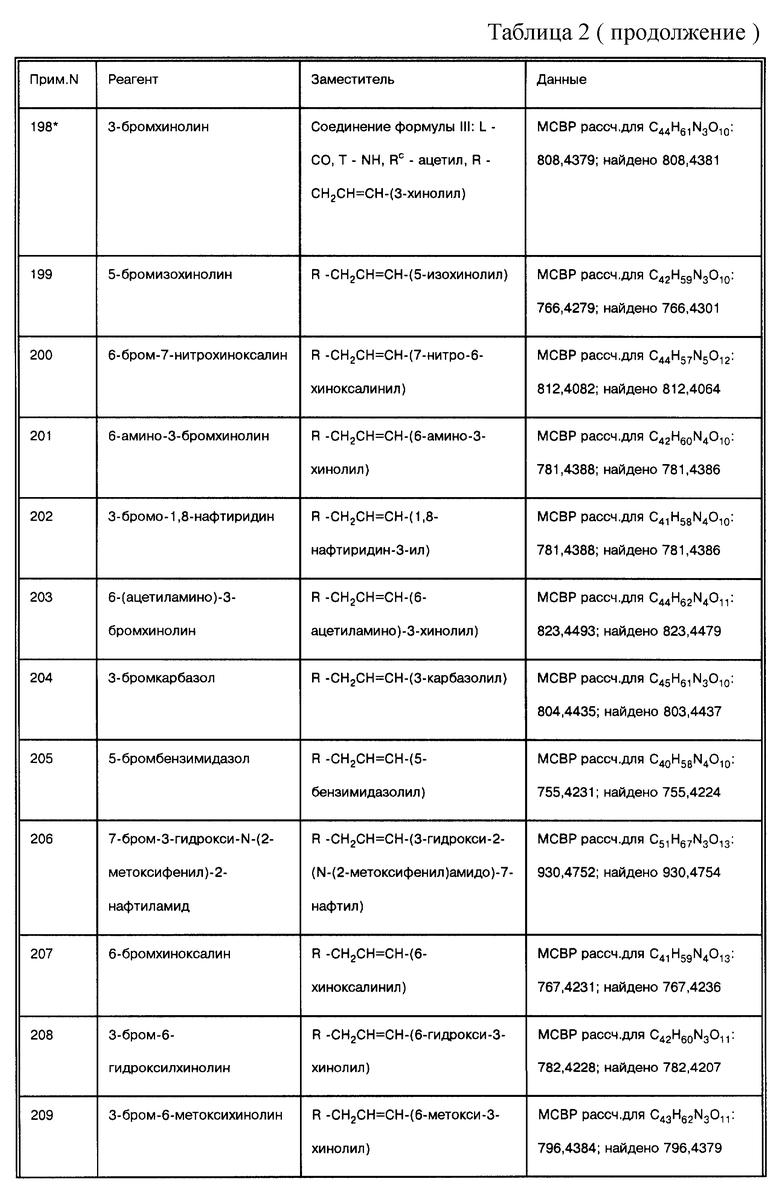
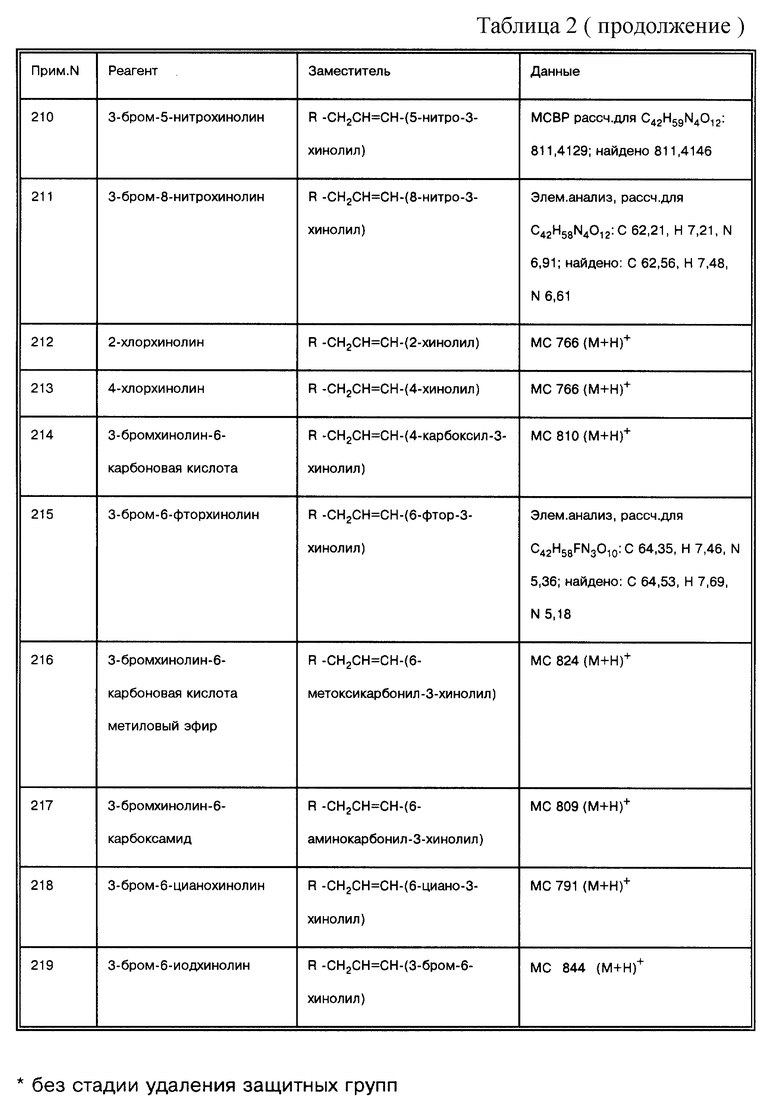
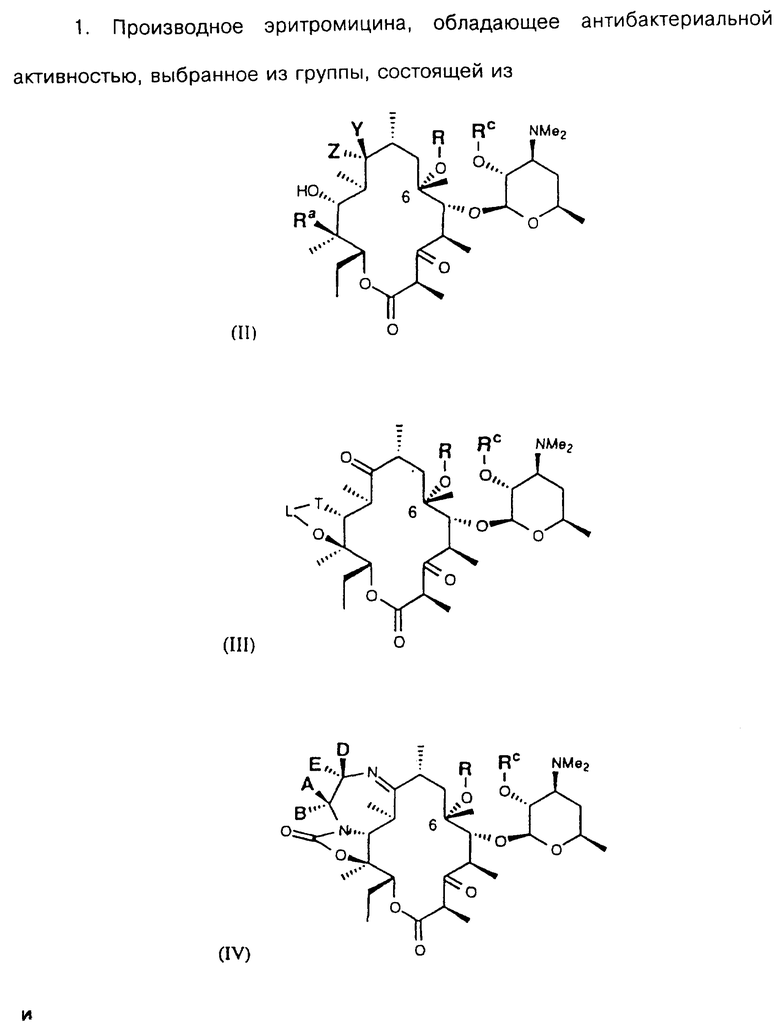


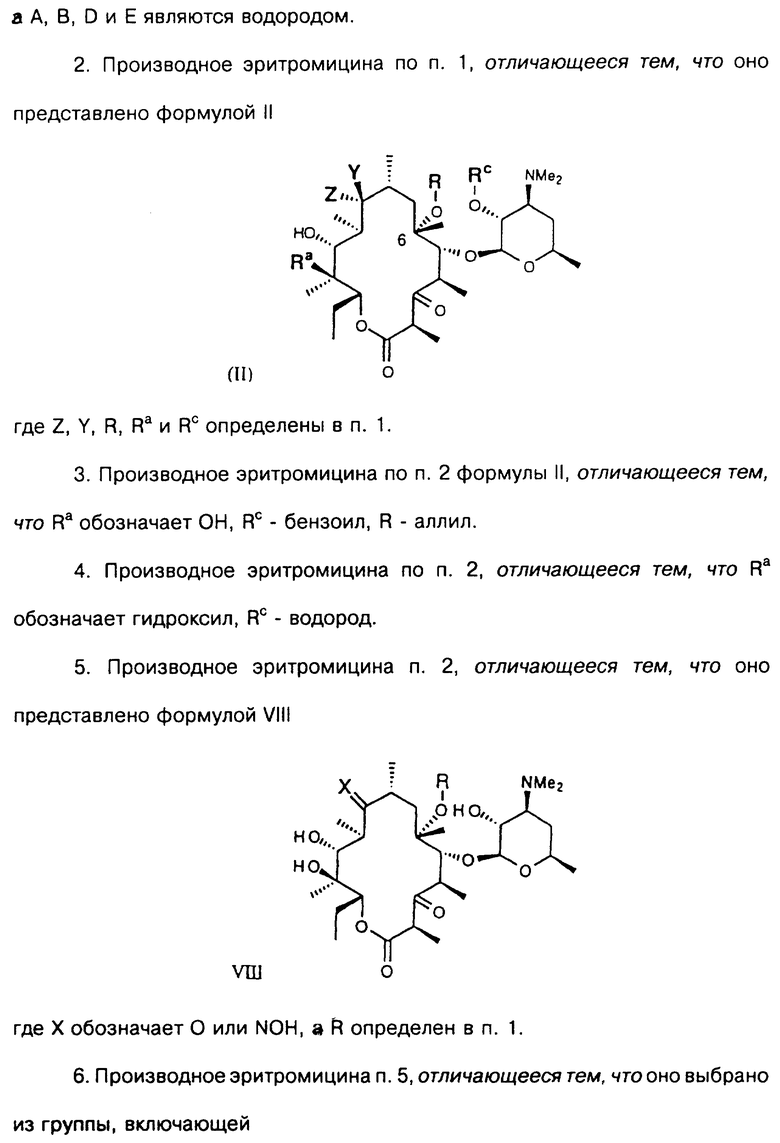


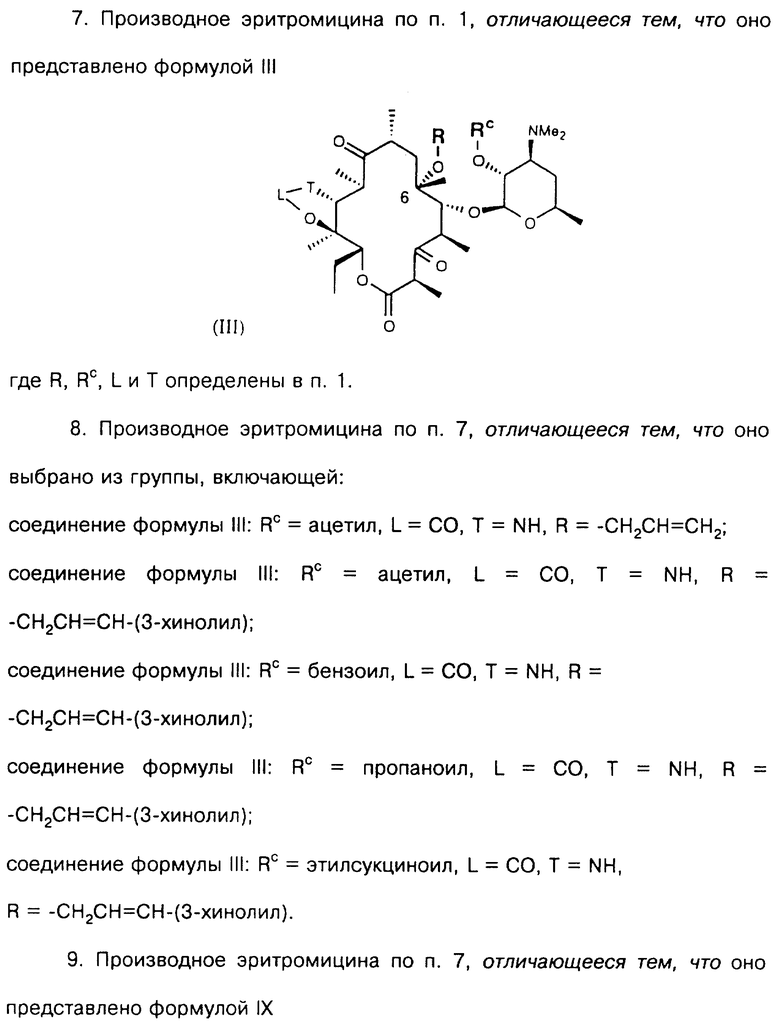
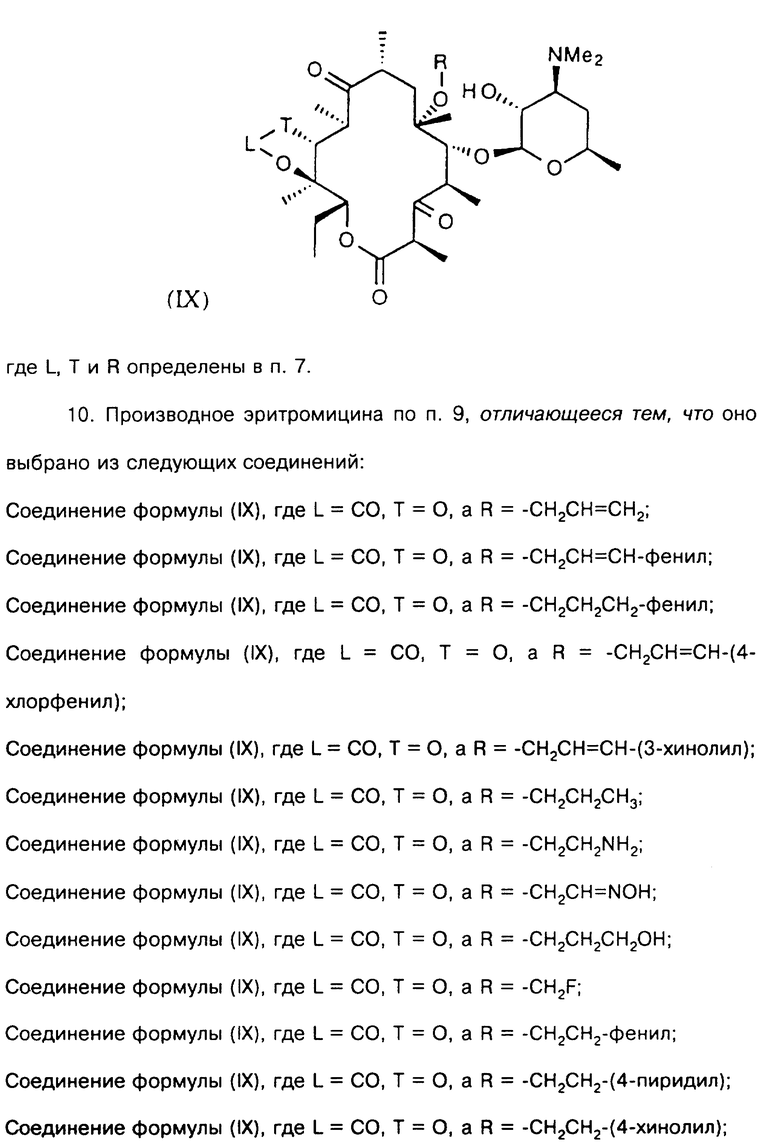










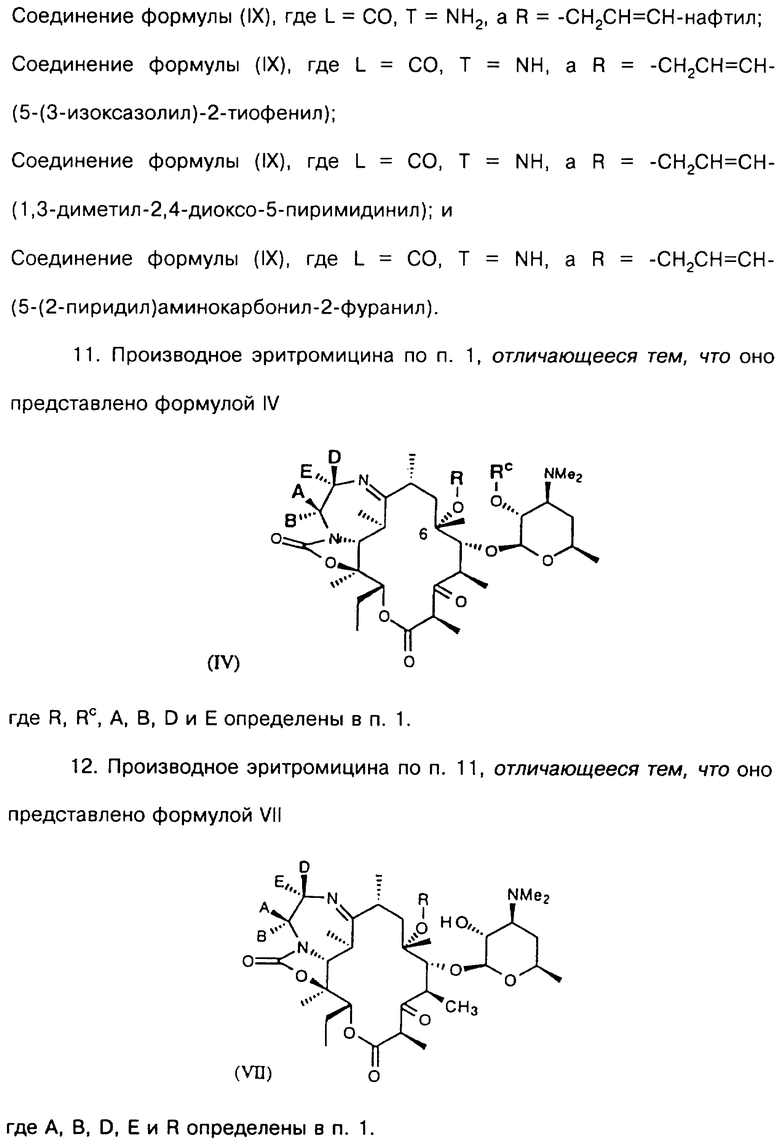

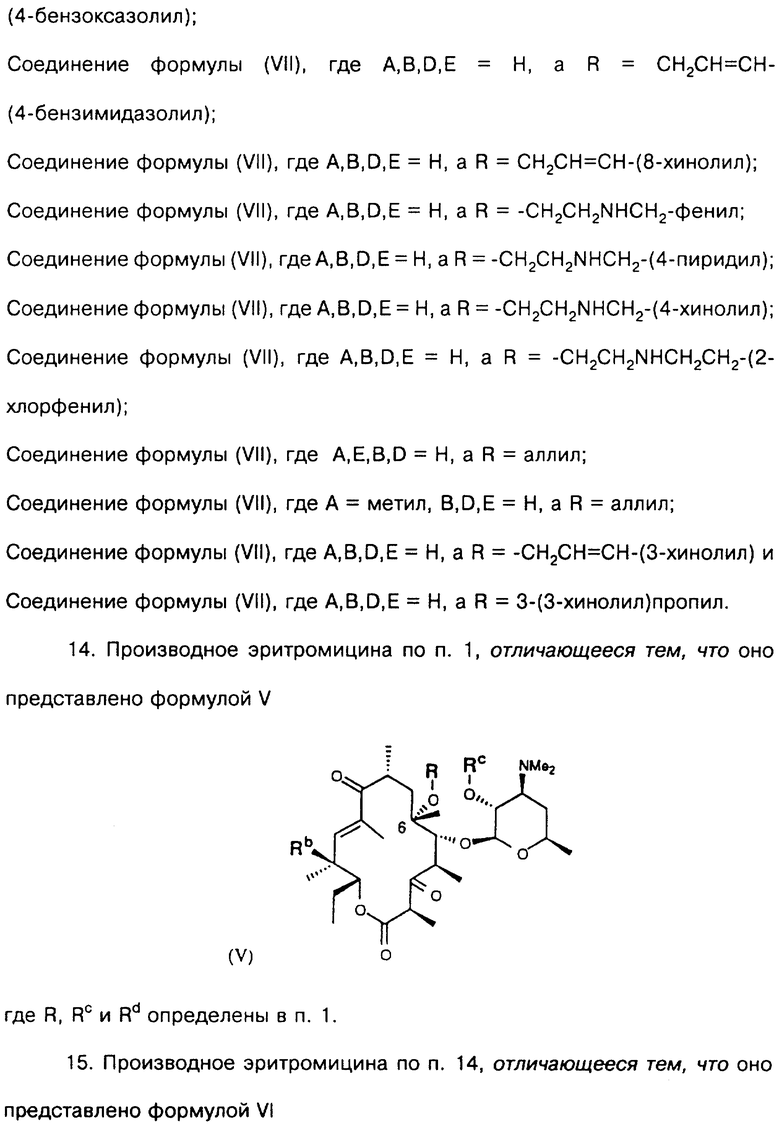
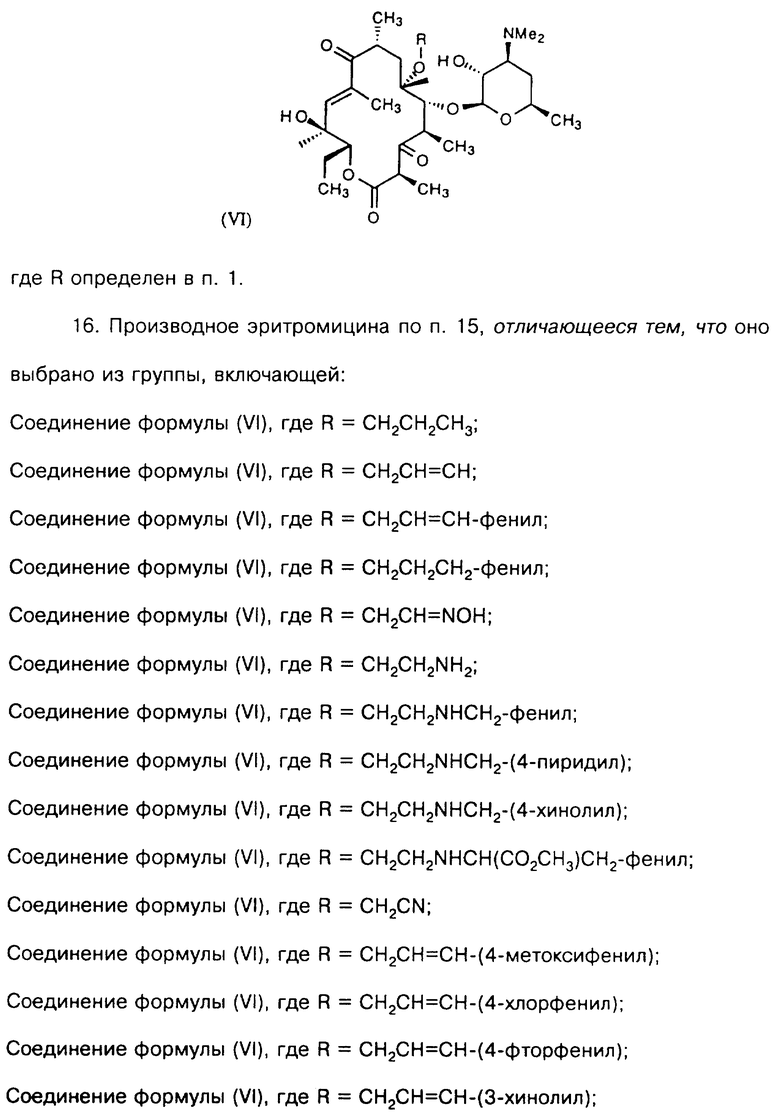
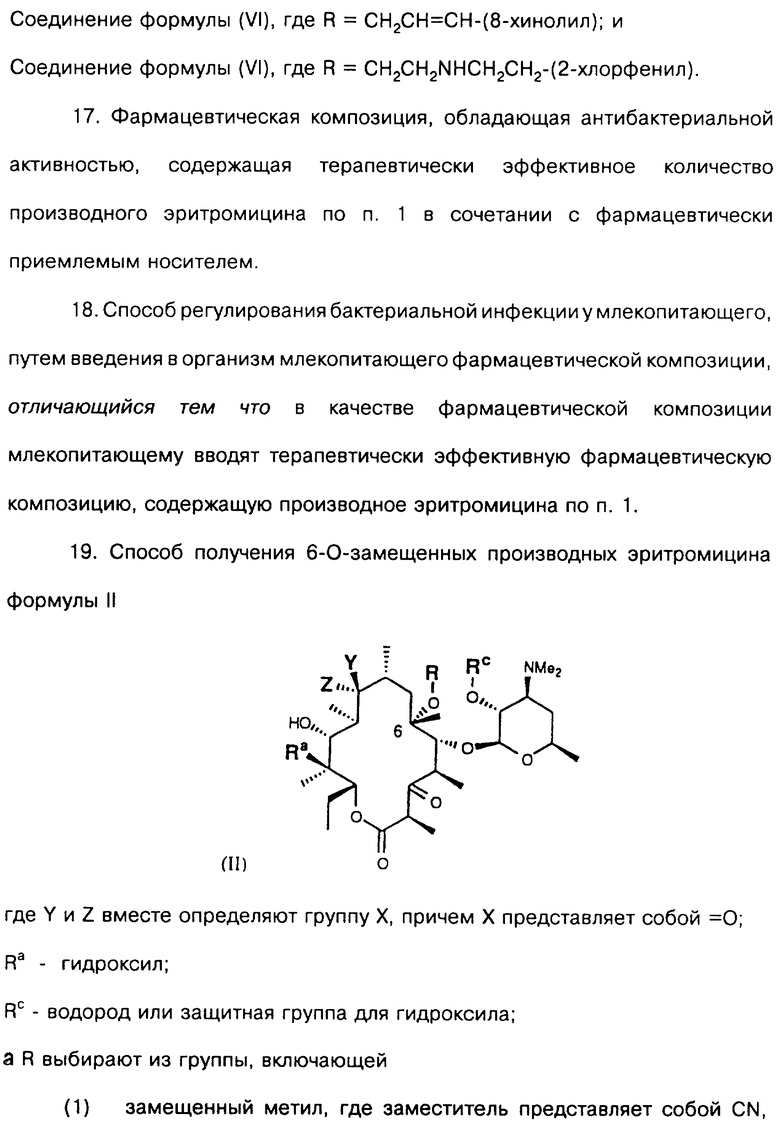

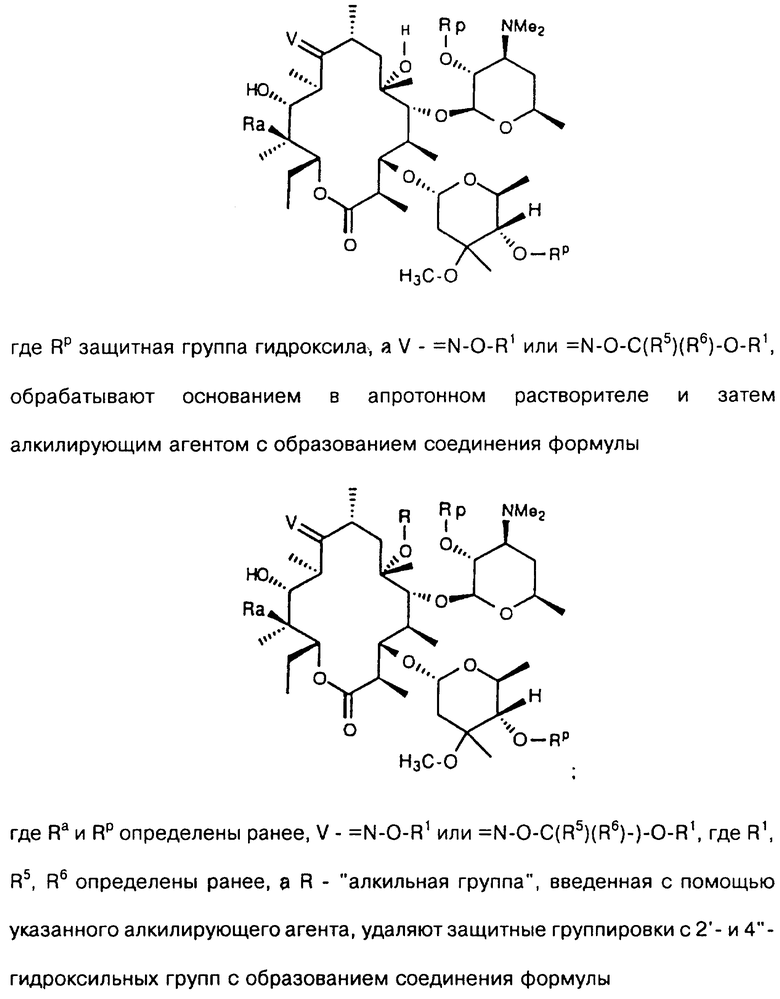
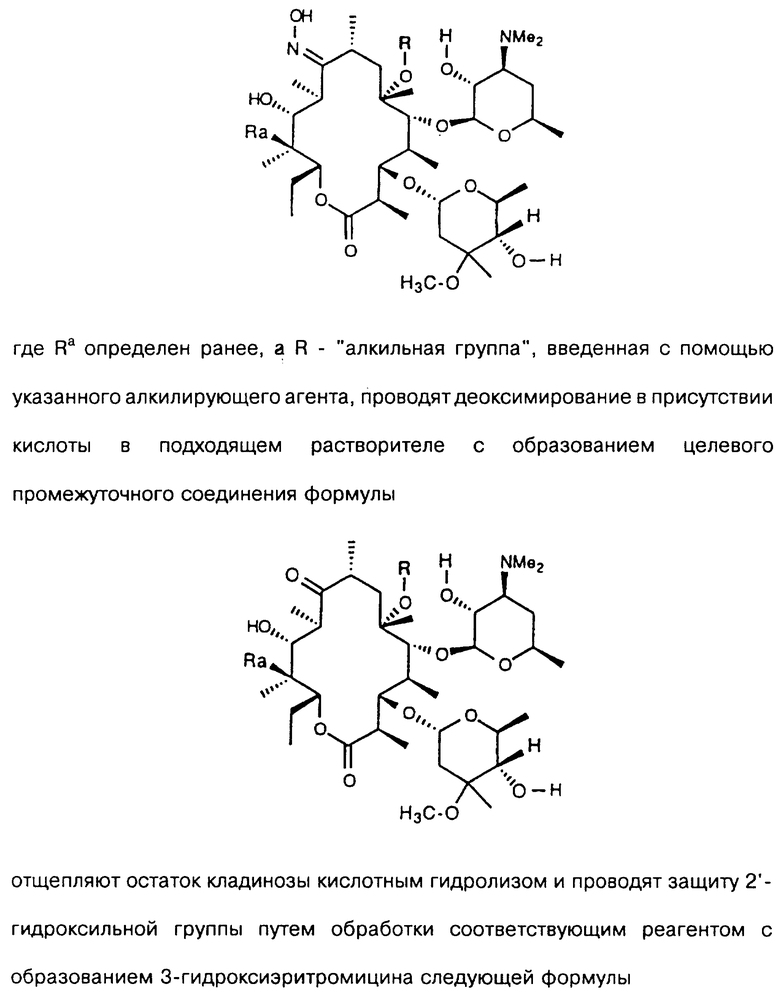
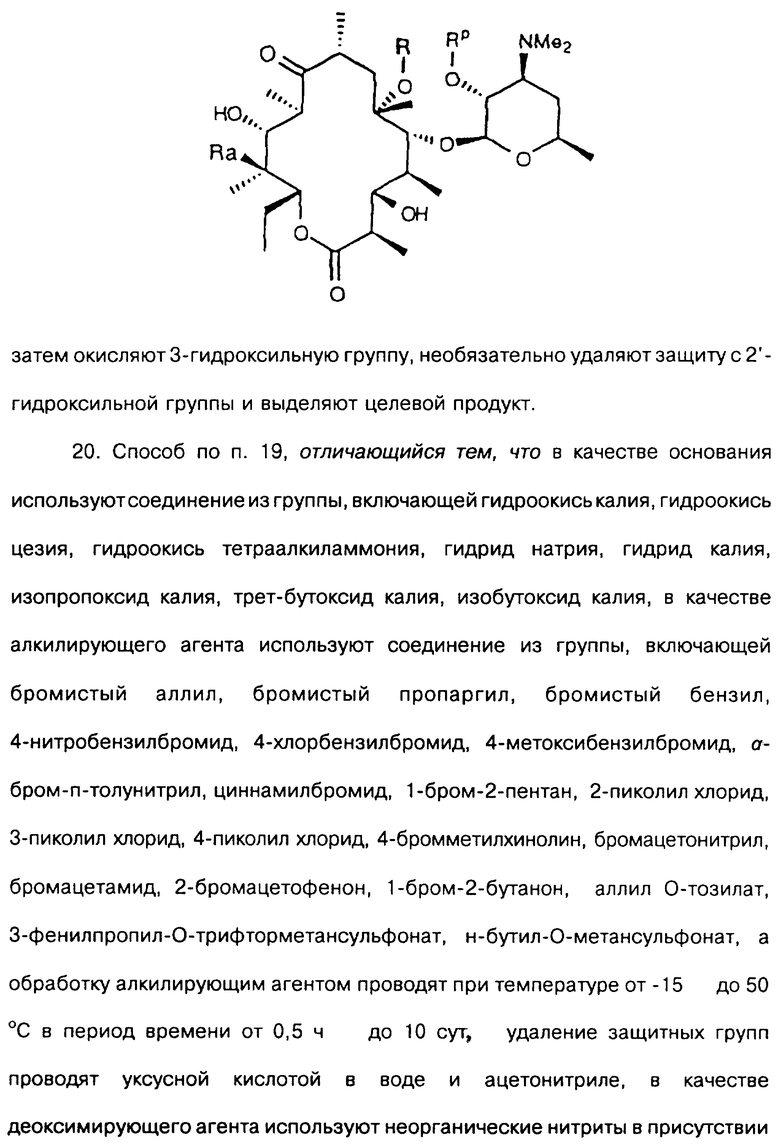
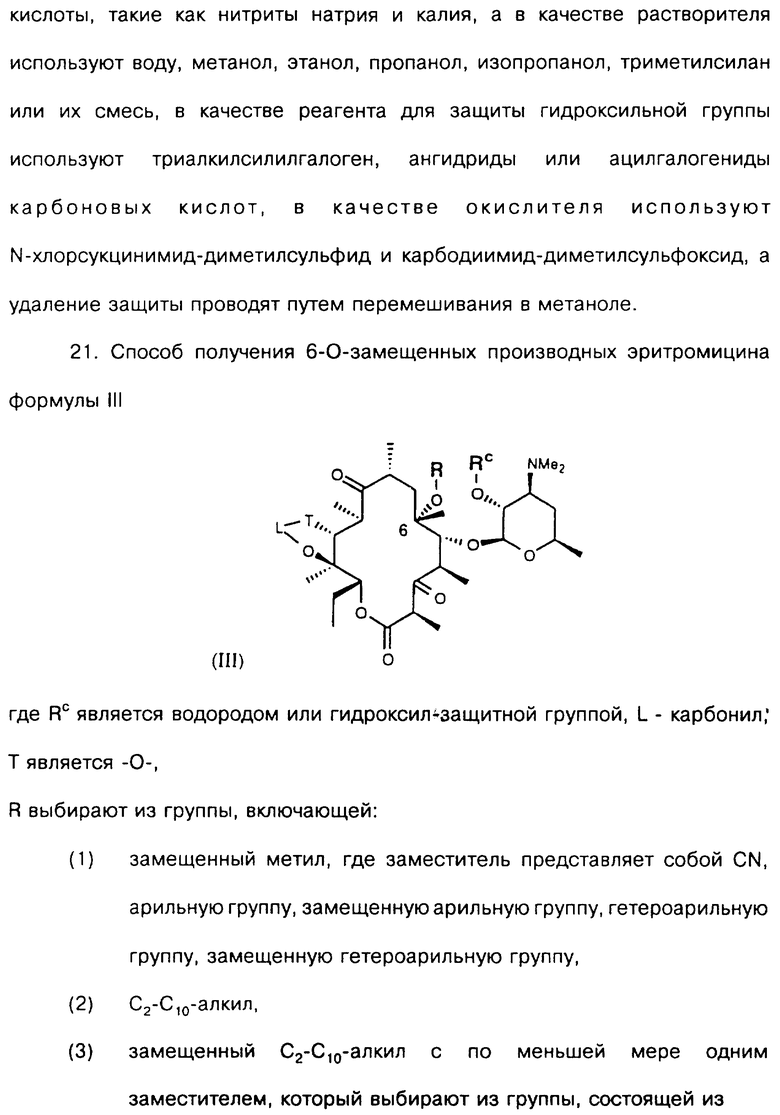
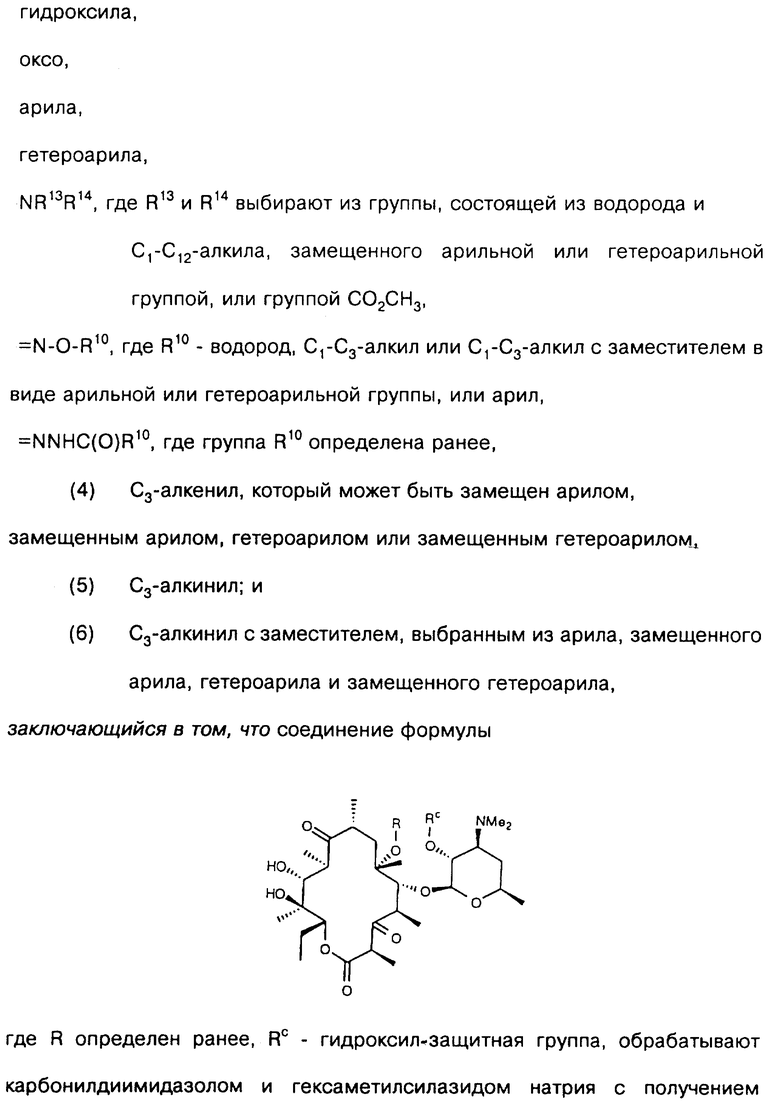
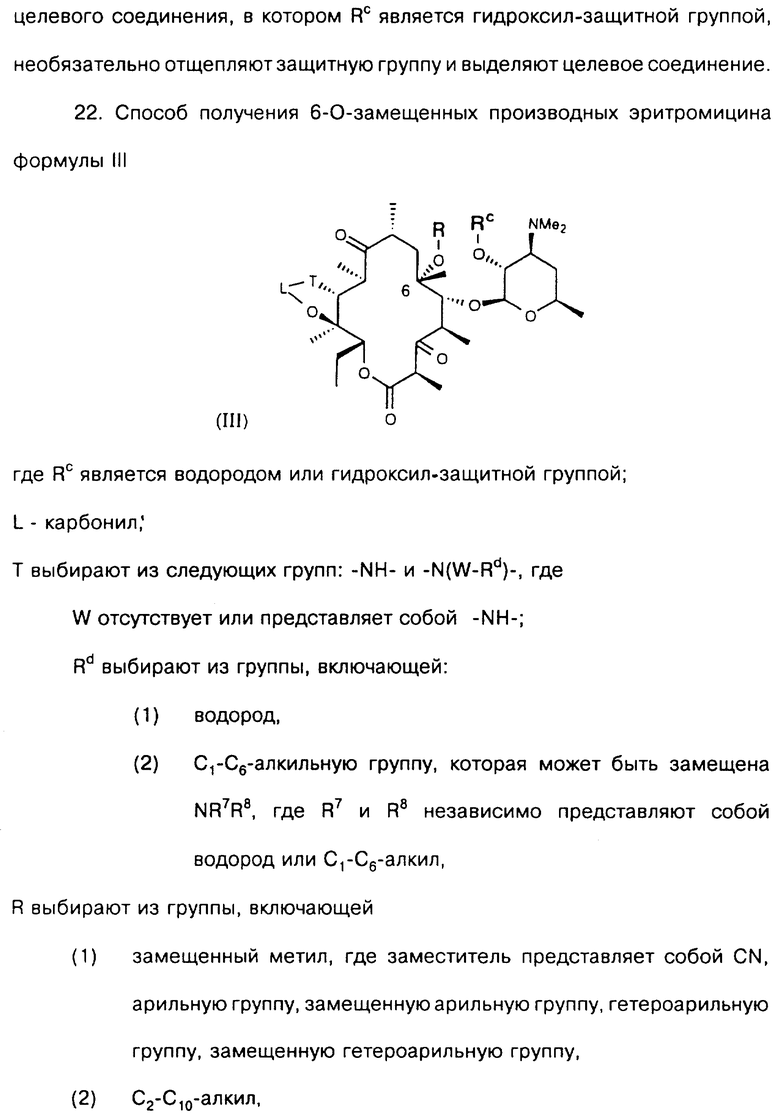

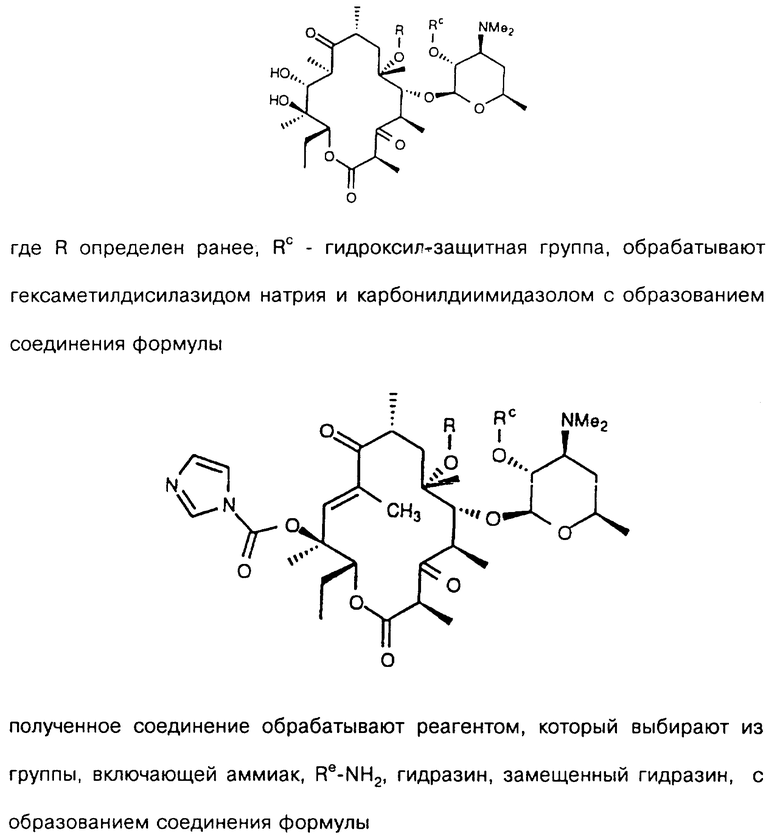
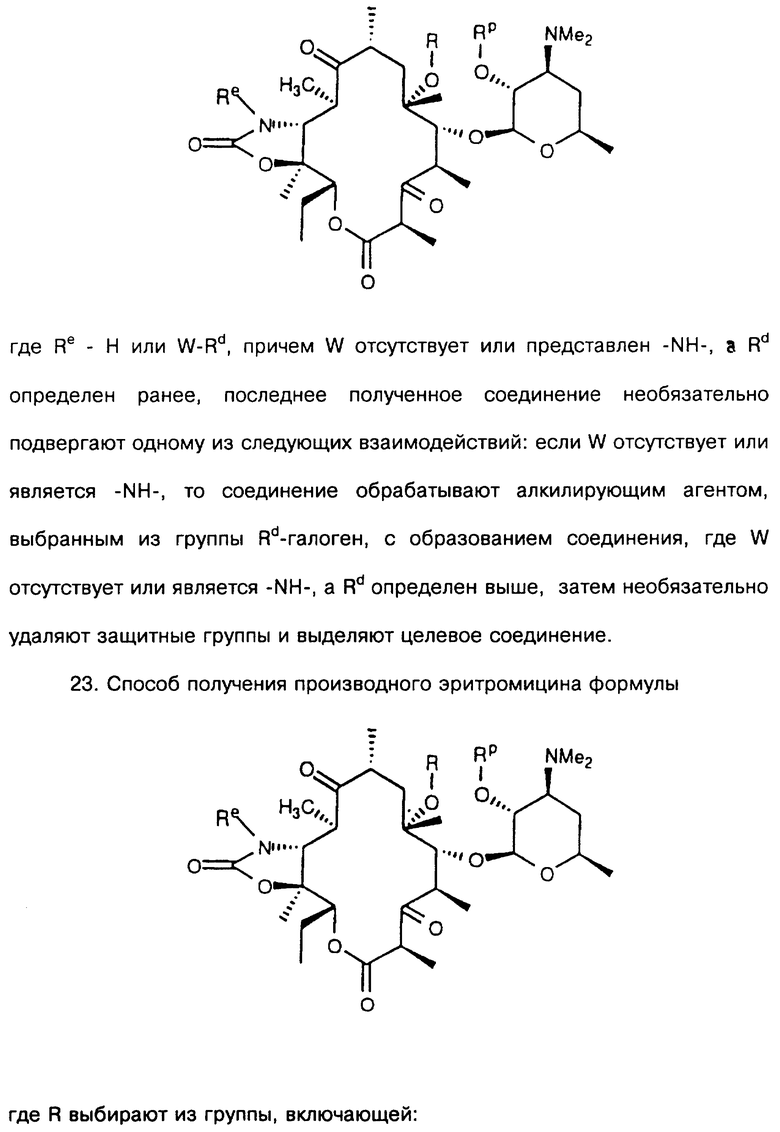

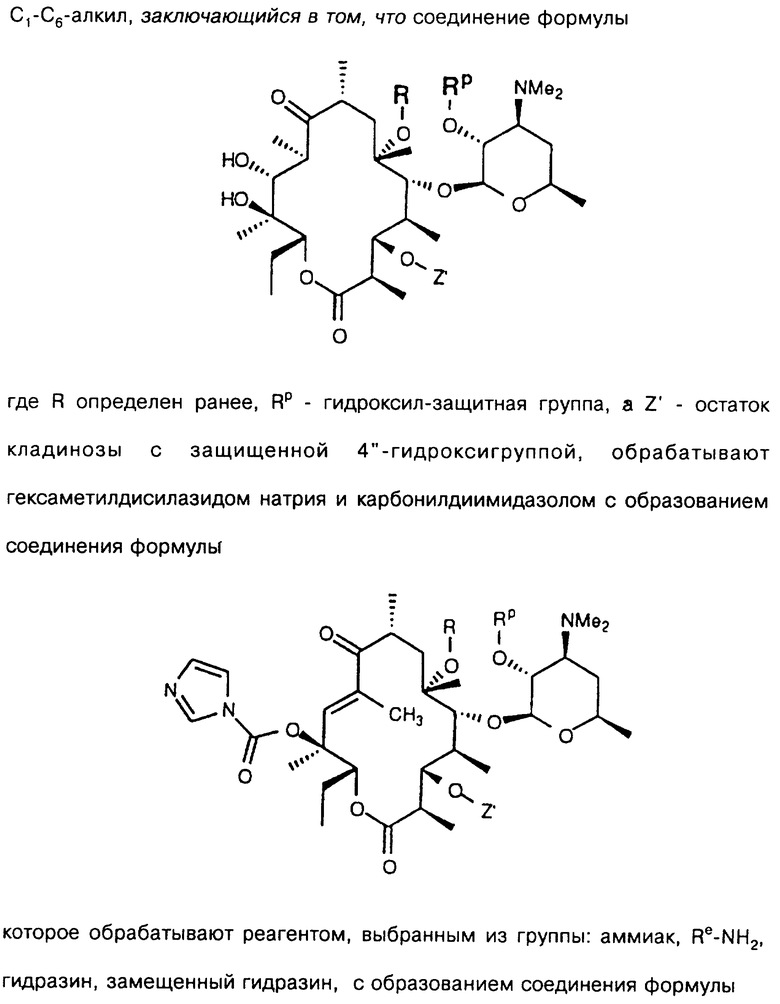
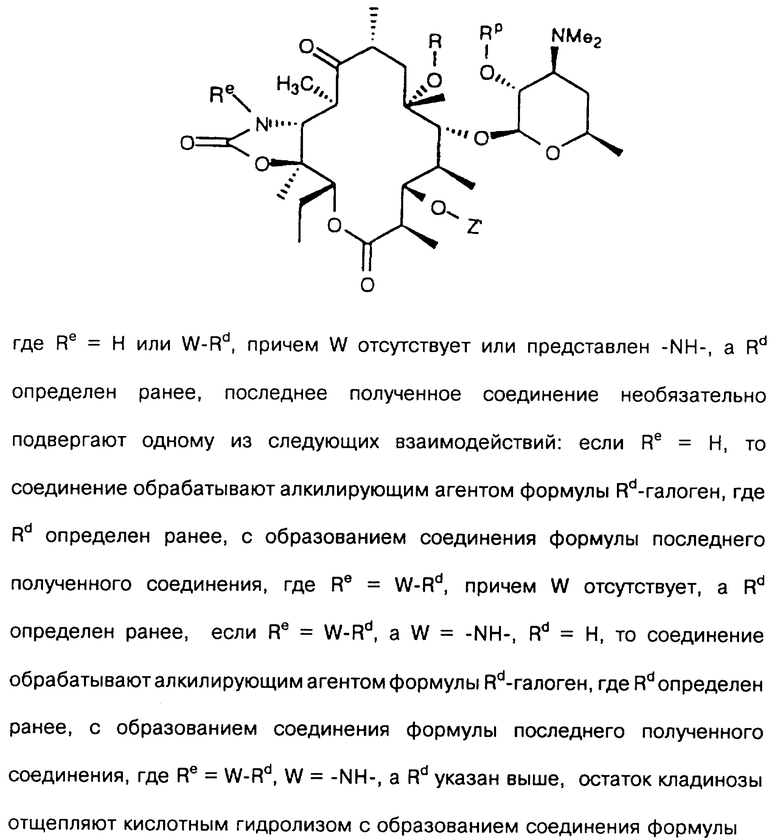
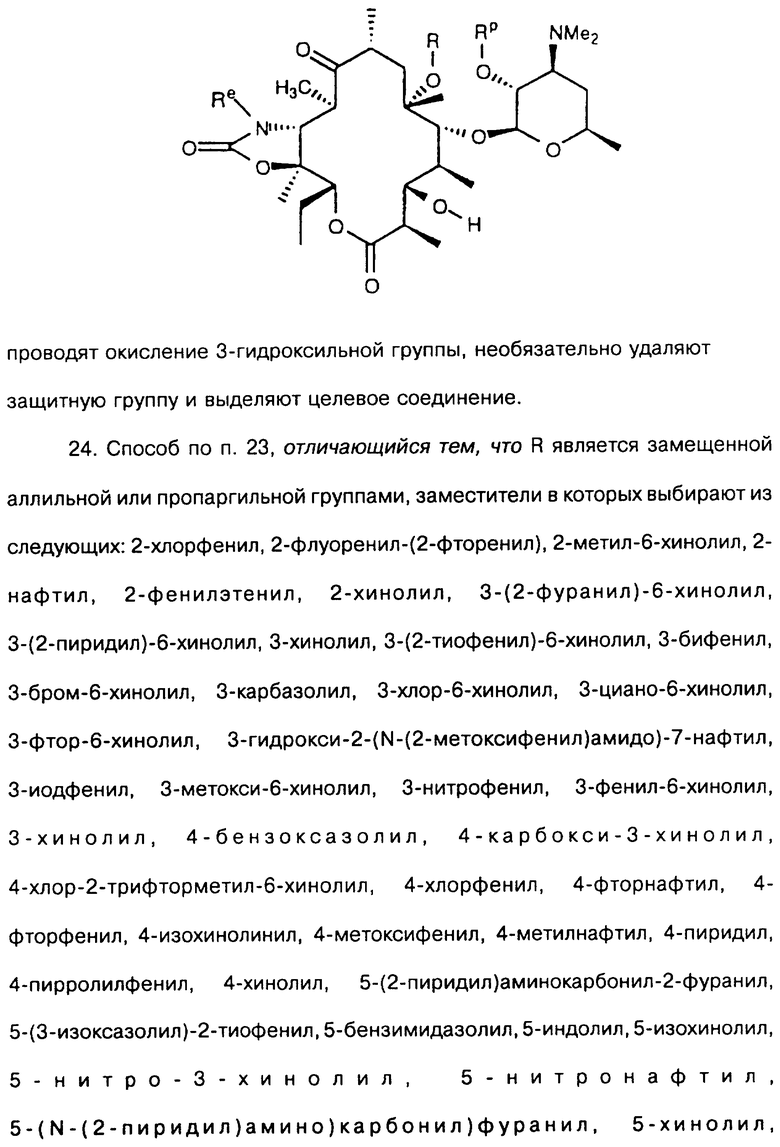

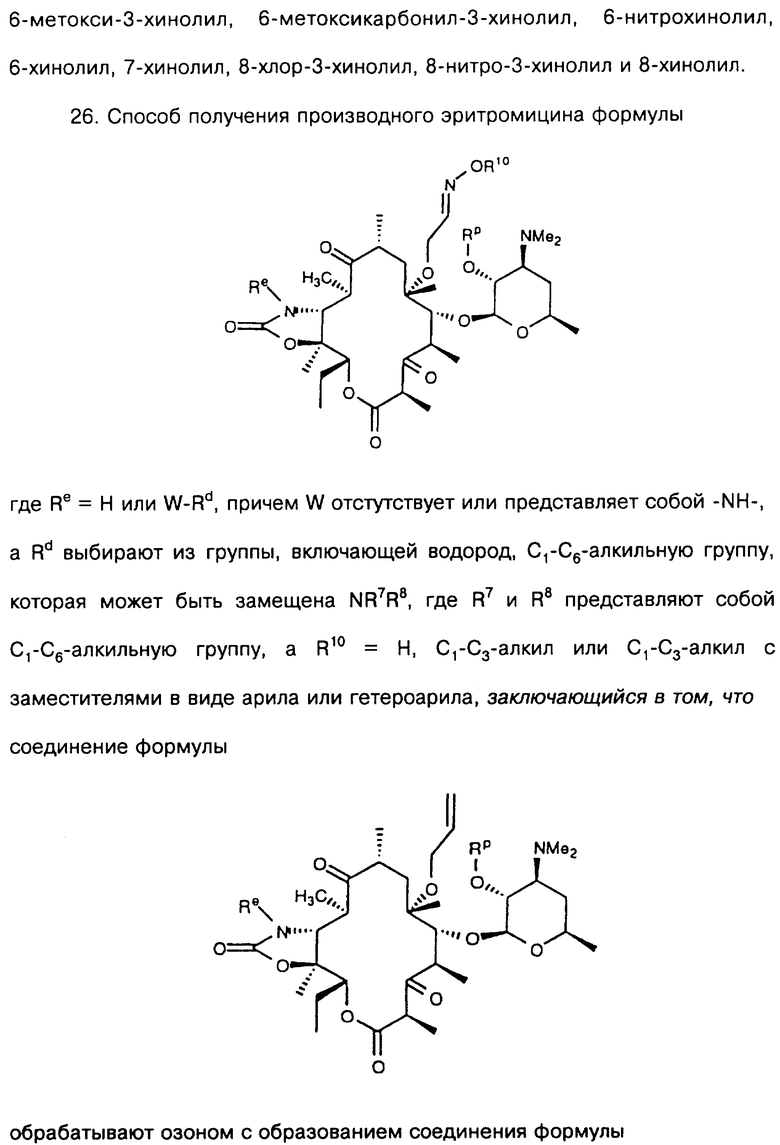
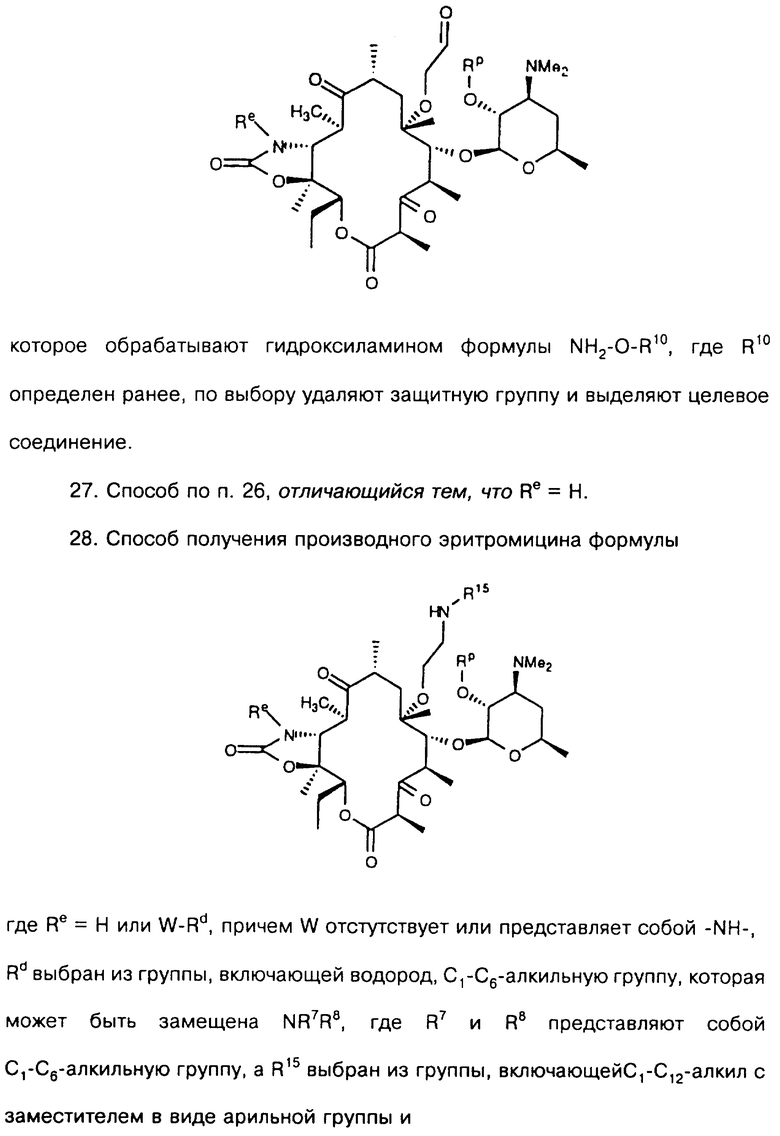
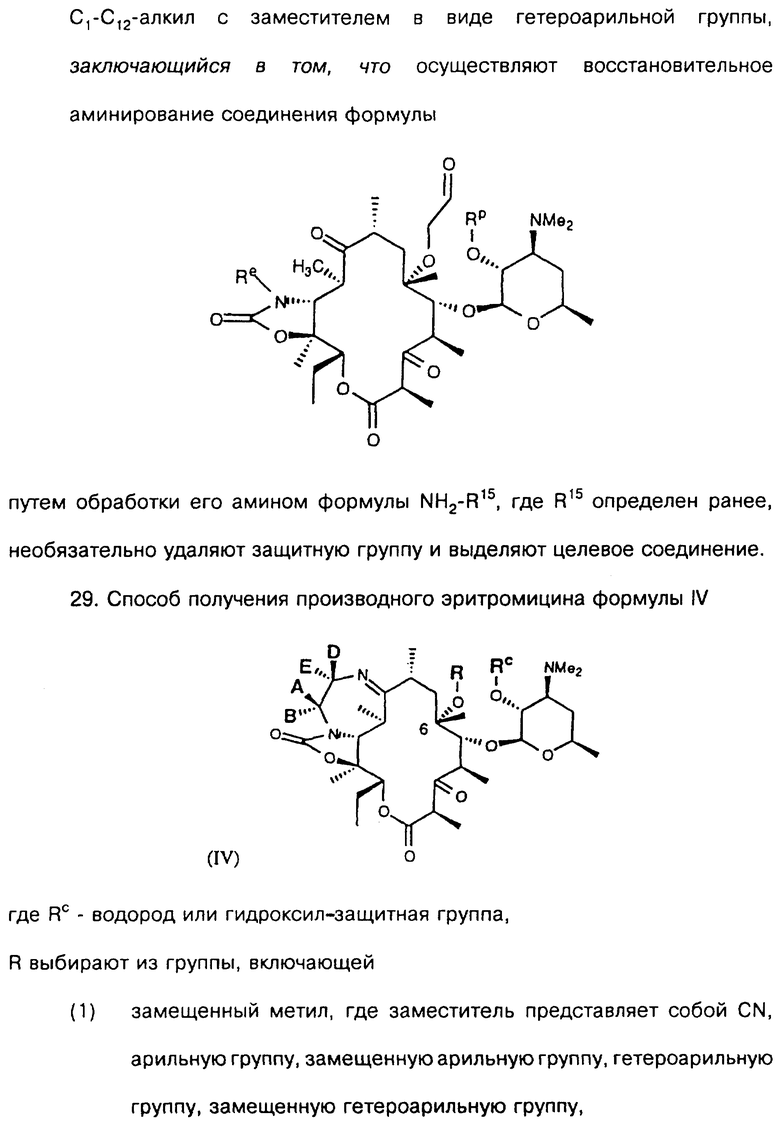

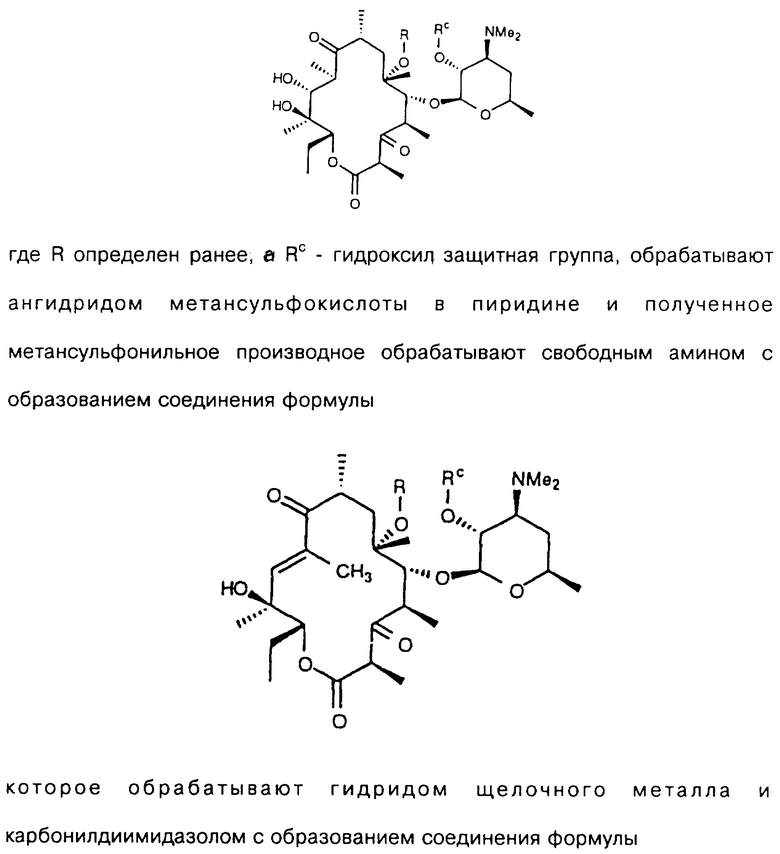
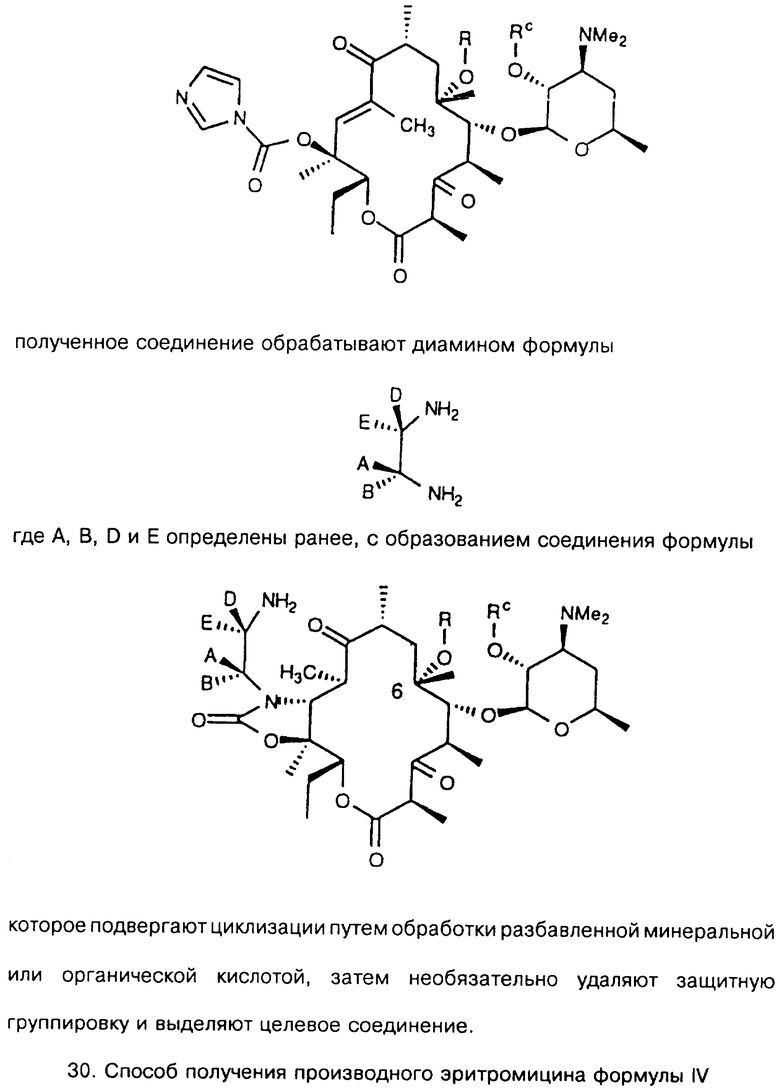
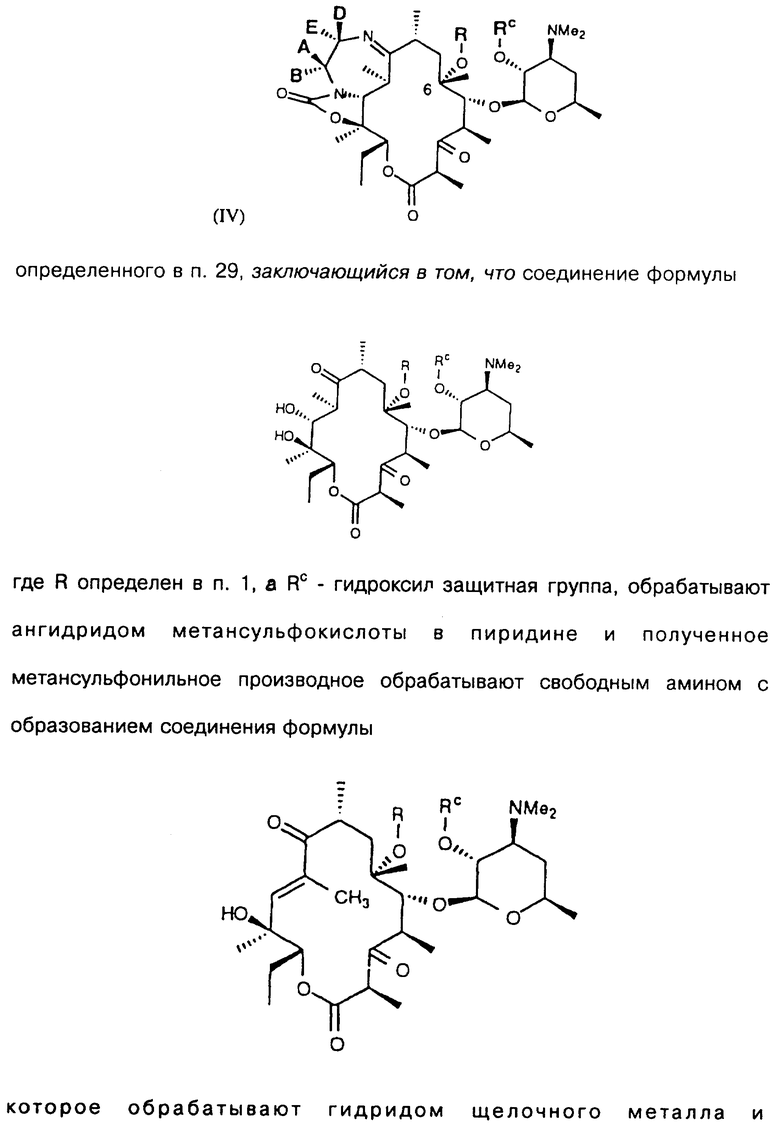
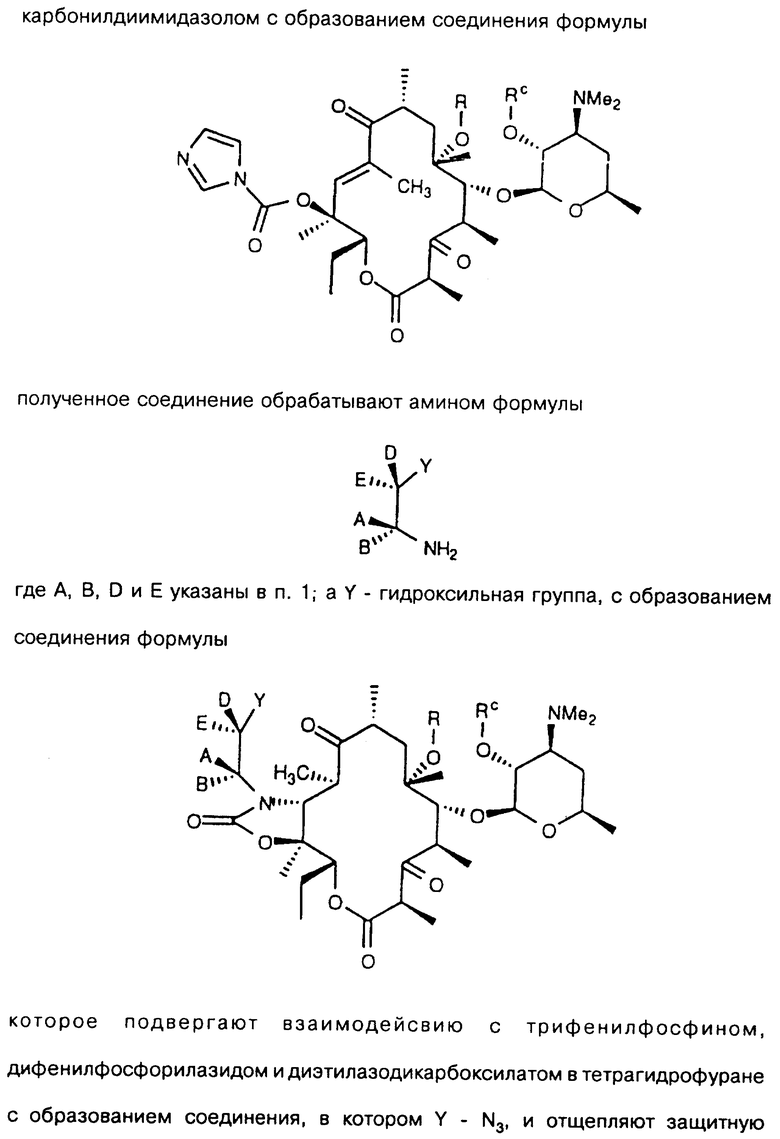
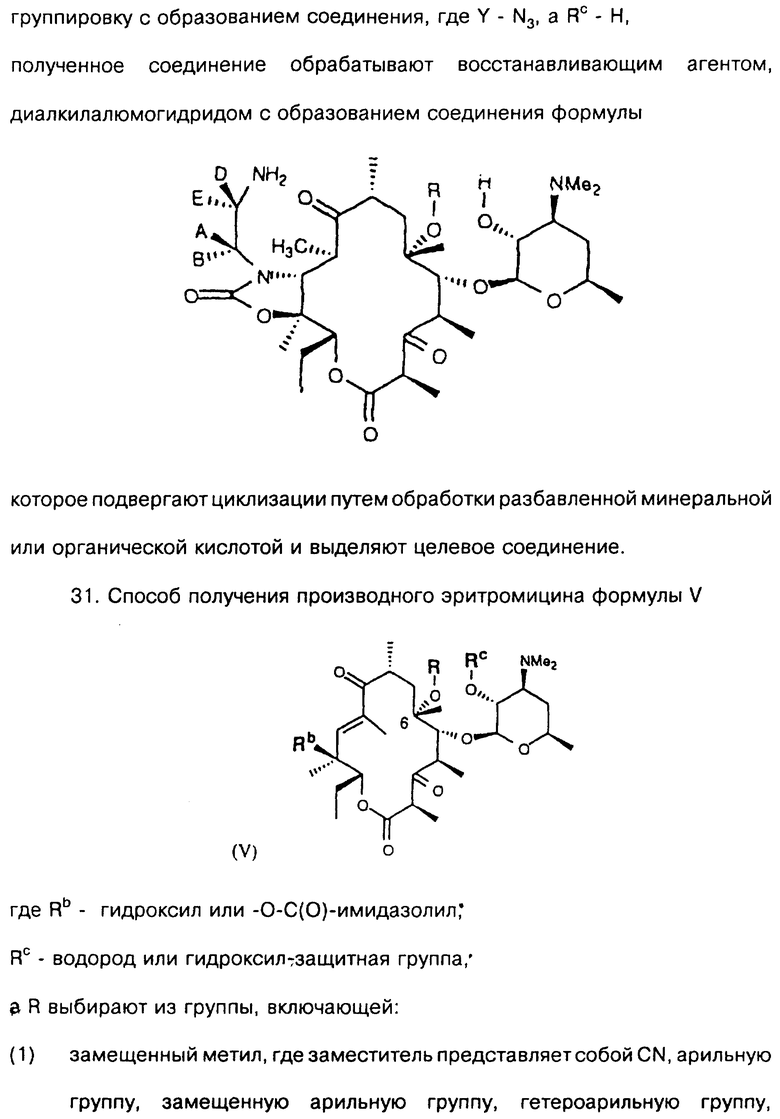

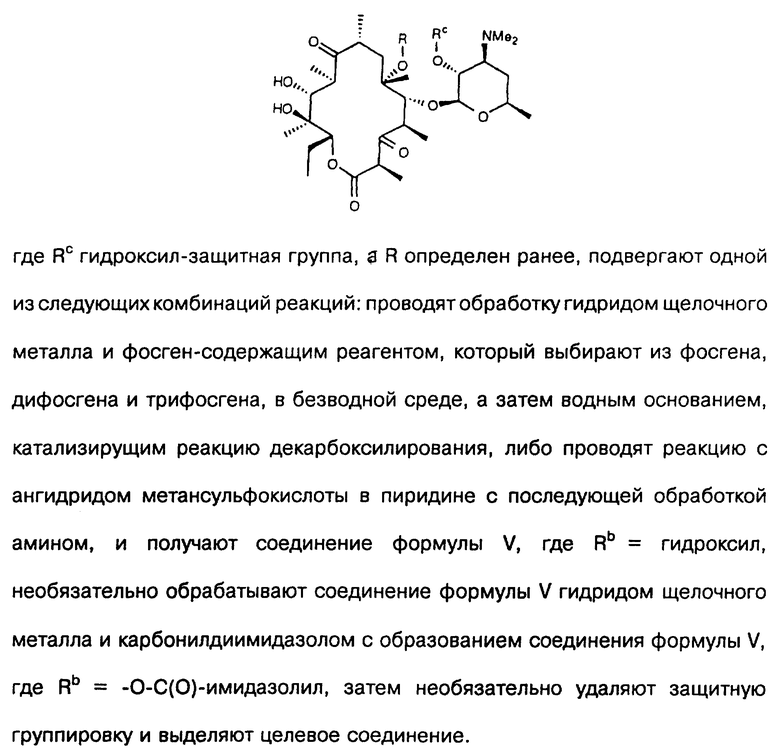
Изобретение относится к производным эритромицина общих формул (II), (III), (IV) и (V), где R представляет собой замещенный C1-С10-алкил, С3-алкенил, С3-алкинил и др. (см. описание). Предложены способы получения этих производных, фармацевтическая композиция на их основе, обладающая антибактериальной активностью, а также способ регулирования бактериальной инфекции у млекопитающего путем введения ему указанной фармацевтической композиции. 12 с. и 19 з.п.ф-лы, 6 табл.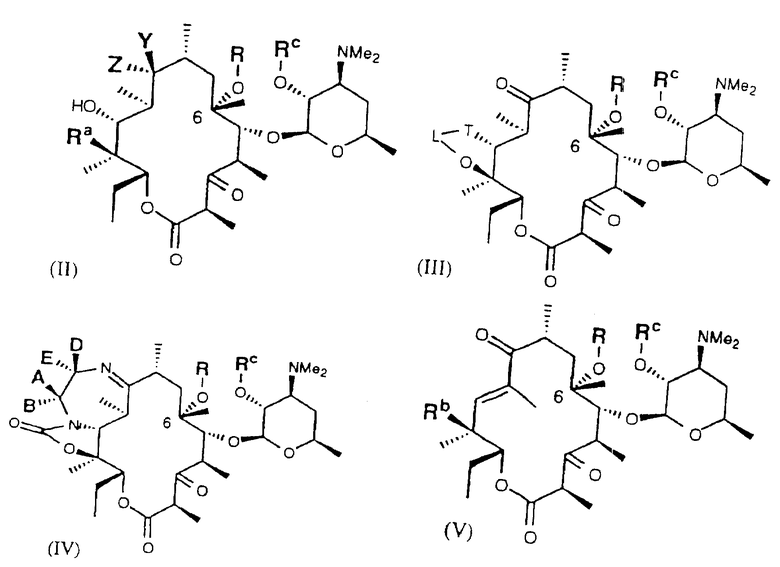
Формула изобретения в факсимильном виде (см. графическую часть).
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| US 4670549 А, 02.06.1987 | |||
| US 5403923 А, 04.04.1995 | |||
| Способ получения производных эритромицина или их солей | 1976 |
|
SU682134A3 |
Авторы
Даты
2002-11-10—Публикация
1997-09-02—Подача