Заявка является частичным продолжением заявки Merck 19280, регистрационный номер США (U.S.S.N.) 08/289474, поданной 11 августа 1994.
Настоящая заявка относится к заявке Merck 18996, (U.S.S.N.) 08/059038, поданной 7 мая 1993, и 189961 А, (U.S.S.N.) 08/235576, поданной 29 апреля 1994.
Ретровирус, называемый вирусом иммунного дефицита человека (ВИЧ), является причинным агентом комплексного заболевания, которое включает прогрессирующее разрушение иммунной системы (синдром приобретенного иммунного дефицита; СПИД) и разрушение центральной и периферической нервных систем. Этот вирус раньше был известен как LAV (лимфаденопатический вирус), HTLV-111 (Т-лимфоцитный вирус человека) или ARV. Обычным признаком ретровирусной репликации является экстенсивный посттрансляционный процессинг предшественников-полипротеинов кодированной вирусно протеазой с генерацией зрелых вирусных белков, необходимых для сборки вируса и его функции. Ингибирование этого процессинга предупреждает образование нормально инфекционного вируса. Например, Kohl, N.E., et аl., Proc. Nat'l Acad. Sci., 85, 4686 (1988) показали, что генетическая инактивация ВИЧ-кодированной протеазы приводит, в результате, к продуцированию частиц незрелого неинфекционного вируса. Эти результаты показывают, что ингибирование ВИЧ-протеазы является практически осуществимым методом лечения СПИДа и предупреждения или лечения заражения ВИЧ.
Секвенирование нуклеиновой кислоты ВИЧ показывает присутствие pol-гена в одной открытой рамке считывания / Ratner, L., et al., Nature, 313, 277 (1985)/. Гомология аминокислотной последовательности ясно показывает, что роl-последовательность кодирует обратную транскриптазу, эндонуклеазу и ВИЧ-протеазу / Toh, et al., ЕМВО J. 4, 1267 (1985); Power, M.D., et al., Science, 231, 1567 (1986); Pearl, L.H., et al., Nature, 329, 351 (1987)/.
Соединение I формулы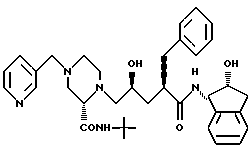
Называемое N-(2(R)-гидрокси-1(S)-инданил)-2(R)-фенилметил-4(S)-гидрокси-5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет-бутилкарбамоил)пиперазинил)пентанамид или его фармацевтически приемлемая соль является мощным ингибитором ВИЧ-протеазы и полезным при лечении СПИДа или ARC без существенного побочного действия или токсичности.
Заявители обнаружили, что введение соединения I в сочетании с другими ингибиторами ВИЧ-протеазы пригодно для лечения СПИДа или АRС (СПИД-ассоциированного комплекса).
Заявители показывают, что сочетание соединений настоящего изобретения является эффективным ингибитором ВИЧ-протеазы.
В настоящем изобретении Заявители вводят сильный ингибитор ВИЧ-протеазы, соединение I, либо одновременно, либо поочередно с одним или несколькими другими ингибиторами ВИЧ-протеазы, такими как соединения I, II, III или IV.
Краткое изложение сущности изобретения
Сочетание настоящего изобретения пригодно для ингибирования ВИЧ-протеазы, предупреждения заражения ВИЧ, лечения при заражении ВИЧ и лечения СПИДа и/или ARC, в виде ли соединений, фармацевтически приемлемых солей (в соответствующем случае), ингредиентов фармацевтической композиции, по отдельности или в сочетании с другими противовирусными средствами, противоинфекционными средствами, иммуномодуляторами, антибиотиками или вакцинами. Также описываются способы лечения СПИДа, способы предупреждения инфицирования ВИЧ и способы лечения заражения ВИЧ.
Подробное описание изобретения и предпочтительных вариантов его осуществления
Настоящее изобретение относится к сочетанию некоторых соединений, или их фармацевтически приемлемых солей, для ингибирования ВИЧ-протеазы, предупреждения или лечения заражения ВИЧ и для лечения возникающего в результате синдрома приобретенного иммунодефицита (СПИДа). Это сочетание определяется следующим образом:
сочетание, содержащее соединение I и ингибитор ВИЧ-протеазы, выбираемый среди соединений I, II, III или IV.
Ингибитор ВИЧ-протеазы - соединение I - синтезируют по схеме заявки Merck 18597 Y, ЕР 0541168, опубликованной 12 мая 1993, включенной в настоящее описание в качестве ссылки. Соединение L-735524 представляет собой N-(2(R)-гидрокси-1(S)-инданил)-2(R)-фенилметил-4-(S)-гидрокси-5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет-бутилкарбоксамидо)пиперазинил)пентанамид или его фармацевтически приемлемую соль.
Соединение 1 представляет собой соединение формулы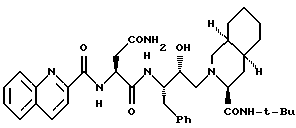
или его фармацевтически приемлемую соль. Его синтезируют по методике, описанной в ЕР 0346847. См. также R.A.Roberts et al., Science, 248, 358 (199).
Соединение II представляет собой соединение формулы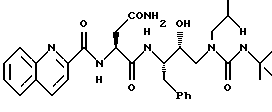
Его синтезируют по методике ЕР 0346847, РСТ WO 92/08700 и РСТ WO 92/8698.
Соединение III представляет собой соединение формулы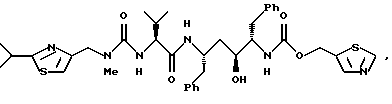
или его фармацевтически приемлемую соль. Его синтезируют по методам ЕР 0486948 и РСТ WO 94/14436.
Соединение IV представляет собой соединение формулы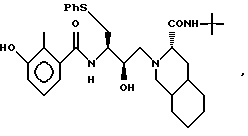
или его фармацевтически приемлемые соли. Его синтезируют по методам WO 95/09843.
Фармацевтически приемлемые соли по настоящему изобретению (в форме водо- или маслорастворимых или диспергируемых продуктов) включают обычные нетоксичные соли или соли четвертичных аммониевых оснований, которые образуются, например, неорганическими или органическими кислотами или основаниями. Примерами таких солей присоединения кислот являются ацетаты, адипаты, альгинаты, аспартаты, бензоаты, бензолсульфонаты, бисульфаты, бутираты, цитраты, камфораты, камфорсульфонаты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, фумараты, глюкогептаноаты, глицерофосфаты, полусульфаты, гептаноаты, гексаноаты, гидрохлориды, гидробромиды, гидроиодиды, 2-гидроксиэтансульфонаты, лактаты, малеаты, метансульфонаты, 2-нафталинсульфонаты, никотинаты, оксалаты, памоаты, пектины, персульфаты, 3-фенилпропионаты, пикраты, пивалаты, пропионаты, сукцинаты, тартраты, тиоцианаты, тозилаты и ундеканоаты. Соли оснований включают аммониевые соли, соли щелочных металлов, такие как натриевые и калиевые соли, соли щелочноземельных металлов, такие как кальциевые и магниевые соли, соли органических оснований, такие как соли дициклогексиламина, соли N-метил-D-глюкамина, и соли аминокислот, таких как аргинин, лизин и так далее. Также, основные азотсодержащие группы могут быть кватернизованы такими агентами, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, бромиды и иодиды; диалкилсульфаты, подобные диметил-, диэтил- и дибутилсульфату; и диамилсульфаты, длинноцепные галогениды, такие как децил-, лаурил-, миристил и стеарилхлориды, бромиды и иодиды, аралкилгалогениды, подобные бензил- и фенетилбромидам, и другие. Другими фармацевтически приемлемыми солями являются этанолятсульфаты и сульфаты.
В соответствующих случаях включаются сложные C1-4-алкилэфиры как пролекарства.
Сочетание соединений настоящего изобретения полезно при ингибировании ВИЧ-протеазы, предупреждении или лечении заражения вирусом иммунодефицита человека (ВИЧ) и при лечении являющихся результатом инфицирования патологических состояний, таких как СПИД. Лечение СПИДа или предупреждение или лечение заражения ВИЧ определяются как входящие в число, не ограничивающие, возможностей лечения разнообразных состояний ВИЧ-инфекции: СПИДа, ARC (родственный СПИДу комплекс), как симптоматического, так и бессимптомного, и фактического или возможного воздействия ВИЧ. Например, соединения настоящего изобретения полезны при лечении инфицирования ВИЧ при подозрении на воздействие ВИЧ в прошлом, например, при переливании крови, замене общей воды организма, травматического укола, или при воздействии на кровь пациента во время хирургической операции.
Сочетания настоящего изобретения также полезны при подготовке и проведении скрининг-анализа противовирусных соединений. Например, сочетания по настоящему изобретению пригодны для выделения ферментных мутантов, которые являются отличными скрининг-инструментами для анализа мощных противовирусных соединений. Кроме того, соединения по настоящему изобретению полезны при установлении или определении сайта связывания других противовирусных средств с ВИЧ-протеазой, например, посредством конкурентного ингибирования. Поэтому, сочетания по настоящему изобретению являются коммерческими продуктами, которые продаются для этих целей.
Сочетания настоящего изобретения, для вышеупомянутых целей, могут вводиться перорально, парентерально (включая подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или метод инфузии), ингаляцией распылением или ректально, в виде доз стандартных составов, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители.
Таким образом, настоящее изобретение также относится к способу лечения и фармацевтической композиции для лечения ВИЧ-инфекции и СПИДа. Лечение заключается во введении нуждающемуся в таком лечении пациенту фармацевтической композиции, содержащей фармацевтический носитель и терапевтически эффективное количество каждого соединения в сочетании настоящего изобретения.
Эти фармацевтические композиции могут существовать в форме принимаемых перорально суспензий или таблеток; назальных аэрозолей; стерильных препаратов для инъекций, например, в виде стерильных водных препаратов для инъекций или масляных суспензий, или суппозиториев.
Когда композиции вводят перорально в виде суспензий, такие композиции получают способами, хорошо известными в технике приготовления фармацевтических препаратов, и они могут содержать микрокристаллическую целлюлозу - для придания объема, альгиновую кислоту или альгинат натрия - как суспендирующий агент, метилцеллюлозу - в качестве загустителя, и известные в технике подслащиватели и корригенты. Композиции в виде таблеток с немедленным выделением лекарственного средства могут содержать микрокристаллическую целлюлозу, дикальцийфосфат, крахмал, стеарат магния и лактозу, и/или другие эксципиенты, связующие, наполнители, дезинтеграторы, разбавители и смазки, известные в технике.
Когда композиции вводят посредством назального аэрозоля или ингаляции, такие композиции готовят в соответствии со способами, хорошо известными в технике приготовления фармацевтических препаратов, и они могут быть получены в виде растворов в физиологическом растворе, с использованием бензилового спирта или других подходящих консервантов, промоторов абсорбции - для усиления биологической доступности, фторуглеродов и/или других солюбилизирующих или диспергирующих веществ, известных в технике.
Растворы или суспензии для инъекций могут быть приготовлены известными в технике способами с использованием нетоксичных, парэнтеральноприемлемых разбавителей или растворителей, таких как маннит, 1,3-бутандиол, вода, раствор Рингера или изотонический раствор хлорида натрия, или подходящих диспергаторов или смачивателей и суспендирующих агентов, таких как стерильные успокаивающие нелетучие масла, включая синтетические моно- или диглицериды, и жирные кислоты, включая олеиновую кислоту.
Когда композиции вводят реактально в форме суппозиториев, такие композиции могут быть приготовлены путем смешивания лекарственного средства с подходящим нераздражаюшим эксципиентом, таким как масло какао, синтетические глицериды или полиэтиленгликоли, которые являются твердыми при обычных температурах, но разжижаются и/или растворяются в ректальной полости с выделением лекарственного средства.
Соединения настоящего изобретения можно назначать людям в интервале доз, специфическом для каждого соединения. Соединения или его фармацевтически приемлемую соль вводят перорально при интервале дозировки от 40 мг до 4000 мг в сутки, однократно или раздельно до 4 раз в сутки. Предпочтительный интервал пероральной дозы для соединения I или его фармацевтически приемлемой соли составляет от 200 мг до 1000 мг, вводимых в три раза в сутки. Соединение 1 или его фармацевтически приемлемую соль назначают перорально при интервале дозировки от 100 мг до 4000 мг в сутки. Предпочтительный интервал пероральной дозы составляет от 200 мг до 1000 мг при введении 3 раза в сутки. Соединение 11 вводят перорально, например, в виде эликсира в 30% водном этаноле, при интервале дозировки от 100 мг до 4000 мг в сутки. Предпочтительный интервал пероральной дозы для соединения 11 составляет от 200 мг до 1000 мг при введении 3 раза в сутки. Соединение III или его фармацевтически приемлемую соль вводят перорально при интервале дозировки от 100 мг до 4000 мг в сутки. Предпочтительный интервал пероральной дозы для соединения III или его фармацевтически приемлемой соли составляет от 200 мг до 1000 мг при введении 3 раза в сутки. Соединение IV или его фармацевтически приемлемые соли вводят перорально при интервале дозировки от 100 мг до 4000 мг в сутки. Следует иметь в виду, однако, что конкретный уровень дозы и частота приема для какого-либо определенного пациента может изменяться и будет зависеть от множества факторов, включая активность конкретного используемого соединения, метаболическую устойчивость и продолжительность действия этого соединения, возраст, массу тела, общее состояние здоровья, пол пациента, питание, способ и время введения, скорость экскреции, сочетание лекарственных средств, тяжесть определенного состояния и реципиента, получающего лечение.
ПРИМЕР 1
Протокол фармакокинетической оценки лечения сочетанием только с соединением 1
Это протокол перекрестного режима многодозового трехфазного лечения случайно выбранных ВИЧ-инфицированных пациентов для оценки фармакокинетики и безопасности совместного приема соединения I и соединения 1.
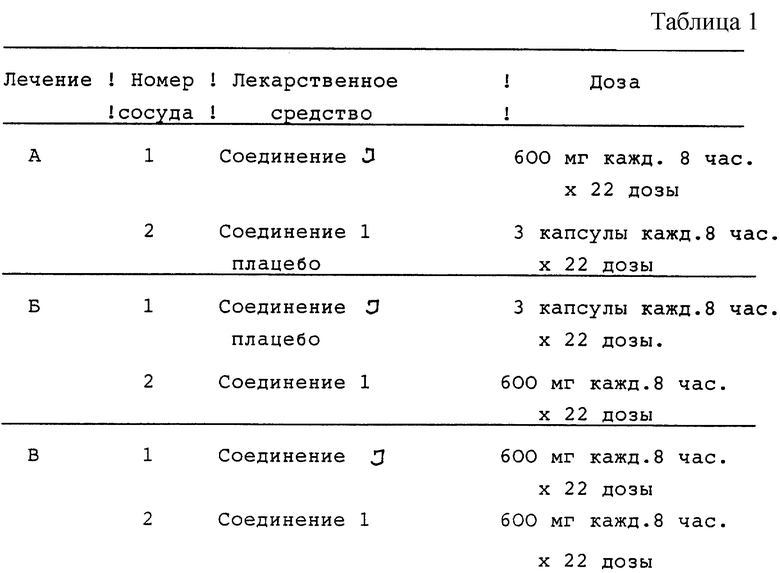
Двенадцать случайно отобранных ВИЧ-инфицированных пациентов получают три различных лечения, состоящих в дозировании в течение полных семи суток и одной дополнительной дозы активного соединения I и соединения 1 плацебо (лечение А), соединение I плацебо и соединения 1 (лечение Б) и активного соединения I и активного соединения 1 (лечение В). Эти виды лечения описываются в табл.1 (см. в конце описания).
Соединение I принимают в виде трех капсул по 200 мг и соединение 1 в виде трех капсул по 200 мг. Капсулы плацебо соответствуют как активному соединению I, так и активному соединению 1.
Соединение I или соответствующее плацебо принимают каждые восемь часов. Потенциальные субъекты оцениваются по приемлемости полной истории болезни, объективному обследованию (включая показатели жизненно важных функций с ортостатическими показателями), ЭКГ с 12-ю отведениями, и лабораторной проверке (включая определение количества CD4) в течение приблизительно одного месяца с начала исследований.
Для анализа безопасности во время каждого периода лечения берут кровь и мочу для лабораторных тестов на безопасность и выполняют физикальное обследование до принятия первой дозы (день 1) и в день приема последней дозы (день 8) каждого периода лечения. Дополнительно снимают ЭКГ с 12-ю отведениями до и спустя 1 час после первой дозы, а также спустя 1 час после последней дозы каждого лечебного периода. Показатели жизненно важных функций, включая ортостатические показатели, измеряют обычно по графику в первый и последний дни приема доз. Пациентам отводятся одни сутки во время недели приема лекарства (один и тот же день приема лекарств для каждого лечения для отдельного пациента - 3, 4 или 5 день) для приема лекарства под наблюдением, наблюдения за побочным действием и контроля за показателями жизненно важных функций. Пациенты имеют карты ежедневного наблюдения для регистрации времени приема всех доз лекарства и отметок о любых неблагоприятных проявлениях в течение каждого лечебного периода. Оценка безопасности после окончания режима, состоящая из лабораторных тестов на безопасность, объективного обследования и ЭКГ, выполняется через 24 часа после последнего лечения.
В процессе лечения А, Б и В отбирают образцы крови для определения содержания в плазме соединения I и соединения 1 через 0, 0,25, 0,5, 0,75, 1, 1,5, 2, 3, 4, 6 и 8 часов после приема последней дозы (день 8). Фармакокинетические параметры, которые проверяют, включают максимальную концентрацию в плазме и АUС (площадь под кривой "концентрация-время") для каждого лекарственного средства.
ПРИМЕР 2
Протокол лечения сочетанием только с соединением 1
По этому протоколу, чтобы показать противовирусную активность одной схемы приема пациентами с ВИЧ-серонегативной реакцией соединения I, получаемого вместе с соединением 1, соединения I вводят при дозе 600 мг три раза в сутки, и соединение 1 вводят по 600 мг три раза в сутки. Противовирусную активность измеряют до и во время лечения сочетанием посредством измерения сывороточного уровня антигена р24 ВИЧ, сывороточного уровня РНК ВИЧ и числа лимфоцитов CD4.
ПРИМЕР 3
Протокол фармакокинетической оценки лечения сочетанием только с соединением 11
Это протокол перекрестного режима многодозового трехфазного лечения случайно выбранных ВИЧ-инфицированных пациентов для оценки фармакокинетики и безопасности совместного приема соединения I и соединения 11.
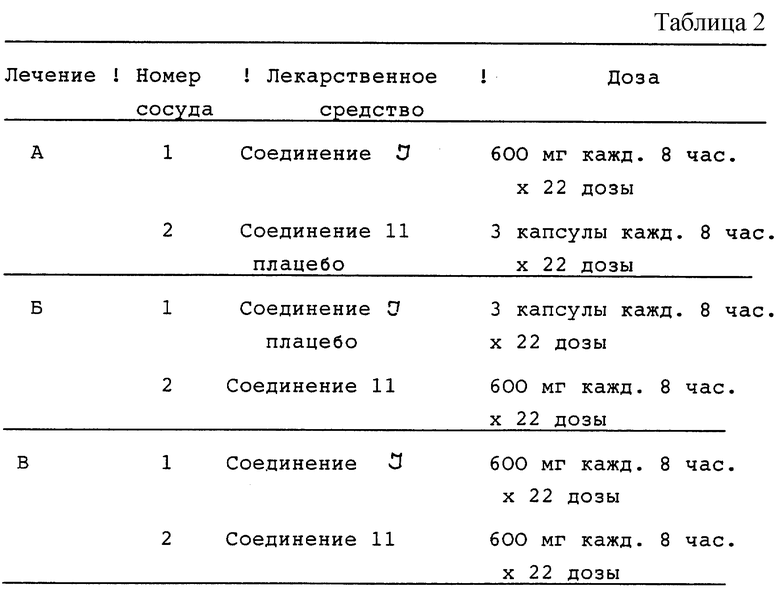
Двенадцать случайно отобранных ВИЧ-инфицированных пациентов получают три различных лечения, состоящих в дозировании в течение полных семи суток и одной дополнительной дозы активного соединения I и соединения 11 плацебо (лечение А); соединения I плацебо и соединения 11 (лечение Б) и активного соединения I и активного соединения 11 (лечение В). Эти виды лечения описываются в табл.2 (см. в конце описания).
Соединение I принимают в виде трех капсул по 200 мг, и соединение 11 - в виде трех капсул по 200 мг. Капсулы плацебо соответствуют как активному соединению I, так и активному соединению 11.
Соединение I или соответствующее плацебо принимают каждые 8 часов. Потенциальные субъекты оцениваются по приемлемости полной истории болезни, объективному обследованию (включая показатели жизненно важных функций с ортостатическими показателями) ЭКГ с 12-ю отведениями, и лабораторной проверке (включая определение количества CD4) в течение приблизительно одного месяца с начала исследований.
Для анализа безопасности во время каждого периода лечения берут кровь и мочу для лабораторных тестов на безопасность, и выполняют физикальное обследование до принятия первой дозы (день 1) и в день приема последней дозы (день 8) каждого периода лечения. Дополнительно снимают ЭКГ с 12-ю отведениями до и спустя 1 час после первой дозы, а также спустя 1 час после последней дозы каждого лечебного периода. Показатели жизненно важных функций, включая ортостатические показатели, измеряют обычно по графику в первый и последний дни приема доз. Пациентам отводятся одни сутки во время недели приема лекарства (один и тот же день приема лекарств для каждого лечения для отдельного пациента - 3, 4 или 5 день) для приема лекарства под наблюдением, наблюдения за побочным действием и контроля за показателями жизненно важных функций. Пациенты имеют карты ежедневного наблюдения для регистрации времени приема всех доз лекарства и отметок о любых неблагоприятных проявлениях в течение каждого лечебного периода. Оценка безопасности после окончания режима, состоящая из лабораторных тестов на безопасность, объективного обследования и ЭКГ, выполняется через 24 часа после последнего лечения.
В процессе лечения А, Б и В отбирают образцы крови для определения содержания в плазме L-735524 и соединения 11 через 0, 0,25, 0,5, 0,75, 1, 1,5, 2, 3, 4, 6 и 8 часов после приема последней дозы (день 8). Фармакокинетические параметры, которые проверяют, включают максимальную концентрацию в плазме и AUC (площадь под кривой "концентрация-время") для каждого лекарственного средства.
ПРИМЕР 4
Протокол лечения сочетанием только с соединением 11
По этому протоколу, чтобы показать противовирусную активность одной схемы приема пациентами с ВИЧ-серонегативной реакцией соединения I, получаемого вместе с соединением 11, соединение I вводят при дозе 600 мг три раза в сутки, и соединение 11 вводят по 600 мг три раза в сутки. Противовирусную активность измеряют до и во время лечения сочетанием посредством измерения сывороточного уровня антигена р24 ВИЧ, сывороточного уровня РНК ВИЧ и числа лимфоцитов CD4.
ПРИМЕР 5
Протокол фармакокинетической оценки лечения сочетанием только с соединением III
Это протокол перекрестного режима многодозового трехфазного лечения случайно выбранных ВИЧ-инфицированных пациентов для оценки фармакокинетики и безопасности совместного приема соединения I и соединения III.
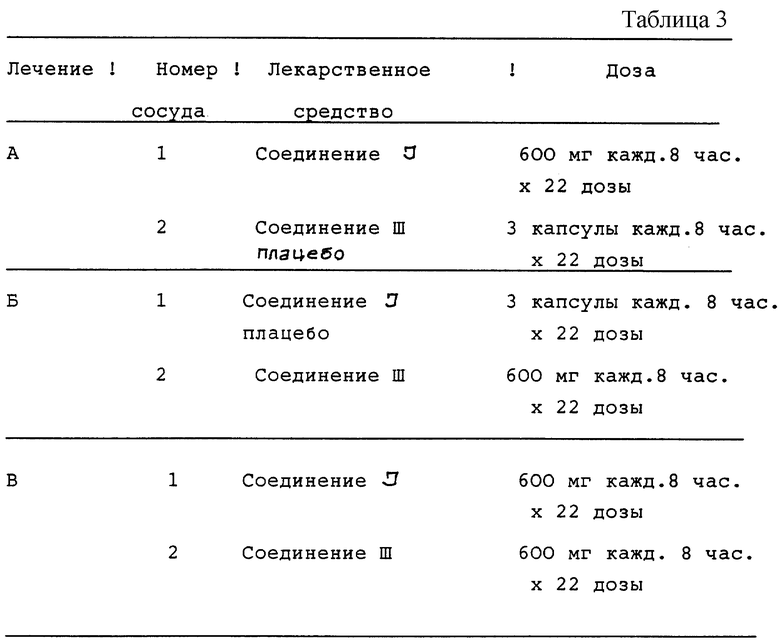
Двенадцать случайно отобранных ВИЧ-инфицированных пациентов получают три различных лечения, состоящих в дозировании в течение полных семи суток и одной дополнительной дозы активного соединения I и соединения III плацебо (лечения А); соединения I плацебо и соединения III (лечение Б) и активного соединения I и активного соединения III (лечение В). Эти виды лечения описываются в табл.3 (см. в конце описания).
Соединение I принимают в виде трех капсул по 200 мг, и соединение III в виде трех капсул по 200 мг. Капсулы плацебо соответствуют как активному соединению I, так и активному соединению III.
Соединение I или соответствующее плацебо принимают каждые 8 часов. Потенциальные субъекты оцениваются по приемлемости полной истории болезни, объективному обследованию (включая показатели жизненно важных функций с ортостатическими показателями), ЭКГ с 12-ю отведениями и лабораторной проверке (включая определение количества CD4) в течение приблизительно одного месяца с начала исследований. Для анализа безопасности во время каждого периода лечения берут кровь и мочу для лабораторных тестов на безопасность и выполняют физикальное обследование до принятия первой дозы (день 1) и в день приема последней дозы (день 8) каждого периода лечения. Дополнительно снимают ЭКГ с 12-ю отведениями до и спустя 1 час после первой дозы, а также спустя 1 час после последней дозы каждого лечебного периода. Показатели жизненно важных функций, включая ортостатические показатели, измеряют обычно по графику в первый и последний дни приема доз. Пациентам отводятся одни сутки во время недели приема лекарства (один и тот же день приема лекарства для каждого лечения для отдельного пациента - 3, 4 или 5 день) для приема лекарства под наблюдением, наблюдения за побочным действием и контроля за показателями жизненно важных функций. Пациенты имеют карты ежедневного наблюдения для регистрации времени приема всех доз лекарства и отметок о любых неблагоприятных проявлениях в течение каждого лечебного периода. Оценка безопасности после окончания режима, состоящая из лабораторных тестов на безопасность, объективного обследования и ЭКГ, выполняется через 24 часа после последнего лечения.
В процессе лечения А, Б и В отбирают образцы крови для определения содержания в плазме соединения I и соединения III через 0, 025, 0,5, 0,75, 1, 1,5, 2, 3, 4, 6 и 8 часов после приема последней дозы (день 8). Фармакокинетические параметры, которые проверяют, включают максимальную концентрацию в плазме и AUC (площадь под кривой "концентрация-время") для каждого лекарственного средства.
ПРИМЕР 6
Протокол лечения сочетанием только с соединением III.
По этому протоколу, чтобы показать противовирусную активность одной схемы приема пациентами с ВИЧ-серонегативной реакцией соединения I, получаемого вместе с соединением III, соединение I вводят при дозе 600 мг три раза в сутки, и соединение III вводят по 600 мг три раза в сутки. Противовирусную активность измеряют до и во время лечения сочетанием посредством измерения сывороточного уровня антигена р24 ВИЧ, сывороточного уровня РНК ВИЧ и числа лимфоцитов CD4.
ПРИМЕР 7
Протокол фармакокинетической оценки лечения сочетанием только с соединением IV
Это протокол перекрестного режима многодозового трехфазного лечения случайно выбранных ВИЧ-инфицированных пациентов для оценки фармакокинетики и безопасности совместного приема соединения и соединения IV.
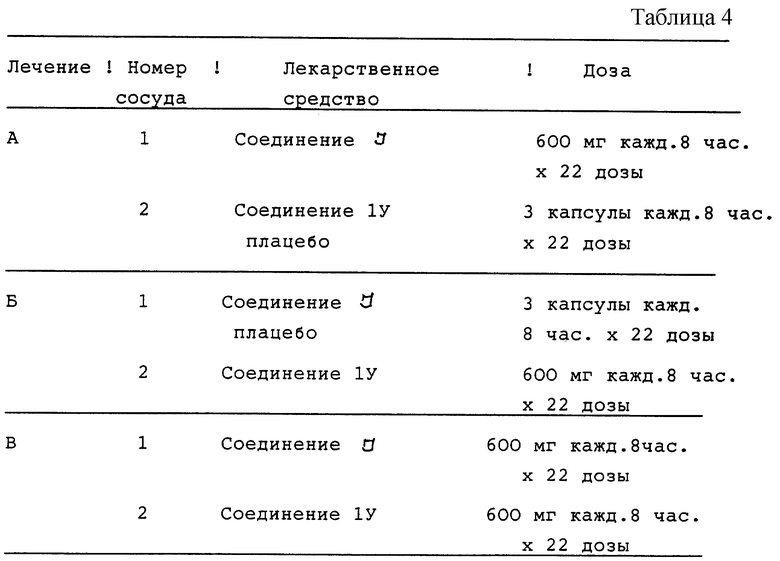
Двенадцать случайно отобранных ВИЧ-инфицировнных пациентов получают три различных лечения, состоящих в дозировании в течение полных семи суток и одной дополнительной дозы активного соединения I и соединения IV плацебо (лечения А); соединения I плацебо и соединения IV (лечение Б) и активного соединения I и активного соединения IV (лечение В). Эти виды лечения описываются в табл.4 (см. в конце описания).
Соединение I принимают в виде трех капсул по 200 мг и соединение IV - в виде трех капсул по 200 мг. Капсулы плацебо соответствуют как активному соединению I, так и активному соединению IV.
Соединение I или соответствующее плацебо принимают каждые 8 часов. Потенциальные субъекты оцениваются по приемлемости полной истории болезни, объективному обследованию (включая показатели жизненно важных функций с ортостатическими показателями), ЭКГ с 12-ю отведениями и лабораторной проверке (включая определение количества СD4) в течение приблизительно одного месяца с начала исследований. Для анализа безопасности во время каждого периода лечения берут кровь и мочу для лабораторных тестов на безопасность и выполняют физикальное обследование до принятия первой дозы (день 1) и в день приема последней дозы (день 8) каждого периода лечения. Дополнительно снимают ЭКГ с 12-ю отведениями до и спустя 1 час после первой дозы, а также спустя 1 час после последней дозы каждого лечебного периода. Показатели жизненно важных функций, включая ортостатические показатели, измеряют обычно по графику в первый и последний дни приема доз. Пациентам отводятся одни сутки во время недели приема лекарства (один и тот же день приема лекарства для каждого лечения для отдельного пациента - 3, 4 или 5 день) для приема лекарства под наблюдением, наблюдения за побочным действием и контроля за показателями жизненно важных функций. Пациенты имеют карты ежедневного наблюдения для регистрации времени приема всех доз лекарства и отметок о любых неблагоприятных проявлениях в течение каждого лечебного периода. Оценка безопасности после окончания режима, состоящая из лабораторных тестов на безопасность, объективного обследования и ЭКГ, выполняется через 24 часа после последнего лечения.
В процессе лечения В, Б и В отбирают образцы крови для определения содержания в плазме соединения I и соединение IV через 0, 0,25, 0,5, 0,75, 1, 1,5, 2, 3, 4, 6 и 8 часов после приема последней дозы (день 8). Фармакокинетические параметры, которые проверяют, включают максимальную концентрацию в плазме и АUС (площадь под кривой "концентрация-время") для каждого лекарственного средства.
ПРИМЕР 8
Протокол лечения сочетанием только с соединением IV
По этому протоколу, чтобы показать противовирусную активность одной схемы приема пациентами с ВИЧ-серонегативной реакцией соединения I, получаемого вместе с соединением IV, соединение I вводят при дозе 600 мг три раза в сутки, и соединение IV вводят по 600 мг три раза в сутки. Противовирусную активность измеряют до и во время лечения сочетанием посредством измерения сывороточного уровня антигена р24 ВИЧ, сывороточного уровня РНК ВИЧ и числа лимфоцитов CD4.
Хотя приведенное выше описание поясняет принципы настоящего изобретения с помощью примеров, данных с целью иллюстрации, следует иметь в виде, что практическое осуществление изобретения охватывает все обычные вариации, приспособления или модификации, как входящие в объем приведенных ниже пунктов формулы изобретения и их эквивалентов.
Изобретение относится к медицине и может быть использовано для ингибирования ВИЧ-протеазы, предупреждения или лечения ВИЧ инфекции или лечения СПИДа. Способ включает введение пациенту, нуждающемуся в этом, N-(2(R)-гидрокси-1(S)-инданил)-2(R)-фенилметил-4(S)-гидpoкcи-5-(1-(4-(3-пиpидилмeтил)-2(S)-N'-(трет-бутилкарбамоил)-пиперазинил))пентанамида (компонента А) или его фармацевтически приемлемой соли в комбинации с компонентом В или его фармацевтически приемлемой солью. Предложенный способ позволяет повысить эффективность лечения за счет побочных эффектов. 2 с. и 5 з.п.ф-лы, 4 табл.
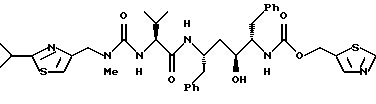
(компонентом В) или его фармацевтически приемлемой солью.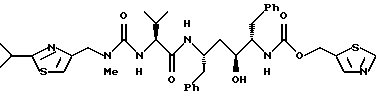
(компонент В), или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
| ШТАММ ПЕРЕВИВАЕМЫХ КЛЕТОК МОНОЦИТОВ ЧЕЛОВЕКА - ПРОДУЦЕНТ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА I ТИПА | 1988 |
|
SU1554370A1 |
| Устройство для возведения двоичных чисел в степень | 1974 |
|
SU541168A1 |
| WO 9414436, 07.07.1994. | |||
Авторы
Даты
2002-12-20—Публикация
1995-08-07—Подача