Изобретение касается в особенности последовательности структурного гена пептидного антибиотика мерсацидина. Секвенирование показало, что премерсацидин состоит из необычно длинной (48 аминокислот) лидерной последовательности и пропептидной части из 20 аминокислот, которая модифицируется во время биосинтеза до зрелого лантибиотика.
Мерсацидин относится к группе бактерицидных пептидов, которые были названы лантибиотиками, что означает, что эти пептиды содержат редкие аминокислоты лантионин и/или 3-метиллантионин. Дополнительные модифицированные аминокислоты, такие как дегидроаланин и дегидробутирин, обычно встречаются, тогда как S -аминовинилцистеин и лизиноаланин обнаружены только в некоторых лантибиотиках (G. Yung (1991), Angew. Chem. Int. Ed. Engl. 30: 1051-1068). Лантибиотики продуцируются грамположительными бактериями и происходят из синтезированных рибосомами препептидов. Структурные гены лантибиотиков были обнаружены на бактериальной хромосоме (например, субтилин и циннамицин) или они ассоциированы с подвижными элементами, такими как транспозоны (например, низин) или большими плазмидами (например, эпидермин и Рер5). Препептиды состоят из N-концевой лидерной последовательности, которая отщепляется после экспорта из клетки-продуцента, и С-концевого пропептида, который пост-трансляционно модифицируется до зрелого лантибиотика (G. Yung (1991), Supra). В первой стадии модификации остатки серина и треонина дегидратируются с образованием дегидроаланина (Dha) или дегидробутирина (Dhb), соответственно (H. -P. Weil еt al. (1990), Eur. Y. Biochem. 194: 217-223). Затем SH-группы остатков цистеина реагируют с двойными связями Dha или Dhb с образованием лантионинов или метиллантионинов, соответственно.
Мерсацидин был выделен из культурального супернатанта Bacillus Spec. HIL У-85, 54728 и вызвал интерес вследствие его значительной эффективности in vivo против метициллин-резистентного Staphylococcus aureus (MRSA) (S. Chatterjee et al. (1992), Y. Antibiotics 45: 839-845). Он представляет собой самый малый по размеру лантибиотик, изолированный до настоящего времени (1825 Да), синтезированный из пропептида из 20 аминокислот, и содержит 3 остатка метиллантионина, один дегидроаланин и один S-амино-винил-2-метилцистеин (фиг.1А) (S. Chatterjee (1992), Y. Antibiotics 45: 832-838). Мерсацидин не несет результирующего заряда и имеет в целом гидрофобные свойства. Недавние результаты показывают, что мерсацидин препятствует биосинтезу пептидогликана. Наиболее вероятно, что это происходит на уровне трансгликозилирования через механизм, который отличается от механизма действия антибиотиков, применяемых в настоящее время против MRSА.
Таким образом, данное изобретение касается премерсацидина, имеющего аминокислотную последовательность, показанную на фиг.2, от аминокислоты 1 по аминокислоту 68, и промерсацидина, имеющего аминокислотную последовательность, показанную на фиг.2, от аминокислоты 49 по аминокислоту 68.
Следующим вариантом данного изобретения являются ДНК, кодирующие премерсацидин или промерсацидин, в частности ДНК, имеющие нуклеотидную последовательность, показанную на фиг.2 от 22 по 225, кодирующую премерсацидин, или от 166 по 225, кодирующую промерсацидин; вектор, содержащий эту ДНК, и клетка-хозяин, содержащая этот вектор.
Другим вариантом данного изобретения является способ получения премерсацидина, промерсацидина или зрелого мерсацидина генноинженерными методами, обычно известными специалисту в данной области, т.е. подходящую клетку-хозяин, содержащую эти ДНК, кодирующие премерсацидин или промерсацидин, культивируют при подходящих условиях с последующим выделением премерсацидина, промерсацидина или зрелого мерсацидина, экспрессируемых клеткой-хозяином, предпочтительно грамположительной бактерией, такой как Bacillus, Streptomyces или Streptococcus.
Наконец, пептиды премерсацидин, или промерсацидин, или их гены согласно данному изобретению могут быть использованы для получения зрелого мерсацидина, как описано, например, в WO 90/00558.
Зрелый мерсацидин применим, например, в качестве пептидного антибиотика для сохранения пищевых продуктов против метициллин-резистентного Staplylococcus aureus или в качестве антибиотика для лечения инфекций, вызываемых Staphylococcus aureus, у животных или человека. Данное изобретение может быть применено также для получения производных мерсацидина, модифицированных в аминокислотной последовательности, со смещенным антибиотическим спектром или отличающейся эффективностью. Кроме того, изобретение открывает пути к повышенной экспрессии мерсацидина или его производных при помощи генной инженерии.
Описание чертежей
Фиг.1: А) Структура лантибиотика мерсацидина;
В) Вероятная последовательность препептида и последовательность зонда из 51 основания, который был применен для идентификации структурного гена.
Фиг. 2: Нуклеотидная последовательность структурного гена MRSA лантибиотика мерсацидина и дедуцированная аминокислотная последовательность препептида. Сайт связывания рибосом впереди стартового кодона АТG отделен перегородками и сайт процессинга отмечен стрелкой. Вероятный rho-независимый терминатор подчеркнут.
Фиг. 3: Сравнение лидерных последовательностей нескольких лантибиотиков. Консервативные последовательности отмечены жирным шрифтом.
Пример
1. Клонирование структурного гена мерсацидина
Вероятная последовательность пропептида мерсацидина (фиг.1,В) была дедуцирована из структуры мерсацидина и на основе общей информации о биосинтезе лантибиотиков. Был синтезирован изображенный предполагаемый зонд из 51 основания на основе предпочтительного использования кодонов Bacillus на PCR-Mate® (Applied Biosystems, Weiterstadt, FRG) и помечен диоксигенином (Boehringer Mannheim, Mannheim, FRG) (фиг.1,В). Аминобутирильные остатки (Abus - половина метиллантионина) происходят из треонинов, тогда как остатки аланина (Аlаs - половина метиллатионина) кодируются как цистеин в пропептиде. S-аминовинил-2-метилцистеин, образующий концевую кольцевую структуру, вероятно, образован из метиллантионина, который окислительно декарбоксилировался, как было показано для эпидермина, содержащего С-концевой S-аминовинилцистеин (J.Kupke еt al. (1992), Y. Bacteriol, 174: 5354-5361).
Поскольку плазмиды не могли быть обнаружены в штамме-продуценте, хромосомную ДНК готовили, как описано Marmur (Y. Marmur (1961), Y. Mol. Biol. 3: 208-218), за исключением того, что проводили только одну экстракцию хлороформом и одно осаждение и что ДНК затем растворяли в буфере для уравновешивания колонки и очищали на колонке Qiagen-tip® 100 (Qiagen, Hilden, FRG). При 51oС одну полосу 2 т.п.н. из продукта расщепления хромосом Hind 111 гибридизировали с зондом в блоте по Саузерну (E.M. Southern (1975), Y. Mol. Biol. 98: 503-517). Фрагменты размером от 1,9 до 2,3 т.п.н. вырезали из геля, элюировали при помощи BIOTRAP® (Schleicher and Schiill, Dassel, FRG) и субклонировали в pU С18 (С. Yanisch - Perron et al. (1985), Yene 33: 103-109) в Е. coli. Плазмиды некоторых рекомбинантных колоний готовили по методу Beinboim and Doly (H.C. Beinboim and Y. Dolly (1979), Nucl. Acids Res. 7: 1513-1523), расщепляли Hind 111 и гибридизировали с зондом. Один из клонов, который дал положительный сигнал, анализировали далее при помощи продуктов расщепления с различными ферментами и последующих блотов по Саузерну. Наконец, фрагмент 1,3 т. п. н. Есо R1- Hind 111 был субклонирован в pEMBL 18 и pEMBL 19 (Z. Dente et аl. (1983), Nucleic Acids Res. 11: 1645-1655) в Е. coli. Кроме того, фрагмент 0,6 т.п.н. ЕсоRV клонировали в вектор рС U1 (Y. Augustin еt al. (1992), Eur. Y. Biochem, 204: 1149-1154) после сайт-направленного мутагенеза сайта ЕсоR1 в сайт EcoRV с применением набора (кита) для трансформирующего сайт-направленного мутагенеза (Clontech, Рalo Alto, USA).
2. Нуклеотидная последовательность структурного гена мерсацидина, mrSA
Фрагмент 0,6 т.п.н. секвенировали на A.L.F. автоматическом секвенаторе ДНК (Рharmacia, Brussels, Belgium) при помощи метода дидезокси-терминации цепи (F. Sander et al. (1977), Рroс. Natl. Acad. Sci. USA 74: 5463-5467) из двухцепочечной ДНК; в качестве праймеров использовали универсальный праймер и обращенный праймер кита для секвенирования AutoRead (Pharmacia, Brussels, Belgium) и два синтетических олигонуклеотида 5' -(ТСТСТТССАТТТТТТТG)3' и 5' -(АААТСАААТТААСАААТАС) 3'. Нуклеотидная последовательность структурного гена мерсацидина, mrSА, показана на фиг.2. Потенциальный сайт связывания рибосом (АGGGGG) был обнаружен на 8 п.н. влево (в направлении 3'-5') от стартового кодона ATG открытой рамки считывания. С-концевая часть этой последовательности соответствует опубликованной первичной структуре мерсацидина (S. Chatterjee et al. (1992), Y. Antibiotics 45: 832-838) и его предложенной пропептидной последовательности. N-концевая часть состоит из лидерной последовательности из 48 аминокислот (стрелка на фиг.2). Промерсацидин состоит из 20 аминокислот. Таким образом, полная длина препептида равна 68 аминокислотам с рассчитанной молекулярной массой 7228 Да. На восемь оснований справа (в направлении 5' - 3') от стоп-кодона ТАА была обнаружена шпилечная структура с величиной свободной энергии -86,7 кдж.моль-1 и размером стебля (ножки) 14 п. н. Эта структура могла бы служить в качестве rho-независимого терминатора во время транскрипции, т.к. за ней следует последовательность ТТТАТТ (фиг.2).
3. Характеристика препептида мерсацидина
Лантибиотики подразделяются на две группы (G. Yung (1991) Supra). Лантибиотики типа А представляют собой удлиненные амфифильные пептиды, которые образуют временные поры в мембранах чувствительных к ним бактерий (H.-G. Sahl (1991), Роrе formotion in bacterial membranes by cationic lantibiotics, p. 347-358, In G. Yung and H.-G. Sahl (ed.) Hisin and novel lantibiotics, Escom, Zeiden). Лантибиотики типа В представляют собой глобулярные пептиды, продуцируемые Streptomyces, которые имеют молекулярные массы менее 2100 Да и высоко гомологичны по их аминокислотной последовательности и кольцевой структуре, которая включает в себя конденсацию "головки" с "хвостом" (G. Yung (1991), Supra). До сих пор мерсацидин не мог быть отнесен ни к одной из этих групп (G. Вierbaum and H.-G. Sahl (1993), Zbl. Bakt. 278: 1-22). В этом отношении особый интерес представляет сравнение последовательности препептида мерсацидина с последовательностями лантибиотиков типа А и типа В.
Две общие характеристики лидерных последовательностей лантибиотиков были сохранены в мерсацидине: i) в лидерной последовательности нет цистеина (G. Yung (1991), Supra); ii) склонность к α-спирали предсказана для С-концевой части лидерной последовательности. Такие структурные элементы были также предсказаны и продемонстрированы для лидерных последовательностей пептидов лантибиотиков типа А при помощи измерений кругового дихроизма в смесях трифторэтанол/вода (A.G. Beck-Sickinger and G. Yung. Synthesis and Conformational аnalysis of lantibiotic leader-, рro - аnd prepeptide р.218-230. In G. Yung and H. -G. Sahl (ed. ). Nisin and novel lantibiotics, Escom, Leiden 1991). Во всех других отношениях лидерная последовательность мерсацидина отличается от лидерных последовательностей лантибиотиков типа А, описанных к настоящему времени. Как показано на фиг.3, она скорее похожа по длине и распределению заряда (48 аминокислот/12 зарядов) на необычно длинный лидер (59 аминокислот, 11 зарядов) лантибиотика типа В циннамицин (C. Kaletta et al. (1989), Рер5, a new lantibiotic: structural gene isolation and prepeptide sequence. Arch. Microbiol. 152: 16-19). В противоположность этому типичная высокозаряженная лидерная последовательность лантибиотика типа А, например лидерный пептид Рер5, содержит 10 заряженных остатков всего лишь в 26 аминокислотах (С. Kaletta et al. (1989), Supra). Консервативные последовательности лантибиотиков типа А (например, мотив FD/NLD/Е,) не обнаружены в лидерном пептиде мерсацидина. Сайт расщепления протеазной лидерной последовательности мерсацидина (-4M--3E--2A--1A-+1C) отличается от консервативного сайта лантибиотиков типа А (фиг.3). Здесь мы находим либо сайт расщепления типа низина (-1, положительно заряженная аминокислота; -2, пролин; -3, отрицательно заряженная или полярная аминокислота и -4, гидрофобная) или сайты расщепления, содержащие гидрофобный глицин, лактицина 481 Y.-C. Piard et al. (1993), Y. Biol. Ghem., 268, 16361-16368 или стрептококцина A-FF 22 (W.Z. Hynes et al. (1993). Appl. Env. Microbiol. 59: 1969-1971). Сайт расщепления (-3А--2F--1А) циннамицина (C. Kalletta et al. (1989), Supra) согласуется с правилом (-3A--2X--1A) для белков, секретируемых через Sес-путь. В заключение можно отметить, что препептид мерсацидина не обнаруживает гомологии с консервативными последовательностями лидерных последовательностей лантибиотиков типа А. Имеется сходство с препептидом циннамицина в длине и распределении заряда, но нет очевидной гомологии последовательности на уровне аминокислот. Мерсацидин меньше, чем лантибиотики типа А, не заряжен положительно и он не деполяризует мембраны, а скорее ингибирует биосинтез пептидогликана. Это, в дополнение к свойствам лидерного пептида, свидетельствует о том, что мерсацидин более близок к лантибиотикам типа В, чем типа А. Недавно были выяснены последовательность и мостиковый паттерн другого лантибиотика - актагардина, который также ингибирует биосинтез клеточной стенки (S. Somma et al. , Antimicrob. Agents Chemother, 11: 396-401, 1977). Сравнение с мерсацидином показывает, что одно кольцо почти полностью сохранено в обоих лантибиотиках. Ввиду сильной гомологии охарактеризованных до настоящего времени лантибиотиков типа В дурамицина А, В, С, анковенина и циннамицина, эти пептиды могли бы также рассматриваться как структурные разновидности, подобно тому, как это наблюдалось для эпидермина и галлидермина или низина А и низина Z. Таким образом, мы предполагаем, что мерсацидин и актагардин должны быть классифицированы как лантибиотики типа В и что обозначение лантибиотиков типа В не должно относиться исключительно к структурным разновидностям дурамицина, но должно охватывать также небольшие глобулярные лантибиотики, которые несут низкий заряд и ингибируют активность ферментов.


Изобретение относится к биотехнологии и касается пептидного антибиотика мерсацидина и его предшественников - премерсацидина и промерсацидина, кодирующих их ДНК, векторов, содержащих эти ДНК, и генно-инженерного способа получения зрелого мерсацидина. Зрелый мерсацидин применим в качестве пептидного антибиотика против заражения пищевых продуктов метициллинрезистентным Staphylococcus aureus или для лечения инфекций, вызываемых Staphylococcus aureus у человека и животных. Изобретение может быть применимо также для получения модифицированных производных мерсацидина со смещенным антибиотическим спектром или отличающихся эффективностью. Изобретение позволяет повысить экспрессию мерсацидина или его производных. 11 с.п. ф-лы, 3 ил.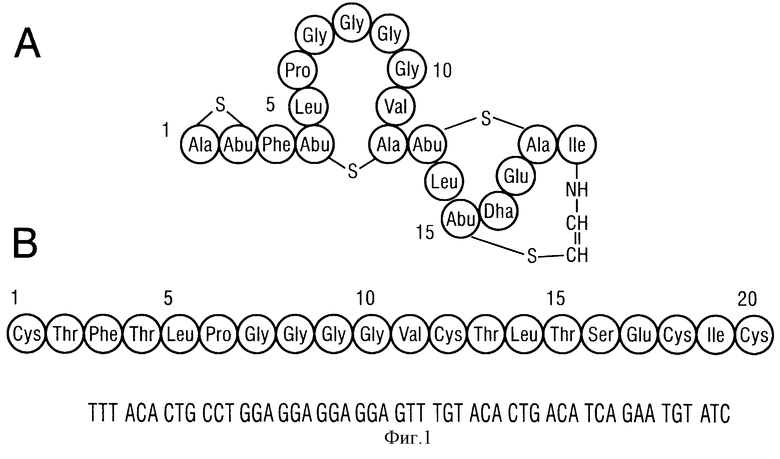
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| J | |||
| ANTIBIOTICS, 1992, №45, р.832-838 | |||
| S | |||
| CHATTERJEE et al | |||
| "Mersacidin Zantibiotic from culture of Bacillus sp | |||
| Устройство для выпрямления опрокинувшихся на бок и затонувших у берега судов | 1922 |
|
SU85A1 |
| ЩЕЛКУНОВ С.Н | |||
| Конструирование гибридных молекул ДНК | |||
| - Новосибирск, Наука, 1984, с.164. | |||
Авторы
Даты
2003-02-20—Публикация
1995-09-11—Подача