Предлагаемое техническое решение относится к биотехнологии и предназначено для использования в медицинской и микробиологической промышленности для производства альфа-2-интерферона человека, необходимого для лечения различных вирусных и онкологических заболеваний.
Продукция рекомбинантных белков в микробных клетках часто сопровождается образованием нерастворимых агрегатов, локализованных в цитоплазме и называемых телами включения (ТВ). Чтобы выделить целевой белок, удаляют контаминирующие клеточные белки, солюбилизируют белок в детергенте и восстанавливают его конформацию, получая биологически активный белок.
Известно несколько способов выделения альфа-интерферона из тел включения.
Известен способ получения альфа-интерферона, согласно которому осадок ТВ солюбилизируют в растворе 8 М гуанидинхлорида (Gdn-HCl). Для ренатурации раствор немедленно разбавляют в 4 раза 0,1 М трис-HCl буфером pH 7,5. Суспензию центрифугируют и осадок отбрасывают. 90% белка в супернатанте составляет нативный мономер альфа-интерферона. Процесс очистки белка в нативных условиях включает 4 хроматографии и конечный выход достигает 11% [1].
Также известен способ, когда рекомбинантный альфа-интерферон солюбилизируют в 8 М Gdn-HCl, после чего раствор разбавляют водой и осаждают альфа-интерферон в труднорастворимой, олигомерной форме. Осадок вновь растворяют в Gdn-HCl, затем в 2 раза разбавляют водой и наносят на адсорбционную колонку, уравновешенную раствором 3 М Gdn-HCl. Сорбированный продукт элюируют водным раствором 0,5% Твин-20 в условиях ренатурации [2].
Оба способа основаны на солюбилизации тел включения в растворе сильного денатуранта (6 - 8 М Gdn-HCl) без добавления восстанавливающих агентов. Такое растворение не разрывает неправильно замкнутые дисульфидные связи, поэтому белок в нативных условиях сохраняет значительную тенденцию к образованию олигомеров и выделяется с низким выходом.
Известен эффективный способ солюбилизации тел включения (прототип), позволяющий получить мономер альфа-интерферона быстро и с высоким выходом. Клетки разрушают лизоцимом, осадок промывают 1% Тритоном X-100 и растворяют в Gdn-HCl в присутствии дитиотреитола (DTT). Для ренатурации раствор разбавляют до концентрации гуанидина менее 3,8 М в присутствии дитиотреитола и транс-4,5-дигидрокси-1,2-дитиана (DHDT). Солюбилизация ТВ в растворе 6 М Gdn-HCl в присутствии DTT значительно повышает выход нативного мономера. Очистка нативного белка достигается гельпроникающей хроматографией [3].
Однако промышленное использование такого способа сталкивается с техническими трудностями. Полная солюбилизация ТВ в сильном денатуранте в присутствии восстанавливающих агентов достигается лишь в разбавленных растворах (концентрация белка 0,5 - 1 мг/мл), кроме того, восстанавливающие агенты токсичны. При масштабировании процесса это приводит к большому расходу Gdn-HCl, большим объемам уже на первых стадиях выделения и соответственно увеличению цены препарата. Кроме того, эффективной ренатурации альфа-интерферона из раствора сильного денатуранта путем разбавления мешают примеси, контаминирующие ТВ. Удаление примесей при масштабировании процесса особенно необходимо для получения высокого выхода целевого белка.
Задачей технического решения является разработка эффективных и пригодных для промышленного использования способов солюбилизации, очистки и эффективной ренатурации альфа-2-интерферона из штамма-продуцента, образующего нерастворимые агрегаты, представленные высокомолекулярными S-S олигомерами альфа-интерферона.
Данная задача решается тем, что разрушение клеток проводят ультразвуком, а после солюбилизации тел включения осуществляют реакцию окислительного сульфитолиза при концентрации белка 5 - 10 мг/мл в растворе, разрушая олигомеры альфа-2-интерферона. Низкомолекулярные примеси отделяют диализом реакционной смеси после сульфитолиза против 8 М мочевины, что позволяет получить стабильные выходы и повышает воспроизводимость способа.
Ренатурацию сульфитированного производного интерферона проводят в присутствии 3 - 4 М мочевины, используя смесь окисленного и восстановленного глутатиона.
Предлагаемый способ осуществлен с использованием штамма-продуцента, полученного трансформацией E.coli SG 20050 плазмидой pIF 16 [4]. Уровень биосинтеза альфа-2-интерферона в трансформированных клетках достигает 50 - 60%. По данным электронной микроскопии в клетках образуются тела включения размером 0,3 - 0,5 мкм. Клетки разрушают ультразвуком, центрифугируют и для дальнейшей работы используют осадок тел включения. Осадок тел включения промывают неионными детергентами, удаляют большую часть высокомолекулярных примесей. Полное растворение тел включения достигается в растворах 6 - 7 М Gdn-HCl.
По результатам электрофореза полученного материала в ПААГ в присутствии SDS, но без предварительной обработки 2-меркаптоэтанолом, нерастворимая фракция большей частью представляет собой сшитые дисульфидными связями олигомеры. Молекулярная масса S-S олигомеров очень высока, они не фракционируются в 15% ПААГ, задерживаясь на границе между концентрирующим и разделяющим гелем. На широкопористом носителе для гельфильтрации материал фракционируется в широких пределах - вплоть до 5 млн. дальтон. Высокая степень олигомеризации альфа-2-интерферона в составе тел включения приводит к тому, что при попытке удалить денатурирующий агент диализом против буферных растворов альфа-2-интерферон практически полностью вновь выпадает в осадок.
Реакция сульфитолиза используется для восстановления активности мономера интерферона после полной инакивации [5], ее используют и для солюбилизации ряда других рекомбинантных белков непосредственно из тел включения [6]. Для растворения тел включения, содержащих альфа-2-интерферон, реакцию сульфитолиза не использовали.
Использование окислительного сульфитолиза для разрыва неправильно замкнутых дисульфидных связей рекомбинантного альфа-интерферона в составе тел включения штамма-продуцента E. coli SG 20050 pIF 16 дает возможность быстро и эффективно растворять целевой белок в "концентрированном" виде, как сульфитированное производное.
В условиях реакции сульфитолиза растворяют альфа-2-интерферон в составе тел включения до мономера в широком диапазоне концентрации белка (5 - 10 мг/мл). Способом SDS-электрофореза в ПААГ в нередуцирующих условиях обнаруживается в основном мономерная форма интерферона в продукте после сульфитолиза (75 - 80%).
В случае недостаточной очистки сульфитированного производного от примесей при ренатурации посредством разбавления раствора реакционной смеси после сульфитолиза происходит агрегация. Примеси, контаминирующие тела включения, ассоциируют с гидрофобными группами целевого белка и препятствуют ренатурации. Чтобы избежать неоднозначных результатов при ренатурации и нестабильности выхода удаляют низкомолекулярные примеси диализом реакционной смеси после сульфитолиза против раствора слабого детергента [7]. Растворимость сульфитированного мономера альфа-2-интерферона сохраняют и повышают при изменении сильно денатурирующей среды (6 - 7 М Gdn-HCl) на слабо денатурирующую среду (7 - 8 М мочевина). Для предотвращения агрегации реакционную смесь разбавляют в 7 - 10 раз 7 - 8 М раствором мочевины и диализуют против такого же раствора.
Эффективная ренатурация достигается переформированием дисульфидных связей в присутствии смеси окисленного и восстановленного глутатиона в соотношении 1 : 10. Присутствие 3 - 4 М мочевины повышает выход ренатурированного белка.
Описанный способ получения альфа-2-интерферона из тел включения дает возможность после двухступенчатой очистки белка в нативных условиях получить гомогенный препарат с удельной противовирусной активностью не менее 1,7 • 108 МЕ/мг, не содержащий примесных белков (не более 0,2 нг/мкг) с выходом 9 - 13 мг из 1 г биомассы.
Препаративное использование данного способа позволяет получить до 400 мг нативного белка в каждом цикла из 30 г биомассы. Способ прост в применении и сочетает последовательные проточные диализы и хроматографическое разделение. Объемы диализных растворов последовательно возрастают от 200 мл на первых стадиях и не превышают 3 - 4 л на конечных стадиях диализа.
Изобретение иллюстрируется следующими примерами конкретного исполнения.
Пример 1. Удаление примесных белков промыванием осадка ТВ неионными детергентами
30 - 40 г биомассы штамма-продуцента альфа-2-интерферона E. coli SG 20050 pIF 16 суспендируют в 300 - 400 мл 50 мМ трис-HCl буфера pH 8,0, содержащего 2 мМ ЭДТА. Клетки разрушают ультразвуком, центрифугируют в течение 1 ч при 12000 об/мин при температуре 4oC. Для дальнейшей работы используют осадок.
Осадок тел включения промывают раствором Тритона X-100 1%, растирая суспензию в гомогенизаторе, и интенсивно перемешивают в течение 15 - 20 мин. Центрифугируют в течение 30 мин при 12000 об/мин при температуре 4oC.
Аналогично осадок дважды суспендируют в растворе 3 М мочевины в 50 мМ трис-HCl буфера pH 7,5. Промывочные растворы содержат набор солюбилизированных высокомолекулярных белков, но не содержат альфа-2-интерферона. Вес осадка 4 - 6 г, содержание альфа-2-интерферона 78 - 80%.
Пример 2. Растворение тел включения в гуанидинхлориде и проведение окислительного сульфитолиза
К полученному в примере 1 осадку добавляют 40 - 50 мл раствора 6 - 7 М Gdn-HCl в 100 мМ трис-HCl буфере pH 8,0, содержащем 1 мМ ЭДТА, и интенсивно перемешивают до прозрачности. Для лучшего растворения суспензию растирают в гомогенизаторе Поттера и обрабатывают ультразвуком 1 - 2 раза.
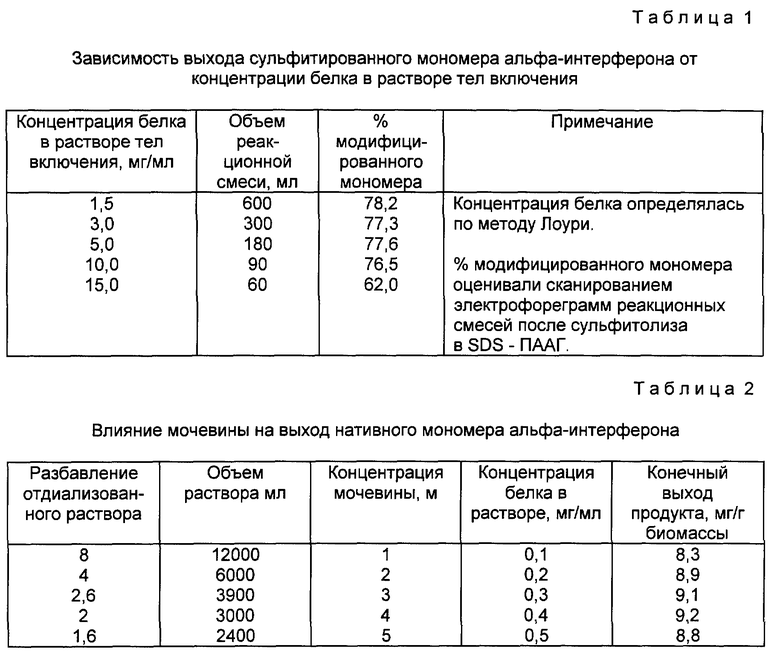
Определяют содержание белка по методу Лоури (пробу разбавляют в 200 раз, чтобы исключить влияние детергента). Раствор тел включения разбавляют 6 - 7 М Gdn-HCl до концентрации белка 5 - 10 мг/мл и проводят окислительный сульфитолиз. К раствору ТВ добавляют сухие навески сульфита натрия и тетратионата натрия (30 мг/мл и 14 мг/мл соответственно). Реакцию проводят при перемешивании 16 - 18 ч при комнатной температуре [8]. По результатам электрофореза в нередуцирующих условиях 75 - 80% белка в растворе переходит в форму сульфитированного мономера в широком диапазоне концентрации белка альфа-2-интерферона в реакционной смеси (табл.1). Для препаративной наработки высокая концентрация белка 5 - 10 мг/мл реакционной смеси позволяет оперировать с небольшими объемами раствора Gdn HCl (100 - 200 мл) без снижения выхода модифицированного мономера.
Пример 3. Очистка модифицированного мономера в денатурирующих условиях
Реакционную смесь (см. пример 2) разбавляют в 7 - 10 раз раствором 8 М мочевины в 50 мМ Na-фосфтаном буфере pH 8,0 и диализуют против такого же буферного раствора 8 М мочевины.
Пример 4. Ренатурация модифицированного мономера
Как показали результаты экспериментов (см. табл.2) присутствие 3 - 4 М мочевины повышает выход нативного мономера после ренатурации, причем объем увеличивается в 2 - 2,5 раза.
Отдиализованный раствор, полученный по примеру 3, разбавляют в 2 раза 50 мМ Na-фосфатным буфером pH 8,0, содержащим восстановленный и окисленный глутатион (концентрация 1 и 0,1 мМ соответственно). Раствор выдерживают 24 - 48 ч при 4 - 10oC и диализуют против 50 мМ Na-фосфатного буфера pH 8,0 и затем против 100 мМ Na-ацетатного буфера pH 4,6. Осадок собирают центрифугированием и отбрасывают.
Пример 5. Очистка альфа-2-интерферона в нативных условиях до гомогенности
В процессе ренатурации и последовательных диализов складывается правильная конформация молекулы альфа-интерферона.
Для очистки белка до гомогенности раствор альфа-интерферона наносят на колонку СМ-52 целлюлозы и элюируют линейным градиентом соли (0 - 0,3 М) NaCl в 100 мМ Na-ацетатном буфере pH 4,6.
Отделение мономерной формы от ди-, тримеров альфа-интерферона проводят гель-фильтрацией на сефадексе G-50 в 100 мМ Na-ацетатном буфере pH 4,6, содержащем 0,12 М NaCl.
Двухступенчатой очистки в нативных условиях достаточно для получения препарата со следующими показателями качества:
- чистота препарата не менее 95% в редуцирующих условиях и не менее 90% в нередуцирующих условиях (по результатам SDS-электрофореза в ПААГ);
- удельная противовирусная активность альфа-2-интерферона не менее 1,7 • 108 МЕ/мг;
- препарат нетоксичен в культуре клеток и на животных;
- содержание примесных белков не более 0,2 нг/мкг белка;
- содержание примеси нуклеиновых кислот не более 40 пг/мг белка.
Выход конечного продукта варьирует от 9 до 13 мг из 1 г биомассы.
Промышленная применимость
Эффективный и пригодный для масштабирования способ солюбилизации, очистки и эффективной ренатурации альфа-2-интерферона из штамма-продуцента, образующего нерастворимые агрегаты, представленные высокомолекулярными S-S олигомерами альфа-интерферона, дает возможность после двухступенчатой очистки белка в нативных условиях получить гомогенный препарат с удельной противовирусной активностью не менее 1,7 • 103 МЕ/мг, не содержащий примесных белков (не более 0,2 нг/мкг) с выходом 9-13 мг из 1 г биомассы.
Использование данного способа позволяет получить до 400 мг нативного белка в каждом цикле из 30 г биомассы. Способ прост в применении и сочетает последовательные проточные диализы и хроматографическое разделение. Объемы диализных растворов последовательно возрастают от 200 мл на первых стадиях и не превышают 3-4 л на наконечных стадиях диализа.
Источники информации
1. Thatcher D.R., Panayotatos N. Purification of Recombinant Human IFN- α2. Methods in Enzymology, 1986, v. 119, p.166-177.
2. Заявка ФРГ N 3511011 "Способ выделения и очистки альфа-интерферона", опубл. 02.10.86.
3. Wilson M.J., Freedman R.B., Fitton J.E. Recovery, Refolding and Purification α2 -Interferon. Biochemical Society Transactions 1988, 76, 1, p. 58-60.
4. Патент РФ N 2054041 "Рекомбинантная плазмидная ДНК pIF16, кодирующая зрелый лейкоцитарный интерферон-альфа-2- человека, штамм E.coli-продуцент зрелого лейкоцитарного интерферона-альфа-2 человека". БИ N 4, опубл. 10.02.96.
5. Fanger J. A. , Pestka S. Procedure for Reduction and Reoxidation of Human Leukocyte Interferon. Methods in Enzymology, 1986, v. 119, p.248-255.
6. Marston F.A. The purification of eukaryotic polypeptides synthesized in Escherichia coli - Biochem. J. 1986, 240 (1), 1-12.
7. Патент США N 4512922 "Очистка и обеспечение активности осажденных гетерологичных протеинов", опубл. 23.04.85.
8. Panayotis G.K., et al. Studies of the Synthesis of Insulin from Natural and Synthetic A and B Chains. I. Splitting of Insulin and Isolation of the S-Sulfonated Derivatives of the A and B Chains. Biochemistry 1967, v.6, N 9, p. 635.
Способ предназначен для использования в медицинской и микробиологической промышленности для производства альфа-2-интерферона человека. Разрушение клеток проводят ультразвуком, солюбилизацию тел включения и разрушение олигомеров интерферона проводят реакцией окислительного сульфитолиза при концентрации белка 5-10 мг/мл в растворе 6-7 М Gdn-HCl. Низкомолекулярные примеси отделяют диализом против 7-8 М мочевины, ренатурацию сульфитированного производного проводят в присутствии 3-4 М мочевины в смеси окисленного и восстановленного глутатиона в соотношении 1:10. Способ позволяет получить до 400 мг нативного белка из 30 г биомассы и пригоден для масштабирования. 2 табл.
Способ получения рекомбинантного интерферона-альфа-2 из нерастворимых тел включения, включающий разрушение клеток, удаление примесных белков промыванием осадка неионным детергентом, солюбилизацию тел включения 6 - 7 М Gdn-HCl, ренатурацию полученного продукта и хроматографическую очистку с получением целевого продукта, отличающийся тем, что разрушение клеток проводят ультразвуком, а после солюбилизации тел включения осуществляют реакцию окислительного сульфитолиза при концентрации белка 5 - 10 мг/мл в растворе 6 - 7 М Gdn-HCl, полученное сульфитированное производное диализуют против 7 - 8 М мочевины и ренатурируют смесью окисленного и восстановленного глутатиона в соотношении 1 : 10 в присутствии 3 - 4 М мочевины.
| Biochemical Society Transactions, 1988, v.76, p.58 - 60 | |||
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PIF16, КОДИРУЮЩАЯ ЗРЕЛЫЙ ЛЕЙКОЦИТАРНЫЙ ИНТЕРФЕРОН α ЧЕЛОВЕКА, ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ ЗРЕЛОГО ЛЕЙКОЦИТАРНОГО ИНТЕРФЕРОНА α ЧЕЛОВЕКА | 1992 |
|
RU2054041C1 |
| Methods in Enzymology | |||
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
| Способ получения бензидиновых оснований | 1921 |
|
SU116A1 |
| Деревянная повозка с кузовом, устанавливаемым на упругих дрожинах | 1920 |
|
SU248A1 |
Авторы
Даты
1998-12-10—Публикация
1996-07-31—Подача