Область изобретения
Настоящее изобретение относится в основном к ацетилгидролазе фактора активации тромбоцитов, а более точно к новым выделенным и изолированным полинуклеотидам, кодирующим ацетилгидролазу фактора активации тромбоцитов к ацетилгидролазным продуктам, кодированным полинуклеотидами, к материалам и методам для рекомбинантного получения ацетилгидролазных продуктов и к материалу антител, специфичных в отношении ацетилгидролазы фактора активации тромбоцитов.
Уровень техники
Фактор активации тромбоцитов (PAF) - биологически активный фосфолипид, синтезированный различными видами клеток. In vivo (в биологических опытах) и при нормальных концентрациях от 10-10 до 10-9 М, PAF активизирует клетки-мишени, такие как тромбоциты и нейтрофилы, посредством связывания специфических G соединенных протеиновых поверхностных рецепторов клеток. [Venable et at. , J.Lipid Res., 34: 691-701 (1993)]. PAF имеет структуру 1-O-алкил-2-ацетил-sn-глицеро-3-фосфохолина. Для оптимальной биологической активности sn-1 положение глицеринового каркаса PAF должно быть связано эфиром с жирными спиртами и положение sn-3 должно иметь фосфохолин в составе головной группы.
Функции PAF являются нормальными физиологическими процессами (напр. при воспалениях, гемостазе и родах) и протекают при патологических воспалительных процессах (напр. при астме, анафилаксии, при септических шоках и артритах) [Venable et al. , supra, и Lindsberg et al., Ann. Neurol., 30: 117-129 (1991)] . Вероятность использования PAF в ответной патологической реакции обеспечивает быстрый ответ, позволяющий модулировать активность PAF, и основное направление этого ответа приводит к антагонистической активности PAF, которая вредит взаимодействию PAF с поверхностными рецепторами клеток. Смотри, например, Heueref et al., Clin, Exp. Allergy, 22: 980-983 (1992).
Синтез и секреция PAF так же, как и его деградация и очистка, должны тщательно регулироваться. Для достижения того, чтобы патологическая воспалительная реакция PAF стала результатом несоответствия механизма регулирования PAF, обеспечивающей чрезмерное усиление процесса получения неподходящего продукта или недостаточной деградации, альтернативное решение предполагает моделирование активности PAF, включающей имитацию или усиление естественного процесса, в результате которого может возникать воспаление. Макрофаги [Stafforini et al., J.Biоl. Сhem., 265(17): 9682-9687 (1990)], гепатоциты и человеческая гепатомная линия клеток HepG2 [Satoh et al., Jclin. Invest., 87: 476-7-481 (1991) и Tarbet et al., J. Biоl. Сhеm., 266(25): 16667-16673)] , как это сообщалось для случая увеличения активности ферментов, PAF ацетилгидролаза (PAF-AH), приводит к инактивации PAF. Кроме того, увеличивая инактивацию PAF, PAF-AH также приводит к инактивации активности фрагментированных при окислении фосфолипидов, таких как продукты активации последовательности арахидоновой кислоты, которые участвуют в процессах воспаления. См. Stremler et al., J.Biol. Chem., 266(17): 11095-11103 (1991). Инактивация PAF посредством PAF-AH осуществляется первоначально посредством гидролиза PAF sn-2 ацетиловой группы и PAF-AH метаболизма окислительно-фрагментированных фосфолипидов посредством удаления sn-2 ацильных групп. Были определены два типа PAF-АН: в форме цитоплазмы, обнаруженной в клетках различных видов и в тканях, таких как клетки эндотелия и эритроциты, и внеклеточные формы, найденные в плазме и сыворотке крови. PAF-AH из плазмы не гидролизует неповрежденные фосфолипиды кроме PAF, и этот субстрат специфически позволяет ферментам циркулировать in vivo в полностью активном состоянии без противоположного эффекта. PAF-AH из плазмы позволяет объяснить полную деградацию PAF в человеческой крови ex vivo [Stafforini et at., J. Biоl. Chem., 262(9): 4223-4230 (1987)].
В то время как цитоплазматические формы PAF-AH плазмы имеют идентичные специфические свойства субстрата, PAF-AH из плазмы имеет биохимические характеристики, которые отличают ее от других PAF-AH из цитоплазмы и также других свойств липаз. В частности PAF-AH из плазмы, ассоциированная с липопротеиновыми частицами, подавляется диизопропилфторфосфатом, не подвержен воздействию ионов кальция, относительно нечувствителен к протеолизу и имеет среднюю молекулярную массу порядка 43000 Да. Смотри Stafforini et al. (1987), supra. В той же самой статье Stafforini et al. приводят описание процедуры для частичного выделения PAF-AH из плазмы человека и смеси аминокислот материала плазмы, полученного с использованием этой процедуры. Цитоплазматический PAF-AH был получен выделением эритроцитов, как это описано в работе Stafforini et al., J. Biol. Chem., 268(6): 3857-3865 (1993) и десяти концевых аминоостатков цитоплазматического PAF-AH, также описанного в этой статье. Hattori et al., J, Biol. Chem., 268(25): 18748-18753 (1993) описывает процесс выделения цитоплазматического PAF-AH из бычьего мозга. Последующая обработка первоначально полученных последовательностей нуклеотидов бычьего мозга цитоплазматического PAF-AH была опубликована в работе Hattori et al., J. Biol. Chem 269(237); 23150-23155 (1994). 5 января 1995 г., спустя три месяца после выхода указанной работы нуклеотидная последовательность для липопротеина ассоциированного фосфолипазой A2 (Lp-PLA2), была опубликована в Smithkline Beecham PLC Patent Cooperation Treaty (PCT) International Publication No. WO 95/00649. Нуклеотидная последовательность Lp-PLA2 отличается одной позицией при сравнении с PAF-AH настоящего изобретения. Различие нуклеотидов (в соответствии с положением 1297 SEQ ID NO: 7) приводит к различию аминокислот ферментов, кодированных полинуклеотидами. Аминокислота в положении 379 SEQ ID NO: 8 является валином, в то время как аминокислота в соответствующем положении в Lp-PLA2 является аланином. Кроме того, нуклеотидная последовательность PAF-AH в соответствии с настоящим изобретением включает 124 основания на 5' конце и двадцать оснований на 3' конце, которые не присутствуют в Lp-PLA2 последовательности. Три месяца спустя, 10 апреля 1995 г., Lp-PLA2 последовательность была депонирована в GenBank под No. U24577, который отличается на одиннадцать позиций по сравнению с нуклеотидной последовательностью PAF-AH настоящего изобретения. Различие нуклеотидов (соответствующих позициям 79, 81, 84, 85, 86, 121, 122, 904, 905, 911, 983 и 1327 SEQ ID NO: 7) приводит к различию в четырех аминокислотах между ферментами, закодированными полинуклеотидами. Аминокислоты на позициях 249, 250, 274 и 389 SEQ ID NO: 8 являются соответственно лизином, аспарагиновой кислотой, фенилаланином и лейцином, в то время как соответствующая аминокислота на соответствующем положении в GenBank последовательности являются изолейцином, аргинином, лейцином и серином.
Рекомбинантный продукт PAF-AH делает возможным использование экзогенного PAF-AH в подобных или усиленных нормальных процессах рассасывания воспаления in vivo. Введение PAF-AH обеспечивает физиологическое преимущество после введения PAF антагонистического рецептора, так как PAF-AH является продуктом, обычно входящим в состав плазмы. Итак, вследствие того, что PAF рецепторы являются антагонистами, которые относятся по своей структуре к PAF, подавляющим природу активной PAF-AH активности, желаемое превращение PAF и окислительное фрагментирование фосфолипидов оказывается предотвращенным. Подавление активности PAF-AH посредством рецептора антагонистического противодействия PAF соответственно блокирует RAF рецептор посредством антагониста. Смотри Stremler et at. , supra. Кроме того, в области острого воспаления, например, при наличии окислителей, происходит инактивация природных ферментов PAF-AH по сравнению с увеличением локального уровня PAF и PAF-подобных составов, которые взаимодействуют с экзогенно вводимым PAF рецептором, являющимся антагонистом для взаимодействия с PAF рецептором. Наоборот, обработка с использованием рекомбинантного PAF-AH увеличивает активность эндогенного PAF-AH и компенсирует любые инактивирующие эндогенные ферменты.
Итак, существует необходимость идентифицировать и выделить последовательность полинуклеотидов человеческой плазмы кодирующих PAF-AH, чтобы получить материалы и методики, полезные для производства рекомбинантной PAF-AH, и производить реагенты для определения PAF-AH в плазме.
Сущность изобретения
Настоящее изобретение предусматривает получение выделенных и изолированных полинуклеотидов (т.е. DNA (ДНК) и RNA (РНК) как кодирующих, так и некодирующих участков, PAF-AH кодирующих PAF-AH человеческой плазмы или активных фрагментов этих ферментов. Предпочтительно DNA последовательность настоящего изобретения включает геномические и cDNA последовательности, а также полностью или частично химически синтезированные DNA последовательности. DNA последовательность кодирует PAF-AH, определена в SEQ ID NO: 7, и DNA последовательность, которая гибридизирует в некодированные цепи при строго определенных условиях или может быть гибридизирована, но для случая избыточности генетического кода, рассматривается в данном изобретении. Также целью этого изобретения является биологическое реплицирование (т.е. копирование изолированных DNA последовательностей, сделанных in vivo или in vitro) DNA последовательностей настоящего изобретения. Автономно реплицирующие рекомбинантные конструкции, такие как плазмида и вирусные DNA векторы, включающие PAF-AH последовательности и особенно векторы, где DNA, кодирующая PAF-AN, непосредственно связана экспрессией с эндогенной или экзогенной регулирующей DNA последовательностью, а также терминатор транскрипции, также рассматривается в данном изобретении.
В соответствии с другим аспектом изобретения прокариотические (procariotic) или эукариотические (eucariotic) клетки-хозяева постоянно трансформируются DNA последовательностью в соответствии с изобретением, позволяя создать желаемую PAF-AH, экспрессируемую этими структурами. Продукты экспрессии PAF-AH клеткой-хозяином могут служить различным полезным целям. Такие клетки служат ценным источником иммуногенов для развития массы антител и особенно иммунореактивов с PAF-AH. Клетка-хозяин в соответствии с изобретением особенно полезна в методах для высокопроизводительных систем PAF-AH, где клетки развиваются в соответствующей культурной среде и требуемые полипептиды выделяются из клеток или из среды, в которой клетки развиваются с использованием, например, иммуноаффинной очистки.
Неиммунологический метод настоящего изобретения, позволяющий выделить PAF-AH из плазмы, предусматривает следующие этапы: (а) отделение частиц липопротеинов с низкой плотностью; (b) растворение этих липопротеиновых частиц с низкой плотностью в буфере, содержащем 10 мМ CHAPS для создания первого PAF-AH раствора ферментов; (с) помещение этого первого PAF-AH раствора ферментов на анионит DEAE в анионообменную колонку; (d) промывку указанного DEAE в анионообменной колонке с применением буфера с рН около 7,5 и содержащего 1мМ CHAPS; (e) элюирование PAF-AH фермента из указанного анианита DEAE в анионообменной колонке в виде фракции с использованием буфера с рН приблизительно 7,5, включающего градиент от 0 до 0,5 М NaCl; (f) получение фракций элюата из указанной DEAE в анионообменной колонке, имеющих активные ферменты PAF-АН; (g) концентрирование указанного состава активной фракции из DEAE в анионообменной колонке до 10 мМ CHAPS с целью создания второго раствора ферментов PAF-AH; (h) помещение указанного второго раствора ферментов PAF-АН в аффинную колонку с использованием аффинного лиганда голубого красителя; (i) элюирование фермента PAF-AH в указанной аффинной колонкe из аффинного лиганда, голубого красителя с применением буфера, содержащего 10 мМ CHAPS и chaotropic соли; (j) использование элюата из аффинного лиганда голубого красителя в аффинной колонне с Сu аффинным лигандом; (k) элюирование фермента PAF-AH в аффинной колонке из Сu аффинного лиганда с использованием буфера, содержащего 10 мМ CHAPS и имидазол; (I) воздействие на элюат из аффинной колонки с Сu аффинным лигандом в SDS-PAGE; и (m) выделение приблизительно 44 кДа фермента PAF-AH из SDS-полиакриламидного геля. Предпочтительно, чтобы буфер на стадии (b) представлял собой 25 мМ Tris-HCl, 10 мМ CHAPS, pH 7,5; буфер на стадии (а) содержал 25 мМ Tris-HCl, 1 мМ CHAPS; на стадии (h) предполагается использование колонки Blue Sepharose Fast Flow; буфер, используемый на стадии (i) содержит 25 мМ Tris-HCl, 10 мМ CHAPS, 0,5 М KSCN, pH 7,5; на стадии (j) предусматривается использование колонны Сu Chelating Sepharose; и буфер на стадии (k) содержит 25 мМ Tris-HCl, 10 мМ CHAPS, 0,5 М NaCl, 50 мМ имидазола при pH в пределах от 7,5 до 8,0.
Предлагаемый настоящим изобретением способ выделения ферментативноактивного PAF-AH из Е.соli, позволяющий получить PAF-AH, включает следующие этапы: (а) приготовление супернатанта центрифугированием из лизированной Е. соli с получением PAF-AH ферментов; (b) помещение этого центрифугированного супернатанта в аффинную колонку с аффинным лигандом голубого красителя; (с) элюирование фермента PAF-AH в этой аффинной колонке из аффинного лиганда голубого красителя, используя буфер, содержащий 10 мМ CHAPS и chaotropic соль; (d) помещение указанного элюата из аффинной колонки с аффинным лигандом голубого красителя в аффинную колонку с аффинным Сu лигандом; и (е) элюирование фермента PAF-AH в аффинной колонки из аффинного Сu лиганда с использованием буфера, содержащего 10 мМ CHAPS и имидазол. Предпочтительно, чтобы колонна на этапе (b), была Blue Sepharose Fast Flow; буфер на этапе (с) содержал 25 мМ Tris-HCl, 10 мМ CHAPS, 0,5 M KSCN, pH 7,5; колонка на этапе (d) была Сu Chelating Sepharose; и буфер на этапе (е) содержал 25 мМ Tris-HCl, 10 мМ СНАРS, 0,5 М NaCl, 100 мМ имидазола, pH 7,5.
Другой метод, предлагаемый данным изобретением, предусматривает выделение активных ферментов PAF-AH из Е.cоli, обеспечивающий получение PAF-AH, включает следующие этапы: (а) подготовку центрифугированного супернатанта из лизированных Е.соli с получением фермента PAF-AH; (b) разбавление этого центрифугированного супернатанта в буфере с низким pH, содержащим 10 мМ CHAPS; (с) помещением этого разбавленного центрифугированного супернатанта в катионообменную колонку при равновесном уровне pH порядка 7,5; (d) элюирование фермента PAF-AH из указанной катионообменной колонки с использованием 1 М соли; (е) повышение pH указанного элюата, полученного из этой катионообменной колонки, и доведение концентрации соли в этом элюате до величины порядка 0,5 М соли; (f) помещение указанного подготовленного элюата, полученного из катионообменной колонки в аффинную колонку с аффинным лигандом голубого красителя; (g) элюирование фермента PAF-AH в указанной аффинной колонке из аффинного лиганда голубого красителя, с использованием буфера, содержащего приблизительно от 2 М до 3 М соли; и (h) диализ указанного элюата из аффинной колонки из аффинного лиганда голубого красителя, используя буфер, содержащий 0,1% Tween. Желательно, чтобы буфер на стадии (b) содержал 25 мМ MES, 10 мМ CHAPS, 10 мМ EDTA, pH 4,9; колонка на этапе (с) является колонкой S sepharose с равновесием на уровне 25 мМ MES, 10 мМ CHAPS, 1 мМ EDTA, 50 мМ NaCl, pH 5,5; PAF-AH элюируется на стадии (d) с использованием 1 мМ NaCl; pH элюата на стадии (е) доводится до pH 7,5, благодаря введению 2 М Tris основания; на стадии (f) предполагается использование sepharose колонки; буферная жидкость, используемая на стадии (g), содержит 25 мМ Tris, 10 мМ CHAPS, 3 M NaCl, 1 мМ EDTA, pH 7,5; и буфер на стадии (h) содержит 25 мМ Tris, 0,5 М NaCl, 0,1% Tween 80, pH 7,5.
Еще один способ, предусматриваемый данным изобретением, обеспечивающий возможность выделения активных ферментов PAF-AH из E.coli, включает следующие этапы: (а) приготовление E.coli экстракта, получаемого растворением супернатанта PAF-AH после лизиса в буфере, содержащем CHAPS; (b) разбавление указанного супернатанта и помещение его в анионообменную колонку, равновесную на уровне pH 8,0; (с) элюирование фермента PAF-AH из указанной анионообменной колонки; (d) использование этого элюата из анионообменной колонки в аффинной колонке с аффинным лигандом голубого красителя; (е) элюирование в аффинной колонке из аффинного лиганда голубого красителя с применением буфера, содержащего 3,0 М соли; (f) разбавление элюата с голубым красителем в соответствующем буфере для выполнения хроматографии с применением гидроксилапатита (гидроксифосфата); (g) выполнение гидроксилапатитовой хроматографии с использованием буфера (содержащего или не содержащего CHAPS) для промывки и элюирования; (h) разбавление указанного элюата гидроксилапатита до требуемой концентрации соли для проведения катионообменной хроматографии; (i) помещение указанного разбавленного элюата гидроксилапатита в катионообменную колонку с уровнем pH в диапазоне примерно от 6,0 до 7,0; (j) элюирование PAF-AH из указанной катионообменной колонки с использованием буфера соответствующего состава; (k) проведение процесса катионообменной хроматографии при пониженных температурах; и (l) составление рецептуры PAF-AH в жидкой или замороженной форме без применения CHAPS.
Желательно на стадии (а) иметь лизисовый буфер, содержащий 25 мМ Tris, 100 мМ NaCl, 1 мМ EDTA, 20 мМ CHAPS, pH 8,0; на стадии (b) разведение супернатанта для анионообменной хроматографии выполняется в соотношении 3-4 с применением 25 мМ Tris, 1 мМ EDTA, 10 мМ CHAPS, pH 8,0 и в этом процессе используется Q-Sepharose колонка с установившимся равновесием, достигаемым с использованием 25 мМ Tris, 1 мМ EDTA, 50 мМ NaCl, 10 мМ CHAPS, pH 8,0; на стадии (с) анионообменная колонка элюируется с применением 25 мМ Tris, 1 мМ EDTA, 350 мМ NaCl, 10 мМ CHAPS, pH 8,0; на стадии (d) элюат, полученный на стадии (с), используется непосредственно в аффинной колонке с аффинным лигандом голубого красителя; на стадии (е) колонка элюируется с использованием буфера, содержащего 3 М NaCl, 10 мМ CHAPS, 25 мМ Tris, pH 8,0; на стадии (f) разведение элюата голубого красителя для гидроксилапатитовой хроматографии осуществляется посредством разведения в 10 мМ фосфате натрия, 100 мМ CHAPS, pH 6,2; на стадии (g) гидроксилапатитовая хроматография проводится с использованием гидроксилапатитовой колонки с равновесием, достигнутым с применением 10 мМ фосфата калия, 100 мМ NaCl, 10 мМ CHAPS и элюирование производится с применением 50 мМ фосфата натрия, 100 мМ NaCl (с использованием или без применения этого соединения) 10 мМ CHAPS, pH 7,5; на стадии (h) разбавление указанного гидроксилапатитового элюата для катионообменной хроматографии осуществляется посредством введения в буфер, имеющий pH приблизительно от 6,0 до 7,0, содержащего фосфат натрия (с использованием или без применения CHAPS); на стадии (i) используется S Sepharose колонка в равновесном состоянии, достигаемом применением 50 мМ фосфата калия, (с применением или без использования) 10 мМ CHAPS, pH 6,8; на стадии (j) элюирование обеспечивается применением соответствующего состава буфера, такого как фосфат калия 50 мМ, 12,5 мМ аспарагиновой кислоты, 125 мМ NaCl, pH 7,5, содержащего 0,01% Tween-80; и на стадии (k) катионообменная хроматография осуществляется при 2-8oС. Примеры соответствующих буферных составов для использования на этапе (l), который обеспечивают стабильность PAF-AH, включают 50 мМ фосфата калия, 12,5 мМ аспарагиновой кислоты, 125 мМ NaCl pH 7,4 (возможно, с добавлением или без добавления Tween-80, и или Pluronic F68) или 25 мМ фосфата калия в качестве буфера, содержащего (по крайней мере) 125 мМ NaCl, 25 мМ аргинина и 0,01% Tween-80 (с добавлением или без добавления Pluronic F68 в количестве около 0,1 и 0,5%).
Еще один способ, предлагаемый настоящим изобретением, предусматривает для выделения активных ферментов rPAF-AH в качестве продукта, получаемого из Е. соli, включает стадии: (а) приготовление экстракта Е.соli, который обеспечивает получение в качестве конечного продукта растворимого rPAF-AH супернатанта после лизиса в буферной жидкости, содержащей Triton Х-100, (b) разведение указанного супернатанта и использование его для иммобилизации металлического аффинитета обменной колонки в состоянии равновесии при рН около 8,0; (с) элюирование продукта rPAF-AH из указанного иммобилизированного металлического аффинитета обменной колонки с буферной жидкостью, содержащей имидазол; (d) доведение до требуемой концентрации соли и помещение этого элюата, полученного из указанного иммобилизированного металлического аффинитета обменной колонки, в гидрофобную интерактивную колонку (НIС#1); (е) элюирование указанного НIС#1 посредством уменьшения концентрации соли и/или увеличения концентрации детергента; (f) титрования указанного НIС#1 элюата до получения рН близкого к 6,4; (g) использование этого приготовленного НIС# 1 элюата в катионообменной колонке (СЕХ#1) с выравниванием рН до величины близкой к 6,4; (h) элюирование указанного СЕХ#1 с использованием концентрированного хлорида натрия; (i) доведение указанного СЕХ#1 элюата, содержащего хлорид натрия, до концентрации порядка 2,0 М; (j) помещение указанного приготовленного СЕХ#1 элюата в гидрофобную интерактивную колонку и использование примерно 2,0 М (НIС#2) в состоянии равновесия на уровне рН 8,0 и около 2,0 М с использованием хлорида натрия; (k) элюирование указанного Н1С#2 посредством снижения концентрации соли и/или увеличения концентрации детергента; (l) разведение указанного Н1С#2 элюата и доведение до величины рН на уровне порядка 6,0; (m) помещение приготовленного Н1С#2 элюата в катионообменную колонку (СЕХ#2) с выравниванием равновесного состояния на уровне рН 6,0; (n) элюирование rPAF-AH продукта из указанного СЕХ#2 с использованием соответствующего буфера.
Желательно, чтобы на стадии (а), рассмотренной выше, использовался лизис-буфер, содержащий 90 мМ TRIS, 0,125% Triton X-100, 0,6 М NaCl, pH 8,0, и лизис протекал в гомогенизаторе высокого давления; на стадии (b) супернатант разводится в равновесном буфере (20 мМ TRIS, 0,5 NaCl, 0,1 Triton X-100, pH 8,0), цинк-хелатная колонка (Chelating Sepharose Fast Flow, Pharmacia, Uppsala, Швеция) заправляется, приводится в состояние равновесия с использованием буфера, загружается разбавленным супернатантом и промывается 20 мМ TRIS, 0,5 М NaCl, 4 М мочевиной, 0,1% Triton X-100, pH 8,0, и производится последующая промывка 20 мМ TRIS, 0,5 М NaCl, 0,02% Triton X-100, pH 8,0; на этапе (с) элюирование производится с использованием 20 мМ Tris, 50 мМ имидазола, 0,02% Triton X-100, pH 8,0; на этапе (d) элюат соответствует 1 мМ EDTA и 2 М NaCl, Phenyl Sepharose 6 Fast Flow (Pharmacia) приводится в состояние равновесия с использованием буфера (2,0 М NaCl, 25 мМ Tris, 0,02% Triton X-100, pH 8,0), загружается подготовленным элюатом из этапа (с) при комнатной температуре, промывается выравнивающим буфером и промывается с использованием 25 мМ NaPO4, 0,02% Triton X-100, pH 6,5 при расходе 30 см/ч; на стадии (е) элюирование производится с применением 25 мМ NaPO4, 3% Triton X-100, pH 6,5; на стадии (g) Macro-Prep High S колонка (Bio-Rad Labs, Richmond, CA) приводится в состояние равновесия с применением буфера (20 мМ NaPO4, 0,02% Triton X-100, pH 6,4), загружается полученным на этапе (f) элюатом, промывается равновесным буфером и промывается 25 мМ Tris, 0,02% Triton X-100, pH 8; на этапе (h) элюирование производится с использованием 25 мМ Tris, 0,02% Triton X-100, 1,3 М NaCl, pH 8,0; на этапе (j) Bakerbond Wide Pore Hi-PropyI С3 (Baker, Phillipsburg, NJ) приводится в состояние равновесия с применением выравнивающего буфера (2,0 М NaCl, 25 мМ Tris, 0,02% Triton Х-100, pH 8,0), загружается подготовленным на этапе (i) элюатом при комнатной температуре, промывается равновесным буферном и промывается 25 мМ Tris, 0,02% Triton X-100, pH 8,0 при 30 см/ч; на этапе (k) элюирование производится с использованием 10 мМ Tris, 3,0% Triton X-100, pH 8,0; на этапе (l) разведение производится в равновесном буфере (20 мМ сукцината, 0,1% PLURONIC F68, pH 6,0); на этапе (m) SP Sepharose Fast Flow (Pharmacia) колонка приводится в состояние равновесия с использованием равновесного буфера из этапа (l), загружается элюатом из этапа (I) и промывается равновесным буфером; и на этапе (n) элюэнт содержит 50 mm NaPO4, 0,7 M NaCl, 0,1% PLURONIC F68, 0,02% TWEEN 80, pH 7,5.
Продукт PAF-АН может быть получен выделением из материала природных клеток или может быть синтезирован химическими методами, но образуется в результате процедуры рекомбинации, включающей прокариотические или эукариотические клетки-хозяина в соответствии с изобретением. Продукты PAF-AH частично или полностью характеризуются аминокислотными последовательностями в соответствии с SEQ ID NO: 8, как это и следовало предполагать. Специфические их особенности заключаются в том, что они являются фрагментами в которых недостает первых двенадцати N-концевых аминокислот PAF-AH взрослого человека аминокислотной последовательности, вошедшей в SEQ ID NO: 8, в частности имеющих Met46, Ala47 или Ala48 SEQ ID NO:8, как первоначальные N-концевые аминокислоты. Также рассматриваемые компоненты является фрагментом, в котором недостает до тридцати С-концевых аминокислот аминокислотной последовательности SEQ ID NO: 8, в частности имеющих Ilе429, и Leu431, как С-концевой остаток. В дальнейшем рассматриваются варианты, являющиеся разновидностями PAF-AH или таких PAF-AH, которые имеют аминокислотную замену в последовательности SEQ ID No: 8 выбранную из групп, содержащих S 108 A, S 273 A, D 286 A, D 286 N, D 296 А, D 394 А, D 338 А, Н 351 А, Н 395 А, Н 399 А, С 67 S, С 229 S, C 291 S, С 334 S, С 407 S, D 286 А, D 286 N и D 304 А. Как указывалось выше, закодированные полинуклеотидами (включая DNA), фрагменты или варианты фрагментов, предусмотренные изобретением так же, как и методы получения рекомбинантнных таких фрагментов или их вариантов посредством выращивания клеток-хозяев, включают и такие как DNA. Ранее рассмотренные продукты PAF-AH включают прокариотические полипептидные продукты экспрессии кодированных DNA аминокислотных групп Met46 посредством Asn441 SEQ ID NO: 8, в форме rРН. 2, и прокариотический полипептидный продукт экспрессии закодированных DNA аминокислотных групп Met46 посредством Ile429 SEQ ID NO: 8, в форме rРН. 9. Оба этих продукта rРН.2 и rРН.9 обладают меньшей амино-концевой гетерогенностью, чем, например, соответствующий прокариотический продукт экспрессии закодированной DNA полностью развитой последовательности PAF-AH, предшествующий трансляции первоначального кодона. Более того, продукт гРН.9 показывает большую карбокси-концевую гомогенность (последовательность). Использование клеток-хозяев млекопитающих предусматривается для таких пост-трансляционных видоизменений (напр. миристоляции, гликозилирования, срезания, липидизации и тирозин, серии или треонин фосфоризации) которые могут быть необходимы для создания условий оптимальной биологической активности рекомбинантных продуктов экспрессии по изобретению. Продукты PAF-AH в соответствии с изобретением могут быть в форме полипептидов полной длины, фрагментов или их вариантов. Варианты могут включать аналоги PAF-AH, в которых одно или более соединений (напр. природно закодированных) аминокислот исключены или заменены, или в которых добавлены одна или более видов аминокислот: (1) без потери одной или более ферментационной активности или иммунологических характеристик, специфических для PAF-AH; или (2) со специфическим частичным нарушением биологической активности PAF-AH. Протеины или другие молекулы, которые связаны с PAF-AH, могут быть использованы для модуляции их активности.
Кроме того, этим изобретением предусматриваются материалы антител (напр. моноклональные и поликлональные антитела, антитела с единой цепью, химерные антитела, CDR-привитые антитела и др. подобные им) и другие связанные протеины, специфические для PAF-AH. Специфическими примерами связанных протеинов в соответствии с изобретением являются моноклональные антитела, получаемые посредством гибридов 90G11D и 90F2D, которые были депонированы в Американской коллекции типовых культур (АТСС), 12301 Parklawn Drive, Rockville, MD 20852 30 сентября 1994 г. и были соответственно определены как Accession Nos. HB 11724 и НВ 11725. Другим примером связанных протеинов в соответствии с изобретением являются моноклональные антитела, получаемые посредством гибридомы 134А, которая была депонирована в АТТС 1 июня 1995 г. и определена как Accession No. HB 11900, Протеины или другие молекулы (напр. липиды или малые молекулы), которые специфически связаны с PAF-AH, могут быть идентифицированы в плазме, используя PAF-AH, изолированный от плазмы, рекомбинантный PAF-AH, PAF-AH варианты или клетки, такие как продукты экспрессии. В то же время связанные протеины оказываются полезными в составе материала для иммобилизации так же, как и для выделения PAF-AH, и полезны при определении или оценке содержания PAF-AH в средах или образцах тканей посредством известных иммунологических процедур. Возможно также использование антиидиотипических антител, характерных для PAF-AH-специфических субстанций антител.
Предметом патентования является также научное значение информационного вклада, достигнутого при открытии DNA и аминокислотной последовательности в соответствии с настоящим изобретением. Как один из многочисленных примеров, знание последовательности c-DNA для PAF-AH делает возможным выделение DNA / DNA гибридизации геномической последовательности DNA, кодирующей PAF-AH, и специфической экспрессии регулируемых последовательностей PAF-AH, таких как стимуляторы, операторы и др. DNA / DNA процедуры гибридизации выполняется с DNA последовательностями настоящего изобретения при условиях строгого соблюдения норм, в частности процесса, позволяющего выделять кодирующую DNA аллельного варианта PAF-AH, других структурных элементов протеинов одного или более биохимических и/или иммунологических свойств PAF-AH, и соединений гомологов протеинов PAF-AH, не свойственных организму человека. Информационная последовательность DNA, принятая в данном изобретении, также делает возможным развитие посредством рекомбинирования гомологов или "выбивания" рекомбинантных DNA [см. напр. Kapecchi, Science, 244: 1288-1292 (1989)] грызунов, при котором затруднено определение функционального фермента PAF-AH, или которое определяет вариант PAF-AH фермента. Полинуклеотиды в соответствии с изобретением, когда они соответственно маркированы, используются для исследования гибридизации с целью определения способности клеток к синтезу PAF-AH. Полинуклеотиды в соответствии с изобретением могут также служить основой диагностических методик, используемых для идентификации генетического изменения (генетических изменений) в локус PAF-AH, который лежит в основе болезненного состояния или состояний. Кроме того, с использованием настоящего изобретения возможно использование этих нечувствительных полинуклеотидов для регулирования экспрессии PAF-AH с применением этих клеток, которые обычно осуществляют этот процесс.
Далее рассматриваются результаты введения PAF-AH, приготовленного в соответствии с изобретением, в организм млекопитающего, особенно человека, с целью улучшения условий патологических воспалений. Основываясь на условиях патологического воспаления, связанного с применением PAF-AH, было обнаружено, что введение PAF-AH служит признаком, например, при лечении астмы [Miwa et al., J. Clin. Invest., 82; 1983-1991 (1988); Hsieh et al., J. Allergy Clin. Immunol. , 91: 650-657 (1993); и Yamashita et al., Allergy, 49: 60-63 (1994)] , анафилаксии (Venable et al., supra], шоков [Venable et al., supra] , перфузионных нарушений и ишемии центральной нервной системы [Lindsberg et al., (1991), supra], вызванных антигенами артритов [Zarco et al., Clin. Exp. Immunol., 88: 318-323 (1992)], атерогенезиса [Handley et al. , Drug Dev. Res., 7: 361-375 (1986)], заболевания Крона [Denizot et al., Degestive Disease and Science, 37(3): 432-437 (1992)], ишемического некроза кишечника / некрозного энтероколита [Denizot et al., supra и Caplan et al., Acta Paediatr., Suppl. 396: 11-17 (1994)], язвенных колитов (Denizot et al., supra), ишемического шока [Satoh et al., Stroke, 23: 1090-1092 (1992)], ишемических повреждений мозга [Lindsberg et al. , Stroke, 21: 1452-1457 (1990) и Lindsberg et al., (1991) supra], соматического волчаночного эритематоза [Matsuzaki et al., Clinica Chimica Acta, 210: 139-144 (1992)], острого панкреатита [Kald et al., Pancreas, 8(4): 440-442 (1993)], септицемии (Kald e tal. , supra), острого постстрептококкового гломерулонефрита [Mezzano et al. , J. Am. Soc. Nephrol., 4: 235-242 (1993), легочного отека, наступающего после IL-2 терапии [Rabinovici et al. , J. Сlin. Invest., 89: 1669-1673 (1992)] , аллергических воспалений [Watanabe et al., Br. J.Pharmacol., 111: 123-130 (1994)], ишемической почечной недостаточности [Grino et al., Annals of Internal Medicine, 121(5): 345-347 (1994); отклонениях при родах [Hoffman et al., Am. J. Obstet. Gynecol., 162(2): 525-528 (1990) и Maki et al., Proc. Natl. Sci. USA, 85: 728-732 (1988)]; синдрома респираторного недомогания у взрослых [Rabinovici et al. , J. Appl. Physiol., 74(4): 1791-1802 (1993); Matsumoto et al., Clin. Exp. Pharmacol. Physiol., 19 509-515 (1992); и Rodriguez-Roisin et al., J. CHn. Invest., 93: 188-194 (1994)]. Здесь также рассматривается использование препарата PAF-AH для воздействия на инфекцию вируса человеческого иммунодефицита (HIV) центральной нервной системы. "Воздействие", как описывается здесь, включает как профилактику, так и терапевтическое лечение.
Известны описания патологических исследований, выполненных на животных. Например, модели исследований астмы и ринита на мышах описаны в примере 16 этой работы; модель артритов кролика описана в работе Zarco at al., supra; опыты с крысами при ишемических некрозах кишечника / некрозных энтероколитах описаны в работе Furukawa et al., Ped. Res., 34, (2): 237-241 (1993) и Caplan et al., supra; опыты паралича у кролика описаны в исследованиях Lindsberg et al. , (1990), supra; эксперименты с волчанкой у мыши описаны в работе Matsuzaki et al., supra; исследования острого панкреатита у крыс описаны у Kald et al., supra: модель легочного отека у крысы после IL-2 терапии описана у Rabinovici et al., supra; модель аллергического воспаления у крысы приводится у Watanabe et al., supra); модель почечного аллотрансплантата собаки описана в работе Watson et al., Transplantation, 56(4): 1047-1049 (1993); и модель синдрома острого респираторного заболевания у крысы и морской свинки соответственно описана в исследовании Rabinovici et al., supra, и LeIlouch-Tubiana, Am. Rev. Respir. Dis, 137: 948-954 (1988).
Специфической особенностью изобретения является состав PAF-AH используемый при лечении млекопитающих, чувствительных или страдающих от патологических условий введения PAF-AH, включая введение PAF-AH млекопитающим в количестве, достаточном для увеличения эндогенной активности PAF-AH и для инактивации патологического действия PAF-AH у млекопитающих.
Предусмотренный настоящим изобретением терапевтический/фармацевтический состав включает продукты PAF-AH и физиологически приемлимые растворы или носители и может также включать другие компоненты, обладающие противовоспалительным эффектом. Приводимая количественная дозировка достаточна для увеличения эндогенной активности PAF-AH и для инактивации патологического действия PAF. Определение дозы приводится в Remmington's Pharmaceutical Sciences, 18 издание, Mack Publishing Co., Taston, PA (1990). Дозировка изменяется в пределах от 0,1 до почти 1000 мг PAF-AH/кг веса тела. Терапевтический состав в соответствии с изобретением может допускать изменения в соответствии с патологическими условиями применения. Например, посредством внутривенного введения, подкожно, соматически, суппозиторно и/или через легкие.
Для патологических условий легких может быть рекомендовано внутрилегочное введение PAF-AH. Предполагается, что использование внутрилегочного введения доз может осуществляться с применением различных устройств для введения, включая, например, распылители, дозирующий ингалятор и ингалятор порошков, которые имеют общее назначение. Введение различных протеинов в легкие и систему кровообращения путем ингаляции аэрозольных форм описано в Adjei et al., Pharm. Res., 7(6): 565-569 (1990) [лейпролид ацетат]; Braquet et al., J. Cardio. Pharm., 13 (Supp. 5) s. 143-146 (1989) (эндотелин-1); Hubbard et al. , Annals of Internal Medicine, III (3), 206-212 (1989) (α1- антитрипсин); Smith et al., J. Clin. Invest., 84: 1145-1146 (1989) (α-1-протеиназа ингибитор); Debs et al. , J. lmmunol., 140: 3482-3484 (1993) (рекомбинантный гамма-интерферона и фактор альфа некрозного новообразования); Patent Cooperation Treaty (PCT) International Publication No. WO 94/20069, опубликовано 15 сентября 1994 г. (рекомбинант пегелированных гранулоцитарных лейкоцитов колоний фактора стимуляции).
Детальное описание чертежей
Множество других аспектов и особенностей настоящего изобретения будут ясны на основании последующего детального его описания в соответствии с чертежами, приводимыми ниже:
Фиг. 1 - фотография PVDF мембраны, содержащей выделенную из человеческой плазмы PAF-AH.
Фиг. 2 - диаграмма, показывающая активность ферментов рекомбинантного PAF-AH из человеческой плазмы.
Фиг. 3 - схематическая диаграмма, иллюстрирующая изображение фрагментов рекомбинантного PAF-AH и их каталитическую активность.
Фиг.4 представляет результаты масс-спектрометрического анализа рекомбинантного продукта PAF-AH, rРН.2.
Фиг.5 представляет результаты масс-спектрометрического анализа рекомбинантного продукта PAF-AH, rРН.9.
Фиг. 6 - диаграмма, иллюстрирующая блокирование отека лап у крыс, вызванного RAF, при локальном введении рекомбинантного PAF-AH в соответствии с настоящим изобретением.
Фиг. 7 - диаграмма, иллюстрирующая блокирование отека лап у крыс, вызванного RAF, при внутривенном введении PAF-AH.
Фиг. 8 - диаграмма, показывающая, что PAF-AH блокирует вызывающий PAF отек, но не устраняет отека, вызванного зимосан-А.
Фиг. 9А и 9В представляют результаты ответной реакции в зависимости от дозы антивоспалительной активности PAF-AH при отеке лап у крыс.
Фиг. 10А и 10В представляют результаты, иллюстрирующие in vivo эффективность одной дозы PAF-AH во времени.
Фиг.11 - график, представляющий фармакокинетику PAF-AH при перемещении в организме крысы
Фиг. 12 - диаграмма, показывающая антивоспалительный эффект PAF-AH по сравнению с меньшим эффектом антагонистов PAF при отеках лап крыс.
Фиг. 13 представляет результаты, показывающие, что PAF-AH нейтрализует эффект паралича кондиционированной средой с HIV-1-инфицированных и активированных моноцитов,
Детальное описание изобретения
Приводимые ниже примеры иллюстрируют настоящее изобретение. Пример 1 представляет новый способ выделения PAF-AH из человеческой плазмы. Пример 2 описывает определение аминокислот первичной структуры короткого фрагмента макромолекулы PAF-AH, выделенный из плазмы человека. Клонирование полной длины кодированного cDNA PAF-AH плазмы человека описывается в примере 3. Идентификация предполагаемого спайсинга вариантов PAF-AH генов плазмы человека описывается в примере 4. Клонирование геномических последовательностей закодированной PAF-AH из плазмы человека описано в примере 5. Пример 6 описывает клонирование cDNA гомологов собаки, быка, цыпленка, грызунов и макаки и PAF-AH cDNA из человеческой плазмы. Пример 7 представляет результаты исследования признаков активности ферментов рекомбинантного PAF-AH трансляционной экспрессии в COS 7 клетки. Пример 8 описывает экспрессию полной длины, срезания и химер человеческого PAF-AH DNA в Е. coli, S. cerevisiae и клетки млекопитающих. Пример 9 представляет процедуру выделения рекомбинанта PAF-AH из Е. coli и результаты исследований, подтверждающие активность его ферментов. Пример 10 описывает различные рекомбинантные продукты PAF-AH, включая аминокислотные замещенные аналоги и амино- и карбокси-укороченные продукты и описывает эксперименты, демонстрирующие, что чистый PAF-AH, выделенный из плазмы, гликодилируется. Результаты исследования назерн-блоттинга PAF-AH RNA из плазмы человека в различных тканях и клеточных линиях представлены в примере 11, в то время как результаты in situ гибридизации представлены в примере 12. Пример 13 описывает развитие моноклональных и поликлональных антител, специфических для PAF-AH из плазмы человека. Примеры 14, 15, 16, 17, 18 и 19 соответственно описывают in vivo терапевтический эффект введения рекомбинантного продукта PAF-AH в соответствии с настоящим изобретением при остром воспалении, плеврите, астме, некрозном энтероколите, синдроме респираторного заболевания и панкреатите в опытах с животными. Пример 20 описывает in vitro эффект рекомбинантного продукта PAF-AH на нейротоксикоз, вызванный HIV инфекцией. Пример 21 представляет результаты иммунологического исследования сыворотки людей с дефицитом активности PAF-AH и описывает идентификацию генетического поражения у пациентов, которые, вероятно, действительно обладают таким дефицитом.
Пример 1
PAF-AH бал выделен из человеческой плазмы с целью определения аминокислотной последовательности.
А. Оптимизация условий выделения
Первоначально частицы липопротеина низкой плотности (LDL) осаждались из плазмы с использованием фосфорного вольфрамата, растворялись в 1% Tween 20 и подвергались хроматографическому исследованию с применением DEAE анионнообменной колонки (Pharmacia, Uppsala, Швеция) в соответствии с методикой, предложенной Stafforini et al, (1987), supra, но при изменении активности PAF-AH, элюированной из DEAE, требуется повторное растворение и соответствующие условия для проведения процесса выделения.
Tween 20, CHAPS (Pierce Chemical Co., Rockford, IL) и октилглюкозид были получены центрифугированием и хроматографической очисткой геля с целью обеспечения возможности растворения LDL частиц. CHAPS обеспечивает на 25% большую активность при растворении, чем Tween 20 и на 300% большее восстановление активности при растворении, чем октилглюкозид. LDL осадок растворялся в 10 мМ CHAPS и затем был выделен с использованием анионита DEAE Sepharose Fast Flow колонки (анионообменная колонка; Pharmacia) с буфером, содержащим 1 мМ CHAPS для обеспечения достаточно большого количества частично выделенного PAF-AH ("DEAE пул") позволившего оценить качество дополнительных колонок.
DEAE пул был использован для приготовления материала, применяемого для тестирования различных хроматографических колонок, используемых для дальнейшего выделения активной PAF-AH. Исследования выполнялись: с колонками Blue Sepharose Fast Flow (Pharmacia), аффинными колонками с аффинным лигандом голубого красителя; S-Sepharose Fast Flow (Pharmacia), катионообменными колонками с экстракцией; аффинными колонками Сu Chelating Sepharose (Pharmacia), с аффинным лигандом голубого красителя; Fractogel S (ЕМ Separations, Gibbstown, NJ), катионообменной колонкой; и Sephacryl-200 (Pharmacia), колонкой с фильтрацией геля. Все эти хроматографические процедуры обеспечивали низкий выход, неудовлетворительный уровень выделения, если использовались с 1 мМ CHAPS. Последующая гелевая фильтрационная хроматография на Sephacryl S-200 в 1 мМ CHAPS обеспечивала получение фракции активных ферментов, которые элюировались выше граничного размера, чем предполагаемая величина, приблизительно 44 кДa. Полученные этими методами результаты позволяют сделать вывод, что LDL протеины были агрегированы в растворе.
Различные пробы LDL были оценены посредством аналитической гель-фильтрационной хроматографии для агрегированного состава активности PAF-АН. Пробы из DEAE pool и свежерастворенного LDL преципитата были проанализированы на Superose 12 (Pharmacia) с применением равновесного буфера с 1 мМ CHAPS. Обе пробы были элюированы в широком диапазоне молекулярных весов с наибольшей активностью свыше 150 кДa. Когда пробы были затем проанализированы на Superose 12 с применением равновесного буфера 10 мМ CHAPS, уровень активности составлял 44 кДa, как и ожидалось для активной PAF-AH. Однако пробы, содержащие некоторое количество активной PAF-AH в области с высоким молекулярным весом, соответствовали степени агрегирования.
Другие пробы, элюированные активной PAF-AH, были выявлены исключительно в области 44 кДa, когда они впоследствии были протестированы посредством гелевой фильтрации. Эти пробы были LDL преципитатом, растворенным в 10 мМ CHAPS в присутствии 0,5 М NaCl и свежего DEAE пул, который был приведен в равновесное состояние с использованием 10 мМ CHAPS после элюирования из DEAE колонки. Эти данные показывают, что, по крайней мере, 10 мМ CHAPS требуется для поддержания неагрегированного состояния PAF-AH. Увеличение концентрации CHAPS от 1 до 10 мМ после хроматографии на DEAE, но перед последующими хроматографическими этапами является результатом значительного различия для процессов выделения. Например, степень выделения PAF-AH на S-Sepharose Fast Flow была увеличена с 2 до 10 раз. Активность PAF-AH при использовании Blue Sepharose Fast Flow колонки становится необратимой при использовании 1 мМ CHAPS, однако колонка обеспечивает повышенный уровень выделения в 10 мМ CHAPS. He была также улучшена DEAE хроматография при предварительном добавлении 10 мМ CHAPS.
Хроматография активносго PAF-AH на Сu Chelating Sepharose после Blue Sepharose Fast Flow колонки показала 15-кратное изменение концентрирования. Было также определено, что активная PAF-AH может быть повторно получена из восстановленного SDS-полиакриламидного геля, если пробы не подвергались кипячению. Активность материала, элюированного из Сu Chelating Sepharose колонки, если использовался электрофорез SDS-полиакриламидный гель, совпадает с главными окрашенными полосами протеина, если гель был окрашен серебром.
В. Процедура выделения PAF-AH
Новая процедура выделения PAF-AH для определения последовательности аминокислот включает следующие этапы, осуществляемые при 4oС. Плазма человека была разведена в 900 мл аликвотах в 1 литровом сосуде Nalgene и доведена до рН 8,6. Затем частицы LDL были осаждены посредством добавления 90 мл 3,85% фосфорвольфрамата натрия и последующего добавления 23 мл 2 М MgCl2. Затем плазма была центрифугирована в течение 15 минут при 3600 g. Осадок был повторно переведен в фазу суспензии в 800 мл 0,2% цитрата натрия. LDL был повторно осажден путем добавления 10 г NaCl и 24 мл 2 М MgCl2. Частицы LDL были гранулированы посредством центрифугирования в течение 15 минут при 3600 g. Такая промывка осуществлялась дважды. Затем гранулы были заморожены при -20oС, Частицы LDL из 5 л плазмы были повторно переведены в форму суспензии в 5 л буфера (25 мМ Tris-HCl, 10 мМ CHAPS, pH 7,5) и подвергались перемешиванию в течение ночи. Растворенные частицы LDL были центрифугированы в течение 1,5 часа при 3600 g. Супернатанты были перемешены и профильтрованы с применением фильтровальной бумаги Whatman 113 с целью удаления любых оставшихся частиц твердой фазы. Растворенный супернатант LDL был загружен в DEAE Sepharose Fast Flow колонку (11•10 см; 1 объем L смолы; 80 мл/мин), уравновешен в буфере В (25 мМ Tris-HCl, 1 мМ CHAPS, pH 7,5). Колонка была промыта буфером В до тех пор, пока абсорбция не возвратилась к исходному уровню. Протеин был элюирован с использованием 8 л 0-0,5 М NaCl градиента и было получено 480 мл фракции. Эта стадия была необходима для получения фиксации Blue Sepharose Fast Flow колонки, указанной ниже. Фракции были исследованы для определения активности ацетилгидролазы методом, описанным в примере 4.
Активные фракции были собраны и достаточное количество CHAPS было добавлено, чтобы создать около 10 мл CHAPS. DEAE пул был помещен накануне вечером при 4 мл/мин в Blue Sepharose Fast Flow колонку (5•10 см; 200 мл рабочего объема), приведенную в равновесное состояние с использованием буфера А, содержащего 0,5 М NaCl. Колонка была промыта равновесным буфером при 16 мл/мин, до тех пор, пока абсорбент не достигал равновесного состояния, Активная PAF-AH была элюирована с использованием буфера А, содержащего 0,5 М KSCN (chaotropic salt) при 16 мл/мин и собрана в виде 50 мл фракций. Этот этап позволил получить более чем 1000-кратное выделение. Активные фракции были собраны и пул доверен до рН 8,0 благодаря введению 1 М Tris-HCl рН 8,0. Активный пул из Blue Sepharose Fast Flow хроматографического процесса был помещен в Сu Chelating Sepharose колонку (2,5•2 см; 10 мл рабочий объем; 4 мл/мин), приведенный в состояние равновесия буфером С [25 мМ Tris-HCl, 10 мМ CHAPS, 0,5 М NaCl, рН 8,0 (возможно также рН 7,5)], и колонка была промыта 50 мл буфера С. Активная PAF-AH была элюирована 100 мл 50 мМ имидазола в буфере С и собрана 10 мл фракции. Фракции, содержащие активную PAF-AH, были собраны и подвергнуты повторному диализу с применением буфера А. Кроме того, для того чтобы обеспечить 15-кратную концентрацию активной PAF-AH, Cu Chelating Sepharose колонка обеспечивала малую степень очистки. Сu Chelating Sepharose пул был восстановлен в 50 мМ DTT в течение 15 мин при 37oС и помещен на 0,75 мм, 75% гель полиакриламида. Срезы геля производились через каждые 0,5 см и помещались в имеющуюся микроцентрифугу с трубками, содержащими 200 мкл 25 мМ Tris-HCl, 10 мМ CHAPS, 150 мМ NaCl. Срезы были собраны и подвергнуты инкубации накануне вечером при 4oС. Супернатант каждого гелиевого среза затем был исследован для определения активного PAF-AH с целью определения, какие протеиновые полосы на SDS-PAGE, содержат активную PAF-AH. Активная PAF-AH была найдена в полосе приблизительно 44 кДa. Протеин из дуплицированного геля был подвергнут электроблоттингу с использованием PVDF мембраны (Immobilon-P, Millipore) и окрашен Coomasse Blue, Фотография PVDF мембраны представлена на фиг. 1.
Как следует из таблицы 1, приводимой ниже, было выделено около 200 мг PAF-AH (2•106 единиц) из 5 л плазмы человека. Для сравнения, как это описано у Stafforim et al. (1987), supra, было выделено 3•104 проб активности PAF-AH.
Итак, следующие этапы были уникальными и критическими для успешного выделения PAF-AH из плазмы для определения первичной структуры короткого фрагмента макромолекулы: (1) растворимость и хроматография в 10 мМ CHAPS, (2) хроматография с использованием аффинной колонки с аффинным лигандом голубого, таким как Blue Sepharose Fast Flow, (3) хроматография на аффинной колонке с аффинным к голубым Сu лигандом, такой как Сu Chelating Sepharose, и (4) элюирование PAF-AH из SDS-PAGE.
Пример 2
Для секвенирования аминокислом протеиновая полоса около 44 кДa из PVDF мембраны, содержащей PAF-AH, в примере 1, были удалены и секвенированы, используя Applied Biosystems 473A Protein секвенатор. Анализ М-концевых последовательностей для приблизительно 44 кДa протеиновой полосы, соответствующей активной PAF-AH, показал, что эти связи содержат две основные последовательности и две минорные последовательности. Соотношение двух основных последовательностей составляло 1:1 и было довольно трудно интерпретировать данные этих последовательностей.
Для различения последовательностей двух основных протеинов, которые разделялись на SDS геле, сдвоенная PVDF мембрана, содержащая приблизительно 44 кДa полосу, была разрезана на две части, так что верхняя ее часть и нижняя часть этой мембраны были раздельно использованы для секвенирования.
N-концевые последовательности, полученные для нижней половины мембраны:
SEQ ID NO: 1
FKDLGEENFKALVLIAF
Определение основных данных протеина показало, что эта последовательность является фрагментом человеческой сыворотки альбумина человеческой сыворотки. Верхняя половина той же самой PVDF мембраны была также секвенирована, и N-концевая аминокислотная последовательность был определена как:
SEQ ID NO: 2
IQVLMAAASFGQTKIP
Эта последовательность не имела сочетаний каких-либо протеинов в своей исследуемой основе и отличалась от N-концевой аминокислотной последовательности:
SEQ ID NO: 3
MKPLVVFVLGG,
о которой сообщалось для эритроцитов цитоплазматического PAF-AH в работе Stafforini et al. (1993), supra. Новая последовательность (SEQ ID NO: 2) была использована для клонирования cDNK кодированной PAF-AH человеческой плазмы, как это описывается ниже в примере 3.
Пример 3
Полная длина клона кодированной PAF-AH из человеческой плазмы была выделена из макрофага cDNA библиотеки.
А. Конструкция макрофага cDNA библиотеки
Poly A + RNA была получена из макрофагов периферийных моноцитов крови. Двойные цепи дефосфолированные cDNA были созданы, используя Invitrogen Copy Kit (San Diego, CA) и BstXI адаптеры легированные предварительно с cDNA для вставки в вектор экспрессии млекопитающихся, pRc/CMV (Invitrogen). Полученные плазмиды были введены в Е.соli штамм XL-1 Blue посредством электропорации. Трансформированные бактерии были размещены с плотностью около 3000 колоний на агаровую пластинку на всех 978 пластинках. Плазмида DNA была приготовлена отдельно из каждой пластины и была сохранена в индивидуальных пулах и также была объединена в большие пулы, каждый из которых содержал 300000 клонов.
В. Скрининг библиотеки посредством PCR
Библиотека макрофагов была классифицирована посредством полимеризационных цепных реакций, использующихся для создание олигонуклеотидного PCR праймера, основанного на новой N-концевой аминокислотной последовательности, описанной в примере 2. Последовательность праймера, приведенного ниже, была указана по IUPAC номенклатуре, где "I" - инозин.
SEQ ID NO: 4
5'ACAYGAATTCGGIATCYTTIGTYTGICCRAA 3'
Таблица выбора кодона Wanda et al., Nuc. Acids Res., 19S: 1981-1986 (1991) была использована для выбора нуклеотидов в третьем положении каждого кодона праймера. Праймер был использован в комбинации со специфическим праймером для SP6 или Т7 промоторами последовательностей, каждая из которых расположена по бокам клонирующих сайтов pRc/CMV, для того чтобы разделять пул библиотеки макрофагов, содержащей 300000 клонов. Все PCR реакции содержат 100 нг темплата cDNK, 1 мг каждого праймера, 0,125 мМ каждого dNTP, 10 мМ Tris-HCl pH 8,4, 50 мМ MgCl2 и 2,5 единиц Taq полимеров. Начальная ступень денатурации проводилась при 94oС в течение четырех минут и при последующих 30 циклов увеличивалась в течение 1 минуты при 94oС, 1 мин при 60oС и 2 мин при 72oС. Конечный PCR продукт был клонирован в pBluescript SK- (Stratagene, La Jolla, CA), и его нуклеотидная последовательность определена посредством методики dideoxy chain termination. PCR продукт содержал последовательности, предсказанные посредством новой пептидной последовательности и соответствуют нуклеотидам 1 до 300 SEQ ID NO: 7.
PCR праймер, приводимый ниже, который специфичен для клонированного PCR фрагмент описанного ранее, использовался для идентификации полной длины клона.
Сенсибилизирующий праймер (SEQ ID NO: 5)
5'TATTTCTAGAAGTGTGGTGGAACTCGCTGG 3'
Десенсибилизирующий праймер (SEQ ID NO: 6)
5'CGATGAATTCAGCTTGCAGCAGCCATCAGTAC 3'
PCR реакция с использованием праймера была проведена, как это было описано выше, для первого выделения cDNA пула, содержащего 300000 клонов, и затем соответствующей субпопуляции малых пулов, содержащих 3000 клонов. Три пула, содержащие 3000 клонов, которые производят продукт PCR ожидаемого размера, были затем использованы для трансформирования бактерий.
С. Скрининг библиотеки посредством гибридизации
DNA из трансформированных бактерий был впоследствии выделен посредством гибридизации, используя оригинальные клонированные фрагменты PCR. Колонии были перенесены на нитроцеллюлозу и прегибридизированны и гибридизированы в 50% формамиде, 0,75 хлориде натрия, 0,075 М цитрате натрия, 0,05 М фосфате натрия, рН 6,5, 1% поливинилпиролидине, 1% Ficoll, 1% альбумина бычьей сыворотке и 50 нг/мл разрушенной под действием ультразвука на DNA спермы лосося. Гибридизированные пробы были маркированы посредством случайно гексамером. После проведения накануне вечером гибридизации при 42oС продукт переноса был обширно промыт в 0,03 М хлориде натрия, 3 мМ цитрате натрия, 0,1% SDS при 42oС. Была определена нуклеотидная последовательность нуклеотидов 10 гибридизированных клонов. Один из клонов, клон sAH 406-3, содержал предсказанную последовательность близкой подлинной пептидной последовательности активной PAF-AH, выделенной из человеческой плазмы. DNA и выведенная аминокислотная последовательность PAF-AH человеческой плазмы определена в SEQ ID NОs: 7 и 8 соответственно.
Клон SAH406-3 содержит 1,52 kb вставку с открытой рамкой считывания, которая кодирует предсказанный протеин из 441 аминокислоты. У концевых аминогрупп один относительно гидрофобный сегмент из 41 остатка стоит перед N-концевой аминокислотой (изолейцин расположен на позиции 42 SEQ ID NO: 8), идентифицированной посредством определения первичной структуры короткого фрагмента макромолекулы протеина. Код протеина, таким образом, может иметь либо длинную сигнальную последовательности, либо сигнальная последовательность плюс дополнительный пептид, который расщепляет готовые функциональные ферменты. Присутствие сигнальной последовательности является одной из характеристик секреции протеинов, Кроме того, протеин, закодированный посредством клона SAN406-3, включает согласованность GxSxG взаимодействия (аминокислоты 271-275 SEQ ID NO: 8) которая, вероятно, содержит активный сайт серина всех известных липаз млекопитающих,
микробные липазы и протеазы серина. См. Chapus et at., Biochimie, 70: 1223-1224 (198) и Brenner, Nature, 334: 528-530 (1998).
Таблица 2 позволяет сравнить аминокислотный состав PAF-AH человеческой плазмы по настоящему изобретению в соответствии с SEQ ID NO: 8 и аминокислотный состав выделенного материала, описанный у Stafforini et al. supra.
Состав аминокислот после выращенный из развитой PAF-AH из человеческой плазмы в соответствии с изобретением и аминокислотный состав ранее выделенного материала полученной PAF-AH из плазмы человеческой крови виден совершенно ясно.
Когда сравнительный анализ, выполненный Hattori et al., supra, первичной структуры, нуклеотида и найденные аминокислотные последовательности PAF-AH из цитоплазмы бычьего мозга с нуклеотидом и аминокислотной последовательностью PAF-AH из человеческой плазмы настоящего изобретения был проведен, не было обнаружено сколько-нибудь подобной структуры в этих последовательностях.
Пример 4
Предполагаемый вариант сплайсов PAF-AH генов человека был определен для случая, когда PCR был выполнен на макрофаге и стимулирована РВМС cDNA с использованием праймеров, которые гибридизированы в 5' нетранслированный участок (нуклеотиды с 31 по 52 SEQ ID NO: 7) и ключевой участок трансляции терминации кодона на 3' окончании PAF-AH cDNA (нуклеотиды 1465 до 1487 SEQ ID NO: 7). PCR выход реакции проявился в образовании двух полос на геле, причем одна соответствовала ожидаемому размеру PAF-AH cDNA из примера 3, а другая оказалась на 100 bp короче. Секвенирование обеих полос показывает, что большая полоса соответствовала PAF-AH cDNA из примера 3, в то время как более короткие полосы показывают отсутствие экзона 2 (пример 5, приводимый ниже) у PAF-AH последовательности, которая кодирует предполагаемый сигнал и пропептидную последовательность PAF-AH из плазмы. Предварительно полученная каталитическая триада и все цистеины были представлены в коротком клоне, тем не менее биохимическая активность протеина, закодированного посредством клона, вероятно, подобна той, которая существует у ферментов плазмы.
Чтобы начать биологические исследования PAF-AH вариантов сплайсов, которые предшествуют кодированию цитоплазматических активных ферментов, было определено относительное содержание двух форм моноцит-производных макрофагов в крови с использованием RNase защиты. Никакой информации не было обнаружено в свежеприготовленных изолированных моноцитах, однако два сообщения были выявлены на второй день in vitro в различии моноцитов в макрофагах и сохранялись в течение 6 дней культивирования. Количество таких сообщений было примерно эквивалентно на протяжении периода дифференциации. Наоборот, аналогичные анализы нервных тканей обнаруживают, что только полная длина переноса, предшествующая кодированию полной длины внеклеточных форм PAF-AH, четко проявляется в этом процессе.
Пример 5
Была также определена последовательность генома PAF-AH из человеческой плазмы. Структура гена PAF-AH была определена посредством выделения лямбда и Р1 фагов клонов, содержащих человеческие геномы DNA, посредством гибридизации DNA в строго определенных условиях. Фрагменты клонов фагов были субклонированы и секвенированы с использованием праймеров, предназначенных для получения постоянных интервалов всего cDNA клона sAH 406-3. Кроме того, новые секвенированые праймеры, предназначенные для ренатурации в области интрона боковых экзонов, были использованы для обратной последовательности экзон-интронных границ с целью подтверждения этой последовательности. Экзон/интронные границы были определены как точка, где геномисческая и cDNA последовательности разветвляются. Выполненные анализы обнаружили, что PAF-AH гена человеческого содержит 12 экзонов.
Экзоны 1, 2, 3, 4, 5, 6 и частично 7 были выделены из мужских эмбриональных плацентных библиотек, сконструированных в lamda FIX (Stratagene). Пятна фага были перенесены на нитроцеллюлозу и прегибридизированы и гибридизированы в 50% формамиде, 0,75 М хлористом натрии, 75 мМ цитрате натрия, 50 мМ фосфате натрия (рН 6,5), 1% поливинилпиролидоне, 1% альбулина бычьей сыворотке и 50 нг/мл DNA спермы лосося, разрушенной ультразвуком. Гибридизированные пробы использовались для идентификации клонов фагов, содержащих экзоны 2-6 и частично 7, состоящие из целых cDNA клонов sAH 406-3. Клон, содержащий экзон 1, был определен с использованием фрагмента, полученного из 5' конца cDNA клона (нуклеотиды с 1 до 312 SEQ ID NO: 7). Обе пробы были маркированы 32P случайно посредством гексамера. После проведенной накануне вечером гибридизации при 42oС блоттинг был экстенсивно промыт в 30 мМ хлористом натрии, 3 мМ цитрате натрия, 0,1% SDS при 42oС, DNA последовательности экзонов 1, 2, 3, 4, 5 и 6 с частично окружающей последовательностью интронов была определена в SEQ ID NOs: 9, 10, 11, 12, 13, и 14 соответственно.
Остатки экзона 7 так же, как и экзонов 8, 9, 10, 11 и 12, были субклонированы Р1 клона из PI библиотеки геномов. Пятна фага Р1 были блоттированы на нитроцеллюлозу и подвергнуты прегибридизации и гибридизации в 0,75 М хлористом натрии, 50 мМ фосфате натрия (рН 7,4), 5 мМ EDTA, 1% поливинилпиролидоне, 1% Ficoll, 1% бычьей сыворотке альбумина, 0,5% SDS, и 0,1 мг/мл от общего количества DNA человека. Гибридизированные зонды, меченные 32P, случайно гексамером, содержали 2,6 kb EcoR1 фрагмент геномической DNA, полученный из 3' lambda клона, выделенного выше. Этот фрагмент содержит экзон 6 и частично экзон 7, присутствующий на клоне фага. После проведенной накануне вечером гибридизации при 65oС блоттинг был промыт, как это было описано выше. DNA последовательность экзонов 7, 8, 9, 10, 11 и 12 с частично окружающей внутренней последовательностью была определена в SEQ ID NOs: 15, 16, 17, 18, 19 и 20 соответственно.
Пример 6
Полная длина клонов PAF-АН cDNA из плазмы была выделена из селезенки цыпленка, мыши, собаки и быка, cDNA библиотек и частично клон грызунов был выделен из тимуса крысы cDNA библиотеки. Клоны были идентифицированы посредством низкоэффективной гибридизации с использованием человеческой cDNA (условия гибридизации были теми же самыми, как это было описано для экзонов 1-6 в приведенном выше примере 5 за исключением того, что использовался 20% формамид вместо 50% формамида). 1 kb HindIII фрагмент человеческого PAF-AH sAH 406-3 cDNA клона (нуклеотиды 309 до 1322 SEQ ID NO: 7) был использован в качестве зонда. Кроме того, клон обезьяны был частично выделен из мозга макаки cDNA посредством PCR, используя праймер основанный на нуклеотидах 285 до 303 и 851 до 867 SEQ ID NO: 7. Нуклеотиды и определенные аминокислотные последовательности мыши, собаки, быка, цыпленка, крысы и макаки cDNA клоны установлены в SEQ ID NOs: 21, 22, 23, 24, 25 и 26 соответственно.
Сравнение полученных аминокислотных последовательностей cDNA клонов с человеческими cDNA клонами на основании идентичности процентного содержания аминокислот приводится в таблице 3.
Около 38% остатков полностью видоизменены во всех последовательностях. Регионы с наибольшим отклонением находятся в концевых аминогруппах (содержащих сигнальную последовательность) и в концевых карбоксильных группах, показанных в примере 10, которые не являются критическими для активных ферментов. Gly-Xaa-Ser-Xaa-Gly основа (SEQ ID NO: 27), обнаруженная в нейтральной липазе и других эстеразах, была сохранена в PAF-AH быка, собаки, мыши, крысы и цыпленка. Центральный серин этого мотива служит как активный сайт нуклеофила для этих ферментов. Были также сохранены предсказанные аспартатные и гистидиновые компоненты активного сайта (пример 10А). PAF-AH из человеческой плазмы согласно настоящему изобретению, тем не менее, по-видимому, использует каталитическую триаду и может принимать α/β конформацию гидролазы нейтральных липаз, даже если они не представляют других гомологических последовательностей липаз.
Более того, предполагается, что PAF-AH из человеческой плазмы имеет область, которая определяет его специфическое взаимодействие с частицами липопротеинов плазмы низкой и высокой плотности. Взаимодействие с этими частицами может быть определено посредством N-концевой части молекулы, которая имеет большой участок аминокислот, полностью сохранившихся среди разновидностей, но не содержащих каталитических триад ферментов.
Пример 7
Для определения, действительны ли PAF-AH с DNA из человеческой плазмы клон SAH406-3 (пример 3) кодирует протеин, имеющий активность PAF-AH, конструкция экспрессии pRc/CMV была кратковременно экспрессирована в COS 7 клетки. Три дня последующей трансфекции по DEAE Dextran методике COS клеточная среда была исследована для оценки активного PAF-AH.
Клетки были посеяны с плотностью 300000 клеток на 60 мм в чашке Петри. На следующий день клетки были инкубированы в DMEM содержащей 0,5 мг/л DEAE декстран, 0,1 мМ хлорохина и 5-10 мг плазмиды cDNA в течение двух часов. Затем клетки были обработаны 10% DMSO (диметилсульфоксиде) в буферном фосфатном физиологическом растворе в течение 1 минуты, промыты средой и инкубированы в DMEM, содержащей 10% фетальной телячьей сыворотки, предварительно обработанной с использованием диизопропилфторфосфатом (DFP), чтобы инактивировать эндогенную бычью сыворотку PAF-AH. После трех дней инкубации среда из трансфекционных клеток была исследована с целью определения активного PAF-AH. Исследования были проведены в присутствии или при отсутствии либо 10 мМ EDTA, либо 1мМ DFP с целью подтверждения, что рекомбинантный фермент был кальцийнезависимым и ингибировался посредством ингибитора DFP-серин эстеразы, как это было описано для PAF-AH из плазмы в работе Stafforini et al. (1987), supra. Отрицательный контроль включал трансфекцию клеток с pRc/CMV или при отсутствии или наличии включения (трансфектированных клеток) в sAH 406-3 включений противоположной ориентации.
Активная PAF-AH в трансфектантном супернатанте была определена посредством методики Stafforini et al. (1990), supra, со следующей модификацией этой методики. Кратко, активная PAF-AH была определена посредством измерения гидролиза 3H-ацетата из [ацетил-3H] PAF (New England Nuclear, Boston, MA). Обезвоженный 3H-ацетат был выделен из маркированного субстрата посредством колонки для обращенно-фазовой хроматографии поверх октадецилсиликагелиевых патронов (Baker Research Products, Phillipsburg, PA). Исследования выполнялись с использованием 10 мкл трансфектанта супернатанта в 0,1 М Hepes буфере, рН 7,2, в реакционном объеме 50 мкл. Субстрат в количестве 50 pmol был использован в реакции с соотношением 1:5 маркированный : холодный PAF. Реакция была инкубирована в течение 30 минут при 37oС и остановлена при добавлении 40 мкл 10% уксусной кислоты. Затем раствор был промыт в октадецисиликагелевой кассете, которая после этого была промыта 0,1 М ацетатом натрия. Водный элюат каждой пробы был собран и измерен в сцинтилляционном счетчике жидкости в течение одной минуты. Активность фермента определялась при расчете за минуту.
Как показано на фиг. 2, среда трансфектировалась из клеток с sAH 406-3, содержащих активную PAF-AH на уровне в 4 раза большем, чем первоначальный. Эта активность не была затронута присутствием EDTA, но устранялась 1 мМ DFP. Эти наблюдения свидетельствуют, что клон sAH 406-3 кодирует активность совместимую с ферментом активную PAF-AH из человеческой плазмы.
Пример 8
PAF-AH из человеческой плазмы полной длины и с различной степенью усечения DNA и PAF-AH DNA химеры мышь-человек были экспрессированы в Е.соli и дрожжевую культуру и стабильно экспрессированы в клетки млекопитающих посредством рекомбинантных методов.
А. Экспрессия в Е.coli
PCR был использован для создания кодированных протеиновых фрагментов человеческой плазмы PAF-AH cDNA из клона sAH 406-3, который легко поддается субклонированию в Е.соli в вектор экспрессии. Субклонированный сегмент, начинающийся у 5' конца человеческого гена с кодоном, закодированным как Ile42 (SEQ ID NO: 8), М-концевого остатка фермента, был выделен из человеческой плазмы. Остаток гена посредством естественного окончания кодона был включен в конструкцию. При этом был использован PCR праймер 5' со структурой:
SEQ ID NO: 28 и содержащий Xbal клонированный сайт так же, как и транслирующий инициацию кодон (подчеркнут). Был использован 3' обратный праймер:
и содержащий Xbal клонированный сайт так же, как и транслирующий инициацию кодон (подчеркнут). Был использован 3' обратный праймер:
SEQ ID NO; 29
5'ATTGATATCCTAATTGTATTTCTCTATTCCTG3'
и включающий концевой кодон sAH 406-3 и содержащий EcoRV клонирующий сайт. PCR реакция была проведена в точности так же, как это было описано в примере 3. Полученный при этой реакции HCR продукт был обработан с Xbal и EcoRV и субклонирован в pBR322 вектор, содержащий Тrр промотор [deBoer et al. , PNAS, 80: 21-25 (1983)] немедленно в обратном направлении клонируемого сайта. Е. соli штамм XL-1 Blue был трансформирован в экспрессионную конструкцию и культивирован в L питательном бульоне, содержащем 100 мг/мл карбеницилина. Трансформант из приготовленной накануне вечером культуры был гранулирован и повторно переведен в форму суспензии в лизис-буфере, содержащем 50 мМ Tris-HCl pH 7,5, 50 мМ NaCl, 10 мМ CHAPS, 1 мМ EDTA, 100 мг/мл лизоцима и 0,05 трипсин-игибированных единиц (TIU)/мл Апротинина. Через час инкубации на льду и разрушения ультразвуком в течение 2 минут лизаты были исследованы для определения активного PAF-AH посредством методики, изложенной в примере 4. Е.соli, трансформированные посредством экспрессионной конструкции (созданной trp АН), генерируют продукт с активной PAF-AH. См. табл. 6 в примере 9.
Конструкции, включающие три дополнительных промотора, facll промотор (deBoer, supra) арабиноза (аrа)В промотор из Salmonella typhimurium [Horwitz et al. , Gene, 14: 309-319 (1981)] и бактериофаг Е7 промотор были также использованы для проведения экспрессии последовательности PAF-AH человеческой в Е.соli. Конструкции, включающие Trp промотор (pUC trp АН), facll промотор (pUC tac АН), и аrаВ промотор (pUC аrа АН) были созданы в плазмиде pUC19 (New England Biolabs, MA), в то время как эта конструкция, включающая Т7 промотор (рЕТ АН), была создана в плазмиде рЕТ15В (Novagen, Madison, WI). Конструкция, содержащая гибридный промотор, рНАВ/РН, состоящая из аrаВ промотора, соединенного с рибосомой связанного сайта в Т7 районе промотoра, был также создана в pEN15B. Все Е.соli конструкции генерируют (производят) активную PAF-AH в диапазоне от 20 до 50 U/ml/OD600. Эта активность соответствует полной массе рекомбинантного протеина ≥1% полного клеточного протеина.
Некоторые Е.coli экспрессионные конструкции были также оценены по получению PAF-AH с удлиненными аминокислотными концами, N-концы PAF-AH натуральной плазмы были идентифицированы как Ile42 посредством аминокислотной последовательности (пример 2). Однако эта последовательность немедленно принимала обратный порядок Ile42, не соответствующей аминокислотам, найденным как сигнальная последовательность расщепленного сайта [т.е. "-3-1-правило" не применимо, т.к. лизин не обнаружен в положении -1; см. von Heijne, Nuc. Acids Res., 14; 4683-4690 (1986)]. Вероятно, более классическая сигнальная последовательность (М1 - А17 или М1 - Р21) определяется посредством клеточной секреторной системы, следующей после эндопротеолитического расщепления. Полная кодированная последовательность для PAF-AH, начинающаяся в начале метионина (нуклеотиды от 162 до 1487 SEQ ID NO: 7), была применена при экспрессии в Е.соli, используя trp промотор. Как показано в таблице 4, такая конструкция создает активный PAF-AH, однако экспрессия была на уровне одной пятидесятой по сравнению с первоначальной конструкцией, начинающейся с Ile42. Другая экспрессивная конструкция, начинающаяся с Val18 (нуклеотиды с 213 до 1487 SEQ ID NO: 7), обеспечивает получение активного PAF-AH на уровне примерно одной трети от уровня первоначальной конструкции. Эти результаты свидетельствуют, что аминоконцевой конец удлиняющего сегмента не является критическим или необходимым для активной рекомбинантной PAF-FH, создаваемого в Е.соli.
Укороченный рекомбинантный продукт человеческого PAF-AH был также произведен в Е. coli с использованием небольшого количества копий плазмиды и промотора, которые могут быть созданы посредством добавления арабинозы к культуре. Один такой N-концевой укороченный продукт PAF-AH является рекомбинантным продуктом экспрессии, кодированных DNA аминокислотных остатков полипептида от Met46, до Asn441 кодированного посредством PAF-AH cDNA полной длины (SEQ ID NO: 8), и определен как rРН.2. Плазмида, используемая для создания rРН. 2 в бактериальной клетке, была pBAR2/PH.2, плазмида на основе pBR322, которая несет (1) нуклеотиды от 297 до 1487 SEQ ID NO: 7, закодированного человеческого PAF-AH, начинается с кодона метионина на позиции 46, (2) аrаВ-С промоторы и аrаС ген из оперона арабинозы Salmonella typhimurium, (3) транскрипцию терминации последовательности из бактериофага Т7 и (4) репликацию оригинала из бактериофага f1.
В частности pBAR2/PH. 2 включает следующие сегменты DNA: (1) из разрушенного Aatll сайта в положении 1994 до EcoRI сайта в нуклеотиде 6274, вектор последовательности, содержащей точку инициации репликации и гены, кодирующие резистентность либо к ампициллину или тетрациклину, полученные из бактериальной плазмиды pBR322; (2) из EcoRi сайта в положении 6274 до Xbal сайта в положении 131, DNA из Salmonella typhimurium оперона арабинозы (внесенные в Genbank под номерами М11045, М11046, М11047, J01797); (3) из Xbal сайта на позиции 131 до Ncol сайта на позиции 170, DNA содержащую связывающий рибосомы сайт от pET-21b (Novagen, Madison, Wl); (4) из Ncol сайта на позиции 170 до Xhol сайта на позиции 1363, последовательность PAF-AH человека cDNA и (5) из Xhol сайта на позиции 1363 до разрушенного Aatll сайта на позиции 1993, DNA-фрагмента из pET-21b (Novogen), который содержит последовательность, терминирующую транскрипцию от бактериофага Е7 до начала репликации из бактериофага f1.
Другой продукт PAF-AH, созданный как rРН.9, является рекомбинантным продуктом экспрессии DNA, кодирующей аминокислотные остатки от Met46 до Ilе429 полипептида, закодированного посредством PAF-AH cDNA полной длины (SEQ ID NO: 8). DNA, кодирующая rРН.9 была введена в тот же самый вектор, используемый для получения rРН.2 в бактериальных клетках. Эта плазмида была запрограммирована pBAR2/PH. 2 и специально включала следующие сегменты DNA: (1) из разрушенного Aatll сайта на позиции 1958 до EcoRI сайта у нуклеотида 6239 вектора последовательности, содержащего начало репликации и гены, закодирующие резистентность либо к ампициллину или тетрациклину, полученному из бактериальной плазмиды pBR322; (2) из EcoRI сайта на позиции 6239 до Xbal сайта на позиции 131, DNA из Salmonella typhimurium оперона арабинозы (внесенные в Genbank под номерами М11045, М11046, М11047, J01797); (3) из Xbal сайта на позиции 131 до Ncol сайта на позиции 170, DNA содержащую сайт связывания рибосомы от pET-21b (Novagen, Madison, Wl); (4) из Ncol сайта на позиции 170 до Xhol сайта на позиции 1328, последовательность, PAF-AH DNA человека и (5) из Xhol сайта на позиции 1328 до разрушенного Aatll сайта на позиции 1958, DNA фрагмента из pET-21b (Novogen), который содержит последовательность окончания транскрипции из бактериофага Т7 и начало репликации из бактериофага f1.
Экспрессия продуктов PAF-AH в pBAR2/PH.2 и pBAR2/PH.9 либо контролируется аrаВ промотором, который полностью подавляется в присутствии глюкозы и при отсутствии арабинозы, но действует как сильный промотор, когда L-арабиноза добавляется к культуре с истощенной глюкозой. Выбор для клеток, содержащих плазмиду, может быть совершен посредством добавления или ампициллина (или другого аналогичного антибиотика) или тетрациклина в культуру среды. Изменение Е.соli штамма может быть использовано как носитель для экспрессии рекомбинантных продуктов PAF-AH, включая, но не ограничиваясь прототропческими штаммами для метаболизма арабинозы, такими как W3110, DH5α, BL21, С600, JM101 и их производными штаммами, содержащими мутации, уменьшающие протеолиз, такими как CAG629, KY1429, и штаммами, не обеспечивающими возможности разлагать арабинозу, такими как SB7219 и МС1061. Преимущество использования штаммов, которые не способны разрушать арабинозу, заключается в том, что индуктор (арабиноза) для получения PAF-AH не истощается из среды на протяжении индукционного периода и в результате повышается уровень PAF-AH по сравнению с тем, который получается со штаммами, восприимчивыми к метаболизации арабинозы. Любая соответствующая среда и условия культивации могут быть использованы для экспрессии продуктов активного PAF-AH в различные Е.соli штаммы. Например, или богатый состав культурной среды, такой как LB, EDM295 (М9 основанный на минимальном содержании в среде конглютинина с дрожжевым экстрактом или казеином, гидролизованным в кислой среде), или "известная" среда, такая как А675. А минимальная среда при рН 6,75, использующая глицерин как источник углерода и с мечеными элементами и витаминами, позволяет осуществить получение реальных PAF-AH продуктов. Тетрациклин включается в среду для поддержания выбора плазмиды.
Плазмида pBAR2/PH. 2 была трансформирована в Е. соli штамм МС1061 (АТСС53338), который содержал делецию оперона арабинозы и, таким образом, не мог метаболизировать арабинозу. МС1061 является также ауксотроф лейцина и был культивирован посредством процесса, использующего определенные среды, содержащие касаминовые кислоты, которые обеспечивают возможность дополнительной лейциновой мутации.
Е.соli М1061 клетки, трансформированные с использованием pBAR2/PH.2, были выращены при 30oС в периодических опытах с питательной средой, содержащей 2 мг/л глюкозы. Глюкоза при этом играет двойную роль - как источник углерода для роста клеток и как ингибитор функции промотора арабинозы. Когда уровень глюкозы в опытах был исчерпан (<50 мг/л), начиналась подача питательной среды, (содержащей 300 г/л глюкозы). Подача увеличивалась линейно в течение 16 часов со скоростью, ограниченной образованием кислотных бипродуктов. В этой точке подача питательного раствора переключалась на питательный раствор, содержащий глицерин вместо глюкозы. Одновременно 500 г/л L-арабинозы было добавлено до конечной концентрации 5 г/л. Подача глицерина сохранялась с постоянной скоростью в течение 22 часов. Клетки были собраны с использованием фильтрации на пустотелых волокнах до почти десятикратной концентрации суспензии. Полученная клеточная паста сохранялась при -70oС. Полученная конечная масса клеток составляла примерно 89 г/л (OD600=50-60) с активной PAF-AH. 65-70 единиц/ОD/мл, представляя около 10% общего количества клеточного протеина. Конечный объем культуры в количестве около 75 литров содержал 50-60 г PAF-AH.
Высокий выход продукционного rPAF-AH мог быть достигнут в случае, когда pBAR2/PH.2 или РН.9 экспрессировалось посредством штаммов SB7219 или МС1061. Другие штаммы с недостаточной степенью деградации арабинозы могут быть использованы для производства продукционных клеток с высокой плотностью. Желательно, чтобы клетки культивировались при следующих условиях. Для экспонентного роста SB7219; pBAR2/PH.2 и SB7219; pBAR2/PH.9 штаммы размещались в ферментатор с питательной средой, содержащей 2 г/л глюкозы. Когда запас глюкозы был исчерпан, в сосуд осуществлялась подача раствора глицерина, содержащего метящий элемент, витамины, соли магния и аммония с целью обеспечения экспоненциального темпа роста. В сосуде поддерживалась температура 30oС, в него подавался воздух в качестве источника кислорода и производилось перемешивание жидкости для того, чтобы поддерживать уровень растворения кислорода свыше примерно 15% насыщения. Когда плотность клеток культуры превышала 110 г/л (в пересчете на влажную массу клеток), расход питательной среды сокращался и шарики, содержащие L-арабинозу, добавлялись к культуре (около 0,5% полного содержания). Образование продукта наблюдалось в течение от 16 до 22 часов. Культура обычно имела до 40-50 г/л (в пересчете на сухой вес клеток). Полученный продукт клеток центрифугировался, сохранялся при температуре -70oС, и rPAF-AH продукт выделялся для анализов. При этом достигалась продуктивность процесса на уровне 150 единиц/мл/OD600.
В. Экспрессия в дрожжевых клетках
Рекомбинантная человеческая PAF-AH была также экспонирована в Saccharomyces cerevisiae. Дрожжевой ADH2 промотор был использован для проведения rPAF-AH экспрессии и получения 7 единиц/мл/OD600 (таблица 5).
С. Экспрессия PAF-AH в клетках млекопитающих
1. Экспрессия человеческой PAF-AH cDNA конструкций
Плазмида, сконструированная для экспрессии PAF-AH с экспрессией pSFN\ PAF-AH, предусматривала применение сильного вирусного промотора из цитомегаловируса полиаденилирование сайта из бычьего растущего гормона гена, и SV 40 источника репликации для создания репликации с высокой степенью копирования плазмиды в COS клетках. Плазмида была электропорирована в клетки.
Первая плазмида была сконструирована таким образом, что 5' боковая последовательность (pDC1/PAFAH. 1) или обе 5' или 3' боковые последовательности (PDC1/PAFAH. 2) человеческого PAF-AH cDNA были перемещены с боковых последовательностей из других генов, известных способностью к экспрессии при высоких уровнях, в клетки млекопитающихся. Трансфекция этих плазмид в COS, CHO или 293 клетки ведет к получению PAF-FH почти на том же самом уровне (0,01 единиц/мл или в 2-4 раза над каркасом макромолекулы) как это указывается для клона sAH 406-3 в примере 7 после ускоренной трансфекции COS клеток. Другая плазмида была сконструирована с включением Friend селезенки с образованным центром вирусного промотора вместо цитамегаловирусного промотора. Человеческая PAF-AH cDNA была вставлена в плазмиду pmH-neo [Hahn et al., Сеnе, 127: 267 (1993)] под контролем Friend селезенки с образованным центром вирусного промотора. Трансфекция плазмаклеточной линии миеломы NSO с плазмидой, которая была получена pSFN/PAFAH и отобрана из нескольких сотен клонов, привела к выделению двух трансфектантов (4В11 и 1С11), позволивших получить 0,15-0,5 единиц/мл PAF-AH активной. Предполагаемая специфическая активность составляет 5000 единиц/миллиграмм, создание этих двух NSO трансфектантов соответствует уровню примерно 0,1 мг/литр.
2. Экспрессия химер мышь-человек PAF-AH генных конструкций
Конструкция (pRc/MS9), содержащая закодированную DNA мышиную PAF-AH в векторе экспрессии млекопитающих pRc/CMV, получена благодаря секреции PAF-AH на уровне 5-10 единиц/мл (1000 раз выше каркаса макромолекулы) после трансфекции в COS клетки. Предполагается, что специфический активный PAF-AH мышей почти такой же, как и ферментов человека, cDNA мышей, тем не менее, экспрессируется в 100-1000 раз на более высоком уровне, чем это имеет место для PAF-AH cDNA человека.
Для того чтобы исследовать разницу между уровнем экспрессии PAF-AH человека и мыши в CPS клетках, две химеры генов человека и мыши были сконструированы и исследованы в клетках COS. Первая из этих конструкций, pRc/PH. MHCl, содержит кодированную полипептидам последовательность N-концевых 97 аминокислот мышиной PAF-AH (SEQ ID NO: 21) присоединенные к С-концевым 343 аминокислотам человеческой PAF-AH в векторе экспрессии pRc/CMV (Invitrogen, San Diego, СА). Второй химерный ген в плазмиде pRc/PH.MHC2 содержит кодированную полипептидом последовательность для N-концевых 40 аминокислот мышиной, присоединенную к С-концевой человеческой PAF-AH в pRc/CMV. Трансфекция COS клеток с pRc/PH.MHCl имеет тенденцию к аккумулированию 1-2 единиц/мл активной PAF-AH в среде. Качество среды определено из трансфекции клеток pRc/PH. MHC2, найдено для содержания только 0,01 единиц/мл активной PAF-AH. Из этих экспериментов ясно, что различие в уровне экспрессии между генами мыши и человека PAF-AH определяется, по крайней мере, в части полипептидных сегментов между выделенными 40 и 97 или соответствуют RNA или DNA кодирующих эту область протеина PAF-AH.
3. Перекодирование первой 290bр PAF-AH закодированной последовательности
Одна из гипотез для низкого уровня человеческой PAF-AH, синтезированной в трансфектированных клетках млекопитающего, заключается в том, что кодоны, используемые природными генами, являются субоптимальными для эффективной экспрессии. Однако из этого не следует, что использование кодона может обеспечить в 500-1000 раз различие уровня экспрессии между генами мыши и человека из-за того, что оптимизация кодонов в основном оказывает только 10-кратный эффект на экспрессию. Вторая гипотеза для объяснения различия между экспрессией PAF-AH мыши и человека состоит в том, что человеческая PAF-AH mPHK в 5' зоне кодирования образует вторичную структуру, которая приводит либо к относительно быстрой деградации mPHK или является неэффективной при начале или продолжении трансляции.
Для проверки этих гипотез был сконструирован синтезированный фрагмент закодированной реальной человеческой PAF-AH протеина с аминоконцевыми остатками до 96, в котором большинство кодонов были замещены ("перекодированы") с использованием кодона с другой последовательностью, но закодированной той же самой аминокислотой. Изменение второго кодона с GTG на GTA приводило к созданию Asp718 сайта, который располагался на одном конце синтетического фрагмента и который присутствовал в cDNA мыши. Другой конец этого фрагмента содержал BamHl сайт, нормально найденный в кодоне 97 гена человека. Около 290 bp Asp718/BamHl фрагментов был произведен из PCR фрагмента, который был получен с использованием двойной асимметричной PCR, близкой по конструкции к синтетическим генам, описанным у Sandhu et al., Biotechniques, 12: 14-16 (1992). Синтетический Asp718/BamHI фрагмент был сшит с закодированными DNA фрагментами остатка человеческой PAF-AH молекулы начиная с нуклеотида 453 SEQ ID NO: 7 так, что последовательность закодированного природного человеческого фермента была вставлена в вектор экспрессии млекопитающего pRc/CMV (Invitrogen, San Diego) для создания плазмиды pRc/HPH.4. Полная последовательность перекодированного гена определяется в SEQ ID NO: 30. Боковая последовательность 5' соседних с человеческой PAF-AH закодированной последовательностью в pRc/HPH.4 получается из кодируемой cDNA PAF-AH мыши в pRc/MS9 (нуклеотиды 1 до 116 SEQ ID NO: 21).
Для испытания экспрессии человеческой PAF-AH из pRc/HPH.4 COS клетки были трансляционно трансфектированы посредством pRc/HPH.4 (перекодированного человеческого гена), pRc/MS9 (PAF-AH мыши) или pRc/MHCl (гибрид 1 мыши и человека). Выбранная среда из трансфектированных клеток была испытана для определения активной PAF-AH, и было обнаружено, что она содержит 5,7 единиц/мл (генов мыши), и 0,9 единиц/мл (гибридов человека и мыши), или 2,6 единиц/мл (перекодированного гена человека). Итак, стратегия перекодирования первых 290 bp кодированной последовательности человека PAF-AH была успешна на уровне экспрессии бустинг-иммунизации человеческой PAF-AH от нескольких нанограмм/мл до около 0,5 микрограмм/мл в переходном процессе COS трансформации клеток. Перекодированный PAF-AH ген из pRc/HPH.4 будет вставлен в вектор экспрессии млекопитающих, содержащий дигидрофолат редуктазу (DYFR), ген и DHFR-отрицательные клетки яичника китайского хомяка будут трансфектироваться этим вектором. Трансфектированные клетки будут объектом селекции метотриксата с целью получения клонов, имеющих высокий уровень человеческой PAF-AH благодаря амплификации гена.
Пример 9
Рекомбинантная PAF-АН из человеческой плазмы (начинающийся с Ile42), экспрессированная в Е.coli, была выделена в единичной Coomassie-окрашенной SDS-PAGE зоне посредством различных методов и исследований для природного PAF-AH фермента.
А. Выделение рекомбинантной PAF-AH
Первая использованная процедура выделения подобна описанной в примере 1 для природной PAF-AH. Последующие этапы были проведены при 4oС. Гранулы из 50 мл PAF-AH, полученные с использованием продукта Е.соli (трансформированного посредством экспрессии конструкции trp АН), были разрушены, как это описывалось в примере 8. Твердая фракция была удалена посредством центрифугирования при 10000 g в течение 20 минут. Супернатант был загружен при 0,8 мл/минуту в Blue Sepharose Fast Flow колонку (2,5•4 см; 20 мл рабочего объема) уравновешенную в буфере D (25 мМ Tris-HCl, 10 мМ CHAPS, 0,5 М NaCl, pH 7,5). Колонка была промыта 100 мл буфера D и элюирована 100 мл буфера А, содержащего 0,5 М KSCN при 3,2 мл/мин. 15 мл активной фракции было загружено в 1 мл Сu Chelating Sepharose колонку, уравновешенную в буферной жидкости D. Колонка была промыта 5 мл буферной жидкости D и затем элюирована 5 мл буферной жидкости D, содержащей 100 мМ имидазол под воздействием гравитации. Фракции, содержащие активную PAF-AH, были проанализированы посредством SDS-PAGE.
Результаты очистки показаны в таблице 6, в которой за единицу принят гидролиз мкмоль PAF в час. Очищенный продукт, полученный при 4oС, появился на SDS-PAGE как единая полоса ниже 43 кДa маркера с некоторой диффузией красителя непосредственно над и ниже ее. Рекомбинантный материал относительно более чистый и выявляет большую специфическую активность по сравнению с PAF-AH, приготовленной из плазмы, как это описано в примере 1.
Когда тот же самый процесс очистки был проведен при нормальной температуре, в дополнительной полосе ниже 43 кДa маркера, группа полос ниже 29 кДa была связана с активной PAF-AH исследуемых участков геля. Эта низкомолекулярная весовая полоса может быть протеолетическим фрагментом PAF-AH, который сохраняет ферментную активность.
Различные процессы очистки были также проведены в условиях окружающей температуры. Гранулы (100 г) PAF-AH, полученные с использованием Е соli, (трансформированные с экспрессионной конструкцией pUC trp АН), были повторно переведены в форму в суспензии в 200 мл лизисного буфера (25 мМ Tris, 20 мМ CHAPS, 50 мМ NaCl, 1 мМ EDTA, 50 мг/мл бензамидина, рН 7,5) и суспензия лизирована три раза с использованием аппарата микрофлуидизации при давлении 105 кг/см2. Твердая фаза была выделена центрифугированием при 14300 g в течение одного часа. Супернатант был десятикратно разведен в разбавляющем буфере [25 мМ MES (2-[N-морфолино] этансульфокислота), 10 мМ CHAPS, 1 мМ EDTA, рН 4,9] и загружен при 25 мл/мин в S Sepharose Fast Flow колонку (200 мл) (катионообменная колонка) выровненную в буфере Е (25 мМ MES, 10 мМ CHAPS, 1 мМ EDTA, 50 мМ NaCl, рН 5,5). Колонка была промыта 1 л буфера Е, элюирована 1 М NaCl, и элюат был собран в виде 50 мл фракций, приведенных к рН 7,5 с использованием 2 М Tris основания. Фракции, содержащие активную PAF-AH, были собраны в пул и обработаны 0,5 М NaCl. S пул был загружен при 1 мл/мин в Blue Sepharose Fast Flow колонку (2,5•4 см; 20 мл), выровненную в буфере F (25 мМ Tris, 10 мМ CHAPS, 0,5 М NaCl, 1 мМ EDTA, рН 7,5). Колонка была промыта 100 мл буфера F и элюирована 100 мл буфера F, содержащего 3 M NaCl при 4 мл/мин. Затем были повторены операции с использованием Blue Sepharose Fast Flow хроматографии с целью снижения уровня содержания эндотоксина в пробе. Фракции, содержащие активную PAF-AH, были собраны в пул и снова подвергнуты диализу с использованием буфера G (25 мМ Tris pH 7,5, 0,5 M NaCl, 0,1% Tween 80, 1 мМ EDTA).
Результаты выделения показаны в таблице 7, причем за единицу принят гидролиз мкмоль PAF гидролиза в час.
Очищенный продукт появляется на SDS-PAGE в виде единой интенсивной полосы ниже 43 кДa маркера с некоторой диффузией непосредственно над или ниже ее. Рекомбинантный материал оказывается существенно более чистым и проявляет большую специфическую активность по сравнению с PAF-AH, приготовленным из плазмы, как это описано в примере 1.
Еще одна процедура выделения, соответствующая настоящему изобретению, включает проведение последовательного лизиса клеток, центрифугирования и первого этапа, проводимого в колонке. Клеточный материал разбавляется 1:1 в лизисном буфере (25 мМ Tris pH 7,5, 150 мМ NaCl, 1% Tween 80, 2 мМ EDTA). Лизис проводится в охлаждаемом микроаппарате с псевдоожиженным слоем материала при давлениях 105-140 кг/см2 в трех фазах с выходом >99% разрушенных клеток. Лизат разводился 1:20 в разводящем буфере (25 мМ Tris, pH 8,5, 1 мМ EDTA) и помещался в колонку, заполненную Q-Sepharose Big Bead хроматографической средой (Pharmacia) и выравнивался в 25 мМ Tris, pH 8,5, 1 мМ EDTA, 0,015% Tween 80. Элюат разбавляется 1:10 в 25 мМ MES, pH 5,5, 1,2 М сульфате аммония, 1 мМ EDTA и помещается в Butyl Sepharose хроматографическую среду (Pharmacia), выровненную в том же самом буфере. Активная PAF-AH элюируется в 25 мМ MES рН 5,5, 0,1% Tween 80, 1 мМ EDTA.
Еще один метод, соответствующий настоящему изобретению и служащий для выделения ферментоактивной PAF-AH из Е.соli, включает следующие этапы: (a) приготовление Е.coli экстракта с получением растворимого PAF-AH супернатанта после лизинга в буфере, содержащем CHAPS; (b) разведение указанного супернатанта и пропускание его через анионообменную колонку, выровненную до уровня примерно рН 8,0; (с) элюирование PAF-AH фермента из указанной анионообменной колонки; (d) использование полученного элюата из указанной анионообменной колонки в афинной колонке с аффинным лигандом голубого красителя; (е) элюирование указанного продукта в аффинной колонке с аффинным лигандом голубого красителя с использованием буфера, содержащего 3,0 М соли; (f) разведение элюата голубого красителя в соответствующем буфере для использования в гидрокислапатитовой хроматографии; (g) полученный продукт гидроксилапатитовой хроматографии был промыт и элюирован с использованием буфера (с применением или без использования CHAPS); (h) разведение указанного гидроксилапатитового элюата до соответствующего солесодержания для катионообменной хроматографии; (i) подачу указанного разбавленного гидроксилапатитового элюата в катионообменную колонку с уровнем рН приблизительно от 6,0 до 7,0; (j) элюирование PAF-AH из указанной катионообменной колонки с применением буфера соответствующего состава; (k) проведение катионообменной хроматографии при низких температурах; (l) получение PAF-AH в жидкой или замороженной форме при отсутствии CHAPS.
Желательно, чтобы на стадии (а), указанной выше, лизисный буфер содержал 25 мМ Tris, 100 мМ NaCl, 1 мМ EDTA, 20 мМ CHAPS, pH 8,0; на стадии (b) разведение супернатанта для анионообменной хроматографии составляет 3-4 раза в 25 мМ Tris, 1 мМ EDTA, 10 мМ CHAPS, рН 8, и на этой стадии используется Q-Sepharose колонка, выровненная 25 мМ Tris, 1 мМ EDTA, 50 мМ NaCl, 10 мМ CHAPS, pH 8,0; на этапе (с) анионообменная колонка элюируется с использованием 25 мМ Tris, 1 мМ EDTA, 350 мМ NaCl, 10 мМ CHAPS, pH 8,0; на этапе (а) элюат из стадии (с) направляется непосредственно в аффинную колонку с аффинным голубым красителем, на этапе (е) колонка элюируется буфером с 3М NaCl, 10 мМ CHAPS, 25 мМ Tris, pH 8,0; на этапе (f) элюат голубого красителя для гидроксилапатитовой хроматографии составлялся посредством разведения в 10 мМ фосфата натрия, 10 мМ CHAPS, pH 6,2; на этапе (g) гидроксилапатитная хроматография использовалась с применением гидроксилапатитовой колонки, выровненной 10 мМ фосфата натрия, 100 мМ NaCl, 100 мМ CHAPS, и элюирование производилось с применением 50 мМ фосфата натрия, 100 мМ NaCl (с использованием или без ее применения) 10 мМ CHAPS, pH 7,5; на этапе (h) производилось разведение указанного гидроксилапатитового элюата для катионообменной хроматографии путем разведения в буфере с уровнем pH от приблизительно 6,0 до 7,0, содержащего фосфат натрия (с или без CHAPS); на этапе (i) S Sepharose колонка выравнивалась 50 мМ фосфатом натрия (с или без) 10 мМ CHAPS, pH 6,8; на этапе (j) элюирование проводилось с использованием буфера соответствующего состава, например фосфат натрия 50 мМ, 12,5 мМ аспарагиновой кислоты, 125 мМ NaCl, pH 7,5 содержащей 0,01% Tween-80; на этапе (k) катионообменная хроматография проводилась при 2-8oС. Примеры соответствующих составов буферов для использования на этапе (l), который стабилизируют PAF-AH, включают 50 мМ фосфат натрия, 12,5 мМ аспарагиновой кислоты, 125 мМ NaCl pH 7,4 (возможно с или без добавления Tween-80 и или Pluronic F-68) или буфер, содержащий 25 мМ фосфата натрия, а также (по крайней мере) 125 мМ NaCl, 25 мМ аргинина и 0,01% Tween-80 (с или без Pluronic F-68 с концентрацией примерно 0,1 и 0,5%).
В. Активность рекомбинант PAF-AH
Наиболее специфической особенностью PAF ацетилгидролазы являются ее маркирующие свойства для субстратов с короткими группами на sn-позиции субстрата. Эта особенность принципиально отличает PAF ацетилгидролазы от других форм PLA2. Так, для определения, действительно ли рекомбинантная PAF-AH разрушает фосфолипиды с длинными цепями жирных кислот на sn-2 позиции, было выполнено исследование гидролиза 1-пальметоил-2-арахидонил-sn-глицеро-3-фосфохолина (арахидонилРС), поскольку это соединение является наиболее подходящим субстратом для оценки характеристик лунок форм PLA2. Как следует из результатов предыдущих исследований с природной PAF-AH, этот фосфолипид не подвергается гидролизу при инкубировании с рекомбинантной PAF-AH. При дополнительных экспериментах арахидонилРС был включен в исследования стандартного анализа гидролиза PAF при концентрациях в диапазоне от 0 до 1225 мкМ с целью определения его ингибиторных свойств при гидролизе PAF рекомбинантной PAF-AH. Не наблюдалось ингибирования гидролиза PAF-AH даже при высоких концентрациях PAF-AH, которые были в 5 раз выше, чем концентрация PAF. Итак, рекомбинант PAF-AH демонстрирует точно такую же селективность субстрата, как и естественный фермент; субстраты с длинными цепями не были выявлены. Более того, рекомбинантный фермент PAF-AH быстро разрушался, окисляя фосфолипид (глутароилРС), который подвержен окислительному расщеплению sn-2 жирных кислот. Естественная плазма PAF-AH имеет несколько другие свойства, которые отличают ее от других фосфолипаз, в том числе не содержащих кальция, и устойчивых к составам, которые модифицируют сульфгидрильные группы или разрушают дисульфиды.
Как нативные, так и рекомбинантные ферменты PAF-AH плазмы чувствительны к DFP, что свидетельствует о том, что серин содержит часть их активных сайтов. Отличительной особенностью нативной PAF-AH ацетилгидролазы плазмы является то, что она связана с липопротеинами при циркуляции и на ее каталитическую эффективность оказывает влияние окружение липопротеинов. Когда рекомбинантная PAF-AH в соответствии с настоящим изобретением была инкубирована с человеческой плазмой (предварительно очищенной от DFP для уничтожения активности эндогенных ферментов), она была связана с липопротеинами низкой и высокой плотности таким же самым образом, как и при естественной активности. Эти результаты весьма существенны, поскольку они являются реальным признаком, показывающим, что модификация липопротеинов низкой плотности весьма существенна при наличии холестерина в атеросклеротической бляшке и что окисление липидов является инициирующим фактором в этом процессе. PAF-AH осуществляет защиту липопротеинов низкой плотности от модификации в условиях окисления in vitro, а также может играть такую же роль in vivo. Введение PAF-AH является, таким образом, индикатором супрессии окисления липопротеинов в атеросклеротических пятнах так же, как и при развивающихся воспалительных процессах.
Эти результаты показывают, что cDNA клон sAH 406-3 кодирует протеин с активностью человеческой плазмы PAF-AH ацетилгидролазы.
Пример 10
Другие различные рекомбинантные продукты PAF-AH были экспрессированы в Е. coli. Продукты включали аналоги PAF-AH, имеющие единичную аминокислотную мутацию и PAF-AH фрагменты.
А. Аминозамещенные продукты PAF-AH
PAF-AH относится к липазам, т.к. она гидролизирует фосфолипид PAF. В то же время не очевидно общее подобие, существующее между PAF-AH и другими известными липазами, при сравнении структуры могут быть найдены общие фрагменты. Серин был идентифицирован как член активного сайта. Серин, связанный с остатком аспаратов и остатком гистидина, образует каталитическую триаду, которая представляет активный сайт липазы. Эти три группы не являются смежными в первичной последовательности белка, однако изученные их структуры свидетельствуют, что эти три группы являются смежными в пространственной трехмерной структуре. Сравнение структур липаз млекопитающих показывает, что остаток аспартата - двадцать четвертая аминокислота С-конца в активном сайте серина. Кроме того, гистедин обычно является от 109 до 111 аминокислотой С-конца в активном сайте серина.
Посредством сайт-направленного мутагенеза и PCR индивидуальные кодоны, кодирующие последовательность человеческой PAF-AH, были модифицированы с целью кодирования остатка аланина и были экспрессированы в Е.Соli. Как показано в таблице 8, например, аббревиатура "S108A" показывает, что остаток серина на позиции 108 был заменен аланином, точковая мутация Sеr273, Asp296 или His351 полностью разрушает активность PAF-AH. Расстояние между активными остатками сайтов аналогично для PAF-AH (от Ser до Asp 23 аминокислоты; от Ser до His 78 аминокислот) и других липаз. Эти эксперименты свидетельствуют, что Sеr273, Asp296 и His351 являются критическими остатками для активности и, следовательно, возможными кандидатами для каталитических триадных групп. Цистеины часто являются критическими для функциональности протеинов вследствие их способности образовывать дисульфидные связи. Фермент плазмы PAF-AH содержит пять цистеинов. Для определения того, является ли каждый из этих пяти остатков критическим для активности ферментов, каждый из цистеинов был мутирован индивидуально в серин и полученные мутанты были экспрессированы в E.coli. Предварительные результаты исследования активности с применением частично выделенных препаратов рекомбинантных продуктов мутации показаны во второй колонке таблицы 8, а результаты с применением более очищенного состава показаны ниже во второй колонке таблицы 8. Эти данные показывают, что все цистеиновые мутанты имеют значительно большую эквивалентную активность, так что ни один из образовавшихся цистеинов не является необходимым для активности PAF-AH. Другие точковые мутации имеют малое или совсем не имеют влияния на каталитическую активность PAF-AH. В таблице 8 "++++" представляют очень сильный тип активности PAF-AH на уровне 40-60 U/мл/OD600, "+++" соответствуют примерно 20-40 U/мл/OD600 активности, "++" составляют около 10-20 U/мл/OD600 активности, "+" соответствует 1-10 U/мл/OD600 активности и "-" соответствует активности менее 1 U/мл/ОD600.
В. Получение фрагментов PAF-AH
С-концевая делеция была приготовлена посредством обработки конца PAF-AH кодирующей последовательности экзонуклеазой III в течение различных промежутков времени и последующего сшивания укороченных кодированных последовательностей к плазмиде DNA, кодируя стоп-кодоны во всех трех считываемых структурах. Десять различных конструкций делеции были охарактеризованы посредством анализа последовательности DNA, экспрессии протеинов и активности PAF-AH. Удаление от двадцати одной до тридцати С-концевых аминокислот значительно уменьшало каталитическую активность, а удаление пятидесяти двух групп полностью нарушало активность (фиг.3).
Подобные делеции были выполнены с N-концевыми окончаниями PAF-AH. Слияние PAF-AH с Е.соli тиоредоксина на М-концах было выполнено для облегчения последующего повышенного уровня экспрессии активности PAF-AH [La Vallie et al, , Bio/technology, 11; 187-193 (1993)]. Удаление девятнадцати аминокислот из полученного естественным путем N-конца (Ile42) снижает активность на 99%, в то время как удаление двадцати шести аминокислот полностью разрушает ферментную активность при слиянии протеинов (фиг.3). Делеция двенадцати аминокислот показывает увеличение активности ферментов примерно в четыре раза.
При последующем выделении PAF-AH из свежей человеческой плазмы с использованием методов, описанных в примере 1 (Microcon 30 фильтр от Amicon был использован для концентрирования Blue sepharose элюата вместо Сu колонки), два N-конца в дополнении к Ile42 были идентифицированы, Ser35 и Lys55. Гетерогенность может быть естественным состоянием ферментов в плазме или может возникать при очистке.
Описанный выше выделенный материал был также объектом анализа гликозинирования. Выделенная натуральная PAF-AH была инкубирован в присутствии или при отсутствии N-гликаназы, фермента, который удаляет N-связанные карбогидраты из гликопротеинов. Выделенные пробы PAF-AH были подвергнуты электрофорезу с использованием 12% SDS полиакриламидного геля и затем обнаружены посредством вестер-блоттинга с применением поликлональной иммунной сыворотки кролика. Протеин, не очищенный N-гликаназой, мигрировал, образуя диффузионную полосу 45-50 кДa, тогда как очищенный с использованием гликаназы протеин мигрировал в узкую полосу 44 кДa, что позволяет определить, что естественная PAF-AH гликозилируется.
N-концевая гетерогенность наблюдалась также в очищенных составах рекомбинантной PAF-AH (Ile42 N-окончания). Эти составы были смесью полипептидов с N-окончаниями, начиная с Аlа47, Ile42 или искусственно приготовленного Met-1 смежного с Ile42.
1. Предварительное сравнение фрагментов PAF-AH с PAF-AH
Для выявления гетерогенности полученного рекомбинантной PAF-AH другие рекомбинантные продукты были приготовлены и испытаны на гомогенность после экспрессии и очистки рекомбинанта. Состав продуктов экспрессированных рекомбинантов pBAR2/PH.2 и pBAR2/PH.9 в Е.соli штамме был проанализирован на различных этапах получения фазы ферментации клеток. Частично очищенные пробы рекомбинантов РН.2 и РН.9 из клеток были собраны в определенное время в течение 5 и 22 часов после индуцирования экспрессии протеина и были исследованы с применением методов лазерной матричной ионизационной масс-спектромерии (MALDI-MS).
Когда был использован РН.2 вектор экспрессии, в спектре частично очищенного протеина наблюдались два пика: для назначения массы, ожидаемой для rPAF-AH протеина. Два пика наблюдались во всех временных точках, с большей гетерогенностью они наблюдались во временных точках в период усиления ферментации, о чем свидетельствовало аккумулирование ацетата и/или снижение содержания кислорода в среде. Точность MALDI-MS средств в этом диапазоне масс была приблизительно на уровне ±0,3% относительно массы одной аминокислоты. Более высокий пик масс наблюдался в присутствии ожидаемого транслированного продукта полной длины для РН.2 вектора минус трансляция, инициируемая метионином, который предположительно должен быть посттрансляционно удален. Более низкий пик масс был примерно 1200 минимальных атомных масс.
Когда был использован РН.9 вектор экспрессии, преобладал единственный пик в спектре частично очищенного протеина при массовой величине предполагаемой для rPAF-AH протеина. Этот единственный пик наблюдался во всех временных точках без увеличения гетерогенности в различных временных точках. Наблюдаемая масса этого протеина возникала в присутствии ожидаемого продукта с полной длиной трансляции для РН.9 вектора минус инициирующими метионин.
2. Выделение и очистка фрагментов PAF-AH
Продукт рекомбинантной экспрессии rРН.2 (продукт экспрессии DNA, кодирующих Met46 - Asn441) и rРН.9 (продукт экспрессии DNA кодирующих Met46 - Ile429) были выделены для дальнейшего сравнения с очищенным rPAF-AH (продукт экспрессии DNA кодирующий Ile42 - Asn441). RPH.9 был приготовлен с использованием Е.соli штамма SB7219 и выделен обычным способом в соответствии с процедурой с применением хелата цинка, описанной выше, а rРН.2 был получен посредством E. coli штамма МС1061 и выделен, как это будет описано ниже. Трансформированные клетки были лизированы при добавлении клеточной пасты с лизисным буфером (100 мМ сукцината, 100 мМ NaCl, 20 мМ CHAPS, pH 6,0). Суспензия была перемешана и лизирована посредством повышенного давления. Лизированные клетки были центрифугированы и полученный супернатант, содержащий rРН.2, был сохранен. Осветленный супернатант был разведен пятикратно в буфере, содержащем 25 мМ фосфат натрия, 1 мМ EDTA, 10 мМ CHAPS, pH 7,0. Разведенный супернатант был в дальнейшем использован для подачи его в Q Sepharose колонку. Эта колонка была предварительно промыта трехкратным объемом буфера, 25 мМ фосфата натрия, содержащего 1 мМ EDTA, 50 мМ NaCl, 10 мМ CHAPS, pH 7,0 (промывка 1), затем промыта 10 объемами колонки буфера 25 мМ Tris содержащего, 1 мМ
EDTA, 10 мМ CHAPS, рН 8,0 (промывка 2) и 10 объемам колонки буфера 25 мМ Tris, содержащего 1 мМ EDTA, 100 мМ NaCl, 10 мМ CHAPS, pH 8,0 (промывка 3). Элюция была проведена с использованием 25 мМ Tris буфера, содержащего 1 мМ EDTA, 350 мМ NaCl, 10 мМ CHAPS, pH 8,0. Q Sepharose элюат был разведен трехкратно в 25 мМ Tris, 1 мМ EDTA, 10 мМ CHAPS, pH 8,0 и затем помещен в Blue Sepharose колонку. Колонка была промыта сначала 10 объемами колонки 25 мМ Tris, 1 мМ EDTA, 10 мМ CHAPS, pH 8,0. Затем эта колонка была промыта тремя объемами колонки 25 мМ Tris, 0,5 М NaCl, 10 мМ CHAPS, pH 8,0. Элюирование было проведено с применением 25 мМ Tris, 3,0 М NaCl, 10 мМ CHAPs, pH 8,0. Blue Sepharose элюат был разбавлен 5-кратно в 10 мМ фосфате натрия, 10 мМ CHAPS, pH 6,2 и затем помещен в хроматографическую колонку. Колонка была промыта 10-кратным объемом 10 мМ фосфата натрия, 100 мМ NaCl, 0,1% Pluronic F68, pH 6,2. rРН.2 был элюирован 120 мМ фосфата натрия, 100 мМ NaCl, 0,1% Pluronic F-68, pH 7,5. Гидроксиапатитный элюат был разведен 6-кратным количеством 10 мМ фосфатом натрия, 0,1% Pluronic F68, pH 6,8. Разбавленный гидоксиапатитный элюат был приведен к pH 6,8 с использованием 0,5 N янтарной кислоты и затем помещен в SP Sepharose колонку. SP Sepharose колонка была промыта 10-кратным объемом 10 мМ фосфата натрия, 0,1% Pluronic F68, pH 6,8 и элюирована 50 мМ фосфата натрия, 125 мМ NaCl, 0,1% Pluronic F68, pH 7,5. Элюированный rРН.2 был доведен до конечной концентрации 4 мг/мл путем разбавления в 50 мМ фосфате натрия, 125 мМ NaCl, 0,15% Pluronic F68, pH 7,5 и Tween 80 и был окончательно доведен до конечной концентрации 0,02% Tween 80. Полученный продукт был отфильтрован через мембрану с порами 0,2 мкм и сохранялся для дальнейшего использования.
3. Сравнение PAF-AH фрагментов с PAF-AH путем секвенирования
Очищенные rРН. 2 и rРН.9 составы были приготовлены с выделенным rPAF-AH посредством N-концевого секвенирования с использованием секвенсера Applied Biosystems модель 473А (Applied Biosystems, Foster City, CA) и применением С-концевого секвенирования посредством Hewlett-Packard C-концевого секвенсера протеина модели G1009A. Полученное rРН.2 соединение обладало меньшей М-концевой гетерогенностью по сравнению с rPAF-AH. N-концевой анализ rРН.9 состава был аналогичен rРН,2, но имел меньшую N-концевую гетерогенность, чем это было определено для состава rРН.9 по сравнению с rРН.2.
Выделенный rРН. 2 состав содержал обычную последовательность с N-конца Ala47 (примерно 86-89%) и меньшую последовательность N-конца Аlа48 (примерно 11-14%) с указанным соотношением этих двух N-концевых компонентов, обладающих достаточной совместимостью для различных условий ферментации, Выделенный rРН.9 состав также содержал обычную последовательность с N-концом Ala47 (приблизительно 83-90%) и меньшую последовательность с N-концом Аlа48 (примерно 10-17%). В противоположность этому попытка создать в бактериях полипептиды, начиная с Ile42 (rPAF-AH), приводила к изменению состава полипептидов с N-концами, начиная с Ala47 (20-53%), Ilе42 (8-10%) или искусственную инициацию Met-1 метионина (37-72%), смежного с Ile42. Для rРН.2 и rРН. 9 исходный метионин эффективно удаляется посредством аминотерминальной пептидазы после бактериального синтеза полипептидов, сохраняя аланин на позиции 47 (или аланин на позиции 48) в качестве N-концевого остатка.
С-концевое секвенирование было выполнено на одном участке rРН.2, который, как наблюдалось, имел С-конец HOOC-Asn-Tyr как основную последовательность (примерно 80%), согласующуюся с предполагаемой последовательностью HOOC-Asn441-Tyr440 С-конца продукта трансляции, в то время как около 20% составлял HOOC-Leu. После приготовления состава rРН.2 он был фракционирован с использованием SDS-PAGE с дополнительным секвенированием первичной и вторичной полос, образуя С-концевую последовательность HOOC-Leu-Met из нижней вторичной полосы (АНL, описанной ниже в разделе в.5), совпадающую с продуктом, который на 10 аминокислот короче, чем транслируемый продукт полной длины так же, как и низкий уровень HOOC-His. Дальнейшее построение карты пептида показывает, что дополнительный С-конец присутствует в некоторых участках протеина. С-конец rРН.9 был первоначально HOOC-Ile-His (приблизительно 78 до 91% в зависимости от участка) непосредственно секвенированным совместно с исходным HOOC-Ile429-His428 С-концом транслируемого продукта. В этой методике возникает некоторый фон ("шум"), так что другие последовательности, присутствующие в небольшом количестве, не могут быть учтены.
4. Сравнение фрагментов PAF-AH с PAF-AH посредством MALDI-MS
Приводили MALDI-MS очищенных продуктов vPH.2 и vPH.9. В спектре vPH.2 имеются два пика в области значений величины массы, ожидаемой для продуктов vPAF-AH (см. фиг.4), сходных с пиками, наблюдаемыми в спектре у частично очищенного белка согласно приведенному выше разделу В.1. Второй пик, с меньшей молекулярной массой, обычно присутствует приблизительно как 20-30% от общего. В спектре vPH.9 наблюдается преобладающий пик, согласующийся к пиком, ожидаемым для продукта полной длины для вектора РН.9 минус инициирующий трансляцию метионин (см. фиг.5). Также наблюдается небольшое плечо для несколько меньшего молекулярного веса, которое соответствует примерно 5% от суммарной величины.
5. Сравнение фрагментов PAF-AH и PAF-AH методом SDS-PAGE.
Электрофорез с использованием додецилсульфата натрия и полиакриламида (SDS-PAGE) был выполнен с целью выделения rPAF-AH, rPH.2 и rРН.9 продуктов. Сложные полосы в пробах, наблюдаемые для rPH. 2 в районе миграции при электрофорезе ожидаемого для rPAF-AH продукта, основаны на стандартном молекулярном весе протеина. В одном или нескольких гелях были видны две преобладающие полосы с четко наблюдаемыми вторичными полосами над и под основной полосой. Эти верхние вторичные, средние первичные и нижние вторичные полосы соответственно были определены как АНU, АНM и AHL. Все эти полосы взаимодействовали с анти-rPAF-AH моноклональными антителами на вестерн-блоттинге и были определены как продукты, относящиеся к rPAF-AH. Верхняя вторичная полоса АНU увеличивала свою интенсивность по мере накопления протеина и, вероятно, представляет модифицированную форму продукта rРАР-АН. Подготовка SDS-PAGE rРАР-АН аналогична подготовке rРН.2. Существуют две главные полосы, которые мигрируют вблизи ожидаемого молекулярного веса rPAF-AH так же, как и меньшая полоса над и ниже главной полосы. Наоборот, rPAF-AH демонстрирует единственную преобладающую полосу на SDS-PAGE без видимой деградации. Также были видны слабые полосы, соответствующие более малому молекулярному весу и предполагаемому положению димера. Не было обнаружено никакой полосы, характерной для АНц.
Состав выделенных rРН.2 и rРН.9 препаратов был также проанализирован на 2D гелях (изоэлектрическая фокусировка (IFF) мочевиной, за которой следует SDS-PAGE во втором измерении). Для rPH.9 2D гели показали пять крупных пятен, разделенных в IFF направлении. Гетерогенность заряда, по-видимому, располагается между участками rPH.9. Наоборот, 2D гелевый профиль rРН.2 был более сложным, т.к. он содержал около 15 раздельных пятен в IFF и SDS-PAGE направлениях.
6. Сравнение активности фрагментов PAF-AH с PAF-AH
Выделенные rРН. 2 и rPH.9 имеют ферментативную активность, не отличимую от эндогенного PAF-AH, выделенного из сыворотки, и rРН.2 и rРН,9 связанных с липопротеином таким же образом, как и очищенный эндогенный PAF-AH.
Пример 11
Предварительный анализ экспрессивных образцов PAF-AH плазмы человека mRNA в тканях человека был выполнен посредством назерн-блоттинговой гибридизации.
RNA была приготовлена из мозга, сердца, почки, плаценты, тимуса и миндалевидной железы человека с применением RNA Start 60 (Tel-Test "В", Friendswood, TX). Кроме того, RNA была приготовлена из кроветворных аналогов предшественников линии клеток человека, ТНР-1 (АТСС TIB 202), которые были индуцированы для различения фенотипа подобного макрофага с использованием форболового эфира форболмиристилацетата (РМА). Ткани RNA и RNA, приготовленные из клеток примиелоциловых ТНР-1 клеток в течение от 1 до 3 дней после индуцирования были подвергнуты электрофорезу с применением 1,2% агароза - формальдегидного геля и затем перенесены на нитроцеллюлозную мембрану. PAF-AH cRNA, sAH 406-3, плазмы человека полной длины были маркированы с применением случайного прайминга и гибридизированы на мембрану при условиях, идентичных тем, которые описаны в примере 3 для скрининг библиотеки. Первоначальные результаты показывают, что пробы PAF-AH гибридизируются в 1,8 полосу в тимусе, миндалевидной железе и в несколько меньшей степени в плаценте RNA.
PAF синтезируется в мозге при нормальной физиологии так же, как и при патологических условиях. Сведения, известные о предвоспалительных и потенциальных невротических свойствах молекул, механизме локализации PAF синтеза или для протекания процесса быстрого катаболизма, рассматриваются как критические для обеспечения здорового состояния нервных тканей. Присутствие PAF ацетилгидролазы в нервных тканях совпадает с ее функциями, такими как защитная роль. Интересно, что оба соединения - бычий гетеротримерный внутриклеточный PAF [клонирование которого описано у Hattori et al., J. Biоl. Chem., 269(37): 23150-23155 (1994)] и PAF в соответствии с настоящим изобретением были идентифицированы в мозге. Для определения, действительно ли эти два фермента экспрессируются в те же самые или в различные участки мозга, человеческий гомолог бычьего мозга внутриклеточного PAF-AH cDNA был клонирован и его mRNA экспрессионная структура в мозге сравнивалась с использованием назерн-блоттинга с mRNA экспрессионной структурой PAF-AH настоящего изобретения таким же самым методом, как это было описано в приведенных выше параграфах. Области мозга, исследованные с применением назерн-блоттинга, были мозжечком, продолговатым мозгом, спинным мозгом, оградой, миндалевидным ядром, хвостовым ядром, таламусом и затылочной областью, передними долями и корой головного мозга. Информация об обоих ферментах была получена для каждой из этих тканей, хотя гетеротримерные внутриклеточные формы появлялись в большем количестве, чем секреционные формы. Назерн-блоттинг анализы дополнительных тканей, кроме того, обнаружили, что гетеротримерные внутриклеточные формы экспрессируются в различных видах тканей и клеток, включая тимус, предстательную железу, яички, яичник, тонкую кишку, толстую кишку, периферийные лейкоциты крови, макрофаги, мозг, печень, скелетные мускулы, почки, поджелудочную железу и надпочечные железы. Такая повсеместная экспрессия свидетельствует о том, что гетеротримерная внутриклеточная PAF-AH имеет общую защитную функцию в клетках.
Также была исследована экспрессия PAF-AH RNA в моноциты, изолированные от человеческой крови, и в течение их спонтанной дифференциации в макрофаги в культуре. Малое количество или полное отсутствие RNA было обнаружено в свежих моноцитах, однако экспрессия была индуцирована и поддерживалась на протяжении дифференциации в макрофаги. Наблюдалось присутствие аккумулированной активности PAF-AH в культурной среде дифференцирующихся клеток. Экспрессия транскрипта человеческой плазмы PAF-AH наблюдалась также в ТНР-1 клетках RNA в течение 1 дня, но не более 3 дней, последующих за индукцией. ТНР-1 клетки не экспрессируют mRNA для PAF-AH в исходном состоянии.
Пример 12
PAF-AH экспрессия в тканях человека и мыши была исследована посредством in situ гибридизации.
Ткани человека были получены от National Disease Research Interchange and Cooperative Hooman Tissue Network. Нормальный мозг и спинной мозг мышей, а также ЕАЕ участки 3 спинного мозга мыши были получены от S/JLJ мышей. Нормальные S/JLJ эмбрионы мышей были получены в течение от семи до восьми дней после оплодотворения.
Срезы тканей были помещены в Tissue Tek II криостат (Miles Laboratories, Inc. , Naperville, II) с малым количеством ОСТ смеси (Miles, Inc., Elkhart, IN). Они были центрованы в криостате, криостат был заполнен ОСТ смесью и затем помещен в контейнер с 2-метилбутаном [C2H5CH(CH3)2, Aldrich Chemical Company, Inc. , Milwaukee, Wl] и контейнер был помещен в жидкий азот. После того как ткани и ОСТ смесь в криостате были заморожены, блок сохранялся при температуре -80oС до момента вскрытия. Блок тканей был разделен на срезы толщиной 6 мкм и срезы был закреплены к предметному стеклу, покрытому Vectabond (Vector Laboratories, Inc., Burlingame, CA) и сохранялись при -70oС до помещения при 50oС приблизительно на 5 минут в теплую среду для удаления конденсата и затем срез фиксировался в 4% параформальдегиде в течение 20 минут при 4oС, дегидрировался (70%, 95%, 100% этанолом) в течение 1 минуты при 4oС на каждой стадии, после чего выдерживался в сухом воздухе в течение 30 минут при комнатной температуре. Срез был помещен в денатурирующий агент на 2 минуты при 70oС в 70% формамид/2Х SSC, прополаскивался дважды в 2Х SSC, дегидрировался и затем осушивался на воздухе в течение 30 минут. Ткани были гибридизированы in situ с радиоизотопной одинарной меткой mRNA, генерируемой из DNA, полученной из внешнего 1Kb HindIII фрагмента гена PAF-АН (нуклеотиды 308 до 1323 STQ ID NO: 7) посредством in vitro RNA транскрипции метки включения 35S-UTP (Amersham) или из DNA, полученной из гетеротримерного внутриклеточного PAF-AH cDNA, идентифицированного Hattori et al. Исследовались пробы с различной длиной от 250-500 bp. Гибридизация выполнялась в течение ночи (12-16 часов) при 50oС; 35S-маркированные рибопробы (6•10 5 cpm/срез), tRNA (0,5 мг/срез) и диэтилпирокарбонатная (depc)-oчищeннaя вода была добавлена в гибридизационный буфер, чтобы привести к конечной концентрации 50% формамида, 0,3 М NaCl, 20 мМ Tris, pH 7,5, 10% сульфата декстрана, 1Х раствора Denhardt, 100 мМ дитиотретола (DTT) и 5 мМ EDTA. После гибридизации срезы были промыты в течение 1 часа при комнатной температуре в 4Х SSC/10 мМ DTT, затем в течение 40 минут при 60oС в 50% формамиде/ 1X SSC /10 мМ DTT, 30 минут при комнатной температуре в 2Х SSC, и 30 минут при комнатной температуре в 0,1Х SSC. Срезы были дегидрированы, осушены на воздухе в течение 2 часов, покрыты фотографической эмульсией Kodak NTB2, осушены на воздухе в течение 2 часов, проявлены (после хранения при 4oС в полной темноте) и подвергнуты контрольному окрашиванию с применением гемотоксилина/эозина.
А. Мозг
Cerebellum. В мозге мыши и человека наблюдался четкий сигнал в Purkinje клеточном слое мозжечка, в клетках Бакета, и индивидуальных нервных клетках зубчатых ядер (один из четырех глубоких центров в мозжечке). Были также получены сведения о гетеротримерных внутриклеточных PAF-AH для клеток этого типа. Кроме того, сигнал PAF-AH плазмы был виден на индивидуальных клетках в гранулированных и молекулярных слоях серого вещества.
Hippocampus. В срезах гипокампа человека индивидуальные клетки, проходящие через срез, который является основой нервных клеток, показывают четкий сигнал. Эти сигналы были идентифицированы как полиморфические клеточные тела и гранулированные клетки. Сведения о гетеротримерных внутриклеточных PAF-AH также были зарегистрированы в гипокампе.
Brain stem. На сечениях как человеческого, так и мышиного ствола мозга наблюдался четкий сигнал на индивидуальных клетках в сером веществе.
Cortex. На срезах коры головного мозга, взятых с мозга, затылочных и височных областей головного мозга, и на полном срезе мозга мыши индивидуальные клетки, проходящие через мозг, показывают четкий сигнал. Эти клетки были идентифицированы как пирамидальные, звездообразные и полиморфические клеточные тела. Это не обозначает различие в экспрессии структуры в различных слоях мозга. Эти in situ результаты гибридизации отличаются от результатов, полученных для коры головного мозга с использованием нозерн-блоттинга. Выявленное различие аналогично результатам от высокочувствительной in situ гибридизации по сравнению с нозерн-блоттингом, Как в мозжечке, так и в гипокампе наблюдались подобные типы экспрессии гетеротримерных внутриклеточных PAF-AH.
Pituitary (гипофиз) Некоторый слабый сигнал был виден на отдельных разбросанных индивидуальных клетках в периферийной части сечений человеческих тканей.
В. Толстая кишка человека
Как при нормальной, так и при заболевании Крона толстой кишки, был идентифицирован сигнал в лимфатических срезах слизистой оболочки с уровнем, лишь незначительно большим, чем в срезах пациентов с болезнью Крона. Толстая кишка при болезни Крона также имеет ярко выраженный сигнал в собственном слое. Аналогично высокий уровень сигнала наблюдался в срезах больного аппендикса, в то время как нормальный аппендикс показывает слабый, но тем не менее обнаруживаемый сигнал. Срез у пациента с язвенным колитом не показывает наличие явно выраженного сигнала даже в лимфатических узлах или в собственном слое.
С. Миндалевидная железа и тимус человека
Четкий сигнал был виден на рассеянных группах индивидуальных клеток внутри зародышевых центров миндалевидной железы и внутри тимуса.
D. Лимфатические узлы человека
Четкий сигнал был обнаружен на срезе лимфатического узла, взятого у нормального донора, в то время как слабый сигнал наблюдался в лимфатических узлах среза донора с септическим шоком.
Е. Тонкая кишка человека
Тонкая кишка как нормального человека, так и при заболевании Крона, имели слабый сигнал в Payer "очажках" и в сечении собственного слоя с незначительно более сильным сигналом на больной ткани.
F. Селезенка и легкое человека
Сигнал не наблюдался ни на каких тканях селезенки (нормальной и на срезах с абсцессом селезенки) или легких (нормальных и на срезах с эмфиземой).
G. Спинной мозг мыши
Как в случае нормального, так и при исследовании ЕАЕ участка 3 спинного мозга наблюдался четкий сигнал в сером веществе спинного мозга с экспрессией, немного большей для ЕАЕ участка 3 спинного мозга. В ЕАЕ участке 3 спинного мозга клетки в белом веществе и в мышечном окружении, вероятно, пропитывают макрофаги и/или другие лейкоциты, выявляя сигнал, который отсутствовал в нормальном спинном мозге.
F. Эмбрионы мыши.
На 11 день сигнал эмбриона явно обнаруживался в центральной нервной системе в четвертом желудочке и сохранялся постоянным в течение всего времени развития, как это проявлялось в мозжечке и стволе мозга. По мере развития эмбриона сигнал становился более четким в центральной нервной системе, в спинном мозге (день 12), передней части коры головного мозга и ганглиях Gassed (день 14), и в гипофизе (день 16). Сигнал наблюдался в периферической нервной системе (начиная с 14 или 15 дня) на нервах, отходящих от спинного мозга, и на 17 день появлялся четкий сигнал вокруг боковой части черепа эмбриона. Экспрессия также наблюдалась в печени и легких на 14 день, на кишках (начиная с 15 дня), и в задней части рта/горла (начиная с 16 дня). На 18 день ход экспрессии имел отличие в сигнале в коре головного мозга, задней части мозга (головной мозг и ствол мозга), нервах, отходящих от поясничной области спинного мозга, задней области рта/горла, печени, почек и несколько более слабый сигнал в легких и гипофизе.
G. Выводы
PAF-AH mRNA экспрессия в миндалевидной железе, тимусе, в лимфатических узлах, Реуеr "очажках", аппендиксе, лимфатических комплексах толстой кишки согласуются с выводами, что возможный предоминант in vivo источнике PAF-AH является макрофагом, потому что все эти ткани развиваются с макрофагами тканей, которые служат как фагоцитные и антигенные развивающиеся клетки.
Экспрессия PAF-AH в воспаленных тканях соответствует гипотезе о роли получаемых моноцитных макрофагов в возникновении воспалительного процесса. Можно предположить, что PAF-AH приводит к ослаблению PAF и предвоспалительных фосфолипидов, которые регулируют последующее распространение воспалительного процесса в случае его возникновения благодаря действию переносчика.
PAF обнаруживался во всех мозговых тканях и является секретом церебральных гранулированных клеток крысы в культуре. In vivo и in vitro выполненные эксперименты свидетельствуют, что PAF связывает специфические рецепторы в нервных тканях и индуцирует функциональные и фенотипные изменения, такие как активация кальция, повышенная регуляция транскрипции активированных генов, и дифференциация предшественников нервных клеточных линий, РС12. Эти наблюдения свидетельствуют о физиологической роли PAF в мозге и его связях, последующие эксперименты с использованием срезов тканей культуры гипокампа и PAF аналогов и антагонистов включают PAF как важный обратный посредник в долгосрочном потенциировании гипокампа. Кроме того, в дополнении к патологическому эффекту при воспалении PAF проявляет способность к использованию в обычных процессах передачи нервных сигналов. Экспрессия внеклеточных PAF-АН в мозге может служить для регуляции продолжительности и величины передаваемых PAF-AH-промежуточных сигналов.
Пример 13
Моноклональные антитела, специфические для рекомбинантного PAF-AH, человеческой плазмы были получены с использованием Е.coli продуцированной PAF-AH в качестве иммуногена.
Мышам # 1342 была введена на нулевой день, на 19 день и на 40 день рекомбинантная PAF-AH. Для бустер-инъекции мыши был введен иммуноген в PBS и через четыре дня мышь была умерщвлена и ее селезенка удалена в стерильных условиях и помещена в 10 мл очищенный от сыворотки RPMI 1640. Одноклеточная суспензия была приготовлена путем измельчения селезенки между замороженными концами предметных стекол микроскопа, погруженными в очищенный от сыворотки RPMI 1640 с добавлением 2 мМ L-глутамина, 1 мМ пирувата натрия, 100 единиц/мл пенициллина, и 100 мг/мл стрептомицина (RPMI) (Gibco, Canada). Клеточная суспензия была профильтрована через стерильный клеточный сетчатый фильтр 70-mesh Nitex (Becton Dickinson, Parsippany, New Jersey) и дважды промыта при центрифугировании при 200 g в течение 5 минут и повторно переведена в форму суспензии из полученных гранул в 20 мл очищенной от сыворотки RPMI. Тимоциты, полученные из 3 обычных Balb/c мышей, были приготовлены аналогичным способом. NS-1 клетки миеломы сохранялись в лог-фазе в RPMI с 11% эмбриональной бычьей сыворотки (FBC) (Hyclone Laboratories, Inc., Logan, Utah) в течение трех дней перед синтезом, были центрифугированы при 200 g в течение 5 минут и полученные гранулы были промыты дважды, как это было описано в предыдущем разделе.
Клетки селезенки (один • 108) были объединены с 2,0•107 NS-1 клеток, центрифугированы и супернатант был подвергнут аспирации. Клеточные гранулы были выведены из лог-фазы посредством применения продувочной трубки и 1 мл PEG 1500 (50% в 75 мМ Hepes, pH 8,0) (Boehringer Mannheim) при 37oС, после чего были перемешаны в течение более 1 минуты и затем дополнены 7 мл очищенной от сыворотки RPMI в течение 7 минут. Затем было добавлено 8 мл RPMI и клетки были центрифугированы при 200 g в течение 10 минут. После извлечения супернатанта гранулы были повторно переведены в форму суспензии в 200 мл RPMI, содержащей 15% FBS, 100 мМ гипоксантина натрия, 0,4 мкМ тимидина (HAT) (Gibco), 25 единиц/мл IL-6 (Boehringer Mannheim) и 1,5•106 тимоцитов/мл, и суспензия была помещена в 10 сосудов Corning с 96 лунками с плоским дном для размещения пластин культуры тканей (Corning, Corning New York).
На 2, 4 и 6 день после реакции 10 мл среды было удалено из лунки реакционной пластины и помещено в свежую среду. На 8 день среда была отцежена посредством ELISA, подвергнута исследованию для определения наличия IgG мыши, связанного с рекомбинантной PAF-AH. 4 пластины Immulon (Dynatech, Cambridge, MA) были покрыты в течение 2 часов при 37oС 100 нг/лунку рекомбинантной PAF-AH, разведенной в 25 мМ TRIS, pH 7,5. Покрывающий раствор был аспирирован и 200 ul/лунку блокирующего раствора [0,5 желатина из рыбьей чешуи (Sigma), разведенного в CMF-PBS] было добавлено и полученный материал был инкубирован в течение 30 минут при 37oС. Пластина была промыта три раза в PBS с 0,05% Tween 20 (PBST) и было добавлено 50 мкл культуры супернатанта. После инкубации в течение 30 минут при 37oС и промывки, как это было описано выше, было добавлено 50 мкл меченного пероксидазой хрена козьего и мышиного иммуноглобулина IgG (fc) (Jackson ImmunoResearch, West Grove, Pennsylvania), разведенного 1:3500 в PBST, Пластины были инкубированы, как это было описано выше, промыты четыре раза в PBST и 100 мкл субстрата, содержащего 1 мг/мл о-фенилендиамика (Sigma) и 0,1 мкл/мл 30% H2O2 в 100 мМ цитрате, рН 4,5 было добавлено. Цветовая реакция была остановлена через 5 минут путем добавления 50 мкл 15% H2SO4. A490 был обнаружен на пластине (Dynatech).
Выбранные лунки синтеза были клонированы дважды путем разведения в пластиах с 96 лунками и визуально определено число клонов/лунку после 5 дней. Гибридомные клоны были: 90DIE, 90Е3А, 90E11D (АТСС НВ 11724), и 90F2D (АТСС НВ 11725).
Моноклональные антитела, полученные посредством гибридом, были определены, используя Isostrip систему (Boehringer Mannheim, Indianapolis, IN). Результаты показывают, что моноклональные антитела, полученные посредством гибридом при слиянии 90 клеток, были все иммуноглобулином IgG 1.
Все моноклональные антитела, полученные посредством гибридом из 90 клеток, достаточно хорошо функционируют при ELISA анализе, но не способны связывать PAF-AH при вестерн-блоттинге. Для создания антител, которые могут определять PAF-AH при вестерн-блоттинге, мышь # 1958 была иммунизирована рекомбинантом фермента. Гибридомы были созданы, как это описано при слиянии 90 клеток, но выделены посредством вестерн-блоттинга, а не с использованием ELISA с целью идентификации вестерн-компетентности клонов.
Для вестерн-анализов рекомбинантная PAF-AH была смешана с равным объемом пробы буфера, содержащего 125 мМ Tris, рН 6,8, 4% SDS, 100 мМ дитиотритола и 0,05% бромфеноловым синим и прокипячен в течение пяти минут перед помещением на 12% SDS полиакриламидный гель (Novex). Последующий электрофорез при 40 мА обеспечил перенос протеинов на поливинилиденфторидную мембрану (Pierce) в течение 1 часа при 120 В с использованием 192 мМ глицерина, 25 мМ Tris основания, 20% метанола и 0,01% SDS. Мембрана была инкубирована в 20 мМ Tris, 100 мМ NaCl (TBS), содержащего 5% сыворотки бычьего альбумина (BSA, Sigma), в течение ночи при 4oС. Пятно было инкубировано в течение 1 часа при комнатной температуре с поликлональной антисывороткой кролика, разведенной 1/8000 в TBS, содержащей 5% BSA, и затем промыто TBS и инкубировано в щелочном фосфате с козьим и мышиным иммуноглобулином IgG в TBS, содержащей 5% BSA, в течение 1 часа при комнатной температуре. Пятно было вновь промыто TBS и затем инкубировано в 0,02% 5-бромо-4-хлоро-3-индолил фосфате и 0,03% нитротетразолине синем в 100 мМ Tris-HCl, pH 9,5, 100 мМ NaCl и 5 мМ MgCl2. Реакция была приостановлена проведением повторной промывки водой.
Выборы лунок синтеза, супернатантов, пригодных для проведения вестерн-анализов, были выполнены, как это указывалось выше. Гибридома 143А реагировала с PAF-AH в вестерн-блоттинге и была клонирована (АТСС НВ 11900).
Поликлональная антисыворотка, специфичная для человеческой плазмы PAF-AH, была индуцирована у кроликов посредством трехмесячной иммунизации с использованием 100 мкг очищенного рекомбинанта фермента в адъюванте Фруйнда.
Пример 14
Было выполнено исследование с целью изучения in vivo терапевтического эффекта рекомбинантной PAF-AH в соответствии с настоящим изобретением при остром воспалении с использованием модели отека лап у крыс [Henriques et al. , Br. J. Farmacol., 106: 579-582 (1992)]. Результаты этих исследований показывают, что rPAF-AH блокирует PAF-индуцируемое воспаление. Одновременное изучение было проведено с целью сравнения эффективности PAF-AH с двумя существующими коммерчески PAF антагонистами.
А. Приготовление PAF-AH
Е. coli с трансформированным PAF-AH вектором экспрессии рuс trp АН был лизирован в микроаппарате с псевдоожиженным слоем, полученная твердая фаза была выделена центрифугированием и клеточный супернатант был загружен в S Sepharose колонку (Pharmacia). Колонка была экстенсивно промыта буфером, содержащим 50 мМ NaCl, 10 мМ CHAPS, 25 мМ MES и 1 мМ EDTA, pH 5,5. PAF-AH был элюирован буфером NaCl с увеличенной до 1 М концентрацией. Аффинная хроматография с использованием Blue Sepharose колонки (Pharmacia) затем была использована на этапе последующей дополнительной очистки. Перед загрузкой PAF-AH в Blue Sepharose колонку проба была разбавлена 1:2 с целью снижения концентрации NaCl до 0,5 М и pH был доведен до величины 7,5. После промывки Blue Sepharose колонки буфером, содержащим 0,5 М NaCl, 25 мМ Тris, 10 мМ CHAPS и 1 мМ EDTA, pH 7,5, PAF-AH был элюирован с использованием NaCl с увеличением концентрации до 3,0 М.
Выделенный таким образом PAF-AH имел чистоту почти 95%, как это следует из SDS-PAGE, и активность в пределах 5000-10000 единиц/мл. Дополнительно был проведен контроль качества каждого препарата PAF-AH, включая определение уровня эндотоксинов и активность гомолиза на свежеполученных эритроцитах крысы. Буфер содержал 25 мМ Tris, 10 мМ CHAPS, 0,5 М NaCl, pH 7,5 и использовался как среда для хранения ферментов, а также в качестве компонента при проведении инъекций. Дозировка, используемая при экспериментах, была основана на результатах испытания активности ферментов, выполненных непосредственно перед началом этих экспериментов.
В. индукция отека
Шесть самок крыс Long Evans восьминедельного возраста (Charles River, Wilmington, МА) весом 180-200 грамм были использованы во всех экспериментах. Перед проведением экспериментов животные были анестезированы смесью анестезирующей жидкости Ketaset (Fort Dodge Laboratories, Fort Dodge, IA), Rompun (Miles Shawnee Mission, KS) и Асе Promazine (Aveco, Fort Dodge, IA), вводимой подкожно приблизительно в количестве 2,5 мг Ketaset, 1,6 мг Rompun, 0,2 мг Асе Promazine в дозе для каждого животного. Отек был индуцирован в лапах путем введения либо PAF, либо зимозана, как это указано. PAF (Sigma # P-1402) был свежеприготовленным для каждого эксперимента и содержал 19,1 мМ исходного раствора, сохраняемого в хлороформе/метаноле (9:1) при -20oС. Необходимый объем был осушен под N2, разведен 1:1000 в буфере, содержащем 150 мМ NaCl, 10 мМ Tris, рН 7,5, и 0,25% BSA и подвергался обработке ультразвуком в течение пяти минут. Животные получили 50 мкл PAF (окончательная доза 0,96 н-моль) подкожно между задними подушечками лап, и отек наблюдался через 1 час и снова через 2 часа в некоторых экспериментах. Зимозан A (Sigma #A-8800) был свежеприготовленным для каждого эксперимента в форме суспензии в 10 мг/мл в PBS. Животные получали 50 мкл зимозана (полная доза 500 мкг) подкожно между подушечками задних лап, и отек наблюдался после 2 часов.
Отек количественно оценивался путем измерения объема лап непосредственно пред введением PAF или зимозана и через установленное время после введения PAF или зимозана. Отек наблюдался в форме увеличения объема лап и измерялся в миллиметрах. Оценка изменения объема выполнялось на анестезированных животных с использованием специального прибора (plethysmometr) (UGO Basile, модель # 7150), который определял изменение объема воды при погружении лапы. Для того чтобы убедиться, что погружение было сравнимым от одной временной точки до другой, задние лапы были маркированы несмываемыми чернилами в месте, где волосяная линия соединяется с пяткой. Повторяемость результатов измерений той же самой лапы с применением этой методики показывает, что точность измерения находится в пределах 5%.
С. Курс ведения и дозировка PAF-АН
PAF-AH вводилась локально между подушечками лап или систематически IV уколами в хвостовую вену. Для локального введения крысы получали 100 мкл PAF-AH (4000-6000 единиц/мл), вводимых подкожно между подушечками правых задних лап. В левые лапы в качестве контроля вводили 100 мкл контрольного вещества (буфер, содержащий солевой раствор). Для систематического введения PAF-AH крысы получали установленную дозу PAF-AH в 300 мкл контрольного вещества, вводимого IV в хвостовую вену. Контроль осуществлялся введением соответствующего объема контрольного вещества IV в хвостовую вену.
D. Локальное введение PAF-AH
Крысам (N=4) были сделаны инъекции 100 мкл PAF-AH (4000-6000 единиц/мл) подкожно между подушечками правых лап. В левые лапы были сделаны инъекции 100 мкл контрольного вещества (буферного солевого раствора). Четырем другим крысам были сделаны инъекции только контрольного вещества. Всем крысам было немедленно выполнено контрольное заражение PAF путем подкожной инъекции в лапы, и объем лап был измерен через час после контрольного заражения. Фиг.6, где отек характеризуется как среднее увеличение объема лапы (мл) ± SEM для каждой испытуемой группы, показывает, что отек лап, инициированный введением PAF, блокируется локальным введением PAF-AH. Группа, которая предварительно получала локальное введение PAF-AH перед проведением контрольного заражения PAF, показала уменьшенный отек по сравнению с инъецированной контрольной группой. Увеличение объема лап на 0,08 мл±0,08 (SEM) наблюдалось в PAF-AH группе по сравнению с 0,63±0,14 (SEM) для группы с введенным контрольным веществом. Увеличение объема лап было прямым результатом инъекции PAF, т.к. инъецированные животные, котором было введено только контрольное вещество, не обнаруживали увеличение объема лап.
Е. Внутривенное введение PAF-AH
Крысы (N= 4 в каждой группе) были предварительно подготовлены IV с применением либо PAF-AH (2000 единиц в 300 мкл контрольного вещества), либо только контрольным веществом за 15 минут до контрольного заражения PAF. Отек наблюдался через 1 и 2 часа после заражения PAF. Фиг.7, где отек представлен как среднее увеличение в объеме (мл) ±SEM для каждой исследуемой группы, показывает, что IV введение PAF-AH блокирует PAF индуцируемый отек лап в течение одного и двух часов после заражения. Группа, которая получила 2000 единиц PAF-AH при IV курсе, показала уменьшение отека после двух часов проведения этого курса. Увеличение объема для PAF-AH зараженной группы после двух часов составило 0,10 мл±0,08 (SEM), против 0,56мл±0,11 для контрольной группы с введенным контрольным веществом.
F. Сравнение PAF-AH защиты в отеке, индуцированном PAF или зимозаном
Крысы (N= 4 в каждой группе) были предварительно подготовлены IV с применением либо PAF-AH (2000 единиц в 300 мкл контрольного вещества) либо только контрольного вещества. Через пятнадцать минут после подготовки группы получали либо PAF, либо зимозан А и через 1 и 2 часа производилось измерение объема лап соответственно. Как видно из фиг. 8, где отек представлен как среднее увеличение объема (мл)±(SEM) для каждой исследуемой группы, систематическое введение PAF-AH (2000 единиц) был эффективным и приводил к уменьшению отека лап, вызванному введением PAF, однако был недостаточным для блокирования отека, индуцированного зимозаном. Было обнаружено увеличение объем лап на 0,08±0,02 для группы, зараженной PAF-AH, по сравнению с аналогичной величиной 0,49±0,03 для контрольной группы.
G. Определение эффективной дозы PAF-AH защиты
В двух раздельных экспериментах группы крыс (N=3 до 4 в каждой группе), были предварительно подготовлены IV с применением обычного раствора PAF-AH или контрольного вещества в объеме 300 мкл за 15 минут до контрольного заражения PAF. Обе лапы были заражены PAF (как это описывалось выше), и отек наблюдался после 1 часа. Фиг.9, где отек представлен как среднее увеличение объема (мл)±SЕМ для каждой исследуемой группы, показывает увеличение защиты от PAF-индуцированного отека у крыс инъецированных увеличенной дозой PAF-AH. При экспериментах ID50 PAF-AH, введенный при IV курсах, было найдено в пределах между 40 и 80 единиц для каждой крысы.
Н. Эффективность PAF-AH, in vivo как функция времени после введения
В двух раздельных экспериментах две группы крыс (N=3 или 4 в каждой группе) были подготовлены IV либо с использованием PAF-AH (2000 единиц в 300 мкл контрольного вещества), либо только контрольного вещества. После введения группы получали PAF в интервалах времени от 15 минут до 47 часов после введения PAF-AH. Отек наблюдался в течение 1 часа после контрольного заражения PAF. Как видно из фиг.10, где отек представлен как среднее увеличение объема (мл)±SEM для каждой исследуемой группы, введение 2000 единиц PAF-AH предохраняет крыс от PAF индуцированного отека в течение по меньшей мере 24 часов.
H. Фармакологическая кинетика PAF-AH
Четыре крысы получили 2000 единиц PAF-AH посредством VI инъекций в объеме 300 мкл. Плазма была собрана в различное время и хранилась при 4oС; содержание PAF-AH в плазме было определено посредством ELISA с использованием экспериментов с двойным mAb захватом. Затем моноклональные антитела 90G11D (пример 13) были разведены в 50 мМ карбонатном буфере рН 9,6 с 100 нг/мл и иммобилизированы на Immulon 4 ELISA пластинах в течение ночи при 4oС. После экстенсивного промывания PBS, содержащей 0,05% Tween 20, пластины были блокированы в течение 1 часа при комнатной температуре с применением 0,5% желатина из рыбьей кожи (Sigma), разведенного в PBS. Пробы сыворотки, разведенные в PBS с 15 мМ CHAPS, были добавлены дважды на промытую ELISA пластину и инкубированы в течение 1 часа при комнатной температуре. После промывки конъюгат биотина моноклинальных антител 90F2D (пример 13) был добавлен в лунки при концентрации 5 мг/мл, разведенный в РВС, и инкубирован в течение 1 часа при комнатной температуре. После промывки 50 мкл разведенный 1:1000 ExtraAvidin (Sigma) был добавлен в лунки и проведена инкубация в течение 1 часа при комнатной температуре. После промывки лунки были обработаны с использованием OPD в качестве субстрата и было проведено их количественное определение. Активность ферментов затем была рассчитана по стандартным кривым. Фиг.11, иллюстрирующая данные с учетом ±SEM, показывает, что в течение одного часа уровень ферментов приближается к расчетной концентрации, определенной для из расчета 5-6 мл объема плазмы для крыс весом 188-200 г и это значение составляет = 374 единиц/мл ±58,2. После одного часа уровень плазмы постоянно уменьшается, достигая величины концентрации плазмы 19,3 единиц/мл ±3,4 в течение 24 часов, который значительно выше, чем эндогенный уровень PAF-AH крыс, который был определен приблизительно как 4 единицы/мл посредством исследования ферментов.
J. Эффективность PAF-AH по сравнению с PAF антагонистами
Группы крыс (N=4 в каждой группе) были подготовлены с одним из трех потенциальных антиотечных препаратов: PAF антагонистом CV3988 (Biomol #L-103) с введением IP (2 мг в 200 мкл ЕtOН), PAF антагониста Alprazolam (Sigma #А-8800), вводимым IP (2 мг в 200 мкл ЕtOН), или PAF-AH (2000 единиц) при введении IV. Контрольные крысы были инъецированы IV 300 мкл объемом контрольного вещества. PAF антагонисты были введены IP (внутрибрюшинно) потому, что они были растворены в эталоне. Крысам, инъецированным с использованием CV 3988 или Alprazolam, было проведено контрольное заражение PAF после 30 минут после введения PAF антагониста, благодаря чему обеспечивалась возможность циркуляции, в то время как PAF-AH и крысы с введенным контрольным веществом были заражены через 15 минут после введения фермента. Крысы, инъецированные PAF-AH, показали уменьшение PAF - индуцированных отеков за исключением тех, которые были в состоянии, определяемом PAF антагонистами CV3988 и Alprazolam. На фиг. 12 отек представлен как среднее увеличение объема (мл)±SEM для каждой из испытуемых групп.
Итак, rPAF-AH является эффективным при блокировании отека, связанного с PAF in vivo. Введение продуктов PAF-AH может проводиться либо локально, либо системно путем IV инъекций. При определении доз было обнаружено, что IV инъекции в количестве 160-2000 единиц на одну крысу приводят к быстрому уменьшению вызванного PAF отека, в то время как величина ID50 показала, что дозировка должна быть в пределах 40-80 единиц на одну крысу. Расчеты, основанные на объеме плазмы для крыс весом 180-200 г, показывают, что концентрация в плазме в интервале 25-40 единиц/мл будет блокировать вызываемые PAF отеки. Эти предположения основаны на использовании результатов изучения предварительно выполненной фармакологической кинетики. Доза 2000 единиц PAF-AH был найдена эффективной для блокирования PAF-индуцированного отека, по крайней мере, в течение 24 часов. Было обнаружено, что в течение 24 часов после введения PAF-AH концентрация ферментов в плазме достигала величины приблизительно 25 единиц/мл. Было обнаружено, что PAF-AH блокирует индуцируемый PAF отек более эффективно, чем два исследованных известных PAF антагониста.
Совместно эти результаты показывают, что PAF-AH эффективно блокирует индуцируемое PAF воспаление и может использоваться в качестве терапевтического средства при болезнях, при которых PAF является первичным медиатором.
Пример 15
Рекомбинантная PAF-AH в соответствии с настоящим изобретением была также испытана во второй in vivo модели, в случае индуцированного PAF плеврита. PAF, как это было показано ранее, индуцирует сосудистые нарушения, когда он вводится в плевру [Henriques et al., supra]. Самкам крыс (Charles River, 180-200 г) была сделана инъекция в хвостовую вену 200 мкл 1% Evans blue dye в 0,9% с 300 мкл рекомбинантном PAF-AH (1500 мкмоль/мл/ч), приготовленной, как это было описано в примере 14, или в эквивалентном объеме контрольного буфера. Через пятнадцать минут крысы получили инъекцию 100 мкл PAF (2,0 нмоль) в плевральную область. Через один час после проведения контрольного заражения PAF крысы были умерщвлены и плевральная жидкость была собрана посредством промывания полости 3 мл солесодержащего буфера с фосфатом гепарина. Степень сосудистых дефектов была определена по количеству Evans blue dye в плевральном пространстве, и была оценена посредством абсорбции при 620 нм. Было обнаружено, что крысы, которым предварительно был введен PAF-AH, имели значительно меньшую утечку в сосудах, чем контрольные животные (имеющие более чем 80% уменьшенное воспаление).
Все перечисленные результаты подтверждают целесообразность использования рекомбинантного фермента PAF-AH для лечения плеврита в соответствии с настоящим изобретением.
Пример 16
Рекомбинантный фермент PAF-AH по настоящему изобретению был также испытан с целью определения эффективности в модели для индуцируемого антигеном эозинофильного рекруитмента. Накопление эозинофилов в воздушных путях является характерной особенностью завершающей фазы иммунной чувствительности, которая наблюдается при астме, ринитах и при экземе. BALB/c мыши (Charles River) были с повышенной чувствительностью, достигнутой посредством двух инъекций в брюшную полость 1 мг овальбумина (OVA) в 4 мг двуокиси алюминия (Imject alum, Pierce Laboratories, Rockford, IL), которые производились с двухнедельным интервалом. Через четырнадцать дней после вторичной иммунизации мышам с повышенной чувствительностью было проведено контрольное заражение или с использованием аэрозольного OVA или солевого раствора в качестве контроля.
Перед контрольным заражением мыши были разделены по случайному принципу на четыре группы по четыре мыши в группе. Мыши в группах 1 и 3 были подготовлены путем введения 140 мкл контрольного буфера, содержащего 25 М Тris, 0,5 М NaCl, 1 мМ EDTA и 0,1% Tween 80, с использованием внутривенной инъекции. Мыши в группах 2 и 4 были подготовлены путем введения 750 единиц PAF-AH (активность 5500 единиц/мл, введенного в количестве 140 мкл PAF-AH буфера). Через тридцать минут после введения PAF-AH или буфера мыши в группах 1 и 2 были подвергнуты воздействию PBS в аэрозольной форме, как это описано ниже, в то время как мыши из групп 3 и 4 были подвергнуты воздействию в аэрозольной форме OVA. Через двадцать четыре часа мышам было введено или 140 мкл буфера (группы 1 и 3) или 750 единиц PAF-AH в 140 мкл буфера (группы 2 и 4) путем внутривенного вливания.
Эозинофильная инфильтрация трахеи была индуцирована у мышей с повышенной чувствительностью при введении животным OVA в форме аэрозоля. Мыши с повышенной чувствительностью были помещены в 50 мл коническую пробирку для центрифуги (Corning) и вдыхали аэрозоль OVA (50 мг/мл), растворенный в 0,9% солевом растворе, в течение 20 минут с применением распылителя (Модель 646, DeVilbiss Corp., Somerset, PA). Контрольные мыши были обработаны аналогичным образом за исключением того, что 0,9% солевой раствор использовался при распылении. Через сорок восемь часов после обработки аэрозолем OVA или солевым раствором мыши были умерщвлены и трахеи были удалены. Трахеи каждой группы были помещены в ОСТ и сохранялись при -70oС до тех пор, пока не были выполнены срезы.
Извлечение эозинофильного инфильтрата из трахей, иссечение тканей четырех групп мышей было выполнено с использованием раствора Luna и гексатоксилин-эозинового раствора или с применением пероксидазы. Двенадцать срезов толщиной 6 мкм были взяты у каждой группы мышей и соответственно промаркированы. Нечетные пробы были окрашены с использованием Luna красителя следующим образом. Срезы были зафиксированы в формалиноспиртовом составе в течение 5 минут при комнатной температуре, промыты трижды водопроводной водой в течение 2 минут при комнатной температуре и затем дважды в dH2O в течение 1 минуты при комнатной температуре. Срезы тканей были окрашены Luna красителем в течение 5 минут при комнатной температуре (Luna краситель содержал 90 мл Weigert's Iron гематоксилин и 10 мл 1% Biebrich Scarlet). Окрашенные микроскопические препараты были погружены в 1% спиртовую кислоту шесть раз, промыты в водопроводной воде в течение 1 минуты при комнатной температуре, пять раз погружены в 0,5% раствор карбоната лития и промыты в проточной водопроводной воде в течение 2 минут при комнатной температуре. Микроскопический препарат был осушен с использованием 70%-95%-100% этанола каждый раз в течение 1 минуты при комнатной температуре и затем дважды очищен ксилолом в течение 1 минуты при комнатной температуре и помещен в Cytoseal 60.
Для окрашивания пероксидазы одинаковое число срезов было зафиксировано в ацетоне при 4oС в течение 10 минут с последующей осушкой воздухом. Двести мкл DAB раствора было добавлено к каждому раствору после отстоя в течение 5 минут при комнатной температуре. Микроскопический препарат был промыт водопроводной водой в течение 5 минут при комнатной температуре и 2 капли 1% осмиевой кислоты было введено в каждый срез в течение 3-5 секунд. Микроскопические препараты были промыты водопроводной водой в течение 5 минут при комнатной температуре и контрастно окрашены Mayers гематоксилином с температурой 25oС при комнатной температуре. Микроскопические препараты были затем промыты в водопроводной воде в течение 5 минут и дегидрированы с использованием 70%-95%-100% этанола в течение 1 минуты с проведением каждой из этих операций при комнатной температуре. Микроскопические препараты были обработаны в двух пробах ксилола в течение 1 минуты при комнатной температуре и помещены в Cytoseal 60.
Был произведен подсчет числа эозинофилов в тканях под слизистой оболочкой трахей. Трахеи мышей из групп 1 и 2 весьма незначительное количество эозинофилов, проходящих через массу оболочки слизистых тканей. Как и следовало ожидать, трахеи мышей в группе 3, которые были подготовлены с использованием буфера и подвергались воздействию распыления OVA, имели большое количество эозинофилов под слизистой оболочкой тканей. Наоборот, трахеи мышей группы 4, которые подвергались воздействию PAF-AH и распылению OVA, имели очень немного эозинофилов в тканях под слизистой оболочкой по сравнению с теми, которые наблюдались в двух контрольных группах, группе 1 и 2.
Итак, терапевтическое использование PAF-AH для организмов показывает более позднюю фазу иммунной чувствительности, включающую аккумулирование эозинофилов в дыхательных путях, как это наблюдается при астме и ринитах.
Пример 17
Продукты PAF-AH в соответствии с изобретением были также тестированы в двух различных моделях на крысах для лечения некрозных энтероколитов (NEC), острых кровоточащих некрозов кишок, которые происходят у детей в раннем возрасте и приводят к серьезным заболеваниям и смертности. Предыдущие эксперименты показывают, что лечение с использованием глюкокортикоидов снижает последствия NEC у животных и у преждевременно рожденных детей, причем активность глюкокортикоидов предполагает возможность увеличения активности плазмы PAF-AH.
А. Исследование активности на крысах с NEC, индуцированным PAF контрольным заражением
1. Предупреждение NEC
Рекомбинантный продукт PAF-AH, rРН.2 (25500 единиц в 0,3 мл, группы 2 и 4) или только контрольное вещество/буфер (25 мМ Tris, 0,5 М NaCl, 1 мМ EDTA и 0,1% Tween 80) (группы 1 и 3) были введены в хвостовую вену самок крыс Wistar (n=3) весом 180 - 220 г. Либо BSA (0,25%) - солевой раствор (группы 1 и 2), либо PAF (0,2 мкг/100 г) суспензии в BSA солевом растворе (группы 3 и 4) были введены в брюшную аорту на уровне верхней артерии брыжейки через 15 минут после rРН.2 или было инъецировано контрольное вещество, как это описано у Furukawa, et al. [J. Pediatr. Res. 34: 237-241 (1993)]. Тонкие кишки были удалены после 2 часов из связок Trietz, промыты холодным солевым раствором и исследованы в общей массе. Образцы были получены при микроскопическом исследовании из верхней, средней и нижней частей тонких кишок. Ткани были зафиксированы в буферном формалине и образцы были исследованы под микроскопом с окрашиванием гематоксилином и эозином. Эти эксперименты были повторены трижды.
Полные исследования показывают нормальное состояние кишок в группах, в которых было введено контрольное вещество BSA солевого раствора. Аналогично rРН.2, введенный при отсутствии PAF, не приводит к эффекту при общем исследовании. Наоборот, введение PAF в нижнюю аорту приводит к быстрому резкому обесцвечиванию и кровоизлиянию серозной поверхности кишок. Подобные кровоизлияния отмечались, когда были исследованы срезы слизистой поверхности тонких кишок, и кишечник обнаруживает признаки полного некроза. Когда rРН.2 был введен через хвостовую вену за 15 минут перед введением PAF в аорту, кишечник вел себя без отклонений.
При исследовании под микроскопом кишки, полученные от групп 1, 2 и 4, показывали нормальное расположение ворсинок и нормальную популяцию клеток внутри тонкого собственного слоя. Наоборот, группа с введенным только PAF показала некроз по всей толщине и кровотечение через всю поверхность слизистой оболочки.
Активация плазмы PAF-AH также была определена у крыс, использовавшихся в экспериментах, описанных выше. PAF-AH активность была определена следующим образом. Соответствующие анализы крови были взяты из хвостовой вены непосредственно перед инъекцией PAF и во время умерщвления. Примерно 50 мкл крови было собрано в гепаринизационную капиллярную трубку. Плазма была получена последующим центрифугированием (980 g в течение 5 минут). Ферменты были исследованы, как это было описано ранее y Yasuda и Johnson, Endocrinology, 130; 708-716 (1992).
Значение активности PAF-АН в плазме у всех крыс перед инъекцией было определено как 75,5±2,5 единиц (1 единица эквивалентна 1 нмоль•мин-1•мл-1 плазмы). Значение активности PAF-AH в плазме через 15 минут после инъекции контрольного вещества было 75,2±2,6 единиц для группы 1 и 76,7±3,5 единиц для группы 3. После 15 минут активность PAF-AH в плазме животных, инъецированных 25500 единиц rРН. 2, была 2249+341 единица для группы 2 и 2494±623 единицы для группы 4).
Значение активности для групп 2 и 4 оставалось умеренным (1855±257 единиц) до умерщвления (2 1/4часа после инъекции vPH.2) (Группа 2=1771±308; группа 4= 1939±478). Полученные результаты свидетельствуют о том, что активность PAF-AH в плазме крыс, которым вводилось только контрольное вещество (группы 1 и 3), не изменялась на протяжении эксперимента. У всех животных, получивших только инъекцию PAF, развивался NEC, в то время как все крысы, которые были инъецированы rРН.2, после инъекции PAF были полностью защищены.
2. Определение дозы для зашиты от NEC
С целью определения достаточной дозы для защиты организмов крыс от NEC животным вводились увеличивающиеся дозы rРН.2 за 15 минут до введения PAF. Первоначально rРН. 2 в количестве от 25,5 до 25500 единиц вводился в хвостовую вену крыс. PAF (0,4 мкг в 0,2 мл BSA-солевом растворе) был затем введен в брюшную аорту через 15 минут после введения rРН.2. Тонкие кишки были удалены и исследованы для определения NEC спустя 2 часа после введения PAF. Активность PAF-AH в плазме была определена перед экзогенным введением фермента и спустя 15 мин и 2 1/4 часа после введения vPH.2. Представлены средние результаты для групп, состоящих из 2-5 животных. Общие результаты показывают, что у всех крыс, получавших менее 2000 единиц фермента, развился NEC. Активность PAF-AH в плазме у животных, получивших наименьшее защитное количество фермента (2040 единиц), составляла 363 единиц на единицу плазмы после 15 минут, представляя пятикратное увеличение по сравнению с базовым уровнем. Если rРН.2 вводился в количестве, меньшем, чем 1020 полных единиц, полученная активность фермента в плазме составляла в среднем приблизительно 160 или менее и у всех животных развивался NEC.
3. Длительность защиты от NEC
Для определения длительности времени, в течение которого экзогенные продукты PAF-AH обеспечивают защиту против развития NEC, крысам одноразово вводилось установленное количество фермента через хвостовую вену и в последующем проводилось контрольное заражение PAF через различные периоды времени. rРН.2 (8500 единиц в 0,3 мл) или только контрольное вещество вводилось в хвостовую вену и PAF (0,36 мг в 0,2 мл BSA-солевом растворе) был введен в брюшную аорту через различное время после введения фермента. Тонкие кишки были удалены через 2 часа после инъекции PAF для полного гистологического исследования с целью оценки развития NEC. Активность PAF-AH в плазме была определена в различное время после введения фермента и через два часа после введения PAF. Значение величины ± стандартная ошибка для активности ферментов была определена для каждой группы.
Полученные результаты показывают, что у крыс не развивается NEC в течение первых восьми часов после инъекции rРН.2, однако у 100% животных с контрольным заражением PAF через 24 и 48 часов после инъекции фермента развивается NEC.
4. Реверсия NEC
Для того что бы определить влияет ли введение продуктов PAF-AH, на реверсивное развитие NEC, индуцированное инъекцией PAF, 25500 единиц фермента было введено посредством инъекции в полую вену через две минуты после инъекции PAF (0,4 мкг). Ни у одного из животных не наблюдалось развитие NEC. Однако, когда rРН. 2 был введен тем же путем через 15 минут после инъекции PAF, у всех животных наблюдалось развитие NEC с ускоренным курсом развития NEC, вызванным посредством введения PAF, как это описано у Furukawa et al. [supra].
Итоги этих наблюдений показывают, что относительно малое (пятикратное) увеличение активности PAF-AH в плазме способно предотвратить NEC. Эти наблюдения, совпадающие с опубликованными ранее сообщениями об активности PAF-AH в плазме у эмбрионов кроликов [Maki, et al., Proc. Natl. Acad. Sd. (USA) 85: 728-732 (1988)] и у раннерожденных детей [Caplan, et al., J.Pecliatr. 116: 908-964 (1990)], свидетельствуют об относительно низкой вероятности предположения того, что профилактическое введение рекомбинантных продуктов PAF-AH при пониженном весе новорожденных может быть полезным при лечении NEC.
В. Активность против NEC в модели на новорожденных
Эффективность продуктов PAF-AH, rРН.2, была оценена как следующая в NEC модели, в которой новорожденные крысы подвергаются стрессовому воздействию питательным составом и асфиксии, двум общим факторам риска для развития заболевания у людей. В этой модели приблизительно у 70-80% животных развиваются полные и микроскопические повреждения желудка, подобные NEC у новорожденных на третий день жизни. Новорожденные крысы были получены от беременных Sprague-Dawley крыс (Harlan Sprague-Dawley, Indianapolis, IN), которые были анестезированы с применением СО2 и извлечены через брюшную полость. Новорожденные животные были собраны, осушены и помещены в инкубатор для новорожденных на протяжении подготовки экспериментов.
Первые выбранные группы животных были использованы с целью определения дозы и абсорбционных характеристик rРН.2. Нормальным новорожденным крысиным детенышам были введены энтерально или в брюшную полость одна или три различные дозы rРН,2 (3λ, 15λ или 75λ) в момент 0 и пробы крови брались через 1 час, 6 часов или 24 часа после начала эксперимента для определения активности PAF-AH в плазме. Активность PAF-AH
измерялась с использованием методики инкубированная с субстратом. [Gray et al., Nature, 374: 549 (1995)] и ELSA с применением rPAF-AH моноклональных антител человека для каждого образца (90F2D и 90G11D, описанных в примере 13). Для отобранных проб был проведен иммуногистохимический анализ с применением двух различных моноклональных антител, развитых у rPAF-AH человека (90F2D и 90G11D, как это описано в примере 13). Иммуногистохимичекий анализ был проведен с использованием стандартного оборудования и применением разведенных 1:100 антител и инкубации в течение ночи.
Последующее энтеральное введение rРН.2 нормальным новорожденным крысам проводилось без измерения активности PAF-AH в плазме в различное время на протяжении эксперимента с использованием или методики инкубирования с субстрата, либо с применением техники ELISA. При внутриперитонеальном введении rРН. 2 величина изменения активности измерялась с применением обоих методов через 1 час после введения дозы и эта активность достигала пика в течение 6 часов. Увеличение доз rРН. 2 (с 3 до 75λ, с 10 до 250 единиц) приводило к возрастанию активности PAF-AH в плазме. Иммуногистохимический анализ обнаружил присутствие продукта rPAF-AH в клетках эпителия слизистой оболочки кишечника после введения в желудок. Реактивность образования кластеров большей частью в кишечных ворсинках наблюдалась с минимальным присутствием окраски в латентных клетках. Наблюдалось большее количество красителя в подвздошной кишке, чем в тощей кишке и некоторое количество продуктов rPAF-AH было выявлено при иммунохимическом анализе в толстой кишке. Не наблюдалось проявляющейся окраски в каких-либо контрольных образцах или в пробах из животных, дозированных с помощью внутрижелудочного введения. Так, энтеральное введение продуктов rPAF-AH приводит к локальному аккумулированию в слизистой оболочке эпителия фермента без какой-либо измеряемой систематически абсорбции, в то время как интраперитонеальное введение продуктов rPAF-АН приводит к усилению степени циркуляции ферментов, но при этом не наблюдается никакого локального аккумулирования их в желудке.
В NEC модели NEC был индуцирован у новорожденных крыс, как это описано у Caplan et al., Pediatr. Pathol., 14: (1994). Итак, животные с новорожденными детенышами питались составом, составленным из порошка (Esbiliac, Borden Inc) через питательную трубку. Объем питания начинался первоначально с 0,1 мл/прием и повышался до 0,4 мл/прием каждые 4 дня проведения исследования. Всем животным было проведено контрольное заражение посредством асфикционного введения дважды в день через дыхательные пути 100% азота в течение 50 секунд в закрытой пластмассовой емкости, последующим за охлаждением (4oС) в течение 10 минут. Функции кишечника и зародышевого пузыря стимулировались посредством слабых воздействий после каждого процесса. Животные содержались в течение 96 часов или до момента истощения. Нездоровые животные, имевшие вздутые животы, кровяной помет, затрудненное дыхание, цианоз или были вялыми, были умерщвлены обезглавливанием. После умерщвления кишечник каждой крысы был подвергнут полному исследованию для определения признаков некроза и затем зафиксирован в формалине для дальнейших гистологических анализов. Образцы были помещены в парафин и иссечены с целью получения гистологических срезов, окрашены с применением гематоксилина и эозина и исследованы при случайном перемешивании двумя исследователями, Повреждение кишечника было отмечено 1+ для эпителия клеток при вздутии или отделении, 2+ для отделения эпителия клеток до середины ворсинок, 3+ для некрозов всех ворсинок и 4+ для полного некроза, проходящего по всей толщине стенок.
Для изучения эффективности rРН. 2 три различные группы крыс были подвергнуты воздействию смеси энтеральным путем, или интраперитонеально, или обоими этими способами. Препарат rРН.2 содержал 0,8 мг/мл протеина и приблизительно 4000 единиц/мг активности PAF-AH с соотношением эндотоксин/протеин <0,5 EU/мг. Животным, которым препарат вводился энтеральным путем, было введено 25λ (80 единиц) rРН.2 через желудочную трубку с разведением при каждом питании (каждые три часа). Интраперитонеально дозируемые животные получали 75λ посредством интраперитонеального введения дважды в день. Контрольные животные получали объем буфера (20 мМ NaPО4, pH 7,4) без rРН. 2 и наблюдались одновременно с каждой подопытной группой. Смертность и симптомы NEC оценивались для каждой исследуемой группы и различия анализировались статистически с использованием Fischer's Exact теста, р-величина <0,05 оказалась весьма существенной. Результаты показаны в таблице 9.
Эти данные представляют совокупные результаты четырех различных экспериментов для i.p. дозирования, четырех экспериментов для энтерального дозирования и трех экспериментов для i.p.+ энтерального дозирования.
Энтеральное введение rРН.2 существенно снижает как NEC, так и смертность у контрольных животных. Результаты четырех различных экспериментов по введению внутрь показывают, что предварительное введение rРН.2 уменьшает NEC с 19/16 (контрольная группа) до 6/26 (р<0,001). Нарушения в кишечнике были различными среди экспериментальных и контрольных животных, однако в большинстве случаев они характеризуются средней величиной некрозов ворсинок в некоторых областях, полным некрозом ворсинок в других областях, наступлением сквозных некрозов отдельных участков стенок и оставшихся частей нормальной гистологии желудка. Наихудшие показатели NEC экспериментальных животных и контрольных животных с нарушениями в желудке были аналогичными (среднее значение 2,8 в контрольной группе по сравнению с 2,4 у крыс, которым было введено rPH.2 p>0,05).
Интерперитонеальное дозирование с rPH.2 существенно не влияет на NEC или смертность в этой модели. Первоначальные симптомы были подобны у этой группы и у контрольных животных (40±5 часов в контрольной группе по сравнению с 36±7 часов у rPH-2-зараженных крыс) и степень NEC в обеих группах была аналогична (среднее значение 2,6 в контрольной группе по сравнению с 2,5 у rPH.2 зараженных крыс).
Были выполнены дополнительные эксперименты, при которых крысы получали дозы rPH. 2 энтерально и интраперитонеально в тех же самых дозах, как и в зараженных группах (25λ, rPH.2 при каждой порции, каждые три часа, плюс 75λ путем интраперитонеальных инъекций дважды в день). Результаты представлены в таблице 9. Хотя и не наблюдалось существенных различий между зараженными и контрольными группами при летальном исходе, тем не менее введение rPH.2 существенно уменьшает нарушения от NEC (10/17 в контрольной группе по сравнению с 3/14 у получавших vPH.2 крыс, р=0,04). Следует отметить, что 6 из 7 животных, умерших в группе, получавшей vPH.2, имели положительную культуру в крови для Е.соli, полученную как раз перед смертью.
Эти результаты также показывают защитную роль продуктов PAF-AH в моделях новорожденных в отношении неиндуцированного PAF NEC. Энтеральное введение продуктов rPAF-AH предотвращает NEC, в то время как введение интраперитонеально этих доз не имеет видимого эффекта. Это делает возможным предположение, что использование продуктов PAF-AH для безопасного питания новорожденных с риском NEC может снизить сферу распространения этого заболевания.
Пример 18
Были проведены исследования эффективности продуктов PAF-AH в моделях морских свинок с синдромом острого респираторного заболевания (ARDS).
Фактор активации тромбоцитов (PAF), инъецированный внутривенно у морских свинок, приводит к глубокому легочному воспалению, напоминающему раннее ARDS у человека. В течение минуты после внутривенного введения PAF легочная паренхима становится отечной с сокращением бронхов и бронхиол [LeIlouch-Tubiana et at., supra. Тромбоциты и полиморфно-ядерные нейтрофилы начинают мигрировать и клеточные агрегаты легко идентифицируются вдоль артериол легких [LeIlouch-Tubiana, Br. J.Exp Path., 66; 345-355 (1985)]. Введение PAF также повреждает бронхиальные эпительные клетки, которые диссоциируют из стенок воздушных путей и аккумулируются в воздушном тракте легких. Эти нарушения клеток эпителия воздушных путей связаны с образованием гиалиновых мембран, которые наблюдаются в организме человека на протяжении развития ARDS. Миграция нейтрофилов и тромбоцитов следует сразу же после диапедеза этих клеток в альвеолярных перегородках и альвеолярном пространстве легких. Клеточный инфильтрат, вызванный PAF-AH, сопровождается значительным сосудистым просачиванием вследствие отека воздушных путей [Kirsch, Exp. Lung Res., 18: 447-459 (1992)] . Признак отека также основывается на in vitro изучении PAF-AH, индуцированного с учетом дозы (10-1000 нг/мл) кровоизлияния 125I маркированных фибриногенов в подвергнутых перфузии легких морских свинок, [Basran, Br. J. Pharmacol., 77: 437(1982)].
Основываясь на перечисленных наблюдениях, была создана модель ARDS у морских свинок. Канюля помещается в яремную вену анестезированных самок Hartly морских свинок (приблизительно 350 - 400 грамм) и PAF, разведенный в 500 мкл объема фосфатно-солевого буфера с 0,25% бычьей сыворотки альбумина в качестве носителя (PBS-BSA), вводится в течение 15 минутного периода времени в полной дозе в пределах 100-400 нг/кг. Через различные интервалы времени после введения PAF животные были умерщвлены и у них были извлечены легочные ткани. У морских свинок, которым был введен PAF, ясно видны разрушения легких и воспаления с учетом количества введенного материала уже через 15 минут и эти процессы продолжались в течение 60 минут. Нейтрофилы и красные кровяные тельца присутствуют в альвеолярном пространстве морских свинок, зараженных PAF, но отсутствуют у контрольных животных или у животных с имитацией заражения. Признак разрушения клеток эпителия является также признаком и следствием образования гиалиновых мембран у людей с ARDS. Проведенный анализ протеина в пробах бронхоальвеолярных тканей (BAL), взятых у морских свинок, зараженных PAF, показал существенное аккумулирование протеина в отеках легких, что является явным признаком разрывов сосудов.
Было обнаружено, что rРН. 2 полностью защищает от воздействия PAF при легочных разрушениях в моделях ARDS морских свинок. Группы морских свинок были предварительно подвергнуты воздействию или rРН.2 (2000 единиц в 500 мкл) или 500 мкл чистого PAF-AH буфера. Через 15 минут эти морские свинки были подвергнуты инфузии 400 нг/кг PAF в объеме 500 мкл с интервалом в 15 минут. Кроме того, контрольная группа морских свинок была подвергнута инфузии 500 мкл PBS-BSA. После завершения PAF инфузии животные были умерщвлены и BAL была собрана с применением промывания легких 2Х 10 мл солевого раствора, содержащего 2 мк/мл гепарина для предохранения от гемокоагуляции. Для определения концентрации протеина в BAL пробы были разведены 1:10 в солевом растворе и было определено содержание OD 280. Было найдено, что BAL от контрольных морских свинок имел концентрацию протеина 2,10±1,3 мг/мл. Резко отличалось BAL от животных, которым была сделана инфузия PAF, и у них было обнаружено наличие содержания протеина в концентрации 12,55±1,65 мг/мл. У морских свинок, предварительно обработанных rРН.2, был обнаружен BAL, содержащий концентрацию протеина 1,13±0,25 мг/мл, которая сравнима с этим показателем для контрольных животных и свидетельствует, что продукт PAF-AH полностью блокирует отек легких в ответ на PAF.
Пример 19
Эффективность продукта PAF-AH, rРН.2, оценивалась в двух различных моделях острого панкреатита.
А. Активность в моделях панкреатита у крыс
Самки крыс Wistar (200-250 г) были приобретены у Charles River Laboratories (Wilmington, MA). Они размещались в контролируемых комнатных условиях при 23±2oС с 12-часовым циклом день/ночь и получали стандартное лабораторное питание и воду ad libitum. Животные были отобраны по случайному принципу либо в контрольные, либо в экспериментальные группы. Крысы были анестезированы 50 мг/кг пентобарбиталом натрия в брюшную область и в надрез яремной вены был введен катетер (размер V3, Biolab products, Lake Havasu, AZ). Катетер был введен подкожно в задней шейной спинной области, и животные были выведены из состояния анестезии. Крысам был осуществлен свободный доступ к воде, но не давалась пища в течение ночи. Эксперименты были проведены на следующий день с использованием нормально чувствующих себя животных. В течение промежутка времени катетер использовался для постоянной инфузии солевого раствора (0,2 мл/ч). В день проведения экспериментов животным были введены внутривенно rРН.2 или растворитель вслед за инфузией: или (1) 5 мкг/кг в час каеруэлина (caeruelin) в течение 3,5 часов или (2) 10 мкг/кг в час каеруэлина в течение 5 часов (Research Plus, Bayonne, NJ). Сразу же после окончания инфузии животные были анестезированы пентобарбиталом натрия, их брюшная полость была вскрыта и 5 мл аспирированной крови из нижней полостной вены было взято для последующего исследования. Животные были затем умерщвлены обескровливанием. Амилаза сыворотки, липаза сыворотки и билирубин сыворотки измерялись, и была извлечена поджелудочная железа. Части поджелудочной железы были либо зафиксированы в 4% фосфатном буфере формальдегидного раствора для гистологических исследований или немедленно подверглись глубокой заморозке при -80oС для измерения активности миелопероксидазы. Дополнительно части поджелудочной железы были исследованы с целью определения содержания воды в поджелудочной железе и содержания амилазы и трипсина, как это описывается ниже. Активность миелопероксидазы, измерение разрушения нейтрофилов были выполнены в поджелудочной железе и легких, как это описывается ниже. Исследование проницаемости сосудов легких также будет рассмотрено ниже. Статистический анализ результатов был проведен с применением непарного Student's t-метода. Приводимые данные представляют значения +S.E.M. по крайней мере, трех различных экспериментов. Принято, что различие в результатах значимо, при р<0,05.
1. Содержание воды в поджелудочной железе
Части поджелудочной железы были подвергнуты осушке с использованием блоттинга и взвешены (влажный вес) и затем были обезвожены в течение 34 часов при 120oС и повторно взвешены (сухой вес). Содержание воды в поджелудочной железе было рассчитано как разность между весом влажной и сухой проб и пересчитано в проценты влажного веса поджелудочной железы. Увеличение содержания воды в поджелудочной железе было рассчитано для оценки развития отека.
2. Сыворотка и амилаза поджелудочной железы
Активность амилазы в сыворотке измерялась с использованием 4,6-этилиден (G7)-Р-нитрофенил (G1)-α1D- мальтоплазида (ET-G7PNP) (Sigma Chemical Co., St. Louis, МО) в качестве субстрата в соответствии с работой Pierre et al., Clin. Chem., 22: 1219 (1976). Активность амилазы в тканях поджелудочной железы, гомогенизированной в 10 мМ фосфатного буфера, рН 7,4, измерялась тем же самым методом.
3. Трипсин поджелудочной железы
Активность трипсина измерялась флуорометрическим методом с использованием Boc-Gin-Ala-Arg-MCA в качестве субстрата. Короче говоря, 200 мкл пробы и 2,7 мл 50 мМ Tris-буфера (рН 8,0) содержащего 150 мМ NaCl, 1 мМ CaCl2 и 0,1% альбумина бычьей сыворотки, были смешены в кювете. Сто мкл субстрата было добавлено к пробе после 20 секунд предварительной инкубации для начала реакции. Затем был определен уровень флюоресценции (возбуждение 3880 нм, эмиссия 440 нм) и выполнены измерения. С целью обобщения результатов различных экспериментов по определению активности трипсина во фракциях полученные данные были пересчитаны в процентное соотношение активности трипсина.
4. Гистология и морфометоия
Для оптической микроскопии выбранный наугад поперечный срез передней, средней и задней части поджелудочной железы были зафиксированы в 10% нейтральном фосфатном буфере формалина. Сохраненный в парафине срез толщиной 5 мкм был окрашен гемтоксилин-эозином (Н&Е) и исследован случайной выборкой специалистами по морфологии. Поврежденные/некрозные acinar клетки были определены (а) или как присутствие следов ацинарных клеток или (b) как вакуолизация и набухание ацинарных клеток и деструкция гистопространственного расположения всего или части ацинуса, причем оба этих фактора должны быть связаны с воспалительными реакциями. Количество ацинарных поврежденных/некрозных клеток и полная площадь, занятая ацинарной тканью, были раздельно количественно оценены морфологически с использованием компьютерного планиметрирования картины анализируемого изображения (модель CCD-72, Dage-MTI, Michigan city, IN), снабженного NIH-1200 программным обеспечением для анализа изображения. Десять случайных выборок микроскопических изображений (125х) были исследованы для каждой пробы тканей. Размер ацинарных клеток, подвергшихся разрушению/некрозу, был определен как процент полного количества ацинарных тканей, которые занимали площадь, на которой оценивалось возникновение разрушения/некроза.
5. Измерение активности поджелудочной железы и легочной милеопероксидазы (МРО)
Секвестрация нейтрофилов в поджелудочной железе и легких была оценена путем измерения активности тканей милеопероксидазы. Пробы тканей были взяты во время умерщвления и хранились при -70oС до момента исследования. Пробы (50 мг) были оттаяны и гомогенизированы в 1 мл 20 мМ фосфатном буфере (рН 7,4) и центрифугированы (10000 g, 10 мин 4oС). Полученные гранулы были повторно переведены в форму суспензии в 50 мМ фосфатного буфера (рН 6,0), содержащего 0,5% бромида гексадецилтриметиламмония (Sigma, St. Louis, МО) и подвергнуты трехкратному замораживанию и оттаиванию. Эта суспензия затем была подвергнута деструкции ультразвуком в течение 40 с и центрифугирована (10000 g, 5 мин при 4oС). Реакционная смесь, содержащая экстрагированные ферменты, 1,6 мМ тетраметилбензидина (Sigma Chemical Co., St. Louis, МО), 80 мМ буфера фосфата натрия (рН 5,4) и 0,3 мМ перекиси водорода, была инкубирована при 37oС в течение 110 с и абсорбция была измерена при 655 нм в CobasBio автоматическом анализаторе. Степень абсорбции была затем пересчитана для сухого фракционного веса проб тканей.
6. Измерение проницаемости легочных сосудов
Разрушение общих билиопанкреатических каналов является также типичным результатом в случае некоторых связанных с панкреатитом легочных заболеваний, оцениваемых посредством исследований проницаемости сосудов легких и гистологических исследований.
За два часа до умерщвления животных была сделана внутривенная инъекция шариков из расчета 5 мг/кг флуоресцентного изотиоцианата альбумина (FIТС-альбумин, Sigma Chemical Co., St. Louis, МО). Проницаемость легочных сосудов оценивалась количеством утечек FIТС-альбумина из сосудистых компонентов в бронхоальвеолярную область. Точнее, сразу же после умерщвления правый бронх был блокирован с применением зажима и была исследована трахея. Соответственно правое легкое было промыто с использованием канюли, вводимой в трахею. Была выполнена трехкратная промывка солевым раствором (60 мл промывочной жидкости) и FITC флюоресценция в сыворотке и промывочной жидкости была измерена при возбуждении 494 нм и эмиссии 520 нм. Соотношение флуоресценции промывочной жидкости и крови было рассчитано и принято за единицу протечек через сосуды легкого. Легкое также было окрашено Н&Е и подвергнуто гистологическому исследованию.
7. Эффект введения Caerulein и rРН.2
Инфузия только caerulein в количестве 5 мкг/кг/ч в течение 305 часов приводит к типичному слабому скрытому панкреатиту у крыс, который характеризовался гиперамилаземией, отеком поджелудочной железы, определяемым содержанием воды в поджелудочной железе, и гистологическими изменениями, включая отмеченные ацинарные вакуолизированные клетки и отек поджелудочной железы. Вливание солевого раствора контрольным животным не приводит к какому-либо результату в этих биохимических и гистологических изменениях. Внутривенное введение rРН.2 в виде доз 5, 10 или 20 мг/кг за 30 минут до начала введения caerulein не изменяет существенно величину изменения отека поджелудочной железы (содержания воды) и гистологию, индуцированную вливанием только caerulein. Введение rРН. 2 также не влияет на активность, индуцированную caerulein, трипсиногена поджелудочной железы или содержание амилазы. Вливание высоких доз caerulein крысам в количестве 10 мкг/кг/ч в течение 5 часов приводило к более сильному панкреатиту, характеризующемуся по отношению к контрольным животным посредством более четкого увеличения активности сыворотки амилазы и отеку поджелудочной железы, индицируемому увеличению МРО активности поджелудочной железы и значительному увеличению активации трипсиногенов и активности амилазы в поджелудочной железе. Гистология поджелудочной железы показывает не только отек самой поджелудочной железы и вакуолизацию ацинарных клеток, но и некоторые локальные некрозы и множество инфильтрирующих клеток.
Введение rРН. 2 (5 или 10 мг/кг внутривенно) за 30 минут до начала вливания caerulein (10 мкг/кг/ч) улучшает величину многих панкреатических изменений, индуцируемых вливанием только одного caerulein. Результаты показаны в таблице 10. Применение rРН.2 в количестве 5 мг/кг приводит к уменьшению активности сывороточной амилазы (с 10984±1412 до 6763±1256). Увеличение дозы rРН. 2 свыше 10 мг/кг не приводит к дальнейшему улучшению гиперамилаземии. Применение rРН. 2 в количестве 5 или 10 мг/кг также приводит к некоторому снижению индуцируемому caerulein развитию отека поджелудочной железы, как это определено по содержанию воды (90,61±0,27 для случая введения только caerulein по сравнению с 88,21±0,61 при введении caerulein + 5 мг/кг rРН.2). Доза 5 мг/кг rРН.2 значительно улучшает активность МРО поджелудочной железы (этот показатель увеличивается в 2,92+0,32 раза по сравнению с контрольной величиной для случая введения только caerulein и 1,19+0,21 для caerulein с rРН. 2, р<0,05). Увеличение дозы rРН.2 не приводит к дальнейшему улучшению МРО активности. Доза rРН.2 незначительно изменяет размер активности трипсиногена или амилазы, содержащейся в поджелудочной железе. Гистология поджелудочной железы показывает некоторое улучшение в микроскопических некрозах и инфильтрате после предварительного применения rРН.2.
Связанные с панкреатитом нарушения деятельности легких наблюдаются, как в клинических условиях при некоторых видах панкреатитов. Вливание caerulein в количестве 5 мкг/кг/ч в течение 3,5 часов, которое проводится при средних формах панкреатита, не дает результатов при сильных поражениях легких. Однако вливание caerulein в количестве 10 мг/кг/ч в течение 5 часов, которое проводится при более сильных формах панкреатита, также приводит к нарушениям в легких, оцениваемых увеличением проницаемости легочных сосудов (0,31±0,04 - 0,79±0,09), легочной МРО активности (показывающей разрушение нейтрофилов) и инфильтрации нейтрофилов при гистологических исследованиях.
Введение rРН/2 в количестве 5 мг/кг за 30 минут до вливания caerulein существенно улучшает повышение легочной МРО активности, индуцируемой посредством вливания только одного caerulein (3,35±0,93 для одного caerulein по сравнению с 1,51±0,26 для caerulein с rРН.2). rРН.2 обработка существенно снижает возникновения четких микроскопических изменений, наблюдаемых в легочных тканях после вливания caerulein. Индуцированное caerulein увеличение проницаемости легочных сосудов было снижена посредством обработки rРН.2, хотя это и не подтверждено статистикой. Повышение дозы свыше 10 мг/кг rРН.2 не давало большего эффекта, чем пониженные дозы в снижении степени нарушений в легких при вливании caerulein.
В. Активность в модели панкреатита у опоссума
Здоровые случайно отловленные американские опоссумы (Didelphis virginiana} обоих полов (2,0 до 4,0 кг) были получены от Scott-Haas и помещены в комнату с контролируемыми условиями при 23±2oС с 12-часовым циклом день/ночь и получали стандартное лабораторное питание с водой ad libitum. После окончания ночи животные были анестезированы 50 мг/кг пентабарбиталом натрия i.p. (Veterinary Laboratories Inc., Lenexa, KS). Целиотомия была выполнена через продольный надрез при стерильных условиях и весь желчный панкреатический канал был перевязан у всех животных с целью индуцировать резкий некроз поджелудочной железы. Дополнительно каналы мочевого пузыря были перевязаны для предотвращения поступлений из желчного пузыря, как места скопления желчи. Был осуществлен случайный отбор животных, составляющих контрольную и экспериментальную группы. Начиная со второго дня после перевязки каналов поджелудочной железы, экспериментальная группа получала по 5 мг/кг веса животного в день rРН. 2 (в 4 мг/мл раствора) внутривенно через хвостовую вену, в то время как контрольная группа получала внутривенно только инъекцию такого же объема безвредного состава связующего вещества. После 1 и 2 дней обработки (на 3 и 4 дни после перевязки каналов поджелудочной железы) животные были умерщвлены путем введения высокой дозы пентобарбитала натрия. Пробы крови были взяты из сердца для определения сыворотки амилазы, сыворотки липазы и сыворотки билирубина и изъята поджелудочная железа. Части поджелудочной железы были зафиксированы в 4% буфере фосфатформальдегидного раствора для гистологических исследований или сразу же заморожены при -80oС для измерения активности миелоперокисдазы. Другие части поджелудочной железы были использованы для определения содержания воды и панкреатитной амилазы, как это было описано выше в разделе А этого примера. Было проведено исследование активности миелопероксидазы и разрушения нейтрофилов в поджелудочной железе, как это описано выше. Было также проведено исследование проницаемости легочных сосудов, как это описано выше.
Результаты измерения величины этих параметров ± стандартное отклонение их значений (SEM) получены при большом количестве измерений в 3 или более отдельных экспериментах. Значение изменений было оценено с использованием Student's t-тестов, когда данные содержат только две группы, или вариантным анализом (ANOVA), когда сравнивались три или более групп. Если ANOVA показывал существенные различия, то результаты анализировались методом Tukey's как результирующие тесты для определения различия между группами. Расчетная р-величина <0,05 была определена для оценки существенности различия.
Результаты показаны в таблице 11. Затруднения в определении общих результатов билиопанкреатических каналов при оценке характеристик некроза поджелудочной железы характеризуются посредством гиперамилаземных, гиперлипаземных и экстенсивных некрозов поджелудочной железы. Далее нарушения в билиопанкреатитных каналах были связаны с индицированием увеличения уровня сыворотки билирубина. Внутривенное введение rРН.2 (5 мг/кг/день), начиная со второго дня после сшивания перевязки каналов поджелудочной железы, улучшает величину многих панкреатических изменений, вызванных перекрытием каналов и введением только плацебо. Однодневная обработка rРН.2 снижает уровень содержания сыворотки амилазы по сравнению с обработанными плацебо животными, хотя эти различия не подтверждены статистикой, и двухдневное введение rРН.2 (на 4 день после перевязки каналов поджелудочной железы) существенно уменьшает уровень содержания сыворотки амилазы по сравнению с плацебо. Однодневное или двухдневное введение rРН.2 уменьшает уровень сыворотки липазы относительно контроля, хотя эти различия не подтверждены статистически. Двухдневное введение rРН. 2 уменьшает содержание амилазы в поджелудочной железе относительно контроля, хотя однодневное введение приводит к увеличению амилазы в поджелудочной железе. Введение rРН.2 не оказало влияние на уровень содержания сыворотки билирубина, активности миелопероксидазы поджелудочной железы или содержания воды в поджелудочной железе.
Основная характеристика гистологических изменений, связанных с закупоркой билипанкреатических каналов, включает отмечаемые некрозы, инфильтрацию воспаленных клеток, вакуолирование ацинарных клеток и заметное увеличение ацинарных клеток. Морфометрическое исследование поджелудочной железы для повреждения ацинарных клеток указывает на главный защитный эффект rРН.2 для поджелудочной железы после однодневного или двухдневного введения rРН.2. После однодневного введения rРН.2 нарушение в ацинарных клетках снижалось до почти 23% общего количества ацинарных клеток ткани по сравнению с 48% повреждений для животных с введенным плацебо. Это уменьшение повреждения ацинарных клеток было даже более очевидным после двух дней введения, при котором введение rРН.2 приводило к поражению 35% полного количества ацинарных клеток ткани по сравнению с примерно 60% поражения для животных с введенным плацебо.
Проницаемость легочных сосудов, оцениваемая с применением FITC инъекций, показывает существенное различие после однодневного и двухдневного введения rРН. 2 по сравнению с контрольной группой, которой вводилось плацебо. Гистологическое исследование легких показывает существенное нарушение в легких у всех животных с введенным плацебо. Нарушение в легких характеризовалось экстенсивным воспалением, связанным с внутритканевыми и внутриальвеольными инфильтрациями, главным образом, макрофагов, лимфоцитов и нейтрофилов и с неоднородным, но значительным внутритканевым отеком и утолщением оболочки альвеол. Введение rРН. 2 приводит к заметному уменьшению инфильтрации воспаленных клеток и уменьшению внутритканевых воспалений в течение всего времени.
Итак, эти результаты показывают, что внутривенное введение rРН.2 в количестве 5 мг/кг/день, начиная с 48 часов после закупорки панкреатических каналов, приводит к существенному улучшению, оцениваемому по увеличению уровня амилазы и липазы в крови и нарушению ацинарных клеток, как это выявляется при морфометрическом анализе срезов с Н&Е красителем, и существенно уменьшает последствия легочных нарушений, вызванные панкреатитом. Введение продукта rРН.2 при использовании этой клинической модели поджелудочной железы дает полезный эффект в снижении заболеваний поджелудочной железы.
Пример 20
Были выполнены исследования для определения влияния PAF-AH продуктов, rРН. 2 на нейротоксичность, связанную с HIV инфекцией. Вирус иммунодефицита человека типа 1 (HIV-1) инфицирует центральную нервную систему и приводит к нарушениям в нервной системе вследствие апоптоза, HIV-1-инфицированные моноциты активируются различными антигенными стимулами, включая контакт с нервными клетками, секретом нейротоксичного провоспалительного цитокинеза высокого уровня, включая PAF. Был изучен эффект воздействия rРН.2 на нейротоксичность кондиционированной среды из HIV-инфицированных и активированных моноцитов.
Моноциты были инфицированы HIV и активированы следующим образом. Моноциты были регенерированы из клеток периферийного костного мозга (РВМС) HIV- и гепатитного В-серонегативных доноров после лейкофереза и очищены (>98%) посредством противоточного элюирования при центрифугировании, как это описано у Genis et at., J. Exp. Med.,176: 1703-1718 (1992). Клетки были культивированы будучи соединенными в виде монослоя структуру (1•104 клеток/мл в Т-75 колбе с культурой), в DMEM (Sigma, St. Louis, МО) с рекомбинантным фактором стимуляции колонии человеческого макрофага (MSCF) (Genetics Institute, Inc. Cambridge, MA). При указанных условиях моноциты разделяются на макрофаги. После 7-10 дней культивации макрофаги были помещены на HIV-1ADA (показатель прироста М60472) с множественным заражением (MOI) 0,01 virions/клеток-мишеней. При этих условиях 20-50% моноцитов были инфицированы на 7 день после HIV-1 посева, как это было определено с применением иммунофлуоресцентции и in situ методики гибридизации [Kalter et al., J, Immunol., 146:298-306 (1991)] . Всем культурам давалась повторное питание свежей средой каждые 2 или 3 дня. Через пять - семь дней после HIV инфицирования и в течение пика активности реверсивной транскриптазы (107 срm/мл), определенной в соответствии с Kalter et al., supra, культуры, инфицированные HIV-1 и параллельные неинфицированные культуры моноцитов были стимулированы введением LPS (10 нг/мл) или растворителя в течение 30 мин при 37oС и затем подверглись быстрому замораживанию при -80oС до момента использования при исследованиях нейротоксичности.
Культура нервных клеток кортикальных нейронов мозга была приготовлена следующим образом. Ткани эмбрионов человеческого мозга были получены из теленцефалона второго триместра (13-16 недель беременности) мозга человеческого эмбриона в соответствии с видоизмененной процедурой, разработанной Banker и Cowan, Brain Res., 126:397-425 (1977). А именно, ткани мозга были собраны, промыты в 30 мл охлажденного Hank's BSS (содержащего Са+2 и Мg+2+25 мМ HEPES, и 5Х гентамицина), отделены от соединительного состава мозговой ткани и крови и разрезаны на образцы размером 2 мм3. Ткани были пропущены через 230 мкм Nitex мешок и осторожно измельчены посредством flame-polished пастеровскую пипетку 10-15 раз. Ткани были центрифугированы при 550 об/мин в течение 5 минут при 4oС и полученный осадок был повторно переведен в форму суспензии в 5-10 мл MEM-hipp (D-глюкоза, 5 г/литр; L-глютамин, 2 мМ; HEPES, 10 мМ; пируват Na, 1 мМ; KCl, 20 мМ) содержащей N1 компоненты (инсулин, 5 мг/л; трансферрин, 5 мг/л; селенит, 5 мкг/л, прогестерон 20 нМ; путресцин, 100 мкМ), а также 10% фетальной телячий сыворотки (FCS), PSN смесь антибиотиков (пенициллин, 50 мг/л; стрептомицин, 50 мг/л; неомицин, 100 мг/л) и фунгизон (2,5 мг/л). Количество клеток и их жизнеспособность были оценены путем разведения в Hank's BSS с 0,4 трипанового синего (1:1 v/v) и определены с применением гемоцитометра. Клетки были мелко раздроблены 5 раз с использованием 10 мл пипетки и помещены с плотностью 105 клеток/12 мм на предметное стеклянное стекло, предварительно покрытое поли-L-лизином (70К-150К MW, Sigma, St. Louis, МО), помещенное в кювету с 24 лунками для культуры. Один миллилитр культуры был помещен с помощью пипетки в каждую лунку. Клетки были культивированы в течение 10-27 дней при 37oС во влажной атмосфере, содержащей 5% СО2, 95% воздуха с заменой среды каждые 3 дня. При этих условиях культура имела >60-70% гомогенности нейронов с 20-30% астроцитов, <1% микроглии и ~10% макрофага и красителя микроглии. После 14-28 дней культивирования культура нервных тканей достигала достаточного уровня N-метил-D-аспарата (NMDA) или non-NMDA рецепторов для окрашивания после эксцитотоксических доз NMDA или альфа-амино-3-гидрокси-5-метил-4 изоксазалонпроприоновой кислоты.
Исследования нейротоксичности проводилось следующим образом. Пробы тестов, которые были: (а) кондиционированная среда из LPS-стимулированного HIV-1 инфицированных моноцитов, (b) контрольная среда, (с) кондиционированная среда с добавками rРН. 2 в количестве 51 мг/мл или (d) кондиционированная среда с добавкой связующего для rРН.2, использованы для развития нейронных клеток культуры с концентрацией 1:10 v/v в течение 24 часов. Нейротоксичность измерялась путем идентификации апоптотических центров in situ на нейронных препаратах, размещенных на предметном стекле и фиксированных в 4% параформальдегиде с применением стандартного набора (Арор Tag; ONCOR, Gaithersburg, MD), который использует деоксинуклеотидилтрансферазу (TdT) для связывания дигоксигенин-dUPT для освобождения 3'-ОН конца вновь расщепленной DNA (TUNEL окрашивание). Полученная картина TUNEL-окрашенных нейронов в ≥15 случайно выбранных микроскопических полях была проанализирована для числа TUNEL-окрашенных центров/число полных нейронов на 50Х поле с применением компьютерной морфометрии (MCID, Imaging Research, St. Catherine, Ontario, Canada). Результаты были пересчитаны в% нейронных центров положительных для TUNEL окраски ±SEM и показаны на фиг.13. Тесты статистических значений различий между контрольными и экспериментальными показателями были обработаны посредством ANOVA или сдвоенных t-тестов со значением р≤0,05. Подсчет этих культур подтверждает, что кондиционированная среда из HIV-инфицированных и активированных моноцитов приводит к отмиранию нейронных клеток в почти 25% полной популяции корковых мозговых нейронов и rРН.2 могут снизить эту токсичность, по крайней мере, до уровня менее 5% полного числа нейронов. Сами по себе rРН. 2 не были нейротоксичны, так как 50 мг/мл rРН.2 не оказывало влияния на отмирание нейронных клеток при сравнении зараженной культуры и контрольной среды. Эти результаты очевидно доказывают, что главный компонент нейротоксичности возникает при введении кондиционированной среды из активированных HIV-1 инфицированных моноцитов, может быть вследствие PAF, так как нейротоксичность может быть почти полностью ликвидирована при применении совместной инкубации с продуктом PAF-AH-ферментом, ответственным за метаболизм PAF-AH в центральной нервной системе. Это позволяет надеяться на дальнейшее использование в терапии неврологических заболеваний, ЦНС, связанных с HIV-инфекцией.
Пример 21
Почти четыре процента населения Японии имеют низкий или необнаруживаемый уровень активности PAF-AH в крови. Этот дефицит находится в соответствии с некоторыми симптомами астмы у детей. [Miwa et al., J. Clin. Invest., 82: 1983-1991 (1988)] , которые, по-видимому, имеют наследственный дефицит аутосомным рецессивным образом.
Для определения, усиливается ли этот дефицит при инактивации в присутствии ферментов или от неспособности синтезировать PAF-AH, плазма многих пациентов с дефицитом активности PAF-AH была исследована для определения активности PAF-AH (посредством методики, изложенной в примере 10 для трансфектантов) и для случая присутствия PAF-AH, используя моноклональные антитела 90G11D и 90F2D (пример 13) в двухслойных структурах ELISA, как это указано ниже. Immulon 4 плоские пластины (Dynatech, Chantilly, VA) были покрыты 100 нг/лунку моноклональными антителами 90G11D и сохранялись в течение ночи. Пластины были блокированы в течение 1 часа при комнатной температуре 0,5% желатином рыбьей чешуи (Sigma), разведенным в CMF-PBS, и затем трижды промыты. Плазма пациентов была разведена в PBS, содержащем 15 мМ CHAPS, и добавлена в каждую лунку пластины (50 мкл/лунку). Пластина была инкубирована в течение 1 часа при комнатной температуре и промыта четыре раза. Пятьдесят мкл 5 мкг/мл моноклональных антител 90F2D, которые были обработаны биотинином по стандартной методике и разведены в PBST, были добавлены в каждую лунку, и пластина была инкубирована в течение 1 часа при комнатной температуре и затем трижды промыта. Пятьдесят мкл ExtraAvidin (Sigma), разведенного 1/1000 в CMF-PBST, было затем добавлено в каждую лунку и пластина была инкубирована в течение 1 часа при комнатной температуре перед исследованием.
Была обнаружена прямая корреляция активности PAF-AH и уровня содержания ферментов. Отсутствие активности в сыворотке пациентов выражалось в отсутствии обнаруживаемых ферментов. Аналогично пробы плазмы с половиной нормальной активности содержали половину нормального уровня PAF-AH. Эти наблюдения показывают, что дефицит активности PAF-AH вызван неспособностью к синтезу ферментов или наблюдается вследствие инактивации ферментов, которые не обнаруживали моноклональные антитела.
Дальнейшие эксперименты показывают, что этот дефицит возникает вследствие генетических нарушений в гене PAF-AH плазме человека. Геном DNA индивидуумов с дефицитом гена PAF-AH является специфическим праймером. Каждая из кодирующих последовательность экзонов была первоначально усилена и секвенирована из одной индивидуальной. Наблюдались одиночные изменения нуклеотидов внутри экзона 9 (от G до Т в положении 996 SEQ ID NO: 7). Изменение нуклеотидов приводило к замене фенилаламина на валин на позиции 279 PAF-AH последовательности (V279F). Экзон 9 был экстракопирован из геномов DNA одиннадцати дополнительных индивидуумов с PAF-AH дефицитом, у которых были обнаружены такие же самые точечные мутации.
Для определения, разрушает ли эта мутация ферменты, Е.coli экспрессионная конструкция, содержащая мутации, была генерирована методом, подобным описанному в примере 10. Введенная в Е.Coli, экспрессионная конструкция не генерирует PAF-AH активности, в то время как контрольная конструкция с недостающей мутацией была полностью активной. Это замещение аминокислоты, вероятно, приводит к структурной модификации, которая позволяет обнаружить дефицит активности и недостаток иммунореактивности с PAF-AH антителами в соответствии с настоящим изобретением.
Специфические антитела PAF-AH согласно изобретению могут быть, таким образом, использованы при диагностике для определения уровня PAF-AH в сыворотке (нормальный уровень оставляет около 1-5 ед/мл) и для дальнейшего развития терапевтического использования с применением PAF-AH. Более того, идентификация генетических нарушений в генах PAF-AH позволяет осуществить генетическую проверку дефицита PAF-AH, проверенную на японских пациентах. Эта мутация позволяет получать рестрикцию сайта эндонуклеазы (Мае II) и, таким образом, дает простой метод анализа полиморфизма рестрикции длины фрагмента (RFLP) для различения активных и мутированных аллелей. См. Lewin, с. 136-141 в Genes V, Oxford University Press, New York (1994).
Скрининг DNA геномов у двенадцати пациентов с дефицитом PAF-AH был проведен путем обработки кипячением DNA с Mae II, блоттинг-методом по Саузерну и гибридизацией проб с экзоном 9 (нуклеотиды 1-396 SEQ ID NO:17). Было обнаружено, что все пациенты имели RELPs, совпадающую с мутантами аллельных генов.
Настоящее изобретение было описано для преимущественных для данного изобретения вариантов, понятно, что при его трактовке могут оказаться использованы изменения и модификации. Естественно, только такие ограничения, как указанные в приводимой формуле изобретения, являются основанием для настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СКРИНИНГА НЕВРОПАТОЛОГИИ | 1996 |
|
RU2155345C2 |
| ICAM-4 И ЕГО ДИАГНОСТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ | 1998 |
|
RU2208230C2 |
| ГИБРИДОМА, ОБОЗНАЧЕННАЯ 199М, И МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СЕКРЕТИРОВАННОЕ ЭТОЙ ГИБРИДОМОЙ | 1997 |
|
RU2183671C2 |
| ПОЛИПЕПТИД, ИМЕЮЩИЙ ФЕРМЕНТАТИВНУЮ АКТИВНОСТЬ ФОСФОДИЭСТЕРАЗЫ | 1998 |
|
RU2272841C2 |
| ГОМОЛОГИ (ATR) ПОЛИПЕПТИДА rad3, ПОЛИНУКЛЕОТИДЫ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ И МАТЕРИАЛЫ | 1996 |
|
RU2252256C2 |
| ТРАНСКРИПЦИОННАЯ РЕГУЛЯТОРНАЯ ДНК ГЕНА ХОМЯКА EF-1α | 1998 |
|
RU2249617C2 |
| Рекомбинантная химерная обратная транскриптаза, обладающая повышенной процессивностью и устойчивостью к ингибиторам амплификации, и способ ее получения | 2020 |
|
RU2762291C1 |
| СПОСОБЫ И ПРЕПАРАТЫ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И ДИФФЕРЕНЦИРОВКИ МЕГАКАРИОЦИТОВ | 1995 |
|
RU2158603C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ОРЕКСИНА А ЧЕЛОВЕКА, ПЛАЗМИДНАЯ ДНК, ШТАММ-ПРОДУЦЕНТ | 2016 |
|
RU2647771C2 |
| ПРИМЕНЕНИЕ S1P | 2004 |
|
RU2362565C2 |













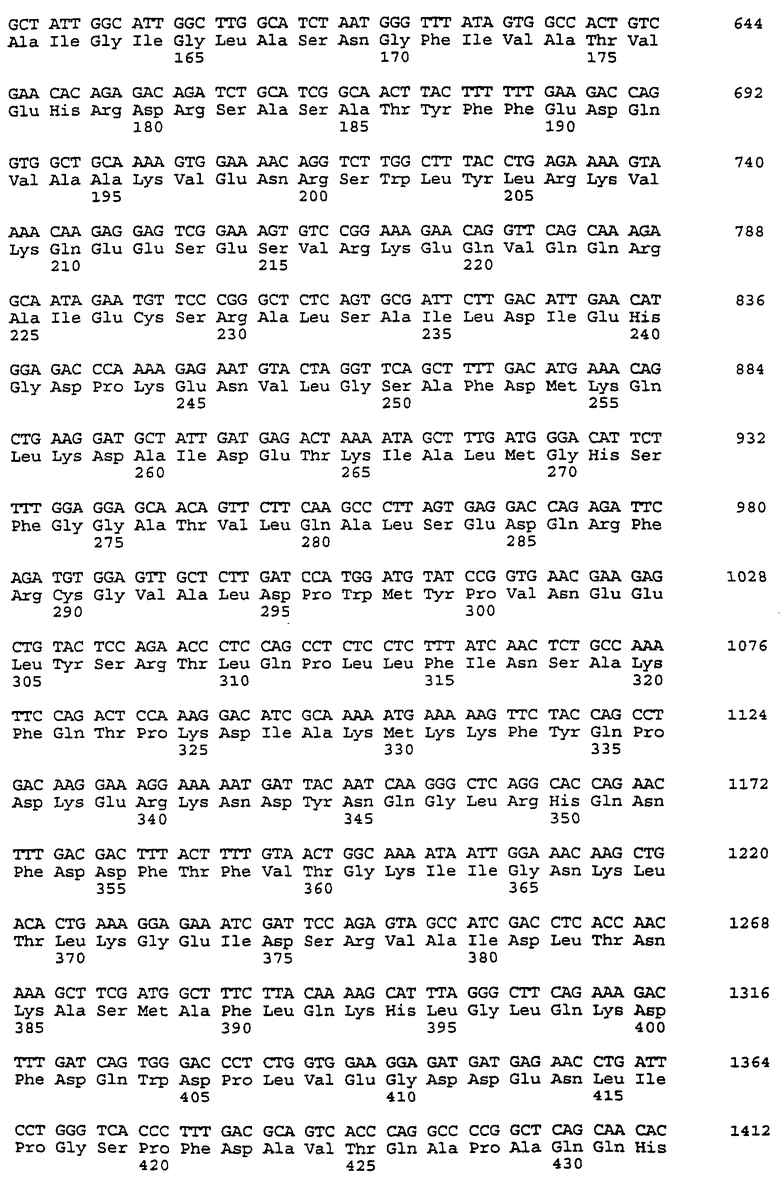









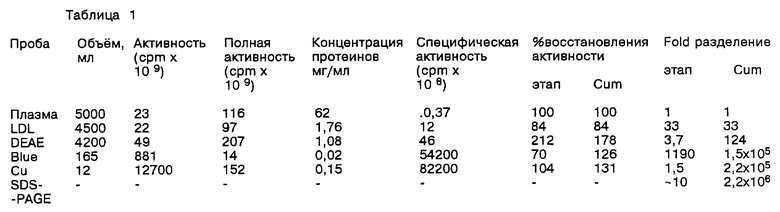

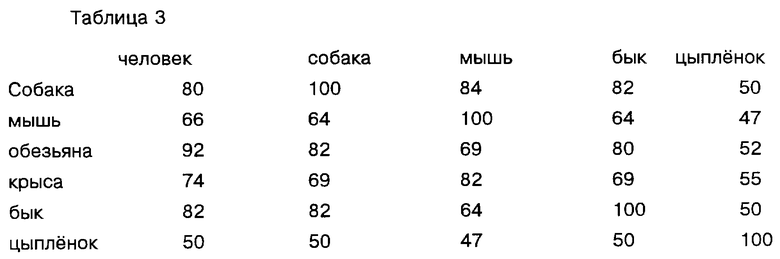


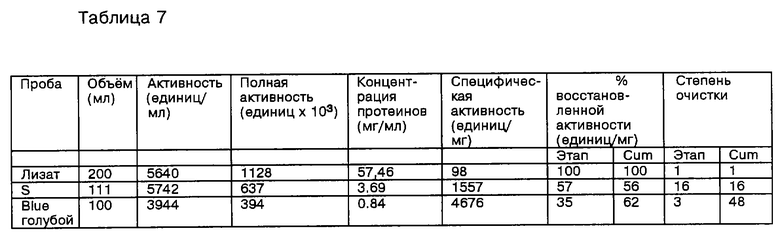
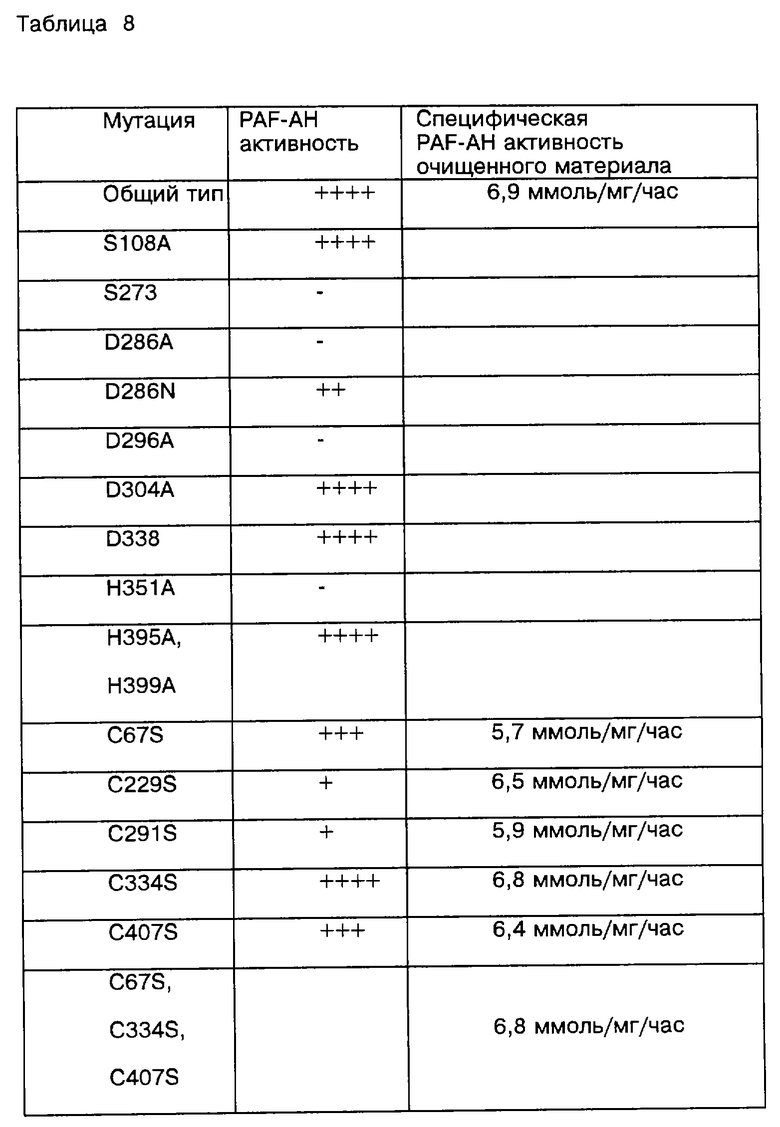
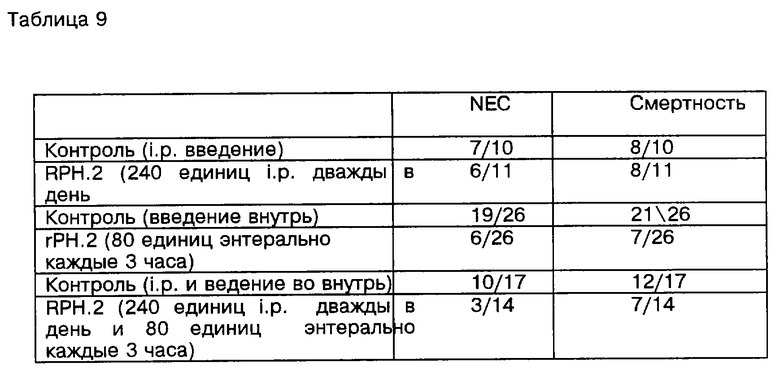
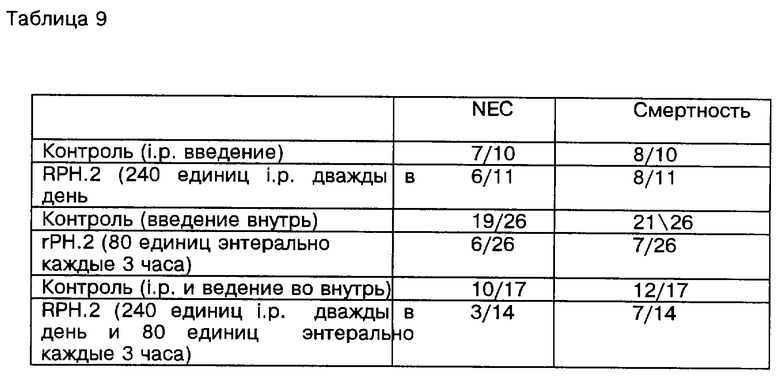
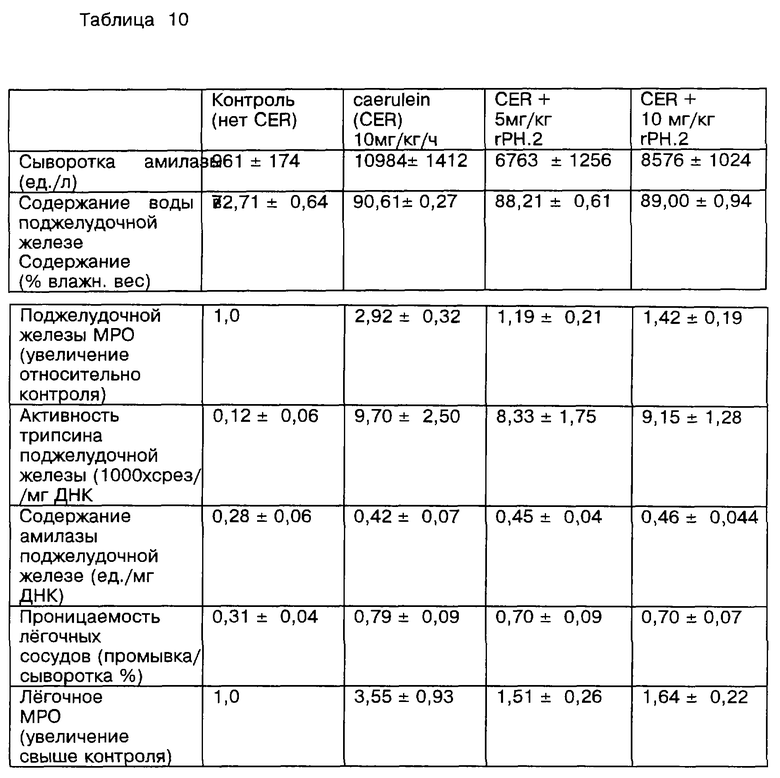
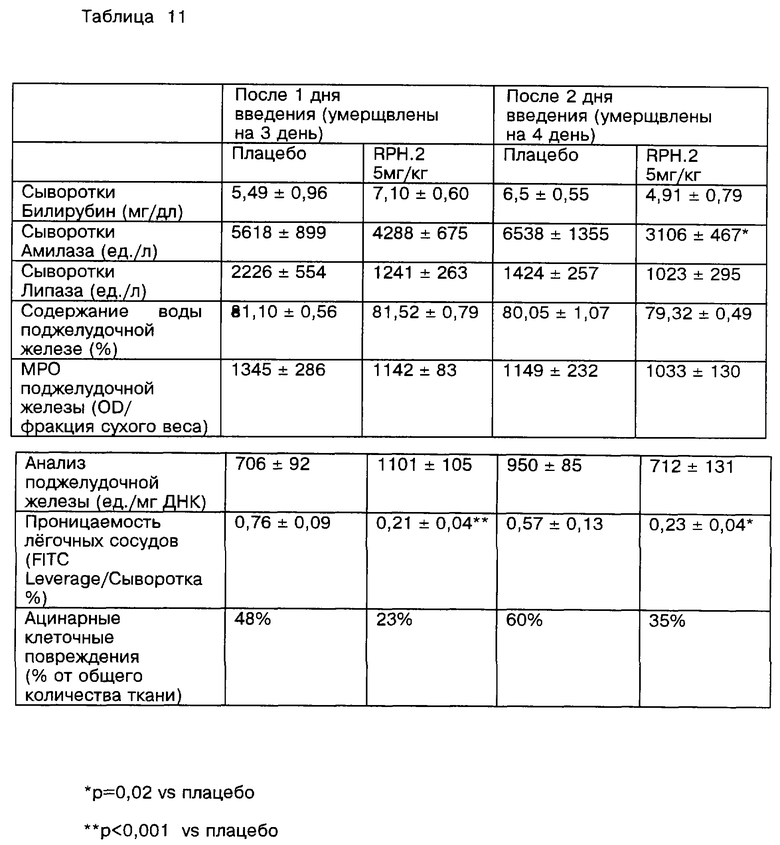
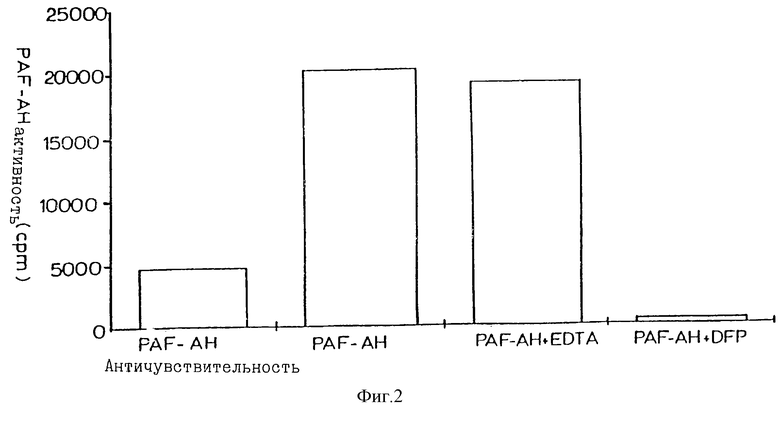
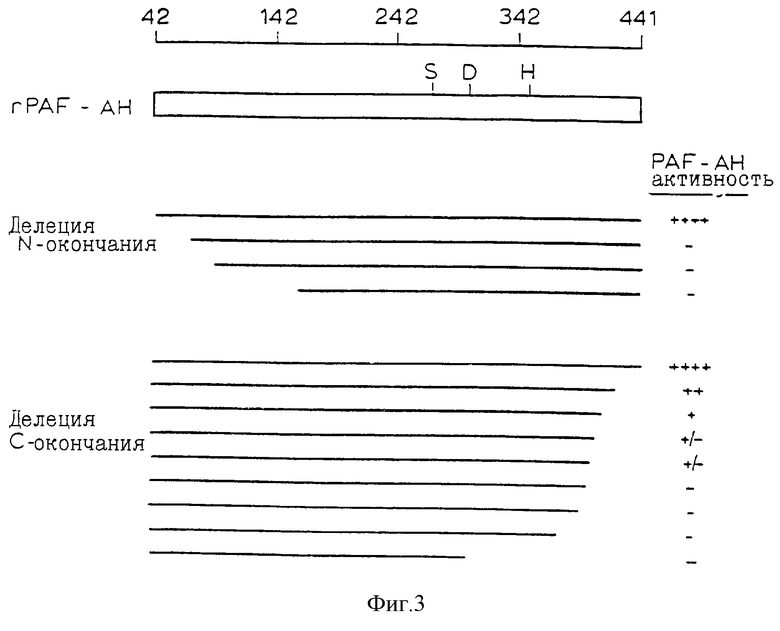
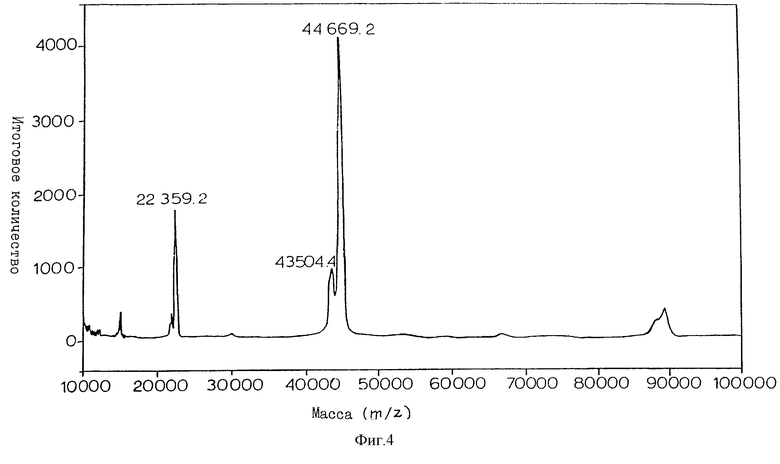
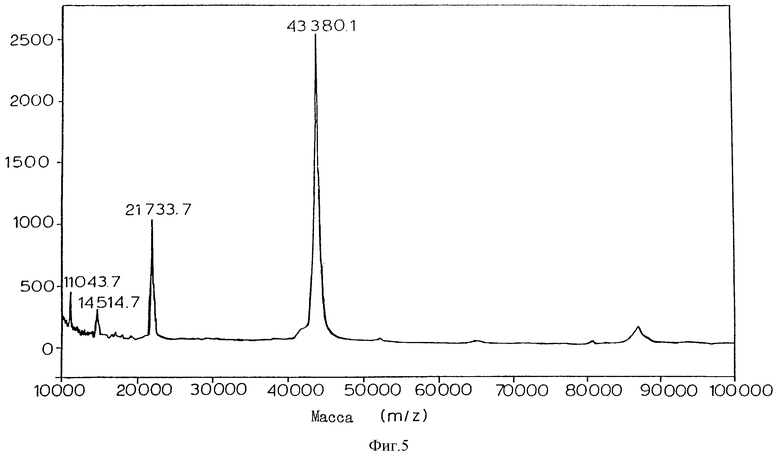
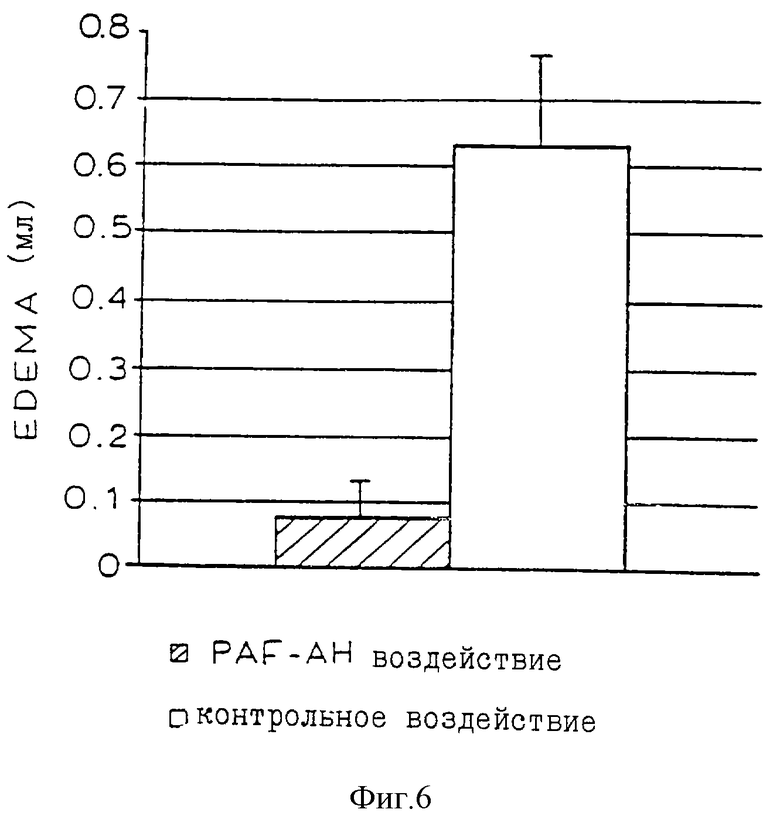
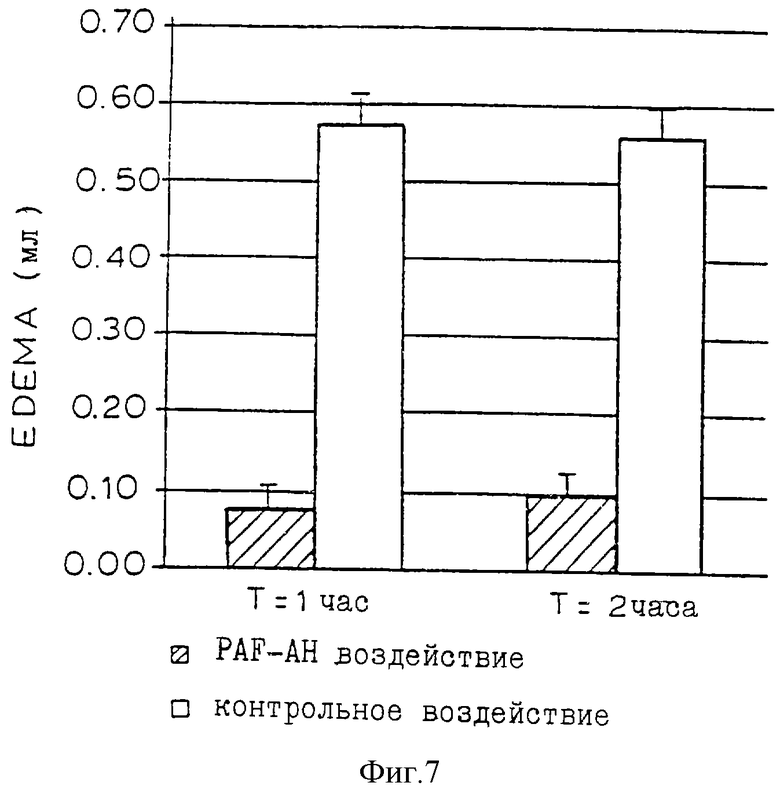
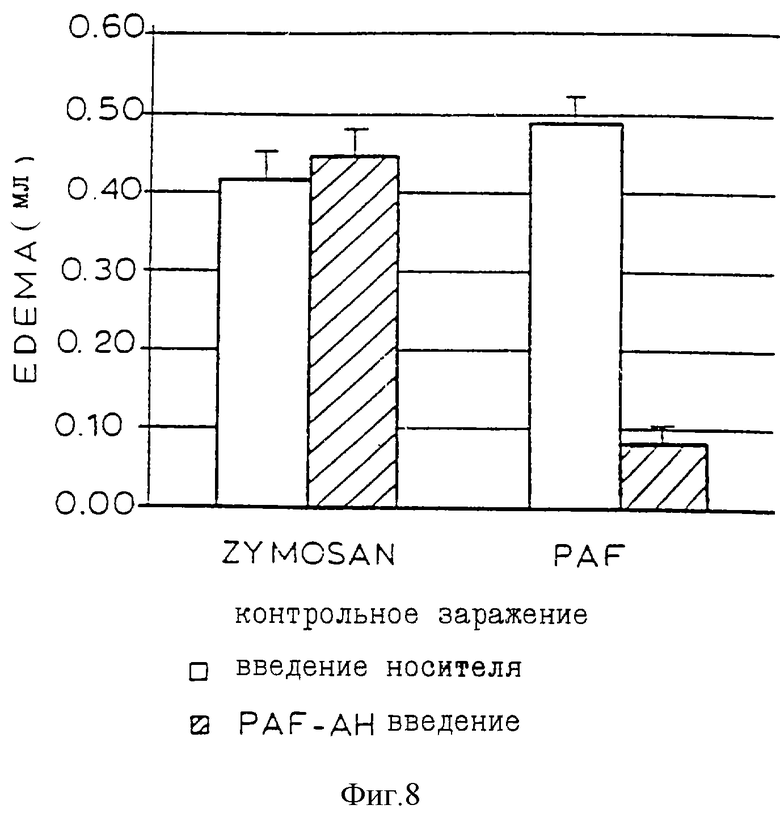
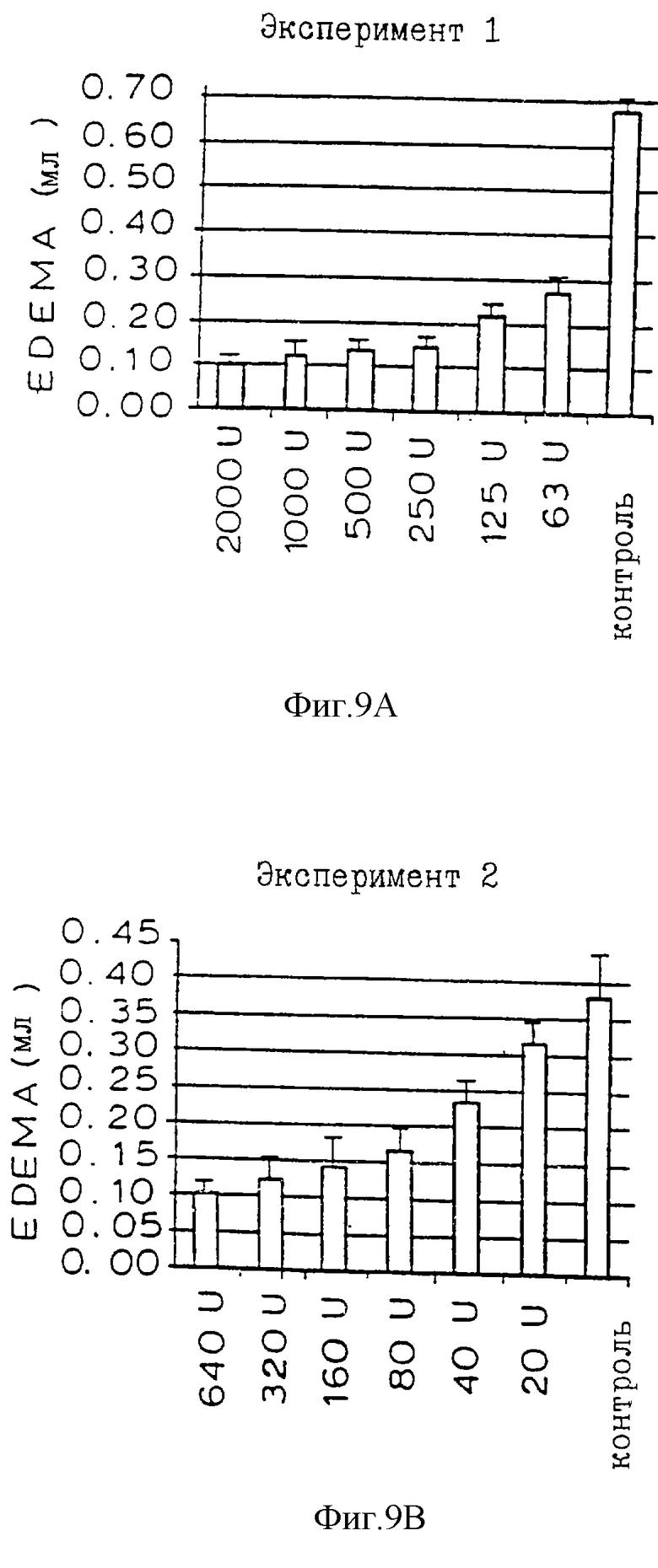
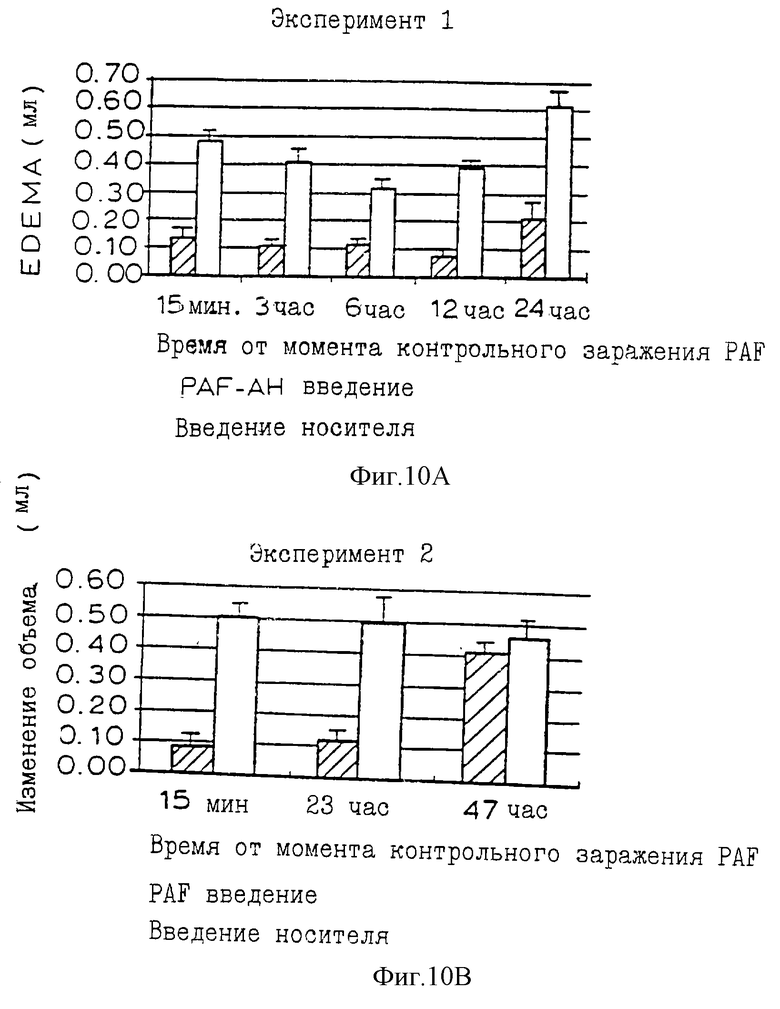
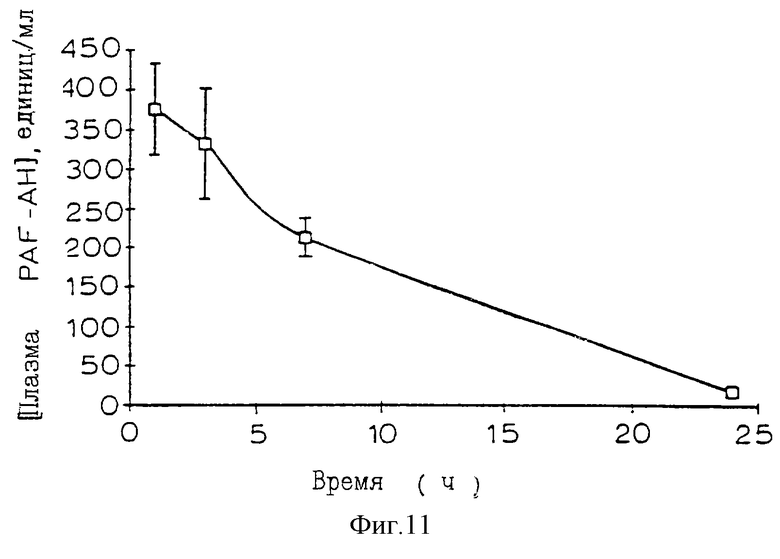
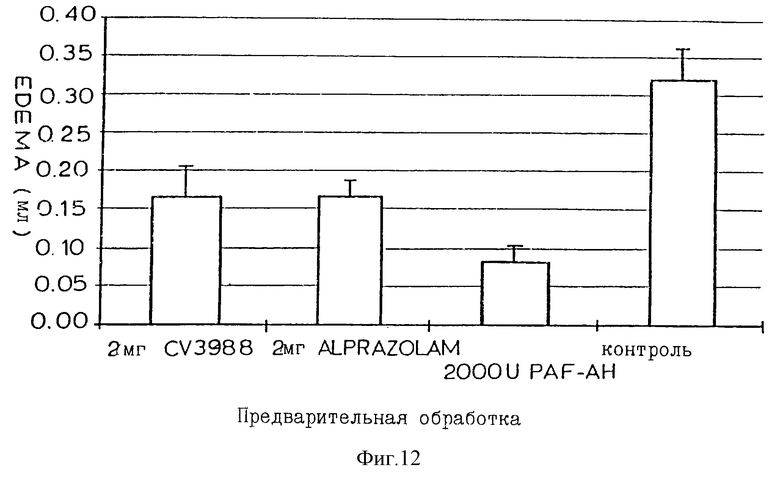
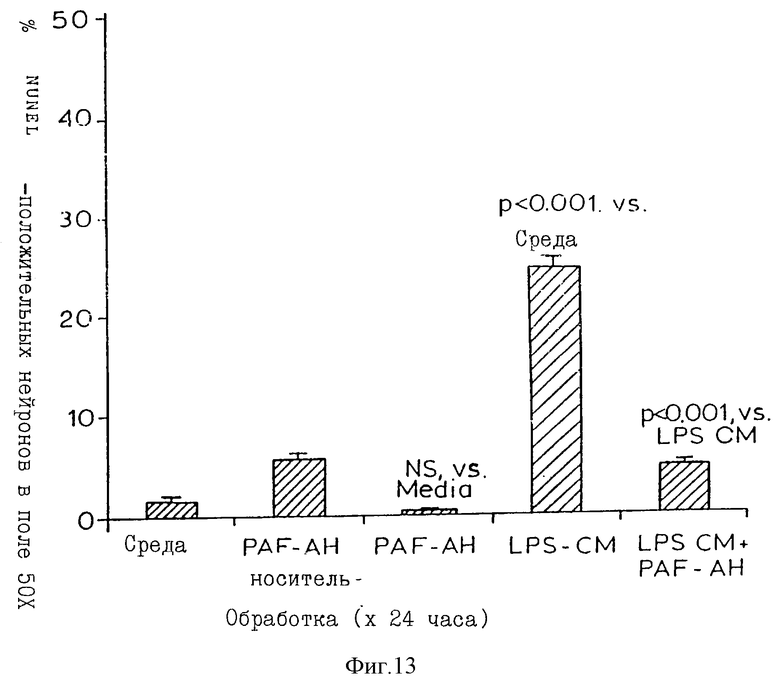
Изобретение относится к медицине, в частности к гематологии. Сущность его состоит в том, что обеспечивает последовательности очищенных и выделенных полинуклеотидов, кодирующие ацетилгидролазу фактора активации тромбоцитов человеческой плазмы. Описаны также материалы и способы рекомбинантного получения продуктов ацетилгидролазы фактора активации тромбоцитов, которые предназначены для регулирования патологических воспалительных явлений. Технический результат - расширение арсенала способов и средств для борьбы с воспалительными заболеваниями. 11 с. и 5 з.п. ф-лы., 11 табл., 13 ил.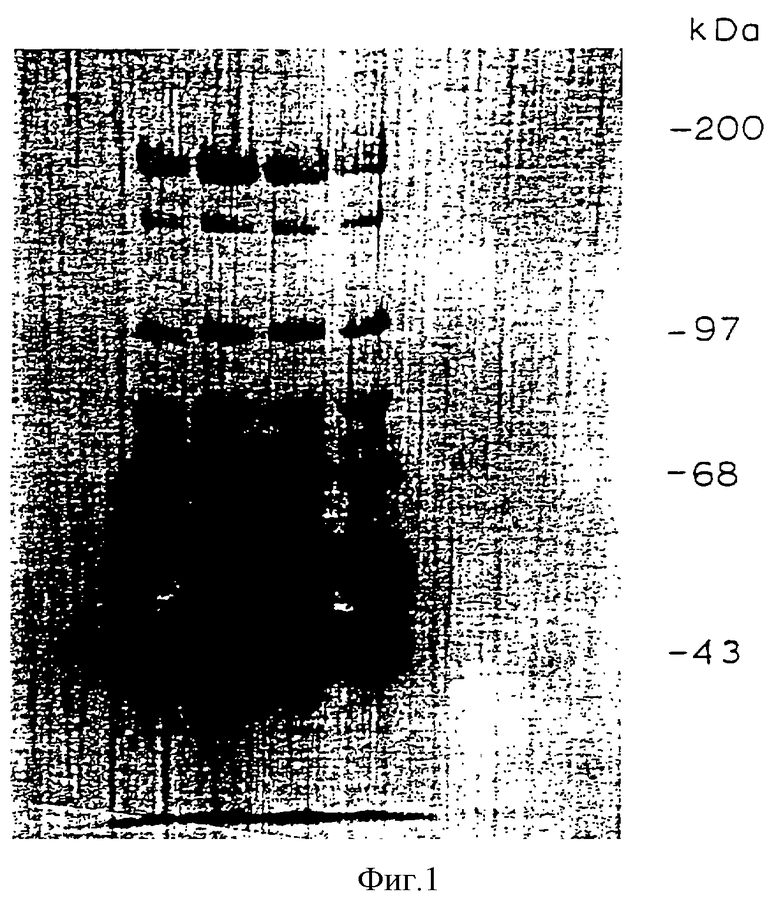
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| M | |||
| Hattory et al | |||
| "Purification and charactezation..." | |||
| J | |||
| Biol | |||
| Chem., v.268, № 25, 1993, р.18748-18753. | |||
Авторы
Даты
2003-07-10—Публикация
1997-08-13—Подача