Изобретение относится к определяющим комплементарность областям (CDR, гипервариабельным участкам) и вариабельным областям (V-участкам) мышиных моноклональных антител к человеческому интерлейкину-8 (ИЛ-8), к человеко/мышиным химерным антителам к человеческому ИЛ-8, а также к реконструированным человеческим антителам, причем области, определяющие комплементарность вариабельной области человеческой легкой цепи (L-цепи) и вариабельной области тяжелой цепи (H-цепи) человека замещены CDR мышиных моноклональных антител к человеческому ИЛ-8. Кроме того, данное изобретение представляет ДНК, которая кодирует вышеупомянутое антитело и его части. Данное изобретение также относится к вектору, который содержит вышеупомянутую ДНК, и более конкретно, экспрессии вектора и клетке-хозяину, трансформированной указанным вектором. Кроме того, данное изобретение представляет процесс получения реконструированного человеческого антитела к ИЛ-8, а также к процессу получения химерных антител к человеческому ИЛ-8.
Интерлейкин-8 (ИЛ-8) был открыт в культуре супернатанта моноцитов, стимулированных липополисахаридом (ЛПС), и является хемокином, известным так же как продуцируемый моноцитами фактор хемотаксиса нейтрофилов (ПМФХН) или активирующий нейтрофилы протеин-1 (АНП-1). ИЛ-8 продуцируется разными клетками, действует на нейтрофильные гранулоциты и лимфоциты и обладает активностью, которая вызывает хемотаксис по градиенту его концентрации. К тому же он не только индуцирует хемотаксис у нейтрофилов, но также активирует функции нейтрофилов, такие как дегрануляция, выделение пероксидов и усиление адгезии на эндотелиальных клетках.
При воспалительных заболеваниях, и более конкретно, при респираторных заболеваниях, таких как легочный муковисцидоз, идиопатический легочный фиброз, респираторный дистресс-синдром взрослых, саркоидоз и эмпиема, а также при кожных заболеваниях, таких как псориаз, и при хроническом ревматоидном артрите, болезни Крона и язвенном колите, наблюдается патологическая инфильтрация лейкоцитов в месте воспаления при этих заболеваниях. Кроме того, ИЛ-8 обнаруживается в исследуемых пробах от пациентов с этими заболеваниями, что наводит на мысль о том, что ИЛ-8 может играть центральную роль в воспалении (McElvaney, N.G. et al., J. Clin. Invest., 90, 1296-1301, 1992; Lynch III, J. P. et al., Am. Rev. Respir. Dis., 145, 1433-1439, 1992; Donnelly, S. C. et al., Lancet, 341, 643-647, 1993; Car, B.D. et al., Am. J. Respir. Crit. Care Mеd., 149, 655-659, 1994; Antony, V.В. et al., J. Immunol. , 151, 7216-7223, 1993; Takematsu, H. et al., Arch. Denmatol., 129, 74-80, 1993; Brennan, F.M. et al., Eur. J. Immunol., 20, 2141- 2144, 1990; Izzo, R. S. et al., Scand. J. Gastroenterol., 28, 296-300, 1993; Izzo, R.S. et al., Am. J. Gastroenterol., 87, 1447-1452, 1992).
Вслед за иммунизацией мышей человеческим ИЛ-8 в качестве антигена Ко Y-C., et al. получили мышиные моноклональные антитела WS-4, которые связываются с человеческим ИЛ-8 и подавляют связывание человеческого ИЛ-8 с нейтрофилами в результате этого связывания, и именно это нейтрализует биологическую активность, которой обладает ИЛ-8. Было четко показано, что изотопы мышиных моноклональных антител WS-4 состоят из к-типа L цепи и Cγ1-типа H цепи (J. Immunol. Methods, 149, 227-235, 1992).
Известные примеры антител к человеческому ИЛ-8, кроме WS-4, включают А. 5.12.14 (Boylan, A.M. et al., J. Clin. Invest., 89, 1257-1267, 1992), антитела анти-Рер-1 и антитела анти-Рер-3, раскрытые в международных патентных заявках N WO 92-04372 и DM/C7 (Mulligan, M.S. et al., J. Immunol., 150, 5585-5595, 1993).
Было также обнаружено с помощью введения мышиных моноклональных антител WS-4 на экспериментальной модели с использованием кроликов, что инфильтрация нейтрофилов подавляется при ишемическом и реперфузионном поражении легких (Sekido N., et al., Nature, 365, 654-657, 1993), индуцируемом ЛПС дерматите (Harada A. , et al., Internatl. Immunol., 5, 681-690, 1993) и индуцируемом ЛПС или интерлейкином-1 (ИЛ-1) артрите (Akahoshi Т., et al., Lymphokine Cytoline Res., 13, 113-116, 1994).
Гомолог человеческого ИЛ-8 существует у кроликов и называется кроличьим ИЛ-8. Так как было четко показано, что мышиные моноклональные антитела WS-4 перекрестно реагируют с кроличьим ИЛ-8, и что антитела подавляют связывание кроличьего ИЛ-8 с кроличьими нейтрофилами (Harada А., et al., Internatl. Immunol., 5, 681-690, 1993), эти данные наводят на мысль о том, что антитела к человеческому ИЛ-8 должны быть полезны в качестве терапевтического средства для лечения воспалительных заболеваний у людей.
Моноклональные антитела, происходящие от других млекопитающих, а не от человека, проявляют высокую степень иммуногенности (также называемую антигенностью) у людей. По этой причине даже если мышиные антитела вводятся людям, в результате того, что они метаболизируются как чужеродное вещество, период полувыведения мышиных антител у людей относительно короток, что таким образом предотвращает соответствующее проявление нежелательных эффектов. Кроме того, человеческие антимышиные антитела, которые продуцируются в ответ на введенные мышиные антитела, вызывают иммунный ответ, который некомфортабелен и опасен для больного, примеры чего включают сывороточную болезнь и другие аллергические реакции. По этой причине мышиные антитела нельзя часто вводить людям.
Чтобы разрешить эти проблемы, был разработан процесс получения очеловеченного антитела. Мышиные антитела могут быть очеловечены двумя способами. Более простой способ включает продукцию химерных антител, у которых вариабельная область (V область) происходит из исходного мышиного моноклонального антитела, а константная область (С область) происходит из подходящего человеческого антитела. Так как получающиеся в результате химерные антитела содержат вариабельную область мышиного антитела в ее полной форме, они обладают специфичностью, идентичной специфичности исходных мышиных антител, и можно ожидать, что они будут связывать антиген.
Кроме того, так как пропорция протеиновых последовательностей, происходящих от другого животного, а не человека, в химерных антителах существенно снижена по сравнению с исходными мышиными антителами, предсказывается, что они обладают меньшей иммуногенностью по сравнению с исходными мышиными антителами. Хотя химерные антитела хорошо связываются с антигеном и обладают низкой иммуногенностью, однако все еще остается возможность появления иммунного ответа на мышиную вариабельную область (LoBuglio A.F., et al., Proc. Natl. Acad. Sci. USA, 86, 4220-4224, 1989).
Хотя второй способ очеловечивания мышиных антител более сложен, латентная иммуногенность мышиных антител снижается значительно. При этом способе только гипервариабельная область (CDR) пересаживается из вариабельной области мышиных антител в человеческую вариабельную область для создания реконструированной человеческой вариабельной области. Однако, чтобы еще больше приблизить строение CDR реконструированной человеческой вариабельной области к строению исходного мышиного антитела, бывают обстоятельства, при которых может быть необходимо пересадить часть протеиновой последовательности структурной области (FR), несущей CDR из вариабельной области мышиного антитела, на человеческую вариабельную область.
Затем эти реконструированные человеческие вариабельные области связываются с человеческой константной областью. Эти части, происходящие из нечеловеческих протеиновых последовательностей, состоят в очеловеченном антителе только из CDR и очень незначительной части CO. CDR состоит из гипервариабельных протеиновых последовательностей, и они не проявляют видовой специфичности. По этой причине реконструированные человеческие антитела, которые содержат мышиные CDR, не должны обладать иммуногенностью, большей, чем иммуногенность природных человеческих антител, содержащих человеческие CDR.
Дополнительные детали, касающиеся реконструированных человеческих антител, можно найти, обратившись к Riechmann L., et al., Nature, 332, 323-327, 1988; Verhoeyen M., et al., 239, 1534-1536, 1988; Kettleborough, С.-A. et al. Protein Eng. , 4, 773-783, 1991; Maeda, H. et al., Hum. Antibodies Hybridomas, 2, 124-134, 1991; Gorman, S.D. et al., Proc. Natl. Acad. Sci. USA, 88, 4181-4185, 1991; Tempest, P.R. et al., Bio/Technology, 9, 266-271, 1991; Co, M. S. et al., Proc. Natl. Acad. Sci. USA, 88, 2869-2873, 1991; Carter, P. et al., Proc. Natl. Acad. Sci. USA, 89, 4285-4289, 1992; Co, M.S. et al., J. Immunol., 148, 1149-1154, 1992; and, Sato, К. et al., Cancer Res. , 53, 851-856, 1993.
Как изложено выше, хотя реконструированные человеческие антитела, как предсказано, будут применимы в целях терапии, неизвестны реконструированные человеческие антитела к человеческому ИЛ-8. Кроме того, не существует стандартных процессов, которые могут универсально применяться в отношении произвольных антител для получения реконструированных человеческих антител. Таким образом, необходимы различные ухищрения для того, чтобы создать реконструированные человеческие антитела, которые проявляют достаточную связывающую активность и/или нейтрализующую активность в отношении конкретного антигена (например, Sato К., et al., Cancer Res., 53, 851-856, 1933). Данное изобретение представляет антитела к человеческому ИЛ-8, обладающие низкой степенью иммуногенности.
Данное изобретение представляет реконструированные человеческие антитела к человеческому ИЛ-8. Данное изобретение также представляет человеческо/мышиные химерные антитела, которые применимы в процессе продукции указанных человеческих антител. Кроме того, данное изобретение также представляет фрагмент реконструированного человеческого антитела. Дополнительно данное изобретение представляет систему экспрессии для продукции химерных антител и реконструированных человеческих антител и их фрагментов. Кроме того, данное изобретение также представляет процесс получения химерных антител к человеческому ИЛ-8 и их фрагментов, а также процесс получения реконструированных человеческих антител к человеческому ИЛ-8 и их фрагментов.
Более конкретно, данное изобретение представляет:
1) V область L цепи мышиного моноклонального антитела к человеческому ИЛ-8 и
2) V область H цепи мышиного моноклонального антитела к человеческому ИЛ-8.
Кроме того, данное изобретение представляет:
1) L цепь, содержащую С область человеческой L цепи и V область L цепи мышиного моноклонального антитела к ИЛ-8 и
2) H цепь, содержащую С область человеческой H цепи и V область H цепи мышиного моноклонального антитела к человеческому ИЛ-8.
Кроме того, данное изобретение также представляет химерные антитела к человеческому ИЛ-8, состоящие из:
1) L цепей, причем каждая включает человеческую С область L цепи и V область L цепи мышиного моноклонального антитела к человеческому ИЛ-8 и
2) H цепей, причем каждая содержит С область человеческой H цепи и V область H цепи мышиного моноклонального антитела к человеческому ИЛ-8.
Кроме того, данное изобретение представляет:
1) V область L цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8 и
2) V область H цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8.
Кроме того, данное изобретение также представляет:
1) L цепь, содержащую С область человеческой L цепи и V область L цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8 и
2) H цепь, содержащую С область человеческой H цепи и V область H цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8.
Дополнительно данное изобретение представляет химерные антитела к человеческому ИЛ-8, состоящие из:
1) L цепей, причем каждая включает С область человеческой L цепи и V область L цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8 и
2) H цепей, причем каждая включает С область человеческой H цепи и V область H цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8.
Кроме того, данное изобретение представляет:
1) CDR V области L цепи моноклональных антител к человеческому ИЛ-8 и
2) CDR V области H цепи моноклональных антител к человеческому ИЛ-8.
Кроме того, данное изобретение также представляет:
1) CDR V области L цепи мышиных моноклональных антител к человеческому ИЛ-8 и
2) CDR V области H цепи мышиных моноклональных антител к человеческому ИЛ-8.
Кроме того, данное изобретение также представляет реконструированную V область человеческой L цепи антитела к человеческому ИЛ-8, состоящую из:
1) структурных областей (FR) V области человеческой L цепи и
2) CDR V области L цепи мышиных моноклональных антител к человеческому ИЛ-8;
а также как реконструированную V область H цепи антител к человеческому ИЛ-8, состоящую из:
1) FR V области H цепи и
2) CDR V области H цепи мышиных моноклональных антител к человеческому ИЛ-8.
Кроме того, данное изобретение представляет реконструированную человеческую L цепь антитела к человеческому ИЛ-8, состоящую из:
1) С области человеческой L цепи и
2) V области L цепи, состоящей из FR человеческой L цепи и CDR L цепи мышиных моноклональных антител к человеческому ИЛ-8;
а также в виде реконструированной H цепи антитела к человеческому ИЛ-8, состоящей из:
1) C области человеческой H цепи и
2) V области H цепи, состоящей из FR человеческой H цепи и CDR H цепи мышиных моноклональных антител к человеческому ИЛ-8.
Кроме того, данное изобретение также представляет реконструированное человеческое антитело к человеческому ИЛ-8, состоящее из:
(A) L цепей, причем каждая включает:
1) человеческую С область L цепи и
2) V область L цепи, содержащую FR человеческой L цепи и CDR L цепи мышиных моноклональных антител к человеческому ИЛ-8;
а также
(Б) H цепей, причем каждая включает:
1) человеческую С область H цепи и
2) V область H цепи, содержащую FR человеческой H цепи и CDR H цепи мышиных моноклональных антител к человеческому ИЛ-8.
Более конкретно, данное изобретение представляет:
1) CDR V области L цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8, имеющие следующие последовательности или их часть:
CDR1: Arg Ala Ser Glu Ile Ile Туг Ser Туг Leu Ala
CDR2: Asn Ala Lys Thr Leu Ala Asp
CDR3: Gin His His Phe Gly Phe Pro Arg Thr
а также
2) CDR V области H цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8, имеющие следующие последовательности или их часть:
CDR1: Asp Туг Туг Leu Ser
CDR2: Leu Ile Arg Asn Lys Ala Asn Gly Tyr Thr Arg Glu Tyr Ser Ala Ser Val Lys Gly
CDR3: Glu Asn Tyr Arg Tyr Asp Val Glu Leu Ala Tyr
Кроме того, данное изобретение представляет реконструированную V область L цепи антитела к человеческому ИЛ-8, включающую:
1) структурные участки (FR) V области L цепи и
2) CDR V области L цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8;
а также реконструированную V область человеческой H цепи антител к человеческому ИЛ-8, состоящую из:
1) FR V области H цепи; и
2) CDR V области H цепи моноклональных антител WS-4 к человеческому ИЛ-8.
Кроме того, данное изобретение представляет реконструированную человеческую L цепь антитела к человеческому ИЛ-8, состоящую из:
1) человеческой С области L цепи и
2) V области L цепи, состоящей из FR человеческой L цепи и CDR L цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8;
а также реконструированную человеческую H цепь антитела к человеческому ИЛ-8, состоящую из:
1) человеческой С области H цепи и
2) V области H цепи, включающей FR человеческой H цепи и CDR H цепи моноклональных антител WS-4 к человеческому ИЛ-8.
К тому же данное изобретение также представляет реконструированное человеческое антитело к человеческому ИЛ-8, состоящее из
(A) L цепей, причем каждая включает:
1) С область человеческой L цепи и
2) V область L цепи, состоящую из FR человеческой L цепи и CDR L цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8, и
(Б) H цепей, причем каждая включает:
1) С область H цепи и
2) V область H цепи, состоящую из FR человеческой H цепи и CDR H цепи мышиного моноклонального антитела WS-4 к человеческому ИЛ-8.
Примеры вышеупомянутых FR человеческой L цепи включают такие, которые имеют аминокислотные последовательности A или их часть, представленные в конце описания.
Примеры вышеупомянутых FR человеческой H цепи включают те, которые имеют аминокислотные последовательности Б или их часть, представленные в конце описания.
Дополнительно данное изобретение также касается ДНК, которая кодирует полипептид, включенный в вышеуказанные различные антитела, и ее фрагментов. Данное изобретение также относится к вектору, который содержит вышеупомянутую ДНК, примером которого является вектор экспрессии. Кроме того, данное изобретение представляет собой клетку-хозяина, которая трансформируется вышеупомянутым вектором.
Кроме того, данное изобретение также представляет процесс получения химерных антител к человеческому ИЛ-8 и его фрагментов, а также процесс получения реконструированных человеческих антител к человеческому ИЛ-8 и их фрагментов.
Фиг. 1 показывает векторы экспрессии HEF-VL-gк и HEF-VH-gγ1, содержащие промотор/энхансер человеческого фактора элонгации 1α(HEF-1α), которые применимы для экспрессии L цепи и H цепи, соответственно, антител данного изобретения.
Фиг. 2 является графиком, показывающим результаты ELISA по подтверждению способности связывания с человеческим ИЛ-8 химерного антитела WS-4 (chL/chH) данного изобретения, секретируемого в культуральную среду клетками COS.
Фиг. 3 является диаграммой конструирования ДНК, которая кодирует аминокислотные последовательности каждого из первой версии "a" (RVHa) V области H цепи реконструированного человеческого антитела WS-4 данного изобретения (А) и первой версии "a" (RVLa) V области L цепи реконструированного человеческого антитела WS-4 (В).
Фиг. 4 является графиком, показывающим результаты ELISA по сравнению способности связывания с человеческим ИЛ-8 V области L цепи (RVLa) и V области H цепи (RVHa) реконструированных человеческих антител WS-4 данного изобретения в комбинации с, соответственно, V областью H цепи химерных антител WS-4 (chH) и V областью L цепи химерных антител WS-4 (chL), экспрессируемых в клетках COS, со способностью связывания химерных антител WS-4 (chL/chH) данного изобретения, секретируемых в культуральную среду клеток COS.
Фиг. 5 является графиком, показывающим результаты ELISA по сравнению способности связывания с человеческим ИЛ-8 8 типов реконструированных человеческих антител WS-4, содержащих RVLa данного изобретения (RVLa/RVHa, RVLa/RVHb, RVLa/RVHc, RVLa/RVHd, RVLa/RVHe, RVLa/RVHf, RVLa/RVHg и RVLa/RVHh), секретируемых в культуральную среду клеток COS.
Фиг. 6 является графиком, показывающим результаты ELISA по сравнению способности связывания с человеческим ИЛ-8 8 типов реконструированных человеческих антител WS-4, содержащих вторую версию RVLb данного изобретения (RVLb/RVHa, RVLb/RVHb, RVLb/RVRc, RVLb/RVHe, RVLb/RVHf, RVLb/RVHg и RVLb/RVHh), продуцируемых в культуральный супернатант клеток COS, со способностью связывания химерных антител WS-4 (chL/chH) данного изобретения, секретируемых в культуральную среду клеток COS.
Фиг. 7 является графиком, показывающим результаты ELISA по сравнению способности связывания с человеческим ИЛ-8 очищенных реконструированных человеческих антител WS-4 RVLa/RVHg и RVLb/RVHg данного изобретения и очищенных химерных антител WS-4 (chL/chH) данного изобретения.
Фиг. 8 является графиком, показывающим результаты исследований подавления связывания лигандных рецепторов по сравнению способности подавлять связывание ИЛ-8 с рецепторами к ИЛ-8 очищенных реконструированных человеческих антител RVLa/RVHg и RVLb/RVHg данного изобретения со способностью подавления связывания мышиных антител WS-4 и химерных антител WS-4 (chL/chH) данного изобретения.
Клонирование ДНК, кодирующей мышиную V область
Чтобы клонировать ген, который кодирует V область мышиных моноклональных антител к человеческому ИЛ-8, необходимо получить гибридому, которая продуцирует мышиные моноклональные антитела к человеческому ИЛ-8, для получения такого гена. После извлечения мРНК из гибридомы мРНК превращали в однонитевую кДНК известными методами с последующей амплификацией целевой ДНК с использованием полимеразной цепной реакции (ПЦР) для получения гена. Примером источника этого гена является гибридома WS-4, которая продуцирует мышиные моноклональные антитела к человеческому ИЛ-8, полученному Ко Y.C., et al. Процесс получения этой гибридомы описан в J. Immunol. Methods, 149, 227-235, 1992, и далее описан в качестве справочного примера 1.
1) Извлечение всей ДНК
Для клонирования целевой ДНК, которая кодирует V область мышиных моноклональных антител к ИЛ-8, всю РНК можно получить путем разрушения клеток гибридомы с помощью обработки тиоцианатом гуанидина и проведения центрифугирования в градиенте плотности на основе хлорида цезия (Chirgwin J.M., et al. , Biochemistry, 18, 5294-5299, 1979). Кроме того, можно также использовать другие методы, которые применяются при клонировании генов, такие как те, при которых производятся обработка детергентом и обработка фенолом в присутствии ингибитора рибонуклеазы (РНКазы), такого, как ванадиевый комплекс (Berger S. L., et al., Biochemistry, 18, 5143-5149, 1979).
2) Синтез кДНК
Затем можно получить однонитевую кДНК, комплементарную мРНК путем обработки всей РНК обратной транскриптазой с использованием олиго(dТ), олигонуклеотида, комплементарного поли(А)-хвосту, расположенному на 3' конце мРНК, в качестве праймера и мРНК, содержащейся во всей РНК, полученной вышеописанным способом, в качестве матрицы (Larrick J. W., et al., Bio/Technology, 7, 934-938, 1989). Дополнительно можно также в то же время использовать случайный праймер. Кроме того, в случае, когда желательно сначала выделить мРНК, это может быть сделано путем нанесения всей РНК на колонку олиго(dТ)-целлюлозы, с которой связан поли(А)-хвост мРНК.
3) Амплификация ДНК, кодирующей V область, с помощью полимеразной цепной реакции.
Затем кДНК, которая кодирует вышеназванную область, специфично амплифицируется с помощью полимеразной цепной реакции (ПЦР). Для амплификации V области L цепи (к) типа мышиных моноклональных антител используются 11 типов олигонуклеотидных праймеров, показанных в ПОСЛ ИД NN 1-11 (мышиная каппа вариабельная; МКВ) и олигонуклеотидный праймер, показанный в ПОСЛ ИД N 12 (мышиный каппа константный; МКК) в качестве 5' концевого праймера и 3' концевого праймера, соответственно. Вышеупомянутые праймеры МКВ гибридизуются с последовательностью ДНК, которая кодирует мышиную лидерную последовательность L цепи каппа-типа.
Для амплификации V области H цепи мышиных моноклональных антител используются 12 типов олигнуклеотидных праймеров, показанные в ПОСЛ ИД NN 13-24 (мышиные тяжелые вариабельные; МТВ) и олигонуклеотидный праймер, показанный в ПОСЛ ИД N 25 (мышиная тяжелая константная; МТК), в качестве 5' концевого праймера и 3' концевого праймера, соответственно. Вышеупомянутые МТB праймеры гибридизуются с последовательностью ДНК, которая кодирует мышиную С область H цепи.
Кроме того, все 5' концевые праймеры (МКВ и МТВ) содержат последовательность GTCGAC, которая создает сайт расщепления рестрикционным ферментом SalI около 3' конца, тогда как оба 3' концевых праймера (МКК и МТК) содержат нуклеотидную последовательность CCCGGG, которая создает сайт расщепления рестрикционным ферментом XmaI вблизи 5' конца. Эти сайты расщепления рестрикционным ферментом используются для субклонирования целевых фрагментов ДНК, которые кодируют обе V области, в соответствующие векторы клонирования. В случае, когда эти сайты расщепления рестрикционными ферментами присутствуют также в целевой последовательности ДНК, которая кодирует обе V области, должны использоваться другие сайты расщепления рестрикционными ферментами для субклонирования в соответствующие клонирующие векторы.
4) Выделение ДНК, кодирующей V область
Затем, чтобы получить фрагмент ДНК, который кодирует целевую V область мышиного моноклонального антитела, продукты амплификации ПЦР разделяют и очищают в агарозном геле с низкой температурой плавления или на колонке [набор для очистки продуктов ПЦР (QIAGEN PCR Purification Spin Kit: QIAGEN); набор для очистки ДНК (GENECLEAN II, BIO 101). Фрагмент ДНК, который кодирует целевую V область мышиных моноклональных антител, получают путем ферментативной обработки очищенного продукта амплификации рестрикционными ферментами SalI и XmaI.
Далее с помощью расщепления подходящего клонирующего вектора, такого как плазмида pUC19 теми же самыми рестрикционными ферментами, SalI и XmaI, и ферментативного связывания вышеупомянутого фрагмента ДНК с этой pUC19 получают плазмиду, которая содержит фрагмент ДНК, который кодирует целевую V область мышиных моноклональных антител. Определение последовательности клонированной ДНК может быть выполнено обычным методом, примером чего является использование автоматического секвенатора ДНК (Applied Biosystems). Клонирование и определение последовательности целевой ДНК описаны детально в примерах 1 и 2.
Гипервариабельные участки (CDR)
Данное изобретение также представляет гипервариабельный участок или определяющую комплементарность область (CDR) вариабельной области мышиных моноклональных антител к человеческому ИЛ-8. V области как L цепи, так и H цепи этих антител образуют связывающий антиген сайт. Эти области на L цепи и H цепи имеют сходную основную структуру. V области обоих цепей содержат четыре структурные области, у которых последовательность является относительно консервативной, и эти четыре структурные области связаны с помощью трех гипервариабельных участков или CDR (Kabat Е.А. et al., "Sequences of Proteins of Immunological Interest", US Dept. Health and Human Services, 1991).
Большинство частей вышеупомянутых четырех структурных областей (FR) имеют β-пластинчатую структуру, и три CDR образуют петли. CDR могут в некоторых случаях образовывать часть β-пластинчатую структуру. Три CDR поддерживаются трехмерно в чрезвычайно близких положениях с помощью FR и принимают участие в образовании связывающего антиген сайта вместе с тремя спаренными CDR. Данное изобретение представляет CDR, которые применимы в качестве компонентов очеловеченных антител, а также ДНК, которая кодирует их. Эти CDR можно определить по экспериментальным правилам Kabat Е.А. et al., "Sequences of Proteins of Immunological Interest", путем сравнения последовательностей V области с известными аминокислотными последовательностями V области, детальное объяснение чего представлено в осуществлении 3.
Получение химерных антител
Перед созданием реконструированной человеческой V области антитела к человеческому ИЛ-8 необходимо подтвердить, образуют ли действительно используемые CDR связывающую антиген область. С этой целью были получены химерные антитела. Чтобы получить химерные антитела, необходимо сконструировать ДНК, которая кодирует L цепь и H цепь химерного антитела. Основной метод конструирования обеих ДНК включает связывание соответствующих последовательностей ДНК мышиной лидерной последовательности, присутствующей в ПЦР-клонированной ДНК, и последовательности мышиной V области с последовательностью ДНК, которая кодирует человеческую С область, уже присутствующей в векторе экспрессии для клетки млекопитающего.
Вышеупомянутые С области человеческого антитела могут быть любыми С областями L цепи и любыми С областями H цепи, и что касается L цепи, примеры включают Cк или Сλ человеческой L цепи, тогда как, что касается H цепи, если это IgG, примеры включают Cγ1, Cγ2, Cγ3 или Cγ4 (Ellison J. et al., DNA, 1, 11-18 (1981), Takahashi N. Et al., Cell, 29, 671-679 (1982), Krawinkel U. Et al., EMBO J., 1, 403-407 (1982)) или другие изотипы.
Получены два типа векторов экспрессии для продукции химерных антител, а именно вектор экспрессии, который содержит ДНК, кодирующую V область мышиной L цепи и С область человеческой L цепи под контролем энхансерно/промоторной области регуляции экспрессии, и вектор экспрессии, который содержит ДНК, которая кодирует V область мышиной H цепи и С область человеческой H цепи под контролем области управления экспрессией энхансерно/промоторного типа. Затем клетки-хозяева, такие как клетки млекопитающих, одновременно трансформировали обоими этими экспрессирующими векторами, и трансформированные клетки культивировали или in vitro, или in vivo для продукции химерного антигена (например, WO91-16928).
Или же, ДНК, которая кодирует V область L цепи мыши и С область L цепи человека, и ДНК, кодирующую V область мышиной H цепи и С область человеческой H цепи, могут вводиться в единственный вектор экспрессии, клетки-хозяева трансформируются с применением этого вектора и затем культивируются или in vitro, или in vivo для продукции химерных антител.
Получение химерных антител из моноклональных антител WS-4 описано в осуществлении 4.
кДНК, которая кодирует лидерную последовательность цепи к-типа мышиных WS-4 и V область, клонируется с использованием ПЦР и соединяется с вектором экспрессии, который содержит ДНК человеческого генома, которая кодирует Cк область человеческой L цепи. Подобным же образом кДНК, которая кодирует лидерную последовательность H цепи и V область мышиного антитела WS-4, клонируется с использованием ПЦР и связывается с вектором экспрессии, который содержит ДНК человеческого генома, которая кодирует человеческую Сγ1, область.
Более конкретно, подходящие нуклеотидные последовательности вводятся на 5' и 3' концах кДНК, которая кодирует V областей мышиных антител WS-4 с использованием специально сконструированных праймеров ПЦР, так что (1) их можно легко вставить в вектор экспрессии и (2) они соответствующим образом функционируют в указанном векторе экспрессии (например, эффективность транскрипции улучшается с помощью введения последовательности Козака в данное изобретение).
Затем ДНК, которая кодирует V область мышиного антитела WS-4, полученная путем амплификации с помощью ПЦР с использованием этих праймеров, вводится в вектор экспрессии HEF (см. фиг. 1), который уже содержит желаемую человеческую C область. Эти векторы пригодны для временной или постоянной экспрессии генетически сконструированного антитела в разных системах клеток млекопитающих.
При испытании на активность по связыванию с антигеном химерных антител WS-4, полученных таким образом, была продемонстрирована активность антител WS-4 в отношении связывания с человеческим ИЛ-8 (см. фиг. 2). Таким образом, было сделано заключение, что была клонирована верная мышиная V область и определена правильная последовательность.
Создание реконструированных человеческих антител WS-4
Чтобы получить реконструированные человеческие антитела, в которых CDR мышиных моноклональных антител пересажены в человеческие антитела, желательно, чтобы была высокая степень гомологии между аминокислотными последовательностями FR мышиных моноклональных антител, имеющих CDR, подлежащие пересадке, и аминокислотными последовательностями FR человеческих моноклональных антител, в которые должны быть пересажены эти CDR.
С этой целью человеческие V области для того, чтобы служить основой для конструирования V областей реконструированных человеческих антител WS-4, можно выбирать путем сравнения аминокислотных последовательностей FR мышиных моноклональных антител с аминокислотной последовательностью FR человеческих антител. Более конкретно, V области L и H цепей мышиных антител WS-4 сравнили со всеми известными человеческими V областями, найденными в базе данных Национального фонда биомедицинских исследований (National Biomedical Research Foundation, NBRF) с использованием генетического аналитического программного обеспечения, GENETEX (Software Development Co., Ltd.).
При сравнении с известными V областями человеческих L цепей было обнаружено, что V область L цепи мышиных антител WS-4 наиболее близко похожа на область человеческих антител HAU (Watanabe S. еt al., Hoppe-Seyler's Z. Physiol. Chem. , 351, 1291-1295, 1970), имеющих гомологию, равную 69,2%. С другой стороны при сравнении с известными V областями H цепи человеческих антител было обнаружено, что V область H цепи антител WS-4 наиболее близко похожа на V область человеческих антител VDH26 (Buluwela L. еt al., EMBO J., 7, 2003-2010, 1988), имеющую гомологию, равную 71,4%.
В основном гомология аминокислотных последовательностей мышиных V областей с аминокислотными последовательностями человеческих V областей меньше, чем гомология с аминокислотными последовательностями мышиных V областей. Это показывает, что V область мышиных антител WS-4 не полностью сходна с человеческой V областью, и в то же время указывает на то, что очеловечивание V области мышиных WS-4 является наилучшим путем решения проблемы иммуногенности у больных людей.
V область мышиных антител WS-4, кроме того, сравнили с консенсусной последовательностью подгруппы человеческой V области по Kabat Е.А., et al., (1991), Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health Services, U.S. Government Printing Office, чтобы сравнить FR V области. Эти результаты показаны в таблице 1.
FR V области L цепи мышиных антител WS-4 наиболее близко похожи на консенсусную последовательность FR V области человеческой L цепи подгруппы I (HSGI), имеющую гомологию, равную 64,4%. С другой стороны FR V области H цепи мышиных антител WS-4 наиболее близко похожи на консенсусную последовательность V области человеческой H цепи подгруппы III (HSGIII), имеющую гомологию, равную 62,3%.
Эти результаты подтверждают результаты, полученные из сравнения с известными человеческими антителами, V областью L цепи человеческих антител HAU, принадлежащей к подгруппе I V областей человеческой L цепи, и V областью H цепи человеческих антител VDH26, принадлежащей к подгруппе III V областей H цепи. Чтобы создать V область L цепи реконструированных человеческих антител WS-4, возможно лучше всего использовать V область человеческой L цепи, принадлежащую к подгруппе I (HSGI), тогда как, чтобы создать V область H цепи реконструированных человеческих антител WS-4, возможно, лучше всего использовать V область H цепи человеческих антител, принадлежащих к подгруппе III (HSGIII).
При сравнении с V областью L цепи известных человеческих антител V область L цепи мышиных моноклональных антител WS-4 наиболее близко похожа на V область L цепи человеческих антител REI, представителя подгруппы 1 V областей L цепи. Таким образом, использовались FR из REI при создании V области L цепи реконструированных человеческих антител WS-4. В этих человеческих FR на основе REI существуют различия в пяти аминокислотах (в положениях 39, 71, 104, 105 и 107; см. таблицу 2) по сравнению с последовательностью человеческих REI, документально показанной в специальной литературе (Palm W. et al., Hoppe-Seyler's Z. Physiol. Chem., 356, 167-191, 1975; и Epp О. et al., Biochemistry, 14, 4943-4952, 1975).
Номера аминокислот, показанные в таблице, приведены на основе опыта Kabat Е. А. et al. (1991). Изменения двух аминокислот в положениях 39 и 71 были теми изменениями, которые вызваны аминокислотами, присутствующими в FRV области L цепи крысиных антител CAMPATH-IH (Riechmann et al., 1988). По Kabat et al. (1991) изменение других трех аминокислот в FR4 (положения 104, 105 и 107) основаны на J области из других человеческих kL цепей и не отличаются от человеческих.
Было создано два варианта V области L цепи реконструированных человеческих антител WS-4. В первом варианте RVLa FR были идентичными FR на основе REI, присутствующих в реконструированных человеческих антителах CAMPATH-IH (Riechmann et al., 1988), тогда как CDR были идентичны CDR V области L цепи мышиных антител WS-4. Второй вариант, RVLb, основан на RVLa, и отличается только по одной аминокислоте в положении 71 в человеческой FR3. Как определено Clothia С. et al., J. Mol. Biol., 196, 901-917, 1987, остаток 71 является частью канонической структуры CDRI V области L цепи.
Предсказано, что аминокислота в этом положении непосредственно влияет на структуру петли CDRI V области L цепи, и по этой причине считается, что она имеет значительное воздействие на связывание с антигеном. В V области L цепи RVLb реконструированных человеческих антител WS-4 фенилаланин в положении 71 заменен на тирозин. В таблице 2 показаны соответствующие аминокислотные последовательности V области L цепи мышиных антител WS-4, FR модифицированных REI для использования в реконструированных человеческих антителах CAMPATH-1H (Riechmann, et al., 1988) и два варианта V области L цепи реконструированных человеческих антител WS-4.
FR V области H цепи мышиных антител WS-4 наиболее близко похожи на V область человеческой H цепи, принадлежащей к подгруппе Ill (таблица 1).
При сравнении с известными V областями человеческих H цепей и V областью H цепи мышиных антител WS-4 наиболее близко похожи на V область H цепи человеческих антител VDH26, представителя подгруппы III V областей человеческих H цепей, от FR1 до FR3 (Buluwela L. et al., EMBO J., 7, 2003-2010, 1988). В отношении FR4, так как о последовательности FR4 из VDH26 не сообщалось, было решено использовать аминокислотную последовательность FR4 человеческих антител 4B4, относящихся к подгруппе III (Sanz I., et al., J. Immunol. , 142, 883-887, 1989). Эти V области человеческой H цепи использовали в качестве основы для создания V области H цепи реконструированных антител WS-4.
Было создано восемь вариантов V области H цепи реконструированных человеческих антител WS-4. Во всех восьми вариантах человеческие FR1, FR2 и FR3 основаны на FR1, FR2 и FR3 человеческих антител VDH26, тогда как FR4 основаны на FR4 человеческих антител 4B4. Мышиные CDR были идентичны CDR V области H цепи мышиных антител WS-4.
В таблицах 3 и 4 показаны соответствующие аминокислотные последовательности V области H цепи мышиных антител WS-4, матрица от FR1 по FR3 человеческих антител VDH26, FR4 человеческих антител 4B4 и 8 вариантов V области H цепи реконструированных человеческих антител WS-4.
Аминокислоты обозначены с использованием однобуквенного кода. Номера аминокислот находятся в соответствии с определением Kabat et al.
Получение ДНК, кодирующей V область реконструированных человеческих антител WS-4
Получение V области реконструированных человеческих антител WS-4 описано детально в примере 5.
Была синтезирована ДНК, которая кодирует соответствующие первые варианты V областей L цепи и H цепи реконструированных человеческих антител WS-4. Затем было подтверждено, что вся последовательность ДНК варианта "а" V областей L цепи и H цепи реконструированных человеческих антител WS-4 кодирует правильную аминокислотную последовательность путем определения последовательности. Последовательность варианта "а" V области L цепи реконструированных человеческих антител WS-4 показана в ПОСЛ ИД N 62, а последовательность варианта "а" V области H цепи реконструированных человеческих антител WS-4 показана в ПОСЛ ИД N 38.
ДНК, которые кодируют другие варианты V области реконструированных человеческих антител WS-4, были получены с использованием незначительного изменения открыто описанного метода индукции ПЦР-мутации (Kamman М. et al., Nucleic Acids Res., 17, 5404, 1989) с первым вариантом "а" в качестве матрицы. Как ранее описано в отношении создания V области реконструированных человеческих антител WS-4, были получены ДНК, которая кодирует один дополнительный вариант V области L цепи реконструированных человеческих антител WS-4 (вариант "b"), а также ДНК, которая кодирует семь дополнительных вариантов V области H цепи реконструированных человеческих антител WS-4 (варианты "b", "с", "d", "e", "f", "g" и "h").
Эти дополнительные варианты содержали легкие изменения в серии аминокислотных последовательностей из первого варианта, и эти изменения в аминокислотных последовательностях были достигнуты с помощью осуществления незначительных изменений в последовательности ДНК при применении индукции мутации с помощью ПЦР. Был создан праймер ПЦР, который вызывает необходимое изменение в последовательности ДНК. После серии ПЦР реакций продукт ПЦР клонировали с последующим определением последовательности для подтверждения того, что произошли изменения последовательности ДНК, которые предполагались. Последовательность варианта "b" V области L цепи реконструированных человеческих антител WS-4 показана в ПОСЛ ИД N 65, а последовательность вариантов "b", "с", "d", "e", "f", "g" и "h" V области H цепи реконструированных человеческих антител WS-4 показаны в ПОСЛ ИД NN 41, 44, 45, 48, 51, 54 и 55, соответственно.
После подтверждения последовательностей ДНК различных вариантов V области реконструированных человеческих антител WS-4 путем определения последовательности ДНК, которая кодирует V область реконструированных человеческих антител WS-4, субклонировали в векторы экспрессии для клеток млекопитающих, которые уже содержали ДНК, которая кодирует человеческую С область. А именно ДНК, которая кодирует V область L цепи реконструированных человеческих антител WS-4, связывали с последовательностью ДНК, которая кодирует С область L цепи, а ДНК, которая кодирует V область H цепи реконструированных человеческих антител WS-4, связывали с последовательностью ДНК, которая кодирует человеческую Cγ1 область.
Затем все комбинации варианта "а" или "b" V области L цепи реконструированных человеческих антител и вариантов с "а" по "h" V области H цепи были испытаны на связывание с человеческим ИЛ-8. В результате, как показано на фиг. 7, оба реконструированных антитела, содержащих вариант "а" или "b" и вариант "g" H цепи (RVLa/RVHg и RVLb/RVHg) продемонстрировали способность связываться с человеческим ИЛ-8 в такой же степени, как и химерное антитело WS-4.
Любая система экспрессии, включая эукариотические клетки, такие как клетки животных или определенные клетки млекопитающих, клетки грибов, клетки дрожжей и прокариотические клетки, такие как бактериальные клетки (например, Escherichia coli), можно использовать для продукции химерных антител или реконструированных человеческих антител к человеческому ИЛ-8 данного изобретения. Предпочтительно, однако, чтобы химерные антитела или реконструированные антитела данного изобретения экспрессировались в клетках млекопитающих, таких как клетки COS или клетки CHO. В этих случаях для экспрессии в клетках млекопитающих можно использовать пригодный обычно используемый промотор. Например, предпочтительно использовать немедленно-ранний промотор человеческого цитомегаловируса (HCMV). Примеры векторов экспрессии, которые содержат промотор HCMV включают HCMV-VH-HCγ1 и HCMV-VL-НСк, а также сюда включаются те, которые производятся от pSV2neo (International Patent Application Publication No. WO92-19759).
Кроме того, примеры других промоторов генетической экспрессии в клетках млекопитающих, которые могут использоваться в данном изобретении, которые нужно использовать, включают промоторы вирусов, таких как ретровирусы, вирус полиомы, аденовирусы и обезьяний вирус 40 (SV40), a также промоторы, происходящие из клеток млекопитающих, таких как человеческий фактор-1 α элонгации полипептидной цепи (HEF-1α). Например, в случае использования промотора SV40 экспрессия может производиться следующим методом Mulligan R.C. et al. (Nature, 277, 108-114, 1979), или в случае использования промотора HEF-1α, экспрессия может производиться по следующему методу Mizushima S. et al. (Nucleic Acids Res., 18, 5322, 1990).
Другим конкретным примером промотора, пригодного для данного изобретения, является промотор HEF-1α. HEF-VH-gγ1 и HEF-VL-gк (фиг. 1) содержатся в векторе экспрессии, включающем этот промотор. Последовательности ДНК, происходящие из вируса полиомы, аденовируса, SV40 или бычьего папилломного вируса (BPV) и т.д., могут использоваться в качестве репликаторных точек. Кроме того, чтобы амплифицировать ряд генетических копий в клетках-хозяевах, можно использовать аминогликозид-3'-фосфотрансферазу, нео-резистентный ген, ген тимидинкиназы (ТК), ген ксантин-гуанинфосфорибозилтрансферазы (XGPRT) или дигидрофолатредуктазу (dhfr) в качестве селективных маркеров.
В заключение данное изобретение, во первых, представляет V область L цепи и V область H цепи мышиных моноклональных антител к человеческому ИЛ-8, а также ДНК, которая кодирует указанную V область L цепи, и ДНК, которая кодирует указанную V область H цепи. Они применимы при получении человеческо/мышиных химерных антител и реконструированных человеческих антител к человеческому ИЛ-8. Примером моноклонального антитела является WS-4. V область L цепи имеет аминокислотную последовательность, показанную, например, в ПОСЛ ИД N 26, а V область H цепи имеет аминокислотную последовательность, показанную, например, в ПОСЛ ИД N 27. Эти аминокислотные последовательности кодируются нуклеотидными последовательностями, показанными, например, в ПОСЛ ИД NN 26 и 27, соответственно.
Химерные антитела к человеческому ИЛ-8 данного изобретения состоят из:
1) С области человеческой L цепи и V области мышиной L цепи; и
2) С области человеческой L цепи и V области мышиной H цепи.
V область мышиной L цепи, V область мышиной H цепи и ДНК, которая кодирует эти области, описаны ранее. Вышеупомянутая С область человеческой L цепи может быть любой человеческой С областью L цепи, примеры которых включают человеческие Cк и Сλ области. Вышеупомянутая С область H цепи может быть любой человеческой С областью H цепи может быть любая человеческая С область H цепи, примеры которой включают человеческую Cγ1, Cγ2, Cγ3 или Cγ4 область (Ellison J. , еt al., DNA, 1, 11-18 (1981), Takahashi N., еt al., Cell, 29, 671-679 (1982) и Krawinkel U., еt al., EMBO J., 1, 403-407 (1982)).
Для продукции химерных антител получены два типа векторов экспрессии. А именно вектор экспрессии, который содержит ДНК, которая кодирует V область мышиной L цепи и человеческую С область L цепи под контролем области управления экспрессией энхансерно/промоторного типа, и вектор экспрессии, который содержит ДНК, которая кодирует мышиную V область H цепи и человеческую С область H цепи под контролем области управления экспрессией энхансерно/промоторного типа. Затем клетки-хозяева, как клетки млекопитающих, одновременно трансформируются этими векторами экспрессии, и трансформированные клетки культивируются или in vitro или in vivo с получением химерных антител.
Или же ДНК, которая кодирует мышиную V область L цепи и человеческую С область L цепи, и ДНК, которая кодирует мышиную V область H цепи и человеческую С область H цепи, может быть введена в единственный вектор экспрессии, клетки-хозяева трансформируются с использованием указанного вектора, и эти трансформированные клетки затем культивируются или in vitro или in vivo для получения химерных антител.
Реконструированное человеческое антитело WS-4 данного изобретения состоит из:
А) L цепей, причем каждая состоит из:
1) человеческой С области L цепи и
2) V области L цепи, состоящей из FR человеческой L цепи и CDR L цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8, а также
В) H цепей, причем каждая состоит из:
1) человеческой С области H цепи и
2) V области H цепи, состоящей из FR человеческой H цепи и CDR H цепи мышиных моноклональных антител WS-4 к человеческому ИЛ-8.
При предпочтительном способе осуществления данного изобретения вышеупомянутые CDR L цепи находятся в аминокислотной последовательности, показанной в ПОСЛ ИД N 26, причем пределы указанной аминокислотной последовательности определены в таблице 5; вышеупомянутые CDR H цепи находятся в аминокислотной последовательности, показанной в ПОСЛ ИД N 27, причем пределы указанной аминокислотной последовательности определены в таблице 5; вышеупомянутые FR человеческой L цепи происходят из REI; вышеупомянутые FR1, FR2 и FR3 человеческой H цепи получены из VDH26, и FR4 получены из 4B4; вышеупомянутая С область L цепи является человеческой Cк областью; вышеупомянутая человеческая С область H цепи является человеческой Cγ1 областью. К тому же вышеупомянутая человеческая С область H цепи может быть человеческой Cγ4 областью или радиоизотоп может быть связан вместо вышеупомянутой человеческой С области L цепи и/или человеческой С области H цепи.
Предпочтительно заменить часть аминокислотной последовательности вышеупомянутой человеческой FR для получения реконструированных человеческих антител, которые обладают достаточной активностью в отношении специфичного антигена.
При предпочтительном способе данного изобретения V область L цепи имеет аминокислотную последовательность, показанную как RVLa или RVLb в таблице 2, а V область H цепи имеет аминокислотную последовательность, показанную как RVHa, RVHb, RVHc, RVHd, RVHe, RVHf, RVHg или RVHh в таблицах 3 и 4. Кроме того, аминокислота в положении 41 в FR V области H цепи должна быть пролином, аминокислота в указанном положении 47 должна быть триптофаном и/или аминокислота в положении 67 указанной FR3 должна быть фенилаланином, и эти антитела, имеющие аминокислотные последовательности, показанные как RVHb, RVHd, RVHe, RVHf, RVHg или RVHh, более предпочтительны. Те, в которых присутствует RVHg в качестве V области H цепи, наиболее предпочтительны.
Для продукции реконструированных антител получены два типа векторов экспрессии. А именно получены вектор экспрессии, который содержит ДНК, которая кодирует ранее описанную реконструированную человеческую L цепь под контролем области управления экспрессией энхансерно/промоторного типа, а также другой вектор экспрессии, который содержит ДНК, которая кодирует ранее описанную реконструированную человеческую H цепь под контролем области управления экспрессией энхансерно/промоторного типа. Затем клетки-хозяева, такие как клетки млекопитающих, одновременно трансформируются этими векторами экспрессии, и трансформированные клетки культивируются или in vitro, или in vivo для получения реконструированных человеческих антител.
Или же ДНК, которая кодирует реконструированную человеческую L цепь, и ДНК, которая кодирует реконструированную человеческую H цепь, вводятся в единственный вектор экспрессии, клетки-хозяева трансформируются с использованием указанного вектора, и эти трансформированные клетки затем культивируют или in vitro, или in vivo для получения целевых реконструированных антител.
Химерные антитела или реконструированные человеческие антитела, полученные таким образом, могут быть выделены и очищены обычными методами, такими как аффинная хроматография с протеином А, ионообменная хроматография или гельфильтрация.
Химерную L цепь или реконструированную человеческую L цепь данного изобретения можно использовать для получения полных антител путем соединения с H цепью. Подобным же образом химерную H цепь или реконструированную человеческую H цепь данного изобретения можно использовать для получения полных антител путем соединения с L цепью.
Мышиная V область L цепи, реконструированная человеческая V область L цепи, мышиная V область H цепи и реконструированная человеческая V область H цепи являются по своей природе областями, которые связывают антиген в виде человеческого ИЛ-8. Полагают, что они будут применяться в качестве фармацевтических препаратов, диагностических средств и т.д. сами по себе или в форме слитого белка с другими протеинами.
Кроме того, CDR V области L цепи и CDR V области H цепи данного изобретения являются также по своей природе частями, которые связывают антиген в виде человеческого ИЛ-8. Считают, что они будут применяться в качестве фармацевтических препаратов, диагностических средств и т.д. сами по себе или в форме слитого белка с другими протеинами.
ДНК, которая кодирует мышиную V область L цепи данного изобретения, применима для получения ДНК, которая кодирует химерную L цепь, или ДНК, которая кодирует реконструированную человеческую L цепь. Подобным же образом, ДНК, которая кодирует V область мышиной H цепи применима для получения ДНК, которая кодирует химерную H цепь, или ДНК, которая кодирует реконструированную человеческую H цепь. К тому же ДНК, которая кодирует CDR V области L цепи данного изобретения, применима для получения ДНК, которая кодирует реконструированную человеческую V область L цепи, или ДНК, которая кодирует реконструированную человеческую L цепь.
Подобным же образом, ДНК, которая кодирует CDR V области H цепи данного изобретения, применима для получения ДНК, которая кодирует реконструированную человеческую V область H цепи, и ДНК, которая кодирует реконструированную человеческую H цепь. Кроме того, реконструированные человеческие антитела F(ab')2, Fab или Fv, или одиночную цепь, Fv, которая связывается как с Fv H цепи, так и L цепи, могут продуцироваться подходящими клетками-хозяевами и использоваться для целей, описанных выше (см., например. Bird R.E. et al., TIBTECH, 9, 132-137, 1991).
Одинарная цепь Fv образуется путем связывания V области H цепи и V области L цепи реконструированного человеческого антитела к человеческому ИЛ-8. В этой одинарной цепи Fv V область H цепи и V область L цепи связаны с помощью линкера, и предпочтительно, с помощью пептидного линкера (Huston J. S. et al., Proc. Natl. Acad. Sci. USA, 85, 5879-5883, 1988).
V область H цепи и V область L цепи этой одиночной цепи Fv может быть одной из вышеупомянутых V областей H цепи и L цепи реконструированных человеческих антител. Конкретные примеры этого включают V области H цепи, образованные аминокислотными последовательностями, описанными в ПОСЛ ИД NN 38, 41, 44, 45, 48, 51 и 54, и одинарную цепь Fv, содержащую V область L цепи, образованную аминокислотными последовательностями, описанными в ПОСЛ ИД NN 62 или 65 (см. WO88-01649).
Эти V области, предпочтительно, связаны пептидным линкером. Примеры пептидных линкеров, которые для этого используются, включают любой произвольный с единственной цепью пептид, образованный, например, остатками 12-19 (см. WO88-09344).
ДНК, которая кодирует одинарную цепь Fv, получена путем использования ДНК, которая кодирует H цепь или V область H цепи, и ДНК, которая кодирует L цепь или V область L цепи вышеупомянутых реконструированных человеческих антител, в качестве матрицы, амплификации части ДНК, которая кодирует те аминокислотные последовательности, которые желательны, используя праймерную пару, которая определяет оба конца, с помощью ПЦР, и амплификации путем соединения праймерной пары, которая определяет ДНК, которая кодирует полипептидный линкер вместе с обоими этими концами, так чтобы соответственно связать H и L цепи.
К тому же, если получены ДНК, которые кодируют одинарную цепь Fv, вектор экспрессии, который их содержит, вместе с клеткой-хозяином, которая трансформирована указанным вектором экспрессии, могут быть получены обычными методами. Кроме того, одинарная цепь Fv может быть получена обычными методами с использованием этой клетки-хозяина.
По сравнению с молекулами антител одинарные цепи Fv проявляют лучшее проникновение в ткань, и предполагается, что они будут использоваться при визуализации с помощью радиоизотопной метки и в качестве терапевтического средства, имеющего функции, сходные с реконструированными человеческими антителами.
Для подтверждения связывающего действия химерных антител, реконструированных человеческих антител и их F(ab')2, Fab, Fv или одинарной цепи Fv в отношении ИЛ-8 данного изобретения можно использовать ELISA (твердофазный иммуноферментный анализ), EIA (иммуноферментный анализ-ИФА), RIA (радиоиммуноанализ - РИА) или методику с флуоресцентными антителами. Например, в случае применения иммуноферментного анализа с химерными антителами и реконструированными человеческими антителами, человеческий ИЛ-8 добавляют в плату, покрытую поликлональными антителами к человеческому ИЛ-8, добавляют супернатант культуры или очищенный образец клеток, которые продуцируют химерные антитела или реконструированные человеческие антитела к человеческому ИЛ-8, и добавляют подходящие вторые антитела, которые помечены ферментом, таким как щелочная фосфатаза. После инкубации и промывания платы добавляют субстрат фермента, такой как п-нитрофенилфосфат, с последующим измерением поглощения для оценки активности по связыванию антигена.
Активность по подавлению связывания с рецепторами ИЛ-8 химерных антител, реконструированных человеческих антител и их F(ab')2, Fab, Fv или одинарной цепи Fv к человеческому ИЛ-8, оценивают путем обычного определения подавления связывания с лигандными рецепторами. Например, чтобы исследовать подавление связывания ИЛ-8 с рецепторами ИЛ-8 на нейтрофилах, после отделения нейтрофилов, полученных из гепаринизированной крови путем центрифугирования или другими способами, получают суспензию клеток, имеющую соответствующее число клеток, которые можно использовать в вышеназванном исследовании.
Раствор, содержащий ИЛ-8, соответственно меченый 125I и тому подобным, и немеченый ИЛ-8 смешивают с раствором, содержащим антитела данного изобретения или их фрагменты, приготовленным в соответствующей концентрации, с последующим добавлением этой смеси к вышеупомянутой суспензии нейтрофилов. После определенного периода времени нейтрофилы отделяются, и определяется активность метки на нейтрофилах.
Для оценки подавления хемотаксиса нейтрофилов антителами или их фрагментами данного изобретения можно использовать обычные известные методы, такие как метод, описанный у Grob P.M. et al., J. Biol. Chem., 265, 8311-8316, 1990.
В случае использования коммерчески доступной камеры для хемотаксиса после разведения антител или их фрагментов данного изобретения в подходящей среде культивирования в камеру добавляют ИЛ-8 с последующим добавлением разведения антител или фрагментов. Затем в камеру добавляют приготовленную суспензию нейтрофилов и оставляют стоять в течение определенного периода времени. Так как мигрирующие нейтрофилы удерживаются на фильтре, помещенном в камере, число таких нейтрофилов может быть определено обычными методами, такими как окрашивание или методы с флуоресцентными антителами. Кроме того, количественное определение может быть выполнено с помощью оценки под микроскопом или с помощью автоматического измерения с использованием какого- либо аппарата.
После стерилизации путем фильтрования с использованием мембранного фильтра химерные антитела, реконструированные человеческие антитела и их фрагменты F(ab')2, Fab, Fv или Fv с одинарной цепью к человеческому ИЛ-8 данного изобретения можно вводить в виде фармацевтического терапевтического препарата, предпочтительно парентерально, путем, например, внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции или подкожной инъекции, или интратрахеально, с помощью, например, ингалятора. Хотя и изменяясь в зависимости от возраста и симптоматики пациента, нормальная дозировка у людей составляет 1-1000 мг/организм, для чего может быть выбрано разделение на дозы, равные 1-10 мг/кг/неделю.
После оценки их очищающей связывающей активности химерные антитела, реконструированные человеческие антитела к человеческому ИЛ-8 и их фрагменты F(ab')2, Fab, Fv или Fv с одинарной цепью можно изготовить в виде фармацевтического терапевтического препарата с помощью методов, обычно используемых для производства препаратов физиологически активных белков. Например, препарат для инъекций состоит из очищенных химерных антител, реконструированных человеческих антител к человеческому ИЛ-8 или их фрагментов F(ab')2, Fab, FV или FV с одинарной цепью, растворенных в растворителе, таком как физиологический раствор или буфер, с добавлением антиадсорбционного средства, такого как твин 80, желатин или человеческий сывороточный альбумин (ЧСА). Или же этот препарат может быть также лиофилизированным для растворения и приготовления перед использованием. Примеры носителей, которые могут использоваться для лиофилизации, включают сахара-спирты или сахара, такие как маннит и глюкоза.
Хотя последующее представляет собой детальное объяснение данного изобретения через его осуществления, описанные ниже, объем данного изобретения не ограничивается этими примерами.
Пример 1: Клонирование ДНК, кодирующей V область мышиных моноклональных антител к человеческому ИЛ-8
ДНК, которая кодирует вариабельную область мышиных моноклональных антител к человеческому ИЛ-8, клонировали способом, описанным ниже.
1. Получение всей PHK
Всю PHK получали из гибридомы WS-4 с помощью модификации метода центрифугирования в градиенте плотности хлорида цезия Chirgwin J.M., et al., описанному в Biochemistry, 18, 5294-5299, 1979.
А именно 1 • 107 клеток гибридомы WS-4 полностью гомогенизировали в 25 мл 4 b гуанидина тиоцианата (Fluka). Гомогенат наслаивали на 5,7 М раствор хлорида цезия в центрифужной пробирке с последующим осаждением PHK путем центрифугирования в течение 14 часов при 20oC при 31000 об/мин в роторе Beckman SW40.
Осадок PHK промывали 80% этанолом и затем растворяли в 200 мкл 20 мМ раствора Трис-HCl (pH 7,5), содержащего 10 мМ ЭДТА и 0,5% N-лаурилсаркозината натрия. После добавления протеиназы (Boeringer) до концентрации, равной 0,5 мг/мл, полученную в результате смесь инкубировали в водяной бане при 37oC в течение 30 минут. Смесь экстрагировали фенолом и хлороформом, и PHK осаждали этанолом. Затем осадок PHK растворяли в 200 мкл 10 мМ раствора Трис-HCl (pH 7,5), содержащего 1 мМ ЭДТА.
2. Экстракция матричной РНК (мРНК)
Чтобы экстрагировать мРНК, кодирующую H цепь мышиных моноклональных антител WS-4, поли-(А)-положительную мРНК экстрагировали из всей РНК, полученной на стадии 1, выше, используя набор для выделения мРНК Fast Track, вариант 3,2 (Invitrogen) и следуя процедуре, описанной в инструкциях производителя.
3. Синтез однонитевой кДНК.
Однонитевую кДНК синтезировали из примерно 40 нг мРНК, полученной на стадии 2, выше, используя набор с DNA Cycle (Invitrogen) и следуя процедуре, описанной в инструкциях. Полученный продукт затем использовали для амплификации кДНК, которая кодирует мышиную V область H цепи. Кроме того, чтобы амплифицировать кДНК, которая кодирует мышиную V область L цепи, была синтезирована однонитевая кДНК из примерно 10 мкг вышеназванной всей РНК.
4. Амплификация гена, кодирующего вариабельную область антитела, с помощью ПЦР
1) Амплификация кДНК, кодирующей мышиную V область H цепи
Праймеры MHv (мышиной тяжелой вариабельной) с 1 по 12, показанные в ПОСЛ ИД NN: с 13 по 24 и праймер MHC (мышиной тяжелой константной), показанный в ПОСЛ ИД N: 25 (Jones S.Т., et al., Bio/Tichnology, 9, 88-89, 1991), использовали для праймеров ПЦР. 100 мкл раствора ПЦР, содержащих 10 мМ Трис-HCl (pH 8,3), 50 мМ KCl, 0,1 мМ дНТФ (дАТФ, дГТФ, ДЦТФ, дТТФ), 1,5 мМ MgCl2, 0,001% (вес/объем) желатин, 5 единиц ДНК-полимеразы AmpliTaq (Perkin Elmer Cetus), 0,25 мМ одного из MHv праймеров, показанных в ПОСЛ ИД NN: с 13 по 24, 75 мкМ MCH праймера, показанного в ПОСЛ ИД N: 25, и 1,5 мкл раствора однонитевой кДНК, полученной на стадии 3, выше. Растворы ПЦР готовили для каждого из праймеров MHV 1-12. После покрытия каждого раствора 50 мкл минерального масла его нагревали в течение по порядку 3 минуты при первоначальной температуре, равной 94oC, с последующим циклом из 1 минуты при 94oC, 1 минуты при 55oC и 1 минуты при 72oC. После повторения этого цикла нагревания 30 раз реакционную смесь далее инкубировали в течение 10 минут при 72oC.
2) Амплификация кДНК, кодирующей мышиную V область L цепи
Праймеры MKv (мышиной каппа вариабельной) с 1 по 11, показанные в ПОСЛ ИД NN: 1 по 11 и праймер MKC (мышиной каппа константной), показанный в ПОСЛ ИД N: 12 (Jones S.T. et al., Bio/Technology, 9, 88-89, 1991) как праймеры в ПЦР.
Амплификацию кДНК производили из 2 мкл однонитевой кДНК, полученной на стадии 3 выше, с использованием того же метода, который описан для амплификации гена V области H цепи на стадии 4, часть (1), выше, за исключением того, что амплификацию выполняли, используя 0,25 мкМ каждой из смесей праймеров MKv и 3,0 мкМ праймера МСК.
5. Очистка и фрагментация продукта ПЦР
Соответствующие фрагменты ДНК V области H цепи и V области L цепи, амплифицированные с помощью ПЦР, как описано выше, разделяли с помощью электрофореза в агарозном геле с использованием 1,5% агарозы (Sigma) с низкой температурой плавления. Куски агарозы, содержащие фрагмент ДНК H цепи длиной примерно 450 по и фрагмент ДНК L цепи длиной примерно в 400 по вырезали отдельно и расплавляли в течение 5 минут при 65oC с последующим добавлением равного объема 20 мМ Трис-HCl (pH 7,5), содержащего 2 мМ ЭДТУ и 300 мМ NaCl.
Эту смесь экстрагировали фенолом и хлороформом, фрагменты ДНК выделяли путем осаждения этанолом и растворяли в 10 мМ Трис-HCl (pH 7,5), содержащем 1 мМ ЭДТУ. Затем фрагменты расщепляли в течение 3 часов при 37oC с применением 5 единиц рестрикционного фермента Xmal (New England BioLabs) в 10 мМ Трис-HCl (pH 7,9), содержащем 10 мМ MgCL2 и 1 мМ дитиотреитола. Затем фрагменты ДНК расщепляли в течение 2 часов при 37oC с помощью 40 единиц рестрикционного фермента SalI (Takara Shuzo), и полученные фрагменты ДНК разделяли с помощью электрофореза в агарозном геле с применением 1,5% агарозы (Sigma) с низкой температурой плавления.
Куски агарозы, содержащие фрагменты ДНК, вырезали и расплавляли в течение 5 минут при 65o с последующим добавлением равного объема 20 мМ Трис-HCl (pH 7,5), содержащего 2 мМ ЭДТА и 300 мМ NaCl. Эту смесь затем экстрагировали фенолом и хлороформом, фрагменты ДНК выделяли осаждением этанолом и растворяли в 10 мМ Трис-HCl (pH 7,5), содержащем ЭДТУ.
Таким образом, соответственно получили фрагмент ДНК, содержащий ген, который кодирует мышиную V область L цепи к-типа, и фрагмент ДНК, содержащий ген, который кодирует мышиную V область H цепи. Вышеназванные фрагменты ДНК, оба имеют сайт присоединения SalI на их 5' конце и сайт присоединения XmaI на их 3' конце.
6. Сцепление и трансформация
Примерно 0,3 мкг фрагмента ДНК SalI-XmaI, содержащего ген, который кодирует мышиную V область L цепи каппа-типа, полученные способом, описанным выше, смешивали с примерно 0,1 мкг вектора pUC19 (Takara Shuzo), подготовленного путем расщепления с помощью SalI, XmaI и щелочной фосфатазы Escherichia coli (ВАР; Takara Shuzo) в течение 4 часов при 16oC в буферной реакционной смеси, содержащей 1 единицу ДНК-лигазы T4 (Gibco BRL), и добавляли прилагаемый буфер для связывания.
Затем вышеупомянутую смесь для связывания добавляли к 50 мкл компетентных клеток Е. Coli DH5 α (GIBCO BRL), после чего клетки оставляли стоять в течение 30 минут на льду, в течение 1 минуты при 42oC и опять на льду в течение 1 минуты. Затем добавляли 400 мкл 2 х YT среды (Molecular Cloning: A Laboratory Manual, Sambrook, et al., Cold Spring Harbor Laboratory Press, 1989). После инкубации в течение 1 часа при 37oC Е. Coli распределяли на 2 х агаризованной среды YT (Molecular Cloning: A Laboratory Manual, Sambrook, et al., Cold Spring Harbor Laboratory Press, 1989), содержащей 50 мкг/мл ампициллина (Meiji Seika), с последующей инкубацией в течение ночи при 37oC для получения трансформанта Е. Coli.
Затем в это время применяли X-Gal (5-бром-4-хлор-3-индолил-β-D-галактозид, Takara Shuzo) в качестве маркера селекции.
Этот трансформант инкубировали в течение ночи при 37oC в 10 мл 2 х среды YT, содержащей 50 мкг/мл ампициллина, и из этой культуры получали плазмидную ДНК с использованием набора QIAGEN Plasmid Mini Kit (QIAGEN) и следуя процедуре, описанной в инструкциях.
Плазмиду, содержащую ген, который кодирует мышиную V область L цепи к-типа, происходящую из гибридомы WS-4, полученную таким образом, назвали pUC-WS4-VL.
Плазмиду, содержащую ген, который кодирует мышиную V область H цепи, происходящую из гибридомы WS-4, получали из фрагментов ДНК SalI-XmaI, следуя тому же методу, который описан выше, за исключением использования JM109 для компетентных клеток Е. coli. Полученную плазмиду назвали pUC-WS4-VH.
Пример 2: Определение нуклеотидной последовательности ДНК
Нуклеотидную последовательность кодирующей области кДНК в вышеназванных плазмидах определяли, используя M13 праймер RV и M13 праймер M4 (оба Takara Shuzo) в качестве праймеров последовательности, автоматический секвенатор ДНК (Applied Biosystems Inc.) и набор Taq Dye Deoxy Tertinator Cycle Sequencing Kit (Applied Biosystems Inc.) и следуя протоколу, описанному производителями. Нуклеотидная последовательность гена, который кодирует V область L цепи мышиных моноклональных антител WS-4, содержащаяся в плазмиде pUC-WS4-VL, показана в ПОСЛ ИД N: 26. Кроме того, нуклеотидная последовательность гена, который кодирует V области H цепи мышиных моноклональных антител, содержащаяся в плазмиде pUC-WS4-VH, показана в ПОСЛ ИД N: 27.
Пример 3: Определение CDR
Основная структура V областей L и H цепей имеет взаимные сходства, причем каждая имеет четыре каркасные области, связанные с помощью трех гипервариабельных областей, областей, определяющих комплементарность (CDR). Хотя аминокислотная последовательность каркасной области относительно хорошо сохраняется, изменчивость аминокислотной последовательности областей CDR чрезвычайно высока (Kabat Е.А. et al., "Sequences of Proteins of Immunological Interest", US Dept. Of Health and Human Services, 1991).
На основании этого факта были определены CDR, которые показаны в таблице 5, путем исследования их гомологии при попытках подобрать аминокислотную последовательность вариабельной области мышиных моноклональных антител к человеческому ИЛ-8 с помощью базы данных аминокислотных последовательностей антител, полученных Kabat et al.
Пример 4: Подтверждение экспрессии клонированной кДНК (получение химерных WS-4 антител)
Получение вектора экспрессии
Чтобы получить вектор, который экспрессирует химерные WS-4 антитела, клоны кДНК pUC-WS4-VL и pUC-WS4-VH, которые кодируют V области L цепи и H цепи мышиных WS-4, соответственно, были модифицированы с помощью ПЦР. Затем они были введены в вектор экспрессии HEF (см. ранее описанный, WО92-19759 и фиг. 1)
Обратный праймер (ПОСЛ ИД N: 28) для V области L цепи и обратный праймер (ПОСЛ ИД N: 29) для V области H цепи были соответственно гибридизованы с ДНК, которая кодирует стартовую из лидерной последовательности V области, и конструировали так, чтобы имелась консенсусная последовательность Козака (Kozak М. et al. , J. Mol. Biol., 196, 947-950, 1987) и сайт рестрикции HindIII. Прямой праймер (ПОСЛ ИД N: 30) для V области L цепи и прямой праймер (ПОСЛ ИД N: 31) для V области H цепи гибридизовали с последовательностью ДНК, которая кодирует терминальную J цепь, и конструировали так, чтобы добавить сплайсинговую донорную последовательность и сайт рестрикции BamHI.
100 мкл реакционной смеси ПЦР, содержащей 20 мМ Трис-HCl (pH 8,2), 10 мМ KCl, 6 мМ (NH4)2SO4, 1% Тритон X-100, 100 мкМ дНТФ, 1,5 мМ MgCl2, 100 пмолей каждого праймера, 100 нг матричной ДНК (pUC-VL или pUC-VH) и 2,5 Ед фермента AmpliTaq, покрывали 50 мкл минерального масла. После первоначальной денатурации в течение 3 минут при 94oC цикл нагревания, состоящий из 1 минуты при 94oC, 1 минуты при 55oC и 1 минуты при 72oC, повторяли 30 раз с последующей конечной инкубацией в течение 10 минут при 72oC.
Продукт ПЦР очищали, используя 1,5% агарозной гель с низкой температурой плавления с последующим расщеплением с помощью HindIII и BamHI. Ген V области L цепи клонировали в вектор экспрессии HEF, HEF-VL-gк, тогда как ген V области H цепи клонировали в HEF вектор экспрессии HEF-VH-gγ1. После определения последовательностей ДНК плазмиды, содержащие фрагмент ДНК, имеющий правильную последовательность ДНК, были названы HEF-chW4L-gк и HEF-chW4H-gγ1, соответственно.
Трансфекция в клетки COS
Чтобы увидеть временную экспрессию химерных антител WS-4, вышеназванные векторы экспрессии испытывали в клетках COS. HEF-chWS4L-gк и HEF-chW4H-gγ1 одновременно трансфицировали в клетки COS путем электропорации, используя систему Gene Pulser (Biorad). Каждую ДНК (10 мкг) добавляли к 0,8 мл образца, содержащего 1•107 клеток/мл в фосфатно-буферном физрастворе (ФБФР) и затем подвергали пульсации при 1,5 кВ с емкостью 25 мкФ.
После того, как их оставляли стоять в течение периода времени, равного 10 минутам, при комнатной температуре, электропорированные клетки суспендировали в 15 мл среды культивирования DMEM (GIBCO), содержащей 5% бычьей плодной сыворотки, освобожденной от γ-глобулина, помещенных в чашку для тканевой культуры. После инкубации в течение 96 часов культуральную среду собирали, остатки клеток удаляли путем центрифугирования и супернатант затем отфильтровывали с помощью дискового фильтра, имеющего диаметр пор, равный 0,45 мкм (Gelman Science).
ELISA
Платы для ELISA для количественного определения связывания антигена и концентрации антител готовили, как описано ниже. Платы для ELISA для определения активности связывания антигена были подготовлены следующим образом. После образования твердого слоя в каждую ячейку 96-ячеечной платы (Nunc) со 100 мкл козьих поликлональных антител к человеческому ИЛ-8 (R & D Systems), растворенных в твердом слое буфера при концентрации, равной 2 мкг/мл (0,1 М бикарбонат натрия, 0,02% азид натрия) и блокирования с помощью 200 мкл буфера для разведений (50 мМ Трис-HCl (pH 7,2), 1% бычьего сывороточного альбумина (БСА), 1 мМ MgCl2, 0,15 М NaCl, 0,05% Твин 20 и 0,02% азид натрия) добавляли 100 мкл рекомбинантного человеческого ИЛ-8 (Amersham) (5 нг/мл).
Очищенный образец химерных антител или супернатант культуры клеток COS, которые экспрессировали их, разводили серийно и добавляли в каждую ячейку. Затем добавляли 100 мкл меченных щелочной фосфатазой козьих к человеческому IgG антител (TAGO) (1 мкг/мл). После инкубации и промывания добавляли раствор субстрата (1 мг/мл п-нитрофенилфосфата) с последующим измерением поглощения при 405 нм.
Для измерения концентрации антител после образования твердого слоя в ячейках 96-ячеечной платы с помощью 100 мкл козьих к человеческому IgG антител (TAGO) с концентрацией 1 мкг/мл и блокирования, очищенный образец химерных антител или культуральной среды клеток COS, которые экспрессировали их, разводили серийно и добавляли в каждую ячейку. Затем добавляли 100 мкл меченных щелочной фосфатазой козьих к человеческому IgG антител (TAGO) (1 мкг/мл). После инкубации и промывания добавляли раствор субстрата (1 мг/мл п-нитрофенилфосфата) и измеряли поглощение при 405 нм.
В результате, так как химерные антитела WS-4 продемонстрировали специфическое связывание с ИЛ-8, считали, что эти химерные антитела имеют правильное строение V области мышиных моноклональных антител WS-4 (см. фиг. 2).
Кроме того, Escherichia coli, имеющую вышеупомянутую плазмиду HEF-chWS4L-gк, поместили на хранение как Escherichia coli DH5 α (HEF-chWS4L-gк), a Escherichia coli, имеющую вышеупомянутую плазмиду HEF-chWS4H-gγ1, поместили на хранение как Escherichia coli JM109 (HEF-chWS4H-gγ1) в Индустриальный технологический научно-исследовательский институт биоинженерии Агентства индустриальной науки и технологии (Bioengineering Industrial Technology Research Institute of the Agency of Industrial Science and Technology (1-1-3 Higashi, Tsukuba, lbaraki, Japan)) 12 июля 1994 под соответствующими названиями FERM ВР-4739 и FERM ВР-4740 в соответствии с положениями Будапештской Конвенции.
Пример 5: Получение реконструированных человеческих антител WS-4
Получение V области H цепи реконструированных человеческих антител WS-4
ДНК, которая кодирует V область H цепи реконструированных человеческих антител WS-4, была сконструирована способом, описанным ниже. Полная ДНК, которая кодирует V область H цепи реконструированных человеческих антител, была сконструирована так, что известные последовательности ДНК, которые соответственно кодируют с FR1 по FR3 человеческих антител VDH26 и FR4 человеческих антител 4B4, связаны с последовательностью ДНК, которая кодирует CDR V области H цепи мышиных антител WS-4.
Затем соответственно добавляли сайт распознавания HindIII/консенсусную последовательность Козака и сайт распознавания BamHI/сплайсинговую донорную последовательность на 5' и 3' концы этой последовательности ДНК с последующим введением в вектор экспрессии HEF. Последовательность ДНК, сконструированную таким образом, затем разделяли на четыре примерно равные олигонуклеотида, после чего вторичную структуру этих нуклеотидов, для которых существовала возможность помехи сборки этих олигонуклеотидов, была определена с помощью компьютера. Четыре олигонуклеотидные последовательности показаны в ПОСЛ ИД NN: 32-35. Эти олигонуклеотиды имеют длину, равную 113-143 основаниям, и примыкающие олигонуклеотиды имеют область перекрывания, обычно состоящую из 20 оснований. HF1 (ПОСЛ ИД NN: 32) и HF3 (ПОСЛ ИД NN: 34) из этих четырех олигонуклеотидов имеют смысловую последовательность ДНК, тогда как другие HF2 (ПОСЛ ИД N: 33) и HF4 (ПОСЛ ИД N: 35) имеют антисмысловую последовательность ДНК. Эти олигонуклеотиды были синтезированы с помощью автоматического синтезатора ДНК (Applied Biosystem).
Кроме того, метод сборки этих четырех нуклеотидов с помощью ПЦР проиллюстрирован на фиг. 3. Примерно 100 нг каждого HF1 и HF2, а также HF3 и HF4 объединяли и добавляли к реакционной смеси ПЦР, имеющей конечный объем, равный 98 мкл и содержащей 2,5 Ед Pfu ДНК-полимеразы. После первоначальной денатурации в течение 3 минут при 94oC растворы инкубировали в течение 2 циклов, причем каждый цикл состоял из инкубации в течение 2 минут при 94oC, 2 минут при 55oC и 2 минут при 72oC.
После взаимной замены половины объема реакционных растворов ПЦР инкубацию продолжали в течение дополнительных двух циклов. После добавления 100 пмолей каждого из праймера RVH5' (ПОСЛ ИД N: 36) и праймера RVH3' (ПОСЛ ИД N: 37) в качестве внешних праймеров, реакционные растворы ПЦР покрывали 50 мкл минерального масла. После первоначальной денатурации в течение 3 минут при 94oC реакционные растворы инкубировали в течение 45 циклов из 1 минуты при 94oC, 1 минуты при 55oC и 1 минуты при 72oC с последующей инкубацией в течение 10 минут при 72oC.
Фрагмент ДНК, содержащий примерно 450 пар оснований, очищали в 1,5% агарозном геле с низкой температурой плавления, расщепляли с помощью HindIII и BamHI и клонировали в HEF вектор экспрессии HEF-VH-gγ1 (фиг. 1). После определения последовательности ДНК с использованием праймера EF-1 (ПОСЛ ИД N: 66) и праймера HIP (ПОСЛ ИД NN: 67) плазмиду, которая содержала фрагмент ДНК, который кодирует правильную аминокислотную последовательность V области H цепи, назвали HEF-RVHa-gγ1. Аминокислотная последовательность и нуклеотидная последовательность V области H цепи, заключенные в этой плазмиде HEF-RVHa-gγ1, показаны в ПОСЛ ИД N: 38.
Каждый из вариантов "b", "с", "d", "e", "f", "g" и "h" V области H цепи реконструированных человеческих антител WS-4 получали способом, описанным ниже.
Вариант "b" (RVHb) амплифицировали с помощью ПЦР, используя мутагенные праймеры LTWl (ПОСЛ ИД N: 39) и LTW2 (ПОСЛ ИД N: 40), сконструированные так, что лейцин в положении 47 заменялся триптофаном, RVH5' (ПОСЛ ИД N: 36) и RVH3' (ПОСЛ ИД N: 37) в качестве праймеров, которые определяют оба конца, и плазмиды HEF-RVHa-gγ1 в качестве матричной ДНК для получения плазмиды HEF-RVHb-gγ1. Аминокислотная последовательность и нуклеотидная последовательность V области H цепи, заключенные в этой плазмиде HEF-RVHb gγ1, показаны в ПОСЛ ИД N: 41.
Вариант "с" амплифицировали с помощью ПЦР, используя мутагенные праймеры QTP1 (ПОСЛ ИД N: 42) и QTP2 (ПОСЛ ИД N: 43), сконструированные так, что глютаминовая кислота в положении 41 заменялась пролином, и плазмиду HEF-RVHa-gγ1 в качестве матричной ДНК для получения плазмиды HEF-RVHc-gγ1. Аминокислотная последовательность и нуклеотидная последовательность V области H цепи, заключенные в этой плазмиде HEF-RVHc-gγ1, показаны в ПОСЛ ИД N: 44.
Вариант "d" амплифицировали с помощью ПЦР, используя мутагенные праймеры QTP1 и QTP2 и плазмиду HEF-RVHb-gγ1 в качестве матричной ДНК для получения плазмиды HEF-RVHd-gγ1. Аминокислотная последовательность и нуклеотидная последовательность V области H цепи, заключенные в этой плазмиде HEF-RVHd-gγ1, показаны в ПОСЛ ИД N: 45.
Вариант "e" амплифицировали путем использования мутагенных праймеров АТР1 (ПОСЛ ИД N: 46) и АТР2 (ПОСЛ ИД N: 47), сконструированные так, что аланин в положении 40 заменялся на пролин, и плазмиды HEF-RVHd-gγ1 в качестве матричной ДНК для получения плазмиды HEF-RVHe-gγ1. Аминокислотная последовательность и нуклеотидная последовательность V области H цепи, заключенные в этой плазмиде HEF-RVHe-gγ1, показаны в ПОСЛ ИД N: 48.
Вариант "f" амплифицировали, используя мутагенные праймеры GTA1 (ПОСЛ ИД N: 49) и GTA2 (ПОСЛ ИД N: 50), сконструированные так, что глицин в положении 44 заменялся аланином, и плазмиду HEF-RVHd-gγ1 в качестве матричной ДНК для получения плазмиды HEF-RVHf-gγ1. Аминокислотная последовательность и нуклеотидная последовательность V области H цепи, заключенные в этой плазмиде HEF-RVHf-gγ1, показаны в ПОСЛ ИД N: 51.
Вариант "g" амплифицировали, используя мутагенные праймеры LTF1 (ПОСЛ ИД N: 52) и LTF2 (ПОСЛ ИД N: 53), сконструированные так, что лейцин в положении 67 заменялся фенилаланином, и плазмиду HEF-RVHd-gγ1 в качестве матричной ДНК для получения плазмиды HEF-RVHg-gγ1. Аминокислотная последовательность и нуклеотидная последовательность V области H цепи, заключенные в этой плазмиде HEF-RVHg-gγ1, показаны в ПОСЛ ИД N: 54.
Вариант "h" амплифицировали, используя мутагенные праймеры LTF1 и LTF2 и плазмиду HEF-RVHb-gγ1 в качестве матричной ДНК для получения плазмиды HEF-RVHh-gγ1. Аминокислотная последовательность и нуклеотидная последовательность V области H цепи, заключенные в этой плазмиде HEF-RVHh-gγ1, показаны в ПОСЛ ИД N: 55.
Получение V области L цепи реконструированных человеческих антител WS-4
ДНК, которая кодирует V область L цепи реконструированных человеческих антител WS-4, была создана способом, описанным ниже. Полная ДНК, которая кодирует V область L цепи реконструированных человеческих антител WS-4, была создана так, что последовательность ДНК, которая кодирует FR человеческих антител REI, связывается с последовательностью ДНК, которая кодирует CDR V области L цепи мышиных антител WS-4.
Затем сайт распознавания HindIII/консенсусную последовательность Козака и сайт распознавания BamHI/сплайсинговую донорную последовательность добавляли, соответственно на 5' и 3' концы этой последовательности ДНК, так чтобы сделать возможным ее введение в вектор экспрессии HEF. Последовательность ДНК, созданная таким образом, затем делится на четыре примерно равные нуклеотида, после чего вторичную структуру этих нуклеотидов, для которых существует возможность помех сборки этих нуклеотидов, анализировали с помощью компьютера.
Четыре олигонуклеотидные последовательности показаны в ПОСЛ ИД N: 56-59. Эти олигонуклеотиды имеют длину, равную 106-124 основаниям, примыкающие олигонуклеотиды имеют область перекрывания, обычно состоящую из 19-23 оснований. LF1 (ПОСЛ ИД N: 56) и LF3 (ПОСЛ ИД N: 58) из этих четырех олигонуклеотидов имеют смысловую последовательность ДНК, тогда как другие LF2 (ПОСЛ ИД N: 57) и LF4 (ПОСЛ ИД N: 59) имеют антисмысловую последовательность. Эти олигонуклеотиды были синтезированы тем же методом, что и примененный в отношении вышеназванных HF1-HF4.
Для сборки, после первоначальной денатурации 98 мкл смеси ПЦР, содержащей 100 нг каждого из четырех типов нуклеотидов и 5 Ед Ampli Taq, в течение 3 минут при 94oC, смесь инкубировали в течение 2 циклов, причем каждый цикл состоял из инкубации в течение 2 минут при 94oC, 2 минут при 55oC и 2 минут при 72oC. После добавления 100 мкл каждого из: праймера RVL5' (ПОСЛ ИД N: 60) и праймера RVL3' (ПОСЛ ИД N: 61) в качестве внешних праймеров, реакционную смесь ПЦР покрывали 50 мкл минерального масла. После первоначальной денатурации в течение 3 минут при 94oC, реакционный раствор инкубировали в течение 30 циклов из 1 минуты при 94oC, 1 минуты при 55oC и 1 минуты при 72oC, с последующей инкубацией в конце в течение 10 минут при 72oC (см. фиг. 3).
Фрагмент ДНК, состоящий примерно из 400 пар оснований, очищали, используя 1,5% агарозный гель с низкой температурой плавления, расщепляли HindIII и BamHI и клонировали в HEF вектор экспрессии HEF-VL-gк (фиг. 1). После определения последовательности ДНК с применением праймера EF-1
(ПОСЛ ИД N: 66) и праймера KIP (ПОСЛ ИД N: 68), плазмида, которая содержала фрагмент ДНК, который кодирует правильную аминокислотную последовательность V области L цепи, была названа HEF-RVLa-gк. Аминокислотная последовательность и нуклеотидная последовательность для V области L цепи, заключенные в этой плазмиде HEF-RVLa-gк, показаны в ПОСЛ ИД N: 62.
Вариант "b" амплифицировали с помощью ПЦР, используя мутагенные праймеры FTY1 (ПОСЛ ИД N: 63) и FTY2 (ПОСЛ ИД N: 64), сконструированные так, что фенилаланин в положении 71 заменялся тирозином, RVL5' (ПОСЛ ИД N: 60) и RVL3' (ПОСЛ ИД N: 61) в качестве праймеров, которые определяют оба конца, и плазмиды HEF-RVLa-gк в качестве матричной ДНК для получения плазмиды HEF-RVLb-gк. Аминокислотная последовательность и нуклеотидная последовательность V области L цепи, заключенные в этой плазмиде HEF-RVHb-gк, показаны в ПОСЛ ИД N: 65.
Чтобы оценить активность по связыванию антигена каждой цепи реконструированных человеческих антител WS-4, клетки COS сначала одновременно трансфицировали способом, описанным ранее в отношении вектора экспрессии HEF-RVLa-gк для варианта "а" L цепи реконструированных человеческих антител WS-4 и вектора экспрессии HEF-chWS4H-gγ1 для H цепи химерных антител WS-4. После отбора культуральной среды, как описано выше, определяли количество произведенных антител и активность по связыванию антигена для антител, продуцируемых с применением метода, описанного в разделе по ELISA в вышеприведенном примере 4. Эти результаты показаны на фиг. 4. Как показано на фиг. 4, это подтверждало то, что не существовало различия в активности по связыванию антигена между химерными антителами (chL/chH), использованными в качестве положительного контроля, и антителами, состоящими из реконструированной L цепи и химерной H цепи (RVLa/chH).
В то же время, чтобы оценить комбинацию вектора экспрессии HEF-chWS4L-gк для L цепи химерных антител WS-4 и варианта "а" H цепи реконструированных человеческих антител WS-4, оба были одновременно сотрансфицированы в клетки COS, и для полученных антител определяли количество произведенных антител и активность по связыванию антигена, используя метод, описанный в разделе "ELISA" в вышеприведенном примере 4. Активность по связыванию антигена не проявлялась у этих антител (chL/RVHa) (см. фиг. 4).
Как описано ранее, так как вариант "а" L цепи реконструированных человеческих антител WS-4 проявлял активность по связыванию антигена, равную активности L цепи химерных антител WS-4, оценку каждого варианта всех реконструированных H цепей выполняли путем одновременного трансфицирования клеток COS каждым вариантом реконструированной H цепи и вариантом "а" L цепи реконструированных человеческих антител WS-4 (RVLa).
Результат был таким, что эти антитела, имеющие варианты "b", "d", "e", "f", "g" и "h" реконструированной H цепи, проявляли активность по связыванию антигена, сравнимую с активностью химерных антител WS-4 (chL/chH), используемых в качестве положительного контроля, показывая таким образом, что эта комбинация формирует функциональный сайт связывания антигена у человеческих антител. Однако, что касается количества продуцируемых антител, все варианты продуцировались в меньшем количестве, чем химерные антитела WS-4 (chL/chH), за исключением варианта "g" (RVHg). Кроме того, активность по связыванию антигена не наблюдалась у антител, имеющих вариант "с" H цепи (см. фиг. 5).
На основании этих данных было сделано заключение, что антитела, имеющие вариант "a" L цепи реконструированных человеческих антител WS-4 (RVLa) и вариант "g" H цепи реконструированных человеческих антител WS-4, снова образуют функциональный сайт связывания антигена, который проявляет благоприятную активность по связыванию антигена, и что количество продуцируемых антител сравнимо с количеством химерных антител WS-4 (chL/chH) после одновременной трансфекции в клетки COS.
Затем оценка варианта "b" L цепи реконструированных человеческих антител (RVLb) производилась путем одновременного трансфицирования клеток COS каждым вариантом H цепи с вариантом "b" L цепи реконструированных человеческих антител WS-4 (RVLb). Результат показал, что только антитела, имеющие "g" вариант H цепи реконструированных человеческих антител (RVLb/RVHg), проявляли активность по связыванию антигена, сравнимую с активностью химерных антител WS-4 (chL/chH), использованных в качестве положительного контроля, и было сделано заключение, что это сочетание образует функциональный сайт связывания антигена в человеческих антителах. Кроме того, что касается количества продуцируемых антител, все варианты продуцировались в меньшей степени, чем химерные антитела WS-4 (chL/chH), за исключением варианта "g" (RVHg) (см. фиг. 6).
При вышеуказанной оценке два типа реконструированных человеческих антител (RVLa/RVHg и RVLb/RVHg), которые проявляли активность по связыванию с человеческим ИЛ-8, и степень продукции, сравнимые с активностью и продукцией химерных антител (chL/chH), соответственно очищали с помощью колонки с протеином А, после чего оценивали активность по связыванию, точно применяя метод, описанный в разделе по ELISA в примере 4. Результат показал, что химерные антитела (chL/chH), антитела RVLa/RVHg и антитела RVLb/RVHg, все проявляли ту же самую степень активности по связыванию (см. фиг. 7).
На основании этих данных было сделано заключение, что антитела, имеющие или вариант "a" (RVLa), или вариант "b" (RVLb) L цепи реконструированных человеческих антител WS-4, и вариант "g" (RVHg) H цепи реконструированных человеческих антител WS-4 снова образуют функциональный сайт связывания антигена, чей уровень активности по связыванию антигена и чей уровень продукции антител сравнимы с активностью и уровнем продукции, которые проявляют химерные антитела WS-4 (chL/chH), после одновременной трансфекции в клетки COS.
Ингибиторную активность в отношении связывания ИЛ-8 с ИЛ-8 рецепторами у реконструированных человеческих антител, состоящих из варианта "а" (RVLa) H цепи и варианта "g" (RVHg) H цепи реконструированных человеческих антител WS-4, или варианта "b" (RVLb) указанной L цепи и варианта "g" (RVHg) указанной H цепи, оценивали с помощью исследования по подавлению связывания с лигандным рецептором.
Примерно 100 мл образца гепаринизированной крови от нормальных субъектов наслаивали в виде 35 мл образцов на 15 мл моно-поли-разделяющего раствора (ICN Biomedicals), и слой человеческих нейтрофилов выделяли путем центрифугирования по предоставляемым инструкциям. После отмывания этих клеток средой RPMI-1640, содержащей 1% БСА, загрязняющие эритроциты удаляли с помощью 150 мМ раствора хлорида аммония. После центрифугирования клетки промывали средой RPMI-1640, содержащей 1% БСА, и ресуспендировали до концентрации 2 • 107 клеток/мл. Было обнаружено, что содержание нейтрофилов в этой клеточной суспензии составило 95% или более, по результатам количественного определения после окрашивания мазков образцов, полученных с использованием Cytospin (Shandon) с красителем Diff-Quik (Green Cross).
Вышеуказанную суспензию нейтрофилов центрифугировали и ресуспендировали до концентрации 2 • 107 клеток/мл с буфером для связывания (Д-ФБФР, содержащий 1% БСА и 0,1% азида натрия). В это время добавляли химерные антитела SK2, имеющие Fc часть, идентичную такой части человеческих антител данного изобретения (см. Международную патентную заявку N PCT/JP 94/00859) и антиген к нему, человеческий ИЛ-6, до концентраций, равных примерно 50 мкг/мл и примерно 40 нг/мл, соответственно, и инкубировали в течение 30 минут на ледяной бане с целью предварительного насыщения Fc рецепторов на нейтрофилах.
ИЛ-8, меченный радиоактивной меткой 125I (74 СБк/ммоль, Amersham) и немеченный ИЛ-8 (Amersham) готовили путем смешивания с буфером для связывания в концентрациях 4 нг/мл, каждый. Химерные антитела WS-4 (chL/chH), реконструированные человеческие антитела (RVLa/RVHg и RVLb/RVHg), человеческие антитела отрицательного контроля (PAESEL + LOREI) или мышиные антитела WS-4 положительного контроля соответственно разводили буфером для связывания до концентраций от 2000 нг/мл до примерно 8 нг/мл, серийно 2-кратными разведениями. 50 мкл раствора ИЛ-8 и 50 мкл раствора каждого антитела инкубировали в течение 30 минут на ледяной бане. Затем добавляли 100 мкл вышеуказанной суспензии нейтрофилов и инкубацию продолжали дополнительно в течение 1 часа при перемешивании каждые 15 минут. После инкубации суспензию клеток наслаивали на 200 мкл 20% раствора сахарозы с последующим центрифугированием и замораживанием. Чтобы количественно определить ИЛ-8, связанный с клетками, клеточный осадок отрезали и радиоактивность измеряли с помощью гамма-счетчика (Aroka). Эти результаты показаны на фиг. 8.
Четко показано, что антитела, имеющие вариант "a" L цепи (RVLa) и вариант "g" H цепи (RVHg) реконструированных человеческих антител WS-4, или вариант "b" указанной L цепи и вариант "g" указанной H цепи, обладают ингибирующей связывание активностью, сравнимой с активностью химерных антител (chL/chH) в отношении связывания ИЛ-8 с ИЛ-8 рецепторами.
Кроме того, Escherichia coli, имеющая вышеуказанную плазмиду HEF-RVLa-gк, была помещена на хранение как Escherichia coli DH5α (HEF-RVLa-gк), и Escherichia coli, содержащая плазмиду HEF-RVHg-gγ1 была помещена на хранение, как Escherichia coli JM109 (HEF-RVHg-gγ1) в Научно-исследовательский институт индустриальной технологии биоинженерии Агентства индустриальной науки и технологии (Bioengeneering Industrial Technology Research Institute of Agency of Industrial Science and Technology (1-1-3 Higashi, Tsukuba, lbaraki Japan) 12 июля 1994 г. под соответствующими названиями FERM ВР-4738 и FERM ВР-4741 на основании положений Будапештской конвенции.
Справочный пример 1: Получение гибридомы WS-4
Гибридому, которая продуцирует моноклональные антитела к человеческому ИЛ-8, получали путем слияния клеток селезенки мышей BALB/c, иммунизированных человеческим ИЛ-8, и клеток мышиной миеломы P3 х 63 -Ag8.653 по обычным методикам с использованием полиэтиленгликоля. Отбор производили, используя активность по связыванию с человеческим ИЛ-8 в качестве критерия для подтверждения гибридомы WS-4 (Ко Y.C., et al., J. Immunol. Methods, 149, 227-235, 1992).
Данное изобретение представляет реконструированные человеческие антитела к человеческому ИЛ-8, и в этих антителах, CDR V области человеческих антител замещается CDR мышиных моноклональных антител к человеческому ИЛ-8. Так как большая часть этого реконструированного человеческого антитела имеет человеческое происхождение, а CDR по своей природе обладает низкой антигенностью, реконструированные человеческие антитела данного изобретения имеют низкую антигенность для людей, и по этой причине можно ожидать, что они будут применимы в медицине для лечения.
Перечень микроорганизмов, помещенных на хранение по положениям статьи 13 бис Договора о патентной кооперации Международного сообщества хранилищ:
Название: Национальный институт биологических наук и Агентство по технологии, касающейся человека индустриальной науки и технологии National Institute of Bioscience and Human Technology Agency of Industrial science and Technology
Адрес: 1-3 Higashi 1-chome, Taukuba, lbaruki, Japan
Регистрационные номера хранилища и даты поступления на хранение:
1) Escherichia coli DH5α (HEF-RVLa-gк)
Номер хранения: FERM ВР-4738
Дата поступления: 12 июля 1994 г.
2) Escherichia coli DH5α (HEF-chWS4L-gк)
Номер хранения: FERM BP-4739
Дата поступления: 12 июля 1994 г.
3) Escherichia coli JM109 (HEF-chWS4H-gγ1)
Номер хранения: FERM ВР-4740
Дата поступления: 12 июля 1994 г.
4) Escherichia coli JM109 (HEF-RVHg-gγ1)
Номер хранения: FERM BP-4741
Дата поступления: 12 июля 1994 г.

























































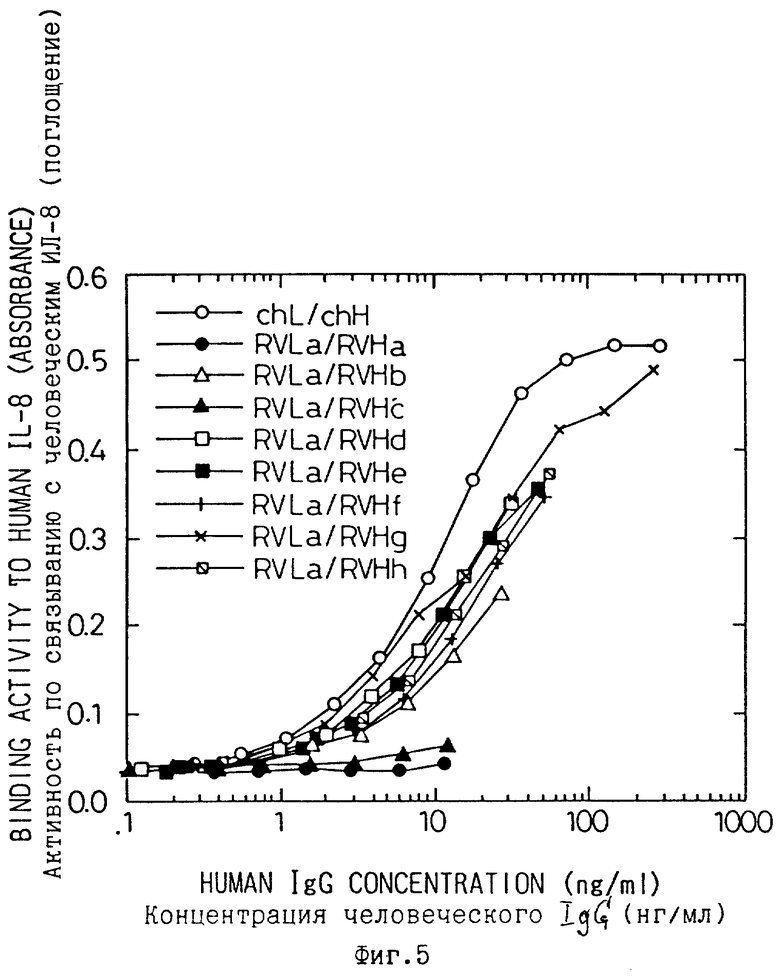


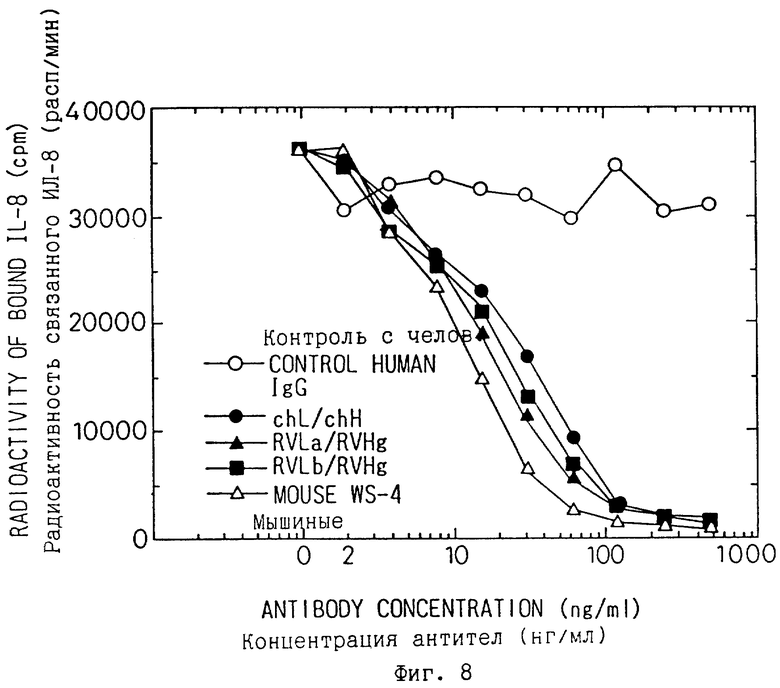
Изобретение касается реконструированных человеческих антител к человеческому ИЛ-8. Большая часть реконструированного антитела происходит из человеческого антитела, a CDR обладает низкой антигенностью для человека. Реконструированное человеческое антитело кодируется ДНК-последовательностью, входящей в вектор экспрессии. Реконструированные человеческие антитела данного изобретения обладают низкой антигенностью для людей и поэтому они могут применяться для терапии в медицине. 11 с. и 4 з.п. ф-лы, 8 ил., 5 табл.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
Авторы
Даты
2000-11-27—Публикация
1995-07-12—Подача