Изобретение относится к области клинической лабораторной диагностики и может найти применение в гинекологии, андрологии и эндокринологии для постановки диагноза при заболеваниях аутоиммунного характера, либо при системной патологии.
Известен лабораторный метод диагностики патологии аутоиммунного характера у женщин, описанный в статье "Circulating antiovarian antibodies in premature ovarian failure", Damewood M.D., Zacur H., Hoffmann G.J., Rock J. A. // Obstetrics and Gynecology, New York, Elsevier, 1986, v. 68, 6, Dec., p. 850-854. (Циркулирующие антиовариальные антитела при преждевременной овариальной недостаточности, Деймвуд М.В., Закур X., Хоффман Г.Дж., Рок Дж.А. //Акушерство и гинекология, Нью-Йорк. Эльзевир, 1986, т. 68, 6, декабрь, с. 850-854). Данный метод является непрямым иммунофлюоресцентным. При осуществлении этого метода ткань нормальных яичников женщин получали путем лапароскопии. Материал быстро замораживали в 100% алкоголе с сухим льдом и делали срезы в криостате. Срезы толщиной 6 мкм помещали на предметные стекла, предварительно обработанные 0,5% желатиной. В данном случае выполнявшие функцию антигена срезы высушивали в течение 1-2 минут и помещали на 10 минут в глициновый буферный раствор, содержащий 0,1% желатины, после чего промывали дистиллированной водой. Разведенные (от 1/4 до 1/32) буферным раствором образцы исследуемых сывороток крови, содержащие циркулирующие антиовариальные антитела, наносили на предметное стекло по 50 мкл, инкубировали 30 минут при 37oС во влажной камере, после чего промывали 5 раз глициновым буферным раствором. Далее добавляли аффинно-очищенные поливалентные козьи антитела против иммуноглобулинов человека, меченные флюоресцин-изотиоцианатом в разведении 1/16 и инкубировали 30 минут, после чего промывали. Затем на предметное стекло помещали каплю 50% глицерина на фосфатно-солевом буферном растворе и каплю накрывали покровным стеклом. Реакцию оценивали визуально под микроскопом по интенсивности свечения в баллах от 1+(слабое) и 2+(умеренное) до 4+(яркое), что соответствовало низкому, среднему и высокому содержанию специфичных антител. Отсутствие свечения расценивали как отсутствие антител. В результате оценки получали возможность констатировать наличие или отсутствие антиовариальных антител в сыворотке крови.
Известен также лабораторный метод диагностики патологии аутоиммунного характера у женщин, описанный в статье "Ovarian antibodies detected by immobilized antigen immunoassay in patients with premature ovarian failure" Luborsky J.L., Visitin I., Boyers S., Asari Т., Caldwell В., DeCherney A.// Joural of Clinical Endocrinology and Metabolism, 1990, vol. 70, 1, р. 69-75, Lippincot, Philadelphia, Pennsilvania, USA. ("Определение овариальных антител у пациентов с преждевременной недостаточностью яичников путем иммуноанализа с иммобилизованным антигеном". Люборский Дж.Л., Визитин И., Бойерс С., Асари Т., Колдуэлл Б., Де-Чирни А. //Журнал клинической эндокринологии и метаболизма, 1990, т. 70, 1, с. 69-75, Липинкот, Филадельфия, США). В данной статье описан метод исследования сывороток крови 45 женщин путем проведения твердофазного иммуноферментного анализа (ТИФА). Обследовались женщины (нормальный кариотип, возраст менее 40 лет) с клиническими проявлениями недостаточности яичников (патология аутоиммунного характера), у которых наблюдалось нарушение менструального цикла и/или отклонение гормонального фона. Одновременно исследовали сыворотки крови (биологическая жидкость, содержит специфичные антитела к овариальному антигену) 19-ти здоровых женщин-добровольцев с нормальным менструальным циклом, которые составляли контрольную группу. Нормальные яичники женщин (содержат овариальный антиген) были получены в ходе операции гистеротомии.
Реагенты и расходные материалы, используемые при проведении ТИФА:
1. Микропланшет для ТИФА с адсорбированным на поверхности лунок антигеном.
2. Бычий сывороточный альбумин (БСА) для блокирования неспецифических центров связывания.
3. Стандартный фосфатно-солевой буферный раствор (ФСБ), а также ФСБ с добавлением 0,05% детергента "Тритон Х-100" (ФСБ-Т).
4. Антитела козьи против легких и тяжелых цепей иммуноглобулинов класса "IgG" человека, меченные щелочной фосфатазой - иммуноферментный конъюгат (ИФК).
Антиген приготовляли следующим образом.
Яичники собирали в ФСБ, нарезали на куски размером 3-4 мм и быстро замораживали на сухом льду (твердый диоксид углерода). В ацетоновой бане с сухим льдом приготовляли гомогенат яичников путем растирания кусочков ткани до порошкообразного состояния. Полученный гомогенат ткани яичников дважды промывали раствором ФСБ, и крупные агрегаты клеточных компонентов удаляли центрифугированием. Для дальнейшего использования суспензию гомогената ткани яичников разводили до конечной концентрации 0,1 мг/мл общего белка. Антиген адсорбировали на поверхности лунок микропланшетов. Использовали 96-луночные микропланшеты для ТИФА. После адсорбции антигена в лунках избыток раствора гомогената яичника удаляли резким встряхиванием микропланшета, и неспецифические центры связывания блокировали 3% раствором БСА в буферном растворе для промывки (0,15 мл, 16 часов; 4oС).
Проведение ТИФА:
1. В часть лунок микропланшета вносили по 0,1 мл образцов контрольных сывороток крови, в остальные лунки вносили образцы сывороток крови пациентов с недостаточностью яичников.
2. Образцы инкубировали в течение 0,5-2 часов при 22oС.
3. Содержимое лунок микропланшета удаляли резким встряхиванием и лунки промывали два раза ФСБ-Т и четыре раза дистиллированной водой.
4. Во все лунки микропланшета вносили по 50 мкл ИФК и инкубировали при 22oС в течение 2-х часов.
5. Удаляли содержимое лунок и промывали лунки микропланшета аналогично п.3.
6. Цветную реакцию осуществляли добавлением специфического субстрата щелочных фосфатаз: 1 мг/мл п-нитрофенилфосфата в 1 М растворе диэтаноламина с добавлением 0,24 мМ хлорида магния при рН, доведенном до 9,8.
7. Результаты цветной реакции измеряли с помощью вертикального оптического абсорбциометра при длине волны 405 нм, показатели цветной реакции были выражены в единицах оптической плотности (ОП).
Оценку результатов проводили, принимая ОП образцов сывороток крови здоровых женщин за величину "cut off", то есть образцы, имеющие показатель ОП ниже этой величины принимали за отрицательные и обозначали "-"; тогда как образцы, у которых данный показатель превышал "cut off", принимали за положительные и обозначали "+". Окончательные результаты были представлены в альтернативной форме, то есть обозначались как положительные или отрицательные (соответственно + или -). Величину ОП=0,27, по мнению авторов, следует считать "пограничной" и образцы с более высокими показателями ОП считали положительными, то есть в таких образцах регистрировали наличие специфичных антител. Описанный метод, принятый за ближайший аналог, также как и аналог, дает возможность констатировать наличие или отсутствие специфичных антител в сыворотке крови, но не измерять их концентрацию.
Изобретение направлено на получение диагностических показателей, позволяющих с высокой степенью достоверности свидетельствовать о заболевании (патологии) аутоиммунного характера. Предложенный метод позволяет выявить и диагностировать аутоиммунные патологии при нарушениях развития половой и эндокринной сферы не только у женщин, но и у мужчин, а также при системных заболеваниях у лиц обоего пола.
Решение поставленной задачи базируется на проведении традиционного ТИФА и реализуется за счет принципиально нового подхода к способу получения антигена, основанному на выделении из образцов тканей стероид-продуцирующих клеток, ответственных за иммунные реакции, с последующей дополнительной очисткой субклеточных фракций, а также за счет применения принципа построения калибровочной кривой методом последовательных разведении.
Традиционный ТИФА включает химическое связывание антигена с поверхностью микропланшета с последующим помещением биологической жидкости, содержащей антитела, на микропланшет, инкубирование, проведение цветной реакции и спектрофотометрическую оценку показателей цветной реакции. При этом получают целевой антиген, подвергая ферментативному гидролизу соответствующие образцы нормальных тканей человека, содержащих стероид-продуцирующие клетки: овариальный антиген получают из яичников женщин, тестикулярный - из половых желез мужчин, антиген надпочечников - из корковой зоны надпочечников. Реакцию ферментативного гидролиза останавливают добавлением хелатирующего агента. Полученную смешанную суспензию клеток подвергают центрифугированию в ступенчатом градиенте плотности, в результате чего изолируют стероид-продуцирующие клетки, которые затем подвергают деструкции путем повторения процедуры "замораживание-оттаивание" не менее 4-х раз и процедуру "оттаивание" сочетают с обработкой ультразвуком. Полученную после деструкции взвесь клеточных компонентов центрифугируют, осаждая балластные клеточные фракции, а содержащуюся в надосадочной жидкости микросомальную фракцию используют в качестве целевого антигена, который в выбранных разведениях ковалентно связывают с поверхностью лунок микропланшета, затем в серию лунок вносят в заданных разведениях калибровочный материал, приготовленный на основе стандартного препарата специфичных к соответствующему целевому антигену антител, в другую серию лунок - исследуемые пробы биологической жидкости и после проведения традиционного ТИФА по спектрофотометрическим показателям строят калибровочную кривую и по ней определяют концентрацию специфичных антител.
Данный способ позволяет установить "базовый" (нормальный) уровень аутоантител, специфичных к антигенам стероид-продуцирующих клеток человека, а также произвести количественную оценку в условных единицах (Е/мл) уровня концентраций естественных (природных) аутоантител к антигенам фолликулярных клеток яичника у женщин (овариальный антиген), клеток Лейдига у мужчин (тестикулярный антиген), и стероид-продуцирующих клеток надпочечника (антиген надпочечника) у пациентов обоего пола. Уровень таких антител выше "базового" свидетельствует о заболевании (патологии) аутоиммунного характера. Установление высокого уровня специфичных аутоантител служит основанием для постановки диагноза соответственно аутоиммунного оофорита у женщин (концентрация антител к овариальному антигену выше 260 Е/мл), аутоиммунного орхита у мужчин (концентрация антител к тестикулярному антигену выше 310 Е/мл), и системного заболевания - полигландулярного синдрома у пациентов обоего пола (концентрация антител к антигену надпочечника выше 350 Е/мл).
Выделенный описанным выше образом целевой антиген представляет собой определенный и постоянный набор белков и гликопротеинов, которые способны в опыте связывать специфичные антитела, при этом антиген постоянного биохимического состава может быть получен многократно. Кроме того, появляется возможность единовременного обследования большого количества проб (до 40 анализов), а также получение относительно больших (до 400 мг) количеств готового антигена и его длительное хранение (до 1 года) в замороженном состоянии; в то время как метод, выбранный в качестве ближайшего аналога, требует "штучного" изготовления антигена при проведении каждой серии опытов в силу иммунохимической разнородности исходного материала (тканей надпочечников, женских и мужских гонад).
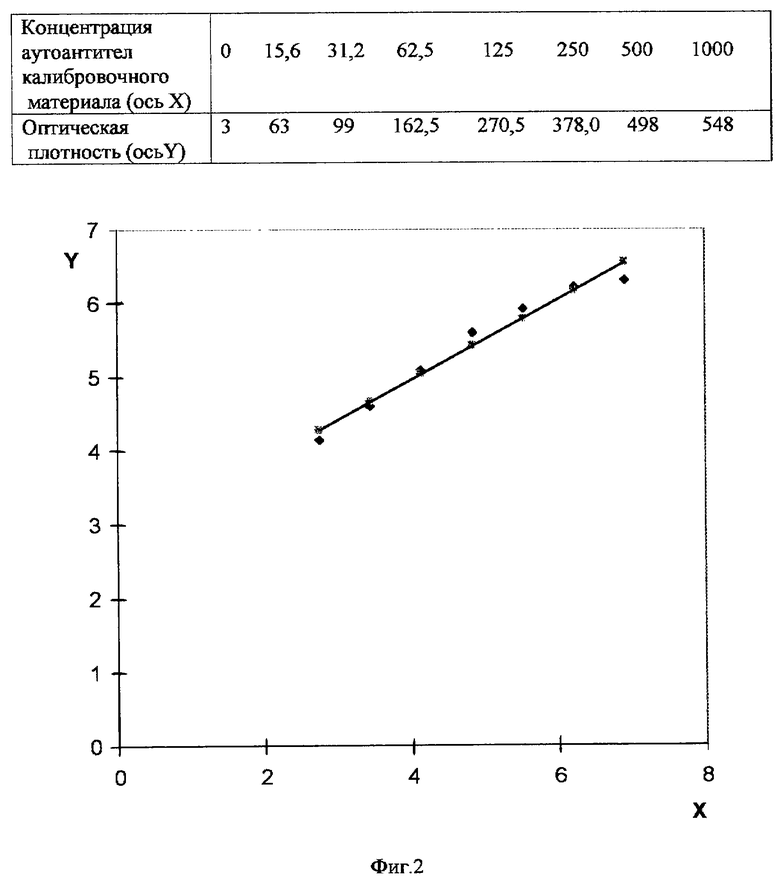
На фиг. 1 представлена схема нанесения калибровочного материала в лунки микропланшета. На фиг.2 представлен пример построения калибровочной кривой.
Способ осуществляется следующим образом.
Образцы нормальных (без патологии) тканей, содержащих стероид-продуцирующие клетки, получают в результате хирургического вмешательства - яичники женщин - путем операции лапароскопии, половые железы мужчин - при хирургической операции изменения пола, образцы корковой зоны надпочечников - при операции частичной адреналэктомии. Образцы тканей подвергают ферментативному гидролизу в стандартном температурном режиме для данного фермента (37oС для бактериальной коллагеназы) до появления видимых признаков мацерации (20-35 минут для образцов женских и мужских гонад, 30-40 минут для образцов надпочечников), после чего реакцию продолжают еще 10 минут. В качестве фермента используют очищенную бактериальную коллагеназу (коммерческий препарат "коллализин" производства НИИ вакцин и сывороток, С.-Петербург, РФ). Реакцию ферментативного гидролиза останавливают добавлением хелатирующего агента и инкубируют 30 минут при постоянном помешивании. В качестве хелатирующего агента используют этилен-диамин-тетраацетат-динатриевую соль (ЭДТА-2Na) в концентрации 0,5%. Полученную смешанную суспензию клеток продавливают сквозь нейлоновое сито, концентрируют центрифугированием и затем подвергают центрифугированию в ступенчатом градиенте плотности среды, в результате чего изолируют стероид-продуцирующие клетки. Изолированные стероид-продуцирующие клетки подвергают деструкции путем повторения процедуры "замораживание-оттаивание" не менее 4-х раз и процедуру "оттаивание" сочетают с обработкой ультразвуком. Для оптимального выхода целевого антигена достаточно повторения вышеописанной процедуры 10 раз. После деструкции балластные клеточные фракции осаждают центрифугированием, а микросомальную фракцию в надосадочной жидкости используют в качестве целевого антигена.
Для формирования ступенчатого градиента плотности используют растворы фиколла-400 различной концентрации на основе ФСБ с добавлением лошадиной сыворотки до конечной концентрации 1% (возможно также применение перколла или другого аналогичного полимерного реагента). Процедуру изолирования клеток гранулезного слоя фолликулов женщин проводят при 5000g в течение 2-х часов в 14% растворе фиколла-400, изолирование клеток Лейдига половых желез мужчин - при 5000g в течение 2-х часов в 13% растворе фиколла-400, и выделение стероид-продуцирующих клеток надпочечника человека при - 4500g 2,5 часа в 15% растворе фиколла-400. Данные режимы центрифугирования обеспечивают наиболее эффективное изолирование клеток соответствующего типа.
Полученный описанным выше способом целевой антиген ковалентно связывают с поверхностью лунок микропланшета согласно общепринятым методам [Нго Т.Т., Ленхофф Г. (ред.) Иммуноферментный анализ. Пер. англ., М., "Мир", 1988, с. 172-192, /1/]. Для связывания с поверхностью лунок целевой антиген разводят 1% раствором бикарбоната аммония до конечной концентрации общего белка: овариальный антиген - до 1 мкг/мл, тестикулярный антиген - до 2 мкг/мл и антиген надпочечника - до 500 нг/мл. В качестве связывающего (сшивающего) бифункционального агента используют 0,25% раствор глутарового альдегида. После завершения реакции связывания микропланшет промывают и высушивают при 37oС в течение 3-х часов. Процедуру твердофазного иммуноферментного анализа проводят в традиционном варианте [/1/, с. 193-209]. В качестве исследуемой биологической жидкости, кроме сыворотки крови, могут быть использованы амниотическая жидкость, спинно-мозговая жидкость и т.п.
Реагенты и расходные материалы, используемые, при проведении ТИФА:
1. Микропланшет для проведения иммуноферментной реакции с нанесенным антигеном, приготовление которого описано выше;
2. Стандартный раствор для промывки микропланшетов (ПР), который готовят следующим образом: к стандартному раствору ФСБ добавляют неионный детергент твин-20 до конечной концентрации 0,05%;
3. Стандартный препарат антител готовят из предварительно отобранных сывороток крови пациентов, у которых выявлены антитела, специфичные к соответствующему антигену (овариальному, тестикулярному или антигену надпочечника человека), демонстрирующие в ТИФА оптическую плотность не менее "0,9". Отобранные образцы сывороток крови человека сливают вместе (делают "пул") и выделяют иммуноглобулиновую фракцию путем ионообменной хроматографии согласно общепринятой методике [Х. Фримель (ред.). "Иммунологические методы". Пер. нем., М., "Медицина", 1987]. Затем методом последовательных разведений [/1/, с. 222-224. ] определяют минимальное количество специфичных антител, которое дает реакцию в ТИФА с 10 нг связанного с поверхностью микропланшета соответствующего антигена. Определенное таким образом количество антител обозначают как единицу "Е" стандартного препарата антител. Иммуноглобулиновую фракцию доводят до концентрации 25000 Е/мл и используют в качестве стандартного препарата антител соответствующей специфичности.
4. Иммуноферментный конъюгат (ИФК) - в качестве иммуноферментного конъюгата используют моноклональные антитела, меченные пероксидазой хрена, со специфичностью к иммуноглобулинам соответствующего класса (IgG, IgM, IgA) или всех классов (специфичность к каппа- и лямбда - цепям иммуноглобулинов). В анализе были использованы моноклональные антитела производства лаборатории биотехнологии моноклональных антител Центрального рентгено-радиологического института (ЦНИРРИ, С.-Петербург, РФ).
5. Дилюент - растворитель (ДЛ) для разведения калибровочного материала, приготовленного на основе стандартного препарата антител, проб исследуемых биологических жидкостей и иммуноферментного конъюгата. ДЛ готовят путем добавления к ПР стерильной лошадиной сыворотки до конечной концентрации 1%.
6. Субстратная смесь - любой химический субстрат для проявления ферментативной пероксидазной реакции, например коммерческий препарат орто-фенилен-диамин (ОФД) в таблетках по 5 мг.
Подготовка реагентов и исследуемых проб к работе:
1. Приготовление калибровочного материала: стандартный препарат антител соответствующей специфичности разводят в 25 раз (например, при использовании одного микропланшета к 250 мкл ДЛ добавляют 10 мкл стандартного препарата антител) и далее последовательными разведениями в 2 раза получают соответственно образцы для калибровки в 1000; 500; 250, 125; 62,5; 31,5 и 15,6 Е/мл.
2. Исследуемые пробы разводят в зависимости от концентрации антител в конкретных биологических жидкостях в 25-100 раз, например образцы сывороток крови разводят в 50 раз, то есть 5 мкл сыворотки крови разводят в 250 мкл ДЛ.
3. Приготовление рабочего раствора ИФК: исходный коммерческий раствор ИФК разводят ДЛ согласно рекомендациям изготовителя, используемые ИФК производства ЦНИРРИ разводят в 150 раз, например при использовании в опыте 1 микропланшета к 70 мкл коммерческого раствора ИФК добавляют 10500 мкл ДЛ.
4. Приготовление субстратной смеси: субстратную смесь приготовляют согласно рекомендациям изготовителя, например, при использовании ОФД для приготовления рабочего раствора одну таблетку ОФД в 5 мг растворяют в 10 мл 0,1 М цитратного буферного раствора (рН 5,0) и добавляют 70 мкл стандартного 5%-го раствора пергидроля.
Проведение ТИФА:
1. В лунки микропланшета вертикальных рядов 1 и 2 вносят по 100 мкл калибровочного материала в возрастающем порядке концентраций: 0 (холостая проба чистый ДЛ); 15,6; 31,5; 62,5; 125; 250; 500 и 1000 Е/мл (фиг.1). Причем материал каждой концентрации вносят в параллели в две соседние лунки одного вертикального ряда, например калибровочный материал 15,6 Е/мл вносят в лунки "С" и "D" ряда "1" и т.д. В лунки вертикальных рядов с 3 по 12 вносят также попарно в параллели по 100 мкл разведенных образцов исследуемых биологических жидкостей, например, одну пробу вносят в лунки "А" и "В" вертикального ряда "3" (фиг.1).
2. Микропланшет с внесенным калибровочным материалом и исследуемыми пробами накрывают крышкой и инкубируют в термостате при 45oС в течение 40 минут.
3. Содержимое лунок микропланшета удаляют резким встряхиванием и промывают лунки 6 раз ПР.
4. Во все лунки микропланшета вносят по 100 мкл свежеприготовленного рабочего раствора ИФК, накрывают микропланшет крышкой и инкубируют в термостате при 45oС в течение 40 минут.
5. Лунки микропланшета промывают аналогично п.3.
6. Во все лунки микропланшета вносят по 100 мкл свежеприготовленного (непосредственно перед употреблением) рабочего раствора субстратной смеси для проявления цветной реакции.
7. Микропланшет помещают в темное место и инкубируют при комнатной температуре приблизительно 10-15 минут до видимого визуального проявления "ступенчатой" окраски в лунках с калибровочным материалом. В остальных лунках проявляется окраска в зависимости от количества содержащихся в пробах специфичных антител.
8. Цветную реакцию останавливают добавлением в каждую лунку по 50 мкл 9%-ной серной кислоты.
9. Результаты цветной реакции измеряют количественно с помощью вертикального оптического абсорбциометра (например, "Униплан". АО "Пикон", Россия).
Расчет результатов: концентрацию специфичных антител в условных единицах (Е/мл) рассчитывают с помощью пакета программ типа "FIA-CALC" (фирма "Wallac", Финляндия) в режиме построения калибровочной кривой в двойных логарифмических координатах (Log/Log) с выравниванием кривой по методу "сплайн" интерполяции. Результаты можно также рассчитать посредством ручного построения графика калибровочной кривой в двойном логарифмическом масштабе с последующим нахождением искомых результатов на графике (фиг.2) [Чард Т. Радиоиммунные методы, М., "Мир", 1981].
Лабораторные исследования, проведенные на базе НИИ акушерства и гинекологии РАМН им. Д.О.Отта (С.-Петербург) и Медицинской академии последипломного образования (С. -Петербург), показали, что "базовый" уровень нормальных аутоантител у здоровых людей составляет для овариального антигена 260 Е/мл, для тестикулярного антигена 310 Е/мл и для антигена надпочечника 350 Е/мл.
Пример 1. Больной К., анамнез - с 15-ти лет наблюдался, обследовался и лечился у эндокринолога, предварительный диагноз - задержка полового и физического развития, с 16-ти лет получал хорионический гонадотропин в качестве терапии. Результаты лабораторных исследований гормонального фона в пределах нормы. Функциональная проба с хорионическим гонадотропином - отрицательная (повышение уровня тестостерона на пробу не произошло). Содержание тестикулярных антител - 1398 Е/мл. Окончательный диагноз: аутоиммунный орхит на фоне нормогонадотропного гипогонадизма.
Пример 2. Больная Ш., возраст 22 года; жалобы при обращении - нарушение менструального цикла.
Результаты лабораторных исследований 20/06/2001: концентрация овариальных антител - 324 Е/мл. Назначена терапия дексаметазоном. Повторное лабораторное исследование 20/09/2001 - 230 Е/мл, месячные с сильными болями, больная направлена на УЗИ-исследование органов малого таза. Результаты УЗИ-исследования: синдром поликистозных яичников, вероятно аутоиммунной природы.
Пример 3. Больная П. , 31 год. Жалобы при обращении: отделяемое - из молочных желез, боли в области малого таза. Перенесенные гинекологические заболевания: хламидиоз, молочница, аменорея. Результаты лабораторного обследования функции щитовидной железы показали незначительное превышение нормы тиреоглобулина. Больная обратилась 6/06/2001 для обследования. При лабораторном обследовании 26/06/2001 выявлено высокое содержание овариальных антител 720 Е/мл. Назначена терапия препаратом "Вобензим", результаты повторного лабораторного обследования на овариальные антитела - 389 Е/мл. Больная направлена на лапароскопию, окончательный диагноз на основании лапароскопического исследования: недостаточность яичников на фоне аутоиммунного оофорита.
Таким образом, предлагаемый метод определения аутоантител демонстрирует высокую степень соответствия с данными клинической и гистологической диагностики. Кроме того, метод позволяет получать сравнимые между собой количественные показатели и не требует оперативного вмешательства.
Изобретение относится к медицине и может быть использовано для количественного определения концентрации антител, специфичных к антигенам стероид-продуцирующих клеток человека, в биологических жидкостях человека, содержащих специфичные антитела. Проводят твердофазный иммуноферментный анализ (тИФА). Соответствующие образцы нормальных тканей человека, содержащих стероид-продуцирующие клетки, подвергают ферментативному гидролизу в стандартном режиме до появления видимых признаков мацерации. Затем обрабатывают ткани хелатирующим агентом и центрифугированием в ступенчатом градиенте плотности изолируют стероид-продуцирующие клетки, которые подвергают деструкции путем повторения процедуры "замораживания-оттаивания" не менее 4 раз и процедуру "оттаивания" сочетают с обработкой ультразвуком. Центрифугированием отделяют микросомальную фракцию стероид-продуцирующих клеток, которую используют в качестве целевого антигена. Последний в выбранных разведениях ковалентно связывают с поверхностью лунок микропланшета. В серию лунок вносят калибровочный материал, в другую серию лунок исследуемые пробы биологической жидкости. Проводят тИФА и по спектрофотометрическим показателям строят калибровочную кривую, по которой определяют концентрацию специфичных антител. Способ позволяет повысить эффективность метода. 2 ил.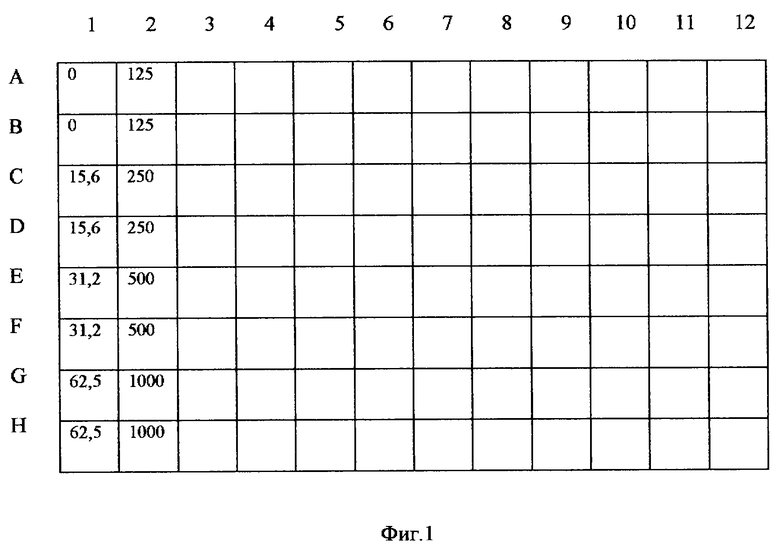
Способ количественного определения концентрации антител, специфичных к антигенам стероид-продуцирующих клеток человека, в биологических жидкостях человека, содержащих специфичные антитела, включающий проведение твердофазного иммуноферментного анализа путем нанесения на микропланшет антигена с последующим помещением исследуемой биологической жидкости на планшет, инкубирование, проведение цветной реакции и спектрофотометрическую оценку показателей цветной реакции, отличающийся тем, что целевой антиген стероид-продуцирующих клеток человека получают, подвергая соответствующие образцы нормальных тканей человека, содержащих стероид-продуцирующие клетки, ферментативному гидролизу в стандартном режиме до появления видимых признаков мацерации, с последующей обработкой тканей хелатирующим агентом, из полученной смешанной суспензии клеток центрифугированием в ступенчатом градиенте плотности изолируют стероид-продуцирующие клетки, которые подвергают деструкции путем повторения процедуры "замораживания-оттаивания" не менее четырех раз и процедуру "оттаивания" сочетают с обработкой ультразвуком, из полученной в результате деструкции взвеси клеточных компонентов центрифугированием отделяют микросомальную фракцию стероид-продуцирующих клеток, которую используют в качестве целевого антигена, который в выбранных разведениях ковалентно связывают с поверхностью лунок микропланшета, затем в серию лунок вносят в заданных разведениях калибровочный материал, приготовленный на основе стандартного препарата антител соответствующей специфичности, в другую серию лунок - исследуемые пробы биологической жидкости, и после проведения твердофазного иммуноферментного анализа по спектрофотометрическим показателям строят калибровочную кривую и по ней определяют концентрацию специфичных антител.
| LUBORSKY J.L | |||
| and ect | |||
| Ovarian antibodies detected by immobilized antigen immunoassay in patients with premature ovarian failure, Journal of Clinical Endocrinology and Metabolism, 1990, vol.70, № 1, p.69-75 | |||
| АНТИГЕННЫЕ ПЕПТИДЫ, СПОСОБ ОБНАРУЖЕНИЯ ВЫДЕЛЯЕМЫХ ОПУХОЛЯМИ ЧАСТИЦ | 1993 |
|
RU2141969C1 |
| ФИЛЛИПОВИЧ Ю.Б | |||
| Основы биохимии | |||
| - М., 1969, с.31. | |||
Авторы
Даты
2003-11-20—Публикация
2002-01-11—Подача