Данное изобретение относится к новым цитотоксическим алкалоидам, Асмарину А и Асмарину В, выделенным из губки Raspailia sp.
Предпосылки изобретения
Морские организмы, в особенности мягкие кораллы, губки и оболочечники, производят множество вторичных метаболитов и демонстрируют различную степень биологической активности (Faulkner, D. Nat. Prod. Rep. 1997, 14, 259-302). Эти метаболиты принадлежат к семейству дитерпеновых алкалоидов; в 1984 году Nakamura, H. et al. Tetrahedron lett. 1984, 25, 2989-2992 была опубликована структура четырех агелазинов: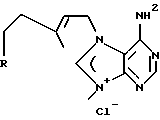
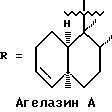
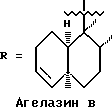
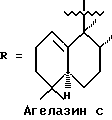
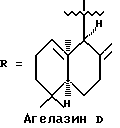
Мы выделили из губки Raspalia sp. новые цитотоксические дитерпеновые алкалоиды, принадлежащие к семейству агелазинов.
Краткое описание изобретения
Данное изобретение представляет новые дитерпеновые алкалоиды, имеющие структуру, представленную формулой (I) или формулой (II):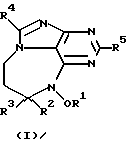
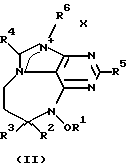
где R1 представляет либо водород, либо низкомолекулярный алкил, либо низкомолекулярный алканоил; R2 представляет водород либо низкомолекулярный алкил; R3 является либо алкилом, либо циклоалкиловой группой, содержащей один или несколько остатков изопрена, либо монотерпеном, либо гексотерпеном, либо гексотерпеновой или дитерпеновой группой; R4 или R5 представляют собой водород либо низкомолекулярный алкил; R6 является низкомолекулярным алкилом; Х представляет собой F, Сl, Вr или I.
В определениях групп в формулах (I) и (II) низкомолекулярный алкил и низкомолекулярный алкильный остаток низкомолекулярного алканоила представляют собой неразветвленную или разветвленную алкильную группу, содержащую от одного до шести атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, sec-бутил, трет-бутил, пентил, неопентил и гексил.
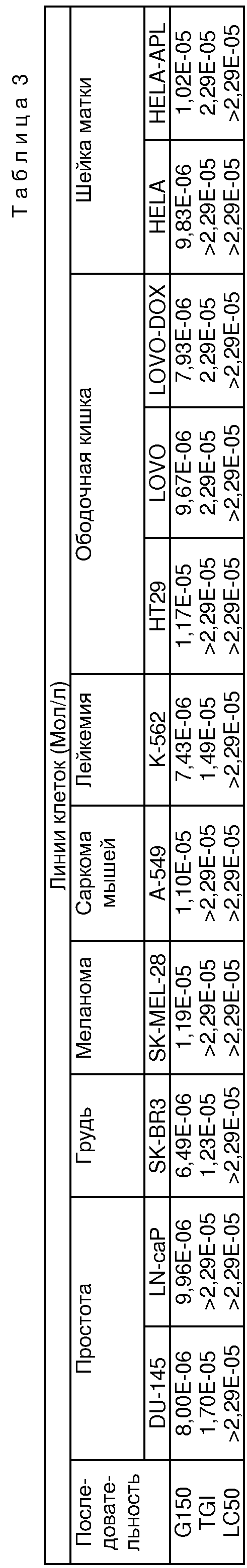
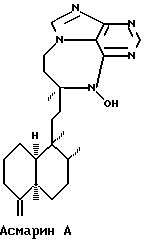
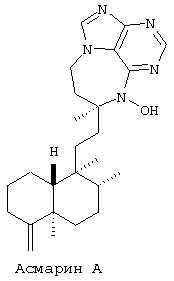
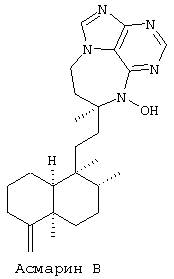
Более точно, данное изобретение относится к Асмарину А и Асмарину В, экстрагированным и выделенным из губки Raspailia sp. Структуры этих соединений показаны ниже: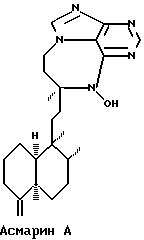
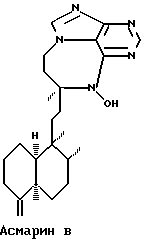
Пространственная структура показана для относительной конфигурации в обоих классах.
Асмарин А и Асмарин В демонстрируют противоопухолевое действие. В особенности Асмарин А и Асмарин В демонстрируют свое противоопухолевое действие против клеточных культур, взятых из солидных опухолей человека, таких как карцинома легкого человека, карцинома толстой кишки человека, меланома человека, и, подобным же образом, они активны в борьбе с другими линиями опухолевых клеток, например лейкемией и лимфомой.
Данное изобретение также предоставляет метод лечения млекопитающего, пораженного злокачественной опухолью, чувствительной к соединению, содержащему вещество формулы (I) либо формулы (II), состоящий в введении терапевтически эффективного количества соединения, имеющего формулу (I) или (II), либо их фармацевтической композиции.
В данном изобретении далее описывается фармацевтические композиции, которые содержат в качестве активного ингредиента вещество, имеющее формулу (I) или (II), а также описан процесс их приготовления.
Еще одним аспектом данного изобретения является метод получения веществ Асмарин А и Асмарин В, который включает в себя экстрагирование и выделение из губки Raspailia sp.
Примеры фармацевтических композиций включают все твердые (таблетки, пилюли, капсулы, гранулы и т.д.) и жидкие (растворы, суспензии, эмульсии) формы с подходящими схемами орального, местного или перентерального введения и они могут включать в себя чистое вещество либо его комбинацию с любым носителем либо другими фармакологически активными веществами. При перантеральном введении данные композиции должны быть простерилизованы.
Корректная дозировка фармацевтических композиций, содержащих вещества с формулами (I) или (II) будет изменяться в зависимости от фармацевтической формы, способа применения и конкретного организма, места и обрабатываемой опухоли. Также должны приниматься в расчет и другие факторы, такие как возраст, вес тела, пол, диеты, время введения препарата, уровень экскреции, состояние организма, сочетание лекарственных средств, чувствительность реакции и тяжесть заболевания. Введение препарата может осуществляться непрерывно либо периодически в пределах максимальной переносимой дозы.
Противоопухолевое действие
Клетки содержались в логарифмической фазе роста в Минимальной основной среде Eagle, содержащей сбалансированные соли Earle с 2,0 мМ L-глютамином, с заменимыми аминокислотами, в отсутствие бикарбоната натрия (ЕМЕМ/neaa); в среду добавлялась 10% фетальная телячья сыворотка, 10-2 М бикарбоната натрия и 0,1 г/л пенициллина-G и стрептомицина сульфата.
Была проведена процедура отбора для определения и сравнения противоопухолевой активности данных соединений с применением адаптированной формы метода, описанного Бергероном и др. (Raymond J. Bergeron et al. Biochem. Bioph. Res. Comm. 1984, 121, 848). В качестве противоопухолевых использовались клетки Р-388 (суспензированная культура лимфоидной неоплазмы мыши DBA/2), А-549 (монослойная культура карциномы легкого человека), НТ-29 (монослойная культура карциномы толстой кишки человека) и MEL-28 (монослойная культура меланомы человека).
Клетки Р-388 были посеяны в 16-миллиметровых чашках в количестве 1•104 клеток на чашку в 1 мл аликвотах MEM 5FCS, содержащих указанное количество препарата. Отдельный комплект культур, не содержащих препарат, был посеян в качестве контрольной группы роста для того, чтобы убедиться, что клетки оставались в экспоненциальной фазе роста. Все определения дублировались. После трех дней инкубации при 37oС, 10% СО2 и относительной влажности 98% был определен приблизительный IC50 посредством сравнения роста в чашках с препаратом по отношению к контрольным чашкам.
Клетки А-549, НТ-29 и MEL-28 были посеяны в 16-миллиметровых чашках в количестве 2•104 клеток на чашку в 1 мл аликвотах MEM 5FCS, содержащих указанное количество препарата. Отдельный комплект культур, не содержащих препарат, был посеян в качестве контрольной группы роста для того, чтобы убедиться, что клетки оставались в экспоненциальной фазе роста. Все определения дублировались. После трех дней инкубации при 37oС, 10% СО2 и относительной влажности 98% чашки окрашивались 0,1% Crystal Violet. Приблизительный IС50 определялся посредством сравнения роста в чашках с препаратом по отношению к контрольным чашкам.
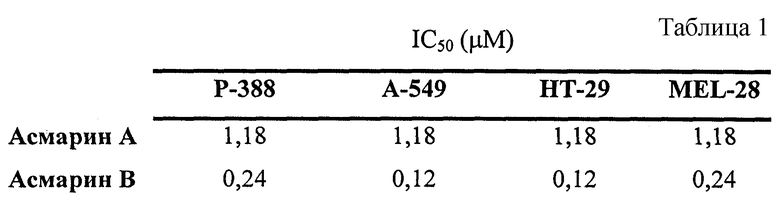
Результаты цитотоксического исследования Асмарина А и Асмарина В in vitro с линиями клеток Р-388, А-549, НТ-29 и MEL-28 приведены в табл.1.
Экстракция и выделение
Массовые спектры низкого разрешения были записаны при помощи масс-спектрометра EIMS. ЯМР-спектры 1Н и 13С были записаны на спектрометре Bruker ARX-500. Все химические смещения приведены с учетом TMS (δ=0 ppm).
Raspailia sp. (Rob van Soest), (класс Demorspongia, порядок Poecilosclerida, семейство Raspailiidea) собиралась аквалангистами на глубине 23,5 метров в районе архипелага Дахлак, Эритрея в мае 1997 года. Сравнительный образец сохранен в Тель-Авивском университете (ЕТ-338). Губка была заморожена на месте. Высушенная вымораживанием губка (20 г) экстрагировалась этилацетатом дважды, в результате чего после испарения было получено коричневое смолоподобное вещество массой 1,2 г. Это коричневое смолоподобное вещество было по Купчону разделено на четыре фракции: гексан, тетрахлорид углерода, хлороформ и воду. Фракции СНСl3 и ССl4 были подобны. Эти две фракции были смешаны и хроматографированы на колонке Sephadex LH-20 элюированием смесью МеОН: СНСl3 (1: 1), в результате чего было выявлено пять фракций. Фракции (3-5) далее были повторно хроматографированы на колонке Sephadex LH-20 в той же системе растворов, в результате чего была получена твердая фаза Асмарина А (100 мг), с температурой плавления 232oС, m/z+=423 (C25H37N5О), (100%) 188 (C8H6N5O+), [α]
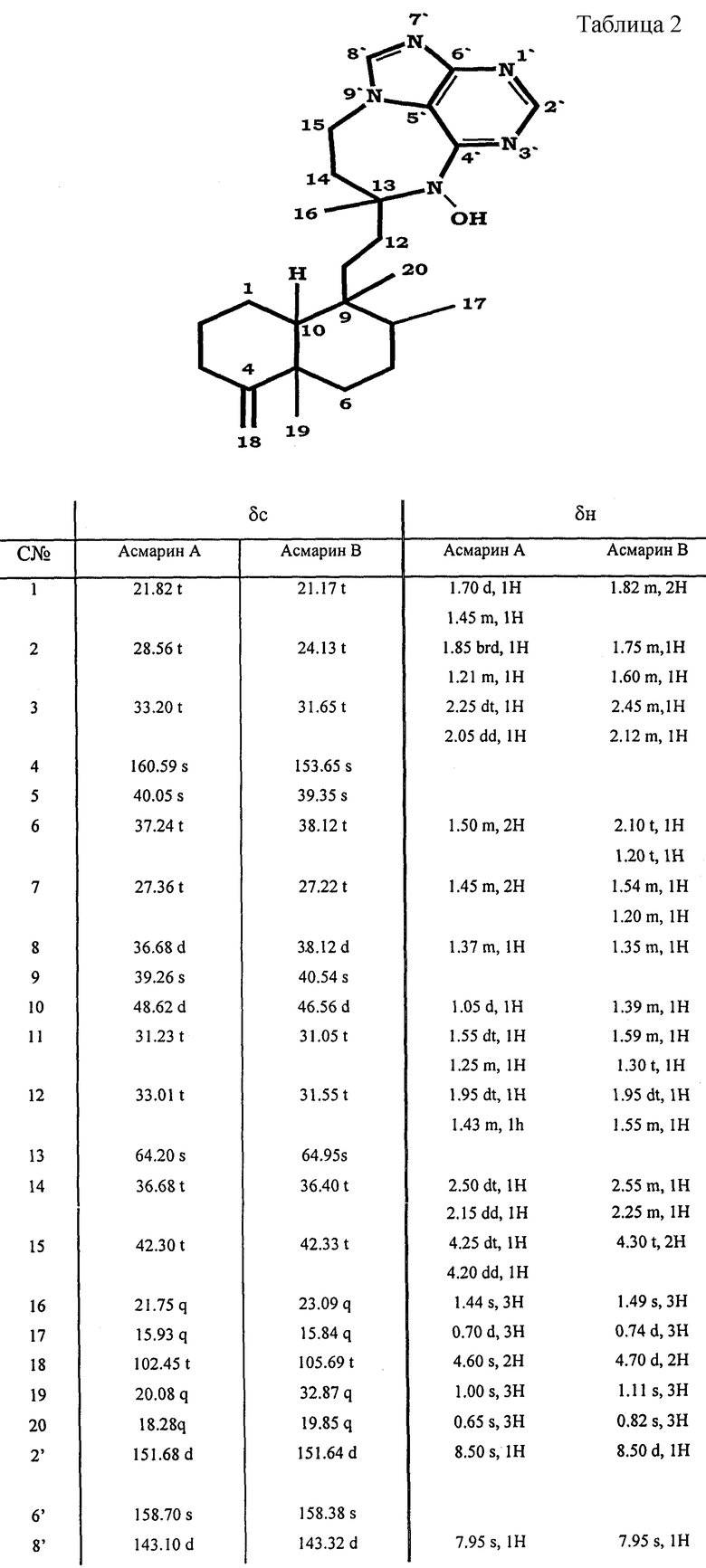
Данные ЯМР для Асмарина А и Асмарина В представлены в табл.2. Во всех случаях растворителем являлся СDСl3, и все химические смещения представлены с учетом TMS (δ=0 ppm).
ПРИЛОЖЕНИЕ 1
Серия цитотоксических экспериментов in vitro с использованием активного начала асмарина (C26H39N5О), структура которого отвечает основной формуле (I) настоящего изобретения
Во всех случаях указанное соединение проявило выраженное противоопухолевое действие. В табл.3 приведены данные, полученные в результате экспериментов в отношении различных клеточных линий.
Изобретение относится к новым цитотоксическим дитерпеновым алкалоидам формулы I или II, где R1 - Н, низший алкил или низший алканоил; R2 - Н, низший алкил; R3 - алкил, содержащий один или более остатков изопрена; R4 и R5 - Н или низший алкил; R6 - низший алкил; Х - F, Cl, Br или I, низший алкил или низший алканоил (разветвленный или неразветвленный). Соединения I или II выделяют из губки Raspailia sp. экстракцией с последующей хроматографией с использованием подходящего растворителя и элюента. 5 с. и 5 з.п.ф-лы, 3 табл.
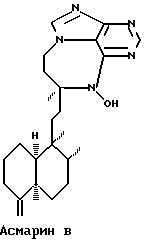
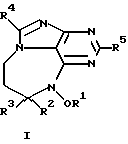
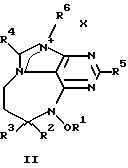
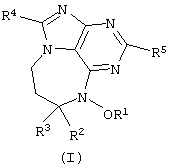
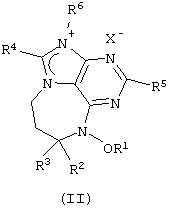
в которых R1 представляет либо водород, либо низкомолекулярный алкил, либо низкомолекулярный алканоил; R2 представляет водород либо низкомолекулярный алкил; R3 является алкиловой группой, содержащей один или более остатков изопрена; R4 или R5 представляют собой водород либо низкомолекулярный алкил; R6 является низкомолекулярным алкилом; Х представляет собой F, Cl, Вr, или I;
а также в которых низкомолекулярный алкил и низкомолекулярный-алкильный остаток низкомолекулярного алканоила представляют собой неразветвленную или разветвленную алкильную группу содержащую 1-6 атомов углерода.
| ПРОИЗВОДНЫЕ 4,5-ДИГИДРОПИРРОЛО[1,2,3-Е,D]ПТЕРИДИНА, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1984 |
|
SU1212012A1 |
| Nakamura H | |||
| et al | |||
| Tetrahedron Letters, 1984, 25, 2989-2992. | |||
Авторы
Даты
2004-01-20—Публикация
1998-12-23—Подача