Изобретение относится к области фармации и медицины и касается технологии приготовления мягких лекарственных форм, а именно мази ибупрофена.
В настоящее время ибупрофен широко применяется в медицине в качестве нестероидного противовоспалительного средства (НПВС). Ибупрофен применяется внутрь и местно при ревматоидном артрите, анкилозирующем спондилоартрозе и других заболеваниях. Широкому распространению ибупрофена способствует его низкая токсичность. До настоящего времени не описано случаев острого отравления ибупрофеном и не установлена смертельная доза для человека (Муравьев Ю.В., Насонова В.А. Чрескожная терапия “Долгит-кремом” суставного синдрома при ревматических заболеваниях - альтернатива пероральному лечению противовоспалительными препаратами// Человек и лекарство. - Тез. докл. Рос. нац. конгресса (5; 1998; Москва). - М.: РЦ “Фармединфо”. - С.142.; Нурофен (ибупрофен, ВШ): Эффективная и безопасная помощь при боли/ Караулов А.А. //Практикующий врач. - 1991. - №4. - С.26).
В России зарегистрирован ряд лекарственных форм ибупрофена для внутреннего употребления и две мягкие лекарственные формы “Ибутол гель” и “Долгит крем”. В Пятигорской государственной фармацевтической академии была разработана мазь ибупрофена, приготовленная на геле ПЭО-1500. Эта мазь может быть принята за прототип.
Состав прототипа, г:
Ибупрофен 5,0
Димексид 10,0
Гель ПЭО-1500 до 85,0
Заявка №2000129270 от 22 ноября 2000 г. Однако размер частиц ибупрофена в мази, приготовленной на геле ПЭО-1500, иногда превышает 100 мкм. Продолжая исследования по созданию оптимальной композиции с ибупрофеном, нами была приготовлена мазь-раствор. При этом в качестве основы использована смесь ПЭО-400 и ПЭО-1500, а в качестве пенетратора димексид.
Целью данного изобретения является создание мази ибупрофена с применением в качестве основы смеси ПЭО-1500 и ПЭО-400.
Для выбора основы изучались разные соотношения ПЭО-1500 и ПЭО-400. С этой целью была приготовлена серия мазей с различными соотношеними ПЭО 1500 и ПЭО 400 при постоянном содержании ибупрофена 5% и димексида 10% и визуально оценены их свойства. Полученные результаты представлены в таблице 1. Установлено, что оптимальным является соотношение 9:8. Оно обеспечивает необходимые реологические свойства мази.
С использованием этих вспомогательных веществ была предложена следующая композиция, г:
Ибупрофен 5,0
Димексид 10,0
ПЭО-1500 45,0
ПЭО-400 40,0
Существенным отличительным признаком заявляемой композиции является использование в качестве мазевой основы смеси ПЭО-1500 и ПЭО-400.
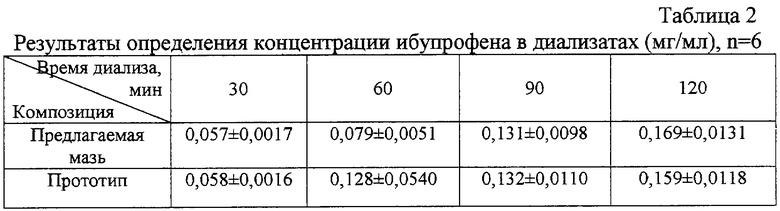
Фармацевтическую доступность ибупрофена из данной композиции изучали методом равновесного диализа через целлофановую мембрану относительно воды. Для диализа использовали по 1 г мази. Объем акцепторной фазы 30 мл. Содержание перешедшего в диализат препарата определяли спектрофотометрически. Высвобождение ибупрофена из предлагаемой композиции такое же, как в прототипе, но в отличие от прототипа предлагаемая композиция представляет собой мазь-раствор, в которой практически весь препарат находится в растворенном состоянии, в то время как для приготовления мази-прототипа требуется очень длительное растирание ибупрофена, что значительно усложняет процесс производства мази. Результаты определения концентрации ибупрофена в диализатах представлены в таблице 2.
Мазь готовят следующим образом: в обогреваемый смеситель загружают рассчитанные количества всех ингредиентов (причем предварительного измельчения субстанции ибупрофена не требуется) и нагревают до 60°С при постоянном перемешивании до полного растворения. Затем образовавшийся раствор охлаждают при перемешивании до температуры 24-25°С. Раствор при этом начинает структурироваться и переходит в состояние густой вязкой жидкости. В этом состоянии мазь может подаваться на фасовку в тубы или банки, еще через 3-4 часа мазь окончательно структурируется и приобретает консистенцию упруго-пластичной массы белого цвета со слабым характерным запахом ибупрофена. При дальнейшем хранении при комнатной температуре мазь не расслаивается.
В ходе проведения исследований оказалось, что полиэтиленоксид-1500 часто содержит механические примеси, поэтому при приготовлении мази можно включить стадию фильтрации расплавленных полиэтиленоксидов при повышенной температуре для удаления возможных примесей.
В примерах 1-3 содержание веществ дано в граммах.
Пример 1.
Ибупрофен 3,0
Димексида 5,0
ПЭО-1500 48,7
ПЭО-400 43,3
Пример 2.
Ибупрофен 5,0
Димексид 10,0
ПЭО-1500 45,0
ПЭО-400 40,0
Пример 3.
Ибупрофен 10,0
Димексид 15,0
ПЭО-1500 39,7
ПЭО-400 35,3
Изучение стабильности мази проводили согласно “Инструкции по проведению работ с целью определения сроков годности лекарственных средств на основе метода ускоренного старения при повышенной температуре” (И-42-2-82). Содержание димексида и ибупрофена определяли методом газожидкостной хроматографии. Навеску мази 5,0 г экстрагировали 25 мл этилацетата. Полученное извлечение хроматографировали при следующих условиях:
температура испарителя - 180°С;
температура детектора - 180°С;
температура термостата от 140 до 180°С со скоростью 5 град/мин;
газ-носитель - азот, скорость 35-40 мл/мин;
колонка 2,4 м×0,3 см, заполненная хроматон NAW-DMCS с 5% Carbowax 20 М.
При этом установлено, что мазь стабильна в течение двух лет.
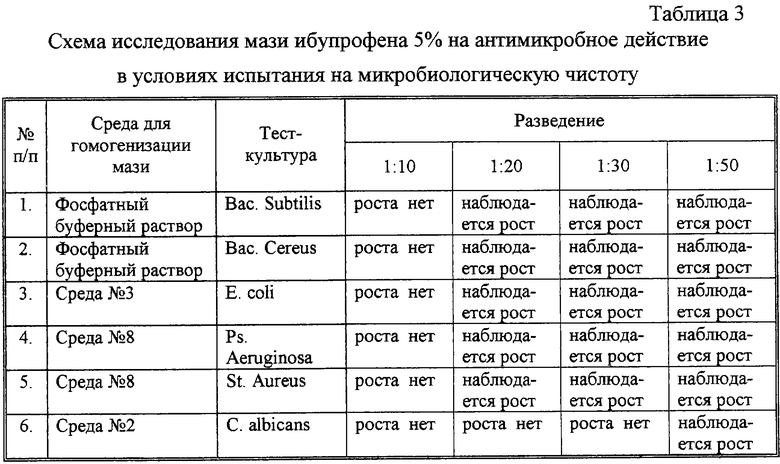
Консервация мази нами не рассматривалась, так как сам ибупрофен обладает антимикробным действием, которое обеспечивает консервацию мази на достаточном уровне. Это подтверждается исследованиями по определению микробиологической чистоты. Мазь ибупрофена должна выдерживать испытания на микробиологическую чистоту в соответствии с Изменениями к ГФ XI от 28.12.95 (категория 2). В 1 г может содержаться не более 100 бактерий, дрожжевых и плесневых грибов (суммарно, при отсутствии Pseudomonas aeruginosa, Staphylococcus aureus и бактерий семейства Enterobacteriaceae). С целью разработки методики было изучено возможное антимикробное действие мази, полученные результаты представлены в табл. 3.
Для проведения испытания были подготовлены образцы тест-штаммов микроорганизмов Bacillus subtilis ATCC 6633, Bacillus cereus ATCC 1072, Escherichia coli ATCC 23922, Pseudomonas aeruginosa ATCC 9027, Staphylococcus aureus ATCC 63381, Candida albicans ATCC 885-653. 2 образца мази по 10,0 г гомогенизировали в 90 мл стерильного фосфатного буферного раствора, 2 образца по 10,0 г - в 90 мл среды №8,1 образец (10,0 г) - в 90 мл среды №3 и 1 образец (10,0 г) - в 90 мл среды №2 без агара. После гомогенизации препарата в колбы вносили по 1 мл разведенных тест-культур, а затем выявляли внесенные микроорганизмы в соответствии с ГФ XI издания.
Проведенные испытания показывают, что в условиях испытания мазь ибупрофена 5% обладает слабым антимикробным действием. В связи с этим целесообразным является установление эффективности консервации мази, которая обеспечивается собственной антимикробной активностью.
Испытание проводили в соответствии с ВФС 42-3456-99 “Определение эффективности антимикробных консервантов лекарственных средств”. В соответствии с правилами проведения этих испытаний существует ряд категорий лекарственных средств, мазь ибупрофена 5% можно отнести к категории 1б: “Препараты, применяемые местно, нестерильные лекарственные средства для введения в полость носа, эмульсии, в том числе и те, что применяют на слизистую”.
Для данной категории существуют следующие критерии эффективности антимикробных консервантов (табл. 4).
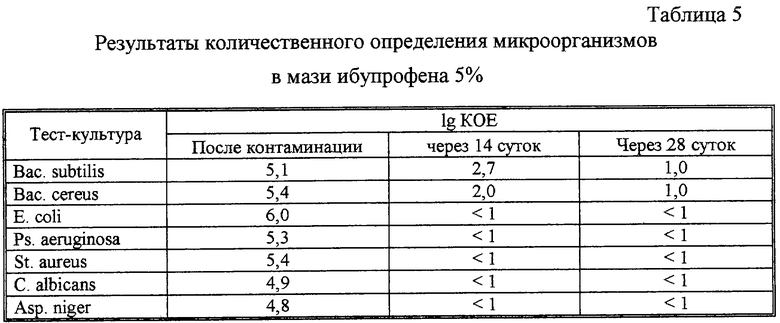
Для проведения этого испытания в стерильные ступки помещали по 50 г мази и 0,25 мл одного из приготовленных инокулятов и перемешивали. Таким образом, в 1,0 г мази содержится 105-106 КОЕ. После контаминации, а затем через 14 и 28 суток в соответствии с требованиями ГФ XI издания проводили определение общего числа микроорганизмов. Для этого по 10,0 г контаминированных образцов гомогенизировали в 100 мл фосфатного буферного раствора, затем делали серию разведении - 1:100; 1:1000 и 1:10000.
1 мл из последнего разведения высевали двухслойным методом на среду №1 (бактерии) и среду №2 (грибы). Посевы через 14 и 28 суток делали из разведения 1:10. Полученные результаты представлены в табл.5.
Как следует из полученных результатов, консервация мази обеспечивается собственным антимикробным действием препарата на достаточном уровне, поэтому введения консервантов не требуется.
Для контроля микробиологической чистоты полученной мази в соответствии с ГФ XI издания проводили испытания на микробиологическую чистоту. Результаты представлены в табл. 6.
Противовоспалительную активность данной мази изучали на модели каолинового отека лапок крыс. Эксперименты проводили на белых беспородных крысах, полученных из вивария ПятГФА, где они содержались в стационарных условиях при естественном режиме на стандартном рационе. В каждом опыте было 3 группы белых крыс. Каждая группа состояла из 6 крыс массой 170,0±20,0. Воспаление вызывали введением под апоневроз задней лапки 0,1 мл 10% суспензии каолина. Определялось влияние мазей на вторую стадию воспаления - экссудацию. Отек оценивали онкометрически, величину отека определяли по изменению объема лапок в процентах к исходному объему лапок, который измеряли до введения флогогена, а также через 4 часа после введения суспензии каолина.
Первая группа животных лечения не получала, второй группе наносили мазь ибупрофена 5%, приготовленную на смеси полиэтиленоксидов ПЭО-1500 и ПЭО-400, третьей - мазь прототип. При этом получены следующие результаты: прирост объема стопы в процентах к исходному объему после введения каолина в контрольной группе составил 50,7±7,4%; в группе, которой наносили мазь, приготовленную на смеси ПЭО - 27,9±2,6%; в группе, получавшей прототип - мазь ибупрофена, приготовленную на геле ПЭО-1500 - 36,1±3,1%. Следовательно, применение мази ибупрофена, приготовленной на смеси ПЭО-1500 и ПЭО-400, позволяет достичь лучшего противовоспалительного эффекта. Предложенная композиция превышает по биологической активности прототип, так как является мазью-раствором, что обеспечивает лучшее проникание действующих веществ через кожные покровы.
Существенным отличительным признаком заявляемой композиции является использование в качестве мазевой основы смеси ПЭО-1500 и ПЭО-400. Преимуществами предлагаемой композиции при повышении физиологической активности являются:
1. Упрощение технологического процесса производства, так как исключается стадия растирания ибупрофена.
2. Повышение фармакологической активности предлагаемой композиции, так как она является мазью-раствором.



| название | год | авторы | номер документа |
|---|---|---|---|
| МАЗЬ ИБУПРОФЕНА, ПРИГОТОВЛЕННАЯ НА ГЕЛЕ ПОЛИЭТИЛЕНОКСИДА-1500, ОБЛАДАЮЩАЯ ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 2000 |
|
RU2185160C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И НЕКРОЛИТИЧЕСКИМ ДЕЙСТВИЕМ | 2007 |
|
RU2367456C2 |
| ФАРМАЦЕВТИЧЕСКАЯ АНТИБАКТЕРИАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ НА ОСНОВЕ АКТИВНЫХ БИОМЕТАЛЛОКОМПЛЕКСОВ | 2011 |
|
RU2489147C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ НАРУЖНОГО И МЕСТНОГО ПРИМЕНЕНИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И НЕКРОЛИТИЧЕСКИМ ДЕЙСТВИЕМ, НА ОСНОВЕ ЛИЗОАМИДАЗЫ | 2007 |
|
RU2367457C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНЫМ И НЕКРОЛИТИЧЕСКИМ ДЕЙСТВИЕМ, НА ОСНОВЕ ЛИЗОАМИДАЗЫ | 2007 |
|
RU2367469C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ МЕСТНЫХ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2000 |
|
RU2185148C2 |
| МАЗЬ БУТАДИОНА, ПРИГОТОВЛЕННАЯ НА ГЕЛЕ ПОЛИЭТИЛЕНОКСИДА-1500, ОБЛАДАЮЩАЯ ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 1997 |
|
RU2128501C1 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ МЕСТНОГО И НАРУЖНОГО ПРИМЕНЕНИЯ НА ОСНОВЕ НИЗКОМОЛЕКУЛЯРНОГО ИНДУКТОРА ИНТЕРФЕРОНА | 2007 |
|
RU2351322C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ МЕСТНЫХ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2000 |
|
RU2185167C2 |
| ГИДРОФИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 1999 |
|
RU2140258C1 |
Изобретение относится к области фармацевтики и касается мази ибупрофена. Изобретение заключается в том, что предложенный состав содержит ибупрофен - 5,0, димексид - 10,0, ПЭО-1500 - 45,0, ПЭО-400 - 40,0. Изобретение обеспечивает реологические свойства мази, поскольку предлагаемая композиция представляет собой мазь-раствор, в которой практически весь препарат находится в растворенном состоянии. 6 табл.
Мазь ибупрофена, обладающая противовоспалительным действием, содержащая ибупрофен, усилитель проникновения, основу, отличающаяся тем, что в качестве усилителя проникновения содержит димексид, основы - полиэтиленоксид-1500, полиэтиленоксид-400 при следующем соотношении компонентов, г:
Ибупрофен 5,0
Димексид 10,0
Полиэтиленоксид-1500 45,0
Полиэтиленоксид-400 40,0
| ЛИНИМЕНТ АНАЛЬГЕЗИРУЮЩЕГО И ПРОТИВОВОСПАЛИТЕЛЬНОГО ДЕЙСТВИЯ | 1997 |
|
RU2131726C1 |
| ПРЕПАРАТ ДЛЯ НАРУЖНОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩИЙ ЛОКСОПРОФЕН | 1997 |
|
RU2173145C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ТРАНСДЕРМАЛЬНОГО ПРИМЕНЕНИЯ | 1991 |
|
RU2107515C1 |
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| АИСТИХИН И.С | |||
| Технология лекарств | |||
| - М.: Медицина, 1975, с.32. | |||
Авторы
Даты
2004-05-27—Публикация
2002-05-27—Подача