Это изобретение находится в области лечения опухолей, которые локализуются в центральной нервной системе (ЦНС) или первичных и вторичных (метастатических) церебрально-спинальных злокачественных опухолей, и обеспечивает новые композиции и системы доставки, применимые для такой терапии.
Первичные опухоли мозга (глиомы) имеют несколько уникальных биологических признаков по сравнению с другими метастазирующими опухолями. Они ограничены локализацией в центральной нервной системе, и метастатического распространения в другие органы фактически не происходит. Даже несмотря на то, что эти опухоли проявляют высокую степень инвазии в мозг, они обладают тенденцией к рецидивам после лечения при той же локализации, где они первоначально были обнаружены. Опухоли являются высокогетерогенными и состоят из многочисленных клеточных типов с различными фенотипическими свойствами.
В настоящее время избираемым лечением является хирургическая операция с последующей лучевой терапией и химиотерапией. Пациенты с наиболее злокачественными формами опухолей мозга (глиобластомами) имеют неблагоприятный прогноз на выживание примерно в течение 10 месяцев после постановки диагноза. Следовательно, имеется насущная потребность в новых стратегиях лечения этой специфической группы опухолей.
Поскольку опухоли имеют тенденцию к рецидивам в месте их первичной локализации, необходимы методики для местного лечения. Кроме того, поскольку эти опухоли состоят из многочисленных опухолевых клеток с различными фенотипическими свойствами, лечение выбора должно быть способным поражать различные типы опухолевых клеток.
Другие опухоли, которые локализуются в центральной нервной системе и которые часто трудно успешно лечить, включают опухоли, происходящие от астроглиальных и олигодендроглиальных клеток, включают, например:
Астроцитомы
- астроцитомы начальных стадий (астроцитомы стадии 1 и 2);
- анапластическая астроцитома (астроцитома стадии 3);
- полиморфная глиобластома (астроцитома стадии 4);
- включая вторичную глиобластому, т.е. опухоли, которые отличаются от астроцитом более начальной стадией;
- первичная глиобластома, т.е. опухоли, которые проявляются в виде первичных глиобластом de novo;
гигантоклеточная глиобластома;
глиосаркомы;
глиоматоз церебральный;
Олиродендроглиомы
- включая олигодендроглиому (стадия II по ВОЗ);
анапластическую олигодендроглиому (стадия III по ВОЗ);
Смешанные глиомы
- олигоастроцитома (стадия II по ВОЗ);
- анапластическая олигоастроцитома (стадия III по ВОЗ);
Эпендимные опухоли
- эпендимома (стадия II по ВОЗ);
- анапластическая эпендимома (стадия III по ВОЗ);
- субэпендимома (стадия I по ВОЗ);
Эмбриональные опухоли
- центральная нейробластома;
- эпендимобластома;
- медуллобластома;
- супратенториальные PNETs;
Нейробластомы
- обонятельная нейробластома;
- нейробластические опухоли надпочечника и симпатической нервной системы.
Для большинства этих опухолей первым лечением выбора является хирургическая операция с последующей лучевой терапией и/или химиотерапией. Однако полное удаление опухоли часто затруднительно оперативными методами, в то же время результаты последующей лучевой терапии и химиотерапии также иногда не полностью успешны вследствие устойчивости к облучению и/или трудностей в доставке терапевтических доз цитотоксических препаратов.
В течение последних лет большое внимание сосредоточено на генной терапии, где были испытаны реверсия злокачественного фенотипа с помощью даун-регуляции экспрессии онкогенов или вставки обычных опухоль-супрессорных генов. Также были внедрены иммунные стимулирующие факторы, такие как цитокины, которые нацелены на усиление распознавания и отторжения опухолей иммунной системой. Кроме того, были модифицированы клетки для прямой доставки генных продуктов к опухолевым клеткам, повышающие их чувствительность к фармакологическим препаратам. Статьи, которые описывают эти разработки, включают (i) Curr. Opin. Oncol., 7, (1995), pages 94-100; (ii) Curr. Opin. Biotechnol., 5, (1994), pages 611-616; (iii) Cancer Res., 53, (1993), pages 2330-2337; (iv) Hum. Gene Ther., 4, (1993), pages 451-460; (v) Hum. Gene Ther., 5, (1994), pages 153-164; and (vi) Trends Pharmacol. Sci., 14, (1993), pages 202-208.
Несмотря на широкие исследования в течение последних лет, имеются значительные препятствия, которые мешают переходу между экспериментальным исследованием и клиническим лечением злокачественных опухолей мозга. Одной проблемой является предупреждение иммуноотторжения генетически модицифированных клеток после внутричерепной имплантации. Это можно преодолеть при инкапсулировании клеток-продуцентов.
Однако это приводит к другим проблемам: найти вещества, особым образом адаптированные для применения на мозге. Несмотря на то, что мозг в иммунологическом отношении является отличным от других частей тела, например, в его потере В-лимфоцитов, он особенно чувствителен к воздействию биологически активных соединений, таких, например, как эндотоксины.
Заявители сейчас установили в соответствии с настоящим изобретением, что иммуноизолирующие альгинатные матрицы особенно пригодны для инкапсулирования клеток-продуцентов, предназначенных для внутричерепной имплантации, при лечении опухолей ЦНС. Особенно предпочтительно, чтобы иммуноизолирующими альгинатными матрицами были микрогранулы.
Таким образом, в широком аспекте настоящее изобретение обеспечивает инкапсулированную клетку-продуцент, способную экспрессировать молекулу, которая является ингибитором роста опухолей ЦНС, эта клетка-продуцент инкапсулируется в иммуноизолирующие альгинатные матрицы. Предпочтительно, чтобы эта молекула была пептидом, белком или полисахаридом и наиболее предпочтительно, чтобы эта молекула была моноклональным антителом.
Настоящее изобретение также обеспечивает способ лечения опухолей ЦНС, который включает имплантирование в месте опухоли инкапсулированной клетки-продуцента, которая способна экспрессировать молекулу, которая является ингибитором роста указанной опухоли.
Кроме того, настоящее изобретение обеспечивает способ получения фармакологического продукта для лечения опухолей ЦНС, который включает инкапсулирование внутри иммуноизолирующих альгинатных матриц клетки-продуцента, способной экспрессировать молекулу, которая является ингибитором роста указанной опухоли.
Настоящее изобретение также обеспечивает применение иммуноизолирующих альгинатных матриц для инкапсулирования клеток-продуцентов, предназначенных для внутричерепной имплантации при лечении опухолей ЦНС.
В одном воплощении изобретения клетки-продуценты, предназначенные для применения здесь, включают генетически сконструированные клетки, которые продуцируют молекулы, например белки, пептиды и полисахариды, которые будут или непосредственно взаимодействовать с опухолевыми клетками, или опосредованно с путями коммуникации клеток опухоли и хозяина. Другими пригодными клетками-продуцентами, рассматриваемыми здесь, являются специализированные клетки, которые продуцируют моноклональные антитела, как, например, гибридомные клетки или даже нативные клетки, которые способны экспрессировать молекулы, ингибирующие опухоли.
Хорошо известно, что рост опухолей зависит от специфических клеточных связей с хозяином, осуществляемых посредством специфических факторов роста, которые регулируют рост опухолевых клеток довольно сложными путями. В этом отношении опухоли зависят от питательных веществ, поставляемых хозяином, поступающих посредством вновь образованных кровеносных сосудов. В последние годы было установлено и описано в литературе несколько клеточных путей взаимодействия опухоли/хозяина.
Следовательно, одним классом клеток-продуцентов, пригодных здесь, являются таковые, которые могут экспрессировать белки или пептиды, которые будут взаимодействовать с путями коммуникации опухоли/хозяина. Например, пригодные клетки-продуценты включают таковые, которые продуцируют белки и пептиды, воздействующие на неоваскуляризацию опухоли, как, например, тромбоспондин, эндостатин, ангиостатин и пролактин, белки, которые нарушают связь опухолевых клеток с внеклеточным матриксом, например ингибиторы протеазы, такие как тканевые ингибиторы металлопротеиназ, и белки и пептиды, которые воздействуют на иммунную систему, включая все различные классы интерлейкинов.
Другой предпочтительный класс клеток-продуцентов состоит из таковых, которые экспрессируют белки или пептиды, непосредственно взаимодействующие с самими опухолевыми клетками. Например, пригодные клетки-продуценты этой категории включают: гибридомные клеточные линии, которые продуцируют моноклональные антитела, которые непосредственно взаимодействуют с рецепторами опухоли, например рецепторами факторов роста клеток, которые воздействуют на опухолевые клетки, такими как рецептор эпидермального фактора роста (EGFr), рецепторы тромбоцитарного фактора роста АА и ВВ, кислотные или основные рецепторы фактора роста фибробластов, альфа- и бета-рецепторы трансформирующего фактора роста, различные классы рецепторов сосудистого эндотелиального фактора роста (VEGFR-1 и VEGFR-2), рецепторы тирозинкиназы с иммуноглобулин- и EGF-подобными доменами, как, например, TIE-1 и TIE-2/tek, фактор роста гепатоцитов (фактор рассеяния) или моно-клональные антитела, направленные против различных классов рецепторов интегрина; моноклональные антитела, направленные против CD-44; моноклональные антитела, направленные против комплексов CDK/циклина; моноклональные антитела, направленные против FAS; моноклональные антитела, направленные против гликолипидов на клеточной поверхности; моноклональные антитела, направленные против гликопротеидов; моноклональные антитела, направленные против белков, производных экспрессии специфических онкогенов.
Особый интерес в некоторых обстоятельствах представляют клетки-продуценты, у которых продукция ингибирующих рост опухолей веществ может быть запущена и выключена с помощью фармакологических способов, например клетки-продуценты с фармакологически индуцируемым геном экспрессии, например активированной тетрациклином экспрессии.
По настоящему изобретению можно использовать любую трансфицируемую клеточную линию. Клеточные линии должны быть постоянными, т.е. способными подвергаться неограниченному клеточному делению и предпочтительно быть отличными от человеческих и неопухолегенными.
Примерами таких клеточных линий, которые доступны из American Type Culture Collection 10350 Linden Lake Plaza, Manassas, Virginia 20109, США, являются (см. Таблицу А):
По настоящему изобретению клетки-продуценты инкапсулируют в иммуноизолирующие альгинатные матрицы, которые способны обеспечить стабильную in situ систему доставки экспрессированного белка или другой молекулы, которая может нарушать рост и прогрессирование опухоли без иммуноотторжения клеток-продуцентов.
Инкапсулирование клеток внутри альгинатных гранул является хорошо известным способом иммобилизации клеток и других веществ и ранее оно использовалось при лечении сахарного диабета, для продукции моноклональных антител, а также в других областях медицины, как описано в литературе.
Из PCT/WO 97/44065 настоящий способ доставки лекарственных препаратов был предложен для генной терапии in vivo, в котором использовались инкапсулированные клетки, высвобождающие векторы переноса генов в месте опухоли мозга. Капсулы, используемые для инкапсулирования клеток, включают две части: а) ядро, включающее живые упакованные клетки, и b) внешнюю оболочку, окружающую указанное ядро.
Настоящее изобретение обеспечивает значительно более простой способ инкапсулирования и продукт, где клетки-продуценты инкапсулируют непосредственно одностадийным способом с использованием альгината с иммуноизолирующим свойством.
Альгинат является полисахаридом, который, в основном, обнаружен в коричневой морской водоросли. Он состоит из моносахаридов двух типов: L-гулуроновой кислоты (G) и D-маннуроновой кислоты (М). Эти полисахаридные единицы находятся в блоках с чередующейся последовательностью G и М (MG-блоки) и блоках, состоящих в основном либо из G-, либо из М-единиц (G-блоки/М-блоки).
Гелеобразующее свойство достигается посредством сшивания G-блоков мультивалентными катионами, особенно Са2+.
Для того чтобы альгинат не был иммунологически активирующим, содержание G должно быть выше 15%. Однако более предпочтительно по настоящему изобретению использовать альгинат с высоким содержанием G, т.е. с содержанием G, равным 50% или выше, для достижения того, чтобы альгинат был иммуноизолирующим. Как хорошо известно в этой области, соотношение G/M-блоков и распределение различных блоков являются критическими факторами для проявления различных свойств полученного геля, образованного посредством сшивания поливалентным катионом.
Другим принципиально важным аспектом является чистота альгината, который используется. Так, одним преимуществом альгинатных матриц, используемых по настоящему изобретению, является то, что их можно получать с качеством высокой чистоты, имеющих хорошо определенное строение и очень низкое содержание примесей, таких как эндотоксины.
Вторым преимуществом альгинатных матриц, используемых по настоящему изобретению, является то, что альгинатные микрогранулы, полученные добавлением по каплям раствора альгината, содержащего живые клетки, к раствору кальция, имеют повышенную концентрацию альгината от центра микрогранул к внешнему ободку. Посредством этого создается оптимальное пространство в центре микрогранул для клеток, чтобы выжить, пролиферировать и продуцировать, в то же время для клеток доступно достаточное количество питательных веществ и кислорода. Внешний ободок с его более высокой концентрацией альгината дает возможность создания барьера так, что ни продуцирующие клетки не выходят из внутреннего пространства, ни иммунологические клетки не поступают в гранулы.
В основном, применение альгината в качестве матрицы для иммобилизации клеток включает смешение суспензии клеток с раствором Na+ альгината, после чего смесь прикалывают к раствору, содержащему мультивалентные катионы (обычно Са2+). Капли образуют гелевые шарики, моментально захватывающие клетки в трехпространственную решетку альгината, сшитую ионами. Эту процедуру иммобилизации можно проводить в очень мягких условиях, и, следовательно, она совместима с живыми клетками. Для детального описания как теории, так и практики способа читатель отсылается к статье "Alginate as Immobilization Matrix for Cells" by Smidsrod and Skjak-Braek in Trends in Biotechnology, March 1990, Vol.8, №3, pages 71-78.
Предпочтительным употребительным способом для образования кальций-альгинатных гранул с инкапсулированными клетками-продуцентами по настоящему изобретению является следующий. Альгинат натрия растворяют в концентрации 1-2% в воде или изотоническом солевом растворе. Раствор альгината стерилизуют пропусканием через мембрану и затем добавляют клетки-продуценты и подводят изотоничность. Кальций-альгинатные гранулы образуются при прикапывании раствора альгината натрия-клеток-продуцентов в баню с хлоридом кальция (0,05-0,25 М) либо вручную, либо, что предпочтительнее, с использованием электростатического генератора гранул, который создает электростатический потенциал 5-7 кВ между иглой, подающей альгинат, и гелеобразующей баней. Регулируя диаметр иглы (например, от 0,1 мм до 0,4 мм), скорость потока (например, от 5 мл/ч до 30 мл/ч) и используемое напряжение, можно получать гранулы относительно одинакового диаметра от 100 до 400 мкм. Однородность гранул регулируется подведением концентрации соли в гелеобразующей бане от 0 до 200 мМ NaCl, при большей концентрации соли, дающей более высокую однородность. Гранулам дают возможность затвердеть в гелеобразующей бане.
Предполагается, что инкапсулированные клетки-продуценты по этому изобретению будут помещены в полость опухоли после обычного объемного удаления опухоли хирургическим путем. Вскоре после операции нагрузка опухолью является минимальной, и у многих пациентов имеется бессимптомный период прежде, чем происходит рецидив. Поскольку операция является травматическим событием, оставшиеся опухолевые клетки будут пытаться установить новые пути биохимического взаимодействия с хозяином. Сюда входит образование новых кровеносных сосудов и новых источников поставки пептидных факторов роста к оставшимся опухолевым клеткам. В это время, когда нагрузка опухолью является минимальной, лечение, осуществляемое по настоящему изобретению, будет наиболее эффективным.
Действительно, особым преимуществом настоящего изобретения в соответствии с одним воплощением является то, что оно позволяет легко провести одновременную имплантацию клеток-продуцентов различных типов для воздействия на различные фенотипические характеристики и факторы окружающей микросреды, влияющие на прогрессирующий рост опухолей мозга и других опухолей. Для этой цели можно создать банк клеток-продуцентов, содержащий инкапсулированные клетки-продуценты, хранящиеся замороженными при температуре жидкого азота. Затем из банка можно извлечь клетки-продуценты, соответствующие генотипической экспрессии опухоли хозяина, которая лечится.
Для того чтобы установить, какие клетки-продуценты необходимы для лечения опухоли, можно использовать в качестве примера следующую процедуру. Вначале по биопсийному материалу проводят характеристику опухоли, включающую определение рецепторного статуса и фенотипа. Соответственно, выбранные клетки-продуценты, которые продуцируют вещества, например моноклональные антитела, направленные против рецепторного статуса опухоли хозяина, затем имплантируют стереотактически вплоть до 60 дней после хирургического удаления первичной опухоли.
Альтернативно, можно имплантировать клетки-продуценты, продуцирующие антиангиогенные вещества, непосредственно после хирургического удаления первичной опухоли.
Доза клеток-продуцентов, которые имплантируют, будет, конечно, зависеть от точных обстоятельств у каждого пациента, но обычно общее число имплантированных клеток будет находиться в пределах от 106 до 1012 на пациента. Число клеток-продуцентов внутри каждой альгинатной или другой инкапсулирующей матрицы будет, конечно, зависеть от размеров гранулы или другой инкапсулирующей формы. Инкапсулированные клетки-продуценты обычно будут хирургически помещены в место раны после удаления первичной опухоли.
Как показали детально описанные ниже опыты, инкапсулированные клетки-продуценты могут выживать, пролиферировать и сохранять периоды их специфической экспрессии in vitro и in vivo. Это открытие представляет возможность терапевтического лечения нового вида для пациентов с опухолевыми заболеваниями мозга, посредством чего можно инкапсулировать различные клетки-продуценты, которые выбраны для воздействия на отобранные характеристики роста и развития опухоли мозга. В опытах, описанных здесь, заявители показали, что специфические MAT, высвобождающиеся из альгинатных гранул, могут ингибировать миграцию опухолевых клеток, что показано по взаимодействию с рецептором эпидермального фактора роста. Заявители также показали, что специфические продукты, высвобождающиеся из инкапсулированных клеток-продуцентов внутри мозга, проникают в паренхиму мозга и могут распространяться с помощью церебро-спинальной жидкости.
Следующие опыты помогут в понимании изобретения и его преимуществ. Ниже будет обращение к сопровождающим чертежам, на которых:
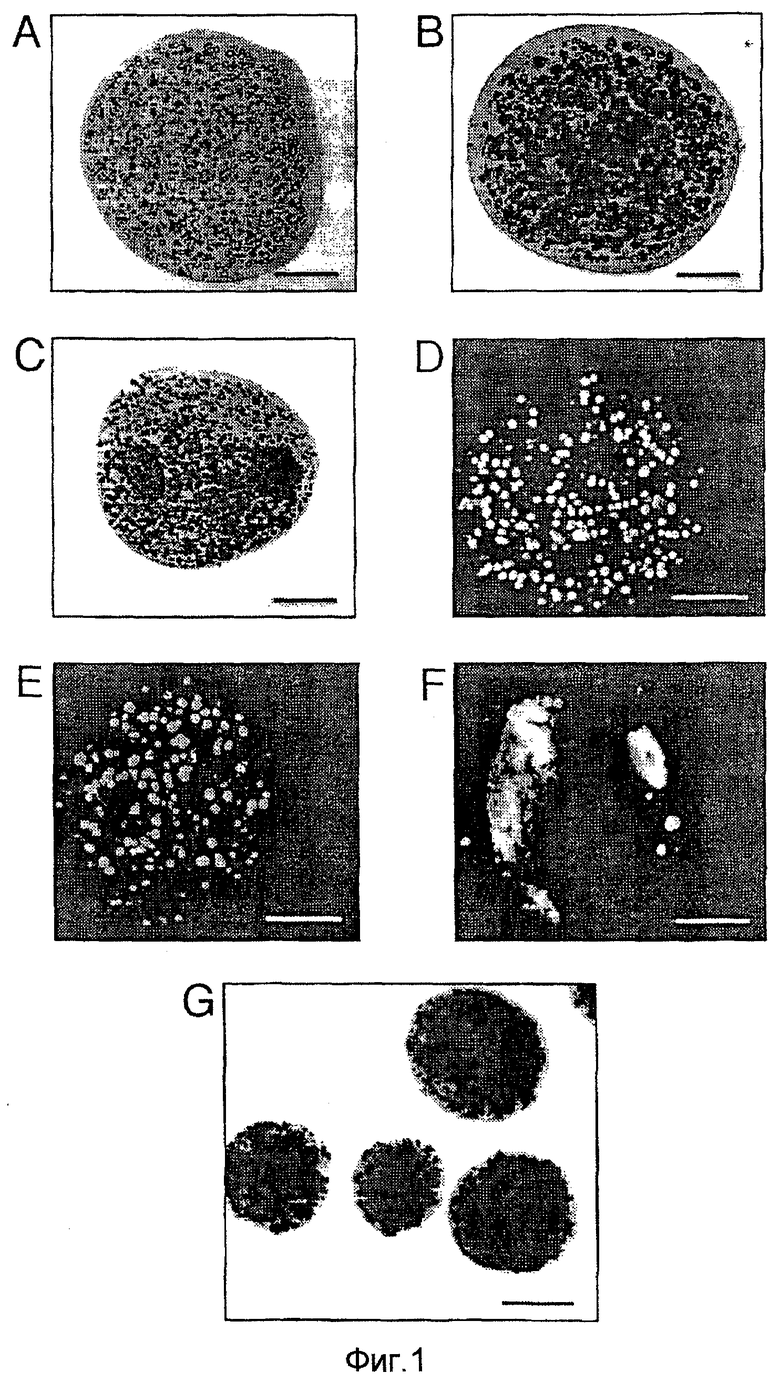
Фигуры 1А-1С: изображения получены с помощью световой микроскопии клеток NIH 3Т3, инкапсулированных в альгинате. Все полосы представляют 250 мкм.
Фигура 1А: день инкапсулирования.
Фигура 1В: инкапсулированные клетки через 3 недели в культуре.
Фигура 1С: инкапсулированные клетки через 9 недель в культуре.
Фигуры 1D-1F: микрофотографии, полученные с помощью конфокальной сканирующей лазерной микроскопии клеток NIH 3Т3, инкапсулированных в альгинате. Живые клетки излучают зеленую флуоресценцию (здесь показаны в виде более светлых участков), в то время как мертвые клетки излучают красную флуоресценцию (здесь не видны). Все полосы представляют 250 мкм.
Фигура D: в день инкапсулирования.
Фигура 1Е: инкапсулированные клетки через 3 недели в культуре.
Фигура 1F: инкапсулированные клетки через 9 недель в культуре.
Фигура 1G: активность β-галактозидазы клеток BT4CnVlacZ, инкапсулированных в альгинате, через 9 недель в культуре. Все полосы представляют 500 мкм.
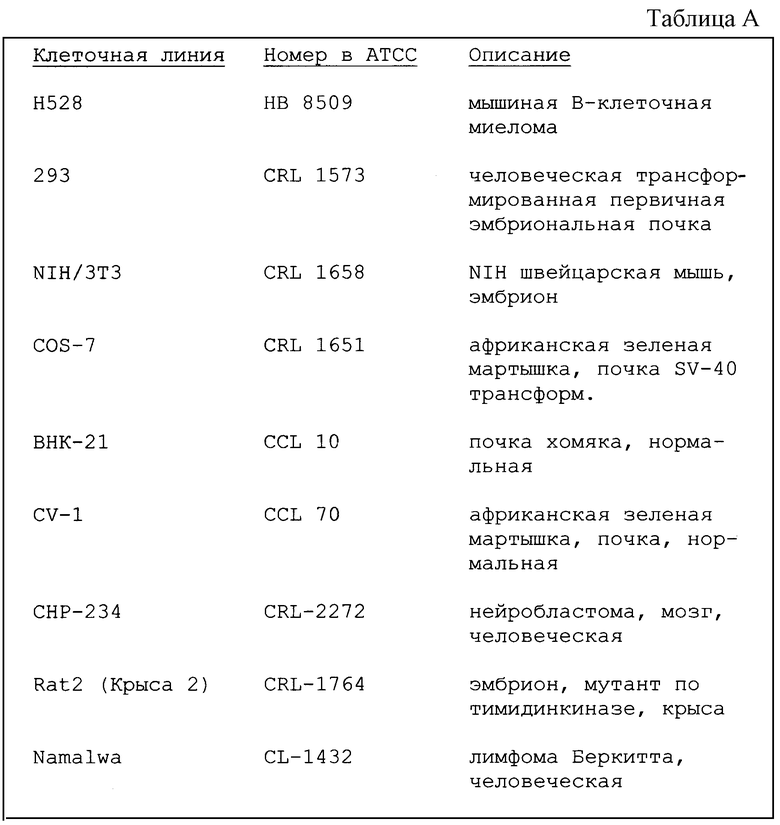
Фигуры 2A-2D: гистограммы проточной цитометрии клеток NIH 3Т3, инкапсулированных в альгинатные гранулы. Горизонтальная ось выражает номер канала в проточном цитометре (относительная флуоресценция ДНК), в то время как вертикальная ось выражает относительное число ядер клеток в каждом канале.
Фигура 2А: контроль, монослойная культура.
Фигура 2В: клетки, инкапсулированные в течение 1 недели.
Фигура 2С: клетки, инкапсулированные в течение 3 недель.
Фигура 2D: клетки, инкапсулированные в течение 9 недель.
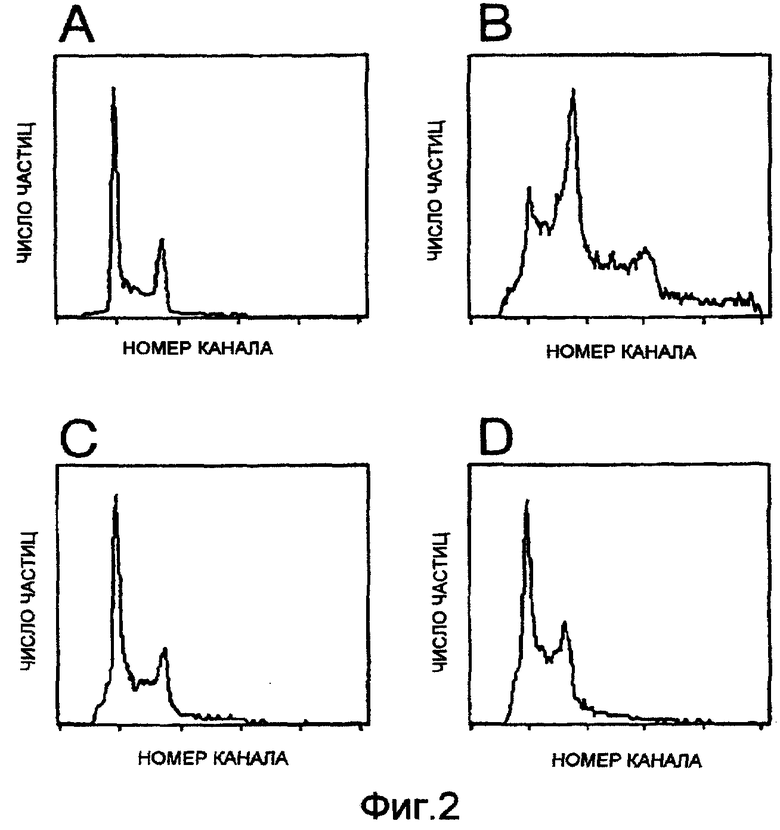
Фигура 3: секреция антител гибридомными клетками Н528, инкапсулированных в альгинате (среднее значение ± средняя ошибка). Горизонтальная ось представляет число суток в культуре, в то время как вертикальная ось показывает высвобождение антител в питательную среду. Кривую построили регрессионным анализом 3-го порядка.
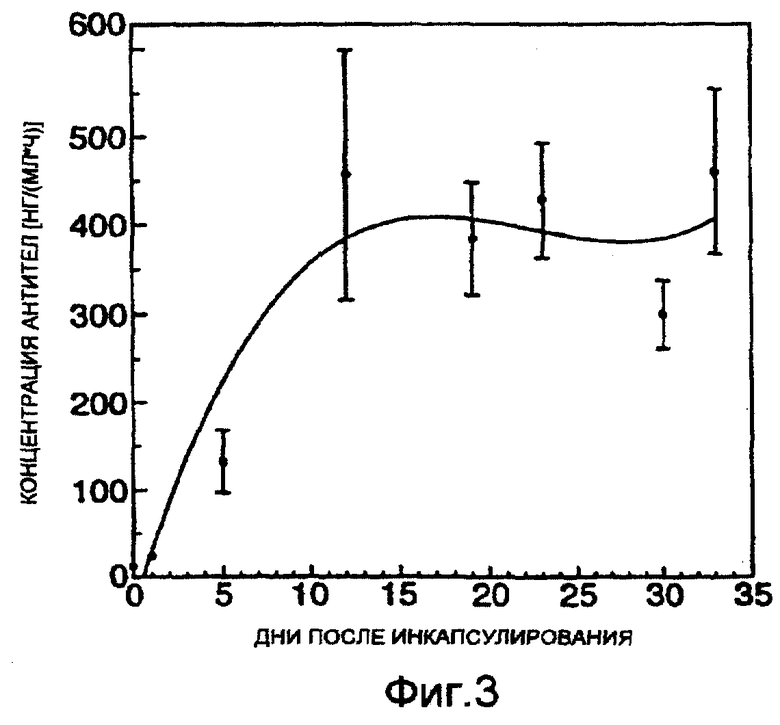
Фигура 4: миграция клеток из сфероидов GaMg через 4 дня, необработанные (контроль), стимулированные 10 нг/мл EGF (EGF) или стимулированные 10 нг/мл EGF в присутствии инкапсулированных гибридомных клеток (EGF/H528).
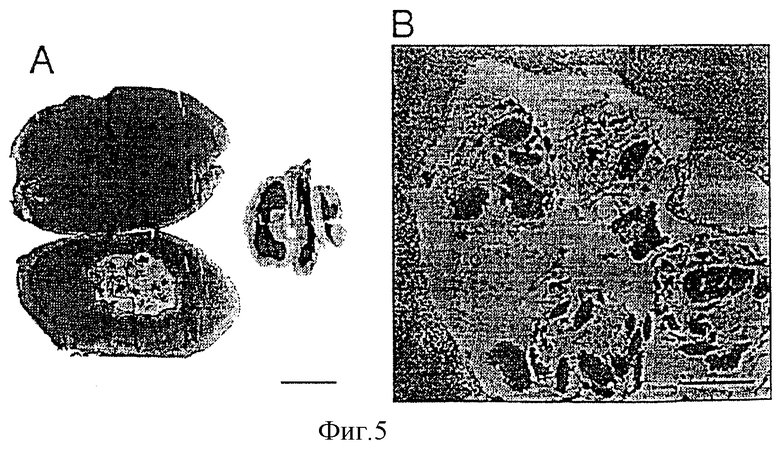
Фигуры 5А-5Н: инкапсулированные гибридомные клетки Н528, имплантированные в мозг крысы.
Фигура 5А: продольный срез мозга крысы. Окрашивание гематоксилин-эозином, полоса представляет 5 мм.
Фигура 5В: тот же срез, что на фигуре 5А, показывающий инкапсулированные клетки Н528 внутри места имплантации. Окрашивание гематоксилин-эозином, полоса представляет 500 мкм.
Фигуры 5С-5Н: микрофотографии, полученные с помощью конфокальной лазерной сканирующей микроскопии, высвобождения и распространения моноклональных антител внутри мозга. Фигуры 5С, Е и F сделаны с одинаковым увеличением. Фигуры 5G и 5Н были также сделаны с одинаковым увеличением.
Фигура 5С: срез паренхимы мозга с инкапсулированными клетками Н528 с дальней левой стороны. Полоса представляет 150 мкм. С левой стороны видна интенсивная флуоресценция в паренхиме мозга с последующим постепенным снижением интенсивности по меньшей мере 1000 мкм внутрь мозга.
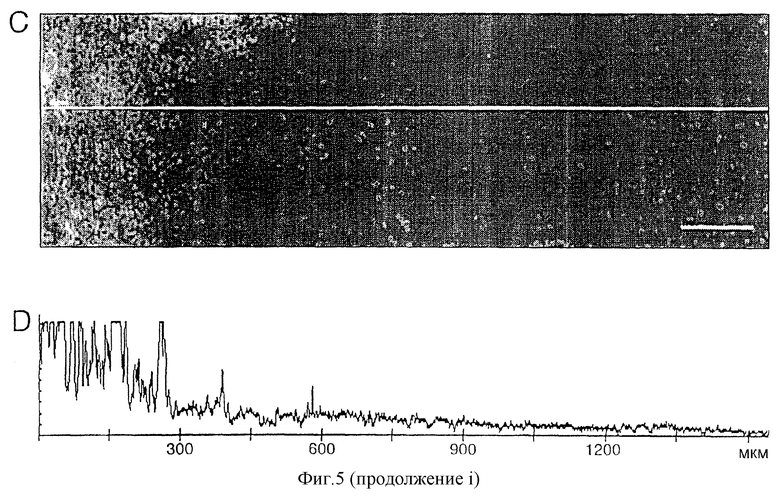
Постепенное изменение интенсивности флуоресценции по горизонтальной линии дополнительно показано на фигуре 5D, где вертикальная ось представляет относительную интенсивность флуоресценции (0-255). Интенсивная флуоресценция видна с левой стороны с постепенным снижением в паренхиму мозга.
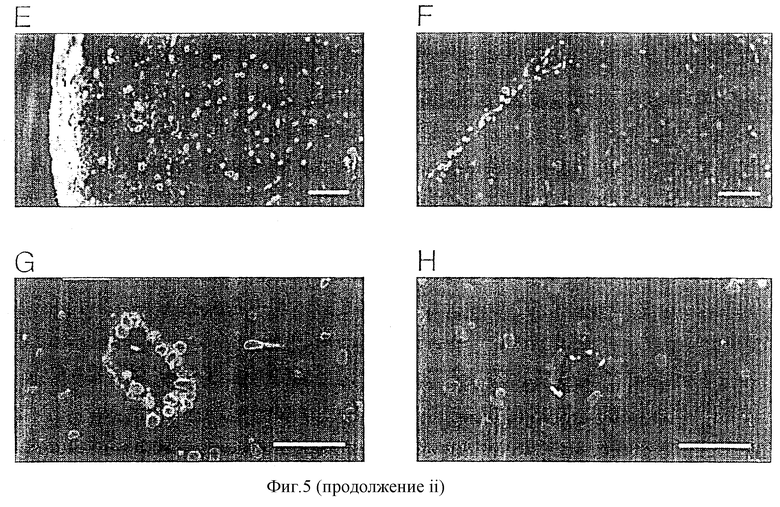
Фигура 5Е: MAT были обнаружены в субарахноидальном пространстве и лежащем ниже мозге. Полоса представляет 75 мкм.
Фигура 5F: слабая флуоресценция, присутствующая в контроле, возможно, вызвана неспецифическим связыванием. Полоса представляет 75 мкм.
Фигура 5G: MAT дополнительно распространяются в периваскулярном пространстве. Полоса представляет 50 мкм.
Фигура 5Н: по сравнению контроли показывают слабое связывание иммуноглобулинов в периваскулярном пространстве. Полоса представляет 50 мкм.
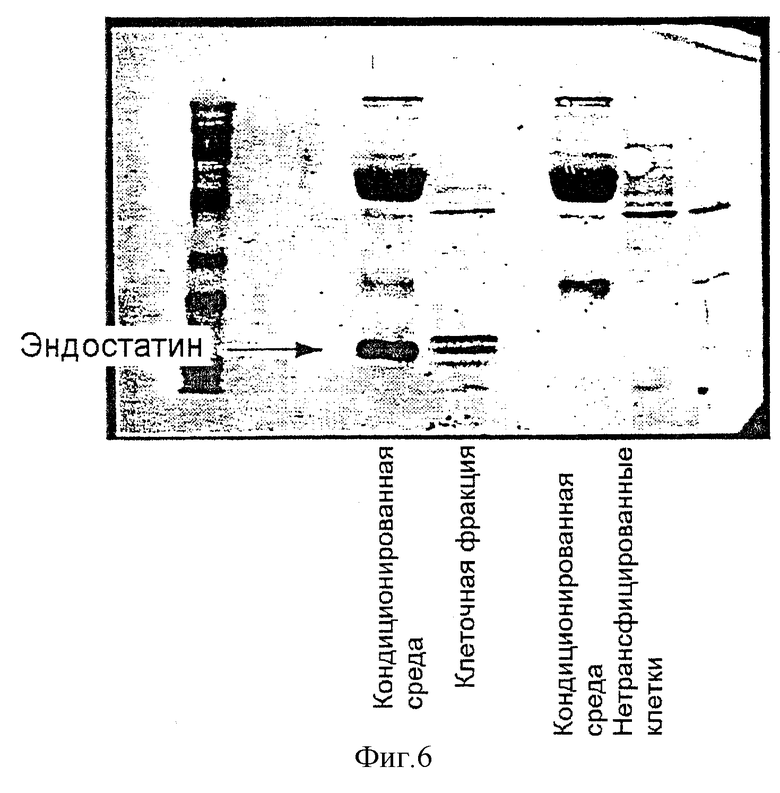
Фигура 6: радиоиммуноанализ, который показывает успешную приживаемость клеток-продуцентов эндостатина. Фигура показывает радиоиммуноанализ высвобождения эндостатина из кондиционированной среды, в клеточных фракциях и в среде из нетрансфицированных клеток во второй, третьей и четвертой колонке, соответственно.
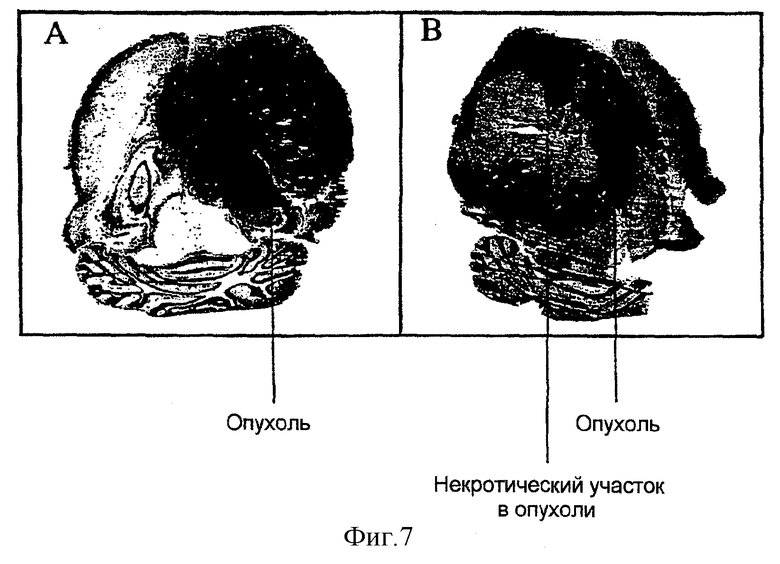
Фигура 7: действие альгинатной терапии эндостатином на рост опухоли. Снимок А показывает пример контрольного животного, которому были имплантированы имитирующие трансфицированные клетки, инкапсулированные в альгинатные гранулы. Более темный участок мозга показывает опухолевый участок.
Снимок В показывает пример животного, обработанного инкапсулированными, продуцирующими эндостатин клетками. Более темный участок показывает опухоль, и видна большая некротическая зона в центре опухоли.
Опыты
Материалы и методы
1. Клеточные линии
В опытах заявителей использовались четыре клеточные линии:
Клеточная линия Детали хранения
1. NIH 3Т3 АТСС CRL/1658
2. BT4CnVlacZ не хранится
3. Н528АТСС НВ 8509
4. GaMg не хранится
Мышиные фибробласты NIH 3Т3 представляют потенциальную линию клеток-продуцентов в том плане, что она способна быть генетически измененной в целях экспрессирования веществ, которые проявляют действие против роста, прогрессирования и развития опухоли. Клетки NIH 3Т3 были инкапсулированы в альгинат, как описано ниже, и использовались для изучения морфологии, жизнеспособности и кинетики клеточного цикла in vitro. Для исследования жизнеспособности инкапсулированных клеток in vivo альгинатные гранулы, содержащие клетки NIH 3Т3, имплантировали в мозг крысы.
Клеточная линия BT4CnVlacZ первоначально была получена из индуцированной этилнитрозомочевиной крысиной глиомы и ее стабильно трансфицировали бактериальным геном lacZ, клонированным в плазмиду, содержащую длинную концевую повторную последовательность с геном устойчивости к неомицину вируса мышиной лейкемии Молони, экспрессированной из внутреннего промотора вируса саркомы Руса. Смотри J.Natl.Cancer Inst., 55 (1975), pages 1177-1187 and Int.J.Cancer, 71 (1997), pages 874-880. Клетки инкапсулировали в альгинате и исследовали in vitro синтез бактериальной β-галактозидазы.
Клеточную гибридомную линию Н528 получили из Американской типовой культуральной коллекции (АТСС Rockville, МА). Клеточную линию получили слиянием клеток миеломы NS-1-Ag4-1 с клетками селезенки от мышей BALB/c, и она продуцирует мышиные моноклональные антитела (MAT) (IgG2a), которые связываются и блокируют EGF-связующий домен человеческого рецептора эпидермального фактора роста (EGFR). В условиях in vitro и in vivo было изучено высвобождение MAT из инкапсулированных в альгинате клеток при использовании этой клеточной линии.
Клеточная линия человеческой гликомы GaMg описана в Anticancer Res., 8 (1988), pages 874-880, и ранее было показано, что она экспрессирует EGFR (Acta Neuropathol. Berl., 84 (1992), pages 190-197). Изучали специфическое ингибирование миграции клеток GaMg в сокультуральной системе между многоклеточными сфероидами GaMg и инкапсулированными клетками Н528.
2. Клеточная культура
Клеточные линии NIN 3Т3 и BT4CnVlacZ росли в матрасах для культивирования площадью 80 см2 (Nunc, Roskilde, Дания) с полной питательной средой, состоящей из среды Игла, модифицированной по способу Дульбекко (DMEM), с добавлением 10% интактированной теплом сыворотки новорожденного теленка, в 4 раза увеличенной по сравнению с прописью концентрации заменимых аминокислот, 2% L-глутамина, пенициллина (100 МЕ/мл) и стрептомицина (100 мкг/мл) (все реактивы от BioWhittaker, Verviers, Бельгия). Клеточные линии гибридомы Н528 и GaMg росли в матрасах для культивирования площадью 80 см2 (Nunc) в культуральной среде RPMI 1640 с добавлением 10% лошадиной сыворотки (BioWhittaker). По достижении слияния монослой GaMg обработали 3 мл 0,025% трипсина (BioWhittaker) и сфероиды стимулировали посевом 5×106 клеток в 20 мл полной среды RPMI в матрасах для культивирования площадью 80 см2 (Nunc), покрытых 0,5% инертным агаром (Difco, Detroit, MI). Все клеточные линии содержали в обычном инкубаторе для тканевых культур при 37°С, 100% относительной влажности, 95% воздуха и 5% СO2.
3. Структура и свойства альгината
В этих опытах для микроинкапсулирования клеток-продуцентов использовали альгинат натрия из коричневой морской водоросли Laminaria hyperborea (LF 10/60) (Protanal, Drammen, Норвегия). Он состоял из двух моносахаридов: α-L-гулуроновой кислоты (G) и β-D-маннуроновой кислоты (М). G- и М-единицы соединены вместе в блоки трех различных типов: GG, ММ и MG, и пропорции и распределение этих блоков определяют химические и физические свойства молекул альгината. Некоторые двухвалентные катионы, подобно Са2+, прочно связываются между отдельными G-блоками, что начинает образование широкой альгинатной сети, в которой G-блоки образуют жесткие соединения. Альгинат, который использовали заявители, имеет высокое содержание, выше 60%, G-блоков, что приводит к высокой механической прочности и пористости, делая его пригодным для инкапсулирования клеток в целях получения вторичных метаболитов (смотри Trends in Biotechnology, 8 (1990), pages 71-78). Сканирующей электронной микроскопией было показано, что размер пор в альгинатных гранулах находится в пределах между 5 и 200 нм (33, 34). Механическая прочность, объем стабильности и пористость гранул коррелируют с содержанием гулуроновой кислоты.
4. Инкапсулирование клеток
Использованный способ инкапсулирования детально описан в "Alginate as Immobilization Matrix for Cells" by Smidsrod and Skjak-Braek in Trends in Biotechnology, March 1990, Vol.8, №3, pages 71-78.
Кратко капли клеток, разведенных в 1,5% альгинате натрия, вылили в 0,1 М Са2+-раствор. После полимеризации альгинатные гранулы три раза промыли в забуференном фосфатом физиологическом растворе Дульбекко (DPRS: Sigma, St.Louis, МО) и один раз в питательной среде. Инкапсулированные клетки культивировали во флаконах для культивирования площадью 175 см2 (Nunc), содержащих 50 мл питательной среды. Питательную среду меняли каждые три дня, и флаконы заменяли один раз в неделю. Все инкапсулированные в альгинате клетки держали в обычном инкубаторе для тканевых культур при 37°С, 100% влажности, 95% воздуха и 5% CO2. Для всех опытов с клеточными линиями NIH 3Т3 и BT4CnVlacZ использовали плотность клеток 6×106 клеток/мл альгината и гранулы размером между 0,8 и 1,2 мм. Для опытов in vitro с клеточной линией Н528 использовали плотность клеток 3×105 клеток/мл альгината и диаметр гранул между 2,3 и 2,5 мм. Для опытов in vivo с клеточной линий Н528 использовали плотность клеток 3×105 клеток/мл альгината и диаметры гранул между 0,8 и 1,2 мм.
Опыты in vitro
1. Морфология и жизнеспособность инкапсулированных в альгинате клеток
Морфологию клеток NIH 3Т3, инкапсулированных в альгинате, исследовали в день инкапсулирования и через 3 и 9 недель в 6 гранулах, перенесенных в 6-луночный планшет (Nunc) с верхним слоем из 1,0 мл DPBS. Гранулы исследовали световым микроскопом Nikon Diaphot и фотографировали фотокамерой Nikon F-301. Опыты по морфологии провели в двух параллелях.
Жизнеспособность клеток внутри альгинальных гранул исследовали в день инкапсулирования и через 3 и 9 недель методом двухцветной флуоресценции на жизнеспособность (тест на живые/мертвые™ жизнеспособность/цитотоксичность, Molecular Probes, Eugene, OR). Раствор метки готовили из 2 мкМ кальцеина-АМ и 4 мкМ этидия гомодимера в полной питательной среде. Альгинатные гранулы поместили по отдельности в 16-мм мультилуночные планшеты (Nunc) с верхним слоем из 0,5 мл раствора метки на 30 минут при комнатной температуре. После этого их перенесли в DPBS и сразу же исследовали. Флуоресценцию измеряли в оптических блоках через альгинат, используя конфокальный лазерный сканирующий микроскоп с аргоновым-криптоновым лазером (Biorad MRC-1000, Hemel Hempstead, Англия), используя оптику с фильтрами на Техасовый красный и ФИТЦ. Флуоресценцию фиксировали в плоскости 120 мкм внутри альгинатных гранул. Опыты по жизнеспособности проводили в трех параллелях.
Изучали образование β-галактозидазы в клетках BT4CnVlacZ, инкапсулированных в альгинате в течение 1, 3 и 9 недель. Гранулы промыли в течение 1 мин в DPBS (рН 8,4) и зафиксировали в течение 10 мин в 0,2% глутаральдегиде и 2% формальдегиде в DPBS. Затем их промыли 3×5 мин в DPBS и окрасили на активность β-галактозидазы 5-бром-4-хлор-3-индолил β-D-галактопиранозидом (х-галь, Sigma). Раствор субстрата состоял из 1 мг/мл х-галя, растворенного в 100 мкл диметилформамида, и его смешали с 5 мМ железосинеродистого калия, 5 мМ железистосинеродистого калия и 2 мМ MgCl2, растворенных в DPBS (все реактивы от E.Merck, Darmstadt, Германия). Их инкубировали при 4°С минимум в течение 24 часов и определили β-галактозидазную активность, представленную в виде окрашенной в голубой цвет цитоплазмы.
2. Кинетика клеточного цикла у клеток, инкапсулированных в альгинате
Распределение по клеточному циклу инкапсулированных клеток NIH 3Т3 определяли проточным цитометрическим ДНК-анализом. Инкапсулированные клетки высвобождали из альгината растворением гранул в полной питательной среде, содержащей 1,5% тринатрий цитрата дигидрат (E.Merck) в течение 15 мин, с последующим центрифугированием при 140 g в течение 4 мин и удалением супернатанта. Клетки вновь дважды суспендировали в полной питательной среде, центрифугировали при 140 g в течение 4 мин, фиксировали в охлажденном на льду 96% этаноле и хранили при 4°С. Перед анализом проточной цитометрией клетки инкубировали в течение 15 мин с 0,5% пепсином (Sigma) в 0,9% физиологическом растворе (рН 1,5) при 37°С перед тем, как выделенные ядра промыли в 0,9% физиологическом растворе и обработали в течение 1 мин рибонуклеазой (Sigma) (1 мг/мл в 0,9% физиологическом растворе). Окрашивание ДНК получили при добавлении пропидия йодистого (Sigma) (50 мкг/мл в 0,9% физиологическом растворе) к ядрам. Содержание ДНК в клетках определяли, используя проточный цитометр Becton Dickinson FACSort (Becton Dickinson, Palo Alto, CA). ДНК-гистограммы получили установкой окна двухпараметрической прямой и побочной цитодиаграммы рассеяния к однопараметрической ДНК-гистограмме. Каждую гистограмму получили при подсчете 5000 возбужденных ядер. Опыты по цитометрии повторили три раза и распределение клеток по циклу определили, как описано в Radiat Environ Biophys., 12 (1975), pages 31-39.
3. Высвобождение антител из инкапсулированных гибридомных клеток
Приготовили альгинатные гранулы с диаметром в пределах между 2,3 и 2,5 мм, содержащие 1,5×103 клеток Н528 на гранулу в день инкапсулирования, как описано выше. Соответственно через 0, 1, 5, 12, 19, 23, 30 и 33 дня по 10 гранул удаляли из маточной культуры и исследовали высвобождение MAT в среду RPMI. Гранулы перенесли в 24-луночные планшеты (Nunc) в 0,5 мл полной среды RPMI (37°C). Через 6 часов инкубации собрали четыре пробы по 100 мкл каждая, поместили в центрифужные пробирки емкостью 1,5 мл (Treff AG, Degersheim, Швейцария) и заморозили при -20°С.
Проточную цитометрию использовали для определения концентрации MAT в пробах. Монослойные клеточные культуры GaMg обработали трипсином с 2 мМ ЭДТА в DPBS. Затем клетки центрифугировали при 140 g в течение 4 мин, супернатант удалили и клетки зафиксировали в 2% растворе параформальдегида в DPBS в течение 1 мин. После чего клетки центрифугировали при 140 g в течение 4 мин, супернатант удалили. Затем клетки повторно развели в DPBS, содержащем 2 мМ ЭДТА, 1% бычьего сывороточного альбумина и 1 г/л глюкозы и распределили в конусообразном 96-луночном планшете (Nunc) из расчета 1,7×105 клеток/лунку. Клетки центрифугировали при 340 g в течение 4 мин и супернатант удалили. После этого клетки обработали на вортексе и инкубировали в течение 2 часов при 4°С с собранными MAT в среде RPMI (неразбавленные и в разведении 1:5, 1:20 и 1:100 в DPBS). В качестве стандарта использовали антитела MAT (528) EGFR (Santa Cruz Biotechnology, Santa Cruz, CA) с известной концентрацией MAT (концентрации 20, 5, 1, 0,2, 0,1 и 0,05 мкг/мл). Клетки промыли дважды в 2 мМ ЭДТА, 1% BSA, 1 г/л глюкозы в DPBS и затем инкубировали с козьими мечеными ФИТЦ антимышиными иммуноглобулинами (Dako A/S, Glostrup, Дания) (в разведении 1:20) в течение 30 мин при 4°С. Проточную цитометрию провели на проточном цитометре Becton Dickinson FACSort. Детектировали и делали видимыми отдельные клетки двухпараметрической прямой и побочной цитограммой рассеивания и устанавливали окно на однопараметрическую ФИТЦ-гистограмму, на которой определяли интенсивность флуоресценции. Получили стандартную кривую связывания антител с клетками GaMg, используя различные титры MAT к EGFR с известной концентрацией на клетки GaMg. При сравнении результатов, полученных со средой, собранной из гибридомы, содержащей альгинантные гранулы, получили кривую концентрации МАТ.
4. Миграция клеток
Сфероиды GaMg по отдельности перенесли в 16-мм мультилуночные планшеты (Nunc) в 1,0 мл полной среды RPMI, содержащей 10 нг/мл EGF (Sigma). После этого опухолевые клетки подвергли воздействию альгинатных гранул, содержащих клетки Н528 (по три альгинатных гранулы в каждой лунке). В качестве контроля сфероиды подвергли воздействию полной среды RPMI с и без 10 нг/мл EGF. Ежедневно в течение четырех дней измеряли ортогональный диаметр каждой колонии, используя световой микроскоп с измерительной сеткой в окуляре. Затем определяли округлый участок, покрытый клетками, мигрировавшими из сфероидов, и использовали в качестве показателя миграции. Опыты провели в двух параллелях с шестью сфероидами в каждом опыте.
5. Приживаемость клеток-продуцентов эндостатина и доказательство высвобождения эндостатина из гранул
5а. Приживаемость клеток-продуцентов эндостатина
Методы:
Клеточная линия и условия культивирования
В качестве линии клеток-продуцентов использовали человеческие эмбриональные почечные клетки 293 (293-EBNA), экспрессирующие ядерный антиген вируса Эпштейн-Барра (EBNA)-1.
Клетки трансфицировали эписомальным вектором экспрессии рСЕР-Рu, содержащим ген, кодирующий человеческий эндостатин, в липосомах и отбирали с 0,5 мкг/мл пуромицина.
Трансфицированные клетки (293-эндо) росли до слияния в матрасах для культивирования площадью 175 см (Nunc, Roskilde, Дания), содержащих питательную среду, состоящую из модифицированной со способу Дульбекко среды Иглы (DMEM) с добавлением 10% инактивированной теплом фетальной бычьей сыворотки, 4,5 г/л D-глюкозы, пенициллина (100 МЕ/мл) и стрептомицина (100 мкг/мл), 205 мкг/мл генетицина (G-418) и 0,5 мкг/мл пуромицина. Имитирующие трансфектанты получили трансфицированием клеток 293 вектором рСЕР-Рu без гена эндостатина и выращивали в тех же условиях, за исключением пуромицина (все реактивы от Biowhitaker, Verviers, Бельгия).
Опухолевую клеточную линию (ВТ4С), выбранную для этих опытов, получили из индуцированной этилнитрозомочевиной крысиной глиосаркомы (пассаж номер 26), и она является сингенной в BD-IX. Клетки росли до слияния в матрасах для культивирования площадью 80 см2 с полной питательной средой, состоящей из модифицированной по способу Дульбекко среды Игла (DMEM) с добавлением 10% интактированной теплом сыворотки новорожденного теленка, в 4 раза увеличенной по сравнению с прописью концентрации заменимых аминокислот, 2% L-глутамина, пенициллина (100 МЕ/мл) и стрептомицина (100 мкг/мл).
5b. Установление высвобождения эндостатина из гранул
Иммуноблоты
Собрали кондиционированную среду из инкапсулированных клеток эндо-29 и 293-EBNA и использовали для постановки обычного Вестерн-блоттинга SDS/PAGE для определения того, высвобождается ли эндостатин из гранул.
Кратко, пробы разделили в 12% SDS-геле и гибридизировали на нитроцеллюлозной мембране PVDP. Блоты промыли 100% метанолом в течение 5 мин, дистиллированной водой - 1 мин, блокирующим раствором (0,05 М Трис/HCl, 0,45 М NaCl, 2% Твина, рН 10,2) - 4 мин и наконец буфером для промывания (0,05 М Трис/HCl, 0,15 М NaCl, 0,05% Твина 20, рН 10,2) в течение 15 мин. Затем блоты инкубировали в течение ночи с кроличьей античеловеческой антисывороткой (1:1000 в буфере для промывания). После инкубирования в течение ночи блоты промыли в DPBS и инкубировали со свиным антикроличьим конъюгированным с щелочной фосфатазой IgG (DAKO, Дания).
Полосы делали видимыми при инкубации субстрата с окрашивающим раствором (2-4 мин).
Опыты in vivo
1. Внутричерепные имплантации
Инбредных крыс самцов BD-IX (36) с массой тела 160-250 г содержали на стандартном гранулированном рационе, давали неограниченный доступ к водопроводной воде и содержали в клетках индивидуально при постоянной температуре и влажности при режиме 12 часов свет и темнота. Крыс анестезировали внутрибрюшинно пентобарбитолом в дозе 0,4 мл/100 г живой массы. Через центральный сагиттальный разрез кожи провели трепанацию черепа с помощью сверла размером 3,5 мм на 4,2 мм сзади брегмы и на 2,5 мм вправо от сагиттального шва. Удалили корковое и белое вещество ткани отсосом до глубины 2,0 мм и в полость ткани поместили от 8 до 14 альгинатных гранул (однодневные гранулы), содержащих либо клетки NIH 3Т3, либо клетки Н528. Отверстие после трепанации закрыли костным воском, кожу зашили полиамидной нитью. В течение 1 часа животным дали отойти от операции под согревающей лампой. Уход за животным вели в соответствии с установленными правилами. Крыс наблюдали один раз в день и через день взвешивали. Все животные быстро выздоровели после имплантаций и не было заметно признаков заболевания или неврологических нарушений во время периода наблюдения.
2. Высвобождение и распространение иммуноглобулинов внутри мозга крыс
Через 3 и 9 недель крыс забили ингаляцией СO2. Мозг извлекли, поместили в раствор Tissue Tec (Miles Laboratories Inc., Naperville, IL) и заморозили в 2-метилбутане (E.Merck), охлажденном в жидком азоте. Продольные срезы (14 мкм) делали на криотоме Reichert-Jung cryocut 1800 (Leica, Wetzlar, Германия) и хранили при ~20°С. Криосрезы, полученные от крыс, которым имплантировали инкапсулированные клетки Н528 и забили через 3 недели, фиксировали в ацетоне в течение 5 мин при комнатной температуре и затем дважды промыли в DPBS в течение 5 мин. Затем срезы инкубировали с мечеными ФИТЦ козьими антимышиными иммуноглобулинами (Dako A/S, разведение 1:20) в течение 1 часа при комнатной температуре и затем промыли в течение 5 мин DPBS. Срезы обработали в течение 30 с рибонуклеазой (Sigma) (0,5 мг/мл в 0,9% физиологическом растворе) и окрашивание ядер получили при добавлении к срезам пропидия йодистого (Sigma) (50 мкг/мл в 0,9% физиологическом растворе). Кроме того, срезы промыли DPBS в течение 5 мин и затем поместили с Vectashield (Vector Laboratories Inc., Burlingame, CA). Флуоресценцию замеряли, используя конфокальный лазерный сканирующий микроскоп Leica TCS NT с аргоновым-криптоновым лазером (Leica), используя оптику с фильтрами на TRITC и ФИТЦ. Исследовали срезы, отобранные на одинаковой глубине внутри мозга экспериментальных животных, и изучали участки максимальной флуоресценции в обеих группах. Криосрезы, полученные от крыс, которым имплантировали клетки NIH 3Т3 и забили через 9 недель, окрасили гематоксилином и эозином для гистологического исследования.
3. Иммунные ответы на клетки-продуценты, инкапсулированные в альгинате
Методы
Через 1, 3 и 9 недель после имплантации оценивали процент иммуноположительных клеток в пограничной зоне между мозгом и альгинатными гранулами у крыс BD-IX. Мозг поместили на подложки, залили в раствор tissue-tec и заморозили в жидком азоте. Серийные продольные срезы 5-20 мкм сделали на криостате Reichert Jung (Leica, Wetzlar, Германия), поместили на предметные стекла и готовили для иммуногистохимического анализа. Срезы зафиксировали в холодном ацетоне в течение 5 мин, инкубировали в течение 30 мин при комнатной температуре с 10% нормальной кроличьей сывороткой, разбавленной в PBS, и затем инкубировали в течение ночи при 4°С во влажной камере с мышиными моноклональными антителами (MAT), разбавленными в 10% кроличьей сыворотке.
Использовали следующие MAT: 0Х42, ED1 и ED2 антикроличьи макрофагальные MAT, 0Х19 против СD5-положительных Т-клеток и OХ33, реагирующими с СD45КА-положительными В-клетками. MAT получили из Serotec, Oxford, Великобритания.
В течение 30 мин использовали биотинилированные кроличьи антимышиные иммуноглобулины, разбавленные 1:300. Авидин-биотин-пероксидазный комплекс (АВС комплекс/HRP, Dakopatts, Glostrup, Дания) готовили, как рекомендовано производителем, и дали ему прореагировать со срезами в течение 30 мин. Наконец, срезы обработали буфером, содержащим 3-амино-9-этилкарбазол, для развития окрашенного продукта реакции. После всех инкубаций последовало промывание в PBS. Все препараты контрастно окрасили гематоксилином, поместили в глицергель (Dakopatts) и исследовали световой микроскопией.
4. Действие альгинатной терапии с эндостатином на рост опухолей
Молодых взрослых крыс BD-IX обоего пола (8 крыс в целом плюс 20 контролей) анестизировали внутрибрюшинными инъекциями эквитезина в дозе 0,4 мл/100 г массы тела. Крыс иммобилизовали на стереотактическом станке (David Kopf Instruments, Tujunga, США), сделали разрезы на коже и провели трепанацию черепа с отверстием 2 мм на 1 мм сзади и на 3,0 мм вправо от брегмы и на глубине 2,5 мм поместили альгинатные гранулы. После этого ввели клетки глиосаркомы 1×104 ВТ4С на 1 мм латеральнее по отношению к альгинатным гранулам на глубину 2 мм. Альгинатные гранулы содержали либо клетки 293, продуцирующие эндостатин, либо имитирующие трансфектанты 293 в качестве контроля. Восемь животных получили имплантаты каждой формы клеточной линии. Кроме того, в качестве контроля нормального прогрессирования опухоли 8 животным ввели только одни клетки ВТ4С.
Наконец, в качестве контроля жизнеспособности клеток внутри гранул в условиях in vivo оставшиеся 4 контрольных животных получили альгинатные гранулы, содержащие одни клетки 293-эндо. Шприц медленно оттягивали в течение 3 мин (для всех инъекций) и отверстие закрыли костным воском и наложили швы. Животным дали отойти после операции под наблюдением. Во время экспериментального периода животных разместили попарно при постоянной температуре и влажности, кормили обычным гранулированным кормом и вволю обеспечивали водопроводной водой.
Результаты
Опыты in vitro
1. Морфология и жизнеспособность инкапсулированных в альгинате клеток
Альгинатные гранулы диаметром 1,0 мм содержали примерно 6,5×102 клеток NIH 3Т3 в день инкапсулирования (фиг.1А). Клетки равномерно распределились внутри альгинатных гранул, со внешним, свободным от клеток ободком 25-50 мкм. Во время культивирования наблюдали клеточную пролиферацию внутри альгината, что привело через 3 недели к повышенной клеточной плотности (фиг.1В). Через 9 недель в культуре, внутри альгинатных гранул, наблюдали наличие многоклеточных сфероидов (фиг.1С). Через 9 недель более 90% гранул оставались интактными в культуре, что оценили световой микроскопией. Примерно через неделю несколько отдельных клеток в культуре мигрировало из альгинатных гранул в питательную среду, и это ограниченное движение отдельных клеток продолжалось во время последующих 8 недель культивирования.
Исследование с помощью конфокальной лазерной сканирующей микроскопии показало, что примерно 90% инкапсулированных клеток оставалось живыми в день инкапсулирования (фиг.1D). Через 3 недели примерно 50% в культуре первоначально инкапсулированных клеток были живыми (фиг.1Е). Некоторые выжившие клетки адаптировались к альгинату и образовали многоклеточные сфероиды, которые можно было четко наблюдать через 9 недель (фиг.1F). На этой временной точке общее число живых клеток внутри гранул было трудно оценивать за счет образования многоклеточных сфероидов. Однако, как показано на фиг.1F, большая часть клеток, находившаяся в сфероидах, была живой.
Инкапсулированные клетки BT4CnVlacZ экспрессировали постоянную и равномерно распределенную β-галактозидазную активность во время всего периода наблюдения в течение 9 недель (фиг.1G).
2. Кинетика клеточного цикла у клеток, инкапсулированных в альгинате
Гистограммы проточной цитометрии NIH 3Т3 клеток показали изменение в плоидности клеток внутри альгинатных гранул через 1 неделю после инкапсулирования (фиг.2В). Возможно, оно представляет полиплоидизацию по сравнению с диплоидным набором в контроле (фиг.2А). Однако через 3 и 9 недель, соответственно фиг.2С, 2D, наблюдали нормализацию плоидности с аналогичным диплоидным распределением, как и в контроле. Фракция пролиферирующих клеток в S и G2M фазах in vitro составила 50% для контроля, по сравнению с 55% и 60% спустя 3 и 9 недель соответственно.
3. Высвобождение антител из инкапсулированных гибридомных клеток
Уже в конце первого дня инкапсулирования было высвобождение 13 нг/(мл×ч) MAT в питательную среду (фиг.3). Диффузия иммуноглобулинов из гранул и в среду постоянно увеличивалась в течение последующих дней культивирования и через 12 дней достигла концентрации 457 нг/(мл×ч). Продукция MAT затем стабилизировалась на уровне около 400 нг/(мл×ч) во время последних 3 недель периода наблюдения.
4. Миграция клеток
Миграция клеток из сфероидов GaMg, стимулированная EGF, была экстенсивной, и средняя величина зоны пророста удвоилась по сравнению с контролем (фиг.4). Однако, когда альгинатные гранулы, содержащие клетки Н528, добавили в присутствии EGF, клеточная миграция сильно ингибировалась, показывая, что инкапсулированные клетки-продуценты Н528 эффективно экспрессируют антитела, направленные против рецептора EGF.
5. Установление высвобождения эндостатина из гранул
Как видно из вестерн-блотов кондиционированной среды, собранной из гранул, высвобождается значительное количество эндостатина из гранул (фиг.6). Радиоиммуноанализ показал, что 10 альгинатных гранул, продуцирующих эндостатин (400 мкм) с 25000 инкапсулированными клетками, секретировали 2,5 мкг/мл/24 ч.
Опыты in vivo
1. Внутричерепные имплантации
Продольные срезы мозга крыс выявили незначительные или отсутствие изменений в паренхиме мозга, смежной с местом имплантации инкапсулированных в альгинате клеток NIH 3Т3 (фиг.5А). Через 9 недель наблюдали незначительный внутричерепной отек или набухание. В альгинатных гранулах отсутствовал какой-либо пророст клеток и они содержали как живые отдельные клетки, так и многоклеточные сфероиды (фиг.5В). Живые клетки были распределены как в центре, так и на периферии гранул, со свободными от клеток участками альгината между клетками. Наблюдали минимальную агрегацию клеток вокруг пограничной зоны между отверстием для имплантации и паренхимой мозга.
2. Высвобождение и распространение иммуноглобулинов внутри мозга крысы
Имплантированные гранулы с инкапсулированными гибридомными клетками можно было легко видеть через 3 недели по интенсивной зеленой флуоресценции (фиг.5С). Иммуноглобулины детектировались в мозговой ткани на расстоянии по меньшей мере 1 мм от альгинатных гранул (фиг.5С, 5D) с постепенным снижением интенсивности флуоресценции от границы места имплантации и внутрь мозга. У двух опытных животных MAT были детектированы по всему полушарию мозга, в котором находились имплантаты (данные не показаны). Дополнительно MAT были обнаружены в лептоменинксе обоих полушарий мозга (фиг.5Е) с самой сильной флуоресценцией, заметной в субарахноидальной области в правом полушарии. Отрицательные контроли показали слабую флуоресценцию в лептоменинксе, возможно вызванную неспецифическим связыванием между иммуноглобулинами и эпитопами клеток лептоменинкса (фиг.5F).
Однако паренхима мозга дала отрицательный результат. Кроме того, MAT находились в периваскулярном пространстве внутричерепных кровеносных сосудов без явного различия в интенсивности флуоресценции между двумя полушариями (фиг.5G). Слабая флуоресценция, присутствующая в контроле, возможно была вновь вызвана неспецифическим связыванием (фиг.5Н).
3. Иммунные ответы на клетки-продуценты, инкапсулированные в альгинате
В мозге, смежном с альгинатными гранулами, наблюдали инфильтрацию мононуклеарных клеток. Количество клеток в инфильтрате уменьшилось с 1 недели к 9 неделе. Через одну неделю после имплантации была видна OХ42-положительная микроглия с дендритной морфологией в паренхиме и реактивная микроглия и проникшие моноциты, появившиеся в пограничной к альгинатным гранулам зоне. ED1 и ED2 окрасили моноциты, близкие к пограничной зоне, в то время как несколько клеток окрашивались этими MAT повсюду в паренхиме мозга. Также в пограничной к гранулам зоне наблюдалось ограниченное количество Т- и В-клеток (таблица). Количество OХ42-положительных клеток в пограничной зоне снизилось с 62% в первую неделю до 20% на 9 неделе, в то время как количество ED1-положительных клеток уменьшилось с 37% на первой неделе до 7% на 9 неделе. Количество ED2-положительных клеток (5%), Т-клеток (14%) и В-клеток (1%) изменилось только предельно во время периода наблюдения (таблица).

4. Действие альгинатной терапии с эндостатином на рост опухолей
Животные, которые были обработаны клетками-продуцентами эндостатина в альгинате жили на 20±4% дольше, чем обработанные имитирующими трансфицированными клетками. Детальные гистологические исследования выявили большие некротические зоны в опухолях, которые получили альгинатную терапию с эндостатином (смотри фиг.7, часть В). Такие некротические зоны никогда не были видны в контроле (имитирующие трансфицированные клетки, инкапсулированные в альгинате, фиг.7, часть А).
Обсуждение
Результаты вышеописанных опытов ясно показывают, что микроинкапсулированные клетки выживают, пролиферируют и сохраняют их фенотипическую экспрессию в течение длительного периода времени. Также было показано, что MAT, высвобождающиеся из альгинатных гранул, имеют способность ингибировать миграцию опухолевых клеток in vitro, взаимодействуя с EGFR, и что MAT высвобождаются и распространяются внутри мозга крыс.
Как видно из результатов световой микроскопии, клетки NIH 3Т3 адаптировались к альгинату in vitro и начали пролиферировать в течение нескольких дней после инкапсулирования. Исследование CLSM выявило, что жизнеспособность клеток находится на уровне около 90% в день инкапсулирования. Во время первых трех недель в культуре примерно 50% первоначально включенных клеток погибло внутри капсул. Однако через 9 недель оставшиеся клетки проявили способность образовывать многоклеточные сфероиды внутри альгината. О наблюдаемой гибели клеток внутри альгината также сообщали и другие авторы, и она может быть результатом пониженной диффузии кислорода, питательных веществ и продуктов выделения, что в конечном счете может привести к равновесию между числом пролиферирующих и погибающих клеток. Более благоприятной скорости диффузии можно достичь при снижении размера гранул, увеличении содержания G-единиц, что повысит размер пор, или изменением концентрации альгината. Кроме того, диффузия зависит от числа первоначально инкапсулированных внутри гранул клеток. Альгинат сам по себе является нетоксичным и, следовательно, не следует ожидать, что он способствует наблюдаемой гибели клеток внутри гранул.
Клетки BT4CnVlacZ показали высокую и равномерно распределенную активность β-галактозидазы в течение 9 недель культивирования.
Эти результаты показывают, что также могут образовываться специфические генные продукты во время продолжительных периодов внутри альгинатных гранул.
Исследование проточной цитометрией показало, что клетки NIH 3Т3 через неделю изменяются от диплоидной к мультиплоидной популяции. Это указывает на то, что ядра клеток делятся, но в результате ограниченного пространства внутри жесткой альгинатной сети клетки первоначально не способны подвергаться цитокинезу. Это приводит к появлению отдельных клеток с двумя или тремя ядрами (фиг.2В). Однако через 3 недели распределение клеточного цикла было аналогичным контролю. Это может указывать на то, что для клеток необходим определенный период адаптации внутри альгината, и что отдельные клетки с двумя и тремя ядрами либо завершают их цитокинез, либо погибают. Гистограммы через 9 недель были аналогичными таковым через 3 недели, но имелись показатели, указывающие на увеличение клеток в пролиферирующих фазах. Анализ распределения клеточного цикла показал увеличение числа пролифелирующих клеток от 50% в контроле до примерно 60% через 9 недель. Это может быть результатом селекции клеток внутри альгинатных гранул с более высокой пролиферативной способностью во время продолжительного культивирования клеток NIH 3Т3.
Высвобождение антител из инкапсулированных гибридомных клеток Н528 было в основном постоянным на уровне примерно 400 нг/(млxч) с 12 дня по 33 день, что показывает, что в культуре через 12 дней установилась стабильная плотность МАТ-секретирующих гибридомных клеток. Этот обнаруженный факт важен для клинической ситуации, поскольку он показывает, что достигается стабильная продукция моноклональных антител на высоком уровне.
Миграцию клеток из сфероидов GaMg стимулировали в присутствии EGF. При добавлении инкапсулированных клеток H528 к стимулированным EGF сфероидам миграция ингибировалась и зона пророста была аналогичной в контроле. На основании этого можно предположить, что паракринные механизмы клеточной пролиферации ингибируются этими МАТ, возможно, за счет блокирования EGF-связывающего домена EGFR.
Было показано, что при имплантации инкапсулированных в альгинате клеток-продуцентов в другие органы вне центральной нервной системы (ЦНС) происходит пророст фибробластов в альгинатных гранулах, приводящий к гибели клеток и разрушению трансплантата (Transplantation, 54 (1992), pages 769-774). За счет уникальной локализации и отсутствия фибробластов в ЦНС этот клеточный пророст не наблюдали в настоящем исследовании (фиг. 5А, В). Было показано, что, в зависимости от состава, альгинаты в некоторых случаях запускают иммунную систему в организме, стимулируя моноциты к продукции высоких уровней цитокинов. Цитокинестимулирующей частью альгината являются М-единицы. Следовательно, для опытов заявителей был выбран альгинат с высоким уровнем G-единиц для того, чтобы свести до минимума иммунный ответ в мозге. В последующих опытах заявители установили низкий иммунный ответ в отношении инкапсулированных в альгинате клеток внутри мозга, только с некоторым образованием микроглии в мозговой ткани, близкой к имплантированным гранулам. Эти наблюдения дополнительно показывают, что инкапсулированные в альгинате клетки-продуценты являются привлекательным способом лечения внутри мозга. Также наблюдали минимальную агрегацию клеток вокруг пограничной зоны между местом имплантации и паренхимой мозга. Это может быть за счет клеток NIH 3Т3, высвобождающихся из альгинатных гранул, вследствие слабого иммунного ответа на имплантат, как обсуждалось выше, и/или за счет ранозаживающего процесса в ткани. Однако не полагается, что небольшое количество клеток-продуцентов, которые высвобождаются из альгината, представляет проблему, поскольку эти клетки обеспечиваются нормальным трансплантатом против механизмов отторжения хозяином. Однако, если желательно, можно предпринять шаги для предупреждения высвобождения клеток, например, покрыв гранулы слоем поли-L-лизина или облучением клеток перед инкапсулированием, ингибируя тем самым пролиферативную способность. Иммуноглобулины высвобождались из альгинатных гранул и распространялись в паренхиме мозга на расстоянии по меньшей мере 1 мм от границы места имплантации. У двух опытных животных MAT также детектировали в целом полушарии мозга, где располагались имплантаты. Это распространение может быть за счет пассивной диффузии. MAT также находились в субарахноидальном пространстве и внутри периваскулярного пространства Вирхова-Робина. Это распространение наиболее вероятно осуществляется постоянным потоком цереброспинальной жидкости внутри ЦНС. Интересно, что опухолевые клетки следуют этими же путями распространения внутри мозга, что делает их доступными для компонентов, продуцируемых инкапсулированными в альгинате клетками.
В заключение опыты, описанные выше, показывают, что инкапсулированные клетки-продуценты выживают и пролиферируют внутри альгината в течение продолжительного периода времени как in vitro, так и in vivo. Внутри цитоплазмы инкапсулированных клеток BT4CnVlacZ продуцируются генные продукты, такие как β-галактозидаза, в течение нескольких недель культивирования. Инкапсулированные гибридомные клетки, кроме того, продуцируют и высвобождают большие количества MAT in vitro и in vivo. Миграция опухолевых клеток GaMg ингибируется в присутствии инкапсулированных клеток Н528. Также имплантаты инкапсулированных клеток Н528 продуцируют и высвобождают MAT внутри мозга крыс, и MAT распространяются внутри паренхимы мозга, а также внутри субарахноидального и периваскулярного пространства. Следовательно, настоящее изобретение представляет обещающее орудие для терапии опухолей ЦНС.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГИ ЖИРНЫХ КИСЛОТ ДЛЯ ЛЕЧЕНИЯ РАКА | 2001 |
|
RU2283105C2 |
| Способ подбора лекарственных средств для реализации фармакологической индукции митохондриальной дисфункции в макрофагах для противоопухолевой терапии | 2023 |
|
RU2810558C1 |
| СПОСОБЫ ИНГИБИРОВАНИЯ МИГРАЦИИ РАКОВЫХ КЛЕТОК | 2006 |
|
RU2404805C2 |
| МОДУЛЬНЫЕ ЧАСТИЦЫ ДЛЯ ИММУНОТЕРАПИИ | 2014 |
|
RU2672055C2 |
| ЭЛЮИРУЮЩАЯ МАТРИЦА И ЕЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2665359C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ, ИСПОЛЬЗУЮЩАЯ АНТИАНГИОГЕННЫЕ СРЕДСТВА И TNF-α | 2002 |
|
RU2316337C2 |
| Многофункциональные гибридные рекомбинантные белковые препараты для терапии опухолевых заболеваний | 2022 |
|
RU2801367C1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ФАКТОРУ РОСТА ГЕПАТОЦИТОВ | 2004 |
|
RU2361879C2 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО НА ОСНОВЕ ИММУНОЛИПОСОМАЛЬНОЙ БИОЛОГИЧЕСКОЙ КОНСТРУКЦИИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ВЕКТОРНОЙ ДОСТАВКИ В ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ ПРИ ОПУХОЛЕВОМ ПРОЦЕССЕ | 2007 |
|
RU2336901C1 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР, КОТОРЫЙ СВЯЗЫВАЕТ HLA-DR, И CAR-T-КЛЕТКА | 2019 |
|
RU2778890C1 |
Изобретение относится к области медицинской генетики. Сущность изобретения представляет клеточная линия, способная экспрессировать молекулы, ингибирующие рост опухоли центральной нервной системы (ЦНС), и инкапсулированная в иммуноизолирующий альгинатный гель. Инкапсулированная клеточная линия обеспечивает новый подход к лечению опухолей, которые локализуются в ЦНС, таких как опухоли головного мозга. Изобретение дает новый технический результат - расширение арсенала генетических средств лечения опухолей головного мозга. 4 с. и 11 з.п.ф-лы, 2 табл., 7 ил.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Yin DX et al | |||
| Tetracyclinecontrolled gene expression. | |||
| Anal | |||
| Biochem | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
Авторы
Даты
2004-05-27—Публикация
1999-08-25—Подача