Настоящее изобретение касается способа получения таксанов из 10-деацетилбаккатина III.
Паклитаксел (paclitaxel) является известным противоопухолевым лекарственным средством со структурой таксана, промышленное получение которого чрезвычайно сложное.
Паклитаксел был впервые выделен экстракцией из коры ствола Taxus brevifolia, и в настоящее время его синтезируют исходя из 10-деацетилбаккатина III, промежуточного соединения, присутствующего в листьях различных видов тисового дерева, в особенности в листьях Taxus baccata L., тем самым обходя экологические проблемы, связанные с доступностью коры Т. Brevifolia.
В литературе приводится ряд синтетических способов: US Re. 34.277 (переиздание патента США 4924011) описывает полусинтез паклитаксела исходя из 10-деацетилбаккатина III, защищенного по гидроксильной группе С-7 триалкилсилильной группой, в частности триэтилсилильной, и в положении 10 ацетильной группой. В WO 98/08832 защиту гидроксильной группы С-7 осуществляют использованием трихлорацетильной группы. Защищенное таким образом производное баккатина III подвергают взаимодействию с ацетилбромидом и, впоследствии, с подходящим производным фенилизосерина, получая паклитаксел после снятия защиты с гидроксильных групп в положении 7 и 2’ и бензоилирования амина.
В WO 93/06094 паклитаксел получают взаимодействием соединения типа бета-лактама с 7-триэтилсилилбаккатином III. Требуемый продукт получают путем снятия защиты в кислой среде.
В патенте США 5476954 синтез паклитаксела проводят исходя из 10-деацетилбаккатина III, защищая гидроксил С-7 2,2,2-трихлорэтоксикарбонилом (Troc) и гидроксил С-10 с помощью Troc или ацетильной группы.
Поэтому очевидно, что решающей стадией синтеза паклитаксела является селективная этерефикация по С-7 с помощью легко и селективно удаляемой группы. До сих пор 7-триэтилсилилдеацетилбаккатин III считался основным промежуточным соединением. Выход, приведенный для превращения 10-деацетилбаккатина III в 7-триэтилсилил-10-деацетилбаккатин III, составляет порядка 85% при использовании от 5 до 20 молей силилирующего агента. Выход последующей реакции ацетилирования, с образованием 7-триэтилсилилбаккатина III, также составляет порядка 85%.
Патенты США 5621121 и 5637723 описывают синтезы таксанов, включая паклитаксел, путем взаимодействия соответственно защищенного баккатина III или 10-деацетилбаккатина III с оксазолидин-5-карбоновыми кислотами, несущими в положении 2 фенильную группу, замещенную алкоксигруппами (патент США 5621121) или тригалоидалкильными группами, в частности трихлорметильными (патент США 5637723), с последующим снятием защиты путем раскрытия оксазолидинового кольца.
Защитные группы, признанные особенно подходящими, включают силильную, 2, 2, 2-трихлорэтоксикарбонильную или 2-(2-(трихлорметил)пропокси) карбонильную группы.
По существу такие же способы могут также быть использованы для получения доцетаксела (Docetaxel), другого известного производного таксана, широко используемого в клинической практике.
В настоящее время найден способ получения таксанов, в частности паклитаксела и доцетаксела, достигающий более высоких выходов, чем известные способы.
Способ по изобретению, приведенный на следующей далее схеме, включает:
a) одновременную защиту гидроксильных групп в положениях 7 и 10 10-деацетилбаккатина III трихлорацетильными группами;
b) последующую этерификацию гидроксила в положении 13 взаимодействием с соединением формулы (VII):
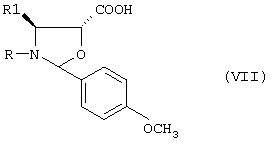
где R означает трет-бутоксикарбонил, бензоил или остаток прямой или разветвленной алифатической кислоты и R1 означает фенил или прямой или разветвленный алкил или алкенил;
c) удаление трихлорацетильных защитных групп;
d) необязательное селективное ацетилирование гидроксила в положении 10 для таких соединений, где R2 означает ацетил;
e) кислотный гидролиз оксазолидинового кольца.
Способ по изобретению отличается от способов, известных из уровня техники, тем, что используемая реакционная последовательность представляет более простой путь, чем приведенные выше известные способы, и значительно улучшенный в отношении получаемых выходов.
Стадию а) обычно проводят с трихлоруксусным ангидридом в подходящих растворителях и в присутствии оснований, таких как пиридин, триэтиламин и тому подобные.
Этерификацию производным оксазолидин-5-карбоновой кислоты осуществляют в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид, или других известных реагентов в безводном органическом растворителе, предпочтительно алифатических, ароматических или хлорированных углеводородах, при температуре в пределах от комнатной температуры до температуры кипения растворителя.
Из образующегося сложного эфира оксазолидина снимают затем защиту, удаляя трихлорацетильные группы в положениях 7 и 10 обработкой NH4ОH/NH4C1 в алифатических спиртах, предпочтительно метаноле.
Селективное ацетилирование гидроксила в положении 10 осуществляют уксусным ангидридом в присутствии солей церия III, скандия или иттербия в растворителе, таком как тетрагидрофуран, дихлорметан, этилацетат, в интервале температур от 5 до 40°С.
Обработка органическими или неорганическими кислотами в растворителях, таких как метанол, этанол, тетрагидрофуран, при температурах примерно в интервале от -2 до +2°С, дает требуемые производные таксана. Использование муравьиной кислоты в тетрагидрофуране при температуре 0°С особенно предпочтительно.
Промежуточные соединения оксазолидина являются известными либо могут быть получены известными способами путем взаимодействия сложного эфира изосерина с 4-метоксибензальдегидом.
Доказано, что выбор анисового альдегида особенно важен для образования оксазолидина, поскольку оксазолидиновая кислота, в противоположность способам, описанным в патентах США 5621121, 5637723 (Rhone-Poulenc Rorer) и 5821363 (Up John), легко может быть выкристаллизована и доведена до соотношения изомеров 95:5, которое чрезвычайно полезно и выгодно для последующей стадии. Кроме того, оксазолидинкарбоновая кислота, получаемая с анисовым альдегидом, особенно стабильна во время снятия защиты трихлоруксусного эфира и последующей стадии ацетилирования. В указанных условиях 2,4-диметоксибензальдегид, используемый в патенте США 5821363, либо хлораль или п-трихлорметилбензальдегид, описанные в патентах США 5621121 и 5637723 (Rhone-Poulenc Rorer), недостаточно стабильны.
Способ по изобретению, в дополнение к паклитакселу (R - бензоил, R1 - фенил) и доцетакселу (R - трет-бутоксикарбонил, R1 - фенил), позволяет эффективно и удобно получать другие производные таксана.
Соединения формулы IV ранее не были описаны и потому составляют дополнительный объект изобретения в качестве промежуточных соединений, используемых в синтезе производных таксана.
Следующие примеры иллюстрируют изобретение более подробно.
Пример 1. Получение 7,10-бис-трихлорацетил-10-деацетилбаккатина III.
Раствор 10 г 10-деацетилбаккатина III (18,4 ммоль) в 125 мл сухого метиленхлорида и 42 мл пиридина добавляют по каплям к 4,77 мл трихлоруксусного ангидрида (42,32 ммоль). Реакционную смесь перемешивают в течение трех часов или, во всяком случае, до завершения реакции, контролируемой ТСХ на силикагеле, используя смесь 5:5 н-гексан/этилацетат в качестве элюента. После завершения реакции добавляют 5 мл метанола для разложения избытка трихлоруксусного ангидрида, затем воду. Органическую фазу тщательно промывают НС1 (0,1 М раствор в воде) для удаления пиридина, после чего оставшуюся органическую фазу сушат над MgSO4 и концентрируют досуха в вакууме. Получают светло-желтый твердый продукт (17 г), который после кристаллизации из хлороформа имеет следующие химические и спектроскопические характеристики:
ИК (КВR) 3517, 1771, 1728, 1240, 981, 819, 787, 675 см-1;
1H-ЯМР (200 МГц); δ 8,11 (Bz, AA’), 7,58 (Bz, С), 7,46 (Bz, BB’), 6,50 (c, Н-10), 5,72 (м, Н-Н-2), 5,02 (д, J=8 Гц, Н-5), 4,95 (м, Н-13), 4,37 (д, J=8 Гц, Н-20а), 4,18 (д, J=8 Гц, Н-20b), 4,02 (д, J=6 Гц, Н-3), 2,32 (с, 4-Ас), 2,22 (с, Н-18), 1,91 (с, Н-19), 1,25 и 1,11 (с, Н-16, Н-17), т. пл.=172-175°С, [α]D=-36° (МеОН, С=0,6).
Пример 2. Получение 13-(2-(4-метоксифенил)-N-бензоил-4-фенилоксазолидил)-10-деацетилбаккатина III.
17 г 7,10-бистрихлорацетил-10-деацетилбаккатина III растворяют в 250 мл безводного толуола и добавляют при перемешивании к 12,6 г 2-(4-метоксифенил)-N-бензоил-4-фенилоксазолидин-5-карбоновой кислоты и 6 г DCC (дициклогексилкарбодиимид). После перемешивания в течение ночи при 40°С реакционную смесь фильтруют и концентрируют досуха. Остаток растворяют в 300 мл смеси метанол/тетрагидрофуран и добавляют к 24 мл 2 М водного раствора NН3. После 1,5 часов при комнатной температуре реакционную смесь концентрируют до небольшого объема в вакууме, затем разбавляют водой и весь полученный объем экстрагируют этилацетатом. Экстракт концентрируют досуха, и остаток очищают на колонке с силикагелем, элюируя продукт смесью этилацетат/петролейный эфир 1:1, получая 16,8 г указанного в заглавии продукта с т. пл. 135°С и [α]D=-58° (МеОН, С=0,5).
Пример 3. Получение 13-(2-(4-метоксифенил)-N-бензоил-4-фенилоксазолидил)-баккатина III.
Раствор 13,7 г продукта по примеру 2 в 200 мл тетрагидрофурана добавляют к 56 мл 10% суспензии СеСl3.7Н2О в тетрагидрофуране с последующим добавлением 5,5 мл уксуснуго ангидрида. После перемешивания в течение ночи при комнатной температуре реакционную смесь фильтруют, фильтрат обрабатывают метанолом и концентрируют до небольшого объема, смесь разбавляют Н2О и продукт экстрагируют этилацетатом, получая 12 г (84%) 13-(2-(4-метоксибензилиден)-N-бензоил-4-фенилоксазолидил)-баккатина III, имеющего следующие химические и спектроскопические характеристики:
1Н-ЯМР: 8,07 (д, Вz), 7,60-7,19 (м, ароматический), 7,48-6,90 (АА', ВВ', n-ОмеРh), 6,33 (с, Н-10), 5,67 (д, J=5 Гц, Н-2), 5,56 (уш.с, Н-3'), 4,93 (д, J=8 Гц, Н-5), 4,90 (уш.с, Н-2'), 4,45 (м, Н-7), 4,28 (д, J=8 Гц, Н-20а), 4,16 (д, J=8 Гц, Н-20b), 3,82 (с, Оме), 2,27 (с, Ас), 2,08 (с, ОАс), 1,66 (с, Н-19), 1,29-1,16 (с, Н-16, Н-17), т. пл. 146°С, [α]D=-62° (МеОН, С=0,8).
Пример 4. Получение паклитаксела.
12 г 13-(2-(4-метоксифенил)-N-бeнзoил-4-фeнилoкcaзoлидил)-баккатина III растворяют в 50 мл тетрагидрофурана, при 0°С добавляют 5 мл муравьиной кислоты; реакционную смесь оставляют перемешиваться при 0°С на три часа, затем разбавляют водой; муравьиную кислоту нейтрализуют КНСО3 и суспензию повторно экстрагируют этилацетатом. Этилацетатные экстракты промывают водой и концентрируют до небольшого объема. После кристаллизации из того же самого растворителя получают 10,5 г паклитаксела, физико-химические и спектроскопические характеристики которого соответствуют указанным в литературе.
Пример 5. Получение доцетаксела.
17 г 7,10-бистрихлорацетил-10-деацетилбаккатина III растворяют в 250 мл безводного толуола и добавляют при перемешивании к 11,6 г 2-(4-метоксифенил)-N-трет-бутоксикарбонил-4-фенилоксазолидин-5-карбоновой кислоты и 6 г DCC. После перемешивания в течение ночи при 40°С реакционную смесь фильтруют и концентрируют досуха. Остаток растворяют в 300 мл смеси метанол/тетрагидрофуран и добавляют к 24 мл 2 М водного раствора NН3. После 1,5 часов при комнатной температуре реакционную смесь концентрируют до небольшого объема в вакууме, затем разбавляют водой и весь полученный объем экстрагируют этилацетатом. Экстракт концентрируют досуха и 10 г указанного остатка растворяют в ТГФ и добавляют при 0°С к 5 мл муравьиной кислоты. Реакционную смесь оставляют перемешиваться при 0°С на три часа, затем разбавляют водой; муравьиную кислоту нейтрализуют КНСО3, суспензию несколько раз экстрагируют этилацетатом. Органические экстракты промывают водой и концентрируют до небольшого объема. После кристаллизации из того же самого растворителя получают 9,2 г доцетаксела, физико-химические и спектроскопические характеристики которого соответствуют указанным в литературе.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУСИНТЕТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ 10-ДЕАЦЕТИЛ-N-ДЕБЕНЗОИЛПАКЛИТАКСЕЛА | 2005 |
|
RU2384578C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДОЦЕТАКСЕЛА | 2005 |
|
RU2510395C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПАКЛИТАКСЕЛА | 2001 |
|
RU2276147C2 |
| ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ПОЛУСИНТЕЗА ТАКСАНОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2159237C2 |
| ПРОИЗВОДНЫЕ 7-(2,2,2-ТРИХЛОР-ТРЕТ.БУТОКСИКАРБОНИЛ)-10-ГИДРОКСИТАКСАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ В СИНТЕЗЕ ТАКСАНОВ | 1996 |
|
RU2162844C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ БАККАТИНА-III И 10-ДЕЗАЦЕТИЛ-БАККАТИНА-III, АКТИВИРОВАННЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ | 1993 |
|
RU2123493C1 |
| ПРОИЗВОДНЫЕ 10-ДЕАЦЕТИЛ-14-БЕТА-ГИДРОКСИБАККАТИНА III, СПОСОБ ИХ ПОЛУЧЕНИЯ И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ | 1996 |
|
RU2161615C2 |
| ПОЛУСИНТЕТИЧЕСКИЕ ТАКСАНЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2001 |
|
RU2259363C2 |
| ТАКСАНОВОЕ СОЕДИНЕНИЕ, А ТАКЖЕ СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2686459C1 |
| СПОСОБ ПОЛУЧЕНИЯ 7-ГИДРОКСИ-ТАКСАНОВ | 1995 |
|
RU2127730C1 |
Изобретение относится к способу получения соединений формулы I:
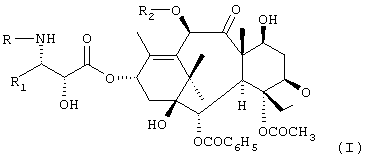
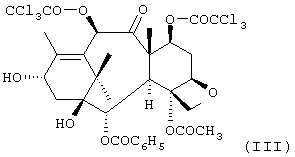
где R означает трет-бутоксикарбонил, бензоил или остаток прямой или разветвленной алифатической кислоты, R1 означает фенил или прямой или разветвленный алкил или алкенил и R2 означает водород или ацетил, который включает: а) одновременную защиту гидроксильных групп в положениях 7 и 10 10-деацетилбаккатина III трихлорацетильными производными с получением соединения формулы III:
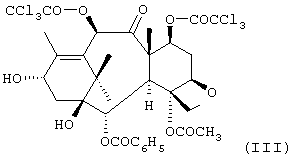
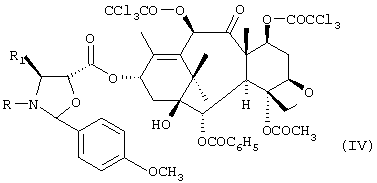
b) последующую этерификацию гидроксильной группы соединения формулы III в положении 13 взаимодействием с соединением формулы VII:

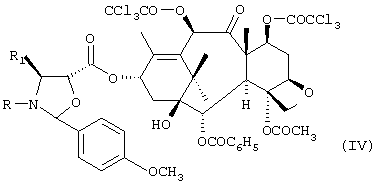
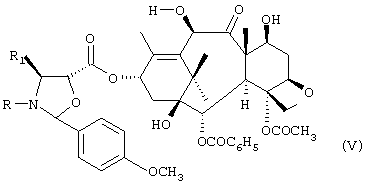
где R означает трет-бутоксикарбонил, бензоил или остаток прямой или разветвленной алифатической кислоты и R1 означает фенил или прямой или разветвленный алкил или алкенил, с получением соединения формулы IV:
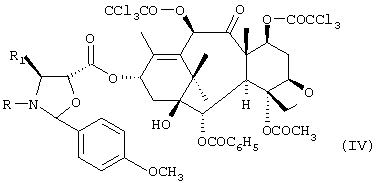
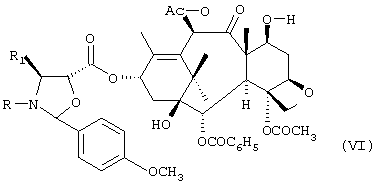
с) удаление трихлорацетильных защитных групп соединения формулы IV с получением соединения формулы V:
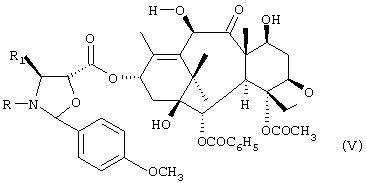
d) необязательное селективное ацетилирование гидроксильной группы в положении 10 соединения формулы V с получением соединения формулы VI:
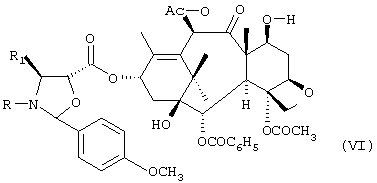
e) кислотный гидролиз оксазолидинового кольца соединения формулы VI с получением соединения формулы I. Промежуточные соединения формулы IV:
где R и R1 принимают значения, указанные выше. Технический результат – усовершенственный способ. 2 с. и 7 з.п.ф-лы.

где R означает трет-бутоксикарбонил, бензоил или остаток прямой или разветвленной алифатической кислоты;
R1 означает фенил или прямой или разветвленный алкил или алкенил;
R2 означает водород или ацетил, который включает а) одновременную защиту гидроксильных групп в положениях 7 и 10 10-деацетилбаккатина III трихлорацетильными производными с получением соединения формулы III
b) последующую этерификацию гидроксильной группы соединения формулы III в положении 13 взаимодействием с соединением формулы VII
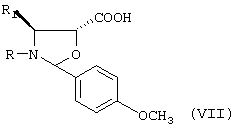
где R означает трет-бутоксикарбонил, бензоил или остаток прямой или разветвленной алифатической кислоты;
R1 означает фенил или прямой или разветвленный алкил или алкенил,
с получением соединения формулы IV

с) удаление трихлорацетильных защитных групп соединения формулы IV с получением соединения формулы V
d) необязательное селективное ацетилирование гидроксильной группы в положении 10 соединения формулы V с получением соединения формулы VI
e) кислотный гидролиз оксазолидинового кольца соединения формулы VI с получением соединения формулы I.
где R и R1 принимают значения, указанные в п.1.
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСАНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ПРИ ИХ ПОЛУЧЕНИИ | 1993 |
|
RU2116302C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСАНА И ИСХОДНЫЕ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2115649C1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| US 5621121 A, 15.04.1997. | |||
Авторы
Даты
2004-07-27—Публикация
2000-02-23—Подача