Настоящее изобретение относится к способу получения паклитаксела.
Паклитаксел представляет собой природную молекулу, имеющую широкий спектр противоопухолевой активности, со следующей структурной формулой:
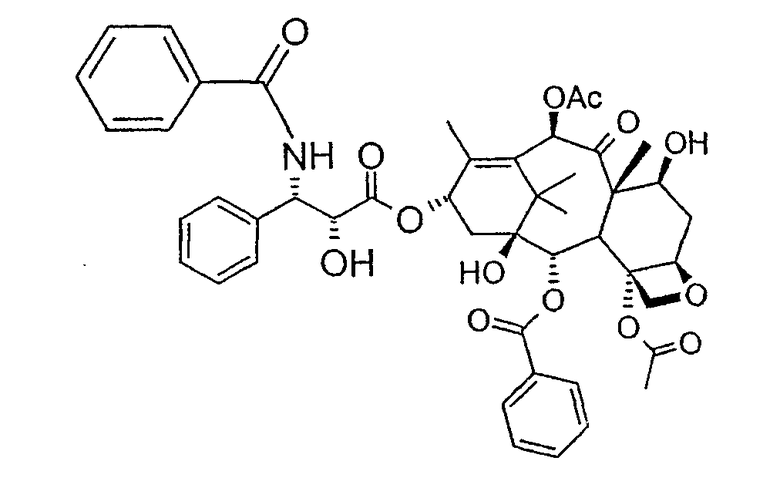
Соединение, впервые выделенное из коры Taxus brevifolia и из других природных источников, можно получить полусинтетически с использованием ряда процедур, описанных как в научной, так и в патентной литературе.
US 4924011 описывает полусинтез паклитаксела, использующий 10-деацетилбаккатин III, с защитной триалкилсилильной группой на С-7 гидроксиле и впоследствии ацетилированный на С-10. Полученное в результате промежуточное соединение реагирует с (2R,3S)-N-бензоил-2-О-(1-этоксиэтил)-3-фенилизосерином, и с полученного в результате продукта снимают защиту, получая паклитаксел.
WO 93/06094 описывает получение паклитаксела реакцией β-лактамного предшественника с 7-О-триэтилсилилбаккатином III, с последующим мягким кислотным гидролизом.
По US 5476954 паклитаксел получают, используя в качестве исходного вещества 10-деацетилбаккатин III, подвергнутый в положении С-7 эстерификации 2,2,2-трихлорэтоксикарбонильной группой (TROC).
По US 5917062 и US 6020507 С-7 гидроксил защищают карбобензоксигруппой (CBZ) или карботретбутоксигруппой (Boc) с последующим селективным ацетилированием С-10 гидроксила.
Из литературы ясно, что ключевой аспект полусинтеза паклитаксела заключается в селективной защите гидроксилов дитерпенового фрагмента (скелет 10-деацетилбаккатина III). Положение С-7 является наиболее реакционноспособным и поэтому в него вводят функциональные группы, которые впоследствии можно легко удалить. Обычно такой группой является триэтилсилильная (ТЭС), которая является устойчивой при условиях, используемых для эстерификации других вовлеченных в синтез гидроксилов и предоставляет примерно 85% выход конверсии. Приблизительно 85% выход получают, когда ацетильную группу впоследствии вводят в положение С-10.
Неожиданно был обнаружен новый способ синтеза паклитаксела с более высоким конечным выходом, а также другие преимущества по сравнению с известными способами.
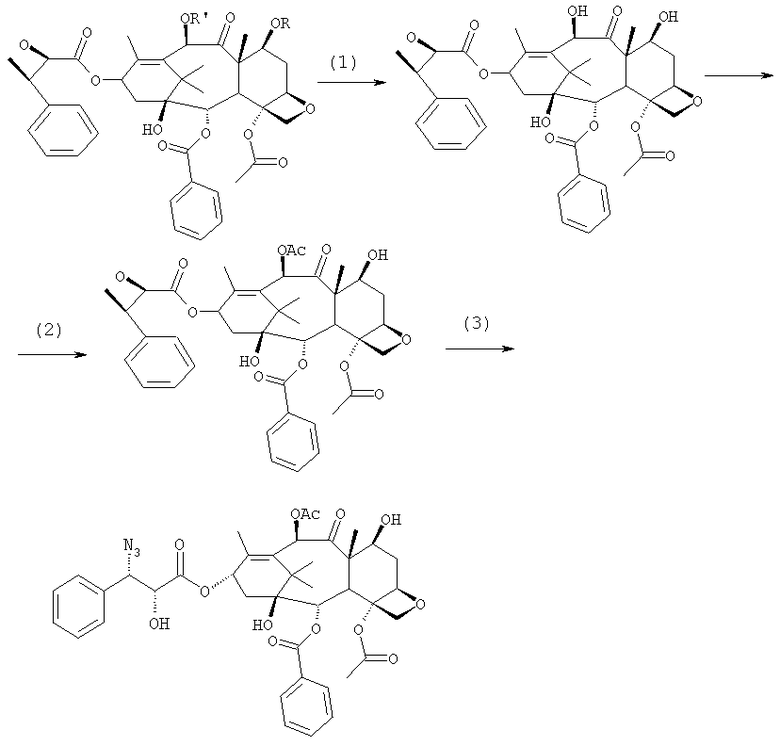
Способ согласно изобретению включает следующие стадии:
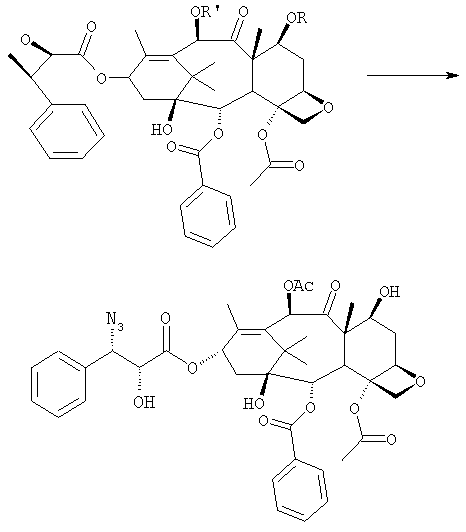
a) защиты гидроксилов 10-деацетилбаккатина III (10-ДАБ III) в 7- и 10-положениях
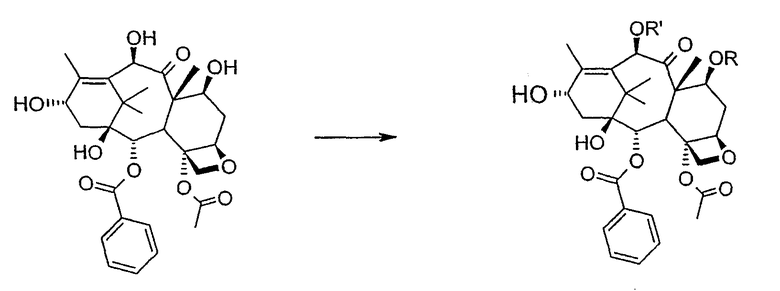
где R=R'= трихлорацетил, или R'= ацетил, а R выбран из трет-бутоксикарбонила и трихлорацетила;
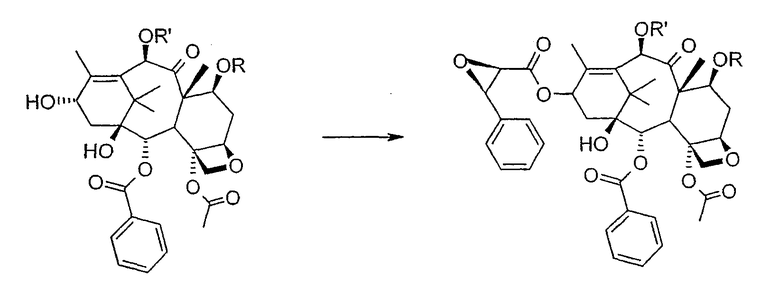
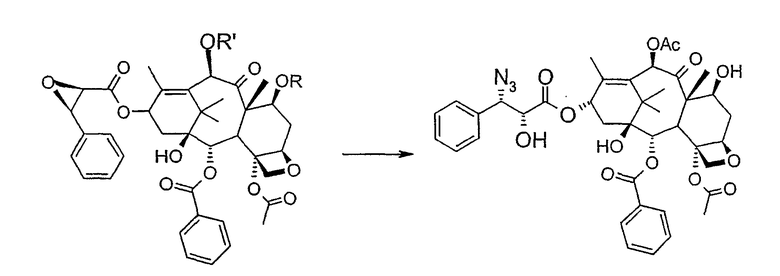
b) этерификации гидроксила в 13-положении 3-фенил-2-эпоксипропионовой кислотой
c) удаления защитных групп в 7- и 10-положениях (1), если они обе представляют собой трихлорацетильные группы с последующим селективным ацетилированием в 10-положении (2) и раскрытием эпоксида азидом натрия (3)
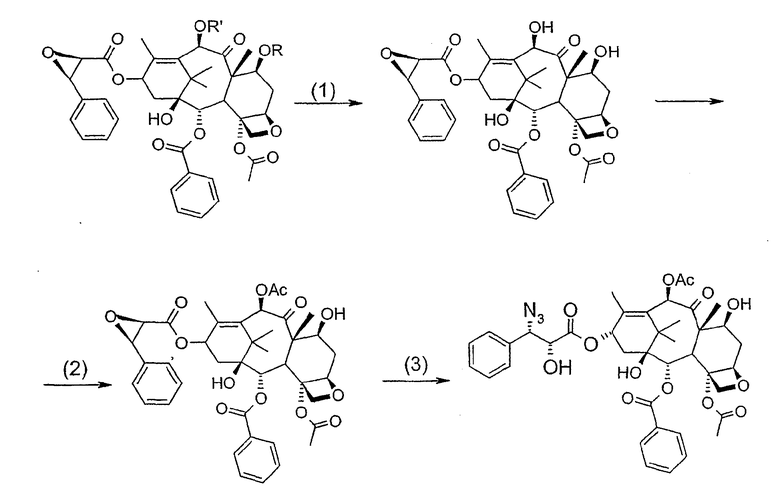
или, альтернативно,
c') если R'= ацетил и R= трихлорацетил, раскрытия эпоксида азидом натрия и одновременного снятия защиты в 7-положении
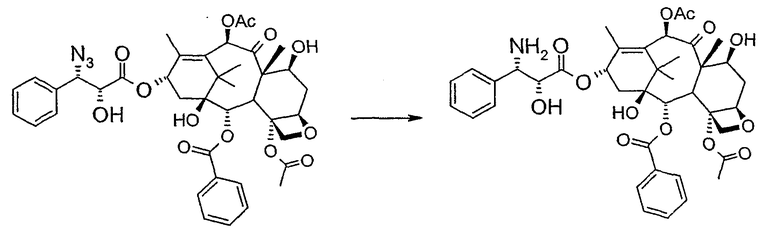
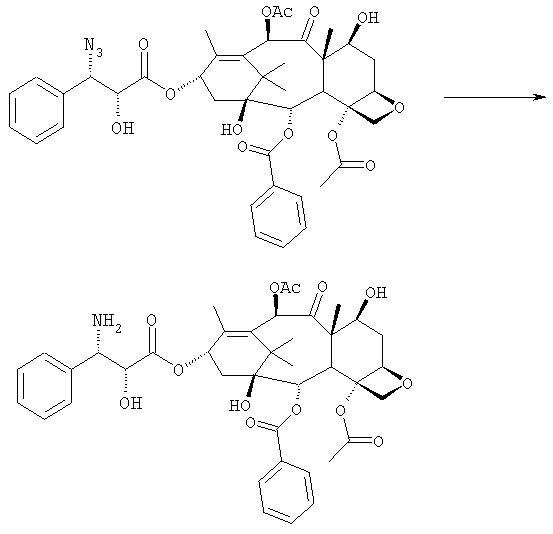
d) восстановления азидогруппы в аминогруппу
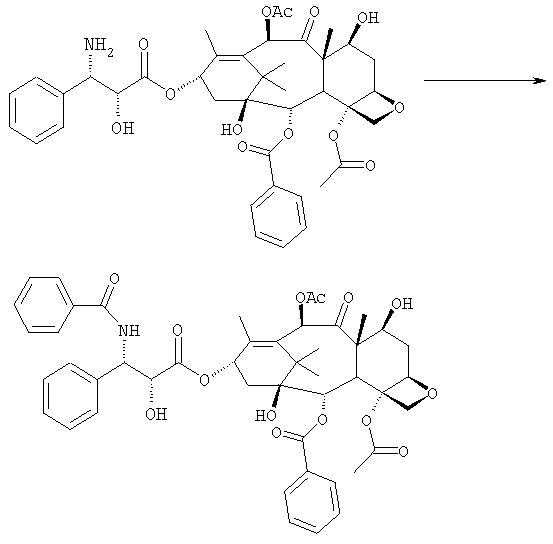
бензоилирования с получением конечного продукта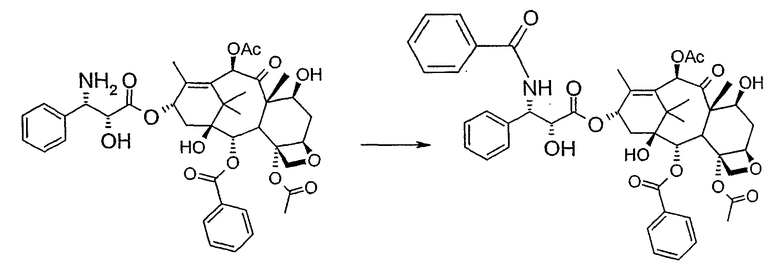
Исходным продуктом является 10-деацетилбаккатин III (10-ДАБ III), который экстрагируют из листьев Taxus baccata. На первой стадии гидроксилы 10-ДАБ III в 7 и 10-положениях количественно подвергают реакции этерификации. Когда R=R'= трихлорацетил, 10-ДАБ III реагирует с трихлорацетилхлоридом в метиленхлориде в присутствии триэтиламина и каталитических количеств [4-диметиламинопиридина (ДМАП). Когда R ≠ R', сначала 10-ДАБ III селективно ацетилируют уксусным ангидридом в присутствии солей церия, скандия, иттербия, предпочтительно CeCl3·7H2O. Полученный в результате баккатин III затем защищают в положении С-7 трет-бутоксикарбонильной или трихлорацетильной группой. Первая может быть введена реакцией баккатина III с трет-бутоксипирокарбонатом в присутствии ДМАП и этилдиизопропиламина или, альтернативно, следуя процедуре, описанной в US 5917062. Трихлорацетильная группа может быть введена в положение 7 реакцией с трихлорацетилхлоридом в пиридине.
На следующей стадии (b) гидроксил в положении 13 подвергают эстерификации 3-фенил-2-эпоксипропионовой кислотой, предпочтительно ее аммонийной солью в толуоле в присутствии дициклогексилкарбодиимида, ДМАП и п-толуолсульфокислоты, посредством этого получая сложный эфир (2R,3R)-3-фенил-2,3-эпоксипропионовой кислоты с баккатином. Когда обе защитные группы R и R' представляют собой трихлорацетил, их можно удалить, используя условия и реагенты, описанные в работах Zheng et al., Tetrahedron Lett., 1995, 36, 2001 и Datta et al., J. Org. Chem., 1995, 60, 761. Предпочтительно, две трихлорацетильные группы удаляют двумя эквивалентами гидроксида аммония. Соединение со снятыми защитными группами селективно ацетилируют в положении 10 уксусным ангидридом в присутствии солей церия, скандия, иттербия, предпочтительно CeCl3·7H2O.
Полученное в результате соединение реагирует с NaN3 в водном метаноле в присутствии метилформиата в условиях, сообщенных в литературе (Yamaguchi T., Tetrahedron Letters 39, 5575-78, 1998), давая соответствующий азид.
Альтернативно, когда R= трихлорацетил и R'= ацетил (d), оксиран реагирует с NaN3, давая соответствующий азид со снятием защиты в 7-положении, соответствующий соединению, полученному на стадии (c').
На следующей далее стадии (d) азид восстанавливают до амина. Восстановление можно провести водородом на катализаторе или PPh3. Полученный на последней стадии (е) продукт бензоилируют в положении аминогруппы, получая паклитаксел. Бензоилирование можно осуществить бензойным ангидридом одновременно с восстановлением либо впоследствии на выделенном восстановленном продукте, используя стехиометрические количества бензоилхлорида в присутствии карбоната калия.
Следующие ниже примеры иллюстрируют изобретение более детально.
Пример I - синтез 7-трихлорацетилбаккатина III
В 25 мл круглодонной колбе растворяют 0,603 г (1,03 моль, 1,0 экв.) баккатина III при перемешивании магнитной мешалкой в 9,7 мл сухого пиридина при 25°С под атмосферой азота. В прозрачный бледно-желтый раствор по каплям добавляют 138 мкл (1,23 ммоль, 1,23 экв.) трихлорацетилхлорида. Через 30 мин после завершения добавления образуется белый осадок. При тех же условиях, как описано выше, в реакционную суспензию по каплям добавляют дополнительные 120 мкл (1,07 ммоль, 1 экв.) трихлорацетилхлорида. После 20 мин раствор имеет желто-коричневую окраску. Тонкослойная хроматография (ТСХ) (SiO2, н-гексан/EtOAc, 2:3) показывает почти полную конверсию исходного баккатина III. Реакционную смесь разбавляют CH2Cl2. Полученный в результате раствор несколько раз промывают насыщенным раствором CuSO4 до полного удаления пиридина (раствор больше не имеет голубую окраску). Органическую фазу концентрируют под вакуумом, сушат над MgSO4, фильтруют и растворитель выпаривают, получая 0,612 г желтовато-белого порошка, соответствующего 7-трихлорацетилбаккатину III, имеющему следующие спектроскопические характеристики.
1Н-ЯМР (400 МГц, CDCl3): δм.д. = 1,08 (с, 3Н, Ме), 1,13 (с, 3Н, Ме), 1,86 (с, 3Н, Ме), 1,97 (ддд, 1 Н, J1=14,4 Гц, J2=10,3 Гц, J3=1,9 Гц, С6-Н), 2,13 (д, 3Н, J= 1,2 Гц, Ме), 2,15 (с, 3Н, Ме), 2,30 (с, 3Н, Ме), 2,32-2,28 (м, 2Н, С14-Н2), 2,68 (ддд, 1Н, J1=14,4 Гц, J2=9,3 Гц, J3=7,3 Гц, С6-Н), 4,04 (д, 1Н, J= 7,0 Гц, С3-Н), 4,17 (дд, 1Н, J1=8,4 Гц, J2=1,0 Гц, С20-Н), 4,34 (д, 1Н, J=8,4 Гц, С20-Н), 4,86 (т, 1Н, J=7,5 Гц, С13-Н), 4,98 (дд, 1Н, J1=9,5 Гц, J2=1,7 Гц, С5-Н), 5,65 (д, 1Н, J=7,0 Гц, С2-Н), 5,70 (дд, 1Н, J1=10,4 Гц, J2=7,4 Гц, С7-Н), 6,42 (с, 1Н, С10-Н), 7,52-7,46 (м, 2Н, аром), 7,62 (м, 1Н, аром), 8,10 (м, 2Н, аром); 13С-ЯМР (100 МГц, CDCl3): δм.д. = 10,8; 15,5; 20,4; 20,9; 22,8; 26,9; 32,5; 38,6; 43,0; 47,2; 56,2; 68,1; 74,5; 75,5; 76,5; 77,0; 79,0; 80,5; 83,7; 89,9; 129,0; 129,4; 130,3; 132,0; 134,0; 145,4; 160,8; 167,2; 169,2; 171,0; 201,9.
Пример II - синтез (2'R,3'R)-7-трихлорацетилбаккатин III-13-(3'-фенил-2,,3'-эпоксипропионата)
В 30 мл безводного толуола при 0°С растворяют 0,164 г (1,00 ммоль, 1 экв.) свежеприготовленной 3-фенил-2-эпоксипропионовой кислоты. Затем добавляют 0,5 г (1 ммоль, 0,68 экв.) 7-(трихлорацетил)-баккатина III [7-(ТСА)-баккатина III] при 0°С под атмосферой азота. Наконец последовательно добавляют дициклогексилкарбодиимид (ДЦК, 0,21 г, 1,00 ммоль, 1,0 экв.), 4-диметиламинопиридин (ДМАП, 0,084 г, 0,68 ммоль, 0,66 экв.) и п-толуолсульфокислоту (п-ТСК, 0,17 г, 0,10 ммоль, 0,1 экв.). Затем раствор нагревают до 70°С при перемешивании магнитной мешалкой и под током азота. Развитие реакции контролируют ТСХ (SiO2, н-гексан/EtOAc, 3:2). Первое пятно, имеющее Rf=0,28, соответствует сложному эпоксиэфиру 7-(ТСА)-баккатина III. Второе пятно, имеющее Rf=0,11, соответствует 7-(ТСА)-баккатину III. После 3 часов смесь охлаждают и суспендированное твердое вещество отфильтровывают. Осажденную дициклогексилмочевину (ДЦМ) промывают CH2Cl2. Объединенные органические фракции концентрируют до сухого состояния. Полученное в результате неочищенное вещество (0,919 г) подвергают флэш-хроматографии (SiO2, н-гексан/EtOAc, 3:2). Получают 0,100 г (0,14 ммоль, 20%) непрореагировавшего 7-(ТСА)-баккатина III и 0,435 г (0,49 ммоль, 73%) (2'R,3'R)-7-трихлорацетилбаккатин III-13-(3'-фенил-2′,3'-эпоксипропионата), имеющего следующие спектроскопические характеристики:
1Н-ЯМР (400 МГц, CDCl3): δм.д.= 1,11 (шир. с, 6Н, 2 Ме), 1,25 (шир. с, 1Н, ОН), 1,76 (д, 3Н, J= 1,2 Гц, Ме), 1,84 (с, 3Н, Ме), 2,02-1,92 (м, 3Н, С14-Н2 + С6-Н), 2,13 (с, 3Н, Ме), 2,39 (с, 3Н, Ме), 2,69 (ддд, 1Н, J1= 14,6 Гц, J2= 9,3 Гц, J3= 7,3 Гц, С6-Н), 3,92 (д, 1Н, J= 6,9 Гц, С3-Н)+, 3,97 (д, 1Н, J= 4,7 Гц, C2'-Н), 4,15 (дд, 1Н, J1= 8,4 Гц, J2= 1,0 Гц, С20-Н), 4,31 (д, 1Н, J= 8,3 Гц, C20-Н), 4,33 (д, 1Н, J= 4,7 Гц, C3'-Н), 4,97 (дд, 1Н, J1= 9,5 Гц, J2= 1,8 Гц, С5-Н), 5,63 (д, 1Н, J= 6,8 Гц, C2-Н), 5,65 (дд, 1Н, J1= 10,7 Гц, J2= 7,33 Гц, С7-Н), 6,02 (дт, 1Н, J1= 8,8 Гц, J2= 1,8 Гц, С13-Н), 7,45-7,30 (м, 5Н, аром), 6,34 (с, 1Н, С10-Н), 7,49 (м, 2Н, аром), 7,64 (м, 1Н, аром), 8,00 (м, 2Н, аром); 13С-ЯМР (100 МГц, CDCl3): δм.д.= 10,8; 14,9; 20,8; 21,0; 22,5; 26,5; 32,4; 35,7; 43,2; 46,7; 56,0; 56,1; 57,9; 70,9; 74,5; 74,8; 76,4; 76,7; 79,0; 80,6; 83,6; 89,8; 126,8; 128,7; 128,9; 129,2, 129,3; 130,2; 132,6; 133,0; 134,1; 141,3; 160,7; 166,3; 167,1; 169,1; 170,1; 201,3.
Пример III - синтез (2'R,3'R)-баккатин III-13-(3'-азидо-2'-гидрокси-3'-фенилпропионата)
В 25 мл одногорлой круглодонной колбе, оборудованной магнитной мешалкой, в 10,0 мл CH3OH при 25°С суспендируют 0,397 г (0,45 ммоль, 1 экв.) (2'R,3'R)-7-трихлорацетилбаккатин III-13-(3'-фенил-2,,3'-эпоксипропионата). Последовательно добавляют 1,26 мл Н2О, 1,26 мл НСООСН3 и 0,735 г (11,3 ммоль, 25,0 экв.) азида натрия. Температуру повышают до 50°С и ход реакции контролируют ТСХ (SiO2, CHCl3/EtOAc/MeOH, 12,0:2,0:0,3). Наблюдают исчезновение исходного продукта и одновременное образование двух продуктов, имеющих Rf=0,22 и 0,29, соответственно. Продукт, имеющий Rf=0,29, впоследствии идентифицируют как конечный продукт, тогда как продукт с Rf=0,22 представляет собой (2'R,3'R)-баккатин III-13-(3'-фенил-2',3'-эпоксипропионат), образовавшийся в качестве промежуточного продукта реакции. Продукт, имеющий Rf=0,29, растет со временем в ущерб продукту, имеющему Rf=0,22. Реакционный раствор после 46 часов имеет желто-коричневую окраску с белым осадком (не прореагировавший NaN3). Реакцию гасят через 46 часов, добавляя воду, наблюдают два дополнительных пятна с Rf=0,38 и 0,13 (неизвлеченные продукты разложения). Осажденное молочно-белое вещество отфильтровывают, промывают водой и затем AcOEt. Получают двухфазную смесь, причем обе фазы являются прозрачными. Две фазы разделяют. Водную фазу три раза экстрагируют AcOEt и объединенные органические фазы концентрируют и сушат над MgSO4. Смесь фильтруют и растворитель выпаривают, получая 0,335 г желтовато-белого порошка. Полученное в результате неочищенное вещество очищают флэш-хроматографией (SiO2, CHCl3/EtOAc/MeOH, 12: 2:0,3), получая 0,279 г (0,36 ммоль; 80%; Rf = 0,22) (2'R,3'R)-баккатин III-13-(3'-азидо-2'-гидрокси-3'-фенилпропионата).
Соединение имеет следующие спектроскопические характеристики:
1Н-ЯМР (400 МГц, CDCl3): δм.д.= 1,14 (с, 3Н, Ме), 1,25 (шир. с, 4Н, Ме + ОН), 1,67 (с, 3Н, Ме), 1,87 (ддд, 1Н, J1= 13,9 Гц, J2= 11,1 Гц, J3= 2,5 Гц, С6-Н), 1,93 (д, 3Н, J= 0,8 Гц, Ме), 2,08 (д, 2Н, J= 8,8 Гц, C14-Н2), 2,24 (с, 3Н, Ме), 2,26 (с, 3Н, Ме), 2,55 (м, 2Н, С6-Н + С7-ОН), 3,28 (д, 1Н, J= 8,4 Гц, С2'-ОН), 3,77 (д, 1Н, J= 7,2 Гц, С3-Н), 4,15 (дд, 1Н, J1= 8,2 Гц, J2= 0,8 Гц, С20-Н), 4,28 (д, 1Н, J= 8,2 Гц, C20-Н), 4,41 (м, 2Н, C7-Н + С2'-Н), 4,93 (дд, 1Н, J1= 9,6 Гц, J2= 2,0 Гц, С5-Н), 4,96 (д, 1Н, J= 4,4 Гц, C3'-Н), 5,64 (д, 1Н, J= 7,2 Гц, C2-Н), 6,17 (дт, 1Н, J1= 7,9 Гц, J2= 1,2 Гц, С13-Н), 6,30 (c, 1Н, С10-Н), 7,46-7,32 (м, 5Н, аром), 7,50 (м, 2Н, аром), 7,63 (м, 1Н, аром), 8,06 (м, 2Н, аром); 13С-ЯМР (100 МГц, CDCl3): δм.д.= 9,8; 15,3; 21,1; 21,9; 22,6; 27,0; 35,6; 35,8; 43,3; 45,9; 58,8; 68,1; 72,0; 72,4; 75,1; 75,3; 75,8; 76,7; 79,4; 81,3; 84,6; 127,9; 128,9; 129,2, 129,5; 130,3; 133,4; 134,1; 135,3; 142,2; 167,2; 170,5; 171,5; 203,8.
Пример IV - синтез N-дебензоилпаклитаксела
В 25 мл двугорлой круглодонной колбе в 5,2 мл свежеперегнанного CH2Cl2 растворяют 0,102 г (0,13 ммоль, 1,0 экв.) (2'R,3'R)-7-гидроксибаккатин III-13-(3'-азидо-2'-гидрокси-3'-фенилпропионата) и в полученный в результате бледно- желтый раствор добавляют воду (0,05 мл), затем 0,071 г (0,26 ммоль, 2,0 экв.) PPh3. Смесь реагирует при комнатной температуре при перемешивании магнитной мешалкой. После 16 часов ход реакции проверяют ТСХ (SiO2, CHCl3/CH3OH 9:1). Исходный продукт (Rf=0,61) исчезает и наблюдается пятно с Rf=0,19. Реакцию гасят, разбавляя смесь (раствор бледно-желтого цвета с белым осадком) CHCl3. Затем смесь промывают дистиллированной Н2О и потом насыщенным раствором хлорида натрия (соляным раствором). Органическую фазу ярко-желтого цвета сушат над MgSO4, затем фильтруют и растворитель выпаривают. Получают 0,177 г масла цвета желтой охры. Неочищенное вещество подвергают флэш-хроматографии (SiO2, CHCl3/CH3OH 9:1), получая 0,074 мг (0,10 ммоль; 76%) N-дебензоилпаклитаксела (порошок бледно-желтого цвета).
1Н-ЯМР (400 МГц, CDCl3): δм.д. = 1,07 (с, 3Н, Ме), 1,09 (с, 3Н, Ме), 1,38-1,22 (шир. с, 2Н, 2ОН), 1,75 (с, 3Н, Ме), 1,88 (с, 3Н, Ме), 1,90 (с, 3Н, Ме), 1,93 (с, 3Н, Ме), 2,20-1,96 (м, 6Н, С14-Н2 + С6-Н, NH2 + OH), 2,52 (ддд, 1Н, J1=15,7 Гц, J2=9,5 Гц, J3=5,9 Гц, С6-Н), 3,88 (д, 1Н, J= 7,2 Гц, С3-Н), 4,10 (д, 1Н, J=4,0 Гц, С20-Н), 4,17 (д, 1Н, J=4,0 Гц, С20-Н), 4,22 (д, 1Н, J=8,0 Гц, С2'-Н), 4,26 (д, 1Н, J=8,0 Гц, С3'-Н), 4,56 (дд, 1Н, J1=11,6 Гц, J2=6,9 Гц, С7-Н), 4,84 (д, 1Н, J=8,8 Гц, С5-Н), 5,83 (д, 1Н, J=7,2 Гц, С2-Н), 6,25 (т, 1Н, J=8,0 Гц, С13-Н), 6,51 (с, 1Н, С10-Н), 7,20-7,00 (м, 8Н, аром), 8,13 (м, 2Н, аром); 13С-ЯМР (100 МГц, CDCl3): δм.д. = 9,8; 15,2; 21,1; 22,0; 22,7; 27,0; 30,0; 35,4; 35,8; 43,3; 45,9; 58,7; 71,3; 72,3; 75,2; 75,8; 76,6; 79,3; 81,2; 84,6; 127,2; 128,5; 128,9; 129,0; 129,4; 130,3; 133,1; 134,1; 142,6; 167,1; 170,4; 171,5; 173,2; 203,9.
Пример V - синтез паклитаксела
В 10 мл круглодонной колбе в 1,25 мл AcOEt растворяют 0,031 г (0,041 ммоль, 1,0 экв.) N-дебензоилпаклитаксела. В прозрачный желтый раствор добавляют 1,25 мл водного насыщенного раствора NaHCO3. В полученную в результате двухфазную смесь при интенсивном перемешивании магнитной мешалкой по каплям добавляют 7,1 мл (0,064 ммоль, 1,5 экв.) бензоилхлорида. Ход реакции контролируют ТСХ (SiO2, CHCl3/СН3OH, 9:1). После исчезновения исходного продукта наблюдается пятно, имеющее Rf=0,50. Реакционную смесь разбавляют AcOEt. Органическую фазу отделяют от водной фазы, которую экстрагируют AcOEt (три экстракции). Объединенные органические фазы сушат над MgSO4, фильтруют и концентрируют. Неочищенное вещество (0,037 г) растворяют в смеси 1:1 СН2Cl2/этиловый эфир, затем добавляют н-пентан (0,030 г, 0,035 ммоль, 86%) для осаждения паклитаксела, имеющего спектроскопические характеристики, сообщенные в литературе.
Пример VI - синтез (2'R,3'R)-7,10-бис-трихлорацетил-10-деацетилбаккатин III-13-(3'-фенил-2,3'-эпоксипропионата)
В 100 мл круглодонной колбе при 0°С в 30 мл безводного толуола растворяют 0,178 г (1,09 ммоль, 1,0 экв.) свежеприготовленной 3-фенил-2-эпоксипропионовой кислоты. В полученном в результате растворе под атмосферой азота и при 0°С суспендируют 0,663 г (0,79 ммоль, 0,73 экв.) 7,10-бис-трихлорацетил-10-деацетилбаккатина III [7,10-бис-(ТХА)-10-ДАБ III]. Наконец, последовательно добавляют дициклогексилкарбодиимид (ДЦК, 0,224 г, 1,09 ммоль, 1,0 экв.), 4-диметиламинопиридин (ДМАП, 0,088 г, 0,72 ммоль, 0,66 экв.) и п-толуолсульфокислоту (п-ТСК, 0,19 г, 0,11 ммоль, 0,1 экв.). Реакцию проводят в гетерогенной фазе при 700С с перемешиванием магнитной мешалкой и под потоком азота. Ход реакции контролируют ТСХ (SiO2, н-гексан/EtOAc, 3:2). Первое пятно, имеющее Rf= 0,28, соответствует сложному эпоксиэфиру 7,10-бис-(ТХА)-10-ДАБ III. Второе пятно, имеющее Rf= 0,15, соответствует 7,10-бис-(ТХА)-10-ДАБ III. Через 3 часа смесь охлаждают и суспендированное твердое вещество отфильтровывают. Темно-желтый осадок промывают CH2Cl2: оставшееся белое твердое вещество представляет собой ДЦМ. Объединенные органические фракции концентрируют и полученное в результате твердое вещество подвергают флэш-хроматографии (SiO2, н-гексан/EtOAc, 3:2). Получают 0,63 г (2'R,3'R)-7,10-бис-трихлорацетил-10-деацетилбаккатин III-13-(3'-фенил-2,3'-эпоксипропионата).
1Н-ЯМР (400 МГц, CDCl3): δм.д.=1,12 (с, 3Н, Ме), 1,14 (с, 3Н, Ме), 1,76-1,60 (м, 2Н, С6-Н + ОН), 1,81 (с, 3Н, Ме), 1,88 (с, 3Н, Ме), 2,04-1,98 (м, 2Н, С14-Н), 2,41 (с, 3Н, Ме), 2,69 (ддд, 1Н, J1=14,5 Гц, J2=9,3 Гц, J3=7,3 Гц, С6-Н), 3,89 (д, 1Н, J= 7,2 Гц, С3-Н), 3,98 (д, 1Н, J= 4,0 Гц, С2'-Н), 4,14 (д, 1Н, J=8,0 Гц, С20-Н), 4,32 (д, 1Н, J=8,0 Гц, С20-Н), 4,34 (д, 1Н, J=4,0 Гц, С3'-Н), 4,97 (д, 1Н, J=7,6 Гц, С5-Н), 5,70-5,62 (м, 2Н, С7-Н + С2-Н), 6,05 (дт, 1Н, J1=8,4 Гц, J2=1,0 Гц, С13-Н), 7,52-7,30 (м, 7Н, ArH), 6,39 (с, 1Н, С10-Н), 7,45 (м, 1Н, ArH), 7,99 (м, 1Н, ArH); 13С-ЯМР (100 МГц, CDCl3): δм.д. = 10,9; 15,1; 20,8; 22,6; 26,3; 32,5; 35,6; 43,1; 46,7; 55,9; 56,5; 58,0; 70,8; 74,2; 76,4; 78,6; 78,9; 80,5; 83,5; 89,5; 89,6; 126,8; 128,8; 129,0; 129,1; 129,4; 130,2; 131,5; 132,5; 134,2; 143,3; 160,6; 161,1; 166,3; 167,0; 170,3; 199,5.
Пример VII - синтез (2'R,3'R)-10-деацетил-баккатин III-13-(3'-фенил-2',3'-эпоксипропионата)
В 25 мл круглодонной колбе в 3 мл СН3ОН суспендируют 0,174 г (0,18 ммоль, 1,0 экв.) (2'R,3'R)-7,10-бис-(ТХА)-10-ДАБ III-13-(3'-фенил-2',3'-эпоксипропионата). Полученную в результате суспензию охлаждают до 0°С и к ней по каплям при интенсивном перемешивании магнитной мешалкой добавляют 0,24 мл (0,36 ммоль, 2,0 экв.) 1,57 М водного раствора NH3. Реакцию проводят в течение 15 мин при 0°С, в течение которых суспензия становится зеленовато-желтой. После этого смесь нагревают до комнатной температуры, и она реагирует в течение дополнительных 5 мин до полного растворения осадка, приводя к получению прозрачного зеленовато-желтого раствора. Полное исчезновение исходных соединений контролируют ТСХ (SiO2, н-гексан/EtOAc, 3:2), которая дает одно пятно на основе. Реакционную смесь разбавляют Н2О, получая молочно-белый раствор, из которого экстрагируют органическую фазу (3 экстракции) AcOEt (при добавлении органического растворителя образуется эмульсия, которую разрушают растворением в ней NaCl). Объединенные органические фазы сушат над MgSO4, фильтруют и растворитель выпаривают. Получают 0,194 г белого порошка (2'R,3'R)-10-деацетилбаккатин III-13-(3'-фенил-2',3'-эпоксипропионата).
1Н-ЯМР (400 МГц, CDCl3): δм.д. = 1,05 (с, 3Н, Ме), 1,09 (с, 3Н, Ме), 1,71 (с, 3Н, Ме), 1,72 (д, 3Н, J1=1,2 Гц, Ме), 1,83 (м, 1Н, С6-Н), 1,95 (д, 2Н, J= 8,8 Гц, С14-Н2), 2,34 (с, 3Н, Ме), 2,58 (ддд, 1Н, J1=14,6 Гц, J2=9,9 Гц, J3=6,9 Гц, С6-Н), 3,85 (д, 1Н, J=7,3 Гц, С3-Н), 3,95 (д, 1Н, J= 4,4 Гц, С2'-Н), 4,14 (д, 1Н, J=8,4 Гц, С20-Н), 4,22 (дд, 1Н, J1=11,3 Гц, J2=6,6 Гц, С7-Н), 4,27 (д, 1Н, J=8,4 Гц, С20-Н), 4,31 (д, 1Н, J=4,4 Гц, С3'-Н), 4,95 (д, 1Н, J=8,8 Гц, С5-Н), 5,16 (с, 1Н, С10-Н), 5,59 (д, 1Н, J=7,3 Гц, С3-Н), 5,99 (дт, 1Н, J1=8,8 Гц, J2=1,2 Гц, С7-Н), 7,30-7,50 (м, 7Н, аром), 7,60-7,70 (м, 1Н, аром), 7,90-8,00 (м, 1Н, аром).
Пример VIII - синтез (2'R,3'R)-баккатин III-13-(3'-фенил-2',3'-эпоксипропионата)
К раствору (2'R,3'R)-10-деацетилбаккатин III-13-(3'-фенил-2',3'-эпоксипропионата) (138 мг) в 3 мл сухого тетрагидрофурана добавляют 7,3 мг CeCl3·7H2O и 0,073 мл уксусного ангидрида. Реакционную смесь перемешивают при комнатной температуре в течение 5 часов, в течение которых реакционная смесь становится гомогенной. Добавляют 1 г льда, продолжая перемешивание в течение 1 часа. Органический растворитель выпаривают под вакуумом и остаток разбавляют 5 мл Н2О. Образовавшийся осадок отфильтровывают и сушат откачкой вакуумным насосом в течение 18 часов. Полученный в результате продукт (белый порошок, 130 мг) имеет следующие характеристики:
1Н-ЯМР (400 МГц, CDCl3): δм.д. = 1,05 (с, 3Н, Ме), 1,09 (с, 3Н, Ме), 1,71 (с, 3Н, Ме), 1,72 (д, 3Н, J1=1,2 Гц, Ме), 1,83 (м, 1Н, С6-Н), 1,95 (д, 2Н, J= 8,8 Гц, С14-Н2), 2,34 (с, 3Н, Ме), 2,58 (ддд, 1 Н, J1=14,6 Гц, J2=9,9 Гц, J3=6,9 Гц, С6-Н), 3,85 (д, 1Н, J=7,3 Гц, С3-Н), 3,95 (д, 1Н, J=4,4 Гц, С2'-Н), 4,14 (д, 1Н, J=8,4 Гц, С20-Н), 4,22 (дд, 1Н, J1=11,3 Гц, J2=6,6 Гц, С7-Н), 4,27 (д, 1Н, J=8,4 Гц, С20-Н), 4,31 (д, 1Н, J=4,4 Гц, С3'-Н), 4,95 (д, 1Н, J=8,8 Гц, С5-Н), 5,59 (д, 1Н, J=7,3 Гц, С3-Н), 5,65 (дд, 1Н, J1=10,7 Гц, J2=7,33 Гц, С7-Н), 6,34 (с, 1Н, С10-Н), 7,30-7,50 (м, 7Н, аром), 7,60-7,70 (м, 1Н, аром), 7,90-8,00 (м, 1Н, аром).
Пример IX - синтез (2'R,3'R)-баккатин III-13-(3'-азидо-2'-гидрокси-3'-фенилпропионата)
В 25 мл одногорлой круглодонной колбе, оборудованной магнитной мешалкой, при 25°С в 5 мл СН3ОН суспендируют 0,17 г (0,45 ммоль, 1 экв.) (2'R,3'R)-баккатин III-13-(3'-фенил-2',3'-эпоксипропионата). Последовательно добавляют 0,63 мл Н2О, 0,23 мл НСООСН3 и 0,36 г (5,5 ммоль, 12,5 экв.) азида натрия. Смесь нагревают до 50°С и ход реакции контролируют ТСХ (SiO2, CHCl3/EtOAc/MeOH, 12,0:2,0:0,3). Реакционная смесь после 46 час имеет желто-коричневую окраску с белым осадком (непрореагировавший NaN3). Добавляют Н2О (10 мл) и осажденное молочно-белое твердое вещество отфильтровывают, промывают водой и затем AcOEt. Разделяют на две фазы, водную три раза экстрагируют AcOEt и объединенные органические фазы концентрируют и сушат над MgSO4, фильтруют и растворитель выпаривают, получая 0,20 г желтовато-белого порошка. Полученное в результате неочищенное вещество чистят флэш-хроматографией (SiO2, CHCl3/EtOAc/MeOH, 12:2:0,3), получая 0,140 г (2'R,3'R)-баккатин III-13-(3'-азидо-2'-гидрокси-3'-фенилпропионата).
Соединение имеет такие же спектроскопические характеристики, как соединение, полученное в примере III.
ПРИМЕР А: 10-деацетил-7,10-бистрихлорацетилбаккатин III 10-DAB III (10 г, 18,38 ммоль) суспендируют в СН2Cl2 (120 мл), добавляют ДМАР (220 мг, 1,4 ммоль, 0,1 экв.) и смесь охлаждают до 0°С на ледяной бане. Затем добавляют Et3N (10,26 мл, 73,6 ммоль, 4 экв.) и, сразу после этого, добавляют Cl3COCl (4,12 мл, 36,8 ммоль, 2 экв.) в струе азота за 5 мин, поддерживая температуру ниже 10°С. После завершения добавления смесь оставляют при перемешивании на ледяной бане в течение 15 мин, затем баню удаляют и смесь перемешивают при комнатной температуре в течение 1 часа. Через 1 ч реакцию контролируют ТСХ (AcOEt 2/н-гексан 3, Rf 10-ДАБ 111=0,05, Rf 7,10-бистрихлорацетил-10-ДАБ 111=0,26) и добавляют Cl3CCOCl (1 мл, 0,5 экв.). Перемешивание поддерживают при комнатной температуре в течение 10 мин, затем смесь выливают в химический стакан, содержащий 160 г измельченного льда, перемешивая при комнатной температуре до уравновешивания (приблизительно 1 ч). После этого водную фазу отделяют и экстрагируют СН2Cl2 (3×40 мл). Объединенные органические фазы промывают 1N HCl (20 мл), затем насыщенным раствором NaHCO3 (20 мл), сушат над Na2SO4, получая бледно-желтое твердое веществ (16,5 г), у которого после кристаллизации: [α]D-34° (CH2Cl2 C5,8); ИК(KBr) 3517, 1771, 1728, 1240, 981, 819, 787, 675 см-1; 1H-ЯМР (200 МГц): δ 8,11 (Bz, C), 7,46 (Bz, BB'), 6,50 (с, Н-10), 5,72 (м, Н-7, Н-29), 5,02 (д, J=8 Гц, Н-5), 4,95 (8 м, Н-13), 4,37 (д, J=8 Гц, Н-20а), 4,18 (д, J=8 Гц, H-20b), 4,02 (д, J=6 Гц, Н-3), 2,32 (с, 4-Ас), 2,22 (с, Н-18), 1,91 (с, Н-19), 1,25 и 1,11 (с, Н-16, Н-17), 1,94 (м, Н14α), 1,89 (м, Н14β).
ПРИМЕР В: Получение баккатина-III (7):
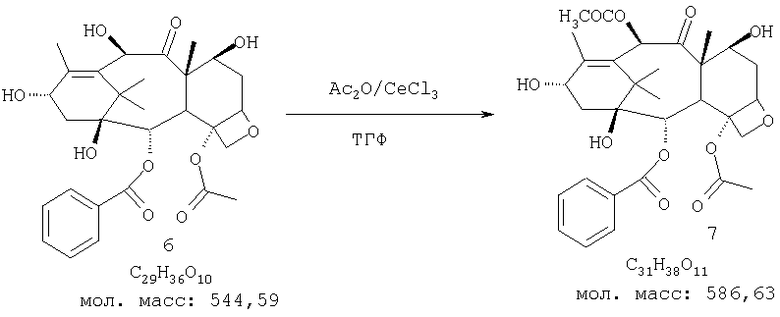
К суспензии 10-дезацетилбаккатина-III (6,382 г, 70 ммоль) в свежеперегнанном сухом ТГФ (350 мл) и уксусном ангидриде (26,5 мл, 280 ммоль) добавляют CeCl3·7Н2O (2,62 г, 7,02 ммоль). Реакционную смесь перемешивают при комнатной температуре. После перемешивания в течение 2 ч реакционная смесь становится однородной, но согласно ТСХ реакция была завершена. Таким образом, перемешивание продолжают в течение ночи при комнатной температуре. В этот момент не остается исходного вещества, в то время как некоторое количество продукта выкристаллизовывается. Смесь гасят ледяной водой (100 мл) и перемешивают в течение 1 ч. Реакционную смесь концентрируют на роторном испарителе для удаления ТГФ и затем выливают в ледяную воду (200 мл). Осажденное твердое вещество фильтруют, промывают водой (2×250 мл) и сушат в вакуумной печи над P2O5 в течение ночи. Выход соединения 7 составляет 41,0 г (100%), 1H-ЯМР-6.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТАКСАНА, ФУНКЦИОНАЛИЗИРОВАННЫЕ ПО 14-ПОЛОЖЕНИЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2320652C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСАНА | 2001 |
|
RU2275365C2 |
| С-2'-МЕТИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ ПАКЛИТАКСЕЛА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ АГЕНТОВ | 2002 |
|
RU2287528C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БАККАТИНА III | 2001 |
|
RU2264394C2 |
| СПОСОБ ПОЛУЧЕНИЯ 14БЕТА-ГИДРОКСИБАККАТИН III-1,14-КАРБОНАТА | 2002 |
|
RU2291866C2 |
| С-4 КАРБОНАТСОДЕРЖАЩИЕ ТАКСАНЫ | 2000 |
|
RU2243223C2 |
| ПОЛУСИНТЕТИЧЕСКИЕ ТАКСАНЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2001 |
|
RU2259363C2 |
| ЗАМЕЩЕННЫЕ АЗОЛЫ, ПРОТИВОВИРУСНЫЙ АКТИВНЫЙ КОМПОНЕНТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2452735C1 |
| ТАКСАНОВОЕ СОЕДИНЕНИЕ, А ТАКЖЕ СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2686459C1 |
| КОМПОЗИЦИИ ИЗОИНДОЛИНА И СПОСОБЫ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНОГО ЗАБОЛЕВАНИЯ | 2015 |
|
RU2692258C2 |
Изобретение относится к новому способу получения паклитаксела, где в качестве исходного используют 10-деацетилбаккатин 111, у которого на первой стадии проводят защиту гидроксилов в положении 7 и 10 одновременно. Способ является многостадийным. Изобретение также относится к новому промежуточному соединению, используемому в этом способе, формулы 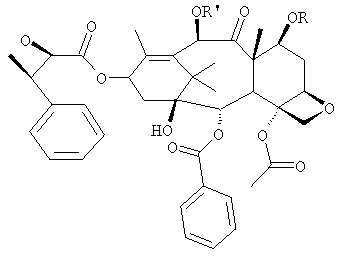 где R=R1= трихлорацетил, или R'= ацетил, a R выбран из трет-бутоксикарбонила и трихлорацетила, или являются водородом. Технический результат - повышение выхода паклитаксела, обладающего противоопухолевой активностью. 2 н. и 7 з.п. ф-лы.
где R=R1= трихлорацетил, или R'= ацетил, a R выбран из трет-бутоксикарбонила и трихлорацетила, или являются водородом. Технический результат - повышение выхода паклитаксела, обладающего противоопухолевой активностью. 2 н. и 7 з.п. ф-лы.
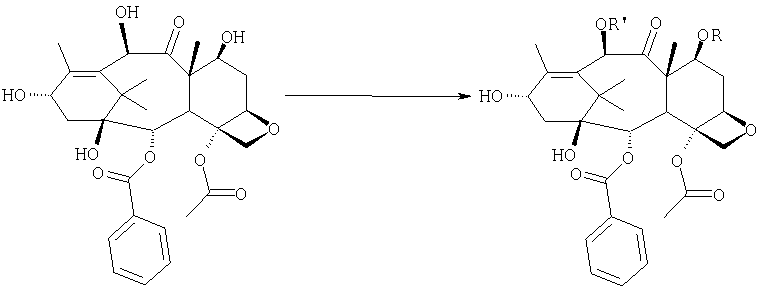
где R=R' = трихлорацетил, или R' = ацетил, a R выбран из третбутоксикарбонила и трихлорацетила,
b) этерификации гидроксила в 13-положении 3-фенил-2-эпоксипропионовой кислотой
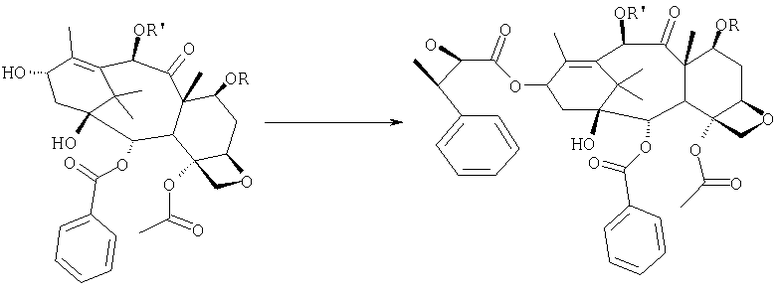
с) удаления защитных групп в положениях 7 и 10 (1), если они обе представляют собой трихлорацетильные группы, с последующим селективным ацетилированием в 10-положении (2) и раскрытием эпоксида азидом натрия (3),
или, альтернативно, с') если R'= ацетил и R= трихлорацетил, раскрытия эпоксида азидом натрия и одновременного снятия защиты в положении 7
d) восстановления азидогруппы в аминогруппу
е) бензоилирования с получением конечного продукта
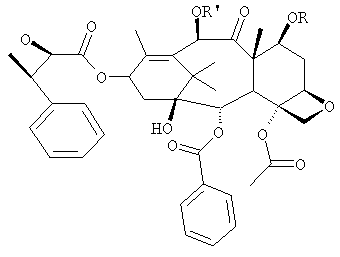
где R и R' являются таким, как определено в п.1, или водородом, в качестве промежуточных продуктов.
| US 6020507 А, 01.02.2000 | |||
| US 5917062 А, 29.06.1999 | |||
| 6,7-МОДИФИЦИРОВАННЫЕ ПАКЛИТАКСЕЛЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1993 |
|
RU2125998C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСАНА И ИСХОДНЫЕ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2115649C1 |
Авторы
Даты
2006-05-10—Публикация
2001-12-03—Подача