Изобретение относится к медицинской микробиологии и может быть использовано для бактериологической диагностики шигеллезов, брюшного тифа, паратифов, сальмонеллезов.
В настоящее время для данного целевого назначения используется Бактоагар Плоскирева производства НПО “Питательные среды” (1).
К основным недостаткам данной среды следует отнести слабую ингибицию кишечной палочки, затрудненную дифференциацию из-за эффекта обесцвечивания колоний лактозоположительной кишечной палочки при посеве высоких концентраций и характерного ползучего роста (“роения”) протея.
Среди питательных сред для выделения шигелл и сальмонелл, выпускаемых ведущими зарубежными фирмами, наиболее близким решением задачи того же назначения к заявляемому изобретению является SS- агар, содержащий в качестве азотистого питания пептон, стимулятор роста, а также лактозу, желчные соли, лимоннокислую соль натрия, натрия тиосульфат, железа окисного цитрат, бриллиантовый зеленый, нейтральный красный, агар (2).
Отечественный вариант SS-агара разработан в ГНЦ прикладной микробиологии (п.Оболенск) и содержит в качестве питательной основы панкреатический гидролизат рыбной муки, в качестве стимулятора роста - экстракт пекарских дрожжей, желчь очищенную сухую (вместо желчных солей) и все остальные ингредиенты импортного аналога (3).
К причинам, препятствующим достижению нижеуказанного технического результата при использовании известной среды, принятой за прототип, относится то, что на отечественном варианте SS-агара затруднена дифференциация лактозоотрицательных (шигеллы, сальмонеллы) и лактозоположительных (кишечная палочка) энтеробактерий из-за незначительного различия в окраске колоний микробных клеток. Кроме того, на среде наблюдается недостаточно высокая ингибиция роста кишечной палочки и “роения” протея.
Задача предлагаемого изобретения - повышение ингибирующих и улучшение дифференцирующих свойств среды.
Указанный технический результат при осуществлении изобретения достигается тем, что питательная среда, включающая панкреатический гидролизат рыбы, стимулятор роста, лимоннокисную соль натрия, лактозу, тиосульфат натрия, желчь очищенную сухую, железа окисного цитрат, бриллиантовый зеленый, нейтральный красный, агар микробиологический, содержит в качестве стимулятора роста - экстракт кормовых дрожжей, в качестве лимоннокислой соли - натрия гидроцитрат (вместо цитрата), дополнительно содержит пептон ферментативный, натрия хлорид, натрия карбонат и трис(гидрооксиметил) аминометан при следующем соотношении компонентов, г/л:
Панкреатический гидролизат рыбы 6,6-6,8
Пептон ферментативный 2,9-3,1
Экстракт кормовых дрожжей 4,9-5,1
Натрия хлорид 3,2-3,4
Натрия гидроцитрат 9,9-10,1
Желчь очищенная сухая 8,4-8,6
Лактоза 9,9-10,1
Железа окисного цитрат 0,9-1,1
Натрия тиосульфат 8,4-8,6
Натрия карбонат 1,9-2,1
Трис (гидрооксиметил) аминометан 2,4-2,6
Бриллиантовый зеленый 0,00049-0,00051
Нейтральный красный 0,049-0,050
Агар микробиологический 9,9-10,1
Вода дистиллированная До 1 л
Содержание в данной среде гидроцитрата и тиосульфата натрия, желчи, бриллиантового зеленого полностью подавляет рост сопутствующей флоры (грамположительные кокки), “роение” протея, значительно ингибирует рост эшерихий. Среда обладает высокой чувствительностью (отмечается рост единичных колоний шигелл и сальмонелл при посеве из разведения 10-7), а также высокой точностью дифференциации лактозоотрицательных (шигеллы, сальмонеллы) и лактозоположительных (кишечная палочка) энтеробактерий. Микроорганизмы рода шигелл и сальмонелл образуют на среде бесцветные колонии диаметром 2,0-2,5 мм. Сероводообразующие штаммы сальмонелл имеют характерный черный центр. Колонии кишечной палочки ярко-красного цвета. Бактерии рода Proteus образуют на среде крупные бесцветные колонии в 0-форме с четко очерченными краями.
Среда сконструирована из отечественных гостированных ингредиентов на основе сухого питательного бульона, имеющего промышленный выпуск на предприятии НПО “Питательные среды” (4).
Среду получают следующим образом.
Пример 1. В колбу с 0,6 л дистиллированной воды вносят следующие ингредиенты, взятые в количестве: панкреатический гидролизат рыбы - 6,6 г, пептон ферментативный - 2,9 г, экстракт кормовых дрожжей - 4,9 г, натрия хлорид - 3,2 г, натрия гидроцитрат - 9,9 г, желчь очищенная сухая - 8,4 г, лактоза - 9,9 г, железа окисного цитрат - 0,9 г, натрия тиосульфат - 8,4 г, натрия карбонат - 1,9 г, трис(гидрооксиметил) аминометан - 0,049 г, бриллиантовый зеленый - 0,00049 г, агар микробиологический - 9,9 г.
Навески сухих ингредиентов тщательно размешивают, объем смеси доводят дистиллированной водой до 1 л, полученную суспензию доводят до кипения, кипятят 1-2 мин до полного расплавления агара рН 7,0±0,2, что соответствует минимальной концентрации ингредиентов. Охлаждают до 45-50°С, разливают в чашки Петри слоем 4,0-5,0 мм и оставляют для застывания. Перед посевом чашки подсушивают с открытыми крышками в течение 90-100 мин при 18-25°С. Посев материала производят в соответствии с “Методическими указаниями по микробиологической диагностике заболеваний, вызываемых энтеробактериями” (М., 1984 г). Время инкубации тесткультур 22±2 часа при 37°С.
Пример 2. Отличается от примера 1 тем, что в 0,6 л дистиллированной воды растворяют панкреатический гидролизат рыбы - 6,7 г, пептон ферментативный - 3,0 г, экстракт кормовых дрожжей - 5,0 г, натрия хлорид - 3,3 г, натрия гидроцитрат - 10,0 г, желчь очищенная сухая - 8,5 г, лактоза - 10,0 г, железа окисного цитрат - 1,0 г, натрия тиосульфат - 8,5 г, натрия карбонат - 2,0 г, трис(гидрооксиметил) аминометан - 2,5 г, бриллиантовый зеленый - 0,0005 г, нейтральный красный - 0,05 г, агар микробиологический -10,0 г.
Объем смеси доводят дистиллированной водой до 1 л. рН среды 7,0±0,2, что соответствует оптимальной концентрации ингредиентов.
Пример 3. Отличается от примера 1 и 2 тем, что в 0,6 л дистиллированной воды растворяют панкреатический гидролизат рыбы - 6,8 г, пептон ферментативный - 3,1 г экстракт кормовых дрожжей - 5,1 г, натрия хлорид - 3,4 г, натрия гидроцитрат - 10,1 г, желчь очищенная сухая - 8,6 г, лактоза - 10,1 г, железа окисного цитрат - 1,1 г, натрия тиосульфат - 8,6 г, натрия карбонат - 2,1 г, трис(гидрооксиметил) аминометан - 2,6 г, бриллиантовый зеленый - 0,00051 г, нейтральный красный - 0,051 г, агар микробиологический - 10,1 г.
Объем смеси доводят дистиллированной водой до 1 л. рН среды 7,0±0,2, что соответствует оптимальной концентрации ингредиентов.
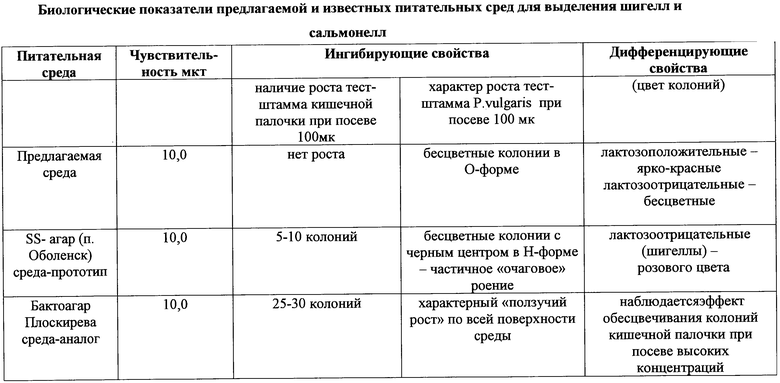
Биологические показатели предлагаемой и известных сред для выделения шигелл и сальмонелл представлены в таблице.
Из табличных данных видно, что по степени ингибиции роста эшерихий (кишечная палочка) разработанная среда превосходит Бактоагар Плоскирева и SS-агар (п.Оболенск). При посеве 100 микробных клеток тест-штамма кишечной палочки на Бактоагаре Плоскирева формируются 25-30 колоний, на SS-агара (п.Оболенск) - 5-10 колоний на предлагаемой питательной среде, при этом наблюдается полная ингибиция роста. Ингибирующие свойства разработанной среды Бактоагара Плоскирева и SS-агара (п.Оболенск) в отношение бактерий рода Proteus заметно отличаются. При посеве 100 мк штамма Р. vulgaris на разработанной питательной среде формируются единичные колонии в О-форме с четко очерченными краями, в то время как на Бактоагаре Плоскирева при той же посевной концентрации микробных клеток наблюдается характерный ползучий рост (“роение”) протейного штамма. На среде-прототипе SS-агаре отмечается частичное “очаговое” роение штамма Р. vulgaris HX-19 при аналогичных условиях посева.
Из данных, приведенных в таблице, также видно, что разработанная среда обладает более четкими дифференцирующими свойствами: колонии кишечной палочки ярко-красного цвета, колонии шигелл и сальмонелл - бесцветные и прозрачные. На Бактоагаре Плоскирева наблюдается эффект обесцвечивания колоний лактозоположительной кишечной палочки при посеве высоких концентраций, что затрудняет дифференциацию. На SS-агаре (п.Оболенск) дифференциация затруднена за счет устойчивого ярко-розового окрашивания колоний лактозоотрицательных энтеробактерий, в особенности шигелл.
БИБЛИОГРАФИЧЕСКИЕ ДАННЫЕ
1. ФС 42-3672-98 Питательная среда для выделения шигелл и сальмонелл (Бактоагар Плоскирева).
2. SSA Salmonella Shigella Agar. Microbiology Manual Merck 1990, p.188. (Каталог фирмы “Merck”).
3. Шепелин А.П., Марчихина И.И. Питательная среда для выделения шигелл и сальмонелл. А.С. №930540 25/13.
4. ФС42-224 ВС-88 Питательный бульон для культивирования микроорганизмов, сухой.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ СЕЛЕКТИВНОГО ВЫДЕЛЕНИЯ САЛЬМОНЕЛЛ | 2002 |
|
RU2233884C2 |
| Дифференциально-селективная питательная среда для выделения шигелл и сальмонелл сухая (Гектоеновый энтеро-агар) | 2023 |
|
RU2812423C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ НАКОПЛЕНИЯ САЛЬМОНЕЛЛ | 2001 |
|
RU2192461C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ НАКОПЛЕНИЯ ЭНТЕРОБАКТЕРИЙ | 2004 |
|
RU2267530C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ САЛЬМОНЕЛЛ И ШИГЕЛЛ | 1993 |
|
RU2079254C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ МИКРОБИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ КРОВИ | 2003 |
|
RU2267537C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ГЕМОКУЛЬТУР | 2003 |
|
RU2265654C2 |
| Питательная среда для дифференциации энтеробактерий | 1985 |
|
SU1298245A1 |
| ЭЛЕКТИВНО-ДИФФЕРЕНЦИАЛЬНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ХОЛЕРНЫХ ВИБРИОНОВ (ВАРИАНТЫ) | 2012 |
|
RU2484141C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ПАТОГЕННЫХ ЭНТЕРОБАКТЕРИЙ | 2000 |
|
RU2179582C2 |
Изобретение относится к медицинской микробиологии, наиболее эффективно может быть использовано для бактериологической диагностики шигеллезов, брюшного тифа, паратифов, сальмонеллезов. Питательная среда данного целевого назначения содержит панкреатический гидролизат рыбы, натрия хлорид, натрия тиосульфат, лактозу, лимоннокислую соль натрия, желчь очищенную сухую, железо окисного цитрат, бриллиантовый зеленый, нейтральный красный, трис(гидрооксиметил) аминометан, натрия карбонат, агар микробиологический, а также экстракт кормовых дрожжей, гидроцитрат (вместо цитрата) натрия, пептон ферментативный, трис(гидрооксиметил) аминометан, натрия карбонат, натрия хлорид. Изобретение позволяет в значительной степени подавлять рост эшерихий и с высокой точностью дифференциации выделять лактозоотрицательные и лактозоположительные энтеробактерии при сохранении высоких ростовых (в отношении шигелл и сальмонелл) свойств среды. 1 табл.
Питательная среда для выделения шигелл и сальмонелл, содержащая панкреатический гидролизат рыбы, стимулятор роста, натрия тиосульфат, лимоннокислую соль натрия, лактозу, желчь очищенную сухую, железа окисного цитрат, бриллиантовый зеленый, нейтральный красный, агар микробиологический, дистиллированную воду, отличающаяся тем, что в качестве стимулятора роста она содержит экстракт кормовых дрожжей, в качестве лимоннокислой соли - натрия гидроцитрат, дополнительно содержит пептон ферментативный, натрия хлорид, натрия карбонат и трис(гидрооксиметил) аминометан при следующем соотношении компонентов, г/л:
Панкреатический гидролизат рыбы 6,6-6,8
Пептон ферментативный 2,9-3,1
Экстракт кормовых дрожжей 4,9-5,1
Натрия хлорид 3,2-3,4
Натрия гидроцитрат 9,9-10,1
Желчь очищенная сухая 8,4-8,6
Лактоза 9,9-10,1
Железа окисного цитрат 0,9-1,1
Натрия тиосульфат 8,4-8,6
Натрия карбонат 1,9-2,1
Трис (гидрооксиметил) аминометан 2,4-2,6
Бриллиантовый зеленый 0,00049-0,00051
Нейтральный красный 0,049-0,051
Агар микробиологический 9,9-10,1
Вода дистиллированная До 1 л
| SSA Salmonella Shigella Agar Microbiology Manual Merck | |||
| Каталог фирмы “Merck”, 1990, р.188 | |||
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ САЛЬМОНЕЛЛ И ШИГЕЛЛ | 1993 |
|
RU2079254C1 |
| КАЛИНА Г.П., ШИГАНОВА В.Л | |||
| Среда с хлористым магнием для обнаружения сальмонелл (Экстремальное исследование) | |||
| Лабораторное дело, 1972, №4, с.240-248 | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Питательная среда для выделения шигелл и сальмонелл (Бактоагар Плоскирева) | |||
| ПЕРЕПЕЛИЦА Л.Г | |||
| Разработка селективной среды для выделения сальмонелл | |||
| Вопросы физиологии, метаболизма и идентификации микроорганизма | |||
| Сборник научных трудов | |||
| - М., 1987, с.74 и 75. | |||
Авторы
Даты
2004-08-10—Публикация
2002-07-22—Подача