Данное изобретение относится к поиску новых химических веществ и новых физиологически активных веществ, соединений-лидеров (leader) и кандидатов в лекарство (drug-candidates), получаемых на основании скрининга комбинаторных библиотек, а также к новым комбинаторным библиотекам.
Более конкретно настоящее изобретение относится к новым замещенным пиридо[4',3':5,6]пирано[2,3-d]пиримидинам и комбинаторной библиотеке, состоящей из новых пиридо[4',3':5,6]пирано[2,3-d]пиримидинов.
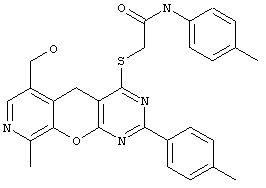
Замещенные пиридо[4',3':5,6]пирано[2,3-d]пиримидины обладают высоким потенциалом физиологической активности. Несмотря на отсутствие в патентной и научной литературе примеров структур, содержащих пиридо[4',3':5,6]пирано[2,3-d]пиримидиновый фрагмент следует ожидать возможную высокую биологическую активность этих соединений по аналогии со структурами, содержащими указанные циклы или их изостеры в каких-либо иных комбинациях. Так, соединение 1, содержащее в своей структуре пиридиновый, пирановый и пиримидиновый циклы, проявляет выраженные антибактериальные свойства [Al-Thebeiti, M. Heterocycles. 1999, 51 (11): 2765-2774]. Вещество 2, в котором вместо пиридинового кольца присутствует изостерное ему бензольное, проявляет не только антибактериальную, но и фунгицидную активность [Bedair, A., Emam, H., El-Hady, N., El-Agrody, A. Farmaco, 2001, 56 (12): 965-974].
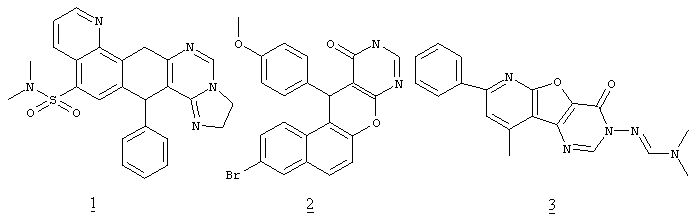
Вещество 3, в котором вместо пиранового кольца присутствует родственное ему фурановое, проявляет противоаллергические свойства [Wagner, G., Prantz, J. Pharmazie, 1993, 48 (4): 250-253].
Учитывая высокий потенциал физиологической активности пиридо[4',3':5,6]пирано[2,3-d]пиримидинов, актуальным является разработка новых классов гетероциклических соединений данного типа и комбинаторных библиотек пиридо[4',3':5,6]пирано[2,3-d]пиримидинов для поиска биологически активных соединений-лидеров.
С целью поиска новых биологически активных соединений-лидеров изобретатели синтезировали неизвестные ранее пиридо[4',3':5,6]пирано[2,3-d]пиримидины и разработали новую комбинаторную библиотеку, включающую эти соединения.
Замещенные пиридо[4',3':5,6]пирано[2,3-d]пиримидины не изучены.
Настоящее изобретение относится к новым пиридо[4',3':5,6]пирано[2,3-d]пиримидинам и к комбинаторной библиотеке новых пиридо[4',3':5,6]пирано[2,3-d]пиримидинов.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Комбинаторная библиотека» означает группу соединений, полученных параллельным синтезом, предназначенную для поиска соединения-хита или соединения-лидера, а также для оптимизации физиологической активности соединения-хита или соединения-лидера, причем каждое соединение библиотеки соответствует общей структурной формуле - скэффолду, и библиотека является коллекцией родственных гомологов или аналогов.
«Соединение-хит» («хит») означает соединение, проявившее в процессе первичного скрининга высокую искомую физиологическую активность.
«Соединение-лидер» («лидер») означает соединение с значительной (максимальной) физиологической активностью, проявляемой при его взаимодействии с конкретной биомишенью.
«Параллельный синтез» означает метод ведения комбинаторного химического синтеза библиотеки, заключающийся в одновременном проведении в одинаковых условиях большого числа однотипных реакций.
«Скэффолд» означает общую структурную формулу или молекулярный остов или инвариантную область соединений комбинаторной библиотеки.
«Заместитель» означает химический радикал, который присоединяется к скэффолду или полупродукту синтеза в процессе их синтеза.
«Нуклеофильный» означает электроноизбыточный реагент.
«Электрофильный» означает электронодефицитный реагент.
«Уходящая группа» означает группу, которая замещается нуклеофилом.
«Инертный заместитель» (или «не мешающий», "Non-interfering substituent") означает низко- или нереакционоспособный радикал, включая, но не ограничивая C1-C7алкил, С2-С7алкенил, С2-С7алкинил, C1-С7алкокси, C7-С12аралкил, замещенный аралкил, С7-C12гетероциклилалкил, замещенный гетероциклилалкил, С7-C12алкарил, С3-С10циклоалкил, С3-С10циклоалкенил, фенил, замещенный фенил, толуил, ксиленил, бифенил, С2-C12акоксиалкил, C2-С10алкилсульфинил, C2-С10алкилсульфонил, (CH2)m-O-(C1-С7алкил), -(CH2)m-N(C1-C7алкил)n, арил, замещенный арил, замещенный алкокси, фторалкил, арилоксиалкил, гетероциклил, замещенный гетероциклил и нитроалкил; где m и n имеют значение от 1 до 7. Предпочтительными «инертными заместителями» являются С1-C7алкил, С2-C7алкенил, С2-C7алкинил, C1-С7алкокси, С7-C12аралкил, С7-C12алкарил, С3-С10циклоалкил, С3-С10циклоалкенил, фенил, замещенный фенил, (СН2)m-O-(C1-C7алкил), -(CH2)m-N(C1-C7алкил)n, арил, замещенный арил, гетероциклил и замещенный гетероциклил.
«Нуклеофильный заместитель» означает химический радикал, который присоединяется к скэффолду в результате реакции с нуклеофильным реагентом, например, выбранным из группы первичных или вторичных аминов, спиртов, фенолов, меркаптанов и тиофенолов. «Электрофильный заместитель» означает химический радикал, который присоединяется к скэффолду в результате реакции с электрофильным реагентом, например, выбранным из группы органических галогенидов, органических кислот или их производных (ангидридов, имидазолидов, галогенангидридов), эфиров органических сульфокислот или органических сульфохлоридов, органических галогенформиатов, органических изоцианатов и органических изотиоцианатов.
«Арил» означает один или более ароматических циклов, каждый из которых включает 5 или 6 атомов углерода. «Арил» может быть конденсированным полициклом, например, как нафталин или неконденсированным, например, как бифенил. «Замещенный арил» имеет один или несколько «не мешающих» заместителей.
«Галоген» означает атом фтора, хлора, брома или иода.
«Гетероцикл» означает один или несколько насыщенных, ненасыщенных или ароматических циклов с 5, 6 или 7 атомами, по крайней мере один из которых является гетероатомом. Преимущественными гетероатомами являются сера, кислород и азот. «Гетероцикл» может быть неконденсированным, например, азолы (1,3,4-тиадиазол, 1,3,4-оксадиазол) и др. или конденсированным полициклом, например, как бензазолы (бензимидазол, бензоксазол, бензтиазол), азолоазины (бициклы, включающие азольный цикл, например, оксазольный, тиазольный, имидазольный и др., и азиновый цикл, например, пиридиновый, пиридазиновый, пиримидиновый, пиразиновый и др.), хиназолиновы, тиенопиримидиноны, 1,2,3,5-тетрагидро-8-тиа-5,7-диаза-циклопента[а]инден-4-оны, 5,6,7,8-тетрагидро-3H-бензо[4,5]тиено[2,3-d]пиримидин-4-оны, 7,8-дигидро-3Н,5Н-6-окса-9-тиа-1,3-диаза-флуорен-4-оны, 5,6,7,8-тетрагидро-3H-9-тиа-1,3,6-триаза-флуорен-4-оновый, 2H-бензо[1,2,4]тиадиазины и др.
«Азогетероцикл» означает гетероцикл, включающий, по крайней мере, один атом азота, например, как пиперидин, морфолин, пиррол, 1,3,4-тиадиазол, 1,3,4-оксадиазол, бензимидазол, бензоксазол, бензтиазол, хинолин, азолоазины (бициклы, включающие азольный цикл, например, оксазольный, тиазольный, имидазольный и др., и азиновый цикл, например, пиридиновый, пиридазиновый, пиримидиновый, пиразиновый и др.), хиназолиновы, тиенопиримидиноны, 1,2,3,5-тетрагидро-8-тиа-5,7-диаза-циклопента[а]инден-4-оны, 5,6,7,8-тетрагидро-3H-бензо[4,5]тиено[2,3-d]пиримидин-4-оны, 7,8-дигидро-3Н,5Н-6-окса-9-тиа-1,3-диаза-флуорен-4-оны, 5,6,7,8-тетрагидро-3H-9-тиа-1,3,6-триаза-флуорен-4-оновый, 2H-бензо[1,2,4]тиадиазины.
«Замещенный азогетероцикл» означает азогетероцикл, имеющий один или несколько «не мешающих» заместителей.
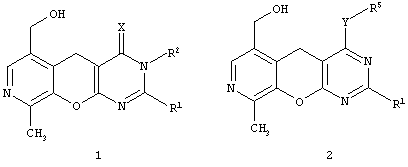
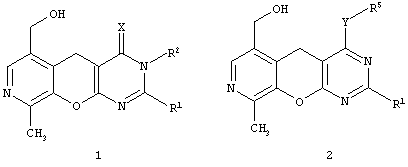
Целью настоящего изобретения является новые замещенные 3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидины общей формулы (1):
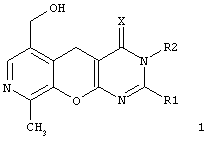
в которой:
Х представляет атом серы или кислорода;
R' представляет арил, замещенный арил, гетарил;
R2 представляет атом водорода, алкил, аллил, замещенный бензил, CH2-C(O)R3, CH2-C(O)NR3R4;
R3, R4 представляют инертный заместитель,
и новые замещенные 5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидины общей формулы (2):
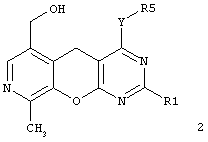
в которой:
Y представляет атом серы, группу SO, группу SO2, группу NH или группу NR6;
R1 представляет арил, замещенный арил, гетарил;
R5 представляет атом водорода, алкил, аллил, замещенный бензил, CH2-C(O)R3, CH2-C(O)NR3R4;
R3, R4, R6 представляют инертный заместитель.
Целью настоящего изобретения является также новая комбинаторная библиотека новых замещенных пиридо[4',3':5,6]пирано[2,3-d]пиримидинов общей формулы (1) и (2).
Предпочтительным вариантом изобретения являются новые замещенные пиридо[4',3':5,6]пирано[2,3-d]пиримидины общей формулы (1) и (2) и комбинаторная библиотека новых замещенных пиридо[4',3':5,6]пирано[2,3-d]пиримидинов общей формулы (1) и (2) или их фармацевтически приемлемую соль, N-оксид или гидрат.
В частности, предпочтительными новыми соединениями являются:
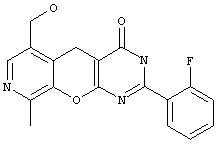
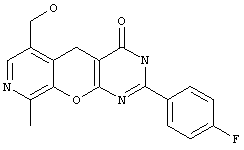
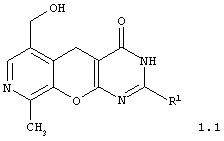
2-замещенные 6-гидроксиметил-9-метил-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-оны общей формулы 1.1:
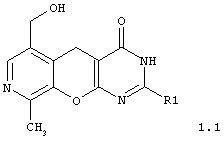
в которой R1 представляет арил, замещенный арил, гетарил;
2,3-дизамещенные 6-гидроксиметил-9-метил-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-оны общей формулы 1.2:
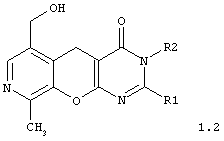
в которой R1 представляет арил, замещенный арил, гетарил;
R2 представляет атом водорода, алкил, аллил, замещенный бензил, CH2-C(O)R3, CH2-C(O)NR3R4;
R3, R4 представляют инертный заместитель;
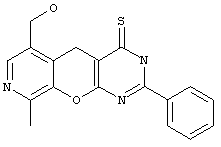
2-замещенные 6-гидроксиметил-9-метил-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тионы общей формулы 1.3:
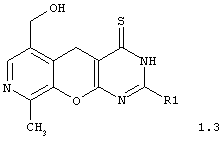
в которой R1 имеет вышеуказанное значение;
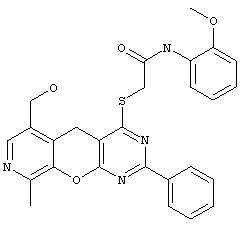
4-сульфанилзамещенные 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидины общей формулы 2.1:
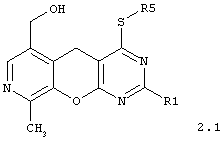
в которой R1 и R5 имеют вышеуказанное значение;
4-сульфинилзамещенные 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидины общей формулы 2.2:

в которой R1 и R5 имеют вышеуказанное значение;
4-сульфонилзамещенные 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидины общей формулы 2.3:
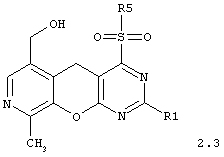
в которой R1 и R5 имеют вышеуказанное значение;
4-аминозамещенные 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидины общей формулы 2.4:
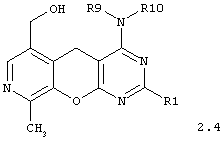
в которой R1 представляет арил, замещенный арил, гетарил;
R9 представляет атом водорода или инертный заместитель;
R5 имеет вышеуказанное значение.
Предпочтительной комбинаторной библиотекой для поиска биологически активных соединений-лидеров является библиотека, состоящая из замещенных пиридо[4',3':5,6]пирано[2,3-d]пиримидинов общей формулы (1) и (2) или их фармацевтически приемлемых солей, N-оксидов или гидратов.
Реагенты, используемые в качестве исходных, в большинстве случаев являются коммерчески доступными или легко получаются известными в литературе способами.
Ниже изобретение описывается с помощью конкретных примеров получения конкретных соединений. Структуры полученных соединений подтверждались данными химического, хроматографического и спектрального анализа. Жидкофазный паралельный ситез новых соединений и комбинаторной библиотеки осуществляли с использованием специальных синтезаторов "CombiSyn-012-3000" [М.Бару, А.Иващенко, Патент России 2180609, 2002; РСТ WO 02/087740 A1, 2002] и оборудования [Technology Platform. In Custom Chemistry; Chemical Diversity Labs, Inc.; San Diego, CA, 2002; p.5, http://www.chemdiv.com.].
Приведенные ниже примеры иллюстрируют, но не ограничивают изобретение.
Общая информация.
Все растворители и реагенты были получены из коммерческих источников, таких как Акрос (Acros) (Бельгия), Сигма-Алдрич (Sigma-Aldrich) (США), Ланкастер (Lancaster) (Англия) и КемДив (ChemDiv) (США). Точки плавления (т.пл.) были получены на приборе фирмы Бюхи (Buchi) (Швейцария) модель В-520. 1Н и 13С ЯМР спектры были получены на спектрометрах фирмы Вариан (Varian) Gemini-300 (300 MHz) в CDCl3, химические сдвиги приведены в шкале δ (м.д.). Внутренний стандарт тетраметилсилан.
Содержание основного вещества контролировали с помощью HPLC на приборе Шимадзу (Shimadzu) 10-AV (колонка Luna-C18, Phenomenex, 25 см × 4.6 мм, UV детектирование при 215 и 254 нм) и LC-MS на приборе Applied Biosystems (Shimadzu 10-AV LC, Gilson-215 автоматическая подача образца, масс-спектрометр API 150EX, детекторы UV (215 и 254 нм) и ELS, колонка Luna-C18, Phenomenex, 5 см × 2 мм).
Аналитическую ТСХ проводили на силикагеле на алюминевых пластинках Silufol UV254 (5 см × 15 см) (Kavalier, Czech Republic) или на стеклянных пластинках с 0.25 мм слоем силикагеля 60 F254 (Merck, Germany). Визуализация осуществлялась с помощью УФ света на длинне волны 254 нм. Для хроматографической очистки использовали силикагель 5-40 μm (Chemapol, Czech Republic) и 63 μm (ЕМ Science, USA). В соответствии с данными LC/MS все синтезированные соединения имели содержание основного вещества выше 95%.
Пример 1. Исходный амид 5-гидроксиметил-2-имино-8-метил-2H-пирано[2,3-с]пиридин-3-карбоновой кислоты. Смесь 20.36 г (100 ммоль) пиридоксаля гидрохлорида и 8.4 г (100 ммоль) амида циануксусной кислоты растворяли при нагревании в 50 мл абсолютного метанола. К полученному теплому раствору прибавляли 20.0 мл (200 ммоль) очищенного пиперидина. Реакционную массу выдерживали при 50°С и постоянном перемешивании 45 минут. Выпавший осадок отфильтровывали, промывали метанолом (3×20 мл). Выход 17.2 г (74%). T.пл.198-199°С. 1Н NMR (DMSO), δ: 2.48 (s, 3Н), 4.65 (d, J=5.4 Hz 2H), 5.30 (t, J=5.2 Hz 1H), 7.70 (s, 1H), 8.19 (s, 1H), 8.50 (s, 1H), 9.04 (s, 1H), 9.39 (s, 1H). В дальнейшем синтезе использовали без дополнительной очистки.
Пример 2. Комбинаторная библиотека 2-замещенных 6-гидроксиметил-9-метил-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-онов 1.1 {1-5}. Параллельный синтез комбинаторной библиотеки проводили в синтезаторе "CombiSyn-012-3000". В каждый из 5 реакторов синтезатора загружали по 50 мл м-бутанола, по 4.6 г (20 ммоль) амида 5-гидроксиметил-2-имино-8-метил-2H-пирано[2,3-с]пиридин-3-карбоновой кислоты, по 40 ммоль соответствующего альдегида и по 1 мл свежеперегнанного пиперидина. Реакционные массы нагревали с обратным холодильником до выпадения осадка. Реакционные массы охлаждали, осадки отфильтровывали, промывали на фильтре метанолом (3×20 мл) и кристаллизовали из диметилформамида или н-бутанола. Получали комбинаторную библиотеку, включающую 5 соединений общей формулы 1.1, в том числе: 6-гидроксиметил-9-метил-2-(4-метоксифенил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-он 1.1 {1) получен с выходом 84%, т.пл.>300°С, 1Н NMR (DMSO), δ: 12.61 (br.s, 1H), 8.11 (s, 1H), 8.08 (d, 2H), 7.03 (d, 2H), 5.24 (t, 1H), 4.48 (d, 2H), 3.83 (s, 3Н), 3.63 (s, 2H), 2.40 (s, 3Н); 6-гидроксиметил-9-метил-2-(3-метоксифенил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-он 1.1 {2} получен с выходом 86%, т.пл.>300 °С, 1Н NMR (DMSO), δ: 12.88 (br.s, 1Н), 8.12 (s, 1H), 7.69 (m, 2H), 7.43 (t, 1H), 7.14 (dd, 1H), 5.28 (t, 1H), 4.50 (d, 2H), 3.82 (s, 3H), 3.70 (s, 2H), 2.50 (s, 3Н); 6-гидроксиметил-9-метил-2-(4-метилфенил)-3,5-дигидро-4H-пиридо[4'3':5,6]пирано(2,3-d]пиримидин-4-он 1.1 {3} получен с выходом 81%, т.пл.>300°С, 1Н NMR (DMSO), δ: 12.80 (s, 1H), 8.13 (s, 1H), 8.02 (d, 2H), 7.33 (d, 2H), 5.25 (t, 1H), 4.50 (d, 2H), 3.61 (s, 2H), 2.37 (s, 3Н), 2.49 (s, 3Н); 6-гидроксиметил-9-метил-2-(2-фторфенил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано(2,3-d]пиримидин-4-он 1.1 {4} получен с выходом 63%, т.пл.>300°С, 1Н NMR (DMSO), δ: 12.85 (br.s, 1H), 8.14 (s, 1H), 7.58-7.77 (m, 2H), 7.37 (m, 2H), 5.28 (t, 1H), 4.51 (d, 2H), 3.70 (s, 2H), 2.49 (s, 3Н); 6-гидроксиметил-9-метил-2-(4-фторфенил)-3,5-дигидро-4H-пиридо(4',3':5,6]пирано[2,3-d]пиримидин-4-он 1.1 {5} получен с выходом 90%, т.пл.>300°С, 1Н NMR (DMSO), δ: 12.40 (br.s, 1H), 8.16 (m, 2H), 8.11 (s, 1H), 7.36 (t, 2H), 5.24 (t, 1H), 4.45 (d, 2H), 3.70 (s, 2H), 2.48 (s, 3H).
Пример 3. Комбинаторная библиотека 2,3-дизамещенные 6-гидроксиметил-9-метил-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-онов 1.2 {1-5}. Параллельный синтез комбинаторной библиотеки проводили в синтезаторе "CombiSyn-012-3000". В каждый из 5 реакторов синтезатора загружали по 10 ммоль соответствующего 2-замещенного 6-гидроксиметил-9-метил-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-она и по 10 мл диметилформамида. К полученным растворам добавляли по 15 ммоль триэтиламина и по 10,1 ммоль соответствующего алкилирующего агента. Реакционные массы перемешивали при 70°С в течение 1 часа. Выпавшие осадки отфильтровывали, промывали водой (3×10 мл) и кристаллизовали из диметилформамида. Получали комбинаторную библиотеку, включающую 5 соединений общей формулы 1.2, в том числе: 6-гидроксиметил-9-метил-2-(4-метоксифенил)-3-(4-фторбензил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-он 1.2 {1} получен с выходом 89%, т.пл.>300°С, 1Н NMR (DMSO), δ: 8.13 (d, 2H), 8.09 (s, 1H), 7.62 (m, 2H), 7,25 (m, 2H), 7.18 (d, 2H), 5.56 (s, 2H), 5.22 (t, 1H), 4.49 (d, 2H), 3.80 (s, 3Н), 3.61 (s, 2H), 2.43 (s, 3Н); 6-гидроксиметил-9-метил-2-(3-метоксифенил)-3-(4-фторбензил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-он 1.2 {2} получен с выходом 86%, т.пл.>300°С, 1Н NMR (DMSO), δ: 8.14 (s, 1H), 7.71 (m, 2H), 7.60 (m, 2H), 7.42 (t, 1H), 7,24 (m, 2H), 7.15 (dd, 1H), 5.54 (s, 2H), 5.29 (t, 1H), 4.51 (d, 2H), 3.83 (s, 3Н), 3.71 (s, 2H), 2.52 (s, 3Н).
Пример 4. Комбинаторная библиотека 2-замещенных 6-гидроксиметил-9-метил-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тионов 1.3 {1-5}. Параллельный синтез комбинаторной библиотеки проводили в синтезаторе "CombiSyn-012-3000". В каждый из 5 реакторов синтезатора загружали по 20 мл ксилола, по 10 ммоль соответствующего 2-замещенного 6-гидроксиметил-9-метил-1-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-она и 5.55 г (25 ммоль) пентасульфида фосфора. Реакционные смеси кипятили с обратным холодильником в течение 2 часов и охлаждали, осадки отфильтровывали. Полученные осадки растворяли в 10 мл кипящей ледяной уксусной кислоты и фильтровали горячими от нерастворимых примесей. Полученные фильтраты охлаждали, выпавшие осадки отфильтровывали, промывали водой (2×30 мл) и кристаллизовали из диметилформамида. Получали комбинаторную библиотеку, включающую 5 соединений общей формулы 1.3, в том числе: 6-гидроксиметил-9-метил-2-(3-хлорфенил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тион 1.3 {1} получен с выходом 80%, т.пл. 265°С, 1Н NMR (DMSO), δ:14.25 (br.s, 1Н), 8.19 (s, 1H), 8.16 (s, 1H), 8.07 (d, 1H), 7.70 (d, 1H), 7.57 (t, 1H), 5.28 (t, 1H), 4.50 (d, 2H), 3.86 (s, 2H), 2.49 (s, 3Н); 6-гидроксиметил-9-метил-2-фенил-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тион 1.3 (2} получен с выходом 69%, т.пл.282-84°С (р), 1Н NMR (DMSO), δ: 14.10 (s, 1H), 8.14 (s, 1H), 8.10 (dd, 2H), 7.50-7.65 (m, 3Н), 5.28 (t, 1H), 4.51 (d, 2H), 3.82 (s, 2H), 2.49 (s, 3Н); 6-гидроксиметил-9-метил-2-(2-хлорфенил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тион 1.3 {3} получен с выходом 62%, т.пл.259°С, 1Н NMR (DMSO), δ: 14.41 (s, 1H), 8.18 (s, 1H), 7.48-7.68 (m, 4H), 5.30 (t, 1H), 4.49 (d, 2H), 3.90 (s, 2H), 2.49 (s, 3H); 6-гидроксиметил-9-метил-2-(4-метилфенил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тион 1.3 {4} получен с выходом 78%, т.пл.268-69°С (р), 1Н NMR (DMSO), δ: 14.00 (s, 1H), 8.14 (s, 1H), 8.07 (d, 2H), 7.34 (d, 2H), 5.30 (t, 1H), 4.53 (d, 2H), 3.85 (s, 2H), 2.50 (s, 3Н), 2.40 (s, 3Н); 6-гидроксиметил-9-метил-2-(4-метоксифенил)-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тион 1.3 {5} получен с выходом 82%, т.пл.249°С (р), 1Н NMR (DMSO), δ: 13.53 (s, 1H), 8.16 (s, 1H), 7.76 (d, 1H), 7.58 (dt, 1H), 7.22 (d, 1H), 7.12 (t, 1H), 5.27 (t, 1H), 4.52 (d, 2H), 3.91 (s, 3H), 3.85 (s, 2H), 2.43 (s, 3H).
Пример 5. Комбинаторная библиотека 4-сульфанилзамещенных 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидинов 2.1 {1-5}. Параллельный синтез комбинаторной библиотеки проводили в синтезаторе "CombiSyn-012-3000". В каждый из 5 реакторов синтезатора загружали по 10 мл диметилформамида и по 10 ммоль соответствующего 2-замещенного 6-гидроксиметил-9-метил-1-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тиона. К полученным растворам добавляли по 15 ммоль триэтиламина и по 10.1 ммоль соответствующего алкилирующего агента. Реакционные массы выдерживали при 70°С при постоянном перемешивании в течение 1 часа и охлаждали. Выпавшие осадки отфильтровывали, промывали метанолом (2×20 мл) и кристаллизовали из диметилформамида. Получали комбинаторную библиотеку, включающую 5 соединений общей формулы 2.1, в том числе: N1-(2-метоксифенил)-2-(6-гидроксиметил-9-метил-2-фенил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфанил)ацетамид 2.1 {1} получен с выходом 79%, т.пл.295°С (разл.), 1H NMR (DMSO), δ: 9.55 (s, 1Н), 8.38 (d, 2H), 8.15 (s, 1H), 8.00 (d, 1Н), 7.47 (m, 3Н), 7.00 (dd, 2H), 6.84 (m, 1Н), 5.31 (t, 1Н), 4.55 (d, 2H), 4.37 (s, 2H), 3.95 (s, 2H), 3.65 (s, 3Н), 2.48 (s, 3Н); N1-(3-метоксифенил)-2-(6-гидроксиметил-9-метил-2-фенил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфанил)ацетамид 2.1 {2} получен с выходом 68%, т.пл.293-294°С, 1Н NMR (DMSO), δ: 9.98 (s, 1Н), 8.32 (d, 2H), 8.14 (s, 1Н), 7.46 (m, 2H), 7.33 (m, 3Н), 7.18 (m, 2H), 5.32 (t, 1Н), 4.55 (d, 2H), 4.27 (s, 2H), 3.95 (s, 2H), 3.67 (s, 3Н), 2.50 (s, 3Н); N1-(4-метилфенил)-2(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфанил)ацетамид 2.1 {3} получен с выходом 71%, т.пл.295-296°С, 1Н NMR (DMSO), δ: 10.29 (br.s, 1Н), 8.28 (d, 2H), 8.13 (s, 1Н), 7.49 (d, 2H), 7.10 (d, 2H), 6.84 (d, 2H), 5.24 (m, 1Н), 4.55 (d, 2H), 4.28 (s, 2H), 3.92 (s, 2H), 3.78 (s, 3Н), 2.48 (s, 3Н), 2.21 (s, 3Н); N1-(2-метоксифенил)-2-(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфанил)ацетамид 2.1 {4} получен с выходом 66%, т.пл.277-278°С, 1Н NMR (DMSO), δ: 9.51 (s, 1Н), 8.33 (d, 2H), 8.13 (s, 1Н), 8.02 (d, 1Н), 6.98 (m, 3Н), 6.87 (d, 2H), 5.30 (t, 1Н), 4.54 (d, 2H), 4.35 (s, 2H), 3.92 (s, 2H), 3.78 (s, 3Н), 3.66 (s, 3Н), 2.50 (s, 3Н);
N1-(4-фторфенил)-2-(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5Н-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфанил)ацетамид 2.1 {5} получен с выходом 71%, т.пл.>300°С, 1Н NMR (DMSO), δ: 10.51 (s, 1Н), 8.27 (d, 2H), 8.14 (s, 1Н), 7.64 (m, 2H), 7.14 (t, 2H), 6.83 (d, 2H), 5.30 (t, 1Н), 4.55 (d, 2H), 4.28 (s, 2H), 3.92 (s, 2H), 3.77 (s, 3H), 2.48 (s, 3Н).
Пример 6. Комбинаторная библиотека 4-сульфинилзамещенных 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидинов 2.2 {1-5}. Параллельный синтез комбинаторной библиотеки проводили в синтезаторе "CombiSyn-012-3000". В каждый из 5 реакторов синтезатора загружали по 20 мл бензола, по 10 ммоль соответствующего 4-сульфанилзамещенного 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидина и по 11 ммоль м-хлорпероксибензойной кислоты. Реакционные массы нагревали до 60°С и выдерживали при этой температуре и при перемешивании в течение 60 мин. Полученные смеси охлаждали, добавляли водный раствор гидрокарбоната натрия, выпавшие осадки отфильтровывали, промывали на фильтре водой (3 по 50 мл), этанолом (2 по 25 мл) и кристаллизовали из смеси этанол - диметилформамид. Получали комбинаторную библиотеку, включающую 5 соединений общей формулы 2.2, в том числе:
N1-(2-метоксифенил)-2-(6-гидроксиметил-9-метил-2-фенил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфинил)ацетамид 2.1 {1} получен с выходом 82%, т.пл.288°С (разл.), 1H NMR (DMSO), δ: 9.55 (s, 1Н), 8.38 (d, 2H), 8.15 (s, 1H), 8.00 (d, 1Н), 7.47 (m, 3H), 7.00 (dd, 2H), 6.84 (m, 1Н), 5.31 (t, 1Н), 4.55 (d, 2H), 4.37 (s, 2H), 3.95 (s, 2H), 3.65 (s, 3H), 2.48 (s, 3H); N1-(3-метоксифенил)-2-(6-гидроксиметил-9-метил-2-фенил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфинил)ацетамид 2.2{2} получен с выходом 91%, т.пл.275°С (разд.), 1Н NMR (DMSO), δ: 9.98 (s, 1Н), 8.32 (d, 2H), 8.14 (s, 1Н), 7.46 (m, 2H), 7.33 (m, 3H), 7.18 (m, 2H), 5.32 (t, 1Н), 4.55 (d, 2H), 4.27 (s, 2H), 3.95 (s, 2H), 3.67 (s, 3H), 2.50 (s, 3H); N1-(4-метилфенил)-2-(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфинил)ацетамид 2.2 {3} получен с выходом 92%, т.пл.273°С (разл.), 1Н NMR (DMSO), δ: 10.29 (br.s, 1Н), 8.28 (d, 2H), 8.13 (s, 1Н), 7.49 (d, 2H), 7.10 (d, 2H), 6.84 (d, 2H), 5.24 (m, 1Н), 4.55 (d, 2H), 4.28 (s, 2H), 3.92 (s, 2H), 3.78 (s, 3H), 2.48 (s, 3H), 2.21 (s, 3H); N1-(2-метоксифенил)-2-(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфинил)ацетамид 2.2 {4} получен с выходом 85%, т.пл.275-277°С, 1Н NMR (DMSO), δ: 9.51 (s, 1Н), 8.33 (d, 2H), 8.13 (s, 1Н), 8.02 (d, 1Н), 6.98 (m, 3H), 6.87 (d, 2H), 5.30 (t, 1Н), 4.54 (d, 2H), 4.35 (s, 2H), 3.92 (s, 2H), 3.78 (s, 3H), 3.66 (s, 3H), 2.50 (s, 3H);
N1-(4-фторфенил)-2-(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфинил)ацетамид 2.2 {5} получен с выходом 90%, т.пл.299°С, 1Н NMR (DMSO), δ: 10.51 (s, 1Н), 8.27 (d, 2H), 8.14 (s, 1Н), 7.64 (m, 2H), 7.14 (t, 2H), 6.83 (d, 2H), 5.30 (t, 1Н), 4.55 (d, 2H), 4.28 (s, 2H), 3.92 (s, 2H), 3.77 (s, 3H), 2.48 (s, 3H).
Пример 7. Комбинаторная библиотека 4-сульфонилзамещенных 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидинов 2.3 {1-5}. Параллельный синтез комбинаторной библиотеки проводили в синтезаторе "CombiSyn-012-3000". В каждый из 5 реакторов синтезатора загружали по 50 мл ледяной уксусной кислоты и по 10 ммоль соответствующего 4-сульфанилзамещенного 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидина. В каждый из реакторов в один прием вносили по 50 ммоль пергидроля в 20 мл ледяной уксусной кислоты и нагревали при перемешивании до 70°С. Содержимое реакторов выливали в 300 мл холодной воды, избыток перекиси водорода разлагали слабым раствором перманганата калия.
Полученные растворы экстрагировали хлороформом (2×50 мл), объединенные экстракты высушивали, упаривали под вакуумом и кристаллизовали из смеси этанол - диметилформамид. Получали комбинаторную библиотеку, включающую 5 соединений общей формулы 2.3, в том числе:
N1-(2-метоксифенил)-2-(6-гидроксиметил-9-метил-2-фенил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфонил)ацетамид 2.3 {1} получен с выходом 84%, т.пл.290°С (разл.), 1Н NMR (DMSO), δ: 9.57 (s, 1Н), 8.38 (d, 2H), 8.17 (s, 1H), 8.04 (d, 1Н), 7.46 (m, 3Н), 6.95 (d, 2H), 6.83 (m, 1Н), 5.32 (t, 1Н), 4.57 (d, 2H), 4.37 (s, 2H), 4.10 (d, 1Н, J=5 Hz) 3.96 (d, 1Н, J=5 Hz), 3.65 (s, 3Н), 2.48 (s, 3Н); N1-(3-метоксифенил)-2-(6-гидроксиметил-9-метил-2-фенил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфонил)ацетамид 2.3 {2} получен с выходом 92%, т.пл.282°С (разл.), 1Н NMR (DMSO), δ: 10.00 (s, 1Н), 8.34 (d, 2H), 8.14 (s, 1Н), 7.46 (m, 2H), 7.36 (m, 3Н), 7.18 (m, 2H), 5.33 (t, 1Н), 4.55 (d, 2H), 4.27 (s, 2H), 4.22 (d, 1Н, J=7 Hz) 3.95 (d, 1Н, J=7 Hz), 3.65 (s, 3Н), 2.50 (s, 3Н); N1-(4-метилфенил)-2-(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфонил)ацетамид 2.3 {3} получен с выходом 90%, т.пл.301°С (разл.), 1Н NMR (DMSO), δ: 10.26 (br.s, 1Н), 8.27 (d, 2H), 8.13 (s, 1Н), 7.49 (d, 2H), 7.10 (d, 2H), 6.85 (d, 2H), 5.24 (m, 1Н), 4.58 (d, 2H), 4.28 (s, 2H), 4.18 (d, 1Н, J=6 Hz) 3.95 (d, 1Н, J=6 Hz), 3.78 (s, 3Н), 2.47 (s, 3Н), 2.21 (s, 3Н); N1-(2-метоксифенил)-2-(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфонил)ацетамид 2.3 {4} получен с выходом 91%, т.пл.275-277°С (разл.), 1Н NMR (DMSO), δ: 9.53 (s, 1Н), 8.36 (d, 2H), 8.13 (s, 1Н), 8.02 (d, 1Н), 6.99 (m, 3Н), 6.83 (d, 2H), 5.32 (t, 1Н), 4.57 (d, 2H), 4.35 (s, 2H), 4.15 (d, 1Н, J=6 Hz) 3.90 (d, 1Н, J=6 Hz), 3.80 (s, 3Н), 3.66 (s, 3Н), 2.50 (s, 3Н); N1-(4-фторфенил)-2-(6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-илсульфонил)ацетамид 2.3 {5} получен с выходом 93%, т.пл.>300°С, 1Н NMR (DMSO), δ: 10.50 (s, 1Н), 8.25 (d, 2H), 8.18 (s, 1Н), 7.62 (m, 2H), 7.15 (t, 2H), 6.87 (d, 2H), 5.31 (t, 1Н), 4.54 (d, 2H), 4.25 (s, 2H), 4.20 (d, 1Н, J=7 Hz) 3.93 (d, 1Н, J=7 Hz), 3.77 (s, 3Н), 2.48 (s, 3Н).
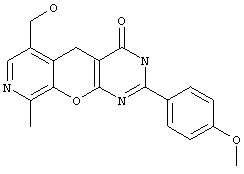
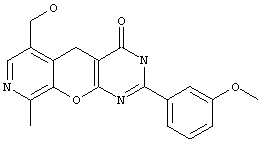
Пример 8. Комбинаторная библиотека 4-аминозамещенных 6-гидроксиметил-9-метил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидинов 2.4 {1-5}. Параллельный синтез комбинаторной библиотеки проводили в синтезаторе "CombiSyn-012-3000". В каждый из 5 реакторов синтезатора загружали по 20 мл спиртового раствора NaOH, по 10 ммоль соответствующего 2-замещенного-6-гидроксиметил-9-метил-1-3,5-дигидро-4H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин-4-тиона и по 25 ммоль соответствующего амина. Реакционные смеси кипятили с обратным холодильником в течение 12 часов и охлаждали, осадок отфильтровывали, промывали водой (2×30 мл) и кристаллизовали из диметилформамида. Получали комбинаторную библиотеку, включающую 5 соединений общей формулы 2.4, в том числе: 4-[N-(2-метоксифенил)амино]-6-гидроксиметил-9-метил-2-фенил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин 2.4 {1} получен с выходом 65%, т.пл.>300°С, 1Н NMR (DMSO), δ: 9,61 (s, 1Н), 8.38 (d, 2H), 8.13 (s, 1Н), 8.00 (d, 1Н), 7.39 (m, 3H), 7.02 (dd, 2H), 6.82 (m, 1Н), 5.31 (t, 1Н), 4.54 (d, 2H), 4.37 (s, 2H), 3.65 (s. 3H). 2.48 (s, 3H); 4-(N-(3-метоксифенил)амино]-6-гидроксиметил-9-метил-2-фенил-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин 2.4{2} получен с выходом 70%, т.пл.>300°С, 1Н NMR (DMSO), δ: 10,10 (s, 1Н), 8.32 (d, 2H), 8.14 (s, 1Н), 7.41 (m, 2H), 7.32 (m, 3H), 7.18 (m, 2H), 5.33 (t, 1Н), 4.56 (d, 2H), 4.27 (s, 2H), 3.67 (s, 3H), 2.49 (s, 3H);
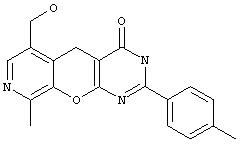
4-[N-(4-метилфенил)амино]-6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин 2.4 {3} получен с выходом 75%, т.пл.>300°С, 1Н NMR (DMSO), δ: 10.10 (s, 1Н), 8.28 (d, 2H), 8.13 (s, 1Н), 7.49 (d, 2H), 7.10 (d, 2H), 6.84 (d, 2H), 5.24 (m, 1Н), 4.55 (d, 2H), 4.28 (s, 2H), 3.78 (s, 3H), 2.48 (s, 3H), 2.21 (s, 3H); 4-[N-(4-метоксифенил)амино]-6-гидроксиметил-9-метил-2-(2-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин 2.4 {4} получен с выходом 63%, т.пл.290°С, 1Н NMR (DMSO), δ: 9.60 (s, 1Н), 8.31 (d, 2H), 8.13 (s, 1Н), 7.98 (d, 1Н), 7.00 (m, 3H), 6.87 (d, 2H), 5.30 (t, 1Н), 4.54 (d, 2H), 4.33 (s, 2H), 3.78 (s, 3H), 3.66 (s, 3H), 2.50 (s, 3H); 4-[N-(4-фторфенил)амино]-6-гидроксиметил-9-метил-2-(4-метоксифенил)-5H-пиридо[4',3':5,6]пирано[2,3-d]пиримидин 2.4 {5} получен с выходом 80%, т.пл.>300°С, 1Н NMR (DMSO), δ: 10.51 (s, 1Н), 8.24 (d, 2H), 8.10 (s, 1Н), 7.61 (m, 2H), 7.11 (t, 2H), 6.84 (d, 2H), 5.31 (t, 1Н), 4.56 (d, 2H), 4.24 (s, 2H), 3.73 (s, 3H), 2.47 (s, 3H).
Пример 9. Влияние на апоптоз соединений, производных 6-гидроксиметил-9-метил-5H-пиридо(4',3':5,6]пирано[2,3-d]пиримидинов Соединения, принадлежащие к производным 6-гидроксиметил-9-метил-5H-пиридо [4',3':5,6]пирано[2,3-d)пиримидинов были испытаны на их способность индуцировать апоптоз в опухолевых клетках, вызывая их гибель. Индукция апоптоза проводилась путем обработки клеток соединением в течение 24-48 часов с последующим определением числа оставшихся в живых клеток с помощью флуоресцентного красителя резозурина, флуоресценция которого усиливается при восстановлении живыми клетками. Флуоресценцию измеряли с помощью микротарелочного регистратора (VICTOR2V, PerkinElmer) в 96-луночных тарелках. В таблице 1 приведены результаты такого тестирования для наиболее активных соединений.


Клетки T-47D (клеточная линия, полученная из опухоли молочной железы) высаживались в лунки 96-луночной тарелки на ночь. На следующее утро в каждую лунку добавлялись тестируемые вещества в концентрации 10 мкМ и тарелки оставлялись на 24-48 часов инкубации. По окончании инкубации в лунки добавляли резозурин и инкубировали в течение 2 часов, необходимых для образования флуоресциирующего продукта его восстановления. Флуоресценция в присутствии испытуемых веществ сравнивалась с контрольной, и процент ингибирования флуоресценции отражал степень клеточной гибели.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ 2Н-ПИРАНО[2,3-С]ПИРИДИНЫ, КОМБИНАТОРНАЯ И ФОКУСИРОВАННАЯ БИБЛИОТЕКИ | 2003 |
|
RU2261251C2 |
| 6-СУЛЬФАМОИЛХИНОЛИН-4-КАРБОНОВЫЕ КИСЛОТЫ, ИХ ПРОИЗВОДНЫЕ И КОМБИНАТОРНАЯ БИБЛИОТЕКА | 2003 |
|
RU2229475C1 |
| ЗАМЕЩЕННЫЕ [1.3]ОКСАЗОЛО[4,5-D]ПИРИДАЗИНЫ И КОМБИНАТОРНАЯ БИБЛИОТЕКА | 2003 |
|
RU2229478C1 |
| ЗАМЕЩЕННЫЕ 3-ОКСО-1,2,3,4-ТЕТРАГИДРОХИНОКСАЛИНЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2003 |
|
RU2251546C1 |
| ЗАМЕЩЕННЫЕ 1,2-ДИГИДРО[2,7]-НАФТИРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2243218C1 |
| 1-СУЛЬФОНИЛ-1,3-ДИГИДРОИНДОЛ-2-ОНЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2003 |
|
RU2259999C2 |
| 1-ОКСО-3-(1Н-ИНДОЛ-3-ИЛ)-1,2,3,4-ТЕТРАГИДРОИЗОХИНОЛИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, КОМБИНАТОРНАЯ БИБЛИОТЕКА И ФОКУСИРОВАННАЯ БИБЛИОТЕКА | 2006 |
|
RU2302417C1 |
| ЗАМЕЩЕННЫЕ 3,7-ДИАЗОБИЦИКЛО[3.3.1]НОНАНЫ, ФОКУСИРОВАННАЯ БИБЛИОТЕКА И КОМБИНАТОРНАЯ БИБЛИОТЕКА | 2003 |
|
RU2228934C1 |
| АЗАГЕТЕРОЦИКЛЫ, ВКЛЮЧАЮЩИЕ ФРАГМЕНТ ПИПЕРИДИН-2-ИЛА-, ФОКУСИРОВАННЫЕ БИБЛИОТЕКИ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2004 |
|
RU2259364C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ВКЛЮЧАЮЩИЕ 2-АМИНОПИРИДИН-3-СУЛЬФОНОВЫЙ ФРАГМЕНТ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФОКУСИРОВАННАЯ БИБЛИОТЕКА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2004 |
|
RU2263667C1 |
Данное изобретение относится к новым замещенным пиридо[4',3':5,6]пирано[2,3-d]пиримидинам общей формулы (1) или (2) или их фармацевтически приемлемым солям, N-оксидам или гидратам, обладающим физиологически активными свойствами, в частности, проявляющим способность индуцировать апоптоз в опухолевых клетках, вызывая их гибель. В общей формуле (1) или (2):
X представляет атом серы или кислорода; Y представляет атом серы, группу SO, группу SO2, группу NH или группу NR6; R1 представляет арил, замещенный арил, гетарил; R2, R5 представляют атом водорода, алкил, аллил, замещенный бензил, CH2-C(O)R3, CH2-C(O)NR3R4, R3, R4, R6 представляют инертный заместитель. Изобретение также относится к новым комбинаторным библиотекам для поиска, соединений-лидеров и кандидатов в лекарственные соединения получаемых на основании скрининга комбинаторных библиотек. 2 н. и 7 з.п. ф-лы, 1 табл.
в которой:
Х представляет атом серы или кислорода;
Y представляет атом серы, группу SO, группу SO2, группу NH или группу NR6;
R1 представляет арил, замещенный арил, гетарил;
R2, R5 представляет атом водорода, алкил, аллил, замещенный бензил, CH2-C(O)R3, CH2-C(O)NR3R4;
R3, R4, R6 представляют инертный заместитель, или их фармацевтически приемлемую соль, N-оксиды или гидраты.
в которой R1 представляет арил, замещенный арил, гетарил.
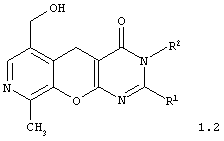
в которой R1 представляет арил, замещенный арил, гетарил;
R2 представляет атом водорода, алкил, аллил, замещенный бензил, CH2-C(O)R3, CH2-C(O)NR3R4;
R3, R4 представляют инертный заместитель.
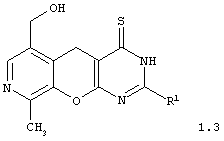
в которой R1 имеет вышеуказанное значение.
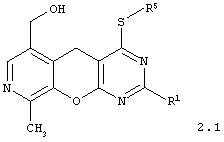
в которой R1 и R5 имеют вышеуказанное значение.
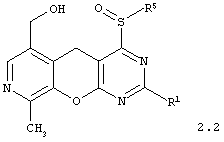
в которой R1 и R5 имеют вышеуказанное значение.
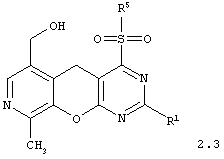
в которой R1 и R5 имеет вышеуказанное значение.
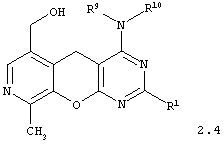
в которой R1 представляет арил, замещенный арил, гетарил;
R9 представляет атом водорода или инертный заместитель, R5 имеет вышеуказанные значения.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНТИОАЛКИЛЬНЫЕ ИЛИ АЛКИЛЭФИРНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИНГИБИРОВАНИЯ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИРУСОВ | 1996 |
|
RU2167155C2 |
| ЗАМЕЩЕННЫЕ 1,2-ДИГИДРО-5-МОРФОЛИНО-4Н-ПИРАНО 4′,3′ ПИРИДО [2,3-B] ТИЕНО [3,2-D] ПИРИМИДИН-8(9Н)-ОН ИЛИ [9,11] ОКСАЗИН-8-ОН, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНЫМ ДЕЙСТВИЕМ | 1985 |
|
SU1282510A1 |
| 5-ЗАМЕЩЕННЫЕ 1-АМИНО -8,9-ДИГИДРО -8,8-ДИМЕТИЛ-3,6Н- ПИРАЗОЛО [3,4-B] ПИРАНО[[4′,3′-d]] ПИРИДИНА ИЛИ ИХ ГИДРОХЛОРИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 1988 |
|
SU1540240A1 |
Авторы
Даты
2006-02-10—Публикация
2004-12-30—Подача