Настоящее изобретение относится к способу детекции и количественного определения в различных биологических средах нуклеиновых кислот аденовирусов путем измерения в реальное время амплификации цепи с помощью полимеразы (полимеразная цепная реакция, PCR). Объектом настоящего изобретения, кроме того, являются, олигонуклеотиды для осуществления этого способа.
Генная терапия в настоящее время получила значительное развитие. Аденовирусы, которые по своей природе ответственны за обычно доброкачественные инфекции, фигурируют среди векторов, используемых вследствие их многочисленных преимуществ.
Расширение клинического внедрения этих аденовирусных векторов в поздних фазах II и III в целях регистрации и разрешения выпуска в продажу вызывает необходимость разработки, узаконения и использования специфических и чувствительных методов, позволяющих осуществлять измерение количественного и качественного биораспределения аденовекторов в различных биологических компартментах и детекцию возникновения при незначительном количестве вирусов инфекции за счет вызывающих контаминацию загрязнителей продукции аденовекторов (в особенности рекомбинантных аденовекторов, компетентных для репликации). Кроме того, необходимо детектировать интеркуррентные аденовирусные инфекции, вызываемые дикими вирусами различных серотипов, ответственными за большинство случаев этих естественных инфекций, являются ли эти инфекции клинически флоридными или латентными, и детектировать вирусологическую кинетику этих самопроизвольных инфекций и клиническую значимость различных состояний в общей популяции или у пациентов группы риска (страдающие раковыми заболеваниями, подвергнутые трансплантации, с иммунодепрессией или с подавленным иммунитетом пациенты и т.д.).
Присутствие аденовируса в пермиссивной клеточной культуре, согласно используемым вплоть до настоящего времени обычным методам детекции, визуализируют по цитопатическому эффекту в клеточном слое. Для доказательства того, что этот цитопатический эффект вызван аденовирусом, по методу твердофазного иммуноферментного анализа (ELISA) детектируют специфический антиген аденовируса.
Методы амплификации выделенных из аденовирусов нуклеиновых кислот путем PCR, кроме того, уже описаны. Так, в заявке на патент Японии JP 07327700 описывается метод типа PCR, согласно которому амплифицируют части ДНК, кодирующей гексон, аденовирусный капсидный белок. Продукты амплификации подвергают дот-блоттингу, затем гибридизируют со специфическими для каждых серотипов зондами. Этот метод, следовательно, предназначен для идентификации подгрупп и серотипов, но не для детекции и количественного определения совокупности аденовирусов, присутствующих в образце. Кроме того, чувствительность этого метода является незначительной и, следовательно, он мало приспособлен для точных количественных определений, например, требуемых во время наблюдения пациентов, к которым применялась генная терапия.
Pring-Akerblom и др. (Journal of Medical Virology, 58, 87-92 (1999)) также описали метод, согласно которому используют шесть пар праймеров в одной и той же полимеразной цепной реакции (так называемая мультиплетная PCR). Идентификацию подгруппы осуществляют, помещая продукты PCR на гель для электрофореза, затем определяя размер продуктов PCR.
Crawford-Miksza и др. (Journal of Clinical Microbiology, 37, 1107-1112 (1999)) описали PCR гексона, специфически детектирующую аденовирусы типов 4, 7 и 21, при использовании консенсусных праймеров, включающих инозин в качестве нуклеозида в случае межконъюгации в некотором вариабельном положении. В этом документе описаны девять различных праймеров.
Согласно этим методам предшествующего уровня техники осуществляют стандартную PCR и классический метод анализа обычно путем гель-электрофореза с гибридизацией или без нее.
Ни один из этих методов не позволяет одновременно детектировать в большом масштабе аденовирусы, происходящие из большинства известных серотипов, и количественно определять вирусные "нагрузки" с чувствительностью в точном соответствии с потребностями генной терапии.
Целью настоящего изобретения, следовательно, является решение этих проблем путем разработки чувствительного и позволяющего детектировать большинство серотипов аденовирусов способа.
Заявители неожиданно обнаружили, что таких преимуществ достигают путем амплификации в реальное время определенной последовательности ДНК, кодирующей гексон, с помощью обладающих ограниченной дегенерацией праймеров и выявления продукта амплификации с помощью недегенерированного зонда.
Настоящее изобретение прежде всего относится к способу детекции и/или количественного определения нуклеиновых кислот аденовирусов в биологическом образце, согласно которому:
- нуклеотидную последовательность аденовируса амплифицируют путем полимеразной цепной реакции (PCR) в реальное время с помощью пары дегенерированных смыслового и антисмыслового праймеров, образованных смесями олигонуклеотидов, обладающих гомологией по меньшей мере на 80% с последовательностью от нуклеотида 21000 до нуклеотида 22000 последовательности аденовируса типа 5, соответствующей идентифицированной последовательности №4, или с комплементарной к ней последовательностью; и
- продукт реакции амплификации детектируют с помощью недегенерированного зонда, образованного одним или несколькими олигонуклеогидами, обладающими гомологией по меньшей мере на 80% с последовательностью от нуклеотида 21000 до нуклеотида 22000 последовательности аденовируса типа 5, соответствующей идентифицированной последовательности №4, или с комплементарной к ней последовательностью, на протяжении числа циклов, достаточного для возможности получения измеримого количества продукта амплификации.
Под выражением "полимеразная цепная реакция (PCR) в реальное время" понимают любой способ амплификации, позволяющий следить за развитием осуществляемой реакции амплификации.
Последовательности праймеров и/или зонда преимущественно обладают гомологией по меньшей мере на 80% с последовательностью от нуклеотида 540 до нуклеотида 780 идентифицированной последовательности №4 или с комплементарной к ней последовательностью. Оба праймера выбирают, соответственно, из смысловой и антисмысловой нитей таким образом, чтобы можно было осуществлять амплификацию фрагмента ДНК. Что касается зонда, то его выбирают так, чтобы он гибридизировался с полученным в результате реакции амплификации фрагментом ДНК. Праймеры PCR согласно настоящему изобретению, используемые для амплификации аденовирусной нуклеиновой кислоты-мишени из образца, находятся в постоянной области гена гексона человеческих аденовирусов, а сайт гибридизации зонда согласно настоящему изобретению находится между обоими праймерами. Аденовирусы предпочтительно имеют человеческий тропизм.
Предпочтительно, вышеуказанные олигонуклеотиды включают по меньшей мере 15 нуклеотидов и зонд имеет теоретическую температуру плавления Тm выше примерно на 10°C±0,5 теоретических Тm праймеров.
Такой способ в продолжении текста сокращенно называют метод PCR гексона. Он включает по существу повторение цикла, состоящего из следующих стадий:
- отделение амплифицируемых нитей путем нагревания экстракта ДНК из образца;
- гибридизация зонда;
- гибридизация с праймерами, такими, как указанные выше;
и
- элонгация с помощью полимеразы.
Его предпочтительно осуществляют с помощью нижеописанных смыслового и антисмыслового праймеров НЕХ1 и НЕХ2 и продукт амплификации предпочтительно гибридизируют с нижеописанным зондом HEX.
Объектом настоящего изобретения является, в частности, олигонуклеотид, отличающийся тем, что он включает по меньшей мере 10 последовательных нуклеотидов нижеследующей идентифицированной последовательности №1 или последовательности, обладающей гомологией последовательности по меньшей мере на 80%, предпочтительно на 90% и еще более предпочтительно на 95%, с вышеуказанной последовательностью:
5'-YCC CAT GGA YGA GCC CAC MCT-3',
в которой Y означает С или Т и М означает А или С.
Вышеуказанный олигонуклеотид предпочтительно включает 15-30 нуклеотидов.
Кроме того, объектом настоящего изобретения является смысловой праймер НЕХ1, образованный смесью отвечающих этому определению олигонуклеотидов. Так, праймер НЕХ1 имеет три дегенерации в положениях 1, 10 и 19, позволяющие охватить большинство серотипов.
Объектом настоящего изобретения является также второй олигонуклеотид, отличающийся тем, что он включает по меньшей мере 10 последовательных нуклеотидов нижеследующей идентифицированной последовательности №2 или последовательности, обладающей гомологией последовательности по меньшей мере на 80%, предпочтительно на 90% и еще более предпочтительно на 95%, с вышеуказанной последовательностью:
5'-GAG AAS GGB GTG CGC AGG TAS AC-3',
в которой S означает G или С и В означает С, G или Т.
Вышеуказанный олигонуклеотид предпочтительно включает 15-30 нуклеотидов.
Объектом настоящего изобретения, кроме того, является антисмысловой праймер НЕХ2, образованный смесью отвечающих этому определению олигонуклеотидов. Так, праймер НЕХ2 имеет три дегенерации в положениях 6, 9 и 21, позволяющие охватить большинство секвенированных серотипов.
Вышеуказанные праймеры предпочтительно включают по меньшей мере два олигонуклеотида и еще более предпочтительно три или четыре олигонуклеотида.
Положениями идентифицированных последовательностей №1 и №2, локализованными в части 3' открытой рамки считывания, кодирующей белок гексон, при использовании в качестве эталона полной последовательности аденовируса типа 5 (№ депонирования М73260), являются соответственно 21565 (НЕХ1) и 21656 (НЕХ2). Они соответствуют положениям 21048 и 21139 последовательности Ad5CMVp53 (длина 35308 пар оснований).
Заявители обнаружили, что концентрация праймеров является критическим параметром PCR в реальное время. Следовательно, дегенерация праймеров НЕХ1 и НЕХ2 ограничена.
Объектом настоящего изобретения, кроме того, является третий олигонуклеотид, отличающийся тем, что он включает по меньшей мере 10 последовательных нуклеотидов нижеследующей идентифицированной последовательности №3 или последовательности, обладающей гомологией последовательности по меньшей мере на 80%, предпочтительно на 90% и еще более предпочтительно на 95% с вышеуказанной последовательностью или с последовательностью, комплементарной к вышеуказанной последовательности:
5'-САС CAG ССА САС CGC GGC GTC АТС GA-3'.
Вышеуказанный олигонуклеотид предпочтительно включает 20-35 нуклеотидов.
Кроме того, объектом настоящего изобретения является зонд HEX, включающий по меньшей мере один олигонуклеотид, имеющий эту последовательность.
Изобретение, кроме того, относится к олигонуклеотидам, имеющим последовательность, комплементарную к последовательностям вышеуказанных олигонуклеотидов.
Согласно предпочтительному варианту осуществления настоящего изобретения, зонд включает молекулу-индикатор или систему молекул в качестве индикатора. Вышеуказанная система-индикатор образована предпочтительно красителем-репортером и красителем-гасителем флуоресценции, соответственно фиксированными на концах 5' и 3' зонда. Согласно предпочтительному варианту осуществления, система-индикатор образована парой "репортер/гаситель", представляемой 6-карбоксифлуоресцеином (FAM) и 6-карбокситетраметилродамином (TAMRA), соответственно фиксированными на концах 5' и 3' зонда. Один из праймеров может быть маркирован таким образом и может выполнять роль зонда.
Особенно предпочтительный зонд согласно изобретению образован:
5' FAM - САС CAG ССА САС CGC GGC GTC АТС GA - TAMRA 3'.
Такой системой-индикатором также может быть так называемая система-индикатор "наращивания" (tailing). Термин "наращивание" состоит во включении в один из концов зонда хвоста, который может автоконъюгироваться. Эту автоконъюгацию выявляют с помощью маркера, который специфически фиксируется на последовательности в этой конфигурации. В присутствии мишени происходит деконъюгация и посылается сигнал. В отсутствие мишени сигнал не посылается. Также могут быть использованы другие системы-индикаторы.
Как вариант, смысловой и антисмысловой праймеры могут включать молекулу-индикатор или систему молекул в качестве индикатора.
Продукт PCR, получаемый по способу, составляющему объект настоящего изобретения, при использовании праймеров последовательностей №1 и №2, предпочтительно имеет величину 114 пар оснований и согласно газовой хроматографии составляет около 58,8%.
Предпочтительно используемой согласно настоящему изобретению полимеразой является Taq-полимераза, однако она может быть любым другим ферментом, обладающим полимеразной активностью и используемым в рабочих условиях PCR.
Объектом настоящего изобретения является также набор реагентов для реакции амплификации типа PCR в реальное время для детекции аденовирусов отличающийся тем, что он включает пару смыслового и антисмыслового праймеров и зонд, такие, как описанные выше. Вышеуказанный набор преимущественно включает, кроме того, два отрицательных контроля и два положительных контроля.
Кроме того, объектом настоящего изобретения является метод PCR для детекции и/или количественного определения аденовируса в анализируемом образце, который может его содержать, отличающийся тем, что он состоит в осуществлении полимеразной цепной реакции в реальное время при использовании набора согласно изобретению.
Согласно особенно предпочтительному аспекту предлагаемого в изобретении метода, вышеуказанные два положительных контроля экстрагируют параллельно с серией анализируемых образцов и они состоят из стандарта, образованного очищенным и титрованным раствором аденовируса, и калибровочного маркера, адаптированного к типу анализируемого образца.
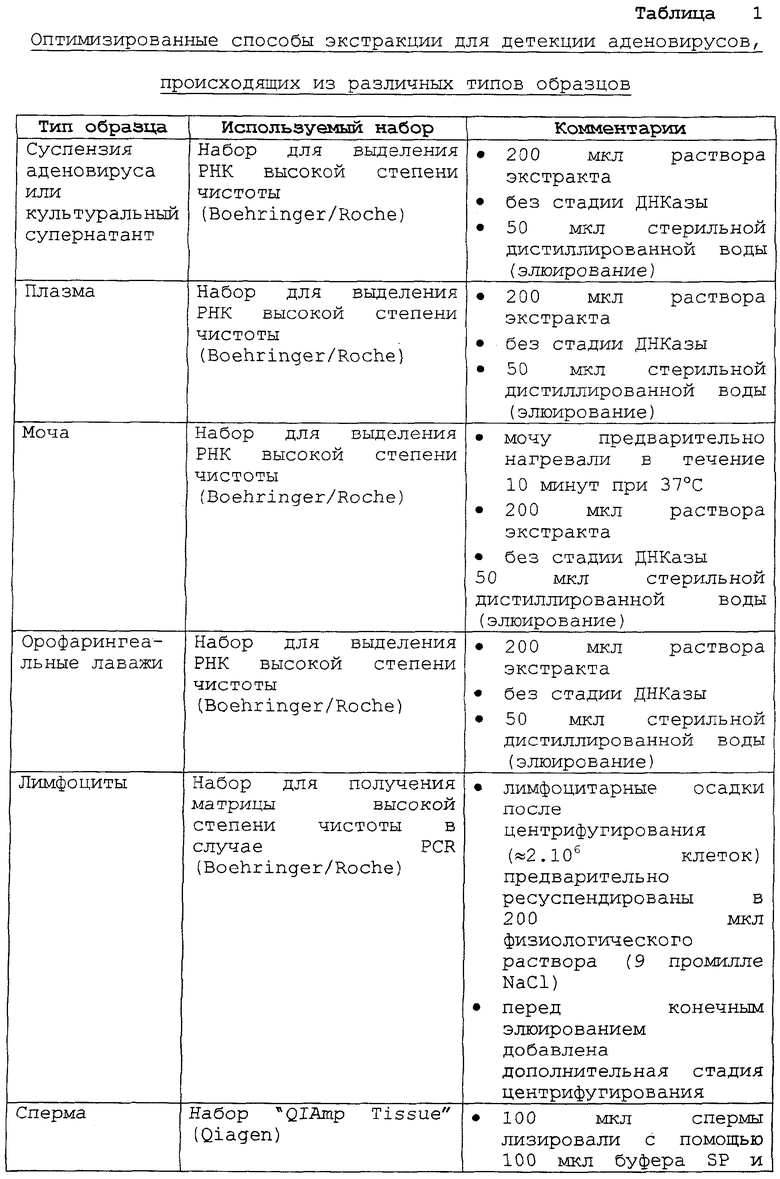
Метод согласно изобретению находит преимущественное применение для детекции и/или количественного определения аденовирусов, присутствующих в образцах типа суспензии или супернатанта культуры, плазмы, мочи, орофарингеальных лаважей, лимфоцитов, спермы, опухолевых или нет биопсий, ректальных мазков на ватных тампонах, фекалий, асцитов.
Настоящее изобретение также относится к способу селекции аденовирусов, пригодных в качестве векторов-"кандидатов", путем оценки репликационных характеристик аденовирусов при применении способа детекции и/или количественного определения согласно изобретению при наблюдении за кинетикой размножения аденовирусов.
Настоящее изобретение также относится к способу диагностики серотипа аденовирусов, присутствующих в тестируемом образце, состоящему в использовании способа согласно изобретению, с последующим секвенированием полученного продукта PCR.
Нуклеотидные последовательности различных серотипов, кодирующие белок гексон, были получены из банков данных или были секвенированы. Серотипы Ad3, Ad7, Ad12, Ad14, Ad16 и Ad21 в положении 9 зонда HEX имеют остаток А. Серотипы Ad5, Ad1, Ad2, Ad6, Ad13, Ad40 и Ad48 в том же самом положении имеют остаток G, тогда как серотипы Ad4 и Ad41 имеют остаток С. Была выбрана имеющая остаток А последовательность, так как последовательность типа G, в противоположность последовательностям типа А или типа С, имеет вторичную структуру, обладающую очень высокой стабильностью (DG=-7,1 ккал/моль), способную нарушать ее гибридизацию, и/или ее смещение, и/или ее деградацию во время полимеризации. С другой стороны, последовательность типа А является более часто встречающейся, чем последовательность типа С.
Межконъюгации А/С (Ad5CMVp53 и серотипы 5, 1, 2, 6, 13, 40 и 48) или A/G (серотипы 4 и 41) проявляются в виде уменьшения ΔRn без значительной модификации Ct (ΔRn представляет собой разницу флуоресценции, детектируемую между измеренной флуоресценцией фонового шума и определяемой флуоресценцией тестируемого образца; Ct определяют как число фракционных циклов, при котором генерируемая расщеплением зонда флуоресценция значительно превышает - обычно в 10 раз - фоновый шум).
Серотипы Ad5, Ad4, Ad12 и Ad14 и Ad5CMVp55 имеют дополнительные различия в положении
- 5 для серотипа Ad5 и Ad5CMVp53;
- 24 для серотипов Ad4 и Ad12;
- 3, 12 и 19 для серотипа Ad14.
Несмотря на эти различия неожиданно можно детектировать нуклеотидные последовательности, кодирующие белки гексоны этих серотипов.
Одним из преимуществ настоящего способа детекции и/или количественного определения человеческих аденовирусов по сравнению со способами, описанными в уровне техники, является замечательная чувствительность детекции с порогом детекции 10 частиц или 1 pfu (бляшкообразующая единица) путем реакции PCR.
Другое преимущество заключается в универсальности метода, поскольку могут быть детектированы и количественно определены 17 различных серотипов человеческих аденовирусов, типичных для совокупности подгрупп A-F.
Кроме того, анализ продуктов PCR осуществляют непосредственно по окончании циклов PCR путем считывания получаемой во время циклов флуоресценции. Следовательно, нет необходимости работать с продуктами PCR, которые подвергаются опасности загрязнения для последующих анализов.
Более того, запись необработанных данных производится полностью. В самом деле, каждый анализ PCR сохраняют в информационных файлах, которые можно хранить в архиве в течение длительного периода времени без повреждения. Необработанные данные могут быть в любой момент повторно проанализированы, если меняются критерии анализов. Сохранение необработанных данных является необходимым, когда нужно работать в соответствии с нормами пригодной лабораторной практики.
Кроме того, количественное определение числа исходных мишеней в реакции является очень надежным и воспроизводимым. Детекцию продукта PCR осуществляют во время циклов PCR с помощью флуоресцентного зонда. Это необходимо для детекции продукта PCR и осуществляется во время экспоненциальной фазы PCR, а не в конечной точке; этот принцип детекции, следовательно, является более чувствительным и более специфическим.
Другое преимущество состоит в том, что избегают неспецифических амплификаций благодаря принципу "горячий старт", причем PCR в реальное время осуществляют в присутствии термостабильной ДНК-полимеразы, активирующейся при первой денатурации.
Для осуществления настоящего изобретения, в случае необходимости, можно руководствоваться общим обзором способов PCR и, в частности пояснительной инструкцией, озаглавленной "Quantitation of DNA/RNA Using Real-Time PCR Detection", опубликованной фирмой Perkin Elmer Applied Biosystems (1999), и "PCR Protocols" (Academic Press, Нью-Йорк, 1989).
Настоящее изобретение поясняется не ограничивающими его объема охраны примерами и путем ссылки на прилагаемый чертеж, на котором представлена стандартная кривая метода PCR гексона согласно изобретению.
Материал и методы
Коллекция аденовирусов, культуральных супернатантов и клеточных линий.
- Большинство культуральных супернатантов различных серотипов человеческих аденовирусов происходит из лаборатории профессора Freymuth (Отдел вирусологии, CHU, Caen).
- Некоторые титрованные аденовирусы дикого типа (Ad2 и Ad5) происходят из UMR №1592 (Emmanuelle Vigne, Unité de Vectorologie et de Transfert de Genes, Институт Gustave-Roussy).
- Титрованный Ad5CMVp53 происходит из Unité de Production de RPR Gencell, Vitry (Didier Faucher). Титры представлены в виде числа pfu (бляшкообразующая единица). Эта единица будет оставаться ссылочной единицей для количественного определения.
- Клеточная линия 293 происходит из АТСС (CRL 1573).
- Клеточная линия А549 (АТСС: CCL 185) любезно представлена Е. Vigne и A. Fallourd, RPR Gencell.
- Клеточная линия MRC5 происходит от bioMerieux (номер по каталогу 84002, Франция).
- Клинические образцы:
- Клинические образцы (плазма, моча, орофарингеальные лаважи, фекалии) происходят либо от здоровых добровольцев, либо от пациентов, госпитализированных в Институте Gustave-Roussy.
- Некоторые плазмы происходят из Центра переливания крови либо за счет покупки мешка, происходящего от примерно 200 доноров, либо мешков, которые не могут быть больше использованы для медицинского применения.
Условия хранения:
- Коллекции аденовирусов и клинических образцов были перенесены в сухой лед и, начиная с момента получения, хранились при температуре -80°С.
- Различные стадии получения, разделения на аликвоты и анализа требуют некоторого числа замораживании и размораживаний (аденовирусов или клинических образцов). Для сохранения тех же условий контроля (стандарт и калибровочные маркеры) подвергают такому же числу замораживании и размораживаний, как и диагностируемые клинические образцы.
Контроли и стандарт:
- Имеются два типа отрицательных контролей:
Первый отрицательный контроль PCR, или NTC ("нетемплатный контроль"), который образован буфером PCR с дистиллированной водой (без мишени). Значение Ct должно составлять 50, так как осуществляют 50 циклов PCR.
Второй тип отрицательного контроля представляет собой отрицательный контроль экстракции, который создают с момента стадии экстракции. Обычно он образован 200 мкл физиологического раствора и получен параллельно с серией экстракций (обычно 1 на 10). Значение Ct также должно составлять 50.
- Имеются два типа положительных "контролей":
Стандарт, который образован очищенным и титрованным раствором аденовируса (≈5·105 pfu), экстрагирован параллельно с серией анализируемых образцов. Экстракт нуклеиновых кислот разводили (обычно последовательные разведения в 10 раз) для получения различных точек для стандарта с целью построения стандартной кривой (чертеж).
Вторым типом положительных контролей является калибровочный маркер. Существуют различные типы калибровочных маркеров в зависимости от типа диагностируемых образцов. Он образован 200 мкл наиболее близкой к образцу среды и известным количеством аденовируса, находящимся в среде серии стандарта (обычно 5·103 pfu). Средами, используемыми для получения калибровочных маркеров, являются физиологический раствор для орофарингеальных лаважей, "пул" плазмы от 200 здоровых доноров для плазм, моча здоровых субъектов для мочи и свежая культуральная среда для культуральных супернатантов. Эти калибровочные маркеры подтверждают правильность способа экстракции. Получаемая путем количественного определения величина по отношению к теоретически ожидаемой величине путем простого тройного правила позволит исправить конечное количественное определение, получаемое с тестируемыми образцами.
Устройство и количественное определение
Все реакции PCR проводили при использовании устройства ABI Prism 7700 (Perkin Elmer Applied Biosystem), которое детектирует сигнал с помощью флуоресцентного зонда (зонд TaqMan™) во время циклов PCR.
Система 7700 представляет собой термоблок для проведения реакций, где каждая лунка (n=96) связана с оптическим волокном, которое, в свою очередь, связано с лазером. Камера CDD собирает эмиссии флуоресценции приблизительно каждые 6 секунд для каждой лунки. При использовании пакета программ S.D.S. (Sequence Detector System™) анализируют данные флуоресценции и определяют число копий мишени в образце.
Количественное определение базировано на принципе PCR в реальное время ("real-time PCR"). В самом деле, продукт PCR характеризуют в момент цикла PCR, где амплификация определяется по деградации зонда, связанной с аккумуляцией продуктов PCR. Чем выше число первоначальных копий мишени, тем меньше нужно циклов PCR для детекции значительного повышения флуоресценции.
Число копий мишени образца определяли количественно путем измерения величины Ct и использования стандартной кривой (чертеж). Теоретически, если PCR протекает на 100%, нужно 3,22 цикла PCR (Ct) для десятикратного увеличения числа мишеней. Обычно фактор 10 числа мишеней дает различие величин Ct от 3,4 до 3,6.
Второй параметр (ΔRn) является важным для контроля подтверждения положительности сигнала PCR. ΔRn представляет собой разницу детектируемой флуоресценции между измеряемой флуоресценцией фонового шума (обычно измеряют между циклом 3 и циклом 15 PCR на всей совокупности планшета) и детектируемой флуоресценцией анализируемого образца.
ПРИМЕРЫ
Пример 1
Детекция аденовируса, происходящего из образца мочи
1.1. Приготовление образца тестируемой мочи
Все реагенты, используемые для этого приготовления, происходят из набора, называемого "Набор для выделения РНК высокой степени чистоты" ("High Pure RNA Isolation Kit") и выпускаемого фирмой Boehringer/Roche.
Для приготовления этого образца следует поступать согласно нижеприводимой методике:
К 200 мкл мочи, предварительно нагретым в течение 10 минут при температуре 37°С, так же как к каждому из контролей (объемом по 200 мкл), добавить 400 мкл буфера для лизиса.
Немедленно интенсивно перемешать. Инкубировать в течение 15 минут при комнатной температуре.
Каждую колонку поместить в пробирку емкостью 2,0 мл и все количество препарата внести в центр колонки. Центрифугировать в течение 1 минуты со скоростью 8000 оборотов в минуту (Эппендорф, 5417R) при температуре 20°С.
Поместить колонку во вторую пробирку емкостью 2,0 мл.
Добавить 500 мкл буфера для промывки I и центрифугировать в течение 1 минуты со скоростью 8000 оборотов в минуту (Эппендорф, 5417R) при температуре 20°С.
Поместить колонку в третью пробирку емкостью 2,0 мл.
Добавить 500. мкл буфера для промывки II и центрифугировать в течение 1 минуты со скоростью 8000 оборотов в минуту (Эппендорф, 5417R) при температуре 20°С.
Поместить колонку в четвертую пробирку емкостью 2,0 мл.
Добавить 200 мкл буфера для промывки II и центрифугировать в течение 3 минут со скоростью 14000 оборотов в минуту (Эппендорф, 5417R) при температуре 20°С.
Поместить колонку в пробирку Эппендорфа емкостью 1/5 мл (пятая пробирка) и идентифицировать пробирку Эппендорфа, в которой будет собираться конечный элюат экстракции нуклеиновых кислот.
Добавить 50 мкл предварительно нагретой дистиллированной воды.
Инкубировать в течение 3 минут при температуре 70°С (сухая баня).
Центрифугировать в течение 1 минуты со скоростью 8000 оборотов в минуту (Эппендорф, 5417R) при температуре 20°С.
Экстракты нуклеиновых кислот хранили при температуре 4°С вплоть до стадии PCR.
"Контроли" и "стандарт" приготовляли, как описано выше (раздел "Материал и методы").
Для приготовления других типов образцов следует обратиться к таблице, поясняющей оптимизированные способы экстракции для детекции аденовирусов, происходящих из различных типов образцов, в том числе образца согласно настоящему примеру.
1.2. Условия детекции по методу PCR гексона согласно изобретению
Концентрации совокупности реагентов, используемых в реакциях амплификации, в частности концентрации смыслового праймера "HEXl", антисмыслового праймера "HEX2'', зонда "HEX" и MgCl2 и других реагентов набора реагентов TaqMan™ PCR Core (Perkin-Elmer Applied Biosystems), представлены в таблице 2.
1.3. Результаты
Стандартная кривая для способа детекции с использованием PCR согласно изобретению представлена на чертеже.
Пример 2
Специфичность способа согласно изобретению
Одним из применений метода PCR гексона согласно изобретению является детектирование аденовирусов в культуральных супернатантах.
Согласно способам уровня техники, присутствие аденовируса в клеточной (пермиссивной) культуре классически визуализировали по цитопатическому эффекту в клеточном слое. Для доказательства того, что этот цитопатический эффект вызван аденовирусом, детектируют специфический антиген аденовируса (путем ELISA, например, номер по каталогу К6021, фирма Dako Diagnostic LTD, Denmark House, Англия).
Экстракты нуклеиновых кислот, происходящих из основных клеточных линий (Нер2, MRC5, 293 и А549, описанных выше в разделе "Материал и методы"), используемых для клеточной диагностики человеческих аденовирусов, тестировали для подтверждения отрицательности в случае PCR гексона согласно настоящему изобретению. Все оцененные экстракты ДНК оказались отрицательными, что свидетельствует о специфичности детекции.
Для метода PCR гексона согласно изобретению очень важно показать "универсальный" характер детекции с различными серотипами человеческих аденовирусов.
Были оценены 17 различных серотипов (таблица 3), представлены все подгруппы (A, B1, B2, С, D, Е, F).
Коллекция из 17 серотипов была тестирована при использовании двух клеточных линий MRC5 (номер по каталогу 84002, bioMerieux, Франция) и А549 (АТСС: CCL 185), дающих похожие результаты. Результаты, полученные при использовании А549, представлены в таблице 3. Можно видеть, что величины Ct являются схожими, кроме таковых для серотипов 12, 18 и 40. Эти три серотипа соответствуют аденовирусам с самыми незначительными титрами. Однако это большое различие Ct главным образом возникает вследствие выбора праймеров и зонда TaqMan™ согласно настоящему изобретению. В самом деле, Ad12 имеет две межконъюгации для смыслового праймера НЕХ1 согласно изобретению и одну межконъюгацию для зонда HEX согласно изобретению. Точно также, Ad40 имеет одну деконъюгацию для антисмыслового праймера НЕХ2 согласно изобретению и одну деконъюгацию для зонда HEX согласно изобретению. Последовательности гена гексона для серотипа 18 нет. Возможно, что эти результаты, полученные с Ad18, также возникают вследствие межконъюгаций.
Нужно заметить, что несмотря на эти деконъюгации (две или три) нуклеотидных последовательностей, культуральные супернатанты остаются в высокой степени положительными.
Эти результаты хорошо подтверждают "универсальный" характер PCR гексона, если считать, что 17 тестированных серотипов являются репрезентативными из совокупности 51 известного серотипа.
Пример 3
Чувствительность способа согласно изобретению
3.1. Оценка порога детекции по числу частиц
В таблице 3 представлены результаты для 17 серотипов аденовирусов с величинами Ct, полученными в зависимости от числа частиц на мл, при определении по методу высокоэффективной жидкостной хроматографии (ВЭЖХ). За исключением трех серотипов с незначительными титрами (Ad12, Ad18 и Ad40), величины Ct находятся в пределах от 8,1 до 9,1 для числа частиц 1,1-8,5·1010/мл.
Если считать, что величина Ct для предела положительности составляет примерно 40 и принять разницу 3,5 Ct за фактор 10 числа мишеней, то это означает возможное отклонение величины Ct на 31 единицу. Это отклонение означает примерно 9 логарифмов по основанию 10. Следовательно, в зависимости от серотипов порог детекции может быть оценен в 10-80 частиц путем реакции PCR.
3.2. Баланс 101 серии стандарта
За 18 месядев была тестирована 101 серия стандартов с помощью 101 независимой экстракции стандарта, содержащего 5·105 pfu Ad5CMVp53 в 200 мкл. Конечный элюируемый объем составляет 50 мкл. 10 мкл экстракта этого стандарта с серией последовательных разведении в 10 раз (чистый, 10-1, 10-2, 10-3, 10-4, 10-5) анализировали для создания, серии стандарта. Последнее тестированное разведение соответствует теоретически 1 pfu Ad5CMVp53 в пробирке для PCR. Все точки серии тестировали двукратно по PCR (Ct1 и Ct2, таблица 5).
Величины Ct, полученные во всех точках с содержанием 1 pfu Ad5CMVp53, представлены в таблице 5. Из 202 реакций PCR 8 реакций являются отрицательными (Ct=50), что означает только 4%. В огромном большинстве случаев количество 1 pfu Ad5CMVp53 является положительным в PCR гексона.
Эти результаты подтверждают хорошую чувствительность детекции. В зависимости от партий приготовления Ad5CMVp53 эквивалент 1 pfu соответствует 10-40 вирусным частицам (≈ мишень), что подтверждает порог детекции, оцененный с помощью коллекции аденовирусов дикого типа.
Пример 4
Кинетика культивирования аденовирусов
Два эксперимента показали, что можно следить за кинетикой размножения аденовирусов с помощью метода PCR гексона согласно изобретению. В этих двух экспериментах использовали либо Ad5 на линии MRC5, либо Ad2 на линии А549 (таблица 4). Полученные для двух экспериментов результаты были похожими.
Матрасы для культивирования клеток площадью 25 см2 инфицировали с помощью разведений аденовирусов, включающих от 105 pfu до 1 pfu. Культуральную среду (5 мл) удаляли, клетки инфицировали с помощью различных концентраций вируса в объеме 2 мл в течение 2 часов (при температуре 37°С). По истечении двух часов среду заменяли. После инфекции во все дни (со дня 0 до дня 11) из матрасов для культивирования отбирали пробы: 250 мкл для теста ELISA (детектирование антигена гексона) и 200 мкл для детекции путем PCR согласно изобретению. В матрас для культивирования снова вводили 450 мкл свежей среды.
Появление цитопатического эффекта (ЕСР) (таблица 4) произошло между 4 днями для точки 105 pfu и 8 днями для точки 10 pfu. Существует связь между инокулированным количеством вируса в матрасе для культивирования и сроком положительности. Порог положительности составляет 10 pfu на матрас для культивирования.
Появление ЕСР происходит одновременно с появлением антигена гексона (тест ELISA). Для каждого из изученных разведений положительность ELISA не предшествует таковой ЕСР.
В случае PCR гексона (таблица 4) величины Ct для отрицательных контролей (Т) слегка положительные (37,6-37,8). Этот результат может объясняться либо незначительным загрязнением аэрозолями в момент инокуляции матрасов для культивирования, либо незначительным загрязнением в момент экстракции. Первая гипотеза кажется более вероятной, так как в день 10 величины Ct вышли за пределы величины 31,2 (разница 6,5 Ct), что означает повышение на фактор 100 числа копий аденовирусов. Метод PCR гексона согласно изобретению показывает существование размножения вируса (значительное понижение Ct) в отсутствие ЕСР и детекции антигена гексона.
В зависимости от тестируемых разведений по методу PCR гексона согласно изобретению совершенно неожиданно выявляют 2-4 "волны" размножения вируса.
Эти результаты ясно показывают, что метод PCR гексона согласно изобретению становится положительным скорее, чем ЕСР или ELISA гексона. Так, метод PCR гексона согласно настоящему изобретению как минимум в 10 раз более чувствительный, чем классические тесты клеточной культуры (культивирование в течение 10 дней + тест ELISA).
Эти результаты, по меньшей мере неожиданные, получаемые с помощью метода PCR гексона, могут быть использованы, в частности, для быстрого и легкого узнавания времени вирусного цикла и степени его амплификации. Эти два последних параметра являются очень важными для оценки репликационных характеристик вируса.
Следовательно, метод PCR гексона согласно изобретению может способствовать преимущественно селекции векторов-"кандидатов" в целях биотехнологических применений, в частности в случае экспрессии и/или генной терапии.
Пример 5
Повторяемость и воспроизводимость способа согласно изобретению
Результаты 101 стандарта, оцененные по PCR гексона (таблица 5), позволяют одновременно определять повторяемость (повторение внутреннего содержания тестов) и воспроизводимость (повторение тестов через промежуток времени). Среднее из величин Ct для 1 pfu составляет 37,2±1,8. Эта степень вариации является относительно незначительной главным образом вследствие того, что она представляет собой результат вариации двух стадий: экстракции и PCR гексона.
В случае значений Ct для 10 pfu (не показаны), среднее составляет 33,7±1,7. Уровень вариации является очень похожим, так как полученные отклонения очень близки. Можно отметить, что разница Ct между двумя средними значениями, полученными с 1pfu и 10 pfu, составляет 3,5 Ct. Эта разница соответствует по существу отклонению на фактор 10 в числе мишеней.
Пример 6
Клинические образцы
Клинические образцы были тестированы с независимыми экстракциями и в различных сериях PCR гексона. Результаты PCR гексона (значения Ct) для 8 образцов плазмы и 20 образцов мочи представлены в таблице 6.
Обычно когда величины Ct ниже или равны 36, вариации Ct для одного и того же экстракта нуклеиновых кислот (Ct1 и Ct2) редко превышают величину 1 Ct (фактор 2 для количественного определения). Это на том основании, что все образцы с величинами Ct<36 рассматривают как поддающиеся количественному определению (статус "положительно квантифицируемый") и образцы с величинами Ct от 36 до 43 рассматривают как положительные, но не поддающиеся количественному определению (статус "положительно детектируемый").
Для образцов плазмы (таблица 6), в одном и том же экстракте нуклеиновых кислот редко встречается отклонение больше 1 Ct за исключением экстракта №1 плазмы №3289 и экстракта №3 плазмы №3579. В этом последнем случае величина 44,6 для Ct1 аберрантная. Разумеется, в различных экстрактах нуклеиновых кислот вариация Ct является более значительной, но редко превышает величину 2 Ct (фактор 4 для количественного определения).
Для образцов мочи (таблица 6), в одном и том же экстракте нуклеиновых кислот не встречается отклонение более 1 Ct за исключением тех случаев, когда величины Ct выше 36. В самом деле, для величин Ct выше 36 степень положительности довольно незначительная, что объясняет более высокую степень вариации.
В различных экстрактах нуклеиновых кислот вариация Ct также является более значительной, только редко превышающей величину 2 Ct между двумя различными экстрактами за исключением для образца мочи №2403, который имеет разницу 3 Ct (фактор 8 в количественном определении). Разумеется, некоторые образцы мочи (№2029, 2626, 3736, 3763, 3765 и 5399) имеют очень высокие величины Ct (обычно >40), свидетельствующие об очень незначительной положительности. В этих последних случаях понятно, что можно легко переходить от положительного сигнала к отрицательному сигналу (Ct=50).
В целом, результаты, полученные в случае клинических образцов по способу детекции путем PCR гексона согласно изобретению, показывают очень хорошую воспроизводимость (для величин Ct), когда положительность является довольно высокой (Ct≤36; статус "положительно-квантифицируемый"). Для величин Ct выше 36 и вплоть до 43 можно принимать во внимание, что мишень является хорошо представленной (положительной), но степень вариации слишком высокая для того, чтобы получить достоверную величину количественного определения.
Пример 7
Линейность количественного определения (квантификации)
Стандартную кривую обычно строят по 12 точкам от 1 pfu до 105 pfu путем реакции PCR, тестируемым двукратно. Для каждого повторения кривые амплификации и величины цикла PCR являются в высшей степени воспроизводимыми (см. чертеж). Напротив, в конечной точке сигналы флуоресценции являются очень вариабельными (вплоть до фактора 10), откуда возникает стремление анализировать продукты PCR в момент появления сигнала (цикл PCR: Ct), а не в конечной точке, как в случае "классической" PCR.
Стандартная кривая, полученная по этим стандартным точкам, представлена на чертеже. Коэффициент корреляции 0,999 указывает на превосходную линейность. В огромном большинстве случаев этот коэффициент составляет от 0,98 до 1. Манипуляции, при которых используют более широкую серию стандарта (от 0,5 pfu до 106 pfu), показали подобные коэффициенты корреляции (не представлены), подтверждающие, таким образом, данные поставщика, описывающие линейность количественного определения на величину более 6 логарифмов.
Величина "Y-прерывание" означает число циклов PCR, следующее из стандартной кривой для детекции одного pfu Ad5CMVp53. Согласно стандартным кривым, эта величина Ct составляет 35-39.
Величина наклона (slope) связана с выходом реакции PCR. Следует напомнить, что для PCR с выходом 100% эта величина должна составлять -3,22. В случае метода PCR гексона согласно изобретению величина наклона составляет от -3,4 до -3,9, что означает средний выход 90%.
Пример 8
Количественное определение в клинических образцах
Примеры количественного определения, достигаемого с помощью PCR гексона, в клинических образцах (таблица 7) селекционированы по двум основным критериям. Первым критерием является то, что образец анализировали путем двух полностью независимых экстракций с помощью последовательных PCR (см. таблицу 6). Вторым критерием является то, что результаты PCR имеют величины Ct ниже или равные 36, хорошо соответствующие статусу "поддающийся количественному определению" для образца.
Шесть клинических образцов отвечают этим двум критериям (таблица 7). Результаты количественного определения являются в высокой степени воспроизводимыми и степень вариации редко превышает фактор 2 для одного и того же образца (таблица 7). Особенно интересно отметить для образца мочи №2403, что разница 3 Ct (теоретически это означает фактор 8 для количественного определения) между двумя экстракциями практически не отражается на величинах количественного определения, получаемых путем PCR гексона. Этот пример подчеркивает интерес к параллельно экстрагируемым калибровочным маркерам, которые позволяют исправить количественное определение в зависимости от небольших колебаний в случае реакций PCR (слегка отличный порог детекции, слегка отличные условия экстракции...).
Условия осуществления реакции
Срок появления цитопатического эффекта (ЕСР) (дни), величина оптической плотности (DO) согласно ELISA (DO Elisa), величина Ct (PCR гексона) и титра согласно ВЭЖХ после инокуляции клеток А549 супернатантом клеток MRC5, собранным после инфекции с помощью аденовирусов дикого типа из коллекции.
Elisa +, если DO>0,171.
Кинетика культивирования Ad2 на А549. Сроки появления ЕСР (дни), величина оптической плотности (DO) по ELISA и величины Ct PCR гексона
вторая строка: Elisa (Elisa +, если DO > 0/171)
третья и четвертая строки: Ct1 и Ct2 PCR гексона
Величины Ct, полученные с 1 pfu Ad5CMVp53 в реакции PCR (101 тест)
b: ND: определение не осуществлено
Результаты PCR гексона при использовании двух коллекций клинических образцов (плазма и моча) с двумя или тремя независимыми экстракциями
образца
b: NA: не применимо; с: Ct=50: PCR отрицательная. d: каждый экстракт тестирован в двух реакциях PCR; Ct1 для опыта 1 PCR и Ct2 для опыта 2 PCR.
Количественное определение с помощью PCR гексона при использовании поддающихся количественному определению клинических образцов
b): Используемый стандарт известен по числу pfu Ad5CMVp53. Это количественное определение относится к миллилитру исходных клинических образцов.


| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНОГО ЗОНДА ДЛЯ ИДЕНТИФИКАЦИИ ДНК АДЕНОВИРУСА СЕРОТИПОВ 3,4,7,14,21 МЕТОДОМ ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2012 |
|
RU2511043C2 |
| СПОСОБ АМПЛИФИКАЦИИ НУКЛЕИНОВЫХ КИСЛОТ С ИСПОЛЬЗОВАНИЕМ ФОСФОРИЛГУАНИДИНОВЫХ ОЛИГОНУКЛЕОТИДОВ | 2017 |
|
RU2698134C2 |
| Способ опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена | 2023 |
|
RU2823930C1 |
| СПОСОБ, КОМПОЗИЦИЯ И НАБОР ДЛЯ ФЛУОРЕСЦЕНТНОЙ КОЛИЧЕСТВЕННОЙ ПЦР И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2808238C1 |
| Способ опосредованного определения концентрации иммуногенного RNP-комплекса вируса бешенства в сырье для антирабических вакцин методом амплификации и гибридизационно-флуоресцентной детекции ДНК-ампликонов | 2020 |
|
RU2760436C1 |
| Способ опосредованного определения титра инфекционной активности вируса бешенства штамма ВНИИЗЖ в сырье для инактивированной антирабической вакцины методом ПЦР в режиме реального времени | 2020 |
|
RU2755925C1 |
| Способ выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней | 2018 |
|
RU2703394C1 |
| Способ дифференциации вакцинного штамма "ВГНКИ" возбудителя аденовирусной инфекции от других штаммов и полевых изолятов с помощью анализа максимумов температур плавления ПЦР-продуктов с применением тандемного флуоресцирующего красителя SuperNova v605 | 2023 |
|
RU2825893C1 |
| Способ опосредованного определения титра инфекционной активности вируса инфекционного гепатита собак генотипа CAV-1 в сырье для культуральных вакцин с помощью полимеразной цепной реакции в режиме реального времени по циклу количественной оценки Cq | 2023 |
|
RU2812441C1 |
| Способ определения концентрации вирионов производственных штаммов возбудителя коронавирусной инфекции животных | 2024 |
|
RU2839298C1 |
Изобретение относится к области вирусологии и биотехнологии. Предложены олигонуклеотиды, праймеры и зонды на их основе, предназначенные для способа детекции и/или количественного определения нуклеиновых кислот аденовирусов в биологическом образце. Способ предусматривает амплификацию путем ПЦР в реальном времени с помощью предложенных праймеров НЕХ1 и НЕХ2, при этом продукт реакции детектируют с помощью зонда HEX. Предложены также набор реагентов для осуществления такого способа и способы диагностики и селекции, основанные на нем. Предложенная группа изобретений позволяет детектировать за одну реакцию различные серотипы аденовирусов и количественно определять очень незначительные количества. 10 н. и 7 з.п. ф-лы, 1 ил., 7 табл.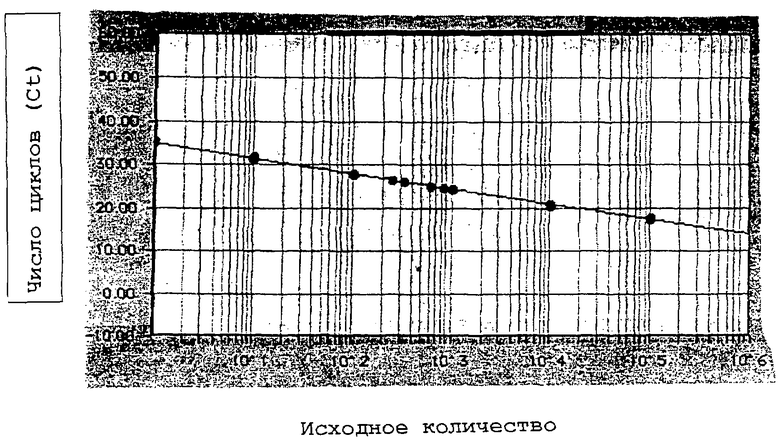
5'-YCC CAT GGA YGA GCC CAC MCT-3',
в которой Y означает С или Т и М означает А или С,
или последовательность, комплементарную указанной последовательности.
5'-YCC CAT GGA YGA GCC CAC MCT-3',
в которой Y означает С или Т и М означает А или С.
5'-GAG AAS GGB GTG CGC AGG TAS AC-3',
в которой S означает G или С и В означает С, G или Т,
или последовательность, комплементарную указанной последовательности.
5'-GAG AAS GGB GTG CGC AGG TAS AC-3',
в которой S означает G или С и В означает С, G или Т.
5'-САС CAG ССА САС CGC GGC GTC АТС GA-3'.
5'-FAM - САС CAG ССА САС CGC GGC GTC АТС GA - TAMRA 3'.
нуклеотидную последовательность аденовируса амплифицируют путем полимеразной цепной реакции (PCR) в реальное время с помощью пары дегенерированных смыслового праймера НЕХ1 и антисмыслового праймера НЕХ2 и
продукт реакции амплификации детектируют с помощью недегенерированного зонда HEX на протяжении числа циклов, достаточного для возможности получения измеримого количества продукта амплификации.
отделение амплифицируемых цепочек путем нагревания экстракта ДНК из образца;
гибридизация зонда;
гибридизация с праймерами и элонгация с помощью полимеразы.
| DE 19716456 A, 22.10.1998 | |||
| DE 19816902 A, 28.10.1999. |
Авторы
Даты
2006-03-27—Публикация
2001-02-07—Подача