Изобретение относится к области биотехнологии, а именно к способу опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена.
Инфекционный гепатит собак - остроконтагиозное заболевание, протекающее с явлениями лихорадки, воспалительных процессов слизистых оболочек глаз, носовой полости, желудочно-кишечного тракта, печени и желчного пузыря, сопровождающегося иногда нарушением деятельности центральной нервной системы. Вирус инфекционного гепатита собак относится к семейству Adenoviridae, роду Mastadenovirus, виду Canine Mastadenovirus А (CAV-1) [1].
Вирионы CAV-1, как и все аденовирусы, представляют собой изометрические частицы кубического типа симметрии с диаметром вириона 70-90 нм. На вершинах икосаэдра имеются отростки (фиберы). Капсид вириона включает 252 капсомера без суперкапсидной оболочки. Капсид содержит 12 структурных белков. Имеется также белок сердцевины, связанный с вирионной ДНК. Нуклеиновая кислота вириона представлена двуспиральной линейной молекулой ДНК размером около 30 500 п.н., которая кодирует белки orf 1-orf 30 [2-4].
Выделяют три различных растворимых антигена, отличающихся по иммунологическим свойствам: А-, B- и С-антигены.
А-антиген, гексон - групповой, общий антиген для всех серотипов вируса, локализованный в 240 капсомерах капсида, каждый из которых граничит с шестью соседними капсомерами, что определило название антигена (hexon). Антитела против очищенного гексонного антигена нейтрализуют инфекционные свойства только гомологичного серотипа. В то же время эта сыворотка реагирует в реакции связывания комплемента с любыми гетерологичными серотипами, так как в составе гексонного антигена имеются две реактивные группы, одна из которых стимулирует образование группоспецифических, а другая - типоспецифических антител. А-антиген является важнейшим иммуногенным компонентом вакцинных препаратов, который требуется детектировать в процессе контроля качества вируссодержащего сырья при промышленном производстве вакцин [5-8].
В-антиген, пентон - токсический антиген, вызывающий округление и скучивание (агрегация) чувствительных клеток однослойной культуры и отделение клеток с поверхности стекла. Локализован в капсомерах, расположенных на вершине двенадцати угловых участков вириона, каждый из которых граничит с пятью соседними капсомерами (penton). Чувствителен к действию трипсина. Ингибирует активность интерферона и повышает тяжесть ассоциированных респираторных инфекций [9].
С-антиген - нитевой (fiber) антиген, имеет морфологически форму нити с узловым утолщением, прикрепленной к пентонному антигену. Представляет собой типоспецифический антиген, устойчив к действию трипсина, способствует адсорбции аденовирусов на эритроцитах обезьяны или крысы и их агглютинации [10].
Система мер борьбы с инфекционным гепатитом собак и ее профилактики предусматривает иммунизацию животных, а также контроль уровня напряженности поствакцинального иммунитета [7-11].
Для вакцинации щенков применяют культуральные вакцины против инфекционного гепатита собак. В процессе производства данных препаратов промышленное сырье исследуют на определение концентрации А-антигена CAV-1 [5].
Как правило, для определения данного компонента применяют спектрометрический метод, который предусматривает процесс ультрацентрифугирования по выделению фракции А-антигена [2] (прототип). Существенными недостатками указанного способа являются:
1) ограничения по чувствительности из-за фона анализируемого соединения; 2) трудоемкость процесса по причине использования процесса ультрацентрифугирования; 3) субъективность получаемых результатов по причине сложности отбора опалесцирующей фракции после центрифугирования в градиенте плотности хлористого цезия; 4) продолжительность проводимого анализа (не менее 48 ч); 5) высокая вероятность контаминации исследуемых образцов [8-11].
В связи с этим целесообразно провести поиск способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин с помощью современных методов исследования.
Предложенный способ позволяет опосредованно определять концентрацию А-антигена штамма «ВГНКИ» CAV-1 в производственном сырье для изготовления культуральных вакцин против CAV-1 в течение 3 часов (быстрее в 16 раз по сравнению с прототипом); не имеет ограничений по чувствительности по причине вычитания фоновых значений; менее трудоемкий по сравнению с прототипом; высокочувствительный и объективный.
Задачей настоящего изобретения является разработка, высокочувствительного и высокоспецифичного способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин на основе современных методов молекулярной биологии с целью устранения вышеуказанных недостатков.
Данная задача решена благодаря созданию способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена, который позволяет:
1) сократить время по определению концентрации А-антигена штамма «ВГНКИ» CAV-1 вируса до 3 ч;
2) исключить вероятность контаминации;
3) повысить чувствительность и специфичность анализа;
4) исключить фактор субъективности получаемых результатов по причине использования приборного обеспечения для детекции результатов;
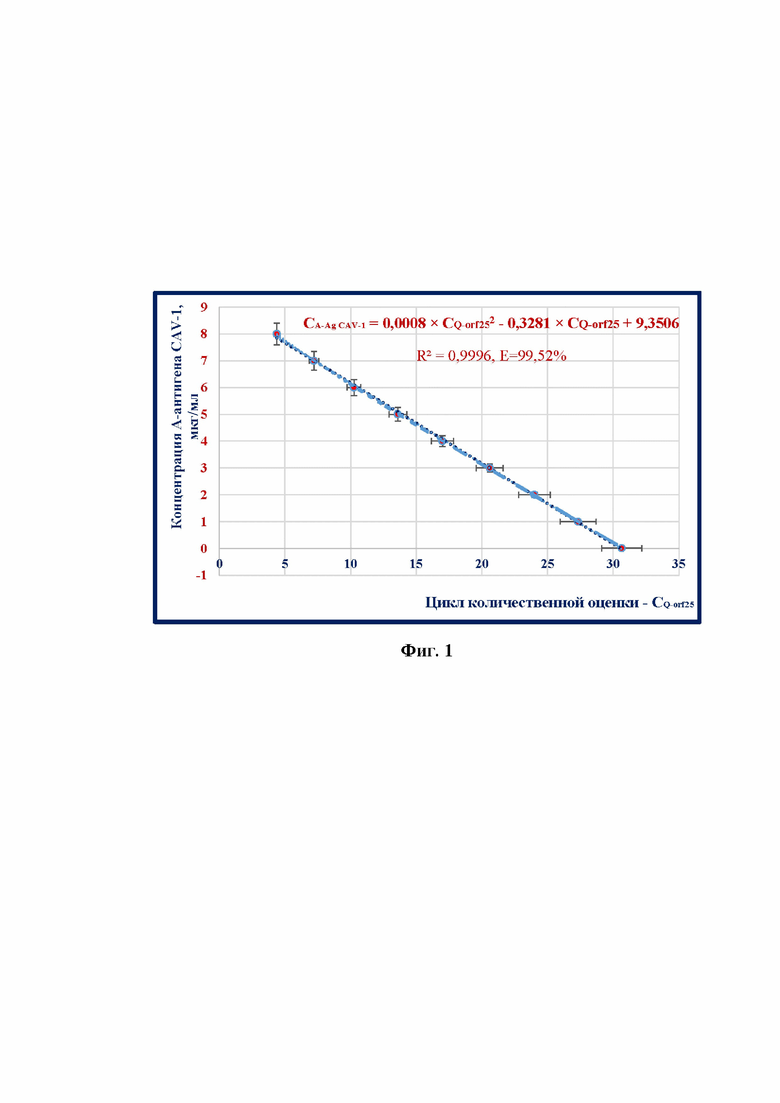
5) повысить достоверность проводимого анализа благодаря установлению зависимости между концентрацией А-антигена штамма «ВГНКИ» CAV-1 (CA-Ag CAV-1) и циклом количественной оценки ампликонов таргетного участка orf25-гена (CQ-orf25), представленной в виде квадратичной функции:
CA-Ag CAV-1=-0,008×CQ-orf252-0,3281×CQ-orf25+9,3506,
где CA-Ag CAV-1 - концентрация А-антигена штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки,
CQ-orf25 - цикл количественной оценки ампликонов таргетного участка orf25-гена,
с высокой достоверностью аппроксимации (R2=0,9996) и эффективностью амплификации (E) 99,52%.
Предложенная модель позволяет опосредованно определять концентрацию А-антигена штамма «ВГНКИ» CAV-1 в сырье для изготовления культуральных вакцин по данным цикла количественной оценки.
Сущность изобретения отражена на графических изображениях:
Фиг. 1 - Зависимость концентрации А-антигена штамма «ВГНКИ» CAV-1 и цикла количественной оценки ампликонов (n=3, отмечены точки, отображающие средние значения циклов количественной оценки).
Фиг. 2 - Дизайн оригинальных специфичных олигонуклеотидных праймеров и молекулярного зонда для разработки способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена.
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO:1 представляет последовательность нуклеотидов orf25-гена кДНК вакцинного штамма «ВГНКИ» возбудителя инфекционного гепатита собак;
SEQ ID NO:2 представляет последовательность аминокислот orf25-гена кДНК вакцинного штамма «ВГНКИ» возбудителя инфекционного гепатита собак.
Сущность изобретения заключается в особом подходе по опосредованному определения концентрации А-антигена штамма «ВГНКИ» CAV-1 в сырье для культуральных вакцин по данным цикла количественной оценки для ампликонов целевого участка orf25-гена возбудителя инфекционного гепатита собак.
Заявляемый способ основан на: 1) твердофазной экстракции РНК возбудителя CAV-1; 2) обратной транскрипции и амплификации специфического фрагмента orf25-гена кДНК CAV-1 с применением оригинальных специфических праймеров и молекулярного зонда, меченого флуоресцентным красителем FAM; 3) детектировании ампликонов с помощью флуоресцентного свечения и отображения накопления сигнала в виде сигмоидного графика; 4) определении значений циклов количественной оценки CQ-orf25; 5) расчете концентрации А-антигена штамма «ВГНКИ» CAV-1 c применением следующей квадратичной функции:
CA-Ag CAV-1=-0,008×CQ-orf252-0,3281×CQ-orf25+9,3506,
где CA-Ag CAV-1 - концентрация А-антигена штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки,
CQ-orf25 - цикл количественной оценки ампликонов таргетного участка orf25-гена,
с высокой достоверностью аппроксимации (R2=0,9996) и эффективностью амплификации (E) 99,52 %.
В настоящее время обратная транскрипция и ПЦР в режиме реального времени используется для выявления нуклеиновой кислоты и генотипирования возбудителя инфекционного гепатита собак. Для количественной оценки А-антигена штамма «ВГНКИ» CAV-1 в промышленном сырье для изготовления культуральных вакцин для профилактики данного заболевания ранее данный метод с применением разработанной системы оригинальных олигонуклеотидов не применялся. Таким образом, сведений об аналогах предлагаемого способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена авторами не обнаружено.
Разработанный способ опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена по сравнению с прототипом отличается более высокой чувствительностью и специфичностью, быстротой выполнения анализа и снижением риска контаминации исследуемых образцов.
В отличие от прототипа разработанный способ включает следующие этапы анализа: 1) выделение РНК из исследуемых образцов; 2) обратная транскрипция и ПЦР в режиме реального времени при амплификации специфического фрагмента orf25-гена кДНК штамма «ВГНКИ» CAV-1 с применением оригинальных специфических праймеров и молекулярного зонда; 3) детектирование ампликонов с помощью флуоресцентного свечения и отображения накопления сигнала в виде сигмоидного графика; 4) определение значений циклов количественной оценки CQ-orf25; 5) расчет концентрации А-антигена штамма «ВГНКИ» CAV-1 с применением квадратичной функции, отраженной выше.
Применение предложенного способа позволит сократить время проведения анализа промышленного сырья при изготовлении культуральных вакцин против CAV-1 по определению концентрации А-антигена штамма «ВГНКИ» до 3 ч; исключить вероятность контаминации; повысить чувствительность и специфичность анализа; исключить фактор субъективности получаемых результатов по причине наличия приборного обеспечения для детекции результатов; повысить достоверность проводимого анализа благодаря установлению зависимости между концентрацией А-антигена штамма «ВГНКИ» CAV-1 и циклом количественной оценки ампликонов целевого участка orf25-гена. Исходя их этого, актуально применять разработанный способ для опосредованного определения концентрации А-антигена вакцинного штамма «ВГНКИ» CAV-1 в сырье для производства вакцин.
Ключевым элементом заявляемого способа является определение циклов количественной оценки для ампликонов целевого участка orf25-гена (CQ-orf25) и расчет концентрации А-антигена штамма «ВГНКИ» CAV-1 в сырье для культуральных вакцин с использованием разработанной квадратичной функции.
Сопоставительный анализ с прототипами позволяет сделать вывод, что новизна и изобретательский уровень заявляемого изобретения заключается в применении обратной транскрипции и полимеразной цепной реакции с использованием разработанных оригинальных специфичных олигонуклеотидов, рассчитанных на участок orf25-гена кДНК штамма «ВГНКИ» CAV-1, и разработанной функции второй степени зависимости CA-Ag CAV-1 и CQ-orf25 (фиг. 1).
Технический результат изобретения заключается в том, что разработанный способ дает возможность: 1) повысить чувствительность и специфичность за счет применения высокоспецифичных оригинальных праймеров и молекулярного зонда, рассчитанных для целевого участка orf25-гена кДНК штамма «ВГНКИ» CAV-1; 2) увеличить достоверность проводимого анализа благодаря подбору оптимальных температурного и временного режимов термоциклирования; 3) в 16 раз быстрее по сравнению с прототипом опосредованно определять концентрацию А-антигена штамма «ВГНКИ» CAV-1 в сырье для культуральных вакцин.
С целью определения концентрации А-антигена вакцинного штамма «ВГНКИ» CAV-1 в сырье для культуральных вакцин по данным цикла количественной оценки для ампликонов целевого участка orf25-гена отдельно подготавливают положительный контрольный образец. Для этого проводят репродукцию штамма «ВГНКИ» CAV-1 в монослойной перевиваемой клеточной линии почки кошки CRFK (Crandell Feline Kidney) до получения 95-100% поражения клеток в течение 72 ч.
Полученную вируссодержащую суспензию после культивирования подвергают центрифугированию при 2000 g в течение 10 минут. Супернатант отбирают для последующих исследований. Проводят ультрацентрифугирование в ступенчатом градиенте хлорида цезия (CsCl) (15-25%) при 60000 g в течение 2 ч при температуре 15±1°С. Опалесцирующий слой отбирают в отдельный пенициллиновый флакон, переносят в центрифужные пробирки, доливают объем пробирок с помощью 1/15 М фосфатного буферного раствора. Осаждают А-антиген для очищения от остатков хлористого цезия с помощью центрифугирования при 60 000 g в течение 1 ч при 15±1°С. Полученный осадок растворяют в необходимом количестве буферного 1/15 М фосфатного буферного раствора.
В готовой суспензии определяют концентрацию А-антигена штамма «ВГНКИ» CAV-1 с помощью спектрометрического метода и подтверждают чистоту с помощью вертикального гель-электрофореза в полиакриламидном геле (ПААГ). В итоге получают охарактеризованный положительный контрольный образец, который вместе с исследуемыми пробами используют в дальнейшей работе.
На следующем этапе исследования составляют контрольную панель положительных стандартов А-антигена штамма «ВГНКИ» CAV-1, в качестве которых используют очищенные препараты со следующими концентрациями аналита: 0,01; 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0; 8,0 мкг/мл. Отрицательным контролем служит суспензия клеток линии CRFK, не контаминированная микроорганизмами.
Из всех стандартных положительных и отрицательного контролей, а также тестируемых проб промышленного сырья выделяют нуклеиновую кислоту с применением набора «РИБО-сорб» (ООО «Интерлабсервис») в соответствии с инструкцией производителя.
Проводят обратную транскрипцию для получения комплементарной ДНК (кДНК) CAV-1 и ПЦР в режиме реального времени. Для этого готовят реакционную смесь, рецептура которой представлена в таблице 1. Дизайн олигонуклеотидов отражен в таблице 2. Расчет праймеров и зонда осуществляли на основании нуклеотидной последовательности orf25-гена штамма «ВГНКИ» возбудителя инфекционного гепатита собак. Термодинамические показатели для олигонуклеотидов отражены в таблице 3.
В качестве гомологичных участку orf25-гена производственного штамма «ВГНКИ» CAV-1 используют следующие олигонуклеотиды:
CAV-F25222-праймер GCCTTCTACATCTAGAAGTGGA
CAV-R25292-праймер TGCCATTGGAGAGACAGAGC
CAV-P25254-FAM/RTQ-1-зонд FAM-AGTGTCACTTGGATAGACTCTAA-RTQ-1,
в концентрации 7 пМ на реакцию. Для формирования нуклеотидных цепей продуктов реакции применяют дезоксирибонуклеозидтрифосфаты с их суммарной концентрацией в реакционной смеси 2,3 мМ. В качестве основы используют буферный раствор (5-кратный), содержание которого составляет 20% от общего объема реакционной смеси. Буферный раствор включает в свой состав ионы калия (K+) (5⋅10−2 M) и диметилсульфооксид (DMSO) (1 %). DMSO включают в реакционную смесь для сведения к минимуму неспецифического связывания олигонуклеотидов. В смесь также добавляют 2,7 мМ хлорида магния. В качестве катализатора обратной транскрипции применяют MMLV-ревертазу (1 е.а.), для реакции амплификации - Taq-ДНК-зависимую ДНК-полимеразу (1 е.а.). Элюаты суммарной РНК каждого образца добавляют к реакционной смеси по 5 мкл. Итоговый объем смеси для проведения одной реакции составляет 25 мкл.
Олигонуклеотиды подбирали в соответствии с рядом общих правил, которые отражены в работах B. Deiman и R. Sooknanan [12-14]. Длины прямого, обратного праймеров и зонда составляют 22, 20, 23 н.о., что соответствует требованиям (20-30 н.о.). Молекулярный вес олигонуклеотидов равен 6734,4; 6044,0 и 7062,7, соответственно. Праймеры и зонд очищены в полиакриламидном геле и с помощью высокоэффективной жидкостной хроматографии, соответственно. Нуклеотидная последовательность зонда не комплементарна олигонуклеотидным праймерам. Отсутствуют 4 и более подряд одинаковых нуклеотидов в цепи праймеров и зонда. Флуорофор FAM присоединен к 5'-концу, а гаситель флуоресценции RHQ1 - к 3'-концу. Данные условия соответствуют требованиям, предъявляемым к олигонуклеотидным праймерам и молекулярному зонду, которые участвуют в реакции амплификации. В качестве флуоресцентного красителя был выбран FAM с длиной волны максимальной флуоресценцией 520 нм. Для тушения свечения использовали гаситель флуоресценции RHQ1 с длиной волны максимального поглощения при 520 нм и возможном диапазоне гашения 470-570 нм. Таким образом, была выбрана подходящая пара «флуорофор-гаситель».
При анализе нуклеотидных последовательностей олигонуклеотидов установили, что для праймеров и зонда не характерно образование «шпилек», а также не выявлено 3'-комплементарности и сайтов, отжигающих сами на себя при условии, когда минимальное количество пар оснований, необходимое для димеризации праймера и минимальное количество пар оснований, необходимое для образования шпильки - 4.
Проведено определение температур плавления (Tm) для олигонуклеотидов методом, учитывающим концентрации ионов K+ и диметилсульфооксида (DMSO).
Физические, термодинамические константы и расчет температур плавления (Tm) разработанных олигонуклеотидных праймеров и зонда представлены в таблице 3, из которой следует, что энтропия, энергия Гиббса и энтальпия для прямого праймера составили 170,5 ккал/моль, 26,5 ккал/моль, 448,0 кал/(K⋅моль), соответственно. Энтропия, энергия Гиббса и энтальпия для обратного праймера составили 160,2 ккал/моль, 26,2 ккал/моль, 415,8 кал/(K⋅моль), соответственно. Энтропия, энергия Гиббса и энтальпия для молекулярного зонда составили 176,1 ккал/моль, 26,8 ккал/моль, 465,2 кал/(K⋅моль), соответственно [15]. Полученные значения использовались для расчета температур плавления представленных олигонуклеотидов. Tm для прямого и обратного праймеров составили по 60°С, для зонда - 59°С.
Экспериментально температуру отжига определяли по кривым плавления гетеродимера олигонуклеотида и матрицы с помощью модели фолдинга с использованием программного обеспечения Hybrid. В результате проведения эксперимента было выявлено, что температура отжига рассматриваемых олигонуклеотидов составляет 60°С. Для проведения реакции амплификации было решено проводить гибридизацию праймеров и зонда с участком orf25-гена кДНК штамма «ВГНКИ» CAV-1 при температуре 60°С.
Последовательности оригинальных олигонуклеотидов проверили на наличие нежелательных совпадений с другими последовательностями нуклеиновых кислот с использованием Банка данных последовательности нуклеиновых кислот CAV-1. Последовательности праймеров и зонда также проанализировали на наличие внутренних вторичных структур с помощью программы сворачивания нуклеиновых кислот с помощью программы Mfold [16, 17]. Выявлено, что для разработанных олигонуклеотидов нежелательных совпадений с другими последовательностями нуклеиновых кислот, а также наличия внутренних вторичных структур не обнаружено.
Проведение обратной транскрипции и реакции амплификации в режиме реального времени осуществляли в детектирующем термоциклере любой марки при температурных и временных параметрах, сведения о которых представлены в таблице 4.
Обратную транскрипцию проводят при температуре 42°С в течение 20 минут. Перед проведением реакции амплификации осуществляют предварительный прогрев смеси при температуре 97°С в течение 5 минут для активации фермента Taq-ДНК-полимеразы и инактивации MMLV-ревертазы. Амплификация включает в себя 3 подэтапа: денатурацию, отжиг олигонуклеотидов, элонгацию. Денатурацию проводят при температуре 97°С в течение 7 с, отжиг праймеров и зонда и элонгацию - при температуре 60°С в течение 45 с. Количество циклов ПЦР в режиме реального времени составляют 40.
Результаты ПЦР анализируют, оценивая и сравнивая графики накопления флуоресцентного сигнала по значениям циклов количественной оценки CQ-orf25, определенных с помощью пересечения пороговой линии и сигмоидной функции вида Fl=f×(CQ-orf25). Учет результатов в реакции происходит на каждом цикле. Прибор определяет уровень флуоресценции и строит кинетическую кривую в координатах: уровень флуоресценции - цикл реакции амплификации. При наличии в исследуемой пробе специфической кДНК-матрицы сигмоида имеет экспоненциальную зависимость. Положительными считаются пробы, которым соответствуют сигмоидные графики, полученные при анализе флуоресценции красителя FAM, входящего в состав молекулярного зонда. Пробы оцениваются как отрицательные, если при их анализе отсутствует экспоненциальная кривая.
На следующем этапе анализа устанавливают зависимость между циклом количественной оценки и концентрацией А-антигена производственного штамма «ВГНКИ» CAV-1 в неинактивированном сырье для культуральных вакцин. Оценивают величину эффективности реакции амплификации, а также достоверность аппроксимации (R2). На основе разработанной квадратичной модели рассчитывают значение концентрации А-антигена штамма «ВГНКИ» CAV-1 в неинактивированном сырье для культуральных вакцин.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Получение положительного контрольного образца для выявления зависимости между циклом количественной оценки и концентрацией А-антигена штамма «ВГНКИ» CAV-1 в неинактивированном сырье для культуральных вакцин.
Для получения положительного контрольного образца проводили репродукцию штамма «ВГНКИ» CAV-1 в монослойной перевиваемой клеточной линии почки кошки CRFK до получения 95-100% поражения клеток в течение 72 ч.
Полученную вируссодержащую суспензию после культивирования подвергали центрифугированию при 2000 g в течение 10 минут. Супернатант отбирают для последующих исследований. Проводили ультрацентрифугирование в ступенчатом градиенте хлорида цезия (CsCl) (15-25%) в соответствии с протоколом, описанным Dietzschold (1996) [10] при 60000 g в течение 2 ч при температуре 15±1°С. Опалесцирующий слой отбирали в отдельный пенициллиновый флакон, переносят в центрифужные пробирки, доливали объем пробирок с помощью 1/15 М фосфатного буферного раствора. Осаждали А-антиген для очищения от остатков хлористого цезия с помощью центрифугирования при 60 000 g в течение 1 ч при 15±1°С. Полученный осадок растворяли в необходимом количестве буферного 1/15 М фосфатного буферного раствора.
В готовой суспензии определяли концентрацию А-антигена штамма «ВГНКИ» CAV-1 с помощью спектрометрического метода (прототип). По данным анализа прототипным способом - концентрация А-антигена штамма «ВГНКИ» CAV-1 составляла 4840 мкг/мл. Проводили вертикальный белковый гель-электрофорез в полиакриламидном геле, содержащем додецилсульфат натрия, для оценки степени чистоты положительного контрольного препарата. Из результатов гель-электрофореза следует, что получен чистый препарат А-антигена штамма «ВГНКИ» CAV-1. Из данного препарата с помощью 1/15 М фосфатного буферного раствора приготовили положительный контрольный образец с концентрацией А-антигена штамма «ВГНКИ» CAV-1 штамма «ВГНКИ» 8,0 мкг/мл. Таким образом, получили охарактеризованный положительный контрольный образец, который вместе с исследуемыми пробами использовали в дальнейшей работе.
Пример 2. Выражение функции зависимости концентрации А-антигена штамма «ВГНКИ» CAV-1 в сырье для изготовления культуральных вакцин и цикла количественной оценки.
Для выражения функции зависимости концентрации А-антигена штамма «ВГНКИ» CAV-1 в сырье для изготовления культуральных вакцин и цикла количественной оценки составляли контрольную панель положительных стандартов А-антигена штамма «ВГНКИ» CAV-1, в качестве которых использовали очищенные препараты со следующими концентрациями аналита: 0,01; 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0; 8,0 мкг/мл. В качестве отрицательного контроля применяли суспензию клеток линии CRFK, не контаминированную микроорганизмами.
Из всех стандартных положительных и отрицательного контролей, а также тестируемых проб промышленного сырья выделяли нуклеиновую кислоту, проводили обратную транскрипцию и ПЦР в режиме реального времени, как описано выше.
Результаты ПЦР анализировали, оценивали и сравнивали графики накопления флуоресцентного сигнала по значениям циклов количественной оценки CQ-orf25, определенных с помощью пересечения пороговой линии и сигмоидной функции вида Fl=f×(CQ-orf25). Устанавливали зависимость между циклом количественной оценки и концентрацией А-антигена штамма «ВГНКИ» CAV-1 в сырье для культуральной вакцины в процессе построения графика квадратичной функции. Полученные данные отражены на фиг. 1 и выражены в виде квадратичной функции:
CA-Ag CAV-1=-0,008×CQ-orf252-0,3281×CQ-orf25+9,3506,
где CA-Ag CAV-1 - концентрация А-антигена штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки,
CQ-orf25 - цикл количественной оценки ампликонов таргетного участка orf25-гена
с высокой достоверностью аппроксимации (R2=0,9996) и эффективностью амплификации (E) 99,52 %, что соответствовало общепринятым требованиям, предъявляемым к молекулярно-биологическим тест-системам [18].
Пример 3. Апробация способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» CAV-1 в сырье для культуральных вакцин по данным цикла количественной оценки для ампликонов целевого участка orf25-гена.
Для анализа использовали 6 суспензий культурального CAV-1 производственного штамма «ВГНКИ» со следующими концентрациями А-антигена: 0,65; 1,55; 3,10; 4,20; 5,65; 7,83 мкг/мл, соответственно (пробы № 1-6). В качестве положительного контроля применяли суспензию А-антигена штамма «ВГНКИ» CAV-1 с концентрацией аналита 8,00 мкг/мл. Отрицательным контролем служила суспензия клеток линии CRFK, не контаминированную микроорганизмами. Испытуемые пробы и контрольные образцы исследовали в трех повторностях. Все этапы исследования проводили, как представлено выше.
По результатам исследования определили, что средние значения циклов количественной оценки для проб № 1-6 составляли 28,41±0,01, 25,30±0,01, 20,16±0,02, 16,43±0,01, 11,66±0,01, 4,65±0,01, соответственно. Пользуясь разработанной квадратичной функцией, рассчитали средние значения концентрации А-антигена штамма «ВГНКИ» CAV-1 для проб № 1-6, которые составили 0,67; 1,56; 3,06; 4,18; 5,63; 7,84 мкг/мл, соответственно (различия не существенны, n=5, p<0,005). Для положительного контроля значение CQ-orf25 составило 4,15±0,01, что соответствовало концентрации А-антигена штамма «ВГНКИ» CAV-1, равной 8,00 мкг/мл. Для отрицательного контроля логистическая кривая не была сформирована, что означало отсутствие вируса CAV-1 в данном контроле.
Таким образом, разработанный способ позволяет опосредованно определять концентрацию А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена.
Пример 4. Определение степени достоверности способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена.
Для подтверждения степени достоверности использовали 405 суспензий культурального вируса гепатита собак производственного штамма «ВГНКИ» с концентрациями А-антигена 0,01-8,00 мкг/мл. Анализ проводили, как описано выше, в трех повторностях.
Интерпретацию результатов проводили, пользуясь разработанной квадратичной функцией, представленной выше, с получением значений концентрации А-антигена для каждой из 405 проб. Для положительного контроля значение цикла количественной оценки составило 4,15±0,01, что соответствовало концентрации А-антигена штамма «ВГНКИ» CAV-1, равному 8,00 мкг/мл. Для отрицательных контролей сигмоида не была сформирована, что означало отсутствие в нем CAV-1.
Данные, полученные с помощью разработанного способа (табл. 5), коррелировали со значениями стандартов на 99,75-100,00% для 8,0-5,0 мкг/мл (n=81), на 99,54-99,85% для 4,9-2,0 мкг/мл (n=81), на 98,74-99,85% для 1,9-0,3 мкг/мл (n=81), на 97,56-99,45% для 0,29-0,01 мкг/мл (n=81), на 95,65-97,60% для концентрации менее 0,01 мкг/мл (n=81).
Аналитическая чувствительность составила не менее 0,01 мкг/мл с достоверностью определения концентрации А-антигена штамма «ВГНКИ» CAV-1, равно 97,56%. Таким образом, полученные результаты свидетельствовали о высокой степени точности разработанного способа опосредованного определения концентрации А-антигена штамма «ВГНКИ» CAV-1 в сырье для культуральных вакцин по данным цикла количественной оценки для ампликонов целевого участка orf25-гена.
Пример 5. Определение специфичности разработанного способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена.
Для исследования специфичности разработанного способа (предлагаемое изобретение), исследовали суспензии вируса ящура серотипа О, вирусов возбудителей парвовирусного энтерита собак и коронавируса собак. Количество инфекционных доз вирусов в суспензиях составляло не менее 4,0 lg ТЦД50/см3 или 4,0 lg ККИД50/см3. Исследования проводили в 5 повторностях.
Этапы исследования проводили, как описано выше. Для проб, содержащих другие вирусы, не наблюдалось формирования графиков экспоненты, и они не выходили за пороговый уровень флуоресцентного сигнала (0,005 у.е.). Таким образом, разработанный способ является специфичным по отношению к возбудителю инфекционного гепатита собак и может быть использован для опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена.
Пример 6. Определение диагностических показателей разработанного способа опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена.
Для определения диагностической чувствительности разработанного способа анализировали 385 культуральных суспензий вакцинного штамма «ВГНКИ» CAV-1 с разными значениями концентрации А-антигена (0,01-8,00 мкг/мл). Данные пробы являлись заведомо положительными. Постановку обратной транскрипции и ПЦР в режиме реального времени проводили, как отражено выше. С помощью разработанного способа (предлагаемое изобретение) определили, что из 385 исследуемых образцов в 383 пробах концентрация определена верно, в 2 - отличия были существенными (концентрация 0,02 мкг/мл).
Для исследования специфичности метода тестировали 219 отрицательных суспензий клеток линии CRFK, не содержащих CAV-1. В результате исследования с помощью разработанного способа (предлагаемое изобретение) определили, что все 219 проб были отрицательными. Пользуясь представленными выше статистическими методами анализа определили, что в 95%-ном доверительном интервале диагностическая чувствительность (DSe) составила 98,15-99,94%, диагностическая специфичность (DSp) - 98,33-100,00%, k-критерий - 0,991; общая точность (DAc) - 98,81-100,00%.
Основными преимуществами предлагаемого изобретения является сокращение времени проведения анализа промышленного сырья для изготовления культуральных вакцин против CAV-1 по определению концентрации А-антигена штамма «ВГНКИ» CAV-1 вируса до 3 часов (в 16 раз быстрее по сравнению с прототипом); исключение вероятности контаминации; повышение аналитической, диагностической чувствительности и специфичности анализа; исключение фактора субъективности получаемых результатов за счет использования приборного обеспечения для детекции результатов; повышение достоверности проводимого анализа благодаря установлению зависимости между концентрацией А-антигена штамма «ВГНКИ» CAV-1 и циклом количественной оценки ампликонов целевого участка orf25-гена, представленной в виде квадратичной функции:
CA-Ag CAV-1=-0,008×CQ-orf252-0,3281×CQ-orf25+9,3506
где CA-Ag CAV-1 - концентрация А-антигена штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки,
CQ-orf25 - цикл количественной оценки ампликонов таргетного участка orf25-гена,
с высокой достоверностью аппроксимации - R2=0,9996 и эффективностью амплификации E= 99,52 %.
Предложенная модель позволяет быстро опосредованно определять концентрацию А-антигена штамма «ВГНКИ» CAV-1 в сырье при изготовлении культуральных вакцин по данным цикла количественной оценки для ампликонов целевого участка orf25-гена.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Способ опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена»:
1. Buonavoglia C, Martella V. Canine respiratory viruses. Vet Res. 2007; 38: 355-373.
2. Erles K, Shiu KB, Brownlie J. Isolation and sequence analysis of canine respiratory coronavirus. Virus Res 2007; 124: 78-87.
3. Schoehn G, El Bakkouri M, Fabry CM et al Three-dimensional structure of canine adenovirus serotype 2 capsid. J Virol 2008; 82: 3192-203.
4. Carlton WW, McGavin MD. Thomson's Special Veterinary Pathology. St. Louis: Mosby, 1995; 125-195.
5. Damián M, Morales E, Salas G, Trigo FJ. Immunohistochemical detection of antigens of distemper, adenovirus and parainfluenza viruses in domestic dogs with pneumonia. J Comp Pathol 2005; 133: 289-293.
6. Benetka V, Weissenböck H, Kudielka I, Pallan C, Rothmüller G, Möstl K. Canine adenovirus type 2 infection in four puppies with neurological signs. Vet Rec 2006; 158: 91-94.
7. Yoon SS, Park JW, Jean YH, Kim HJ, Han B, Han HR. Prevalence of lymphocyte nuclear pockets in Holstein-Friesian dairy cattle infected with bovine leukemia virus in Korea. Asian-Aust J Anim Sci 2005; 18: 879-883.
8. Hu RL, Huang G, Qiu W, Zhong ZH, Xia XZ, Yin Z. Detection and differentiation of CAV-1 and CAV-2 by polymerase chain reaction. Vet Res Commun 2001; 25: 77-84.
9. Ditchfield J, Macpherson LW, Zbitnew A. Association of Canine Adenovirus (Toronto A 26/61) with an Outbreak of Laryngotracheitis (“Kennel Cough”): A Preliminary Report. Can Vet J 1962; 3: 238-47.
10. Yoon KB, Kang MI, Park NY, Han DU. Seroepidemiological survey on canine distemper, canine parvovirus, canine coronavirus, canine adenovirus type-2, canine parainfluenzavirus of dogs by indirect immunofluorescent test. Korean J Vet Res 1995; 35: 75-85.
11. Chvala S, Benetka V, Möstl K, Zeugswetter F, Spergser J, Weissenböck H. Simultaneous canine distemper virus, canine adenovirus type 2, and Mycoplasma cynos infection in a dog with pneumonia. Vet Pathol 2007; 44: 508-12.
12. Deiman B., van Aarle P., Sillekens P. Characteristics and applications of nucleic acid sequence based amplification // Mol. Biotech. - 2002. - Vol. 20. - P. 163-179.
13. Sooknanan R., van Gemen B., Malek L. Nucleis acid sequence-based amplification // Molecular methods for virus detection-London: Academic press, 1995. - P. 261-285.
14. SantaLucia J. J., Hicks D. The thermodynamics of DNA structural motifs // Annual Review of Biophysics and Biomolecular Structure: journal. - 2004. - Vol. 33. - P. 11-14.
15. Молекулярный олигокалькулятор. [Электронный ресурс] / URL: http://www.bio.bsu.by/molbiol/oligocalc.html. (Дата обращения: 14.08.2023).
16. Nicolas von Ahsen, Carl T. Wittwer, Ekkehard Schütz. Oligonucleotide melting temperatures under pcr conditions: nearest-neighbor corrections for Mg2+, deoxynucleotide triphosphate, and dimethyl sulfoxide concentrations with comparison to alternative empirical formulas (англ.) // Clinical Chemistry: journal. - 2001. - Vol. 47, no. 11. - P. 1956-1961.
17. SantaLucia J. J. A unified view of polymer, dumbbell, and oligonucleotide DNA nearest-neighbor thermodynamics (англ.) // Proceedings of the National Academy of Sciences of the United States of America: journal. - 1998. - Vol. 95, no. 4. - P. 1460-1465.
18. Vallat B. OIE Quality Standard and Guidelines for Veterinary Laboratories:Infectious Diseases. - 2nd ed. - Paris, France, 2008. - 67 p.
Состав реакционной смеси компонентов для обратной транскрипции и полимеразной цепной реакции в режиме реального времени для опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак с помощью предлагаемого изобретения
объем реакционной смеси - 25 мкл.
Дизайн оригинальных олигонуклеотидов для разработки способа (предлагаемое изобретение)
Физические, термодинамические параметры и температура плавления олигонуклеотидов для опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак (предлагаемое изобретение)
- с коррекцией концентрации солей
* - расчет показателей проводили без учета модификаций на 5'- и 3'-концах.
Временные и температурные режимы обратной транскрипции и реакции амплификации для опосредованного определения концентрации А-антигена штамма «ВГНКИ» CAV-1 в сырье для культуральных вакцин (предлагаемое изобретение)
Достоверность опосредованного определения концентрации А-антигена штамма «ВГНКИ» CAV-1 производственного штамма «ВГНКИ» в сырье для культуральных вакцин (предлагаемое изобретение) (n=3 для каждой пробы)
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing SYSTEM "ST26SequenceListing_V1_3.dtd"
PUBLIC "-//WIPO//DTD Sequence Listing 1.3//EN">
-<ST26SequenceListing productionDate="2024-05-03"
softwareVersion="2.1.2" softwareName="WIPO Sequence" fileName="CAV-1
A-antigen.xml" dtdVersion="V1_3">
-<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-08-30</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>538</ApplicantFileReference>
-<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-08-30</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ "Федеральный центр охраны
здоровья животных" (ФГБУ "ВНИИЗЖ")</ApplicantName>
<ApplicantNameLatin>Federal State-Financed Institution Federal Centre
for Animal Health (FGBI ARRIAH)</ApplicantNameLatin>
<InventorName languageCode="ru">Доронин Максим
Игоревич</InventorName>
<InventorNameLatin>Doronin Maksim Igorevich </InventorNameLatin>
<InventionTitle languageCode="ru">Способ опосредованного определения
концентрации А-антигена производственного штамма «ВГНКИ» возбудителя
инфекционного гепатита собак в сырье для культуральных вакцин по
данным цикла количественной оценки при амплификации целевого участка
orf25-гена</InventionTitle>
<SequenceTotalQuantity>5</SequenceTotalQuantity>
-<SequenceData sequenceIDNumber="1">
-<INSDSeq>
<INSDSeq_length>1632</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
-<INSDSeq_feature-table>
-<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1632</INSDFeature_location>
-<INSDFeature_quals>
-<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
-<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CAV-1</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggggaggacacgaagtgctctacctgcaaattttgaccccgtgtatccat
atgacgccccaaaaccatccactcaaccccctttttttaatgatagaaaaggtctcactgaatcatcccc
cggaactctggctgtgaatatctcgcctccactaaccttctctaacctaggcgcgatcaagctttccacg
ggtgccggactcatcctcaaagagggaaaattagaagccaacataggaccgggtcttaccacaaatcaag
aaggacaaatcactgttgaaaaagacagtgacggcctaacattcacttcccccctacacaagattgacaa
caccgtatctctaagcataggcgaagggttagaagatgaaagtggcacactcaaagtgaatttccctagt
cccccaccccctctactattttcccctccacttgcagaggcggggggtactgtttcactacccttgcagg
agtccatgcaagtaactgaaggaaagctcggcgtaaagcctaccacctactctccgccccttcaaaaaac
tgaccagcaagtaagcctgcgcgtaggtccgggtctcaccgtactaaacggacaattgcaagcagttcaa
cctccagcaacaacctacaaggagcctctcttagaaactgagaactctgtttctcttaaagtaggtgccg
gccttgccgtgcaggatggagccctagtggcaacccctccaaacgtcaccttttccgcacccctagaaaa
aaatggaaatgcagtgtcagtgcgcgtaggcgcgggcttatctatacagggtaatgccttagtggccaca
acctccccaaccttgaccttcgcctatccattgattaagaataacaaccatataactctaagtgctggga
gtggcttaagagtatccggaggtagccttactgtggccactggacctggactttcccatataaatggaac
aatagctgctgtaataggcgcaggtttaaaattcgaaaacaatgccattcttgcaaaattaggcaatggt
ctaaccatcagggatggcgccattgaagcagtggcaccacaaccctcatttacccctgtaactctatgga
ctggacctgatccaaacgttaacgcctcaattaatggcactccggtaattagatcatttatatcattaac
tagagacagtaacttagtcacagtcaatgctagctttactggagaaggaagctatcaatcagtgagccct
acccaatctcaattcagcttaattctagaatttaaccagtttggacagctaatgtccacagggaacctta
attccactaccacttggggagaaaaaccctggggcaataacactgtacaggtacaaccaagtcacacctg
gaaactatgcatgcctaacagagaagtgtactccacccccgccgctacccttaccagttgtggactaaac
agtattgcacatgacggtgcccccaacagaagtattgactgcatgctaattataaacaaactagctggcg
ctgcaacttacactctcacatttagatttttaaattttaacaaactaagctcaagtaccgtgtttaagac
tgatgtattaaccttcacctatgtgggggaacaatttgcg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
-<SequenceData sequenceIDNumber="2">
-<INSDSeq>
<INSDSeq_length>544</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
-<INSDSeq_feature-table>
-<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..544</INSDFeature_location>
-<INSDFeature_quals>
-<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
-<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CAV-1</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MGRTRSALPANFDPVYPYDAPKPSTQPPFFNDRKGLTESSPGTLAVNISPPL
TFSNLGAIKLSTGAGLILKEGKLEANIGPGLTTNQEGQITVEKDSDGLTFTSPLHKIDNTVSLSIGEGLE
DESGTLKVNFPSPPPPLLFSPPLAEAGGTVSLPLQESMQVTEGKLGVKPTTYSPPLQKTDQQVSLRVGPG
LTVLNGQLQAVQPPATTYKEPLLETENSVSLKVGAGLAVQDGALVATPPNVTFSAPLEKNGNAVSVRVGA
GLSIQGNALVATTSPTLTFAYPLIKNNNHITLSAGSGLRVSGGSLTVATGPGLSHINGTIAAVIGAGLKF
ENNAILAKLGNGLTIRDGAIEAVAPQPSFTPVTLWTGPDPNVNASINGTPVIRSFISLTRDSNLVTVNAS
FTGEGSYQSVSPTQSQFSLILEFNQFGQLMSTGNLNSTTTWGEKPWGNNTVQVQPSHTWKLCMPNREVYS
TPAATLTSCGLNSIAHDGAPNRSIDCMLIINKLAGAATYTLTFRFLNFNKLSSSTVFKTDVLTFTYVGEQ
FA</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
-<SequenceData sequenceIDNumber="3">
-<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
-<INSDSeq_feature-table>
-<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
-<INSDFeature_quals>
-<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
-<INSDQualifier id="q3">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gccttctacatctagaagtgga</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
-<SequenceData sequenceIDNumber="4">
-<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
-<INSDSeq_feature-table>
-<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
-<INSDFeature_quals>
-<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
-<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgccattggagagacagagc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
-<SequenceData sequenceIDNumber="5">
-<INSDSeq>
<INSDSeq_length>23</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
-<INSDSeq_feature-table>
-<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..23</INSDFeature_location>
-<INSDFeature_quals>
-<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
-<INSDQualifier id="q5">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>agtgtcacttggatagactctaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---

Изобретение относится к области биотехнологии. Описан способ опосредованного определения концентрации А-антигена производственного штамма «ВГНКИ» возбудителя инфекционного гепатита собак в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена. Основными преимуществами предлагаемого изобретения является сокращение времени проведения анализа промышленного сырья для изготовления культуральных вакцин против CAV-1 по определению концентрации А-антигена штамма «ВГНКИ» CAV-1 вируса до 3 часов (в 16 раз быстрее по сравнению с прототипом); исключение вероятности контаминации; повышение аналитической, диагностической чувствительности и специфичности анализа; исключение фактора субъективности получаемых результатов за счет использования приборного обеспечения для детекции результатов; повышение достоверности проводимого анализа благодаря установлению зависимости между концентрацией А-антигена штамма «ВГНКИ» CAV-1 и циклом количественной оценки ампликонов целевого участка orf25-гена, представленной в виде квадратичной функции с высокими значениями достоверности аппроксимации и эффективности реакции амплификации.
2 з.п. ф-лы, 2 ил., 5 табл., 6 пр.
1. Способ опосредованного определения концентрации А-антигена вакцинного штамма «ВГНКИ» возбудителя инфекционного гепатита собак имеющего orf25-ген с SEQ ID NO: 1, в сырье для культуральных вакцин по данным цикла количественной оценки при амплификации целевого участка orf25-гена, предлагающий амплификацию специфического фрагмента orf25-гена кДНК штамма «ВГНКИ» возбудителя инфекционного гепатита собак с применением следующих разработанных специфичных олигонуклеотидных праймеров и молекулярного зонда:
CAV-F25222-праймер с дизайном GCCTTCTACATCTAGAAGTGGA
CAV-R25292-праймер с дизайном TGCCATTGGAGAGACAGAGC
CAV-P25254-FAM/RTQ-1-зонд с дизайном FAM-AGTGTCACTTGGATAGACTCTAA - RTQ-1,
и определение значений цикла количественной оценки с применением функции второй степени:
CА-Ag CAV-1 = -0,008 × CQ-orf252 - 0,3281 × CQ-orf25 + 9,3506
с высокой достоверностью аппроксимации R2 = 0,9996 и эффективностью амплификации Е=99,52%.
2. Способ по п. 1, отличающийся тем, что его аналитическая чувствительность составила не менее 0,01 мкг/мл с достоверностью определения концентрации А-антигена 97,56%, в 95%-ном доверительном интервале диагностическая чувствительность составила 98,15-99,94%, диагностическая специфичность – 98,33-100,00%, k-критерий – 0,991, общая точность – 98,81-100,00%.
3. Способ по п. 1, отличающийся тем, что с его применением сокращается время проведения анализа в 16 раз.
| Erles K, Shiu KB, Brownlie J | |||
| Isolation and sequence analysis of canine respiratory coronavirus | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Damián M, Morales E, Salas G, Trigo FJ | |||
| Immunohistochemical detection of antigens of distemper, adenovirus and parainfluenza viruses in domestic dogs with pneumonia | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ЧУМЫ, ИНФЕКЦИОННОГО ГЕПАТИТА, АДЕНОВИРУСНЫХ ИНФЕКЦИЙ И ПАРВОВИРУСНОГО ЭНТЕРИТА У СОБАК И СПОСОБ ПРОФИЛАКТИКИ ЧУМЫ, ИНФЕКЦИОННОГО ГЕПАТИТА, АДЕНОВИРУСНЫХ ИНФЕКЦИЙ И ПАРВОВИРУСНОГО ЭНТЕРИТА У СОБАК | 1991 |
|
RU2030917C1 |
Авторы
Даты
2024-07-30—Публикация
2023-10-18—Подача