(a) Область техники, к которой относится изобретение
Изобретение относится к способу генотипирования последовательности нуклеиновой кислоты с применением амплификации с использованием пары праймеров, включающих первый праймер, имеющий последовательность ДНК, гомологичную миниатюрному транспозируемому элементу, содержащему инвертированные повторы (MITE), и второй праймер, идентичный первому праймеру или отличный от него. Изобретение в целом относится к применению праймеров MITE в фингерпринтинге или при исследовании сцепления.
(b) Описание предшествующего уровня техники
После открытия McClintock транспозируемой системы элементов Ac/Ds (McClintock В. 1946. Maize genetics. Carnegie Inst. Wash. Yearbook 45:176-186; и McClintock В. 1947. Cytogenetic studies of maize and neurospora. Carnegie Inst. Wash. Yearbook 46:146-152) генетическая идентификация новых транспозируемых систем (семейств) элементов стала популярной областью генетических исследований растений (Peterson P.А. 1986. Mobile elements in maize. Plant Breeding Reviews 4:3-122), а также других организмов. За этим последовала молекулярная характеристика транспозируемых элементов и применение данных элементов в качестве средства для идентификации и выделения генов, особенно после клонирования локуса white с ретротранспозоном copia Drosophila (Bingham P.М., R. Lewis and G.M. Rubin. 1981. Cloning of DNA sequences from the white locus of D. melanogaster by a novel and general method. Cell 25:693-704) и молекулярной характеристики транспозируемого элемента Ас кукурузы (Pohlman R.F., N.V.Fedoroff and J.Messing. 1984. The nucleotide sequence of the maize controlling element Activator. Cell 37: 635-643) и En/Spm (Pereira A., Zs. Schwarz-Sommer, A. Gieri, I.Bertram, P.A.Peterson and H.Saedler. 1985. Genetic and molecular analysis of the Enhancer (En) transposable element system of Zea mays. EMBO J. 4:17-25). С этих пор исследования, связанные с транспозируемыми элементами, стали особенно привлекательными для биологических наук.
Как и в других областях биологических исследований, идентификация транспозируемых элементов была ускорена с помощью современных компьютерных технологий. Bureau et al. (Bureau Т.Е., Р.С.Roland and S.R.Wessler. 1996. A computer-based systematic survey reveals the predominance of small inverted-repeat elements in wild-type rice genes. Proc. Natl. Acad. Sci. 93: 8524-8529) применили данный подход для идентификации многочисленных членов нового семейства транспозируемых элементов. Данные элементы сходны с традиционными элементами, транспозируемыми посредством ДНК (в противоположность ретроэлементам, которые транспозируются через промежуточные продукты РНК, Boeke J.D., D.J.Garfinkel, С.A.Styles and G.R.Fink. 1985. Ту elements transpose through an RNA intermediate. Cell 40: 491-500), в том, что они обладают концевыми инвертированными повторами (TIRs). Однако в отличие от классических охарактеризованных генетически транспозируемых элементов, данные элементы являются небольшими по размеру и не характеризуются кодирующей способностью. Данные элементы рассматриваются как миниатюрные транспозируемые элементы, содержащие инвертированные повторы, или MITE (Bureau et al. выше).
Со времени введения метода анализа полиморфизма длины рестрикционных фрагментов (RFLP) (Bostein D., R.White, M.Skolnick and R.W.Davis. 1980. Construction of genetic linkage map in man using restriction fragment lenght polymorphism. Am. J. Hum. Genet. 32: 314-331) в качестве способа молекулярного картирования картирование генома и способы фингерпринтинга существенно улучшились, что доказывается развитием других новых способов, таких как анализ полиморфизма с помощью случайно амплифицированных ДНК (RAPD, Welsh J. and M. McClelland. 1990. Fingerprinting genomes using PCR with arbitrary primers. Nucleic Acids Res. 18: 7213-7218; Williams J.G.K., A.R.Kubelik, K.J.Livak, J.A.Rafalski and S.V.Tingey. 1990. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers. Nucleic Acids Res. 18: 6531-6535) и полиморфизм длины амплифицированных фрагментов (AFLP, Vos P., R.Hogers, M.Bleeker, M.Reijans, T. van de Lee, M.Homes, A.Frijters, J.Pot, J.Peleman, M.Kuiper and M.Zabeau. 1995. AFLP: a new technique for DNA fingerprinting. Nucleic Acid Res. 23: 4407-4414). Примененные недавно способы с использованием ретроэлементов (Sinnet D., J. - M.Deragon, L.R.Simard and D.Labuda. 1990. Alumorphs-human DNA polymorphisms detected by polymerase chain reaction using Alu-specific primers. Genomics 7: 331-334; and Nelson D.L., S.A.Ledbetter, L.Corbo, M.F.Victoria, R.Ramirez-Solis, T.D.Webster, D.H.Ledbetter and C.T.Caskey. 1989. Alu polymerase chain reaction: A method for rapid isolation of human specific DNA sequences from complex DNA sources. Proc. Natl. Acad. Sci. 86: 6686-6690) и повторов простых последовательностей (SSRs) (Litt M. and J.A.Luty. 1989. A hypervariable microsatellite revealed by in vitro amplification of a dinucleotide repeat within the cardiac muscle actin gene. Am. J. Hum. Genet. 44: 397-401; Tautz D. 1989. Hypervariability of simple sequences as a general source for polymorphic DNA markers. Nucleic Acids Res. 17: 6463-6471; and Weber J. L. and P. E. May. 1989. Abundant class of human DNA polymorphisms which can be typed using the polymerase chain reaction. Am. J. Hum. Genet. 44: 388-396.) явилось стадией создания новых приспособлений для картирования генома и фингерпринтинга.
Izvak et al. описали повторяющиеся элементы, названные Angel, которые характеризовались способностью образовывать шпилькообразные структуры. Их небольшой размер и способность к образованию вторичной структуры явились основанием для авторов обозначить их как MITE. Однако Angel не соответствует ни конкретному, ни общему определению MITE, как здесь обозначается, так как нет указаний на то, что к нему примыкает сайт-мишень дупликации (TSD) любого вида. Так как TDS являются отличительными чертами не только MITE, но фактически всех известных транспозируемых элементов, ясно, что Angel не должен быть обозначен ни как MITE, ни даже как транспозон.
Sinnett et al. описали способ, затрагивающий совершенно иной транспозируемый элемент, названный Alu. В целом транспозоны могут быть подразделены на два больших класса. Элементы класса I охватывают эндогенные ретровирусы, LTR-ретротраспозоны, LINE (длинные рассеянные ядерные элементы), SINE (короткие рассеянные ядерные элементы) и мобильные псевдогены. Alu представляет собой SINE. Элементы класса II включают MITE и другие транспозоны с концевыми инвертированными повторами. Alu не имеет концевых инвертированных повторов. Класс I перемещается посредством промежуточных продуктов РНК и действия обратной транскриптазы, тогда как элементы класса II перемещаются прямо в форме ДНК с помощью транспозазы, кодируемой элементом. MITE найдены у многих эукариот и прокариот. Alu найдены только у приматов. Очевидно, что Alu и MITE являются повторами, распределенными по геному их хозяев, и могут быть ассоциированы с генами. Alu-ПЦР подразумевает конструирование праймеров (более конкретно - двух) на основе их концевых последовательностей. 5'- и 3'-концевые последовательности различаются, и праймеры, как таковые, различаются по последовательности. ПЦР фрагментов от MITE до MITE включает праймер, сконструированный по их концевым инвертированным повторам. Следовательно, необходим только один праймер.
Методология маркирования полиморфизма длины рестрикционных фрагментов (RFLP) состоит из расщепления геномной ДНК рестрикционным ферментом, разделения фрагментов ДНК электрофорезом, переноса разделенных фрагментов ДНК на твердую подложку, состоящую из нейлоновой мембраны, для того, чтобы получить изображение геля на подложке, которое может быть использовано для экспериментов по гибридизации с известными последовательностями ДНК. Известной последовательностью ДНК может быть клонированная геномная последовательность, или последовательность кДНК, или конкретный продукт ПЦР. Данную последовательность ДНК (последовательность зонда) метят радиоактивными, флуоресцентными или окрашенными нуклеотидами. Результаты гибридизации проявляют при экспозиции твердой подложки либо с чувствительной рентгеновской пленкой, либо они могут быть выявлены прямо на подложке, когда окрашенные нуклеотиды используют для мечения зонда. Часто наблюдается одна или несколько полос ДНК в зависимости от происхождения последовательности зонда. Полиморфизм длины рестрикционных фрагментов визуализируют как различия между характером полос у разных генотипов, и они отражают различие в распределении сайтов рестрикции данным рестрикционным ферментом.
Методология маркирования полиморфизма случайно амплифицированными ДНК (RAPD) состоит в том, что короткие последовательности ДНК из 10 нуклеотидов применяют в качестве праймеров для проведения реакции ПЦР с использованием в качестве матрицы суммарной геномной ДНК. Нуклеотидный состав олигонуклеотидных праймеров выбирают произвольно без какого-либо учета существующей последовательности ДНК. Продукты ПЦР визуализируют непосредственно после электрофореза в агарозном геле. Обычно в качестве продукта амплификации генома эукариот можно выявить от одного до 15 амплифицированных фрагментов ДНК. Полиморфизмы определяют непосредственно в агарозном геле после окрашивания в виде различий в параметрах амплификации между генотипами, и они отражают единичные нуклеотидные замены в праймере и вставки/делеции.
Методология маркирования полиморфизма длины амплифицированных фрагментов (AFLP) состоит из расщепления геномной ДНК рестрикционным ферментом, лигирования полученных фрагментов геномной ДНК с адапторной последовательностью (короткая двухцепочечная последовательность ДНК, которая имеет на одном конце сайт с той же последовательностью, что и сайт, образованный ферментом рестрикции, применяемым для расщепления геномной ДНК) и проведения реакции ПЦР с применением в качестве праймера олигонуклеотида, гомологичного адапторной последовательности. Результаты амплификации визуализируют непосредственно в акриламидном геле после окрашивания в виде нескольких (до 60) фрагментов ДНК. Полиморфизмы выглядят как различия в присутствии/отсутствие конкретных амплифицированных фрагментов ДНК в различных генотипах, и они отражают, подобно RFLP, различия в распределении сайтов рестрикции данным рестрикционным ферментом, но в отношении подгруппы геномной ДНК.
Методология маркирования повторов простых последовательностей (SSR) состоит в применении повторов простых последовательностей (таких как (ТА)n, (CAGA)n, (GA)n и т.д., причем "n" обычно варьирует между 5 и 18) в качестве зондов для идентификации геномных клонов из генной библиотеки организма, несущего данные мотивы простой последовательности. Выделенные клоны затем секвенируют и конструируют пару ДНК-праймеров, прилегающих к SSR, для ПЦР-амплификации SSR и прилегающих последовательностей ДНК. Полиморфизмы выглядят как один или очень небольшое количество амплифицированных фрагментов ДНК, варьирующих по одному или нескольким нуклеотидам в разных генотипах, и они отражают различия в количестве повторов ("n") простой последовательности.
Маркеры ДНК на основе ретроэлементов и других больших повторяющихся элементов состоят из сконструированных праймеров, окружающих элемент, и полиморфизмы находят, когда элемент присутствует или отсутствует в различных генотипах.
Существуют другие типы маркеров ДНК, но они представляют собой сочетание типов маркеров ДНК, описанных выше. Например, CAP представляют собой рестриктированные амплифицированные полиморфные ДНК, где продукт ПЦР расщепляется рестрикционными ферментами после амплификации с помощью ПЦР. Могут быть сконструированы пары праймеров из повторяющегося элемента и праймера AFLP или из различных повторяющихся элементов.
Крайне желательным должно быть получение новой всеобъемлющей последовательности нуклеиновой кислоты для применения в исследованиях сцепления и изучении фингерпринтинга.
Крайне желательным должно быть также получение способа определения полиморфизмов у эукариот с применением данной новой первазивной последовательности нуклеиновой кислоты.
КРАТКОЕ ОПИСАНИЕ СУЩЕСТВА ИЗОБРЕТЕНИЯ
Одной из целей настоящего изобретения является представление новой первазивной последовательности нуклеиновой кислоты для применения в исследованиях сцепления и изучении фингерпринтинга.
Другой целью настоящего изобретения является представление способа определения полиморфизмов у эукариот с применением данной новой первазивной последовательности нуклеиновой кислоты.
В соответствии с настоящим изобретением представляется способ определения полиморфизмов интересующей последовательности нуклеиновой кислоты. Способ включает стадии:
a) амплификации указанной интересующей последовательности нуклеиновой кислоты с первым праймером, гомологичным миниатюрному транспозируемому элементу, содержащему инвертированные повторы (MITE), его фрагменту или его производному, и со вторым праймером, где указанный первый праймер отжигается с указанным MITE, когда он присутствует в указанной интересующей последовательности нуклеиновой кислоты, и указанный второй праймер является идентичным или неидентичным первому праймеру и гомологичным или негомологичным последовательности MITE;
b) разделения фрагментов интересующей последовательности нуклеиновой кислоты, амплифицированных на стадии а); и
c) анализа фрагментов, полученных на стадии b), с помощью сравнения с контрольными фрагментами, полученными после амплификации последовательности нуклеиновой кислоты с, по меньшей мере, одним праймером, для определения различий в последовательности нуклеиновой кислоты между фрагментами, полученными на стадии b), и контрольными фрагментами, в результате чего различие указывает на полиморфизм интересующей нуклеиновой кислоты.
В соответствии с настоящим изобретением представляется также способ генотипирования эукариота. Способ включает стадии:
a) амплификации указанной последовательности нуклеиновой кислоты указанного эукариота с первым праймером, гомологичным MITE, его фрагменту или его производному, и со вторым праймером, где указанный первый праймер отжигается с указанным MITE, когда он присутствует в указанной последовательности нуклеиновой кислоты указанного эукариота, и указанный второй праймер является идентичным или неидентичным первому праймеру и гомологичным или негомологичным последовательности MITE;
b) разделения фрагментов, полученных амплификацией последовательности нуклеиновой кислоты на стадии а); и
c) сравнения фрагментов, полученных на стадии b), с фрагментами контрольной последовательности нуклеиновой кислоты указанного эукариота, в результате чего идентичность фрагментов стадии b) с фрагментами контрольной последовательности нуклеиновой кислоты указывает на то, что указанный эукариот имеет указанную последовательность нуклеиновой кислоты.
Дополнительно в соответствии с настоящим изобретением представляется способ фингерпринтинга эукариотического организма. Способ включает стадии:
a) амплификации последовательности нуклеиновой кислоты эукариотического организма с первым праймером, гомологичным MITE, его фрагменту или его производному, и со вторым праймером, где указанный первый праймер специфичен для последовательности MITE, и указанный второй праймер является идентичным или неидентичным первому праймеру и гомологичным или негомологичным последовательности MITE; и
b) разделения фрагментов, полученных амплификацией последовательности нуклеиновой кислоты на стадии а), в результате чего выявляют совместно разделяемые фрагменты, характеризующие эукариотический организм.
Предпочтительно стадию амплификации выполняют с помощью процедуры ПЦР. Первый праймер происходит из консенсусной последовательности элемента MITE. Более предпочтительно, чтобы первый праймер имел последовательность нуклеиновой кислоты, происходящую из консенсусной последовательности Tourist, Stowaway, Barfly или Mariner.
Наиболее предпочтительно, чтобы первый праймер имел последовательности нуклеиновой кислоты, выбранные из группы, состоящей из SEQ ID NO: I, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34 и SEQ ID NO: 35.
Второй праймер необязательно является праймером, выбранным из группы, состоящей из специфичного для MITE праймера, праймера на основе последовательности SSR, праймера на основе последовательности ретроэлемента, праймера на основе последовательности клонированной нуклеиновой кислоты, определяющей RFLP, праймера на основе случайной геномной последовательности, праймера на основе векторной последовательности и праймера на основе последовательности гена.
В соответствии с настоящим изобретением предлагается также применение полиморфизма как составляющей способа настоящего изобретения для прослеживания потомства эукариотического организма, для определения гибридности эукариотического организма, для идентификации вариаций сцепленных фенотипических признаков эукариотического организма, для идентификации индивидуальных потомков от скрещивания, где указанные потомки имеют желаемый генетический вклад от родителя-донора и/или родителя-реципиента, или в качестве генетических маркеров для создания генетических карт.
Способ настоящего изобретения может быть применен для выделения геномной последовательности ДНК, прилегающей к кодирующим или некодирующим последовательностям генов. Геномная последовательность ДНК, прилегающая к кодирующей последовательности гена, предпочтительно является промотором или регуляторной последовательностью.
Далее, в соответствии с настоящим изобретением представляется фрагмент нуклеиновой кислоты или его производное, полученный амплификацией последовательности нуклеиновой кислоты эукариотического организма, с, по меньшей мере, одним праймером, гомологичным MITE, для применения в качестве зонда для последовательности нуклеиновой кислоты.
Фрагмент нуклеиновой кислоты или его производное может быть применен для отбора с помощью маркеров (MAS), клонирования на основе картирования, сертификации гибридов, фингерпринтинга, генотипирования и в качестве аллель-специфичного маркера.
Эукариотом или эукариотическим организмом предпочтительно является растение, животное или грибы.
Также в соответствии с настоящим изобретением представляется способ картирования генома, который включает стадии:
a) фракционирования генома эукариотического организма;
b) клонирования таким образом фракционированного генома в вектор;
c) тестирования таким образом клонированных векторов путем амплификации ДНК в таким образом клонированных векторах с применением первого праймера, гомологичного миниатюрному транспозируемому элементу, содержащему инвертированные повторы (MITE), и второго праймера, причем первый праймер способен гибридизоваться с миниатюрным транспозируемым элементом, содержащим инвертированные повторы (MITE), на ДНК, а второй праймер является идентичным или неидентичным первому праймеру и гомологичным или негомологичным последовательности MITE;
d) разделения продуктов удлинения на стадии амплификации по размеру;
e) измерения параметров продуктов удлинения; и
f) реконструирования генома из перекрывающихся параметров.
В соответствии с настоящим изобретением предлагается также способ картирования полиморфного генетического маркера, который включает:
a) получение смеси расщепляемых рестрикционными ферментами последовательностей нуклеиновой кислоты из биологического материала от эукариотического организма;
b) амплификацию смеси расщепляемых рестрикционными ферментами последовательностей нуклеиновой кислоты с применением первого праймера, гомологичного миниатюрному транспозируемому элементу, содержащему инвертированные повторы (MITE), его фрагменту или его производному, и второго праймера, где первый праймер специфичен для MITE, а второй праймер является идентичным или неидентичным первому праймеру и гомологичным или негомологичным последовательности MITE;
c) идентификацию набора дифференциально амплифицированных последовательностей нуклеиновой кислоты в смеси; и
d) картирование, по меньшей мере, одной из дифференциально амплифицированных последовательностей нуклеиновой кислоты в отношении уникального генетического полиморфизма, обеспечивая тем самым маркер для полиморфизма.
Система маркеров на основе MITE настоящего изобретения отличается от любого из предшествующих подходов в данной области, является намного более простой, более информативной и воспроизводимой.
Для целей настоящего изобретения ниже определены следующие термины.
Термин "MITE" предназначен для обозначения миниатюрного транспозируемого элемента, содержащего инвертированные повторы. В действительности, MITE представляют собой суперсемейство транспозируемых элементов. Данные элементы имеют менее 3 тысяч пар нуклеотидов в длину, содержат совершенные или вырожденные концевые инвертированные повторы, к ним примыкает сайт-мишень дупликации, меньший, чем или равный 10 парам оснований, и они представлены в геноме в количестве от умеренного до большого.
MITE предпочтительно имеют менее чем одну тысячу пар оснований в длину, содержат совершенные или вырожденные концевые инвертированные повторы, к ним примыкают сайты-мишени дупликации ТА или ТАА, и они представлены в геноме в количестве от умеренного до большого.
Термин "праймер на основе MITE" предназначен для включения праймера, включающего MITE или его фрагмент, и праймера, который является производным MITE, и праймера, который узнает MITE, гибридизуется или отжигается с ним.
Термин "генетический маркер на основе MITE" (MGM) предназначен для обозначения маркера, гибридизующегося с элементом MITE, или маркера, продуцируемого при амплификации последовательности нуклеиновой кислоты с помощью ПЦР с применением, по меньшей мере, одного праймера MITE и, необязательно, другого праймера MITE или праймера на основе последовательности SSR, последовательности ретроэлемента, последовательности RFLP или генной последовательности.
Термин "полиморфизм внутри MITE" "(IMP)" относится к подтипу MGM и предназначен для обозначения маркера, полученного амплификацией последовательности нуклеиновой кислоты с помощью ПЦР с применением одного праймера MITE или двух различных праймеров MITE.
Термин "эукариот" или "эукариотический организм" предназначен для обозначения растений, животных и грибов.
Термин "гомологичный" предназначен для применения в контексте гомологичной последовательности нуклеиновой кислоты, т.е. последовательность нуклеиновой кислоты, которая должна гибридизоваться в жестких условиях с комплементом последовательности нуклеиновой кислоты, к которой он является гомологичным.
КРАТКОЕ ОПИСАНИЕ ФИГУР
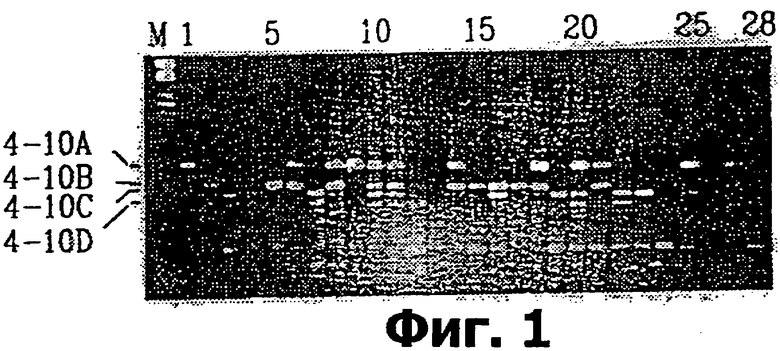
На фигуре 1 показаны продукты ПЦР сочетания праймеров ТЕМ-4/-10 или одного праймера Т ЕМ-10 в агарозном геле;
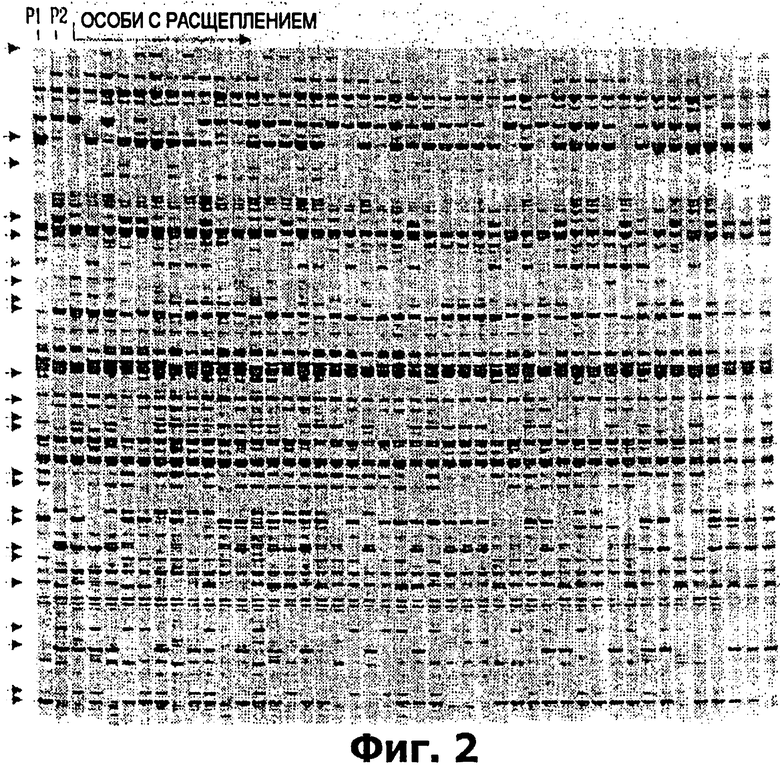
на фигуре 2 показана часть результатов ПЦР праймера ТЕМ-1, меченного флуоресцентной краской IRD700™, проявленного в 6% акриламидном геле с помощью автоматической системы LI-COR 4200 в соответствии с предпочтительным вариантом осуществления изобретения, где Р1 является родительским Н. vulgare, Lina (P1), P2 является родительским Н. spontaneum, Canada Park (P2), а особи с расщеплением происходят в результате скрещивания между популяциями Lina и Canada Park DH (двойной гаплоид);
на фигуре 3 показаны результаты ПЦР с праймерами ТЕМ-3/-10 с более продолжительным временем удлинения в течение 1 минуты и 15 секунд в агарозном геле;
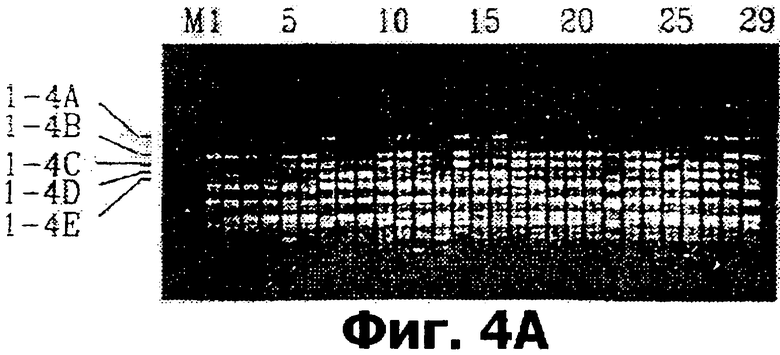
на фигурах 4А и 4В показаны результаты ПЦР в агарозном геле с праймерами ТЕМ-1/-4, выявляющие различные продукты с 60-секундным временем удлинения и с 75-секундным временем удлинения;
на фигуре 5 показана карта сцепления популяции Н. vulgare cv. Line x H. spontaneum Canada Park, демонстрирующая распределение локусов IMP, определенных с помощью праймеров ТЕМ-1 и ТЕМ-10;
на фигуре 6 проиллюстрирован фингерпринтинг 27 линий Hordeum в агарозном геле;
на фигуре 7 показана часть результатов фингерпринтинга 27 линий Hordeum с праймером ТЕМ-1, меченным флуоресцентной краской IRD700™;
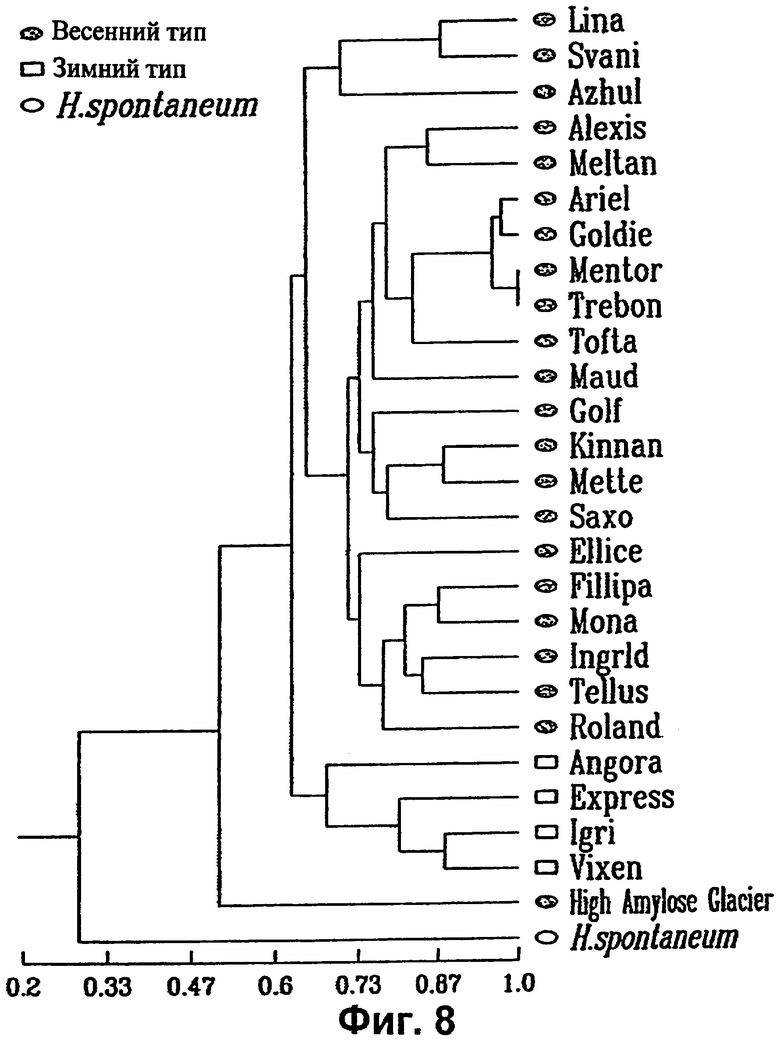
на фигуре 8 показана дендрограмма, полученная по результатам образования кластеров UPGMA матрицы генетического сходства 27 сортов, на основе параметров полос, полученных с праймерами ТЕМ-1 и ТЕМ-10.
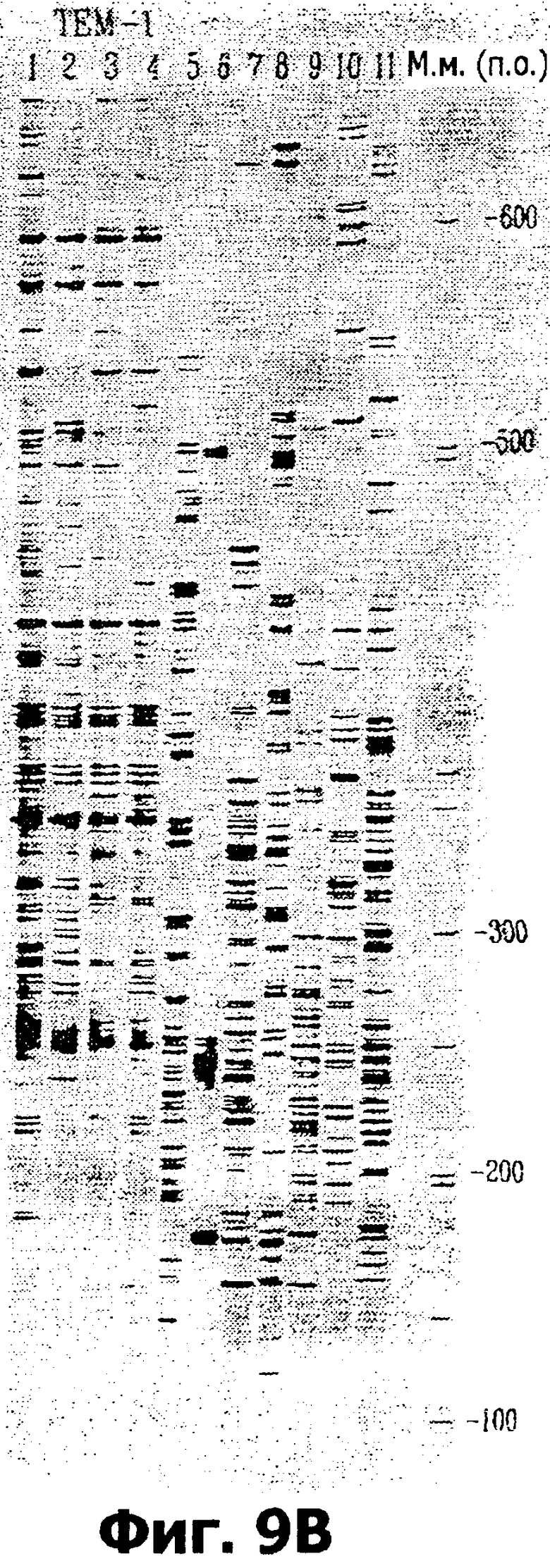
На фигурах 9А, 9В, 9С и 9D проиллюстрировано универсальное применение маркеров на основе MITE у различных эукариот, где продемонстрированы профили амплификации ПЦР одиннадцати различных источников ДНК с применением праймера Master ТЕМ-12 (фиг.9А); праймера Master ТЕМ-1 (фиг.9В); праймера Master ТЕМ-10 (фиг.9С) и праймера Master ТЕМ-11 (фиг.9D).
Фигуры 10А, 10В, 10С, 10D и 10Е являются примером результатов, полученных с применением праймера Master (ТЕМ-1) и соответствующего ему якорного праймера.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении представлен новый генетический маркер, обозначаемый здесь как основанный на MITE генетический маркер (MGM). Данным новым способом с применением ПЦР выявляют полиморфизмы с использованием праймеров, сконструированных на основе широко представленных транспозируемых элементов, MITE. Пригодность данных праймеров на основе транспозируемых элементов определяли путем изучения параметров расщепления в популяции ячменя для картирования с удвоенным гаплотипом и при генотипировании 26 сортов Hordeum vulgare и одной линии Hordeum spontaneum. В соответствии с настоящим изобретением предлагается новый тип маркеров ДНК, обозначаемых здесь как основанные на MITE генетические маркеры, а также хромосомная локализация данных маркеров, их универсальность и мобильность, и результаты фингерпринтинга. Наконец, заявители обсуждают осуществимость и обобщение подходов MGM и IMP настоящего изобретения.
Преимущества и улучшения по сравнению с существующей технологией
Как упоминалось выше, члены MITE часто обнаруживают в состоянии с генами, и, таким образом, они не ограничены участками повторов. Данная первазивность MITE является чрезвычайно важной. Она указывает на то, что в большинстве эукариотических организмов практически любой участок генома может быть подвергнут амплификации с помощью IMP.
С помощью каждого отдельного праймера амплифицировалось в итоге 50-100 отдельных полос, что свидетельствует о присутствии большого числа копий MITE в геноме. В случае некоторых праймеров и 50-100 локусов на праймер скринингом может быть легко охвачен весь геном.
Праймер MITE может быть объединен с другими типами праймеров, таких как праймеры, специфичные для SSR, ретроэлементов, секвенированных RFLP, случайных геномных последовательностей, векторных последовательностей и генов. Это, несомненно, должно повышать возможности способа MGM настоящего изобретения.
Способ настоящего изобретения в сочетании с автоматизированной флуоресцентной системой генотипирования высокого разрешения LI-COR обеспечивает крайне высокую эффективность картирования ДНК и способов фингерпринтинга. Его преимущества в эффективности и разрешающей способности по сравнению с RAPD и RFLP очевидны, поскольку в одной реакции можно было определить значительно большее количество локусов. Анализы с помощью MGM и IMP просты, быстры и окупаемы. В отличие от анализа RAPD требуется значительно меньшее количество праймеров. В отличие от способов AFLP и RFLP, для MGM и IMP не требуется расщепление ферментами рестрикции или лигирование адаптера.
Техническое описание.
i) Растительные материалы
Примененная популяция для картирования состоит из 88 индивидуумов с удвоенным гаплотипом, полученных скрещиванием Hordeum vulgare сорта Lina и Н. spontaneum сорта Canada Park. Данную популяцию применяли для составления карты сцеплений, основанной преимущественно на маркерах RFLP.
Для экспериментов по фингерпринтингу применяли в общей сложности 27 сортов (смотри таблицу 1), включая 26 представителей Н. vulgare и одного представителя Н. spontaneum, Canada Park, которого использовали вместе с Lina в качестве родителей для создания популяции для картирования. Коллекция включала двухрядные и шестирядные типы. В состав двухрядных типов были включены как весенние, так и зимние сорта. Все 27 сортов предварительно применяли в исследовании генотипирования с помощью RFLP, и, следовательно, генетические отношения в данных сортах были известны на основании RFLP.
ii) Системы детекции ПЦР
Для сравнения разрешения и эффективности при идентификации полиморфизмов применяли две системы детекции.
Первая представляла собой стандартную агарозную систему детекции. В данной системе ПЦР проводили со стандартными праймерами (немечеными). Продукты ПЦР визуализировали в 2% агарозных гелях в присутствии или в отсутствие агарозы Nusieve (2/3 Nusieve : 1/3 обычной агарозы). Вторая представляла собой автоматическую систему секвенирования/генотипирования ДНК LI-COR. Праймеры для данной системы метили флуоресцентным красителем IRD700™ (LI-COR, Inc., Licoln, Nebraska). Продукты ПЦР визуализировали в 6% акриламидном денатурирующем геле в устройстве со стеклянными пластинами длиной 41 см. Электрофорез в геле проводили с помощью системы LI-COR 4200.
iii) ПЦР
В данной работе были созданы и оценены семь праймеров master (таблица 2) и их 3' якорных производных (таблица 3). Шесть праймеров master являлись праймерами MITE (ТЕМ-1, ТЕМ 2, ТЕМ-3, ТЕМ-10, ТЕМ-11 и ТЕМ-12), а ТЕМ-4 представлял собой сегмент консервативных последовательностей домена обратной транскриптазы (RT) нескольких Tyl/copia-подобных ретротранспозонов (Hirochika H. and Hirochika R. 1993. Tyl/copia group retrotransposons as ubiquitous components of plant genomes. Jpn. J. Genet. 68: 35-46). Праймеры master были вырожденными, поскольку в определенном положении были возможны более одного нуклеотида. Якорные праймеры представляли собой праймеры master с дополнительным нуклеотидом, добавленным к 3'-концу праймера master (таблица 3). Праймеры MITE разрабатывали на основе консенсусных последовательностей областей концевых инвертированных повторов (TIR) MITE каждой категории. Для создания праймеров применяли оба TIR. TEM-4 применяли только в сочетаниях с другими праймерами. Праймеры применяли как в системе детекции с агарозным гелем, так и в автоматической системе детекции LI-COR, за исключением того, что праймеры для последней метили флуоресцентным красителем.

Амплификацию ПЦР для системы детекции в агарозе проводили в объеме 25 мкл, содержащем 2,5 мМ MgCl2, 0,4 мМ dNTP, 1 мкМ каждого из праймеров и 0,625 единицы ДНК-полимеразы AmpliTaq™ (Perkin-Elmer). Применяли следующий профиль: стадия исходной денатурации 1 мин 30 сек при 94°С; затем 35 циклов по 30 сек при 94°С, 45 сек при 58°С и 1 мин при 72°С и конечное удлинение 5 минут при 72°С. Данный профиль применяли, если специально не указано другое. Во всех случаях, когда включали ТЕМ-1, применяли температуру отжига 60°С.
Амплификацию ПЦР для системы детекции LI-COR проводили при тех же условиях, что и в случае стандартной агарозной системы, за исключением того, что суммарный объем реакционной смеси составлял 20 мкл, и применяли 0,5 единицы ДНК-полимеразы AmpliTaq (Perkin-Elmer). Применяли тот же общий профиль (без изменения температуры для ТЕМ-1). Амплификацию ПЦР проводили в два этапа. Первый этап представляет собой предварительную амплификацию с немечеными праймерами на протяжении 35 циклов. Для второго этапа амплификации применяли аликвоту 3 мкл смеси предварительной амплификации. На втором этапе амплификации применяли меченый праймер в концентрации 0,1 мкМ (по сравнению с 1 мкМ немеченого праймера на первом этапе).
iv) Сбор данных и статистический анализ
а) Фингерпринтинг и анализ генетического сходства
Для каждой особи проводили оценку полиморфных и общих полос в виде их наличия (1), отсутствия (0) или утраты данных (9). Полученные данных "сырых" матриц применяли для создания матриц относительного генетического сходства (GS) с использованием измерения Nei и Li (Nei M. and W. Li. 1979. Mathematical models for studying genetic variation in terms of restriction endonucleases. Proc. Natl. Acad. Sci. 76: 5269-5273), 2nxy/(nх+ny), где nх и nу представляют собой количество полос на дорожках х и у, соответственно, а nху является количеством полос, имеющихся на обеих дорожках. Для расчета величин GS применяют как полиморфные, так и общие полосы.
На основе матриц GS с помощью способа арифметического среднего невзвешенных парных групп (UPGMA) строили дендрограммы. Строили объединенную дендрограмму, полученную анализом с двумя праймерами MITE (ТЕМ-1 и ТЕМ-10). Для сравнения матрикса генетического сходства, основанного на генетических маркерах на основе MITE, с матриксом генетического сходства тех же сортов, основанным на 313 полосах полиморфного маркера RFLM, применяли нормализованную статистику Mantel (Mantel N. А. 1967. The detection of disease clustering and a generalized regression approach. Cancer Res. 27: 209-220). Оценку значимости осуществляли сравнением наблюдаемой величины Z с распределением 1000 случайных перестановок матриц. Весь статистический анализ проводили с помощью программы NTSYS-pc (Rohlf f. J. 1994. NTSYS-pc numerical taxonomy and multivariate analysis system, version 1.80, Exeter Software, N. Y.).
b) Генетическое картирование
Локализацию основанных на MITE генетических маркеров, полученных с праймерами ТЕМ-1 и ТЕМ-10, определяли путем их картирования в рамках 71 маркеров RFLP, ранее использованных для создания карты Hordeum vulgare сорта Lina x H. spontaneum популяции Canada Park. Для картирования применяли группу из 88 особей данной популяции с удвоенным гаплотипом. Отношения расщепления анализировали с помощью χ2 анализа. Картирование проводили с помощью компьютерной программы MAPMAKER (Lander Е.S., P.Green, J.Abrahamson, A.Barlow, M.J.Daly, S.E.Lincoln and L.Newburg 1987. MAPMAKER: An interactive computer package for constructing primary genetic linkage maps of experimental and natural populations. Genomics 1:174-181). Генетические маркеры на основе MITE были связаны с группами сцепления с помощью двухточечного анализа с порогом LOD, равным 4, за исключением группы 7Н, которая дала две группы с этим порогом, и которые были привязаны на основании опубликованного расположения маркеров RFLP. Для расположения маркеров в пределах групп сцепления применяли многоточечный анализ с порогом LOD, равным 2.
РЕЗУЛЬТАТЫ
Для оценки последовательностей MITE с применением основанного на ПЦР способа настоящего изобретения были разработаны праймеры областей концевых инвертированных повторов (TIR), причем все праймеры были направлены в обратную сторону от TIR. Таким образом, ожидается, что любые последовательности, амплифицированные с данными праймерами, находятся между двумя соседними MITE в пределах поддающихся амплификации расстояний. Данные праймеры применяли отдельно или в сочетании с анализом расщепления, используя популяцию с удвоенным гаплотипом из 88 особей, полученных скрещиванием Hordeum vulgare сорта Lina и Н. spontaneum сорта Canada Park.
а) Амплификация с одиночными праймерами
Каждый из праймеров MITE давал в агарозном геле около 10 различных полос, причем 2-5 из них были полиморфными. Данные полиморфизмы четко различались у родителя Lina H.vulgare и родителя Canada Park H. spontaneum и преимущественно давали ожидаемое менделевское расщепление 1:1 в удвоенном гаплотипе. На фиг.1 представлен пример параметроов расщепления.
М обозначает маркер λPstI. Дорожка 1 содержит продукты ПЦР H. vulgare Lina. Дорожка 2 содержит продукты ПЦР H. spontaneum Canada Park. Дорожки 3-28 содержат продукты ПЦР особей картируемой популяции.
Праймер ТЕМ-1 давал высокий фон с некоторыми очень слабыми или практически невидимыми полосами, возможно, из-за множества близкородственных последовательностей, например, полученных благодаря вариациям в участках TIR. В данном случае к реакционным смесям добавляли 2% формамид, поскольку формамид, как сообщалось, снижает фон ПЦР и повышает специфичность (Nagaoka Т. and Y. Ogihara 1997. Applicability of inter-simple sequence repeat polymorphisms in wheat and their use as DNA markers in comparison to RFLP and RAPD markers. Theor. Appl. Genet. 94: 597-602).
На секвенирующем геле LI-COR с праймером ТЕМ-1 было обнаружено приблизительно 100 отдельных полос, с праймером ТЕМ-10 - от 60 до 70, а с праймером ТЕМ-3 можно было обнаружить от 30 до 40. Часть полиакриламидного геля с ТЕМ-1 после электрофореза показана на фиг.2. Как и при агарозной системе детекции, полиморфизмы четко различались у родителя Lina H. vulgare и родителя Canada Park H. spontaneum и преимущественно давали менделевское расщепление 1:1 в популяции с удвоенным гаплотипом.
Дорожка 1 содержит продукты ПЦР родителя H. vulgare, Lina. Дорожка 2 содержит продукты ПЦР родителя Н. spontaneum, Canada Park. Дорожки 3-45 содержат продукты ПЦР особей популяции, полученной скрещиванием Lina X Canada Park.
b) Сочетания праймеров
Тесты с сочетанием праймеров проводили только с агарозной системой детекции. При применении данных праймеров в различных сочетаниях возникло несколько неожиданных ситуаций. В то время как сочетание ТЕМ-4/ТЕМ-10 определяло те же параметры, что и ТЕМ-10 в отдельности, сочетание ТЕМ-1/ТЕМ-10 дало иной результат: большинство полос от одного ТЕМ-10 было подавлено, полосы от одного ТЕМ-1 также были хуже видны, и появлялись полосы с меньшим размером. Сочетание ТЕМ-3/ТЕМ-10 с большим временем удлинения (1 мин 15 сек) определяло другие параметры с тремя четкими полосами расщепления, отличными от таковых для любого праймера в отдельности (фиг.3). Дорожки 1-16 соответствуют отдельным особям картируемой популяции. Родители не показаны.
Сходные ситуации наблюдались с праймером ТЕМ-1. В то время как параметры полос не менялись при сочетании ТЕМ-1 с ТЕМ-4 (фиг.4А), параметры менялись, когда данный праймер сочетали с ТЕМ-3 или ТЕМ-10. Более того, при увеличении времени удлинения (1 мин 15 сек) сочетание ТЕМ-1/ТЕМ-4 давало более крупную полосу расщепления при подавлении некоторых других полос (фиг.4В). Интересно, что более крупная полоса (обозначаемая как Т1-4АА после сочетания праймеров) расщепляется практически так же, как и полоса Т4-10А (фиг.1). Т1-4АА и Т4-10А не были одним и тем же продуктом общего праймера ТЕМ-4, поскольку один ТЕМ-10 также амплифицировал полосу Т4-10А. Кроме того, Т1-4АА была приблизительно на 300 п.о. крупнее Т4-10А. Это свидетельствует о том, что сочетания двух праймеров амплифицировали тесно сцепленные области ДНК. Это не является неожиданным, поскольку предсказано присутствие данных транспозируемых элементов в большом количестве копий.
Подписи к фиг.4А и 4В являются теми же, что и к фиг.1. Номера дорожек соответствуют друг другу на фиг.4А и 4В.
Некоторые сочетания праймеров давали невоспроизводимые результаты. Возможными объяснениями являются:
- каждый праймер по отдельности амплифицировал более 10 полос, и, следовательно, сочетания данных праймеров могли либо давать слишком много полос для их четкой визуализации, либо могли давать параметры полос, которые колеблются в соответствии с изменениями микроусловий;
- важным фактором, определяющим получаемые параметры, может быть различие в температурах отжига (как в случае ТЕМ-4, температура отжига которого значительно ниже); и
- различия в сродстве праймеров могут приводить к преобладанию отдельных полос, как это было в случае с ТЕМ-1 и ТЕМ-10.
Тем не менее, имеется вероятность того, что, как и в случае реакций с одним праймером, применение системы детекции с флуоресцентным мечением позволит разрешить некоторые из данных проблем и что сочетания праймеров должны значительно увеличить количество определяемых локусов.
с) Хромосомная локализация основанных на MITE генетических маркеров
С применением агарозной системы детекции три праймера MITE и ретротранспозоновый праймер Tyl/copia дали в общей сложности 15 выявляемых полиморфных маркеров для картируемой популяции. Все они, за исключением двух, расщеплялись с ожидаемым отношением расщепления 1:1. Тринадцать из данных маркеров могли быть помещены на карту. Остальные два маркера остались несвязанными. Это были маркеры, проявляющие значительное отклонение от ожидаемого отношения расщепления, которые, по-видимому, состоят из двух полос сходного размера и которые не могли быть разделены в агарозе.
На фиг.5 основанные на MITE генетические маркеры отмечены более крупным шрифтом и жирным шрифтом. Можно видеть лишь локусы, выявляемые в акриламидном геле с флуоресцентно меченными ТЕМ-1 и ТЕМ-10. Локусы в скобках представляют собой те, которые не могли быть размещены с показателем LOD, большим или равным 2. На секвенирующем геле LI-COR с праймерами ТЕМ-1 и ТЕМ-10 выявлялось, соответственно, приблизительно 120 и 90 четких полос. Диапазон размеров выявляемых полос составлял приблизительно от 100 п.о. до 1 т.п.о. Часть результата амплификации с ТЕМ-1, визуализированного электрофорезом в полиакриламидном геле, представлена на фигуре 2.
С праймерами ТЕМ-1 и ТЕМ-10 было получено, соответственно, семьдесят пять и 19 полиморфных полос. Некоторые пары полос проявляли содоминантное поведение (локусы Т1-0,2 на 1Н, Т1-4 и Т1-16 на 2Н, Т10-6 на 3Н, Т1-8 на группе 4Н и Т1-36 на 7Н, фигура 5), но остальные полосы характеризовались параметрами присутствия/отсутствия точно для 41 полосы, перешедшей от родителя Lina, и 41 полосы, перешедшей от родителя Н. spontaneum. Из 70 картированных ТЕМ-1 локусов 24 значительно отклонялись от ожидаемого отношения расщепления 1:1. Все 24 локуса, за исключением одного (Т1-19 на 7Н), картировались на области, где маркеры RFLP также показывали искаженные отношения расщепления в данной картируемой популяции. Два из 18 локусов ТЕМ-10 значительно отклонялись от ожидаемого отношения расщепления, и они вновь локализовались в областях, где локусы RFLP также отклонялись от ожидаемого отношения 1:1.
В общей сложности было картировано 88 локусов. Данные локусы перекрывали все семь групп сцепления (фигура 5). Более того, в распределении локусов не проявлялось значительной кластеризации, отличной от той, которую можно было бы ожидать вокруг центромерных участков, где рекомбинация обычно снижена (например, группы 1Н, 3Н и 7Н, фигура 5). Действительно, распределение сходно с тем, которое было найдено с RFLP, выявляющими кДНК. Это свидетельствует о том, что MITE локализованы в областях генома, включающих кодирующие последовательности, и что можно охватить геном целиком с помощью ограниченного набора основанных на MITE праймеров.
d) Фингерпринтинг
В общей сложности 27 сортов, включая родительский Lina Н. vulgare, родительский Canada Park Н. spontaneum и 25 сортов Н. Vulgare (таблица 1), были применены для оценки пригодности данных праймеров MITE для фингерпринтинга. С применением агарозы было обнаружено, что праймеры и сочетания праймеров ТЕМ-3, ТЕМ-10, ТЕМ-1/-3 и ТЕМ-1/-4 пригодны для различения данных сортов. С каждым из данных праймеров и сочетаний наблюдалось от одной до трех полиморфных полос. Пример экспериментов с фингерпринтингом в агарозе представлен на фиг.6.
Три полосы расщепления на фиг.6 показали, что 27 сортов разделяются на 7 групп.М представляет молекулярную массу маркера λPstI. Числа соответствуют таковым в таблице 1.
Два праймера MITE, TEM-1 и ТЕМ-10 исследовали в анализе фингерпринтингом в системе детекции с флуоресцентным мечением. Для TEM-1 было зарегистрировано в общей сложности 62 полосы, 37 из которых были полиморфными, а остальные 22 оставались неизменными во всех 27 сортах. Часть данного электрофореза представлена на фиг.7. Для ТЕМ-10 было зарегистрировано в общей сложности 60 полос, 34 из которых были полиморфными, а остальные 26 оставались неизменными во всех 27 сортах. Обозначение дорожек на фиг.7 можно найти в таблице 1.
Дорожки 1-27 представляют результаты для Lina, Canada Park, Alexis, Angora, Ariel, Azhul, Ellice, Express, Fillipa, Goldie, Golf, High amylose glacier, Igri, Ingrid, Kinnan, Maud, Meltan, Mentor, Mette, Mona, Roland, Saxo, Svani, Tellus, Tofta, Trebon и Vixen, соответственно. Знаками тире отмечены маркеры, отличающие, по меньшей мере, один сорт от других.
Для TEM-1, ТЕМ-10, а также объединенных данных для двух праймеров, строили матрицы с применением коэффициента Nei и Li (Nei and Li, см. выше). Для тех же групп результатов строили дендрограммы. Дендрограмма объединенных данных для ТЕМ-1 и ТЕМ-10 представлена на фиг.8. Дендрограмма четко отделяет линию Н. spontaneum от сортов Н. vulgare. За исключением Azhul (шестирядный тип), весенние двухрядные типы кластеризовались друг с другом и отделялись от 4 зимних типов (Angora, Express, Igri и Vixen), включенных в настоящее изобретение. Кластеризуемая с зимними двурядными сортами линия High Amylose Glacier относится к шестирядному типу. Сравнение матрикса GS с таковым, полученным ранее с помощью анализа RFLP, показало хорошую корреляцию между ними с Z=0,69475 по статистическому способу Mantel. Данная положительная корреляция имела высокую достоверность с вероятностью Р=0,0020 того, что данная величина Z могла бы быть получена случайно.
е) Универсальность праймеров
Для демонстрации универсальности праймеров праймеры master на основе MITE животных и праймеры master на основе MITE растений были применены в отношении геномной ДНК растения, насекомого и человека.
На фиг.9А, 9В, 9С и 9D показан типичный результат амплифицированных ПЦР профилей одиннадцати ДНК из различных источников с применением праймера Master ТЕМ-12 (фиг.9А); праймера Master ТЕМ-1 (фиг.9В); праймера Master ТЕМ-10 (фиг.9С) и праймера Master TEM-11 (фиг.9D), обозначенных в таблице 2. Источниками ДНК (пронумерованными над каждой дорожкой) являются:
1) ДНК здорового человека, мужчины.
2) ДНК здорового человека, женщины.
3) ДНК человека, мужчины с альбинизмом.
4) ДНК человека, женщины с альбинизмом.
5) Насекомое: Trichogramma.
6) Бобовые: соя.
7) Бобовые: люцерна.
8) Крестоцветные: Canola.
9) Злаковые: пшеница.
10) Злаковые: овес.
11) Злаковые: ячмень.
Данные результаты четко показывают, что маркеры на основе MITE могут быть применены у широкого круга видов.
f) Изменчивость последовательностей, полученных с Master.
Для демонстрации изменчивости маркерной системы на основе MITE последовательности праймера Master модифицировали путем добавления дополнительного нуклеотида на их 3'-конце. Эффект проявляется в увеличении специфичности амплифицированного продукта и особенно полезен тогда, когда амплифицированный профиль, полученный с последовательностью Master, слишком сложен для интерпретации, как в случае с праймером ТЕМ-1, полученным от Stowaway.
На фиг.10А, 10В, 10С, 10D и 10Е показан пример результатов, полученных с праймером Master ТЕМ-1 на стадии предварительной амплификации и амплификации с его соответствующим заякоренным праймером, представленным в таблице 3. На фигурах показаны амплифицированные с помощью полимеразной цепной реакции (ПЦР) профили злаковой ДНК (ячменя), позволяющие сравнить профиль, полученный с одним праймером Master TEM-1 (фиг.10 А); якорным праймером ТЕМ-1А, якорным дополнительным "А" на его 3'-конце (фиг.10В); якорным праймером ТЕМ-1С, якорным "С" (фиг.10С); якорным праймером TEM-1G, якорным "G" (фиг.10D) и якорным праймером ТЕМ-IT, якорным "Т" (фиг.10Е).
Из данных результатов ясно, что когда TEM-1 заякорен по своему 3'-концу А, С, Т или G, получают более простые параметры амплификации. Ясно также, что различные и комплементарные параметры амплификации получаются с различными 3'-концевыми якорями.
Общие цели и коммерческое применение
В различных исследованиях показано, что транспозируемые элементы присутствуют у практически каждого изученного к настоящему времени вида. Ретротранспозоны присутствуют в геномах растений в большом количестве копий. Было установлено, что в гаплоидном геноме человека находится 5×105 копий семейства Alu, что соответствует одному элементу Alu на каждые 5 т.п.о. ДНК. Один этот элемент составляет 5% генома приматов (Berg D.E. and M.M. Howe. 1989. Mobile DNA. Washington, American Society of Microbiology). Группа элементов Tyi/copia может накапливать до 106 копий на геном у видов Vicia, что составляет до >2% генома, хотя между видами наблюдались большие различия (Pearce S.R., H.Gill, D.Li, J.S.Heslop-Harrison, A.Kumar and A.J.Flavell. 1996. The Tyl-copia group retrotransposons in Vicia species: copy number, sequence heterogeneity and chromosome localisation. Mol. Gen. Genet. 250:305-315). Количество копий ретротранспозона BARE-1 составляет 3×104, что соответствует 6,7% генома ячменя (Suoniemi А., К.Anamthawat-Jonsson, Т. Arna and А.Н.Schulman. 1996. Retrotransposon BARE-1 is a major, dispersed component of the barley (Hordeum vulgare L.) genome. Plant Molecular Biology 30: 1321-1329). В исследовании SanMiguel et al. (SanMiguel P., A. Tikhonov, Y.-K. Jin, N.Motchoulskaia, D.Zakharov, A.Melake-Berhan, P.S.Springer, K.J.Edwards, M.Lee, Z.Avramova and J.L.Bennetzen 1996. Nested retrotransposons in the intergenic regions of the maize genome. Science 274: 765-768) секвенирование примыкающей к гену Adhl-F кукурузы смежной области размером 280 т.п.о., выделенной в клон искусственной хромосомы дрожжей (YAC), выявило 37 классов сгруппированных ретротранспозонных повторов, составляющих >60% клона.
Элементы Tourist и Stowaway (Bureau Т.Е. and S.R.Wessler. 1992. Tourist: A large family of small inverted repeat elements frequently associated with maize genes. Plant Cell 4: 1283-1294; и Bureau Т.Е. and S.R.Wessler. 1994. Stowaway: A new family of inverted repeat elements associated with the genes of both monocotyledonous and dicotyledonous plants. Plant Cell 6: 907-916) являются членами класса TIR транспозируемых элементов, хотя они значительно отличаются от традиционных семейств транспозируемого элемента TIR, подобных Ас и En/Spm. Barfly, новый член транспозируемых элементов TIR, как и Tourist и Stowaway, связан с геном ксилозоизомеразы ячменя. Данные элементы вместе с некоторыми другими элементами этого типа, обобщенно обозначаемые как MITE (Bureau Т.Е., Р.С.Ronald, and S.R.Wessler. 1996. A computer-based systematic survey reveals the predominance of small inverted-repeat elements in wild-type rice genes. Proc. Natl. Acad. Sci. 93: 8524-8529), были обнаружены у большого числа видов растений, изученных к настоящему времени. Ожидается, что MITEs также присутствуют в большом количестве копий в геномах эукариот.
Повсеместность и рассеянность по геному транспозируемых элементов позволяет предполагать, что они могут быть использованы в качестве основанных на ПЦР приспособлениях для картирования. Действительно, Sinnet et al. (Sinnet D., J.-M. Deragon, L.R.Simard and D.Labuda. 1990. Alumorphs-human DNA polymorphisms detected by polymerase chain reaction using Alu-specific primers. Genomics 7: 331-334) использовали Alu-специфичные праймеры для поиска полиморфизмов в различных образцах ДНК человека. Данные исследователи четко продемонстрировали осуществимость применения данных полиморфизмов (названных алюморфами) в качестве приспособления для анализа генома (Sinnet et al., смотри выше) и успешно применили данные алюморфы для выявления связи одного алюморфа с заболеванием человека (Zietkiewicz Е., М.Labuda, D.Sinnet, F.H.Glorieux and D.Labuda. 1992. Linkage mapping by simultaneous screening of multiple polymorphic loci using Alu oligonucleotide-directed PCR. Proc. Natl. Acad. Sci. 89: 8448-8451). Copia-подобный ретротранспозон, PDR1, был так же успешно использован для изучения полиморфизмов, а в сочетании с другими специфическими праймерами - для дифференцировки различных линий Pisum (Lee D., Т.Н. N.Ellis, L.Turner, R.P.Hellens and W.G.Cleary. 1990. A copia-like element in Pisum demonstrates the uses of dispersed repeated sequences in genetic analysis. Plant Molecular Biology 15: 707-722).
В настоящем изобретении MITE, члены транспозируемого элемента TIR, применяют в качестве инструментов картирования и фингерпринтинга у ячменя, и они дают успешный результат как в обычной агарозной системе, так и в системе автоматизированного анализа ДНК LI-COR, в выявлении полиморфизмов, локализации данных MGM на существующей карте генетического сцепления и фингерпринтинге сортов в пределах вида Н. vulgare.
С помощью обычной системы детекции в агарозе авторы изобретения показали, что с тремя праймерами MITE и одним ретротранспозонным праймером определяется 15 четко выявляемых полиморфизмов, и 13 из 15 были картированы как принадлежащие к четырем группам сцепления ячменя. Каждый праймер MITE или сочетание праймеров давало более 10 выявляемых полос, из которых 2-5 были полиморфными. В автоматизированной генотипирующей системе LI-COR каждый из двух отмеченных праймеров MITE давал около 100 выявляемых полос, причем до 75 из них были полиморфными. С применением данных двух праймеров были получены маркеры, картирующие все семь групп сцепления ячменя. Это демонстрирует случайное распределение основанных на MITE маркеров в геномах.
Новые MITE стабильно не выявляются с помощью компьютерных поисков сходства последовательностей. Поскольку количество MITE растет, на основе только MGM могут быть легко разработаны подробные карты сцепления практически любого вида с большим количеством копий MITE. Также могут быть легко выполнены исследования по сцеплению важных генов с MGM. Высокий уровень вариации, выявленный с помощью данных основанных на MITE праймеров в сортах в пределах того же вида, показывает практическую ценность данных праймеров.
Некоторые транспозируемые элементы, такие как Alu (Berg and Howe, выше; Makalowski W., G.A.Michell and D.Labuda. 1994. Alu sequences in the coding regions of mRNA: a source of protein variability. Trends Genet. 10: 188-193) и элемент В2 мыши (Clemens M.J. 1987. A potential role for RNA transcribed from B2 repeats in the regulation of mRNA stability. Cell 49: 157-158), как было обнаружено, часто связаны с генами. Члены MITE также часто идентифицировались в генах растений и других эукариот. Stowaway был впервые открыт как причина мутации в локусе wx кукурузы (Bureau and Wessler, выше). Было найдено более 100 генов, содержащих MITE в кодирующих или некодирующих участках (Bureau et al., выше). Тесная связь ретроэлементов с генами животных и растений, а также MITE - с генами сельскохозяйственных культур и других растений, открыла новое направление характеристики генов или последовательностей генов. Действительно, с применением других типов транспозируемых элементов были проведены исследования по выделению последовательностей генов (Nelson D.L., S.A.Ledbetter, L.Corbo, M.F.Victoria, R.Ramirez-Solis, T.D.Webster, D.H.Ledbetter and C.T.Caskey. 1989. Alu polymerase chain reaction: A method for rapid isolation of human-specific DNA sequences from complex DNA sources. Proc. Natl. Acad. Sci. 86: 6686-6690; Souer E., F.Quattrocchio, N. de Vetten, J. Mol and R.Koes. 1995. A general method to isolate genes tagged by a high copy number transposable element. Plant Journal 7: 677-685), анализу генома (Hirochika H. 1997. Retrotransposons of rice: their regulation and use for genome analysis. Plant Molecular Biology 35: 231-240; 35 Lee D., Т.H.N.Ellis, L.Turner R.P.Hellens and W.G.Cleary. 1990. A copia-like element in Pisum demonstrates the uses of dispersed repeated sequences in genetic analysis. Plant Molecular Biology 15: 707-722) и анализу структуры и экспрессии генов (White S.E., L.F.Habera and S.R.Wessler. 1994. Retrotransposons in the flanking regions of normal plant genes: A role for copia-like elements in the evolution of gene structure and expression. Proc. Natl. Acad. Sci. 91: 11792-11796).
Ряд аспектов применимости способа настоящего изобретения.
1) Исследования сцепления
a) Как описано в настоящей заявке, могут быть созданы карты сцепления с маркерами MITE. Для этого необходимы популяция расщепления и родители. Карты сцепления конструируют на основе расщепления.
b) Можно осуществить сцепление с фенотипическим признаком или геном. Для ускорения исследования этого можно достичь в сочетании с массовым анализом расщепления. В данном случае для ПЦР амплификации с праймерами MITE для идентификации полиморфных маркеров и, следовательно, предполагаемых сцеплений необходимо использовать двух родителей и пулов, которые различаются фенотипически (по признаку) или генетически (по гену).
с) На основе того же принципа с помощью различных способов статистического анализа, таких как одноточечные ANOVA, интервальное картирование и сложное интервальное картирование, можно выявлять связь MGM или IMP с локусами количественного признака (QTL), контролирующими признаки, находящиеся под сложным генетическим контролем.
d) После установления связи маркеров с признаками, имеющими сельскохозяйственное значение, данные маркеры могут быть применены в селекции с помощью маркеров (MAS) для ускорения программ размножения.
2) В исследованиях фингерпринтинга
Подходы MGM и IMP могут быть применены для облегчения в конструирования больших библиотек вставок, таких как YAC (искусственных хромосом дрожжей), для облегчения идентификации сортов и для облегчения выделения генов, а также для превращения маркера.
a) Полученные маркеры MGM и IMP могут служить в качестве маркеров при сопоставлении соседних участков и при "прогулке по хромосоме".
b) Подходы MGM и IMP могут быть легко применены в фингерпринтинге сортов и размножении линий для выявления их родословных и генетических отношений, для определения вклада родителя в потомство и для сертификации новых линий и сортов.
Подход MGM может быть также применен для облегчения в выделении и субклонировании геномных последовательностей.
a) Когда ген помечен транспозируемым элементом, можно использовать MGM благодаря его распространенности в геноме. Праймер MITE может быть применен в сочетании с праймером, созданным на основе меченого транспозона. Примыкающую последовательность можно амплифицировать и затем использовать для выделения гена дикого типа. Данный подход может сэкономить один цикл скрининга библиотеки ДНК по сравнению с обычным клонированием меченного транспозоном гена.
b) По сценарию, сходному с выделением гена, MGM может быть использован для выделения геномных последовательностей, примыкающих к известным последовательностям генов. Праймер MITE и праймер, созданный на основе известной последовательности гена, могут быть применены в ПЦР для амплификации фланкирующих последовательностей.
c) Амплификация с помощью праймера на основе определяющего RFLP клона ДНК, примененного в сочетании с праймером MITE, может быть использована для превращения маркера RFLP в маркер на основе ПЦР.
Хотя изобретение было описано на примере конкретными осуществлениями, следует понимать, что к нему применимы дополнительные модификации, и данная заявка предназначена для охвата любых вариаций, применений или адаптации изобретения, следующих, в целом, принципам изобретения и включающих такие ответвления от настоящего раскрытия, которые вытекают из известной или общепринятой практики в данной области, к которой относится изобретение, и которые могут быть применены к существенным особенностям, изложенным здесь выше, и которые находятся в объеме прилагаемой формулы изобретения.


















Изобретение относится к области молекулярной биологии и биотехнологии и может быть использовано в процессах генотипирования. Предложен способ фингерпринтинга эукариотического организма. Последовательность нуклеиновой кислоты эукариотического организма амплифицируют с помощью праймера, гибридизующегося в жестких условиях либо с миниатюрным транспозируемым элементом, либо с его фрагментом или производным. Продукты амплификации разделяют по массе. Результаты указанного разделения используют для определения эукариотического организма. Применение изобретения позволяет осуществить фингерпринтинг с высокой эффективностью и разрешающей способностью. 7 з.п. ф-лы, 3 табл., 18 ил.
a) стадию амплификации последовательности нуклеиновой кислоты эукариотического организма с праймером, гомологичным миниатюрному транспозируемому элементу, содержащему инвертированные повторы (MITE), его фрагменту или производному, где указанный праймер способен к гибридизации в жестких условиях с указанным MITE, или с его фрагментом или производным; и указанный праймер получен из консенсусных последовательностей последовательности элементов Tourist, Stowaway, Barfly или HSMarl Mariner и MADE1; и
b) стадию разделения фрагментов, полученных в результате амплификации последовательности нуклеиновой кислоты на стадии а), по массе; и c) стадию определения эукариотического организма на основании разделения по массе указанных фрагментов.
| CASACUBERTA E | |||
| et al | |||
| Plant Journal | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| IZSVAK, J | |||
| Mol | |||
| Evoltion, 48, 1999, 12-21 | |||
| SINNET D | |||
| et al | |||
| Genetics, 7, 1990, р.331-334 | |||
| BUREAU T.Z | |||
| et al | |||
| Plant Cell | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2006-07-10—Публикация
2000-03-30—Подача