Изобретение относится к биотехнологии, в частности производству бализа, применяемого в медицине и ветеринарии. Бализ используется для изготовления: суппозиторий «Бализ» (патент РФ №2076696, МПК (6) А 61 К 9/02, 31/71, 1993), противовоспалительной ранозаживляющей мази для лечения мастита (патент РФ №2187302, МПК (7) А 61 К 31/00, 35/78, 9/06, А 61 Р 17/02, 2000), крема для кожи и лица (патент РФ №2137467, МПК (6) А 61 К 7/48, 1997), средства по уходу за волосами Аштен (патент РФ №2101004, МПК (6) А 61 К 7/06, 1995). Бализ представляет собой сумму глюконовых кислот: глюконовую, 2,5-дикетоглюконовую, 5-кетоглюконовую, 2-кетоглюконовую и коменовую кислоты.
Известны штаммы бактерий: Gluconobacter oxydans-01 - продуцент бализа (всесоюзная коллекция промышленных микроорганизмов В-2380). Авторское свидетельство СССР №1391653, М.кл. А 61 К 35/74, 1988 и штамм бактерий: Gluconobacter oxydans-02-продуцент бализа (всесоюзная коллекция микроорганизмов В-1974Д). Патент РФ №2026351, МПК (6) С 12 Р 1/04, С 12 N 1/20, А 61 К 35/74, 1995.
Однако эти штаммы обладают недостаточно высокой окислительной активностью и способны накапливать 2,6% бализа за 72 часа и за 48 часов соответственно.
Известен способ получения бализа патент РФ №20332412, МПК (6) С 12 Р 1/04, А 61 К 35/74, включающий выращивание посевного материала из штамма бактерий Gluconobacter oxydans в питательной среде, содержащей, г/л: маннита - 25, пептона - 3, дрожжевого автолизата жидкого с содержанием 350-500 мг% аминного азота - 50, остальное - вода, с последующим внесением его в ферментационную питательную среду и проведение глубинной ферментации, а затем ионообменную очистку.
Однако известный способ получения бализа трудоемок, используемые ионообменные смолы анионит АВ-17 в ОН- форме и катионит КУ-2 в Н+ форме не позволяют получить бализ высокой степени очистки, и для подготовки анионита в ОН- форме используется неэкологичное дорогостоящее сырье.
Технической задачей изобретения является выделение штамма, обладающего высокой окислительной активностью и разработка экологически чистого способа получения бализа с большей производительностью, экономичностью.
Указанная техническая задача решается использованием в качестве продуцента бализа вновь выделенного штамма бактерий Gluconobacter oxydans-03.
Для этого штамм бактерий Gluconobacter oxydans-03 выращивают на питательной среде, содержащей, г/л: маннита - 25, пептона - 3, дрожжевого автолизата жидкого с содержанием 350-500 мг% аминного азота - 50, остальное - вода, в течение 30-36 часов и вносят в количестве 0,75% от объема ферментационной среды, содержащей 4% глюкозы, 1,5-2,0% дрожжевого автолизата жидкого с содержанием 350-500 мг% аминного азота, 0,01% фосфорнокислого калия однозамещенного, 0,005% аммония фосфорнокислого двузамещенного, вода остальное и проводят глубинную ферментацию в течение 30-36 часов.
Отделение культуральной жидкости от бактериальных клеток осуществляют с применением бентонита, которого берут не менее 0,6% от объема культуральной жидкости, с последующей ионообменной очисткой. Для ионообменной очистки использовали анионит АВ-17-8 чс в НСО3 - форме и катионит Ку-2-8 чс в H+ форме.
Предлагаемый способ отличается от прототипа:
1. используемым штаммом бактерий;
2. количеством посевного материала, вносимого в ферментационную среду;
3. увеличением количества дрожжевого автолизата, вводимого в ферментационную среду;
4. отделением культуральной жидкости от бактериальных клеток бентонитом, взятым в количестве не менее 0,6% от объема культуральной жидкости;
5. для ионообменной очистки используют анионит АВ-17-8 чс в НСО3 - форме и катионит Ку-2-8 чс в H+ форме.
Предлагаемый способ позволяет использовать более экологически чистое и дешевое сырье для подготовки ионообменных смол к работе и сократить сроки проведения ионообменной очистки, получив бализ высокой степени чистоты.
Предлагаемый штамм выделен на спелых плодах винограда, произрастающего в Анапском районе Краснодарского края, с применением традиционных микробиологических методов и хранится в коллекции музея чистых культур микроорганизмов OOO «Кубанской научно-производственной лаборатории физиологически активных веществ». Штамм хранят на питательной среде с маннитом с внесением 1,5% агара под вазелиновым маслом при температуре (+4) - (+6)°С. Он относится к семейству Pseudomonadaceae роду Gluconobacter виду oxydans и имеет следующие культурально-морфологические свойства: клетки суточной культуры на среде следующего состава, г: маннит - 25, пептон - 3, дрожжевой автолизат жидкий с содержанием 350-500 мг% аминного азота - 50, вода дистиллированная до 1 литра, имеют размеры (2,7-5,5)×(0,88-1,1) мкм.
Клетки двенадцатисуточной культуры на агаризованной среде выше указанного состава имеют размеры (2,2-5,5)×(0,44-0,88) мкм.
Форма клеток эллипсоидальная. Встречаются поодиночке, парами, реже цепочками. Движутся при помощи полярно расположенных жгутиков. Споры не образуют. Грамотрицательные.
Агаризованная среда с маннитом. Встречаются колонии двух форм и размеров:
1. колонии круглые, плоские по краю, выпуклые в центре, середина колоний непрозрачная, блестящие, поверхность гладкая, структура мелкозернистая, край слегка волнистый, консистенция маслянистая, равномерная суспензия в воде, цвет кремовый; диаметр колонии 8-11 мм;
2. колонии круглые, выпуклые, блестящие, поверхность гладкая, профиль изогнутый, структура мелкозернистая, край ровный, консистенция маслянистая, равномерная суспензия в воде, цвет кремовый; диаметр колоний 3.0-5.5 мм.
Сусло - агар. Встречаются колонии трех типов:
1. колонии круглые, блестящие, гладкие, профиль изогнутый, край слабоволнистый, структура мелкозернистая, равномерная суспензия в воде, цвет коричневый, консистенция маслянистая; диаметр колоний 1-3 мм;
2. колонии круглые, профиль изогнутый, край слегка волнистый, структура мелкозернистая, консистенция маслянистая, равномерная суспензия в воде, цвет кремовый, в центре коричневая точка; диаметр колоний 3,0-3,5 мм;
3. колонии неправильной формы, шероховатые, профиль плоский, край волнистый, консистенция маслянистая, равномерная суспензия в воде, цвет светло-коричневый; диаметр колоний 4,0-5,5 мм.
Картофельный агар. Колонии круглые, блестящие, профиль изогнутый, край ровный, структура мелокозернистая, консистенция маслянистая, равномерная суспензия в воде, цвет беловато-кремоватый; диаметр колоний от точечных до 2,5 мм.
Среда Захарова. Колонии круглые, блестящие, гладкие, край ровный, профиль плоский, структура мелкозернистая, консистенция маслянистая, равномерная суспензия в воде, цвет светло-коричневый по центру и кремовый по краю; диаметр колоний 1-2 мм.
Ферментационная среда. Колонии круглые, блестящие, профиль плоский, структура мелкозернистая, край ровный, консистенция маслянистая, равномерная суспензия в воде, цвет у одних колоний коричневый, у других - желтовато-коричневый; диаметр от точечных до 3 мм.
Рост на моркови умеренный, бежевого цвета, штрих блестящий, консистенция маслянистая.
Рост на картофеле слабый, штрих блестящий беловато-бежевого цвета. Консистенция маслянистая.
Рост на пиве и сахарозе умеренный, при этом среды из пива и сахарозы не загустевают. На среде с пивом пленки в течение 7 суток не образуется. По стенкам пробирки наблюдается кольцо из прикрепленных к стеклу клеток.
Физиолого-биохимические свойства штамма.
Оптимальное значение рН 5,0-5,5, оптимальная температура роста 28°С, строгий аэроб, каталозоположителен, сусло-желатину не разжижает, крахмал не гидролизует. Окисляет глюкозу до глюконовой кислоты, 2-кетоглюконовой кислоты, 5-кетоглюконовой кислоты и 2,5-дикетоглюконовой кислоты. Образует коричневый пигмент, способный к диффузии (культура штрихом на чашке Петри, питательная среда: глюкоза - 2,5%, КН2PO4 - 0,01%, дрожжевой автолизат жидкий с содержанием 350-500 мг% аминного азота - 3%, СаСО3 - 3%, агар-агар 1,5%).
Отношение к углеводам. Усваивает с образованием кислоты глюкозу и арабинозу. Не образует кислоту при использовании рамнозы, сахарозы, мальтозы, фруктозы, рафинозы.
Отношение к спиртам. Усваивает без образования кислоты инозит, маннит, глицерин, усваивает этанол с образованием кислоты, не усваивает дульцит и сорбит. Индол, сероводород не образует, нитраты не восстанавливает.
Влияние отличительных признаков, характеризующих заявляемый способ получения бализа, исследовали, помещая в стеклянный сосуд емкостью 120 литров 85 литров ферментационной питательной среды, содержащей от ее объема: 4% глюкозы, 0,01% калия фосфорнокислого однозамещенного, 0,005% аммония фосфорнокислого двузамещенного и жидкий дрожжевой автолизат с содержанием 350-500 мг% аминного азота, остальное - вода. Далее в ферментационную питательную среду вносили посевной материал, содержащий штамм бактерий Gluconobacter oxydans-03, который выращивали в течение 30 часов на жидкой питательной среде состава, г/л: маннита - 25, пептона - 3, дрожжевого автолизата жидкого с содержанием 350-500 мг % аминного азота - 50, вода до 1 л. Ферментацию во всех опытах вели 72 часа. Через 24, 30, 36, 48 и 72 часа проверяли содержание бализа в культуральной жидкости после полного отделения ее от бактериальных клеток.
Результаты 13 из этих опытов приведены в таблице 1.
В первом опыте изучали влияние количества взятого бентонита на полноту отделения бактериальных клеток от культуральной жидкости. Выявили, что бентонита надо брать не менее 0,6% от объема культуральной жидкости. Во всех дальнейших опытах использование бентонита в таком количестве позволяет сократить сроки отделения культуральной жидкости от бактериальных клеток.
В опытах 2-5 исследовали влияние количества внесенного в ферментационную питательную среду дрожжевого автолизата жидкого на выход бализа. Установили, что необходимо брать 1,5-2,0% дрожжевого автолизата жидкого с содержанием 350-500 мг% аминного азота от объема ферментационной питательной среды.
Влияние отличительных признаков на содержание бализа в культуральной жидкости, содержащей штамм бактерий Gluconobacter oxydans-03
0,7
100
1,5
2,1
2,2
2,6
3,1
Меняя количество посевного материала в опытах 6-13, установили, что его необходимо вносить в количестве не менее 0,75% от объема ферментационной питательной среды.
Для ионообменной очистки использовали смолы анионит АВ-17-8 чс в НСО3 - форме и катионит Ку-2-8 чс в H+ форме, которые позволили получить более очищенный от примесей бализ, сократить сроки химочистки и при подготовке смол к работе использовать менее дорогое и экологически чистое сырье.
Как видно из приведенных данных таблицы 1, предлагаемый способ получения бализа с введением в состав ферментационной питательной среды 1,5-2,0% от ее объема дрожжевого автолизата жидкого с содержанием 350-500 мг% аминного азота, использованием штамма бактерий Gluconobacter oxydans-03 и внесением в ферментационную питательную среду 0,75% от ее объема посевного материала, отделением бактериальных клеток от культуральной жидкости бентонитом, приводит к увеличению производительности способа получения бализа (выход бализа за 30-36 часов составляет 3,1%).
Рассмотрим пример конкретного выполнения, позволяющий сравнить способность накапливать бализ штаммами бактерий Gluconobacter oxydans-02 и Gluconobacter oxydans-03.
Посевные материалы, один с использованием штамма бактерий Gluconobacter oxydans-02, а другой со штаммом бактерий Gluconobacter oxydans-03, выращивали на жидких питательных средах состава, г/л: маннита - 25, пептона - 3, дрожжевого жидкого автолизата с содержанием 350-500 мг% аминного азота - 50, вода до 1 л, в течение 30 часов.
Брали два стеклянных сосуда вместимостью 120 литров, в которые помещали по 85 литров ферментационной питательной среды, содержащей от ее объема: 4% глюкозы, 0,01% калия фосфорнокислого однозамещенного, 0,005% аммония фосфорнокислого двузамещенного и 2% дрожжевого автолизата жидкого с содержанием 350-500 мг% аминного азота, остальное - вода.
В первый сосуд с 85 литрами ферментационной питательной среды вносили 0,75% посевного материала, содержащего штамм бактерий Gluconobacter oxydans-02, во второй сосуд с 85 литрами ферментационной питательной среды вносили 0,75% посевного материала, содержащего штамм бактерий Gluconobacter oxydans-03. Ферментацию вели в обоих сосудах 72 часа. Через 24, 30, 36, 48 и 72 часа отбирали пробы культуральной жидкости в количестве 1 литра, отделяли ее от бактериальных клеток добавлением 0,6% бентонита и проверяли содержание бализа (табл.2).
Содержание бализа в культуральной жидкости испытуемых штаммов бактерий Gluconobacter oxydans
Из приведенных данных в таблице 2 видно, что содержание бализа при использовании предлагаемого штамма бактерий Gluconobacter oxydans-03 после 30-36 часов ферментации такое же (3,1%), как в культуральной жидкости штамма - аналога на 72 часу ферментации.
Таким образом, предлагаемый штамм бактерий Gluconobacter oxydans-03 обладает повышенной окислительной активностью и его использование в качестве продуцента бализа способствует сокращению сроков ферментации в 2,4 раза.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОМЕНОВОЙ КИСЛОТЫ | 2011 |
|
RU2459623C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БАЛИЗ | 1992 |
|
RU2032412C1 |
| ШТАММ БАКТЕРИЙ GLUCONOBACTER OXYDANS - ПРОДУЦЕНТ БАЛИЗА | 1992 |
|
RU2026351C1 |
| Штамм бактерий GLUсоNовастеR oxYDaNS - продуцент сорбозы | 1988 |
|
SU1555363A1 |
| ШТАММ БАКТЕРИЙ ENTEROCOCCUS FAECIUM В-2240D - ПРОДУЦЕНТ ОПТИЧЕСКИ ЧИСТОЙ L(+)-МОЛОЧНОЙ КИСЛОТЫ И ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ L(+)-МОЛОЧНОЙ КИСЛОТЫ ИЛИ ЕЕ СОЛЕЙ | 2000 |
|
RU2205216C2 |
| ШТАММ LACTOCOCCUS LACTIS SUBSP.LACTIS F-119 - ПРОДУЦЕНТ АНТИБИОТИЧЕСКОГО КОМПЛЕКСА LGS И СПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИЧЕСКОГО КОМПЛЕКСА LGS С ЕГО ИСПОЛЬЗОВАНИЕМ | 2007 |
|
RU2374320C2 |
| Способ получения рибофлавина | 1980 |
|
SU908092A1 |
| Способ получения L-треонина | 1981 |
|
SU974817A1 |
| Способ получения -гомосерина | 1978 |
|
SU840107A1 |
| Способ получения L-треонина | 1980 |
|
SU904325A1 |
Изобретение относится к биотехнологии. Используют штамм бактерий Gluconobacter oxydans-03. Вносят посевной материал в количестве 0,75% по объему от ферментационной среды. Количество дрожжевого автолизата, вводимого в ферментационную среду, составляет 1,5-2%. Глубинную ферментацию ведут в течение 30-36 часов и отделяют культуральную жидкость от бактериальных клеток бентонитом, взятым в количестве 0,6% от объема культуральной жидкости. Предложенный штамм обладает повышенной окислительной активностью и его использование в качестве продуцента бализа способствует сокращению сроков ферментации в 2,4 раза. 2 н. и 3 з.п. ф-лы, 2 табл.
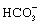 форме и катионите Ку-2-8 чс в Н+ форме.
форме и катионите Ку-2-8 чс в Н+ форме.
| ШТАММ БАКТЕРИЙ GLUCONOBACTER OXYDANS - ПРОДУЦЕНТ БАЛИЗА | 1992 |
|
RU2026351C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БАЛИЗ | 1992 |
|
RU2032412C1 |
Авторы
Даты
2006-11-20—Публикация
2005-06-06—Подача