Предпосылки создания изобретения
Область изобретения
Настоящее изобретение относится к способу придания растениям резистентности к соединениям, подавляющим сорняки.
Уровень техники
Борьба с сорняками очень важна для увеличения урожайности и качества культурных растений. Для этой цели в основном применяют соединения, подавляющие сорняки, такие как гербициды. Однако при использовании соединений, подавляющих сорняки, не всегда легко отделить культурные растения от сорняков родственных видов, чтобы выборочно подавить только сорняки. Поэтому были предприняты попытки получить растения, обладающие резистентностью к соединениям, подавляющим сорняки, и некоторые резистентные растения были внедрены в практику.
В последнее время для получения растений, обладающих резистентностью к соединениям, подавляющим сорняки, применяли методы генной инженерии. Таким, например, является способ получения растения, обладающего резистентностью к гербициду глифозату, описанный Hinchee M.A.W. et al., в котором ген 5-енолпирувилшикимат-3-фосфат-синтазы (EPSPS), являющийся ферментом-мишенью глифозата, подвергают мутагенезу таким образом, чтобы уменьшить сродство к глифозату, и вводят ген в растение [Hinchee M.A.W. et al., BIO/TECHNOLOGY, 6: p 915 (1988).
Цели изобретения
Поскольку необходимое разнообразие способов придания растениям резистентности к соединениям, подавляющим сорняки, недостаточно, желательно разработать в дальнейшем различные виды таких способов.
Основная цель настоящего изобретения - обеспечить новый тип способа для придания растениям резистентности к соединениям, подавляющим сорняки.
Эта цель наряду с другими целями и преимуществами данного изобретения станет очевидной для специалистов в данной области из нижеприведенного описания со ссылкой на сопровождающие чертежи.
Краткое описание чертежей
Фиг.1 представляет карту рестрикции плазмиды рЕТВСН. bchH является геном протопорфирин IX связывающей субъединицы хелатазы магния фотосинтезирующей бактерии Rhodobackter sphaeroides. Т7 pro представляет собой последовательность промотора фага Т7, а Т7 ter представляет последовательность терминатора фага Т7. Ampr - это ген резистентности к ампициллину, lacq - ген белка репрессора лактозного оперона и ori - точка начала репликации.
Фиг.2 представляет карту рестрикции плазмиды pACYCSP. РРО - ген протопорфирин IX оксидазы из бобов сои, и lac pro - последовательность промотора лактозного оперона. Cmr - ген резистентности к хлорамфениколу и ori - точка начала репликации.
Фиг.3 представляет карту рестрикции плазмиды pTVDCH. bchH является геном протопорфирин IX связывающей субъединицы хелатазы магния фотосинтезирующей бактерии Rhodobackter sphaeroides. lac pro представляет последовательность промотора лактозного оперона. Ampr - это ген резистентности к ампициллину и ori - точка начала репликации.
Фиг.4 представляет карту рестрикции плазмиды pBIBCH. bchH является геном протопорфирин IX связывающей субъединицы хелатазы магния фотосинтезирующей бактерии Rhodobackter sphaeroides. NP представляет последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII - это ген резистентности к канамицину, a RB и LB соответственно правая и левая граничные последовательности Т-ДНК.
Фиг.5 представляет карту рестрикции плазмиды pNO. NP представляет собой последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII представляет ген резистентности к канамицину, а RB и LB представляют соответственно правую и левую граничные последовательности Т-ДНК.
Фиг.6 представляет карту рестрикции плазмиды pTCHLH. TCHLH является геном протопорфирин IX связывающей субъединицы хелатазы магния табака, в которой удален транзитный сигнал хлоропластов. lac pro представляет собой последовательность промотора лактозного оперона. Amr - это ген резистентности к ампициллину, Kmr - ген резистентности к канамицину и ori - точка начала репликации.
Фиг.7 представляет карту рестрикции плазмиды pBITCHLH. TCHLH представляет ген протопорфирин IX связывающей субъединицы хелатазы магния табака, в которой удален транзитный сигнал хлоропласта. NP - последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII - ген резистентности к канамицину, a RB и LB представляют соответственно правую и левую граничные последовательности Т-ДНК.
Фиг.8 представляет карту рестрикции плазмиды pTVGMP. GMP является геном протопорфириноген оксидазы (РРО) из бобов сои, в котором удален транзитный сигнал хлоропласта и FAD-связывающая последовательность. lac pro представляет последовательность промотора лактозного оперона. Ampr представляет ген резистентности к ампициллину и ori - точка начала репликации.
Фиг.9 представляет карту рестрикции плазмиды pBIGMP. GMP является геном протопорфириноген оксидазы (РРО) из бобов сои, в котором удален транзитный сигнал хлоропласта и FAD-связывающая последовательность. NP - последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII - это ген резистентности к канамицину, a RB и LB - соответственно правая и левая граничные последовательности Т-ДНК.
Фиг.10 представляет карту рестрикции плазмиды pTVCRP. CRP является геном протопорфириноген оксидазы (РРО) Chlamydomonas reinhardtii, в котором удален транзитный сигнал хлоропласта и FAD-связывающая последовательность. lac pro представляет последовательность промотора лактозного оперона. Amr - ген резистентности к ампициллину и ori - точка начала репликации.
Фиг.11 представляет карту рестрикции плазмиды pBICRP. CRP является геном протопорфириноген оксидазы (РРО) Chlamydomonas reinhardtii, в котором удален транзитный сигнал хлоропласта и FAD-связывающая последовательность. NP - последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 353 промотор вируса мозаики цветной капусты, NPTII - это ген резистентности к канамицину, а RB и LB - соответственно правая и левая граничные последовательности Т-ДНК.
Фиг.12 представляет карту рестрикции плазмиды pTVHVFI. HVF является геном феррохелатазы ячменя, в котором удалена сигнальная последовательность. lac pro представляет последовательность промотора лактозного оперона. Amr - ген резистентности к ампициллину и ori - точка начала репликации.
Фиг.13 представляет карту рестрикции плазмиды pBIHVF. HVF является геном феррохелатазы ячменя, в котором удалена сигнальная последовательность. NP - последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII - это ген резистентности к канамицину, a RB и LB - соответственно правая и левая граничные последовательности Т-ДНК.
Фиг.14 представляет карту рестрикции плазмиды pTVCSF. CSF является геном феррохелатазы огурца, в котором удалена сигнальная последовательность. lac pro представляет последовательность промотора лактозного оперона. Amr - это ген резистентности к ампициллину и ori - точка начала репликации.
Фиг.15 представляет карту рестрикции плазмиды pBICSF. CSF является геном феррохелатазы огурца, в котором удалена сигнальная последовательность. NP - последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII - ген резистентности к канамицину, а RB и LB - соответственно правая и левая граничные последовательности Т-ДНК.
Фиг.16 представляет карту рестрикции плазмиды pHEMF. HEMF является геном копропорфириноген III оксидазы (hemF) Escherichia coli. lac pro представляет последовательность промотора лактозного оперона. Amr - это ген резистентности к ампициллину и ori - точка начала репликации.
Фиг.17 представляет карту рестрикции плазмиды pBIHEMF. HEMF является геном копропорфириноген III оксидазы (hemF) Escherichia coli. NP - последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII - это ген резистентности к канамицину, a RB и LB - соответственно правая и левая граничные последовательности Т-ДНК.
Фиг.18 представляет карту рестрикции плазмиды pBIHASYS8. HASYS8 является геном, кодирующим белок MG(HASYS)8. NP - последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII - это ген резистентности к канамицину, а RB и LB - соответственно правая и левая граничные последовательности Т-ДНК.
Фиг.19 представляет карту рестрикции плазмиды pBIRASSL8. RASSL8 является геном, кодирующим белок MG(HASYS)8. NP - последовательность промотора гена нопалинсинтазы, NT - последовательность терминатора гена нопалинсинтазы, 35S - 35S промотор вируса мозаики цветной капусты, NPTII - это ген резистентности к канамицину, а RB и LB - соответственно правая и левая граничные последовательности Т-ДНК.
Краткое описание изобретения
При указанных обстоятельствах создатели настоящего изобретения интенсивно изучали, как разработать новый тип способа придания растениям резистентности к соединениям, подавляющим сорняки. В результате было обнаружено, что резистентность к соединениям, подавляющим сорняки, можно придать растениям путем создания условий, в которых растения вырабатывают определенный белок в клетках растений. Таким образом, настоящее изобретение было завершено.
Итак, настоящее изобретение предоставляет:
1. Способ придания растениям резистентности к соединениям, подавляющим сорняки, который включает стадии:
введение гена, кодирующего белок, имеющий следующие характеристики (а)-(с):
(a) наличие специфического сродства к веществу, связанному с подавляющей сорняки активностью у соединения, подавляющего сорняки,
(b) отсутствие значимой способности к модификации вещества, к которому упомянутый белок имеет специфическое сродство, и
(c) освобожденность в значительной степени от каркасных участков вариабельного района иммуноглобулина в клетке растения; и
экспрессию гена (далее используется термин - первый аспект способа настоящего изобретения).
2. Способ согласно вышеуказанному 1, по которому ген вводят в клетку растения в форме, в которой его действенно связывают с оператором и промотором, и оба из них являются функционирующими в клетке растения.
3. Способ согласно вышеуказанным 1 и 2, в котором вещество, связанное с активностью подавления сорняков в соединении, подавляющем сорняки, само является соединением, подавляющим сорняки.
4. Способ согласно вышеуказанным 1 и 2, в котором вещество, связанное с активностью подавления сорняков в соединении, подавляющем сорняки, является эндогенным веществом растения.
5. Способ согласно вышеуказанным 1 и 2, в котором соединение, подавляющее сорняки, является ингибитором биосинтеза порфиринов у растения.
6. Способ согласно вышеуказанным 1 и 2, в котором соединение, подавляющее сорняки, является гербицидным соединением типа ингибитора протопорфириноген IX оксидазы.
7. Способ согласно вышеуказанным 5 и 6, в котором вещество, связанное с активностью подавления сорняков у соединения, подавляющего сорняки, является протопорфирином IX.
8. Способ согласно вышеуказанным 5 и 6, в котором белок является протопорфирин IX связывающей субъединицей белка хелатазы магния или вариантом упомянутого белка, имеющим специфическое сродство к протопорфирину IX.
9. Способ по вышеуказанному 8, в котором белок является хелатазой магния, полученной из фотосинтезирующего организма.
10. Способ по вышеуказанному 8, в котором белок является хелатазой магния, полученной из растения.
11. Способ по вышеуказанному 8, в котором белок является хелатазой магния, полученной из табака.
12. Способ по вышеуказанным 5 и 6, в котором белок включает аминокислотную последовательность SEQ ID NO:53.
13. Способ по вышеуказанным 5 и 6, в котором белок включает аминокислотную последовательность SEQ ID NO:54.
14. Способ по вышеуказанным 5 и 6, в котором белок включает аминокислотную последовательность SEQ ID NO:55.
15. Способ по вышеуказанным 5 и 6, в котором белок включает аминокислотную последовательность SEQ ID NO:56.
16. Способ по вышеуказанным 5 и 6, в котором белок включает аминокислотную последовательность SEQ ID NO:57.
17. Способ по вышеуказанным 5 и 6, в котором белок включает аминокислотную последовательность SEQ ID NO:58.
18. Способ по вышеуказанным 5 и 6, в котором белок включает аминокислотную последовательность SEQ ID NO:59.
19. Способ по вышеуказанным 5 и 6, в котором белок включает аминокислотную последовательность SEQ ID NO:60.
20. Способ по вышеуказанным 5 и 6, в котором белок состоит из 4-100 аминокислот.
21. Способ согласно вышеуказанным 5 и 6, в котором вещество, связанное с активностью подавления сорняков у соединения, подавляющего сорняки, является протопорфириногеном IX.
22. Способ согласно вышеуказанным 5 и 6, в котором белок является вариантом протопорфириноген IX оксидазы, не обладающим способностью к окислению протопорфириногена IX и имеющим специфическое сродство к протопорфириногену IX.
23. Способ согласно вышеуказанным 5 и 6, в котором белок является вариантом протопорфириноген IX оксидазы, не обладающим способностью к окислению протопорфириногена IX и имеющим специфическое сродство к гербицидному соединению типа ингибитора протопорфирин IX оксидазы.
24. Способ согласно вышеуказанным 22 и 23, в котором белок является вариантом протопорфириноген IX оксидазы, полученной из растения.
25. Способ согласно вышеуказанным 22 и 23, в котором белок является вариантом протопорфириноген IX оксидазы, полученной из соевых бобов.
26. Способ согласно вышеуказанным 22 и 23, в котором белок является вариантом протопорфириноген IX оксидазы, полученной из водоросли.
27. Способ согласно вышеуказанным 22 и 23, в котором белок является вариантом протопорфириноген IX оксидазы, полученной из Chlamydomonas.
28. Способ придания растениям резистентности к соединениям, применяемым для подавления сорняков, который включает стадии:
введение гена, кодирующего белок, имеющий следующие характеристики (а)-(с):
(a) наличие специфического сродства к протопорфирину IX;
(b) отсутствие значимой способности к модификации протопорфириногена IX; и
(c) освобожденность в существенной степени от каркасных участков вариабельного участка иммуноглобулина в клетке растения, и
экспрессию гена (далее используется термин - второй аспект способа настоящего изобретения).
29. Способ согласно вышеуказанному 28, в котором ген вводят в клетку растения в форме, в которой его действенно соединяют с промотором и терминатором, причем оба являются функционирующими в клетке растения.
30. Способ согласно вышеуказанным 28 и 29, в котором соединение, подавляющее сорняки, является ингибитором биосинтеза порфиринов в растении.
31. Способ согласно вышеуказанным 28 и 29, в котором соединение, подавляющее сорняки, является гербицидным соединением типа ингибитора протопорфириноген IX оксидазы.
32. Способ согласно вышеуказанным 30 и 31, в котором белок является хелатазой магния или вариантом упомянутого белка, имеющим специфическое сродство к протопорфирину IX.
33. Способ согласно вышеуказанным 30 и 31, в котором белок является феррохелатазой или вариантом указанного белка, имеющим специфическое сродство к протопорфирину IX.
34. Способ согласно вышеуказанным 30 и 31, в котором белок является феррохелатазой, полученной из растения.
35. Способ согласно вышеуказанным 30 и 31, в котором белок является феррохелатазой, полученной из ячменя.
36. Способ согласно вышеуказанным 30 и 31, в котором белок является феррохелатазой, полученной из огурца.
37. Способ согласно вышеуказанным 30 и 31, в котором белок является пептидом, состоящим из 4-100 аминокислот.
38. Способ придания растениям резистентности к соединениям, подавляющим сорняки, который включает стадии:
введение гена, кодирующего белок, имеющий следующие характеристики (а)-(с):
(a) наличие специфического сродства к протопорфириногену IX;
(b) отсутствие способности к модификации копропорфириногена III;
(c) освобожденность в существенной степени от каркасных участков вариабельного участка иммуноглобулина в клетке растения, и
экспрессию гена (далее используется термин - третий аспект способа настоящего изобретения).
39. Способ согласно вышеуказанному 38, в котором ген вводят в клетку растения в форме, в которой его действенно соединяют с промотором и терминатором, причем оба являются функциональными в клетке растения.
40. Способ согласно вышеуказанным 38 и 39, в котором белок является копропорфириноген III оксидазой или вариантом указанного белка, имеющим специфическое сродство к протопорфириногену IX.
41. Способ согласно вышеуказанным 38 и 39, в котором белок является копропорфириноген III оксидазой, полученной из микроорганизма.
42. Способ согласно вышеуказанным 38 и 39, в котором белок является копропорфириноген III оксидазой Escherichia coli.
43. Растение, обладающее резистентностью к соединению, подавляющему сорняки, резистентность которому придается способом по вышеуказанным 1, 2, 28 или 29.
44. Растение, обладающее резистентностью к соединению, подавляющему сорняки, резистентность которому придается с помощью способа по вышеуказанным 38 или 39.
45. Способ защиты растения, который включает внесение соединения, подавляющего сорняки, в область выращивания растения по вышеуказанному 43.
46. Способ защиты растения, который включает внесение соединения, подавляющего сорняки, в область выращивания растения по вышеуказанному 44.
47. Способ селекции растения, который включает внесение соединения, подавляющего сорняки, к которому растение по вышеуказанному 43 является резистентным, в область выращивания растения по вышеуказанному 43 и других растений, и селекцию растения на основании различия в росте между растениями.
48. Способ селекции растения, который включает внесение соединения, подавляющего сорняки, к которому растение по вышеуказанному 44 является резистентным, в область выращивания растения по вышеуказанному 44 и других растений, и селекцию растения на основании различия в росте между растениями.
49. Способ по вышеуказанному 47, в котором растения являются клетками растений.
50. Способ по вышеуказанному 48, в котором растения являются клетками растений.
51. Способ по вышеуказанным 1 или 2, в котором соединение, подавляющее сорняки, является гербицидным соединением типа ингибитора протопорфириноген IX оксидазы, выбранным из нижеперечисленных соединений (1)-(3), а вещество, связанное с активностью подавления сорняков у соединения, подавляющего сорняки, является протопорфирином IX, протопорфириногеном IX или гербицидным соединением типа ингибитора протопорфириноген IX оксидазы:
(1) хлорметоксинил, бифенокс, хлорнитрофен (CNP), ацифлуорфен (5-[2-хлор-4-(трифторметил)фенокси]-2-нитробензойная кислота) и его сложный этиловый эфир, ацифлуорфен-натрий, оксифлуорфен (2-хлор-1-(3-этокси-4-нитрофенокси)-4-трифторметилбензол), оксадиазон (3-[2,4-дихлор-5-(1-метил-этокси)фенил)]-5-(1,1-диметилэтил)-1,3,4-оксадиазол-2Н-(3Н)-он), 2-[4-хлор-2-фтор-5-(проп-2-инилокси)фенил]-2,3,4,5,6,7-гексагидро-1Н-изоиндол-1,3-дион, хлорфталим (N-(4-хлорфенил)-3,4,5,6-тетрагидрофталимид), TNPP-этил (этил 2-[1-(2,3,4-трихлорфенил)-4-нитропиразолил-5-окси]пропионат) или N3-(1-фенилэтил)-1, 6-диметил-5-пропионилникотинамид;
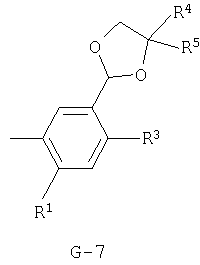
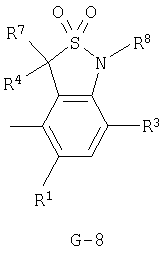
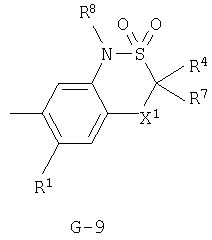
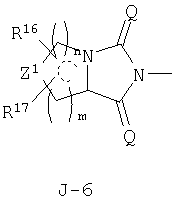
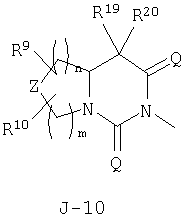
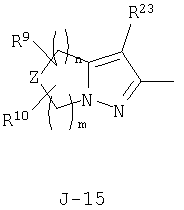
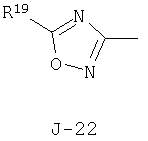
(2) соединение, представленное общей формулой J-G(I), где G является группой, представленной любой из следующих общих формул G-1-G-9, a J является группой, представленной любой из следующих общих формул J-1-J-30:


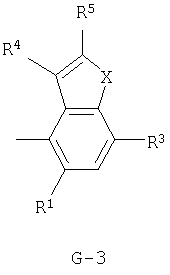

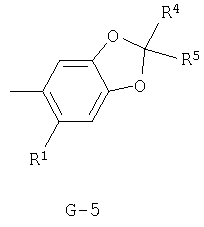
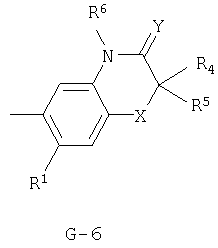

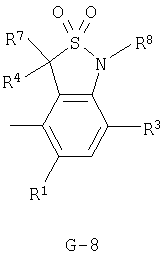




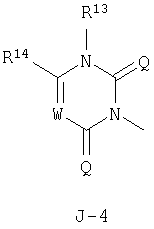
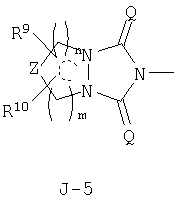
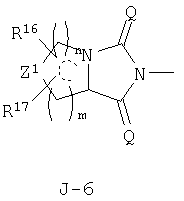
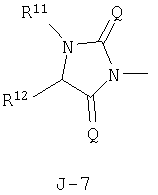
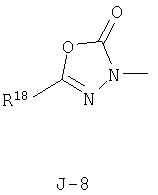
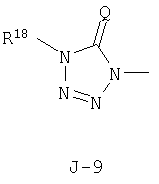
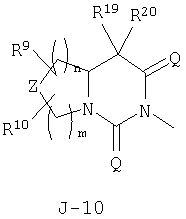



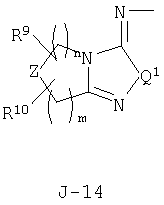
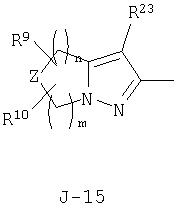
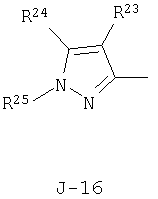
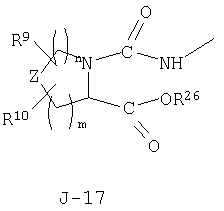

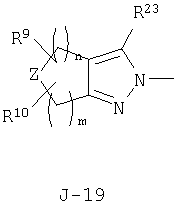

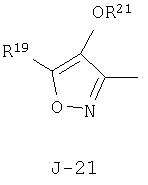



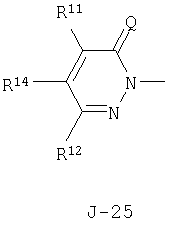
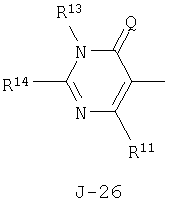

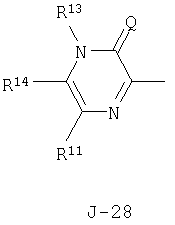

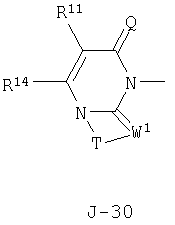
в которых пунктирные линии в формулах J-5, J-6, J-12 и J-24 представляют, что левостороннее кольцо содержит только одинарные связи или одна связь в кольце является двойной связью между атомами углерода;
Х представляет атом кислорода или атом серы;
Y представляет атом кислорода или атом серы;
R1 представляет атом водорода или атом галогена;
R2 представляет атом водорода, C1-C8 алкильную группу, C1-С8 галогеналкильную группу, атом галогена, ОН-группу, OR27-группу, SH-группу, S(О)pR27-группу, COR27-группу, CO2R27-группу, C(O)SR27-группу, С(O)NR29R30-группу, СНО-группу, CR27=NOR36-группу, CH=CR37CO2R27-группу, CH2CHR37CO2R27-группу, CO2N=CR31R32-группу, нитрогруппу, цианогруппу, NHSO2R33-группу, NHSO2NHR33-группу, NR27R38-группу, NH2-группу или фенильную группу, необязательно замещенную одной или несколькими одинаковыми или разными C1-C4 алкильными группами;
р равно 0, 1 или 2;
R3 представляет C1-C2 алкильную группу, C1-C2 галогеналкильную группу, ОСН3-группу, SCH3-группу, OCHF2-группу, атом галогена, цианогруппу или нитрогруппу;
R4 представляет атом водорода, C1-С3 алкильную группу, C1-С3 галогеналкильную группу или атом галогена;
R5 представляет атом водорода, C1-С3 алкильную группу, атом галогена, C1-С3 галогеналкильную группу, циклопропильную группу, винильную группу, С2 алкинильную группу, цианогруппу, С(О)R38-группу, CO2R38-группу, С(О)NR38R39-группу, CR34R35CN-группу, CR34R35C(О)R38-группу, CR34R35CO2R38-группу, CR34R35C(O)NR38R39-группу, CHR34OH-группу, CHR34OC(О)R38-группу или OCHR34OC(О)NR38R39-группу, или, если G является G-2 или G-6, то R4 и R5 могут образовывать С=O группу вместе с атомом углерода, к которому они присоединены;
R6 представляет C1-C6 алкильную группу, C1-C6 галогеналкильную группу, С2-С6 алкоксиалкильную группу, С3-С6 алкенильную группу или С3-С6 алкинильную группу;
X1 представляет одинарную связь, атом кислорода, атом серы, NH-группу, N(C1-C3 алкил)группу, N(C1-С3 галогеналкил)группу или N(аллил)группу;
R7 представляет атом водорода, C1-C6 алкильную группу, C1-С6 галогеналкильную группу, атом галогена, S(O)2(C1-C6 алкил) группу или С(=O)R40-группу;
R8 представляет атом водорода, C1-С8 алкильную группу, С3-С8 циклоалкильную группу, С3-С8 алкенильную группу, С3-С8 алкинильную группу, C1-C8 галогеналкильную группу, С2-С8 алкоксиалкильную группу, С3-С8 алкоксиалкоксиалкильную группу, С3-С8 галогеналкинильную группу, С3-С8 галогеналкенильную группу, C1-C8 алкилсульфонильную группу, C1-С8 галогеналкилсульфонильную группу, С3-С8 алкоксикарбонилалкильную группу, S(О)2NH(C1-С8 алкил)группу, C(O)R41-группу или бензильную группу, фенильное кольцо которой может быть замещено R42;
n и m независимо равны 0, 1, 2 или 3, а m+n равно 2 или 3;
Z представляет CR9R10-группу, атом кислорода, атом серы, S(O)-группу, S(O)2-группу или N(C1-C4 алкил) группу;
каждый R9 независимо представляет атом водорода, C1-С3 алкильную группу, атом галогена, гидроксильную группу, C1-C6 алкоксигруппу, C1-C6 галогеналкильную группу, C1-C6 галогеналкоксигруппу, С2-С6 алкилкарбонилоксигруппу или С2-С6 галогеналкилкарбонилоксигруппу;
каждый R10 независимо представляет атом водорода, C1-С3 алкильную группу, гидроксильную группу или атом галогена;
R11 и R12 независимо представляют атом водорода, атом галогена, C1-С6 алкильную группу, С3-С6 алкенильную группу или C1-С6 галогеналкильную группу;
R13 представляет атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, С3-С6 алкенильную группу, С3-С6 галогеналкенильную группу, С3-С6 алкинильную группу, С3-С6 галогеналкинильную группу, НС(=O)-группу, (C1-C4 алкил)С(=O)-группу или NH2-группу;
R14 представляет C1-C6 алкильную группу, C1-C6 алкилтио-группу, C1-C6 галогеналкильную группу или N(СН3)2 группу;
W представляет атом азота или CR15;
R15 представляет атом водорода, C1-C6 алкильную группу, атом галогена или фенильную группу, необязательно замещенную C1-C6 алкильной группой, одним или двумя атомами галогена, C1-C6 алкоксигруппой или CF3 группой;
каждый Q независимо представляет атом кислорода или атом серы;
Q1 представляет атом кислорода или атом серы;
Z1 представляет CR16R17-группу, атом кислорода, атом серы, S(O)-группу, S(O)2-группу или N(C1-C4 алкил) группу;
каждый R16 независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-C6 алкоксигруппу, C1-C6 галогеналкильную группу, C1-C6 галогеналкоксигруппу, С2-С6 алкилкарбонилоксигруппу или С2-С6 галогеналкилкарбонилоксигруппу;
каждый R17 независимо представляет атом водорода, гидроксильную группу или атом галогена;
R18 представляет C1-C6 алкильную группу, атом галогена или C1-С6 галогеналкильную группу;
R19 и R20 независимо представляют атом водорода, C1-C6 алкильную группу или C1-C6 галогеналкильную группу;
Z2 представляет атом кислорода, атом серы, NR9 группу или CR9R10-группу;
R21 и R22 независимо представляют C1-C6 алкильную группу, C1-C6 галогеналкильную группу, С3-С6 алкенильную группу, С3-С6 галогеналкенильную группу, С3-С6 алкинильную группу или С3-С6 галогеналкинильную группу;
R23 представляет атом водорода, атом галогена или циано-группу;
R24 представляет C1-C6 алкилсульфонильную группу, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, С3-С6 алкенильную группу, С3-С6 алкинильную группу, C1-C6 алкоксигруппу, C1-C6 галогеналкоксигруппу или атом галогена;
R25 представляет C1-C6 алкильную группу, C1-С6 галогеналкильную группу, С3-С6 алкенильную группу или С3-С6 алкинильную группу;
R26 представляет C1-С6 алкильную группу, C1-С6 галогеналкильную группу или фенильную группу, необязательно замещенную C1-С6 алкилом, одним или двумя атомами галогена, одной или двумя нитрогруппами, C1-С6 алкоксигруппой или CF3 группой;
W1 представляет атом азота или СН группу;
Т представляет собой группу, представленную одной из следующих общих формул Т-1, Т-2 и Т-3:
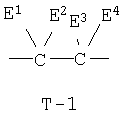
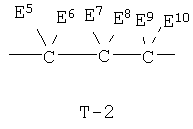

(где Е1, Е2, Е3, Е4, Е5, Е6, Е7, Е8, Е9, Е10, Е11 и Е12 независимо представляют атом водорода или C1-С3 алкильную группу);
R27 представляет C1-C8 алкильную группу, С3-С8 циклоалкильную группу, С3-С8 алкенильную группу, С3-С8 алкинильную группу, C1-C8 галогеналкильную группу, С2-С8 алкоксиалкильную группу, С2-С8 алкилтиоалкильную группу, C2-C8 алкилсульфинилалкильную группу, С2-С8 алкилсульфонилалкильную группу, C1-C8 алкил-сульфонильную группу, фенилсульфонильную группу, фенильное кольцо которой может быть замещено по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена и C1-C4 алкильной группы, C4-С8 алкоксиалкоксиалкильную группу, C4-C8 циклоалкилалкильную группу, С6-С8 циклоалкоксиалкильную группу, С4-С8 алкенилоксиалкильную группу, С4-С8 алкинилоксиалкильную группу, С3-С8 галогеналкоксиалкильную группу, С4-С8 галогеналкенилоксиалкильную группу, С4-С8 галогеналкинилоксиалкильную группу, C3-C8 циклоалкилтиоалкильную группу, С4-С8 алкенилтиоалкильную группу, С4-С8 алкинилтиоалкильную группу, C1-C4 алкильную группу, замещенную феноксигруппой, цикл которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-С3 алкильной группы и C1-С3 галогеналкильной группы, бензилоксигруппу, цикл которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-С3 алкильной группы и C1-С3 галогеналкильной группы, С4-С8 триалкилсилилалкильную группу, С3-С8 цианоалкильную группу, С3-С8 галогенциклоалкильную группу, С3-С8 галогеналкенильную группу, С5-С8 алкоксиалкенильную группу, C5-C8 галогеналкоксиалкенильную группу, C5-С8 алкилтиоалкенильную группу, С3-С8 галогеналкинильную группу, C5-C8 алкоксиалкинильную группу, С5-С8 галогеналкоксиалкинильную группу, С5-С8 алкилтиоалкинильную группу, С2-С8 алкилкарбонильную группу, бензильную группу, цикл которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-С3 алкильной группы и C1-С3 галогеналкильной группы, CHR34COR28 группу, CHR34COOR28 группу, CHR34P(O)(OR28)2 группу, CHR34P(S)(OR28)2 группу, CHR34C(O)NR29R30 группу или CHR34C(O)NH2 группу;
R28 представляет C1-C6 алкильную группу, C2-C6 алкенильную группу, С3-С6 алкинильную группу или тетрагидрофуранильную группу;
R29 и R31 независимо представляют атом водорода или C1-C4 алкильную группу;
R30 и R32 независимо представляют C1-C4 алкильную группу или фенильную группу, цикл которой может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-С3 алкильной группы и C1-С3 галогеналкильной группы; или
R29 и R30 могут вместе образовать -(CH2)5-, -(CH2)4- или -СН2СН2OCH2СН2-, или цикл, образованный таким образом, может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-С3 алкильной группы, фенильной группы и бензильной группы; или
R31 и R32 могут образовать С3-С8 циклоалкильную группу вместе с атомом углерода, к которому они присоединены;
R33 представляет C1-C4 алкильную группу, C1-C4 галогеналкильную группу или С3-С6 алкенильную группу;
R34 и R35 независимо представляют атом водорода или C1-C4 алкильную группу;
R36 представляет атом водорода, C1-C6 алкильную группу, С3-С6 алкенильную группу или С3-С6 алкинильную группу;
R37 представляет атом водорода, C1-C4 алкильную группу или атом галогена;
R38 представляет атом водорода, C1-C6 алкильную группу, С3-С6 циклоалкильную группу, С3-С6 алкенильную группу, С3-С6 алкинильную группу, С2-С6 алкоксиалкильную группу, C1-C6 галогеналкильную группу, фенильную группу, цикл которой может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-C4 алкильной группы и C1-C4 алкоксигруппы, -СН2СO2 (C1-C4 алкил) группу или -СН(СН3)СО2(C1-C4 алкил)группу;
R39 представляет атом водорода, C1-C2 алкильную группу или С(О)О(C1-C4 алкил)группу;
R40 представляет атом водорода, C1-C6 алкильную группу, C1-C6 алкоксигруппу или NH(C1-C4 алкил) группу;
R41 представляет C1-C6 алкильную группу, C1-C6 галогеналкильную группу, C1-C6 алкоксигруппу, NH(C1-C6 алкил)группу, фенильную группу, цикл которой может быть замещен одним заместителем, выбранным из группы, состоящей из R42 группы, бензильной группы и С2-С8 диалкиламиногруппы; и
R42 представляет C1-C6 алкильную группу, один или два атома галогена, C1-C6 алкоксигруппу или CF3 группу;
(3) соединение формулы (II):
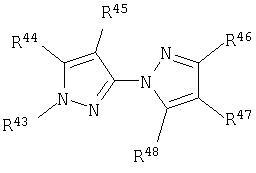
или нипилакрофен
в котором R43 представляет C1-C4 алкильную группу;
R44 представляет C1-C4 алкильную группу, C1-C4 алкилтиогруппу, C1-C4 алкоксигруппу, C1-C4 галогеналкильную группу, C1-C4 галогеналкилтиогруппу или C1-C4 галогеналкоксигруппу;
R43 и R44 могут вместе образовать -(СН2)3- или -(СН2)4-;
R45 представляет атом водорода или атом галогена;
R46 представляет атом водорода или C1-C4 алкильную группу;
R47 представляет атом водорода, нитрогруппу, цианогруппу, -COOR49 группу, -C(=X)NR50R51 группу или -C(=X2)R52 группу;
R48 представляет атом водорода, атом галогена, цианогруппу, C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена и гидроксильной группы, C1-C4 алкоксигруппу, фенильную группу, необязательно замещенную по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, нитрогруппы, цианогруппы, C1-C4 алкильной группы, C1-C4 алкоксигруппы и галоген-C1-C4 алкильной группы, пирролильную группу, С2-С8 алкильную группу, С3-С8 алкенильную группу, С3-С8 алкинильную группу, С3-С8 алкоксигруппу, группу, выбранную из группы, состоящей из С2-С8 алкильной группы, С3-С8 алкенильной группы, С3-С8 алкинильной группы, С3-С8 алкоксигруппы, в которую введен по меньшей мере один атом кислорода, или любую одну из групп, представленных следующими формулами:

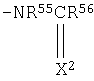
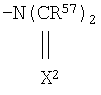

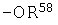
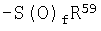

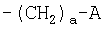
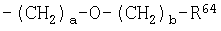
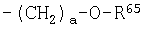

где R49, R50 и R52 являются одинаковыми или разными, атомом водорода или C1-C4 алкильной группой;
R50 и R51 могут образовать вместе с атомом азота, к которому они присоединены, насыщенный алициклический 5- или 6-членный цикл;
R52 представляет атом водорода, C1-C4 алкильную группу или C1-C4 алкильную группу, замещенную по меньшей мере одним атомом галогена;
R53 представляет атом водорода, C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С2-С6 алкенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С6 алкинильную группу, необязательно замещенную по меньшей мере одним атомом галогена, фенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С8 циклоалкильную группу, цианометильную группу или R63CO-группу;
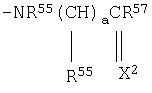
R54 представляет атом водорода, C1-C6 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С2-С6 алкенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С6 алкинильную группу, необязательно замещенную по меньшей мере одним атомом галогена, фенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С8 циклоалкильную группу, цианометильную группу, C1-C4 алкокси-C1-C6 алкильную группу, ди-С1-С4 алкиламино-С1-С4 алкильную группу, тетрагидрофурфурилметильную группу, С3-С6 алкинилокси-С1-С4 алкильную группу, бензил, цикл которого может быть замещен заместителем, выбранным из группы, состоящей из атома галогена, нитрогруппы, цианогруппы, C1-C4 алкильной группы, C1-C4 алкоксигруппы и галоген-C1-C4 алкильной группы, -C(=X2)R63 группу, -(CH2)a-(O)d-R70 группу, -(СН2)а-О-(CH2)b-R70 группу, -(СН2)a-X2-R76 группу;
R53 и R54 могут образовать вместе с атомом азота, к которому они присоединены, насыщенный алициклический 3-, 5- или 6-членный цикл, или ароматический 5- или 6-членный цикл, в котором атом углерода может быть необязательно заменен атомом кислорода;
R55 представляет атом водорода, C1-C4 алкильную группу, С2-С6 алкенильную группу, С3-С6 алкинильную группу или R55 и R56 вместе могут образовать -(СН2)е-:
R56 и R57 независимо представляют C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С2-С6 алкенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С6 алкинильную группу, необязательно замещенную по меньшей мере одним атомом галогена или фенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, атомом водорода, С3-С6 циклоалкильной группой, -XR60 группой или NR61R62 группой;
R58 представляет атом водорода, C1-C6 алкильную группу, С2-С6 алкенильную группу, С3-С6 алкинильную группу, C1-C4 алкилкарбонильную группу, циано-С1-С3 алкильную группу, C1-C4 алкоксикарбонил-С1-С4 алкильную группу, ди-С1-С4 алкоксикарбонил-C1-С4 алкильную группу, бензильную группу, C1-C4 алкокси-С1-С4 алкинильную группу, -(СН2)а-R75 группу, -(СН2)a-X2R72 группу, -(СН2)a-X2-(CH2)bR72 группу или -(СН2)a-X2-(CH2)b-X2-(CH2)c-R72 группу;
R59 представляет атом водорода, C1-C4 алкильную группу, C2-С6 алкенильную группу, С3-С6 алкинильную группу, циано-С1-С3 алкильную группу, C1-C4 алкилкарбонил-С1-С3 алкильную группу или фенильную группу;
R60 представляет C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена;
R61 и R62 являются, одинаковые или разные, атомом водорода или C1-C4 алкильной группой;
R63 представляет C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена, C1-C4 алкокси-C1-C4 алкильную группу, C1-C4 алкилтио-С1-С4 алкильную группу, С3-С6 циклоалкильную группу, фенильную группу, цикл которой может быть замещен одним заместителем, выбранным из группы, состоящей из атома галогена, нитрогруппы, цианогруппы, C1-C4 алкильной группы, C1-C4 алкоксигруппы и галоген-C1-C4 алкильной группы, -NR73R74 группу или -(СН2)а-(О)d-R75 группу;
R64 представляет C1-C4 алкоксикарбонильную группу или карбоксильную группу;
R65 представляет хлорметильную группу, цианометильную группу, С3-С6 циклоалкильную группу, в которую может быть введен по меньшей мере один атом кислорода, или C1-C4 алкоксикарбонил-С1-С4 алкильную группу;
R66 представляет гидроксильную группу или -NR67R68 группу;
А представляет -NR67R68 группу или -S(O)f-R69 группу;
R67 и R68 являются, одинаковые или разные, атомом водорода или C1-C4 алкильной группой;
R69 представляет C1-C4 алкильную группу или C1-C4 галогеналкильную группу;
R70 представляет атом водорода, гидроксильную группу, атом галогена, C1-C4 алкильную группу, необязательно замещенную по меньшей мере одной C1-C4 алкоксигруппой, С3-С6 циклоалкильную группу, в которую может быть введен по меньшей мере один атом кислорода, С3-С6 циклоалкильную группу, необязательно замещенную одной или двумя метильными группами, фурильную группу, тиенильную группу или -C(=O)R71 группу;
R71 и R72 являются, одинаковые или разные, C1-C4 алкильной группой или C1-C4 алкоксигруппой;
R73 и R74 являются, одинаковые или разные, C1-C4 алкильной группой или фенильной группой;
R75 представляет С3-С6 циклоалкильную группу, в которую может быть введен по меньшей мере один атом кислорода, С3-С6 циклоалкильную группу, необязательно замещенную одной или двумя метильными группами, фурильную группу, тиенильную группу или -С(=O)R71 группу;
R76 представляет C1-C4 алкильную группу;
a, b и с независимо равны 1, 2 или 3;
d равно 0 или 1;
е равно 2 или 3;
f равно 1 или 2 и
X2 представляет атом кислорода или атом серы.
Подробное описание изобретения
В способе настоящего изобретения вещества, связанные с активностями подавления сорняков, соединений, подавляющих сорняки (далее - соединения, подавляющие сорняки), являются веществами, составляющими часть систем метаболических реакций в организмах, которые ответственны за активность и подавление сорняков при нанесении соединений на растения. Примеры таких веществ включают соединения, подавляющие сорняки, как таковые, эндогенные вещества растений и т.п. Конкретно, такими эндогенными веществами растений являются, например, субстраты целевых ферментов, на которые действуют соединения, подавляющие сорняки, или предшественники или метаболиты субстратов, которые вызывают дисфункцию клеток при накоплении в клетках растений; вещества, продуцируемые вышеуказанными веществами в клетках растений, вызывающие дисфункцию клеток; и т.п. Более конкретно, известно, что когда соединение, обладающее гербицидной активностью (далее - гербицидное соединение), которое ингибирует активность протопорфириноген IX оксидазы (ЕС 1.3.3.4, далее - РРО), наносят на растения, протопорфириноген IX, являющийся субстратом РРО, накапливается в клетках растения и метаболизирует с образованием протопорфирина Х с последующим образованием активного кислорода в присутствии в клетках протопорфирина Х и света, который нарушает функции клеток (Junshi MIYAMOTO ed., Atarashii Noyaku Kagaku (Chemistry of New Agrochemicals), Chapter 3, Section 3.3, p 106 (1993), Hirokawa Shoten, Tokyo]. Таким образом, протопорфириноген IX, протопорфирин IX и активный кислород в этих системах и т.п. могут служить примерами таких веществ.
В способе настоящего изобретения соединения, подавляющие сорняки, включают соединения с гербицидной активностью, активностями регуляторов роста растений и т.п.
Примеры гербицидных соединений включают соединения, ингибирующие биосинтез порфирина, соединения, ингибирующие электронный перенос при фотосинтезе, соединения, ингибирующие биосинтез каротиноидов, соединения, ингибирующие биосинтез аминокислот, соединения, ингибирующие биосинтез липидов, соединения, ингибирующие биосинтез клеточных стенок, соединения, влияющие на биосинтез белков, биосинтез нуклеиновых кислот и на деление клеток, соединения, обладающие активностью антагонистов ауксина и т.п. Более конкретно, соединениями, ингибирующими биосинтез порфиринов, являются, например, соединения, ингибирующие РРО активность (гербицидное соединение РРО-ингибиторного типа) и т.п. Соединениями, ингибирующими электронный перенос при фотосинтезе, являются, например, соединения, ингибирующие электронный перенос в фотохимических системах I или II, соединения, ингибирующие 4-гидроксифенилпируватдиоксигеназу (ЕС 1.13.11.27; далее - 4-HPPD), влияющую на биосинтез пластохинона, который переносит электроны и т.п. Соединениями, ингибирующими биосинтез каротиноидов, являются, например, соединения, ингибирующие фитоендесатуразу (далее - PDS)и т.п. Соединениями, ингибирующими биосинтез аминокислот, являются, например, соединения, ингибирующие EPSPS, ацетолактатсинтазу (ЕС 4.1.3.18; далее - ALS), глутаминсинтетазу (ЕС 6.3.1.2; далее - GS), дигидроптероатсинтазу (ЕС 2.5.1.15; далее - DHP) и т.п. Соединениями, ингибирующими биосинтез липидов, являются, например, соединения, ингибирующие ацетил-СоА карбоксилазу (ЕС 6.4.1.2; далее - АСС) и т.п. Соединениями, ингибирующими биосинтез клеточных стенок, являются, например, соединения, ингибирующие биосинтез целлюлозы и т.п. Соединениями, влияющими на биосинтез белка, биосинтез нуклеиновых кислот и на деление клеток, являются, например, соединения, ингибирующие образование микротрубочек и т.п.
Примеры соединений, обладающих активностью регуляторов роста растений, включают соединения, обладающие антагонистической активностью против гормонов растений, усиливающих элонгацию и дифференциацию клеток и т.п. Конкретно, например, ими являются 2,4-D, феноксиалканкарбоновая кислота, производные бензойной кислоты, производные пиколиновой кислоты и т.п.
Вышеописанными гербицидными соединениями РРО-ингибиторного типа являются, например, соединения, описанные у Duke, S.O., Rebeiz, С.A., ACS Symposium Series 559, Porphyric Pesticides, Chemistry, Toxicology, and Pharmaceutical Applications, American Chemical Society, Washington DC (1994) и т.п. Конкретно, примеры таких соединений включают следующие соединения:
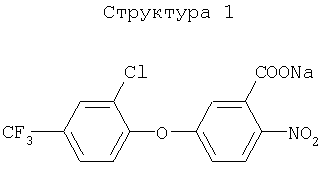
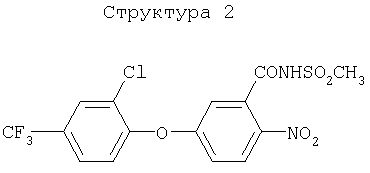
(1) хлорметоксинил, бифенокс, хлорнитрофен (CNP), ацифлуорфен (5-[2-хлор-4-(трифторметил)фенокси]-2-нитробензойная кислота) и его сложный этиловый эфир, ацифлуорфеннатрий, оксифлуорфен (2-хлор-1-(3-этокси-4-нитрофенокси)-4-трифторметилбензол), оксадиазон (3-[2,4-дихлор-5-(1-метилэтокси)фенил)]-5-(1,1-диметилэтил)-1,3,4-оксадиазол-2Н-(3Н)-он), 2-[4-хлор-2-фтор-5-(проп-2-инилокси)фенил]-2,3,4,5,6,7-гексагидро-1Н-изоиндол-1,3-дион, хлорфталим (N-(4-хлорфенил)-3,4,5,6-тетрагидрофталимид), TNPP-этил (этил 2-[1-(2,3,4-трихлорфенил)-4-нитропиразолил-5-окси]пропионат) или N3-(1-фенилэтил)-2,6-диметил-5-пропионилникотинамид;
(2) соединение, представленное общей формулой J-G(I), где G является группой, представленной любой из следующих общих формул G-1 - G-9, a J является группой, представленной любой из следующих общих формул J-1 - J-30:



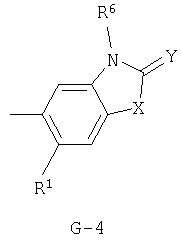
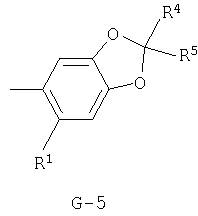
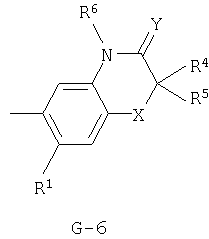


























в которых пунктирные линии в формулах J-5, J-6, J-12 и J-24 представляют, что левостороннее кольцо содержит только одинарные связи или одна связь в кольце является двойной связью между атомами углерода;
Х представляет атом кислорода или атом серы;
Y представляет атом кислорода или атом серы;
R1 представляет атом водорода или атом галогена;
R2 представляет атом водорода, C1-С8 алкильную группу, C1-С8 галогеналкильную группу, атом галогена, ОН-группу, OR27-группу, SH-группу, S(О)pR27-группу, COR27-группу, CO2R27-группу, С(О)SR27-группу, C(О)NR29R30-группу, СНО-группу, CR27=NOR36-группу, CH=CR37CO2R27-группу, CH2CHR37CO2R27-группу, CO2N=CR31R32-группу, нитрогруппу, цианогруппу, NHSO2R33-группу, NHSO2NHR33-группу, NR27R38-группу, NH2-группу или фенильную группу, необязательно замещенную одной или несколькими одинаковыми или разными C1-C4 алкильными группами;
р равно 0, 1 или 2;
R3 представляет C1-C2 алкильную группу, C1-C2 галогеналкильную группу, ОСН3-группу, SCH3-группу, OCHF2-группу, атом галогена, цианогруппу или нитрогруппу;
R4 представляет атом водорода, C1-С3 алкильную группу, C1-С3 галогеналкильную группу или атом галогена;
R5 представляет атом водорода, C1-С3 алкильную группу, атом галогена, C1-С3 галогеналкильную группу, циклопропильную группу, винильную группу, C2 алкинильную группу, цианогруппу, С(О)R38-группу, CO2R38-группу, С(О)NR38R39-группу, CR34R35CN-группу, CR34R35C(О)R38-группу, CR34R35CO2R38-группу, CR34R35C(О)NR38R39-группу, CHR34OH-группу, CHR34OC(О)R38-группу или OCHR34OC(О)NR38R39-группу, или, если G является G-2 или G-6, то R4 и R5 могут образовывать С=O группу вместе с атомом углерода, к которому они присоединены;
R6 представляет C1-C6 алкильную группу, C1-C6 галогеналкильную группу, С2-С6 алкоксиалкильную группу, С3-С6 алкенильную группу или С3-С6 алкинильную группу;
X1 представляет одинарную связь, атом кислорода, атом серы, NH-группу, N(C1-С3 алкил)группу, N(C1-С3 галогеналкил)группу или N(аллил)группу;
R7 представляет атом водорода, C1-C6 алкильную группу, C1-С6 галогеналкильную группу, атом галогена, S(O)2(C1-C6 алкил) группу или С(=O)R40-группу;
R8 представляет атом водорода, C1-С8 алкильную группу, С3-С8 циклоалкильную группу, С3-С8 алкенильную группу, С3-С8 алкинильную группу, C1-С8 галогеналкильную группу, С2-С8 алкоксиалкильную группу, С3-С8 алкоксиалкоксиалкильную группу, С3-С8 галогеналкинильную группу, С3-С8 галогеналкенильную группу, C1-С8 алкилсульфонильную группу, C1-C8 галогеналкилсульфонильную группу, С3-С8 алкоксикарбонилалкильную группу, S(О)2NH(C1-C8 алкил)группу, C(O)R41-группу или бензильную группу, фенильное кольцо которой может быть замещено R42;
n и m независимо равны 0, 1, 2 или 3, а m+n равно 2 или 3;
Z представляет CR9R10-группу, атом кислорода, атом серы, S(О)-группу, S(О)2-группу или N(C1-C4 алкил) группу;
каждый R9 независимо представляет атом водорода, C1-С3 алкильную группу, атом галогена, гидроксильную группу, C1-C6 алкоксигруппу, C1-C6 галогеналкильную группу, C1-C6 галогеналкоксигруппу, С2-С6 алкилкарбонилоксигруппу или C2-C6 галоген-алкилкарбонилоксигруппу;
каждый R10 независимо представляет атом водорода, C1-С3 алкильную группу, гидроксильную группу или атом галогена;
R11 и R12 независимо представляют атом водорода, атом галогена, C1-C6 алкильную группу, С3-С6 алкенильную группу или C1-С6 галогеналкильную группу;
R13 представляет атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, С3-С6 алкенильную группу, С3-С6 галогеналкенильную группу, С3-С6 алкинильную группу, С3-С6 галогеналкинильную группу, НС(=O)-группу, (C1-C4 алкил)С(=O)-группу или NH2-группу;
R14 представляет C1-C6 алкильную группу, C1-C6 алкилтиогруппу, C1-C6 галогеналкильную группу или N(СН3)2 группу;
W представляет атом азота или CR15;
R15 представляет атом водорода, C1-C6 алкильную группу, атом галогена или фенильную группу, необязательно замещенную C1-C6 алкильной группой, одним или двумя атомами галогена, C1-С6 алкоксигруппой или CF3 группой;
каждый Q независимо представляет атом кислорода или атом серы;
Q1 представляет атом кислорода или атом серы;
Z1 представляет CR16R17-группу, атом кислорода, атом серы, S(О)-группу, S(О)2-группу или N(C1-C4 алкил) группу;
каждый R16 независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-C6 алкоксигруппу, C1-C6 галогеналкильную группу, C1-С6 галогеналкоксигруппу, С2-С6 алкилкарбонилоксигруппу или С2-С6 галогеналкилкарбонилоксигруппу;
каждый R17 независимо представляет атом водорода, гидроксильную группу или атом галогена;
R18 представляет C1-C6 алкильную группу, атом галогена или C1-C6 галогеналкильную группу;
R19 и R20 независимо представляют атом водорода, C1-C6 алкильную группу или C1-C6 галогеналкильную группу;
Z2 представляет атом кислорода, атом серы, NR9 группу или CR9R10-группу;
R21 и R22 независимо представляют C1-C6 алкильную группу, C1-C6 галогеналкильную группу, С3-С6 алкенильную группу, С3-С6 галогеналкенильную группу, С3-С6 алкинильную группу или С3-С6 галогеналкинильную группу;
R23 представляет атом водорода, атом галогена или цианогруппу;
R24 представляет C1-С6 алкилсульфонильную группу, C1-С6 алкильную группу, C1-С6 галогеналкильную группу, С3-С6 алкенильную группу, С3-С6 алкинильную группу, C1-C6 алкоксигруппу, C1-С6 галогеналкоксигруппу или атом галогена;
R25 представляет C1-С6 алкильную группу, C1-С6 галогеналкильную группу, С3-С6 алкенильную группу или С3-С6 алкинильную группу;
R26 представляет C1-С6 алкильную группу, C1-С6 галогеналкильную группу или фенильную группу, необязательно замещенную C1-С6 алкилом, одним или двумя атомами галогена, одной или двумя нитрогруппами, C1-С6 алкоксигруппой или CF3 группой;
W1 представляет атом азота или СН группу;
Т представляет собой группу, представленную одной из следующих общих формул Т-1, Т-2 и Т-3:



(где Е1, Е2, Е3, Е4, Е5, Е6, Е7, Е8, Е9, Е10, Е11 и Е12 независимо представляют атом водорода или C1-С3 алкильную группу);
R27 представляет C1-C8 алкильную группу, С3-С8 циклоалкильную группу, С3-С8 алкенильную группу, С3-С8 алкинильную группу, C1-C8 галогеналкильную группу, C2-C8 алкоксиалкильную группу, С2-С8 алкилтиоалкильную группу, С2-С8 алкилсульфинилалкильную группу, С2-С8 алкилсульфонилалкильную группу, C1-C8 алкилсульфонильную группу, фенилсульфонильную группу, фенильное кольцо которой может быть замещено по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена и C1-C4 алкильной группы, С4-С8 алкоксиалкоксиалкильную группу, С4-С8 циклоалкилалкильную группу, С6-С8 циклоалкоксиалкильную группу, С4-С8 алкенилоксиалкильную группу, С4-С8 алкинилоксиалкильную группу, С3-С8 галогеналкоксиалкильную группу, С4-С8 галогеналкенилоксиалкильную группу, С4-С8 галогеналкинилоксиалкильную группу, С6-С8 циклоалкилтиоалкильную группу, С4-С8 алкенилтиоалкильную группу, С4-С8 алкинилтиоалкильную группу, C1-C4 алкильную группу, замещенную феноксигруппой, цикл которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-С3 алкильной группы и C1-С3 галогеналкильной группы, бензилоксигруппу, цикл которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-С3 алкильной группы и C1-С3 галогеналкильной группы, C4-C8 триалкилсилилалкильную группу, С3-С8 цианоалкильную группу, С3-С8 галогенциклоалкильную группу, С3-С8 галогеналкенильную группу, C5-C8 алкоксиалкенильную группу, C5-C8 галогеналкоксиалкенильную группу, C5-С8 алкилтиоалкенильную группу, С3-С8 галогеналкинильную группу, C5-С8 алкоксиалкинильную группу, C5-С8 галогеналкоксиалкинильную группу, C5-С8 алкилтиоалкинильную группу, С2-С8 алкилкарбонильную группу, бензильную группу, цикл которой замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-С3 алкильной группы и C1-С3 галогеналкильной группы, CHR34COR28 группу, CHR34COOR28 группу, CHR34P(O)(OR28)2 группу, CHR34P(S)(OR28)2 группу, CHR34C(O)NR29R30 группу или CHR34C(O)NH2 группу;
R28 представляет C1-C6 алкильную группу, С2-С6 алкенильную группу, С3-С6 алкинильную группу или тетрагидрофуранильную группу;
R29 и R31 независимо представляют атом водорода или C1-C4 алкильную группу;
R30 и R32 независимо представляют C1-C4 алкильную группу или фенильную группу, цикл которой может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-С3 алкильной группы и C1-С3 галогеналкильной группы; или
R29 и R30 могут вместе образовать -(CH2)5-, -(CH2)4- или -СН2СН2OCH2СН2-, или цикл, образованный таким образом, может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-С3 алкильной группы, фенильной группы и бензильной группы; или
R31 и R32 могут образовать С3-С8 циклоалкильную группу вместе с атомом углерода, к которому они присоединены;
R33 представляет C1-C4 алкильную группу, C1-C4 галогеналкильную группу или С3-С6 алкенильную группу;
R34 и R35 независимо представляют атом водорода или C1-C4 алкильную группу;
R36 представляет атом водорода, C1-C6 алкильную группу, С3-С6 алкенильную группу или С3-С6 алкинильную группу;
R37 представляет атом водорода, C1-C4 алкильную группу или атом галогена;
R38 представляет атом водорода, C1-C6 алкильную группу, С3-С6 циклоалкильную группу, С3-С6 алкенильную группу, С3-С6 алкинильную группу, С2-С6 алкоксиалкильную группу, C1-С6 галогеналкильную группу, фенильную группу, цикл которой может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, C1-C4 алкильной группы и C1-C4 алкоксигруппы, -CH2CO2(C1-C4 алкил) группу или -СН(СН3)СО2 (C1-C4 алкил) группу;
R39 представляет атом водорода, C1-C2 алкильную группу или С(О)(C1-C4 алкил)группу;
R40 представляет атом водорода, C1-С6 алкильную группу, C1-С6 алкоксигруппу или NH(C1-C4 алкил)группу;
R41 представляет C1-C6 алкильную группу, C1-C6 галогеналкильную группу, C1-C6 алкоксигруппу, NH(C1-C6 алкил)группу, фенильную группу, цикл которой может быть замещен одним заместителем, выбранным из группы, состоящей из R42 группы, бензильной группы и С2-С8 диалкиламиногруппы; и
R42 представляет C1-C6 алкильную группу, один или два атома галогена, C1-C6 алкоксигруппу или CF3 группу;
(3) соединение формулы (II):

или нипилакрофен
в котором R43 представляет C1-C4 алкильную группу;
R44 представляет C1-C4 алкильную группу, C1-C4 алкилтиогруппу, C1-C4 алкоксигруппу, C1-C4 галогеналкильную группу, C1-C4 галогеналкилтиогруппу или C1-C4 галогеналкоксигруппу;
R43 и R44 могут вместе образовать -(СН2)3- или -(СН2)4-;
R45 представляет атом водорода или атом галогена;
R45 представляет атом водорода или C1-C4 алкильную группу;
R47 представляет атом водорода, нитрогруппу, цианогруппу, -COOR49 группу, -C(=X)NR50R51 группу или -C(=X2)R52 группу;
R48 представляет атом водорода, атом галогена, цианогруппу, C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена и гидроксильной группы, C1-C4 алкоксигруппу, фенильную группу, необязательно замещенную по меньшей мере одним заместителем, выбранным из группы, состоящей из атома галогена, нитрогруппы, цианогруппы, C1-C4 алкильной группы, C1-C4 алкоксигруппы и галоген-C1-C4 алкильной группы, пирролильную группу, С2-С8 алкильную группу, С3-С8 алкенильную группу, С3-С8 алкинильную группу, С3-С8 алкоксигруппу, группу, выбранную из группы, состоящей из С2-С8 алкильной группы, С3-С8 алкенильной группы, С3-С8 алкинильной группы, С3-С8 алкоксигруппы, в которую введен по меньшей мере один атом кислорода, или любую одну из групп, представленных следующими формулами:

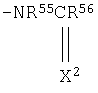
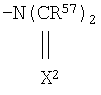

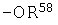
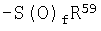







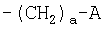
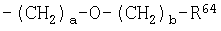
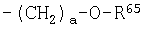

где R49, R50 и R51 являются одинаковыми или разными, атомом водорода или C1-C4 алкильной группой;
R50 и R51 могут образовать вместе с атомом азота, к которому они присоединены, насыщенный алициклический 5- или 6-членный цикл;
R52 представляет атом водорода, C1-C4 алкильную группу или C1-C4 алкильную группу, замещенную по меньшей мере одним атомом галогена;
R53 представляет атом водорода, C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С2-С6 алкенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С6 алкинильную группу, необязательно замещенную по меньшей мере одним атомом галогена, фенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С8 циклоалкильную группу, цианометильную группу или R63CO-группу;
R54 представляет атом водорода, C1-C6 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С2-С6 алкенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С6 алкинильную группу, необязательно замещенную по меньшей мере одним атомом галогена, фенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С8 циклоалкильную группу, цианометильную группу, C1-C4 алкокси-C1-C6 алкильную группу, ди-С1-С4 алкиламино-C1-C4 алкильную группу, тетрагидрофурфурилметильную группу, С3-С6 алкинилокси-С1-С4 алкильную группу, бензил, цикл которого может быть замещен заместителем, выбранным из группы, состоящей из атома галогена, нитрогруппы, цианогруппы, C1-C4 алкильной группы, C1-C4 алкоксигруппы и галоген-C1-C4 алкильной группы, -C(=X2)R63 группу, -(СН2)а-(О)d-R70 группу, -(СН2)а-О-(CH2)b-R70 группу, -(СН2)a-X2-R76 группу;
R53 и R54 могут образовать вместе с атомом азота, к которому они присоединены, насыщенный алициклический 3-, 5- или 6-членный цикл, или ароматический 5- или 6-членный цикл, в котором атом углерода может быть необязательно заменен атомом кислорода;
R55 представляет атом водорода, C1-C4 алкильную группу, С2-С6 алкенильную группу, С3-С6 алкинильную группу или R55 и R56 вместе могут образовать -(СН2)е-;
R56 и R57 независимо представляют C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С2-С6 алкенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, С3-С6 алкинильную группу, необязательно замещенную по меньшей мере одним атомом галогена или фенильную группу, необязательно замещенную по меньшей мере одним атомом галогена, атомом водорода, С3-С6 циклоалкильной группой, -XR60 группой или NR61R62 группой;
R58 представляет атом водорода, C1-C6 алкильную группу, С2-С6 алкенильную группу, С3-С6 алкинильную группу, C1-C4 алкилкарбонильную группу, циано-С1-С3 алкильную группу, C1-C4 алкоксикарбонил-С1-С4 алкильную группу, ди-С1-С4 алкоксикарбонил-C1-С4 алкильную группу, бензильную группу, C1-C4 алкокси-С1-С4 алкинильную группу, -(CH2)a-R75 группу, -(CH2)a-X2-R72 группу, -(СН2)а-Х2-(СН2)bR72 группу или -(СН2)а-Х2-(СН2)b-Х2-(СН2)c-R72 группу;
R59 представляет атом водорода, C1-C4 алкильную группу, С2-С6 алкенильную группу, С3-С6 алкинильную группу, циано-С1-С3 алкильную группу, C1-C4 алкилкарбонил-С1-С3 алкильную группу или фенильную группу;
R60 представляет C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена;
R61 и R62 являются, одинаковые или разные, атомом водорода или C1-C4 алкильной группой;
R63 представляет C1-C4 алкильную группу, необязательно замещенную по меньшей мере одним атомом галогена, C1-C4 алкокси-C1-C4 алкильную группу, C1-C4 алкилтио-С1-С4 алкильную группу, С3-С6 циклоалкильную группу, фенильную группу, цикл которой может быть замещен одним заместителем, выбранным из группы, состоящей из атома галогена, нитрогруппы, цианогруппы, C1-C4 алкильной группы, C1-C4 алкоксигруппы и галоген-C1-C4 алкильной группы, NR73R74 группу или -(CH2)a-(О)d-R75 группу;
R64 представляет C1-C4 алкоксикарбонильную группу или карбоксильную группу;
R65 представляет хлорметильную группу, цианометильную группу, С3-С6 циклоалкильную группу, в которую может быть введен по меньшей мере один атом кислорода, или C1-C4 алкоксикарбонил-C1-C4 алкильную группу;
R66 представляет гидроксильную группу или NR67R68 группу;
А представляет -NR67R68 группу или -S(O)f-R69 группу;
R67 и R68 являются, одинаковые или разные, атомом водорода или C1-C4 алкильной группой;
R69 представляет C1-C4 алкильную группу или C1-C4 галогеналкильную группу;
R70 представляет атом водорода, гидроксильную группу, атом галогена, C1-C4 алкильную группу, необязательно замещенную по меньшей мере одной C1-C4 алкоксигруппой, С3-С6 циклоалкильную группу, в которую может быть введен по меньшей мере один атом кислорода, С3-С6 циклоалкильную группу, необязательно замещенную одной или двумя метильными группами, фурильную группу, тиенильную группу или -C(=O)R71 группу;
R71 и R72 являются, одинаковые или разные, C1-C4 алкильной группой или C1-C4 алкоксигруппой;
R73 и R74 являются, одинаковые или разные, C1-C4 алкильной группой или фенильной группой;
R75 представляет С3-С6 циклоалкильную группу, в которую может быть введен по меньшей мере один атом кислорода, С3-С6 циклоалкильную группу, необязательно замещенную одной или двумя метильными группами, фурильную группу, тиенильную группу или -C(=O)R71 группу;
R76 представляет C1-C4 алкильную группу;
a, b и с независимо равны 1, 2 или 3;
d равно 0 или 1;
е равно 2 или 3;
f равно 1 или 2 и
X2 представляет атом кислорода или атом серы.
Кроме того, другими N-замещенными пиразолами являются 3-звмещенные-2-арил-4,5,6,7-тетрагидроиндазолы, описанные в Lyga et al., Pesticide Sci., 42: p 29 (1994), и т.п.
Конкретными примерами соединений, ингибирующих перенос электронов в фотохимической системе I, являются, например, паракват, дикват и т.п. Конкретными примерами соединений, ингибирующих перенос электронов в фотохимической системе II, являются, например, триазиновые соединения (например, атразин и т.д.), соединения мочевины (например, диурон и т.д.), нитрильные соединения (например, бромоксинил и иоксинил) и т.п. Конкретными примерами соединений, ингибирующих 4-HPPD, являются, например, изоксазолы (например, изоксафлутол, пиразолы, трикетоны) и т.п. Конкретными примерами соединений, ингибирующих PDS, являются, например, норфлуразон, флурохлоридон, флуридон, флуртамон, дифлуфеникан и т.п. Конкретными примерами соединений, ингибирующих EPSPS, являются, например, глифозат и т.п. Конкретными примерами соединений, ингибирующих ALS, являются, например, сульфонилмочевины, имидазолиноны, пиримидинилтиобензоаты, триазолпиримидины и т.п. Конкретными примерами соединений, ингибирующих GS, являются, например, биалафос, глуфозинат и т.п. Конкретными примерами соединений, ингибирующих DHP, являются, например, асулам и т.п. Конкретными примерами соединений, ингибирующих АСС, являются, например, циклогександионы, арилоксифеноксипропионаты и т.п. Конкретными примерами соединений, ингибирующих целлюлозу, являются, например, дихлобенил и т.п.
Различные примеры соединений, подавляющих сорняки, применимых по настоящему изобретению, представлены следующими химическими структурами:
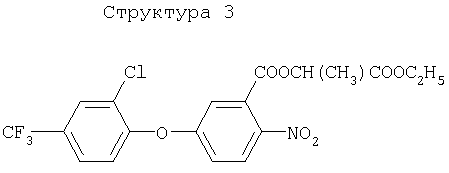
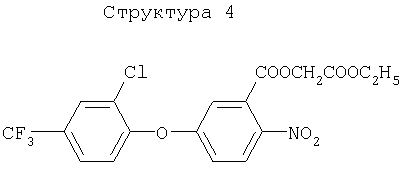

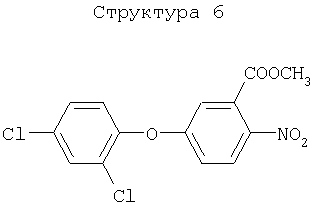
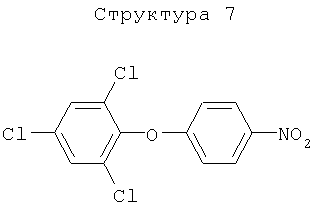

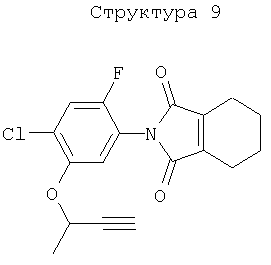

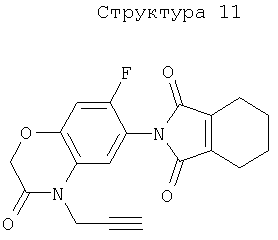
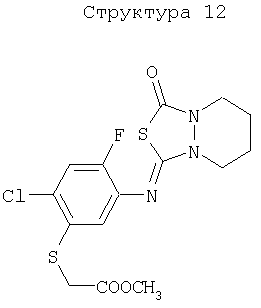
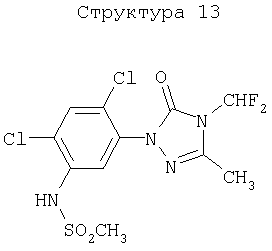

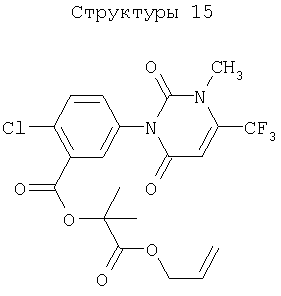
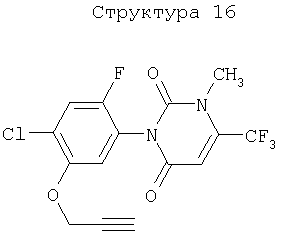
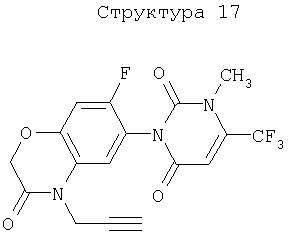

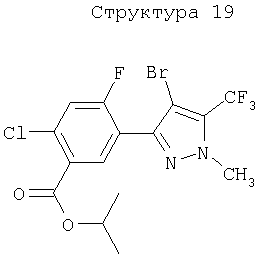
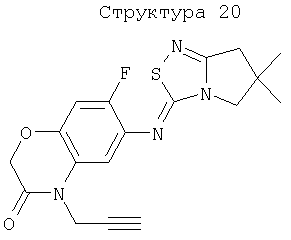
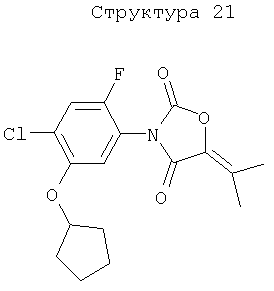
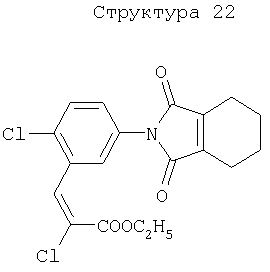
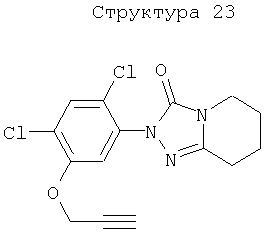
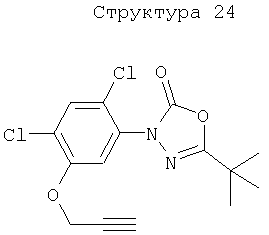
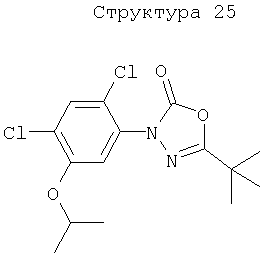


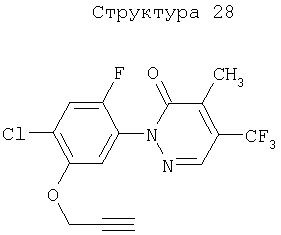
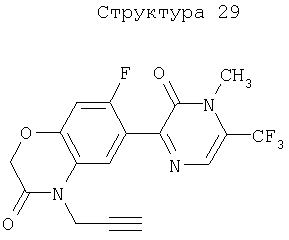
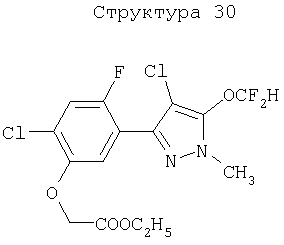


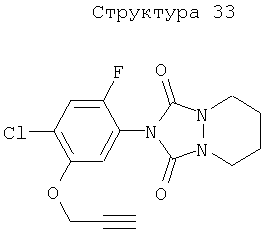
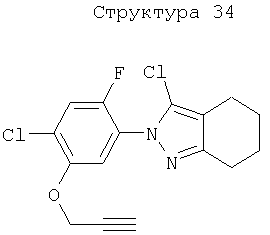


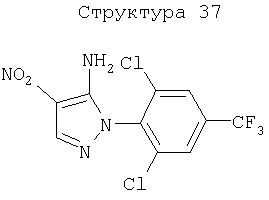
В первом аспекте настоящего изобретения используемые гены кодируют белки, имеющие следующие характеристики от (а) до (с) (далее иногда - целевые белки):
(a) имеющие специфическое сродство к соединениям, подавляющим сорняки;
(b) не имеющие по существу способности к модификации веществ, к которым указанный белок имеет специфическое сродство; и
(c) являющиеся по существу свободными от каркасных участков вариабельных участков иммуноглобулина.
Термин "специфическое сродство" в отношении к веществам, подавляющим сорняки, в вышеуказанной характеристике (а) означает, что фермент (целевой белок) и субстрат (вещество, подавляющее сорняки) или фермент (целевой белок) и ингибитор или регулятор активности фермента (вещество, подавляющее сорняки) ферментативно связываются друг с другом; или целевой белок и вещество, подавляющее сорняки, связываются друг с другом на основе сродства и специфичности, как при образовании рецепторно-химической связи, например связи между рецептором и лигандом и т.п. Целевые белки могут быть представлены природными белками; их вариантными формами, полученными при замене аминокислот, при соединении, делеции, модификации и т.п. у природных белков; искусственно синтезированные белки, имеющие редко встречающиеся аминокислотные последовательности, выбранные на основании их сродства к веществам, подавляющим сорняки, постольку поскольку они имеют структуры, специфически связывающиеся с веществами, подавляющими сорняки. Термин "не имеющий по существу способности к модификации" в характеристике (b) означает, что ферментативная реакционноспособность по отношению к веществам, к которым указанный белок имеет специфическое сродство, по существу отсутствует или вообще не существует (за исключением специфического сродства к веществам, подавляющим сорняки, в характеристике (а)). Примеры включают: целевой белок не обладает какой-либо способностью к превращению веществ, к которым указанный белок имеет специфическое сродство, как, например, некоторые вещества, подавляющие сорняки, или вещества, обладающие существенной частью структуры субстратов на основании специфического сродства к указанному белку и т.п., или к веществу, имеющему химическую структуру, отличную от структуры вещества, к которому указанный белок имеет специфическое сродство. Белок, "не имеющий по существу способности к модификации", может быть идентифицирован посредством проверки отсутствия восстановления роста микроорганизмов, у которых произведена делеция гена, кодирующего указанный белок, и которые не могут расти при обычных условиях в случае, когда производят внедрение гена, кодирующего данный белок, в микроорганизм таким образом, что внедренный ген экспрессируется в микроорганизме.
Термин "являющиеся по существу свободными от каркасных участков вариабельных участков иммуноглобулина" в характеристике (с) обозначает, что целевой белок не образует стереоструктуру, специфичную для вариабельных участков иммуноглобулина. Термин "каркасные участки вариабельных участков иммуноглобулина" обозначает участки, оставшиеся после удаления гипервариабельных участков из вариабельных областей Н цепи и L цепи, которые являются составными частями молекулы иммуноглобулина.
В этих участках аминокислотная последовательность сохраняется постоянной в относительно высокой степени, и эти участки служат для поддержания высокой степени постоянства стереоструктуры вариабельных участков. Благодаря образованию вышеуказанной стереоструктуры гипервариабельные участки, расположенные раздельно в трех сайтах соответственно на Н цепи и L цепи, объединяются в один сайт на стереоструктуре с образованием антигенсвязывающего сайта [Alberts, В., et al., ed. (1983), Molecular Biology of the Cell, p 979, Garland Publishing, Inc., New York].
Целевой белок, имеющий вышеуказанную характеристику (с), может быть выбран на основе, например, аминокислотной последовательности белков. Конкретными примерами такого белка являются белки, которые не содержат какой-либо аминокислотной последовательности, состоящей приблизительно из 30 аминокислот или более и имеющей приблизительно 60% или более гомологии с известными аминокислотными последовательностями каркасных участков вариабельных участков иммуноглобулина, и т.п. Например, присутствие или отсутствие вышеупомянутых каркасных участков может быть подтверждено путем PCR с использованием гена, кодирующего белок, в качестве матрицы, и молекул ДНК, имеющих нуклеотидные последовательности, кодирующие вариабельные участки из Н цепи или L цепи иммуноглобулина, в качестве праймеров амплификации, например, праймеры VH1BACK и VH1FOR-2, или VK2BACK и VK4FOR, описанные Clackson, Т. et al., Nature 352; p 624 (1991), или праймеры, содержащиеся в коммерчески доступных наборах для клонирования генов рекомбинантных антител, например, Heavy primer mix или Light primer mix of Recombinant Phage Antibody System (Pharmacia Biotech), для анализа присутствия или отсутствия амплификации ДНК с данной длиной.
Примеры связывающих белков, имеющих специфическое сродство к веществам для подавления сорняков, включают также пептиды, обладающие сродством к веществам для подавления сорняков.
Конкретные примеры целевых белков, имеющих вышеуказанные характеристики от (а) до (с), включают связывающие белки неактивного типа, обладающие сродством к протопорфирину IX [напр., магнийхелатаза неактивного типа, субстратом которой является протопорфирин IX (вещество, подавляющее сорняки), феррохелатаза неактивного типа (протогем ферролиаза; ЕС 4.9.9.1), кобальтовая хелатаза неактивного типа, которая катализирует хелатную реакцию иона кобальта с соединением, имеющим тетрапиррольный цикл, в качестве субстрата, пептиды, обладающие сродством к протопорфирину IX, т.е. белки, состоящие из 4-100 аминокислот (например, пептид HASYS, обладающий сродством к протопорфирину IX, например, белок, включающий аминокислотную последовательность SEQ ID NO: 53, и белок, имеющий аминокислотную последовательность SEQ ID NO: 54; пептид RASSL, обладающий сродством к протопорфирину IX, например, белок, включающий аминокислотную последовательность SEQ ID NO: 55, и белок, имеющий аминокислотную последовательность SEQ ID NO: 56; пептид YAGY, обладающий сродством к порфириновым соединениям, например, белок, включающий аминокислотную последовательность SEQ ID NO: 57, и белок, имеющий аминокислотную последовательность SEQ ID NO: 58; пептид YAGF, обладающий сродством к порфириновым соединениям, например, белок, включающий аминокислотную последовательность SEQ ID NO: 59, и белок, имеющий аминокислотную последовательность SEQ ID NO: 60; и т.п.], связывающие белки неактивного типа, обладающие сродством к протопорфириногену IX (например, РРО неактивного типа, копропорфириноген III оксидаза неактивного типа), и т.п.
Вышеуказанные связывающие белки неактивного типа включают их вариантные формы, активности которых утрачены в результате замещения аминокислоты, кроме того, делеции, модификации и т.п. природных активных белков в естественных или искусственных условиях.
Клеточная дисфункция, вызванная веществами, подавляющими сорняки, может быть предотвращена путем связывания этих связывающих белков с веществами, подавляющими сорняки, в клетках растений для проявления желательной резистентности к соединениям, подавляющим сорняки.
Магнийхелатаза неактивного типа представляет собой связывающую протопорфирин IX субъединицу белка магнийхелатазы или ее вариантную форму, обладающую специфическим сродством к протопорфирину IX, и их конкретные примеры включают субъединицу белка, из которой удалена ее органельная транзитная сигнальная последовательность, и т.п.
Феррохелатаза неактивного типа представляет собой ее вариантную форму, не обладающую способностью модифицировать протопорфирин IX и обладающую специфическим сродством к протопорфирину IX, и их конкретные примеры включают вариантную форму феррохелатазы, в которой участок, предположительно являющийся сайтом, связывающим ион Fe, может быть модифицирован, и т.п.
Кобальтовая хелатаза неактивного типа представляет собой связывающую субстрат субъединицу белка кобальтовой хелатазы, или ее вариантную форму, не обладающую способностью модифицировать протопорфирин IX и обладающую специфическим сродством к протопорфирину IX.
РРО неактивного типа представляет собой ее вариантную форму, не обладающую способностью к окислению протопорфириногена IX и обладающую специфическим сродством к протопорфириногену IX, и их конкретные примеры включают вариантную форму РРО, в которой удален участок, предположительно являющийся участком РРО, связывающим FAD (участок, имеющий аминокислотную последовательность GXGXXG, в которой Х является любой аминокислотой, например участок, включающий от 63 до 68 аминокислоты N-конца РРО, локализованного в хлоропласте mouse-ear кресс (Arabidopsis thaliana), и обладающий аминокислотной последовательностью GGGISG, и т.п.
Оксидаза копропорфириногена III неактивного типа представляет собой ее вариантную форму, не обладающую способностью к окислению протопорфириногена IX и обладающую специфическим сродством к протопорфириногену IX.
Гены, кодирующие вышеописанные белки, могут быть получены, например, следующим образом.
В качестве генов, кодирующих субъединицу белка магнийхелатазы, связывающую протопорфирин IX, известны, например, гены, полученные из фотосинтезирующей бактерии Rhodobackter capsulatus (каталог банка генов М74001), mouse-ear кресс (каталог банка генов Z68495), ячменя (каталог банка генов U96216), львиного зева (Antirrhinum majus) (каталог банка генов U26916), Synechocystis P.С.С. (каталог банка генов U29131) и т.п. Для выделения такого известного гена (с известной нуклеотидной последовательностью PCR может быть проведена с использованием геномной ДНК или кДНК организма, имеющего требуемый ген, в качестве матрицы и праймеров, получаемых на основе нуклеотидных последовательностей, соответствующих последовательностям в районе N- и С-концов белка, кодируемого геном, для амплификации требуемого гена. Кроме того, гены, кодирующие субъединицу белка магнийхелатазы, связывающей протопорфирин IX, могут быть получены из фотосинтезирующих организмов, отличных от вышеуказанных. Например, вначале составляют библиотеку кДНК путем получения мРНК из требуемого фотосинтезирующего организма, синтезируя кДНК с использованием мРНК в качестве матрицы с помощью обратной транскриптазы и встраивая кДНК в вектор фага, такой как ZAPII и т.д., или в вектор плазмиды, такой как pUC и т.д. Для амплификации фрагмента ДНК, содержащего по меньшей мере часть гена, кодирующего субъединицу белка магнийхелатазы, связывающую протопорфирин IX, может быть проведена PCR с использованием вышесоставленной библиотеки кДНК в качестве матрицы и праймеров, разработанных и синтезированных на основе нуклеотидных последовательностей, в высокой степени консервативных среди известных генов, таких как вышеописанные гены. Для выбора позитивных клонов проводят скрининг библиотеки кДНК с использованием фрагмента ДНК, полученного в качестве зонда. Требуемый ген субъединица белка магниевой хелатазы, связывающий протопорфирин IX, может быть подтвержден секвенированием нуклеотидной последовательности выбранного клона.
Для получения гена, кодирующего вариантную форму субъединицы белка магнийхелатазы, связывающей протопорфирин IX, имеющую специфическое сродство к протопорфирину IX, например, вызывают мутацию гена, кодирующего субъединицу белка путем замены, присоединения, делеции, модификации и т.п. нуклеотида, с последующим внедрением полученного гена в штамм Escherichia coli BL21 (ВЕ3) по методу, описанному Gibson, L.C.D. et al., Proc. Natl. Acad. Sci. USA, 92; p 1941 (1995) и т.п., для получения трансформантов и культивирования трансформантов в условиях, обеспечивающих высокую экспрессию внедренного таким образом гена. Требуемый ген, кодирующий вариантную форму субъединицы белка, имеющую специфическое сродство к протопорфирину IX, может быть получен путем селекции штамма, культивируемые клетки которого становятся красными и обладают флуоресцентной абсорбцией, что демонстрирует накопление протопорфирина IX (длина волны возбуждения 405 нм, длина волны эмиссии 630 нм).
В качестве генов, кодирующих феррохелатазу, известны, например, гены, полученные из Escherichia coli (каталог банка генов D90259), Bacillus subtilis (каталог банка генов М97208), Bradyrhizobium japonicum (каталог банка генов М92427), дрожжей Saccharomyces cerevisiae (каталог банка генов J05395), мыши (каталог банка генов J05697), человека (каталог банка генов D00726), ячменя (каталог банка генов D26105), огурца (каталог банка генов D26106) и т.п. Для выделения такого известного гена (с известной нуклеотидной последовательностью) PCR может быть проведена с использованием геномной ДНК или кДНК организма, имеющего требуемый ген, в качестве матрицы и праймеров, получаемых на основе нуклеотидных последовательностей, соответствующих последовательностям в районе N- и С-концов белка, кодируемых геном, для амплификации требуемого гена. Кроме того, для получения других генов, кодирующих феррохелатазу, например, во-первых, библиотеку кДНК составляют путем получения мРНК из требуемого организма, синтезируя кДНК с использованием мРНК в качестве матрицы с помощью обратной транскриптазы и встраивая кДНК в вектор фага, такой как ZAPII и т.д., или в вектор плазмиды, такой как pUC и т.д. Библиотека кДНК может быть внедрена в мутантный штамм Escherichia coli VS 200, дефицитный по феррохелатазе, описанной Miyamoto, К, et al., Plant Physiol., 105; р 769 (1994), с последующим проведением комплементационного теста для селекции клонов, содержащих ген феррохелатазы, полученный из требуемого организма. Кроме того, для амплификации фрагмента ДНК может быть проведена PCR с использованием вышесоставленной библиотеки кДНК в качестве матрицы и праймеров, полученных на основе нуклеотидных последовательностей, в высокой степени консервативных среди известных генов, таких как вышеописанные гены. Для выбора позитивных клонов проводят скрининг библиотеки кДНК с использованием фрагмента ДНК, полученного в качестве зонда. Требуемый ген феррохелатазы может быть подтвержден секвенированием нуклеотидной последовательности выбранного клона.
Для получения гена, кодирующего вариантную форму феррохелатазы, не обладающую способностью модифицировать протопорфирин IX и обладающую специфическим сродством к протопорфирину IX (например, гена, кодирующего вариантную форму феррохелатазы, в которой модифицирован участок, предположительно являющийся сайтом, связывающим ион Fe), может быть проведена PCR путем получения праймера для мутагенеза для внедрения мутации в участок на основе нуклеотидной последовательности, кодирующей аминокислотную последовательность в районе этого участка, и используя набор для сайт-специфического мутагенеза для получения гена, кодирующего вышеуказанную вариантную форму. Конкретно дикий тип гена феррохелатазы вставляют в клонирующий участок плазмидного вектора pKF19K и PCR проводят, используя полученную плазмидную ДНК в качестве матрицы, вышеописанный праймер для мутагенеза и селекционный праймер для восстановления амбермутации, локализованной на гене pKF19K резистентности к канамицину. Ген, амплифицированный посредством PCR, вводят в Escherichia coli MV1184 (штамм, свободный от супрессора) и проводят скрининг трансформантов в соответствии с резистентностью к канамицину для выделения Escherichia coli, имеющей ген феррохелатазы, в котором нуклеотидная последовательность была модифицирована в соответствии с аминокислотной последовательностью, входящей в состав требуемого участка. Выделенный ген может быть удостоверен как ген, кодирующий требуемый белок путем анализа нуклеотидной последовательности плазмидной ДНК Escherichia coll.
Гены, кодирующие пептиды, имеющие сродство к протопорфирину IX, т.е. белки, состоящие из 4-100 аминокислот, могут быть получены путем синтеза пептидной библиотеки в соответствии с, например, методом комбинаторной химии, как описано у Sugimoto, N., Nakano, S., Chem. Lett., p 939 (1997) и т.п., с выбором пептида, обладающего сродством к веществу, подавляющему сорняки, анализируя аминокислотную последовательность выбранного таким образом пептида с помощью пептидного секвенатора, конструируя ген, содержащий нуклеотидную последовательность, кодирующую аминокислотную последовательность и синтезируя аминокислотную последовательность с помощью синтезатора ДНК или т.п.
Кроме того, фазовый клон, проявляющий пептид, обладающий сродством к веществу, подавляющему сорняки, может быть получен путем селекции библиотеки фагов в соответствии с фаговым проявляющим методом. Конкретно, например, библиотека фагов, проявляющих белок, имеющий случайную аминокислотную последовательность на поверхности фаговых частиц М13, составляется путем вставки нуклеотидной последовательности, кодирующей белок, имеющий случайную аминокислотную последовательность, в верхнюю часть от участка гена фага М13, кодирующего покрывающий белок pIII. С другой стороны, вещество, подавляющее сорняки, меченое биотином, связывают с плашкой, покрытой авидином или стрептоавидином для получения подложки, покрытой веществом, подавляющим сорняки. Фаг, проявляющий требуемый белок, обладающий сродством к веществу, подавляющему сорняки, может быть выделен посредством скрининга вышеописанной библиотеки фагов на плашке, покрытой веществом, подавляющим сорняки, и ген требуемого белка может быть получен из выделенного фага.
Ген, кодирующий белок, содержащий повтор аминокислотной последовательности, представленной SEQ ID NO: 53, 55, 57 или 59 четыре раза или восемь раз, может быть получен путем, например, селекции нуклеотидной последовательности, где нуклеотидная последовательность, кодирующая вышеуказанную аминокислотную последовательность, повторяется данное количество раз после инициации кодона ATG, синтеза олигонуклеотида, включающего выбранную нуклеотидную последовательность, и олигонуклеотида, включающего нуклеотидную последовательность, комплементарную выбранной нуклеотидной последовательности с помощью синтезатора ДНК, и затем подвергают их гибридизации. Кроме того, гены, кодирующие аминокислотные последовательности, представленные SEQ ID NO: 54, 56, 58 или 60 могут быть получены путем селекции нуклеотидной последовательности, кодирующей аминокислотную последовательность, синтеза олигонуклеотида, включающего выбранную нуклеотидную последовательность, и другого олигонуклеотида, включающего нуклеотидную последовательность, комплементарную выбранной нуклеотидной последовательности с помощью синтезатора ДНК, и затем подвергают их гибридизации. В этом отношении для выбора нуклеотидной последовательности, кодирующей данную аминокислотную последовательность, например, предпочитают выбирать кодоны, часто использующиеся в генах, выделенных из растений.
В качестве генов РРО известны, например, гены, выделенные из Escherichia coli (каталог банка генов Х68660), Bacillus subtilis (каталог банка генов М97208), Haemophilus Influenzae (каталог банка генов L42023), мыши (каталог банка генов D45185), человека (каталог банка генов D38537), mouse-ear кресс (каталог банка генов D83139), табака (каталог банка генов Y13465, Y13466) и т.п. Для выделения такого известного гена (с известной нуклеотидной последовательностью) PCR проводят, используя геномную ДНК или кДНК организма, имеющего требуемый ген, в качестве матрицы и праймеров, получаемых на основе нуклеотидных последовательностей, соответствующих последовательностям в районе N- и С-концов белка, кодируемого геном, для амплификации требуемого гена. Далее, для получения других генов РРО, например, вначале составляют библиотеку кДНК из организмов, имеющих требуемый ген в соответствии с вышеописанным методом. Библиотека кДНК может быть введена в РРО-дефицитный мутантный штамм Escherichia coli VSR800, описанный Narita., S., et al., Gene, 182; p 169 (1996), затем ее подвергают комплементациоиному тесту для выбора клонов, содержащих ген РРО, полученный из требуемого организма. Далее для амплификации фрагмента ДНК может быть проведена PCR с использованием ранее составленной библиотеки в виде матрицы и праймеров, полученных на основе нуклеотидных последовательностей, обладающих высокой степенью консервативности среди известных генов, таких как вышеописанные гены. Для выбора позитивных клонов проводят скрининг библиотеки кДНК с использованием фрагмента ДНК, полученного таким образом в качестве зонда. Структура целевого гена РРО может быть подтверждена путем определения последовательности нуклеотидной последовательности выбранного клона.
Для получения гена, кодирующего вариантную форму РРО, не обладающую способностью к окислению протопорфириногена IX и обладающую специфическим сродством к протопорфириногену IX, вызывают мутацию гена РРО путем замены, присоединения, делеции, модификации и т.п. нуклеотида, и полученный ген внедряют в вышеуказанный штамм Escherichia coli, чей рост ингибируется по светозависимому типу путем обработки гербицидного соединения РРО-ингибиторного типа. Ген, кодирующий белок, обладающий способностью связывать протопорфириноген IX, может быть выбран путем культивирования Escherichia coli, полученного таким образом в присутствии гемина, аминолевулиновой кислоты и гербицидного соединения РРО-ингибиторного типа, для выбора клона, который может расти даже на свету. Ген, кодирующий белок, не обладающий способностью к окислению протопорфириногена IX, может быть выбран путем экспрессии модифицированного гена, селекционированного таким образом в организме хозяина, таком как Escherichia coli и т.д., для получения белка, кодируемого этим геном, и измерения его способности к окислению протопорфириногена IX в соответствии с методом, описанным Jacobs, N. J. and Jacobs, J. M. (1982) Enzyme, 28, 206-219 и т.п. Более конкретно, вышеуказанный модифицированный ген внедряют в экспрессионный вектор Escherichia coli и вводят в дефицитный по гену РРО (локус hemG) мутантный штамм Escherichia coli, такой как штамм Escherichia coli ВТЗ, описанный Yamamoto, F., et al., Japanese J. Genet., 63; p 237 (1988) и т.п.Escherichia coli культивируют в культуральной среде, содержащей гемин и аминолевулиновую кислоту в добавление к ингибитору клеточного роста, соответствующего селекционному маркеру вектора, введенного в Escherichia coli для получения трансформантов. Белок, кодируемый трансформированным геном, может быть получен из этого трансформанта. Кроме того, для идентификации нерастущего штамма ген, не являющийся комплементарным к гену, дефицитному по РРО его клетки-хозяина, может быть получен путем культивирования трансформанта в культуральной среде, по существу свободной от гемина и аминолевулиновой кислоты. Последний способ может также быть использован для селекции гена, кодирующего белок, не обладающий способностью к окислению протопорфириногена IX.
Далее, для получения гена, кодирующего вариантную форму РРО, в котором удален участок, предположительно являющийся FED-связывающим сайтом для РРО (участок, имеющий аминокислотную последовательность GXGXXG, в котором Х является любой аминокислотой), вначале на основании нуклеотидной последовательности, кодирующей аминокислотную последовательность в районе участка, получают праймер для мутагенеза для введения удаленной мутации в участок. Затем, используя праймер мутагенеза и коммерчески доступный набор для сайт-специфического мутагенеза (Mutan-Super Express, Takara Shuzo), проводят PCR, как описано выше, для получения гена, кодирующего вышеуказанный вариантный белок, в котором вышеуказанный участок был удален.
Гены, кодирующие пептидные белки, такие как пептиды HASYS и RASSL, обладающие сродством к протопорфирину IX, и пептиды YAGA и YAGF, обладающие сродством к порфириновым соединениям и т.п., могут быть получены посредством гибридизации олигонуклеотидов, синтезированных с помощью ДНК-синтезатора.
Более того, гены, кодирующие неизвестные пептидные белки, обладающие сродством к другим веществам, подавляющим сорняки, могут быть получены посредством следующих методов и т.п. Например, различные пептидные библиотеки могут быть составлены в соответствии с, например, методом комбинаторной химии, как описано у Sugimoto, N., Nakano, S., Chem. Lett., p 939 (1997) и т.п. Пептиды, выбранные из составленных таким образом пептидных библиотек, с направлением сродства к веществам, подавляющим сорняки, затем подвергают анализу аминокислотной последовательности с помощью пептидного секвенатора. Следовательно, гены, кодирующие эти пептиды, могут быть синтезированы с помощью синтезатора ДНК. Альтернативно, фазовые клоны, проявляющие пептиды, обладающие сродством к веществам, подавляющим сорняки, могут быть получены путем селекции библиотек фагов, в соответствии с фаговым проявляющим методом. Конкретно, например, библиотека фагов, проявляющих белок, имеющий случайную аминокислотную последовательность на поверхности фаговых частиц М13, составляется путем вставки нуклеотидной последовательности, кодирующей белок, имеющий случайную аминокислотную последовательность, в верхнюю часть от участка гена фага М13, кодирующего покрывающий белок pIII. С другой стороны, вещество, подавляющее сорняки, меченное биотином, связывают с плашкой, покрытой авидином или стрептоавидином для получения подложки, покрытой веществом, подавляющим сорняки. Фаг, проявляющий требуемый белок, обладающий сродством к веществу, подавляющему сорняки, может быть выделен посредством скрининга вышеописанной библиотеки фагов на плашке, покрытой веществом, подавляющим сорняки, и ген требуемого белка может быть получен из выделенного фага.
В качестве генов, кодирующих копропорфириноген III оксидазу, известны, например, гены, полученные из Escherichia coli (каталог банка генов Х75413), Salmonella typhimurium (каталог банка генов L19503), дрожжей Saccharomyces cerevisiae (каталог банка генов J03873), мыши (каталог банка генов D1633), человека (каталог банка генов D16233), соевых бобов (каталог банка генов Х71083), ячменя (каталог банка генов Х82830), табака (каталог банка генов Х82831) и т.п. Для выделения такого известного гена (с известной нуклеотидной последовательностью) проводят PCR с использованием геномной ДНК или кДНК организма, имеющего требуемый ген, в качестве матрицы и праймеров, получаемых на основе нуклеотидных последовательностей, соответствующих последовательностям в районе N- и С-концов белка, кодируемого геном, для амплификации требуемого гена. Кроме того, для получения других генов копропорфириноген III оксидазы, например, вначале библиотеку кДНК составляют из организма, имеющего требуемый ген, путем получения мРНК из требуемого организма, синтезируя кДНК с использованием мРНК в качестве матрицы с помощью обратной транскриптазы, и встраивая кДНК в плазмидный вектор, такой как pRS313, описанный Sikorski, R. S., et al., Genetics, 122; p 19 (1989) и т.п. Библиотека кДНК может быть внедрена в мутантный штамм дрожжей НЕМ13, дефицитный по копропорфириноген III оксидазе, описанный Troup, В, et al., Bacteriol., 176; р. 673 (1994), с последующим проведением комплементационного теста для выбора клонов, содержащих копропорфириноген III оксидазу, полученных из требуемого организма. Кроме того, для амплификации фрагмента ДНК может быть проведена PCR с использованием ранее составленной библиотеки кДНК в качестве матрицы и праймеров, полученных на основе нуклеотидных последовательностей, в высокой степени консервативных среди известных генов, таких как вышеописанные гены. Для выбора позитивных клонов проводят скрининг библиотеки кДНК с использованием фрагмента ДНК, полученного в качестве зонда. Структура требуемого гена копропорфириноген III оксидазы может быть подтверждена секвенированием нуклеотидной последовательности выбранного клона.
Для получения гена, кодирующего вариантную форму копропорфириноген III оксидазы, не обладающую способностью окислять протопорфириноген IX и обладающую специфическим сродством к протопорфириногену IX, например, ген копропорфириноген III оксидазы, подвергают мутации путем замены, присоединения, делеции, модификации и т.п. нуклеотида, и полученный ген вводят в вышеуказанный штамм Escherichia coli, чей рост ингибируется по светозависимому типу путем обработки гербицидного соединения РРО-ингибиторного типа. Ген, кодирующий белок, обладающий способностью связывать протопорфириноген IX, может быть выбран путем культивирования Escherichia coli, полученного таким образом в присутствии гемина, аминолевулиновой кислоты и гербицидного соединения РРО-ингибиторного типа, для выбора клона, который может расти даже на свету. Ген, кодирующий белок, не обладающий способностью к окислению протопорфириногена IX, может быть выбран путем экспрессии модифицированного гена, селекционированного таким образом в организме хозяина, таком как Escherichia coli и т.д., для получения белка, кодируемого этим геном, и измерения его способности к окислению протопорфириногена IX в соответствии с методом, описанным Jacobs, N. J. and Jacobs, J. M. (1982) Enzyme, 28, 206-219 и т.п.
Во втором аспекте способа настоящего изобретения используемые гены кодируют белки, имеющие следующие характеристики от (а) до (с):
(a) имеющие специфическое сродство к протопорфирину IX;
(b) не имеющие по существу способности к модификации протопорфириногена IX;
(c) являющиеся по существу свободными от каркасных участков вариабельных участков иммуноглобулина.
Термин "специфическое сродство" в отношении к протопорфирину IX в характеристике (а) является по существу таким же, как и в вышеописанном первом аспекте способа настоящего изобретения, и означает, что белок и протопорфирин IX ферментативно связываются друг с другом; или белок и протопорфирин IX связываются друг с другом на основе сродства и специфичности, как при образовании рецепторно-химической связи, такой как связь между рецептором и лигандом и т.п. Эти белки могут быть представлены природными белками; их вариантными формами, полученными при замене, присоединении, делеции, модификации и т.п. аминокислот у природных белков; и искусственно синтезированными белками, имеющими редко встречающиеся аминокислотные последовательности, выбранные на основании их сродства к протопорфирину IX, постольку поскольку они имеют структуры, специфически связывающиеся с протопорфирином IX.
Термин "не имеющий по существу способности к модификации" в отношении к протопорфирину IX, в характеристике (b) означает, что ферментативная реакционноспособность белка по отношению к протопорфириногену IX, по существу отсутствует или вообще не существует. Например, это означает, что белок не обладает какой-либо способностью к превращению протопорфириногена IX в вещество, обладающее химической структурой, отличающейся от структуры протопорфириногена IX.
Термин "являющиеся по существу свободными от каркасных участков вариабельных участков иммуноглобулина" обозначает то же, что и в вышеописанном первом аспекте способа настоящего изобретения, и что белок не образует стереоструктуру, специфичную для вариабельных участков иммуноглобулина, как описано выше в данном документе.
Конкретными примерами целевых белков, имеющих вышеуказанные характеристики от (а) до (с), являются связывающие белки активного или неактивного типа, обладающие сродством к протопорфирину IX [напр., магнийхелатаза активного или неактивного типа, субстратом которой является протопорфирин IX, феррохелатаза активного или неактивного типа, кобальтовая хелатаза активного или неактивного типа, которая катализирует хелатирующую реакцию иона кобальта с соединением, имеющим тетрапиррольный цикл, в качестве субстрата, пептиды, т.е. белки, состоящие из 4-100 аминокислот, обладающие сродством к протопорфирину IX, (например, белки, содержащие по меньшей мере один пептид, выбранный из пептида HASYS, обладающего сродством к протопорфирину IX, напр., белок, включающий аминокислотную последовательность SEQ ID NO: 53, и белок, имеющий аминокислотную последовательность SEQ ID NO: 54; пептид RASSL, обладающий сродством к протопорфирину IX, т.е. белок, включающий аминокислотную последовательность SEQ ID NO: 55, и белок, имеющий аминокислотную последовательность SEQ ID NO: 56; пептид YAGY, обладающий сродством к порфириновым соединениям, напр., белок, включающий аминокислотную последовательность SEQ ID NO: 57, и белок, имеющий аминокислотную последовательность SEQ ID NO: 58; пептид YAGF, обладающий сродством к порфириновым соединениям, т.е. белок, включающий аминокислотную последовательность SEQ ID NO: 59, и белок, имеющий аминокислотную последовательность SEQ ID NO: 60; и т.п.) и т.п.
Гены, кодирующие вышеуказанные белки, могут быть получены, например, следующим образом.
Магнийхелатаза активного типа состоит из трех гетерогенных субъединичных белков, т.е. из субъединичного белка, связывающего протопорфирин IX (Н субъединичного белка), I субъединичного белка и D субъединичного белка, все они являются необходимыми для каталитической активности. Три независимых субъединичных белка кодируются разными генами. Гены субъединичного белка, связывающего протопорфирин IX, могут быть получены посредством PCR или скрининга библиотеки кДНК, как описано выше в данном описании.
В качестве генов, кодирующих I субъединицу белка магнийхелатазы, известны, например, гены, полученные из фотосинтезирующей бактерии Rhodobacter sphaeroides (каталог банка генов AF017642), Rhodobacter capsulatus (каталог банка генов Z11165), Arabidopsis (каталог банка генов D49426), ячменя (каталог банка генов U26545), соевых бобов (каталог банка генов D45857), табака (каталог банка генов AF14053), Synechocystis P.С.С.6803 (каталог банка генов U35144) и т.п. Для выделения такого известного гена (с известной нуклеотидной последовательностью) PCR может быть проведена с использованием геномной ДНК или кДНК организма, имеющего требуемый ген, в качестве матрицы, и праймеров, получаемых на основе нуклеотидных последовательностей, соответствующих последовательностям в районе N- и С-концов белка, кодируемого требуемым геном. Кроме того, гены, кодирующие I субъединичный белок магнийхелатазы, могут быть получены из фотосинтезирующих организмов другим способом. Например, вначале составляют библиотеку кДНК путем получения мРНК из нужного фотосинтезирующего организма, синтезируя кДНК с использованием мРНК в качестве матрицы с помощью обратной транскриптазы и встраивая кДНК в вектор фага, такой как ZAPII и т.д., или в вектор плазмиды, такой как pUC и т.д. Для амплификации фрагмента ДНК, содержащего по меньшей мере часть гена, кодирующего I субъединичный белок магнийхелатазы, может быть проведена PCR с использованием вышесоставленной библиотеки кДНК в качестве матрицы и праймеров, разработанных и синтезированных на основе нуклеотидных последовательностей, в высокой степени консервативных среди известных генов, таких как вышеописанные гены. Для выбора позитивных клонов проводят скрининг библиотеки кДНК с использованием фрагмента ДНК, полученного в качестве зонда. Структура требуемого гена I субъединичного белка магниевой хелатазы может быть подтверждена секвенированием нуклеотидной последовательности выбранного клона.
В качестве генов, кодирующих D субъединицу белка магнийхелатазы, известны, например, гены, полученные из фотосинтезирующей бактерии Rhodobacter sphaeroides (каталог банка генов AJ001690), Rhodobacter capsulatus (каталог банка генов Z11165), гороха (каталог банка генов AF014399), табака (каталог банка генов Y10022), Synechocystis P.С.С.6803 (каталог банка генов Х96599) и т.п. Выделение такого известного гена (с известной нуклеотидной последовательностью) или генов, отличных от вышеописанных, может проводиться также, как описано для гена, кодирующего I субъединицу белка магнийхелатазы.
В третьем аспекте способа настоящего изобретения используемые гены кодируют белки, имеющие следующие характеристики от (а) до (с):
(a) имеющие специфическое сродство к протопорфириногену IX;
(b) имеющие способность к модификации копропорфириногена III и
(c) являющиеся по существу свободными от каркасных участков вариабельных участков иммуноглобулина.
Термин "специфическое сродство" в отношении к протопорфириногену IX, в характеристике (а) является по существу таким же, как и в вышеописанном первом или втором аспекте способа настоящего изобретения и означает, что белок и протопорфириноген IX ферментативно связываются друг с другом; или белок и протопорфириноген IX связываются друг с другом на основе сродства и специфичности, как при образовании рецепторно-химической связи, такой как связь между рецептором и лигандом и т.п. Эти белки могут быть представлены природными белками; их вариантными формами, полученными при замене, присоединении, делеции, модификации и т.п. аминокислот у природных белков; и искусственно синтезированными белками, имеющими редко встречающиеся аминокислотные последовательности, выбранные на основании их сродства к протопорфириногену IX, постольку поскольку они имеют структуры, специфически связывающиеся с протопорфириногеном IX.
Термин "имеющий способность к модификации копропорфириногена III" в характеристике (b) обозначает, что белок является ферментативно активным по отношению к копропорфириногену III. Например, это означает, что белок обладает способностью превращать копропорфириноген III в вещество, обладающее структурой, отличной от структуры копропорфириногена III.
Термин "являющиеся по существу свободными от каркасных участков вариабельных участков иммуноглобулина" обозначает то же, что и в вышеописанном первом или втором аспекте способа настоящего изобретения, и что белок не образует стереоструктуру, специфичную для вариабельных участков иммуноглобулина, как описано выше в данном описании.
Конкретными примерами белков, имеющих вышеуказанные характеристики от (а) до (с), являются связывающие белки активного или неактивного типа, обладающие сродством к пропорфириногену IX, напр., копропорфириноген III оксидаза активного типа, чьим субстратом является пропорфириноген IX и т.п.
В качестве ссылки активность магнийхелатазы, феррохелатазы или копропорфириноген III оксидазы, например, измеряют, используя следующие методы.
(1) Магнийхелатаза:
гены, кодирующие три независимые субъединицы, используются для определения активности магниевой хелатазы в соответствии с методом Gibson, L.C.D. et al., (Proc. Acad. Sci. USA, 92; p 1941 (1995)) и т.п.
(2) Феррохелатаза:
активность феррохелатазы может быть определена, например, в соответствии с методом Porra, R. J., (Anal. Biochem., 68; p 289 (1975)) и т.п.
(3) Копропорфириноген III оксидаза:
активность копропорфириноген III оксидазы может быть определена, например, в соответствии с методом Yoshinaga, Т., Sano, S., et al., (J. Biol. Chem., 255; p 4722 (1980)) и т.п.
В способе (включая вышеперечисленные первый - третий аспекты) настоящего изобретения для введения гена, кодирующего белок, имеющий характеристики от (а) до (с), в клетку растения может быть введен ген, кодирующий один белок. Кроме того, в клетку растения может быть введено множество генов, кодирующих различные белки. Такое введение гена в клетки растений может проводиться с помощью подходящих генно-инженерных методик, например, Agrobacterium инфекция (JP-B 2-58917 и JP-A 60-70070), электропорация протопластов (JP-A 60-251887 и JP-A 5-68575), метод particle gun (JP-A 5-508316 и JP-A 63-258525) и т.п. Предпочтительно, если ген, который должен быть введен в клетку растения, внедряют в вектор, имеющий селекционный маркерный ген, такой как ген резистентности к ингибитору клеточного роста растительной клетки.
Для экспрессии гена в растительной клетке ген может быть введен в хромосому растительной клетки путем гомологичной рекомбинации [Fraley, R. Т. et al., Proc. Natl. Acad. Sci. USA, 80; p 4803 (1983)] для выбора растительной клетки, экспрессирующей ген. Альтернативно, ген может быть введен в растительную клетку в форме, которая операбельно связана с промотором и терминатором, которые оба могут функционировать в растительной клетке.
Термин "операбельно связан", использующийся в данном описании, обозначает, что вышеупомянутые промотор и терминатор связаны таким образом, что введенный ген экспрессируется в растительной клетке под контролем промотора и терминатора.
Промоторами, которые могут функционировать в растительной клетке, являются, например, составные промоторы, полученные из Т-ДНК, такие как промотор гена нопалинсинтазы, промотор гена октопинсинтазы и др., промоторы, полученные из вирусов растений, такие как 19S и 35S промоторы, полученные из вируса мозаики цветной капусты и др., индукционные промоторы, такие как промотор гена лиазы фенилаланинаммония, промотор гена хальконсинтазы, промотор гена белка, связанного с патогенезом и др., и т.п. Промотор не ограничивается этими промоторами, могут быть использованы другие промоторы.
Терминаторами, которые могут функционировать в растительной клетке, являются, например, терминаторы, полученные из Т-ДНК, такие как терминатор нопалинсинтазы, и т.д., терминаторы, полученные из вирусов растений, такие как терминаторы, полученные из вирусов чеснока GV1, GV2 и т.д. и т.п. Терминатор не ограничивается этими терминаторами, и другие терминаторы растений могут быть использованы.
Клетками растений, в которые вводятся гены, являются, например, ткани растений, целые растения, культивируемые клетки, семена и т.п. Примеры видов растений, в которые вводятся гены, включают двудольные растения, такие как табак, хлопок, рапс, сахарная свекла, mouse-ear кресс, канола, лен, подсолнечник, картофель, люцерна, салат-латук, банан, соя, горох, бобы, сосна, тополь, яблоня, виноград, цитрусовые, орехи и т.д.; однодольные растения, такие как кукуруза, рис, пшеница, ячмень, рожь, овес, сорго, сахарный тростник, газонная трава и т.д.
Трансформантные растительные клетки, экспрессирующие ген, кодирующий связывающий белок, имеющий характеристики от (а) до (с), могут быть получены путем культивирования клеток, в которые перенесен этот ген в селекционной культуральной среде соответственно с селекционным маркером, связанным с локусом гена, например, в культуральной среде, содержащей ингибитор клеточного роста или т.п., и выделения клона, способного расти в культуральной среде. Альтернативно, вышеуказанные трансформантные растительные клетки могут быть отобраны путем культивирования растительных клеток, в которые этот ген вводят в культуральной среде, содержащей соединение, подавляющее сорняки, к которому задана резистентность, и выделяют клоны, способные расти в культуральной среде. Целевые растения с резистентностью к соединению, подавляющему сорняки, могут быть получены из трансформантных клеток, полученных таким образом, путем регенерации целого растения в соответствии с обычным методом культивирования растительных клеток, например, описанным в Plant Gene Manipulation Manual, Method for Producing Transgenic Plants, UCHIMITA, Kodansha Scientific (1996). Таким образом, могут быть получены трансформированные растения, такие как ткани растений, целые растения, культуры клеток и т.п.
Например, рис и mouse-ear кресс, экспрессирующие ген, кодирующий вышеуказанный белок, могут быть получены в соответствии со способом, описанным в Experimental Protocol of Model Plants, Rice and Mouse-Ear Cress Edition, (Supervisors: Koh SHIMAMOTO and Kiyotaka OKADA, Shuiun-sha, 1996), Chapter 4. Кроме того, в соответствии со способом, описанным в JP-A 3-291501, соевые бобы, экспрессирующие ген, кодирующий связывающий белок, получают путем введения гена в адвентициальный зародыш соевых бобов с помощью метода particle gun. Также в соответствии со способом, описанным Fromm, M.E., et al., Bio/Technology, 8; р 838 (1990), может быть получена кукуруза, экспрессирующая ген, кодирующий вышеуказанный белок, путем введения гена в адвентициальный зародыш с помощью метода particle gun. Пшеница, экспрессирующая ген, кодирующий вышеуказанный белок, может быть получена путем введения гена в стерильно культивируемый незрелый скутеллум пшеницы с помощью метода particle gun в соответствии с традиционным способом, описанным TAKUMI et al., Journal of Breeding Society (1995), 44: Extra Vol.1, р 57. Также в соответствии с традиционным способом, описанным HAGIO, et al., Journal of Breeding Society (1995), 44: Extra Vol.1, р 67, может быть получен ячмень, экспрессирующий ген, кодирующий вышеуказанный белок, путем введения гена в стерильно культивируемый незрелый скутеллум ячменя с помощью метода particle gun.
Для подтверждения резистентности растения, экспрессирующего ген, кодирующий вышеуказанный белок, к соединению, подавляющему сорняки, растение преимущественно воспроизводят с применением соединения, подавляющего сорняки, к которому задана резистентность, для оценки степени воспроизведения растения. Для более количественного подтверждения, например, в случае резистентности к соединению, обладающему гербицидной активностью РРО-ингибиторного типа, предпочтительно кусочки листьев растения погружают в водные растворы, содержащие соединение, обладающее гербицидной активностью РРО-ингибиторного типа, в различных концентрациях, или водные растворы, содержащие соединение, обладающее гербицидной активностью, распыляют на кусочки листьев растения и затем оставляют на среде с агаром на свету при комнатной температуре. Через несколько дней хлорофилл экстрагируют из листьев растений в соответствии со способом, описанным Mackenney, G., J. Biol. Chem., 140; p 315 (1941), для определения содержания хлорофилла.
Так как растения (напр., ткани растений, целые растения, культуры клеток, семена и т.п.), резистентные к соединениям, подавляющим сорняки, полученные по способу настоящего изобретения (включая первый - третий аспекты), демонстрируют резистентность к соединениям, подавляющим сорняки, даже в случае, если соединение, подавляющее сорняки, применяют на области роста (напр., на области культивации, на области пролиферации и т.д.), то эти растения могут расти. Следовательно, если соединение, подавляющее сорняки, применяют на области роста растения, резистентного к требуемому соединению, подавляющему сорняки, то нужное растение может быть защищено от растений, не имеющих резистентности к соединению, подавляющему сорняки. Например, сорняки могут эффективно подавляться путем применения соединения, подавляющего сорняки, на области роста растения, обладающего резистентностью к соединению, подавляющему сорняки.
Кроме того, путем применения соединения, подавляющего сорняки, на области роста растения, резистентного к соединению, подавляющему сорняки, полученного по способу настоящего изобретения (включая первый - третий аспекты), и на области роста других растений (напр., растений, не имеющих или имеющих слабую резистентность к соединению, подавляющему сорняки), одно из растений может быть выбрано на основе разницы в росте растений. Например, путем применения (добавления) соединения, подавляющего сорняки, на культивационной области (культуральной среде) растительных клеток, резистентных к соединению, подавляющему сорняки, полученных по способу настоящего изобретения, и других растительных клеток (напр., растительных клеток, не имеющих или имеющих слабую резистентность к соединению, подавляющему сорняки), одна из растительных клеток может быть эффективно выбрана на основе разницы в росте растений.
Следующие примеры далее иллюстрируют настоящее изобретение в деталях, но не ограничивают его сферу.
Пример 1
Выделение гена протопорфирин IX связывающей субъединицы белка магнийхелатазы.
Геномную ДНК фотосинтезирующей бактерии Rhodobacter sphaeroides ATCC17023 получают с использованием набора ISOPLANT для получения геномной ДНК (производитель Nippon Gene). Затем согласно описанию Gibson L.C.D. и др., Proc. Natl. Acad. Sci. USA, 92; p 1941, (1995), PCR проводят с использованием 1 мкг упомянутой геномной ДНК в качестве матрицы и 10 пмоль олигонуклеотида, состоящего из нуклеотидной последовательности, представленной SEQ ID NO: 1, и 10 пмоль олигонуклеотида, состоящего из нуклеотидной последовательности, представленной SEQ ID NO: 2, в качестве праймеров для амплификации фрагмента ДНК, содержащего ген bchH протопорфирин IX связывающей субъединицы белка магнийхелатазы. Олигонуклеотиды получают с помощью ДНК синтезатора (синтезатор ДНК/РНК РЕ Applied Biosystems, модель 394) и очищают картриджем для очистки олигонуклеотидов (РЕ Applied Biosystems, OPC картридж). PCR проводят при температуре 94°С в течение 2 минут, 96°С в течение 40 секунд и затем при 68°С в течение 7 минут, с повторением цикла с температурами 96°С в течение 40 секунд и затем 68°С в течение 7 минут 28 раз, и в заключение при 96°С в течение 40 секунд, при 68°С в течение 7 минут и затем при 72°С в течение 10 минут.
Пример 2
Экспрессия гена протопорфирин IX связывающей субъединицы белка магнийхелатазы в Escherichia Coli (в дальнейшем употребляется сокращение Е. coli).
Согласно описанию Gibson L.C.D. et al., Proc. Natl. Acad. Sci. USA, 92; p 1941, (1995), фрагмент ДНК, содержащий ген bchH, полученный в Примере 1, расщепляют ферментами рестрикции NdeI и BglII. Полученный фрагмент ДНК вставляют между сайтом рестрикции NdeI и сайтом рестрикции BamHI в вектор экспрессии pET11a (производитель Stratagene) для получения плазмиды рЕТВСН (Фиг.1). Эту плазмиду рЕТВСН вводят в штамм BL21(DE3) компетентных клеток Е. coli (производитель Stratagene), в соответствии с прилагаемым к компетентным клеткам руководством, для получения штамма BL21 (DE3) / рЕТВСН Е. coli. Штамм помещают в пробирку (14×10 мм), в 1,5 мл жидкой культуральной среды LB (1% триптона, 0,5% дрожжевого экстракта, 0,5% NaCl), содержащей 100 мкг/мл ампициллина, пробирку накрывают алюминиевой фольгой (далее это называют условия темноты), культивируют со встряхиванием при 37°С под светом флуоресцентной лампы (около 8000 люкс). Когда абсорбция жидкой культуральной среды при 600 нм становится около 0,6, в жидкую культуральную среду добавляют изопропил β-D-тиогалактопиранозид (IPTG), таким образом, чтобы конечная концентрация стала 0,4 мМ, и продолжают культивирование еще в течение 20 часов. В это время Escherichia Coli становится красной и наблюдается флуоресцентное поглощение (длина волны возбуждения 405 нм, длина волны эмиссии 630 нм), что демонстрирует накопление протопорфирина IX в Escherichia Coli. Если штамм Escherichia Coli BL21 (DE3) / рЕТВСН культивируют тем же образом, но не добавляют IPTG, Е. Coli не становится красной и не детектируется вышеуказанное флуоресцентное поглощение. Напротив, когда штамм Е. coli BL21 (DE3) / рЕТВСН культивируют тем же образом (с IPTG), но пробирку не накрывают алюминиевой фольгой (далее это называют условия освещенности), E.coli растет и становится красной, как и ранее.
Пример 3
Экспрессия гена РРО, полученного из соевых бобов, в E. coli, дефицитной по гену hemG.
Соевые бобы (Glycine max var. Williams82) высевают, выращивают при 25°С в течение 20 дней и собирают зеленые листья. Собранные зеленые листья замораживают в жидком азоте и замороженные листья размельчают при помощи пестика и ступки. Из растолченных листьев экстрагируют РНК с использованием экстрагирующего РНК реагента ISOGEN (производитель Nippon Gene) согласно инструкции. Полученный жидкий экстракт РНК подвергают осаждению этанолом, для того чтобы собрать общую РНК, затем общую РНК фракционируют с использованием набора для фракционирования поли(А)РНК BIOMAG mRNA Purification Kit (производитель Perceptive Bio System) согласно инструкции для сбора поли (А) РНК фракции. Используя 1 мг этой поли (А) фракции РНК как матрицу, синтезируют кДНК с помощью кДНК синтезирующего реагента, содержащегося в наборе Marathon cDNA amplification kit (производитель Clontech), согласно приложенной к нему инструкции. PCR проводят с использованием полученной кДНК в качестве матрицы, олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 3 и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 4 в качестве праймеров для амплификации фрагмента ДНК, содержащего ген оксидазы протопорфириногена IX хлоропластного типа. Указанные выше олигонуклеотиды получают с помощью синтезатора ДНК (синтезатор ДНК/РНК РЕ Applied Biosystems, модель 394) и очищают с помощью картриджа для очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС cartridge). PCR проводят при 94°С в течение 1 минуты, затем при 65°С в течение 5 минут, и с повторением цикла выдерживания при 94°С в течение 15 секунд и затем при 65°С в течение 5 минут 29 раз. После PCR амплифицированный фрагмент ДНК очищают фильтрацией реакционной смеси с помощью MicroSpin S-400HR (производитель Pharmacia Biotech), и фрагмент ДНК присоединяют к плазмиде pCR2.1 (производитель Invitrogen), разрезанной ферментом рестрикции SalI для получения плазмиды pSPPO-P. Затем плазмиду вводят в компетентные клетки штамма INVαF' E. coli (производитель Invitrogen), и выбирают ампициллин-резистентные штаммы. Затем плазмиду, содержащуюся в выбранных ампициллин-резистентных штаммах, секвенируют с использованием набора для циклического секвенирования Dye terminator (производитель РЕ Applied Biosystems) и ДНК секвенатора 373S (производитель РЕ Applied Biosystems). В результате установлена нуклеотидная последовательность SEQ ID NO: 5, что подтверждает, что плазмида pSPPO-P содержит ген оксидазы протопорфириногена IX хлоропластного типа.
Плазмиду pSPPO-P расщепляют ферментом рестрикции PshBI и в получившемся фрагменте ДНК притупляют концы с использованием Т4 ДНК полимеразы, и далее расщепляют с помощью SphI для выделения фрагмента ДНК, содержащего ген РРО хлоропластного типа из соевых бобов, и lac промотора. Затем плазмиду pACYC184 (производитель Nippon Gene) расщепляют ферментами рестрикции Nrul и SphI для удаления фрагмента в 410 пар оснований, и вышеуказанный фрагмент ДНК вставляют взамен удаленного для получения плазмиды pACYCSP (фиг.2). Затем плазмиду pACYCSP вводят в штамм ВТ3 Е. coli, дефицитный по РРО гену (генный локус hemG) (описано Yamamoto F., et al., Japanese J. Genet., 63; p 237 (1988) и т.д.) в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Полученную Е. coli культивируют в YPT среде (5 г/литр дрожжевого экстракта, 5 г/литр триптона, 5 г/литр пептона, 10 г/литр NaCl, pH 7,0), содержащей 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина, чтобы выбрать штамм ВТ3/pACYCSP Е. coli, устойчивый к хлорамфениколу и канамицину, у которого дефицит по гену hemG дополняется геном РРО из соевых бобов.
Пример 4.
Тест на способность протопорфирин IX связывающей субъединицы белка магнийхелатазы обеспечивать резистентность к соединению, контролирующему сорняки.
Штамм Е. coli ВТ3 / pACYCSP, полученный как в Примере 3, помещают в YPT среду, содержащую 10 или 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, 10 мкг/мл гемина, 50 мкг/мл аминолевулиновой кислоты, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина, и культивируют в условиях темноты или в условиях освещенности тем же образом, что и в Примере 2. В качестве контроля штамм Е. coli ВТ3/pACYCSP культивируют в той же среде, как описано выше, но без гербицидного соединения, в тех же условиях. Затем через 18 часов после начала культивирования измеряют абсорбцию жидкой культуральной среды при 600 нм. Приняв абсорбцию среды без гербицидного соединения за 1, высчитывают относительное значение абсорбции среды, содержащей гербицидную добавку. Результаты показаны в Таблице 1.
Плазмиду pTVBCH (Фиг.3) конструируют путем амплификации фрагмента ДНК, содержащего ген bchH, полученный из фотосинтезирующей бактерии Rhodobacter sphaeroides, с использованием олигонуклеотида, состоящего из последовательности нуклеотидов SEQ ID NO: 1 и олигонуклеотида, состоящего из последовательности нуклеотидов SEQ ID NO: 2, в соответствии с той же схемой, что и в Примере 1, с расщеплением получившегося фрагмента ДНК при помощи ферментов рестрикции NcoI и BglII, и введением расщепленного фрагмента ДНК между NcoI сайтом рестрикции и BamHI сайтом рестрикции плазмиды pTV118N (производитель Takara Shuzo Co., Ltd.).
Плазмиды pTVBCH и pTV118N соответственно были введены в штамм ВТ3/pACYCSP Е. coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Полученную Е. coli культивируют в YPT среде, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина, чтобы получить штамм ВТЗ/pACYCSP + pTVBCH Е. coli, несущий плазмиды pACYCSP и pTVBCH и штамм BT3/pACYCSP + pTV118N, несущий плазмиды pACYCSP и pTV118N.
Эти штаммы помещают в YPT среду, содержащую 10 или 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, в соответствии с той же схемой, что и в Примере 2. Затем через 18 часов после начала культивирования измеряют абсорбцию жидкой культуральной среды при 600 нм. Приняв абсорбцию среды без гербицидного соединения за 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты показаны в Таблице 2.
Затем эти штаммы помещают в YPT среду, содержащую гербицидное соединение РРО-ингибиторного типа, представленное выше структурами 1, 14, 15, 18-22, 29, 32, 33, 34 и 36, соответственно содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, как и в Примере 2. Затем через 18 часов после начала культивирования измеряют абсорбцию жидкой культуральной среды при 600 нм. Приняв абсорбцию среды без гербицидного соединения за 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты показаны в Таблице 3.
Пример 5
Введение гена, кодирующего протопорфирин IX связывающую субъединицу белка магнийхелатазы, в табак.
Плазмиду конструируют путем введения гена bchH в растение методом инфекции Agrobacterium. Сначала бинарный вектор рВI121 (производитель Clontech) расщепляют ферментом рестрикции SacI и вставляют линкер Kpn I (производитель Takara Shuzo Co., Ltd.) для получения плазмиды pBIK, в которой удален сайт узнавания SacI pBI121 и добавлен сайт узнавания KpnI. С другой стороны, в соответствии со схемой, описанной в Примере 1, PCR проводят с использованием геномной ДНК фотосинтезирующей бактерии Rhodobacter sphaeroides в качестве матрицы, праймера из олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 7, и праймера из олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 8, для амплификации фрагмента ДНК, содержащего bchH ген. Затем вышеуказанную плазмиду pBIK расщепляют ферментами рестрикции XbaI и KpnI для удаления гена β-глюкуронидазы, и вместо него вставляют фрагмент ДНК, полученный в результате расщепления вышеуказанного фрагмента ДНК, содержащего ген bchH, ферментами рестрикции XbaI и KpnI, для получения плазмиды pBIBCH (Фиг.4), в которой ген bchH присоединен под 35S промотором. Двойной вектор pBI121 (производитель Clontech) также расщепляют ферментами рестрикции BamHi и SacI для удаления гена β-глюкуронидазы, в получившемся фрагменте ДНК притупляют концы с помощью Т4 ДНК полимеразы, после чего его подвергают циклизации с помощью Т4 ДНК лигазы, чтобы сконструировать плазмиду pNO (Фиг.5). Плазмиду используют как вектор, контролирующий экспрессию гена bchH плазмиды pBIBCH.
Плазмиды pBIBCH и pNO вводят в Agrobacterium tumefaciens LBA4404 соответственно. Штамм Agrobacterium, несущий pBIBCH, и штамм Agrobacterium, несущий pNO, выделяют путем культивирования полученных трансформантов в среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина, и выбора требуемых трансформантов.
Затем в соответствии с методикой, описанной в Manual for Gene Manipulation of Plant (Hirofumi UCHIMIYA, Kodan-sha Scientific, 1992), ген вводят в табак. Штамм Agrobacterium, несущий pBIBCH, культивируют при 28°С в течение ночи в LB среде и затем кусочки листьев табака, выращенного стерильно, погружают в жидкую культуральную среду. Кусочки листьев культивируют при комнатной температуре в течение 2 дней в Murashige-Skoog среде (MS-среда, описанная Murasige Т., Skoog F., Physiol. Plant. (1962) 15, p 473), содержащей 0,8% агара, 0,1 мг/л нафталинуксусной кислоты и 1,0 мг/л бензиламинопурина. Затем кусочки листьев промывают стерилизованной водой и культивируют в течение 7 дней в MS среде, содержащей 0,8% агара, 0,1 мг/л нафталинуксусной кислоты, 1,0 мг/л бензиламинопурина и 500 мкг/мл цефотаксима. Кусочки листьев переносят в среду, содержащую 0,8% агара, 0,1 мг/л нафталинуксусной кислоты, 1,0 мг/л бензиламинопурина, 500 мкг/мл цефотаксима и 100 мкг/мл канамицина (далее употребляется термин селективная MS среда) и культивируется на этой среде постоянно в течение 4 месяцев, с пересаживанием кусочков листьев табака в свежую селективную MS среду каждый 1 месяц. В течение культивирования появляются дифференцировавшиеся ростки из стебля и листьев из кусочков листьев табака, эти ростки пересаживают в MS среду, содержащую 0,8% агара, 300 мкг/мл цефотаксима и 50 мкг/мл канамицина, для образования корней для получения воспроизведенных растений. Полученные воспроизведенные растения пересаживают и культивируют на MS среде, содержащей 0,8% агара и 50 мкг/мл канамицина для получения растений табака, в каждое из которых введен ген bchH. Сходным образом кусочки листьев табака инфицируют штаммом Agrobacterium, несущим pNO, чтобы получить воспроизведенные растения из кусочков листьев табака и отдельные растения табака (далее употребляется термин контрольный рекомбинантный табак).
Пример 6
Тест на резистентность к гербицидным соединениям табака, несущего встроенный ген, кодирующий протопорфирин IX связывающую субъединицу белка магнийхелатазы.
Листья табака, в которые встроен ген bchH, и листья контрольного рекомбинантного табака, полученные в Примере 5, собирают и каждый лист делят на равные правую и левую часть соответственно, вдоль по главной жилке листа. Одну часть кладут в водный раствор, содержащий 0,3 м.д. гербицидного соединения РРО-ингибиторного типа со структурой 8, в то время как другую часть не подвергают действию гербицида. Эти кусочки листьев помещают в MS среду, содержащую 0,8% агара, и оставляют при комнатной температуре в течение 7 дней в свещенном месте. Затем каждый кусочек листа размельчают в ступке в 5 мл 80% водного раствора ацетона, чтобы экстрагировать хлорофилл. Жидкий экстракт разбавляют 80% водным раствором ацетона и измеряют абсорбцию при 750 нм, 663 нм и 645 нм, чтобы вычислить общее содержание хлорофилла в соответствии с методикой, описанной Macknney G., J. Biol. Chem. (1941) 140, p 315. Результаты, полученные для 4 клонов табака со встроенным bchH геном (BCHI для 4) и контрольного рекомбинантного табака представлены в Таблице 4. В таблице уровень резистентности к гербицидному соединению представлен в процентах общего содержания хлорофилла в кусочках листьев, обработанных гербицидным соединением, по отношению к нему в необработанных кусочках листьев.
Клоны табака со встроенным геном bchH и контрольный рекомбинантный табак тем же образом также обрабатывают гербицидным соединением РРО-ингибиторного типа, которое представлено выше структурами 3, 7, 10, 11, 13, 17, 23, 24, 25, 27, 28, 30 или 35, и измеряют уровень резистентности к каждому гербицидному соединению. Результаты показаны в Таблице 5. В таблице уровень резистентности к гербицидному соединению представлен в процентах общего содержания хлорофилла в кусочках листьев, обработанных гербицидом, по отношению к нему в необработанных кусочках листьев.
Структура №
Пример 7
Выделение гена, кодирующего вариантный белок протопорфирин IX связывающей субъединицы белка магнийхелатазы табака.
Общая РНК была получена из тканей листьев табака (Nicotiana tabacum cv. Srl) с использованием RNeasy Plant Kit (производитель QIAGEN)) в соответствии с инструкцией. Фрагмент ДНК, содержащий ген, кодирующий протопорфирин IX связывающую субъединицу белка магнийхелатазы табака, чей хлоропластный транзитный сигнал был удален (далее употребляется термин вариантная субъединица хелатазы табака), получают с помощью набора RNA LA PCR (AMV) Ver 1.1 (производитель Takara Shuzo Co., Ltd.) согласно инструкции. Сначала синтезируют первую нить кДНК с использованием общей РНК, как матрицы, и олиго-dT-адаптор праймера, содержащегося в вышеуказанном наборе. Затем проводят PCR с использованием первой нити кДНК в качестве матрицы и LA Taq полимеразы, содержащейся в вышеуказанном наборе для амплификации фрагмента ДНК, содержащего ген, кодирующий вариантный белок субъединицы хелатазы табака. В этой PCR используют олигонуклеотидный праймер, состоящий из последовательности нуклеотидов SEQ ID NO: 9, и олигонуклеотидный праймер, состоящий из последовательности нуклеотидов SEQ ID NO: 10. Эти олигонуклеотиды синтезируют с помощью ДНК синтезатора (синтезатор ДНК/РНК РЕ Applied Biosystems, модель 394) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, OPC картридж). PCR проводят при 94°С в течение 2 минут и затем повторяют 30 раз цикл выдерживания при 94°С в течение 30 секунд, затем при 50°С в течение 30 секунд и при 72°С в течение 7 минут. После PCR фрагмент ДНК, амплифицированный путем PCR, клонируют в плазмиде pCR2.1 с использованием ТА Cloning Kit (производитель Invitrogen) в соответствии с инструкцией. Полученную плазмиду расщепляют ферментом рестрикции KpnI и анализируют с помощью электрофореза в агарозном геле. Плазмида, в которой определяли фрагмент ДНК в 8,0 кб, была названа pTCHLH. Плазмида имеет такую структуру, что ген вариантной субъединицы хелатазы табака вставлен таким образом, что его экспрессия напрямую находится под контролем lac промотора. Плазмиду pTCHLH расщепляют ферментом рестрикции KpnI, затем путем самосшивания образуется плазмида pTCHLH1 (Фиг.6), в которой фрагмент ДНК состоит приблизительно из 60 нуклеотидов, удаленных из плазмиды pTCHLH.
Пример 8
Тест на способность вариантного белка субъединицы магнийхелатазы табака обеспечивать резистентность к гербицидным соединениям
Плазмиды pTCHLH1 и pCR2.1, полученные в Примере 7, вводят в штамм ВТ3/pACYCSP E.coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; р 557 (1983). Штамм Е. coli ВТ3/pACYCSP+pTCHLH1, несущий плазмиды pACYCSP и pTCHLHI, и штамм Е. coli BT3/pACYCSP+pCR2.1, несущий плазмиды pACYCSP и pCR2.1, получают путем культивирования вышеуказанных штаммов соответственно в среде YPT, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 50 мкг/мл канамицина.
Эти штаммы Е. coli помещают в YPT среду, содержащую 10 или 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 50 мкг/мл канамицина, 10 мкг/мл гемина, 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, тем же образом, что и в Примере 2. Затем через 18 часов после начала культивирования измеряют абсорбцию жидкой культуральной среды при 600 нм. Приняв абсорбцию среды без гербицидного соединения за 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты представлены в Таблице 6.
Пример 9.
Введение гена, кодирующего вариантный белок субъединицы магнийхелатазы табака, в табак.
Плазмиду для введения гена, кодирующего вариантный белок субъединицы магнийхелатазы табака, в табак конструируют методом инфекции Agrobacterium. Сначала фрагмент ДНК, содержащий ген, кодирующий вариантный белок субъединицы магнийхелатазы табака, получают путем расщепления плазмиды pTCHLH1, полученной в Примере 1, ферментами рестрикции Крn I и SalI. С другой стороны, бинарный вектор рВI121 (производитель Clontech) расщепляют ферментом рестрикции SmaI, и на это место вставляют линкер KpnI (производитель Takara Shuzo Co., Ltd.) для получения плазмиды рВI121К, в которой удален сайт узнавания ферментом рестрикции SmaI рВI121 и добавлен сайт узнавания KpnI. Плазмиду рВI121К расщепляют ферментом рестрикции SacI с последующим образованием тупых концов ДНК путем добавления к двухцепочечной ДНК с гэпом нуклеотидов и ДНК полимеразы I. Затем ДНК дефосфорилируют с помощью щелочной фосфатазы, полученной из кишечника теленка, и подвергают циклизации путем вставки фосфорилированного SalI линкера (4680 Р, производитель Takara Shuzo Co., Ltd.) для конструирования плазмиды pBI121KS. Бинарный вектор pBI121KS расщепляют ферментами рестрикции KpnI и SalI для удаления гена β-глюкуронидазы, и на это место вставляют ген, кодирующий вариантный белок субъединицы магнийхелатазы табака, для получения плазмиды pBITCHLH (Фиг.7).
Плазмиду pBITCHLH вводят в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивируют в среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина с последующим выбором требуемых трансформантов, для выделения штамма Agrobacterium, несущего плазмиду pBITCHLH.
Кусочки листьев табака, выращенных стерильно, инфицируют штаммом Agrobacterium, тем же образом, что и в Примере 5, и получают табак, в который встроен ген, кодирующий вариантный белок субъединицы магнийхелатазы табака.
Пример 10
Подтверждение резистентности к гербицидным соединениям табака, несущего встроенный ген, кодирующий вариантный белок субъединицы магнийхелатазы табака.
Уровень резистентности к гербицидным соединениям был подтвержден количественно тестированием табака, несущего встроенный ген, кодирующий вариантный белок субъединицы магнийхелатазы табака, полученного в Примере 9, тем же образом, что и в Примере 6.
Пример 11
Выделение гена, кодирующего вариантный белок РРО соевых бобов, не способный к окислению протопорфириногена IX и имеющий специфическое сродство к протопорфириногену IX.
PCR проводят с использованием плазмиды pSPPO-P, полученной в Примере 3, в качестве матрицы и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 11, и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 12, в качестве праймеров для амплификации фрагмента ДНК, кодирующего РРО соевых бобов, в котором удалены хлоропластный транзитный сигнал и FAD связывающая последовательность (в дальнейшем упоминается как вариантная РРО соевых бобов). Олигонуклеотиды синтезируют с помощью синтезатора ДНК (синтезатор ДНК/РНК РЕ Applied Biosystems, модель 394) и очищают с помощью картриджа для очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). PCR проводят, повторяя 30 раз цикл выдерживания при 94°С в течение 1 минуты, при 55°С в течение 2 минут и при 72°С в течение 3 минут. Амплифицированные фрагменты ДНК расщепляют ферментами рестрикции NcoI и SalI и вводят между NcoI сайтом рестрикции и SalI сайтом рестрикции плазмиды pTV118N (производитель Takara Shuzo Co., Ltd.), для того, чтобы сконструировать плазмиду pTVGMP (Фиг.8).
Плазмиду pTVGMP вводят в мутантный штамм ВТ3 Е. coli, дефицитного по гену РРО, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Если полученную Е. coli культивируют в YPT среде, содержащей 100 мкг/мл ампициллина и 10 мкг/л канамицина, то роста комплементарного штамма не получают.
Пример 12
Тест на способность вариантной РРО соевых бобов обеспечивать резистентность к гербицидным соединениям.
Плазмиды pTVGMP и pTV118N, полученные в Примере 11, вводят в штамм ВТ3/pACYCSP E.coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Штамм Е.coli ВТ3/pACYCSP + pTVGMP, несущий плазмиды pACYCSP и pTVGMP, и штамм E.coli BT3/pACYCSP + pTV118N, несущий плазмиды pACYCSP и pTV118N, получают путем культивирования вышеуказанных штаммов в среде YPT, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина.
Эти штаммы помещают в YPT среду, содержащую 10 или 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, тем же образом, что и в Примере 2. Затем, через 18 часов после начала культивирования, измеряют абсорбцию жидкой культуральной среды при 600 нм. Приняв абсорбцию среды без гербицидного соединения за 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты представлены в Таблице 7.
Пример 13
Введение гена, кодирующего вариантную РРО соевых бобов, в табак.
Плазмида для введения гена, кодирующего вариантную РРО соевых бобов, в табак была сконструирована методом инфекции Agrobacterium. PCR проводят с использованием плазмиды pSPPO-Р, полученной в Примере 3, в качестве матрицы и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 13, и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 14, в качестве праймеров для амплификации фрагмента ДНК, кодирующего вариантную РРО соевых бобов. Затем плазмиду рВI121К, полученную в Примере 9, расщепляют ферментами рестрикции KpnI и SacI для удаления гена β-глюкуронидазы, и фрагмент ДНК, полученный в результате расщепления фрагмента ДНК, содержащего вышеуказанный ген, кодирующий вариантную РРО соевых бобов, ферментами рестрикции KpnI и SacI, вставляют на место удаленного участка, для того, чтобы получить плазмиду pBIGMP (Фиг.9), в которой ген присоединен под промотором 35S.
Плазмиду pBIGMP вводят в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивируют в среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина, с последующим выбором требуемых трансформантов, чтобы изолировать штамм Agrobacterium, несущий pBIGMP.
Кусочки листьев табака, выращенных стерильно, инфицируют штаммом Agrobacterium, тем же образом, что и в Примере 5, и получают табак, в который вставлен ген, кодирующий вариантную РРО соевых бобов.
Пример 14
Подтверждение резистентности к гербицидным соединениям табака, несущего встроенный ген, кодирующий вариантную РРО соевых бобов.
Уровень резистентности к гербицидным соединениям РРО-ингибиторного типа, представленным структурой 8, подтверждают количественно тестированием табака, несущего встроенный ген, кодирующий вариантную РРО соевых бобов, полученный в Примере 13 тем же образом, что и в Примере 6. Результаты, полученные на 4 клонах табака (GMP 1-4) со встроенным геном, кодирующим вариантную РРО соевых бобов, и контрольном рекомбинантном табаке, представлены в Таблице 8. В таблице уровень резистентности к гербицидному соединению представлен в процентах общего содержания хлорофилла в кусочках листьев, обработанных гербицидом, по отношению к нему в необработанных кусочках листьев.
Пример 15
Выделение гена РРО хламидомонад
Chlamydomonas reinhardtii CC407 штамм, полученный из Центра Генетики Хламидомонад (адрес: DCMB Group, Department of Botany, Box 91000, Duke University, Durham, NC 27708-1000, USA), культивируют в активирующем фотосинтез свете 200 мкЕ/м2/с в течение 5 дней в жидкой культуральной среде ТАР (E.H.Harris, The Chlamydomonas Sourcebook, Academic Press, San Diego, 1989, p.576-577), содержащей 7 мМ NH4Cl, 0,4 мМ MgSO4·7H2O, 0,34 мМ CaCl2·2H2O, 25 мМ фосфата калия, 0,5 мМ Трис (рН 7,5), 1 мл/л Hatner mimer элемент и 1 мл/л ледяной уксусной кислоты, чтобы получить 200 мл (1,0×106 клеток/мл) жидкой культуральной среды, содержащей клетки в ранней стационарной фазе роста.
Общую РНК получают из этих клеток с использованием ISOGEN (производитель Nippon Gene) согласно инструкции. Также поли(А)РНК фракционируют с использованием набора BioMag mRNA Purification (производитель Perceptive Bio Systems) согласно инструкции. кДНК синтезируют на основе полученной поли(А)РНК с использованием набора Marathon cDNA Amplification (производитель Clonthech) согласно приложенной к нему инструкции и PCR проводят с использованием полученной кДНК в качестве матрицы.
В качестве праймеров для PCR получают олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 15, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 16. Олигонуклеотиды получают с помощью синтезатора ДНК (синтезатор ДНК/РНК РЕ Applied Biosystems, модель 394) и очищают картриджем для очистки олигонуклеотидов (РЕ Applied Biosystems, OPC cartridge).
PCR проводят с получением реакционной жидкости с использованием набора Advantage cDNA PCR (производитель Clontech) согласно приложенной к нему инструкции и затем после выдерживания при 94°С в течение 1 минуты, затем при 65°С в течение 5 минут, с повторением 29 раз цикла выдерживания при 94°С в течение 15 секунд и затем при 65°С в течение 5 минут. После PCR амплифицированный фрагмент ДНК очищают фильтрацией реакционной смеси через MicroSpin S-400HR (производитель Pharmacia Biotech) и фрагмент ДНК клонируют в плазмиде pCR2.1 с использованием набора ТА Cloning (производитель Invitrogen) согласно приложенной к нему инструкции для конструирования плазмиды рСРРО.
Нуклеотидную последовательность фрагмента ДНК, содержащегося в полученной плазмиде рСРРО, определяют с использованием набора краситель-терминирующего циклического секвенирования (производитель РЕ Applied Biosystems) и ДНК секвенатора 373S (производитель РЕ Applied Biosystems). В результате получается нуклеотидная последовательность SEQ ID NO: 17, что подтверждает, что плазмида рСРРО содержит полную длину кДНК РРО Chlamydomonas reinhardtii.
Пример 16
Выделение гена, кодирующего вариантный белок РРО Chlamydomonas reinhardtii, не способный к окислению протопорфириногена IX и имеющий специфическое сродство к протопорфириногену IX.
PCR проводят с использованием плазмиды рСРРО, полученной в Примере 15, в качестве матрицы, и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 19, и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 20, в качестве праймеров для амплификации фрагмента ДНК, кодирующего РРО Chlamydomonas reinhardtii, в котором удалены хлоропластный переходный сигнал и FAD связывающая последовательность (далее упоминается как вариантная РРО Chlamydomonas reinhardtii). Олигонуклеотиды синтезируют с помощью синтезатора ДНК (синтезатор ДНК/РНК РЕ Applied Biosystems, модель 394) и очищают с помощью картриджа для очистки олигонуклеотидов (РЕ Applied Biosystems, OPC картридж). PCR проводят, повторяя 30 раз выдерживание при 94°С в течение 1 минуты, при 55°С в течение 2 минут и при 72°С в течение 3 минут. Амплифицированный фрагмент ДНК расщепляют ферментами рестрикции BamHI и SacI и вставляют между BamHI сайтом рестрикции и SacI сайтом рестрикции плазмиды pTV119N (производитель Takara Shuzo Co., Ltd.), чтобы сконструировать плазмиду pTVCRP (Фиг.10).
Плазмиду pTVCRP вставляют в мутантный штамм ВТ3 Е. coli, дефицитный по РРО гену, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Если полученную Е. coli культивируют в YPT среде, содержащей 100 мкг/мл ампициллина и 10 мкг/л канамицина, то не получают роста комплементарного штамма.
Пример 17
Тест на способность вариантной модифицированной РРО из Chlamydomonas reinhardtii обеспечивать резистентность к гербицидным соединениям.
Плазмиды pTVCRP и pTV118N, полученные в Примере 16, вводят в штамм ВТ3/pACYCSP Е. coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; р 557 (1983). Штамм Е. coli ВТ3/pACYCSP + pTVCRP, несущий плазмиды pACYCSP и pTVCRP, и штамм E.coli BT3/pACYCSP + pTV118N, несущий плазмиды pACYCSP и pTV118N, были получены с помощью культивирования вышеуказанных штаммов в среде YPT, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина.
Эти штаммы Е. coli помещают в YPT среду, содержащую 10 или 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, так же, как и в Примере 2. Затем, через 18 часов после начала культивирования, измеряют абсорбцию жидкой культуральной среды при 600 нм. Приняв абсорбцию среды без гербицидного соединения за 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты представлены в Таблице 9.
Пример 18
Введение гена, кодирующего вариантную РРО Chlamydomonas reinhardtii, в табак.
Плазмида для введения гена, кодирующего вариантную РРО Chlamydomonas reinhardtii, в табак была сконструирована методом инфекции Agrobacterium. ДНК фрагмент, содержащий ген, кодирующий вариантную РРО Chlamydomonas reinhardtii, был получен путем расщепления плазмиды pTVCRP, полученной в Примере 16, ферментами рестрикции BamHI и SacI. Бинарный вектор рВI121 (производитель Clontech) расщепляют ферментами рестрикции BamHI и SacI для удаления гена β-глюкуронидазы и вышеуказанный ген, кодирующий вариантную РРО Chlamydomonas reinhardtii, вставляют на его место, чтобы получить плазмиду pBICRP (Фиг.11).
Плазмиду pBICRP вводят в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивируют в среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина, с последующим выбором желаемых трансформантов, чтобы изолировать штамм Agrobacterium, несущий плазмиду pBICRP.
Кусочки листьев табака, выращенных стерильно, инфицируют штаммом Agrobacterium, в соответствии с той же схемой, что и в Примере 5, и получают табак, в который встроен ген, кодирующий вариантную РРО Chlamydomonas reinhardtii.
Пример 19
Подтверждение резистентности к гербицидным соединениям табака, несущего встроенный ген, кодирующий вариантную РРО
Chlamydomonas reinhardtii.
Уровень резистентности к гербицидным соединениям типа ингибиторов РРО, представленным структурой 8, подтверждают количественно тестированием табака, несущего встроенный ген, кодирующий вариантную РРО Chlamydomonas reinhardtii, полученного в Примере 18 тем же способом, что и в Примере 6. Результаты, полученные на 4 клонах табака (CRP 1-4) со встроенным геном, кодирующим вариантную РРО Chlamydomonas reinhardtii, и контрольного рекомбинантного табака представлены в Таблице 10. В таблице уровень резистентности к гербицидному соединению представлен в процентах общего содержания хлорофилла в кусочках листьев, обработанных гербицидом, по отношению к нему в необработанных кусочках листьев.
соединению (%)
Пример 20
Проверка способности вариантного белка феррохелатазы ячменя, имеющего специфическую аффинность к протопорфирину IX, придавать резистентность к гербицидным соединениям. Плазмиду, несущую ген феррохелатазы ячменя, получают методом, описанным Miyamoto К, et al., Plant Physiol. 105; р 769 (1994). Полученную плазмиду расщепляют ферментами рестрикции NspI и EcoRI, чтобы получить фрагмент ДНК, содержащий ген, кодирующий феррохелатазу ячменя, чья сигнальная последовательность была удалена (везде далее будет употребляться термин вариантная феррохелатаза). Этот фрагмент ДНК вставляют между SphI сайтом рестрикции и EcoRI сайтом рестрикции плазмиды pTV119N (производитель Takara Shuzo Co., Ltd.) чтобы сконструировать плазмиду pTVHVFl (Фиг.12).
Плазмиды pTVHVFl и pTV118N вводят в штамм ВТ3/pACYCSP Е. coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Штамм ВТ3/pACYCSP + pTVHVF1, несущий плазмиды pACYCSP и pTVHVF1, и штамм BT3/pACYCSP + pTV118N, несущий плазмиды pACYCSP и pTV118N Е. coli, были получены с помощью культивирования вышеуказанных штаммов в среде YPT, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина.
Эти штаммы Е. Coli помещают в YPT среду, содержащую 10 или 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, тем же способом, что и в Примере 2. Затем через 18 часов после начала культивирования измеряют абсорбцию жидкой культуральной среды при 600 нм. Считая абсорбцию среды без гербицидного соединения за 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты представлены в Таблице 11.
Пример 21
Введение гена, кодирующего вариантную феррохелатазу ячменя, в табак.
Плазмида для введения гена, кодирующего вариантную феррохелатазу ячменя, в табак была сконструирована методом инфекции Agrobacterium. Плазмиду pTVHVFl, полученную в Примере 20, расщепляют ферментом рестрикции NcoI с последующим образованием тупых концов в ДНК путем добавления нуклеотидов к двухцепочечной бреши в ДНК с помощью ДНК полимеразы I. Затем ДНК дефосфорилируют с помощью алкалин-фосфатазы, полученной из кишечника теленка, и циклизуют с помощью вставки фосфорилированного BamHI линкера (4610 Р, производитель Takara Shuzo Co., Ltd.) для конструирования плазмиды pTVHVF2. Затем pTVHVF2 расщепляют ферментом рестрикции EcoRI с последующим образованием тупых концов в ДНК путем добавления нуклеотидов к двухцепочечной бреши в ДНК с помощью ДНК полимеразы I. Затем ДНК дефосфорилируют с помощью алкалин-фосфатазы, полученной из кишечника теленка, и циклизуют с помощью вставки фосфорилированного SalI линкера (4680Р, производитель Takara Shuzo Co., Ltd.) для конструирования плазмиды pTVHVF3. Плазмиду pBI121KS, полученную в Примере 9, расщепляют ферментами рестрикции BamHI и SalI, чтобы удалить ген β-глюкуронидазы. Фрагмент ДНК, содержащий ген, кодирующий вариантную феррохелатазу ячменя, был получен расщеплением вышеуказанной плазмиды pTVHVF3 ферментами рестрикции BamHI и SalI. Образовавшийся фрагмент ДНК вставляют в плазмиду pBI121KS, замещая ген β-глюкуронидазы, чтобы получилась плазмида pBIHVF (Фиг.13), в которой вариантный ген ячменя присоединен под промотор 35S.
Плазмиду pBIHVF вводят в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивируют в среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина, с последующим выбором желаемых трансформантов, чтобы изолировать штамм Agrobacterium, несущий плазмиду pBIHVF.
Кусочки листьев табака, выращенных стерильно, инфицируют штаммом Agrobacterium, таким же способом, как и в Примере 5, и получают табак, в который вставлен ген, кодирующий вариантную феррохелатазу ячменя.
Пример 22
Подтверждение резистентности к гербицидным соединениям табака, несущего встроенный ген, кодирующий вариантную феррохелатазу ячменя.
Уровень резистентности к гербицидным соединениям типа ингибиторов РРО, представленным структурой 8, подтверждают количественно тестированием табака, несущего встроенный ген, кодирующий вариантную феррохелатазу ячменя, полученного в Примере 21 таким же способом, как и в Примере 6. Результаты, полученные на 4 клонах табака (HVF 1-4) со встроенным геном, кодирующим вариантную феррохелатазу ячменя, и на контрольном рекомбинантном табаке, представлены в Таблице 12. В таблице уровень резистентности к гербицидному соединению представлен в процентах общего содержания хлорофилла в кусочках листьев, обработанных гербицидом, по отношению к нему в необработанных кусочках листьев.
тестируемому соединению (%)
Пример 23
Проверка способности вариантного белка феррохелатазы огурца, имеющего специфическую аффинность к протопорфирину IX, придавать резистентность к гербицидным соединениям.
Реакция PCR проводится с использованием клона кДНК феррохелатазы огурца, изолированной методом, описанным Miyamoto, К. et al., Plant Physiol., 105; р 769 (1994), в качестве матрицы, олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 21, и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 22, в качестве праймеров для амплификации ДНК фрагмента, кодирующего феррохелатазу огурца, в котором удалена сигнальная последовательность (в дальнейшем употребляется термин вариантная феррохелатаза огурца). Олигонуклеотиды были синтезированы с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищены с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Реакцию PCR проводят выдерживанием при 94°С в течение 1 минуты, при 55°С в течение 2 минут и при 72°С в течение 3 минут с повторением 30 раз. Амплифицированный фрагмент ДНК расщепляют ферментами рестрикции BamHI и SacI и вставляют между BamHI сайтом рестрикции и SacI сайтом рестрикции плазмиды pTV119N (производитель Takara Shuzo Co., Ltd.), чтобы сконструировать плазмиду pTVCSF (Фиг.14).
Плазмиды pTVCSF и pTV118N вводят в штамм ВТ3/pACYCSP Е. coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Штамм ВТ3/pACYCSP + pTVCSF, несущий плазмиды pACYCSP и pTVCSF, и штамм BT3/pACYCSP + pTV118N, несущий плазмиды pACYCSP и pTV118N Е. coli, получают с помощью культивирования вышеуказанных штаммов в среде YPT, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина.
Эти штаммы Е. coli помещают в YPT среду, содержащую 10 или 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, таким же способом, как и в Примере 2. Затем, через 18 часов после начала культивирования, измеряют абсорбцию жидкой культуральной среды при 600 нм. Взяв абсорбцию среды без гербицидного соединения как 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты представлены в Таблице 13.
Пример 24
Введение гена, кодирующего вариантную феррохелатазу огурца, в табак.
Плазмида для введения гена, кодирующего модифицированную феррохелатазу огурца, в табак была сконструирована методом инфекции Agrobacterium. Плазмиду рВI121 (производитель Clontech) расщепляют ферментами рестрикции BamHI и SacI, чтобы удалить ген β-глюкуронидазы. Фрагмент ДНК, содержащий ген, кодирующий вариантную феррохелатазу огурца, получают путем расщепления вышеуказанной плазмиды pTVCSF, описанной в Примере 23, ферментами рестрикции BamHI и SacI. Образовавшийся фрагмент ДНК вставляют в плазмиду рВI121, замещая ген β-глюкуронидазы, чтобы получить плазмиду pBICSF (Фиг.15), в которой вариантный ген феррохелатазы огурца присоединен под промотор 35S.
Плазмиду pBICSF вводят в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивируют в среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина, с последующем выбором желаемых трансформантов, чтобы изолировать штамм Agrobacterium, несущий плазмиду pBICSF.
Кусочки листьев табака, выращенных стерильно, инфицируют штаммом Agrobacterium, в соответствии с той же схемой, что и в Примере 5, и получают табак, в который вставлен ген, кодирующий модифицированную феррохелатазу огурца.
Пример 25
Подтверждение резистентности к гербицидным соединениям табака, несущего встроенный ген, кодирующий вариантную феррохелатазу огурца.
Уровень резистентности к гербицидным соединениям РРО-ингибиторного типа был подтвержден количественно тестированием табака, несущего вставленный ген, кодирующий модифицированную феррохелатазу огурца, полученного в Примере 24 таким же способом, как и в Примере 6.
Пример 26
Выделение гена оксидазы копропорфириногена III (hemF) из Е. coli.
Геномную ДНК выделяют из штамма LE392 Е. coli с использованием набора ISOPLANT для выделения геномной ДНК (производитель Nippon Gene). Праймер из олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 23, и праймер из олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 24, были синтезированы по 5' и 3' концам нуклеотидной последовательности hemF гена Е. coli, зарегистрированного в GenBank (каталожный номер Х75413). Олигонуклеотиды получают с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Реакцию PCR проводят с использованием около 1 мкг геномной ДНК из штамма LE392 Е. coli в качестве матрицы и вышеуказанных олигонуклеотидов (каждого по 10 пмоль) в качестве праймеров для амплификации фрагмента ДНК, содержащего hemF ген Е. coli. PCR проводят с повторением цикла выдерживания при 94°С в течение 1 минуты, при 55°С в течение 2 минут и при 72°С в течение 3 минут 30 раз.
Пример 27
Проверка hemF белка Е. Coli на способность придавать резистентность к гербицидным соединениям.
Амплифицированным методом, описанным в Примере 26, фрагмент ДНК, содержащий ген hemF, расщепляют ферментами рестрикции FbaI и PstI и вставляют между BamHI сайтом рестрикции и PstI сайтом рестрикции имеющейся в коммерческой продаже плазмиды pUC118 (производитель Takara Shuzo Co., Ltd.), чтобы сконструировать плазмиду pHEMF (Фиг.16).
Плазмиды pHEMF и pTV118N вводят в штамм ВТ3/pACYCSP Е. coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Штамм ВТ3/pACYCSP + pHEMF, несущий плазмиды pACYCSP и pHEMF, и штамм BT3/pACYCSP + pTV118N, несущий плазмиды pACYCSP и pTV118N E. coli, получают с помощью культивирования вышеуказанных штаммов в среде YPT, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина.
Эти штаммы E.coli помещают в YPT среду, содержащую 10 или 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, в соответствии с той же схемой, что и в Примере 2. Затем через 18 часов после начала культивирования измеряют абсорбцию жидкой культуральной среды при 600 нм. Взяв абсорбцию среды без гербицидного соединения как 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты представлены в Таблице 14.
Пример 28
Введение hemF гена Е. coli в табак.
Плазмиду для введения hemF гена Е. coli в табак конструируют методом инфекции Agrobacterium. Сначала, для получения hemF гена Е. coli синтезируют праймер из олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 25, и олигонуклеотида, состоящего из нуклеотидной последовательности SEQ ID NO: 26, с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). PCR проводят с использованием праймеров из олигонуклеотидов, тем же способом, что и в Примере 26, для амплификации фрагмента ДНК, содержащего hemH ген Е. coli.
Плазмиду рВ1121 (производитель Clontech) расщепляют ферментами рестрикции BamHI и SacI, чтобы удалить ген β-глюкуронидазы. Фрагмент ДНК, содержащий hemF ген Е. coli получают расщеплением вышеуказанного PCR-амплифицированного фрагмента ферментами рестрикции BamHI и SacI. Образовавшийся фрагмент ДНК вставляют в плазмиду рВ1121, замещая ген β-глюкуронидазы, чтобы получить плазмиду pBIHEMF (Фиг.17), в которой hemF ген Е. coli, присоединен под промотор 35S.
Плазмиду pBIHEMF вводят в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивируют в среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина, с последующем выбором желаемых трансформантов, чтобы изолировать штамм Agrobacterium, несущий плазмиду pBIHEMF.
Кусочки листьев табака, выращенных стерильно, инфицируют штаммом Agrobacterium, тем же способом, что и в Примере 5, и получают табак, в который вставлен hemF ген Е. coli.
Пример 29
Подтверждение резистентности к гербицидным соединениям табака со встроенным hemF геном Е. coli.
Уровень резистентности к гербицидным соединениям типа ингибиторов РРО был подтвержден количественно тестированием табака, несущего hemF ген Е. Coli, полученного в Примере 28, в соответствии с той же схемой, что и в Примере 6.
Пример 30
Испытание на связывание соединение порфирина - связующий белок с протопорфирином IX.
Фаговую библиотеку, представляющую белок, содержащий аминокислотную последовательность из 5 случайных аминокислот, и фаговую библиотеку, включающую аминокислотную последовательность HASYS или RASSL (в которой Н - гистидин, А - аланин, S - серин, Y - тирозин, R - аргинин и L - лейцин), которая может специфически связываться с соединениями порфирина 5, 10, 15, 20-тетракис (N-метилпиридин-4-ил)-21Н, 23Н-порфин (Н2TMpyP), получают согласно методу, описанному KITANO et al., Nihon Kagakukai (Chemical Society of Japan) 74th Spring Annual Meeting Pre-Published Abstracts of Presentation II, p 1353, 4G511 (1998).
Сначала конструируют фаговую библиотеку, представляющую белок, состоящий из аминокислотной последовательности, включающей 5 случайных аминокислот. Были синтезированы смешанные олигонуклеотиды, состоящие из нуклеотидной последовательности SEQ ID NO: 27, и смешанные олигонуклеотиды, состоящие из нуклеотидной последовательности SEQ ID NO: 28. Смешанные олигонуклеотиды были синтезированы с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищены с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Вышеуказанные смешанные олигонуклеотиды (каждого по 59 пмоль) фосфорилируют по 5' концу обработкой соответствующей Т4 ДНК киназой. Их перемешивают и после прогревания при 70°С в течение 10 минут подвергают отжигу путем медленного охлаждения до комнатной температуры со скоростью 0,5°C/минута. Плазмиду pCANTAB5E (производитель Pharmacia Biotech), расщепляют ферментами рестрикции SfiI и NotI для удаления гена рекомбинантного антитела ScFv. Вышеуказанную фосфорилированную и подвергшуюся отжигу пару олигонуклеотидов вставляют на место вышеуказанного гена рекомбинантного антитела ScFv, чтобы приготовить плазмиду, содержащую последовательность нуклеотидов, кодирующих белок, состоящий из аминокислотной последовательности из 5 случайных аминокислот, и присоединенную к ней аминокислотную последовательность поверхностного белка фага М13. Плазмиду вводят в штамм TG-1 Е. coli согласно методу, описанному Hanahan D.J., Mol. Biol., 166; p 557 (1983) и культивируют в 2 × YT среде (10 г/л дрожжевого экстракта, 15 г/л триптона, 5 г/л NaCl, pH 7,2), содержащей 100 мкг/мл ампициллина, для получения рекомбинантного штамма TG-1 Е. coli. Рекомбинантный штамм TG-1 Е. coli помещают в 2 × YT среду, содержащую 100 мкг/мл ампициллина, и культивируют со встряхиванием при 37°С. Затем через 1 час после начала культивирования 6×1010 pfu фага-помощника М13К07 (производитель Pharmacia Biotech) помещают в среду, и культуру продолжают еще 18 часов встряхивать. Затем жидкую культуральную среду центрифугируют при 1000×g в течение 20 минут, чтобы собрать фаговую библиотеку, представляющую белок, содержащий аминокислотную последовательность из 5 случайных аминокислот.
Чтобы приготовить клон фагов, представляющих белок, состоящий из аминокислотной последовательности HASYS (SEQ ID NO: 53), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 29, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 30. И для получения клона фагов, представляющих белок, состоящий из аминокислотной последовательности RASSL (SEQ ID NO: 55), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 31, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 32. Эти олигонуклеотиды были синтезированы с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищены с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Клон фагов, представляющий белок, состоящий из аминокислотной последовательности HASYS или RASSL, был получен с помощью тех же операций, что и для получения фаговой библиотеки, представляющей белок, содержащий аминокислотную последовательность из 5 случайных аминокислот.
Суспензию фагов, содержащую клон фагов, представляющих белок, состоящий из аминокислотной последовательности HASYS, клон фагов, представляющих белок, состоящий из аминокислотной последовательности RASSL, или фаговую библиотеку, представляющую белок, содержащий аминокислотную последовательность из 5 случайных аминокислот (титр 105 pfu), наносят на нитроцеллюлозный фильтр (производитель Schleicher & Schuell) и затем нитроцеллюлозный фильтр блокируют встряхиванием в РВТ буфере (137 мМ NaCl, 8.10 мМ Na2HPO4, 2,68 мМ KCl, 1,47 мМ КН2PO4, 0,05% Tween 20, pH 7,2), содержащем 1% сывороточного альбумина быка. Нитроцеллюлозный фильтр промывают РВТ буфером и встряхивают в течение 18 часов в 2 × SSC буфере (0,3 М NaCl, 0,03 М цитрата натрия), содержащем 10 мкМ протопорфирина IX. Далее вышеуказанный нитроцеллюлозный фильтр промывают 2 × SSC буфером, сушат и определяют флуоресценцию, исходящую от протопорфирина IX под ультрафиолетовым светом (365 нм).
Пятна фаговой библиотеки не флуоресцируют, в то время как пятна обоих клонов фага, представляющих белок, состоящий из аминокислотной последовательности HASYS, и белок, состоящий из аминокислотной последовательности RASSL, показывают ясную флуоресценцию.
Пример 31
Проверка протопорфирин IX связывающего белка на способность придавать резистентность к гербицидным соединениям.
Вначале была получена плазмида, которая могла бы экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности HASYS (SEQ ID NO: 53), или состоящий из аминокислотной последовательности RASSL (SEQ ID NO: 55). Для получения плазмиды, способной экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO: 54 (далее будет называться белок MGHASYS), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 33, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 34. Вышеуказанные олигонуклеотиды синтезируют с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Вышеуказанные олигонуклеотиды (каждого по 50 пмоль) фосфорилируют каждый по 5'-концу обработкой Т4 ДНК киназы. Их перемешивают и после прогревания при 70°С в течение 10 минут подвергают отжигу путем медленного охлаждения до комнатной температуры со скоростью 0,5°C/минута. Плазмиду pYV118N расщепляют ферментами рестрикции NcoI и EcoRI для удаления генного фрагмента, состоящего из 16 пар оснований. Плазмида pHASYS, способная экспрессировать ген, кодирующий белок MGHASYS, была получена вставкой вышеуказанных фосфорилированных и подвергшихся отжигу пары олигонуклеотидов на позицию вышеуказанных удаленных 16 пар оснований.
Затем для получения плазмиды, способной экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO: 56 (далее употребляется название белок MGRASSL), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 35, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 36. Вышеуказанные олигонуклеотиды синтезируют с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Плазмиду pRASSL, способную экспрессировать ген, кодирующий белок MGRASSL, получают по той же методике, что и плазмиду pHASYS.
Получают плазмиду, способную экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности YAGY или YAGF (где Y - тирозин, А - аланин, G - глицин, F - фенилаланин) (Suqimoto N., Nakano S., Chem. Lett. p 939, 1997), способный связывать соединение порфирина Н2TMpyP. Для получения плазмиды, способной экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO: 58 (далее употребляется название белок MGYAGY), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 37, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 38. Для получения плазмиды, способной экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO: 60 (далее употребляется название белок MGYAGF), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 39, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 40. Эти олигонуклеотиды синтезируют с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Плазмиду pYAGY, способную экспрессировать ген, кодирующий белок MGYAGY, и плазмиду pYAGF, способную экспрессировать ген, кодирующий белок MGYAGF, получают по той же методике, что и плазмиду pHASYS.
Вышеуказанные плазмиды pHASYS, pRASSL, pYAGY, pYAGF и pTV118N вводят в штамм ВТ3/pACYCSP E.coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Птамм ВТ3/pACYCSP + pHASYS, несущий плазмиды pACYCSP и pHASYS, штамм ВТ3/pACYCSP + pRASSL, несущий плазмиды pACYCSP и pRASSL, штамм BT/pACYCSP + pYAGY, несущий плазмиды pACYCSP и pYAGY, штамм ВТ3/pACYCSP + pYAGF, несущий плазмиды pACYCSP и pYAGF и штамм BT3/pACYCSP + pTV118N, несущий плазмиды pACYCSP и pTV118N E.coli, были получены с помощью культивирования вышеуказанных штаммов в среде YPT, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина.
Эти штаммы E. coli помещают в YPT среду, содержащую 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности тем же образом, что и в Примере 2. Затем через 18 часов после начала культивирования измеряют абсорбцию жидкой культуральной среды при 600 нм. Взяв абсорбцию среды без гербицидного соединения как 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты представлены в Таблице 15.
Далее получают плазмиду, способную экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности, в которой множество аминокислотных последовательностей HASYS и RASSL повторно присоединены друг к другу. Для получения плазмиды, способной экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO: 61 (далее употребляется название белок MG(HASYS)4, (HASYS)n, или - последовательность, в которой пептид HASYS повторно присоединен друг к другу n раз) синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 или SEQ ID NO: 44. Эти олигонуклеотиды синтезируют с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Сначала олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 42, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 43, фосфорилируют каждый по 5'-концу обработкой Т4 ДНК киназой. После этого олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 41, и олигонуклеотид, состоящий из фосфорилированной нуклеотидной последовательности SEQ ID NO: 42, или олигонуклеотид, состоящий из фосфорилированной нуклеотидной последовательности SEQ ID NO: 43, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 44 (каждого по 300 пмоль), перемешивают и после прогревания при 70°С в течение 5 минут подвергают отжигу путем медленного охлаждения до комнатной температуры со скоростью 0,5°C/минута. Вышеуказанные две пары олигонуклеотидов, подвергшиеся отжигу, перемешивают и сдваивают с помощью Т4 ДНК лигазы, и получившийся фрагмент ДНК фосфорилируют по 5' концу Т4 ДНК киназой. С другой стороны, вектор pTV118N расщепляют ферментами рестрикции NcoI и EcoRI для удаления генного фрагмента, состоящего из 16 пар оснований, и вышеуказанный фосфорилированный фрагмент ДНК вставляют на указанную позицию, чтобы получить плазмиду pHASYS4, способную экспрессиовать ген, кодирующий белок MG(HASYS)4.
Далее, для получения плазмиды, способной экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO: 62 (далее употребляется название белок MG(HASYS)8), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 45, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 46. Эти олигонуклеотиды синтезируют с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж). Сначала вышеуказанные олигонуклеотиды фосфорилируют каждый по 5' концу обработкой Т4 ДНК киназой. После этого олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 41, и олигонуклеотид, состоящий из фосфорилированной нуклеотидной последовательности SEQ ID NO: 42 (каждого по 300 пмоль), перемешивают; олигонуклеотид, состоящий из фосфорилированной нуклеотидной последовательности SEQ ID NO: 43, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 44 (каждого по 300 пмоль), перемешивают и, далее, олигонуклеотид, состоящий из фосфорилированной нуклеотидной последовательности SEQ ID NO: 45, и олигонуклеотид, состоящий из фосфорилированной нуклеотидной последовательности SEQ ID NO: 46 (каждого по 600 пмоль), перемешивают. Эти три смеси подвергают прогреванию при 70°С в течение 5 минут, подвергают отжигу путем медленного охлаждения до комнатной температуры со скоростью 0,5°C/минута. Вышеуказанные три пары олигонуклеотидов, подвергшиеся отжигу, перемешивают и сдваивают с помощью Т4 ДНК лигазы, и получившийся фрагмент ДНК фосфорилируют по 5' концу Т4 ДНК киназой. Плазмиду pHASYS8, способную экспрессировать ген, кодирующий белок MG(HASYS)8, получают тем же способом, что и плазмиду PHASYS4.
Далее, для получения плазмиды, способной экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO: 63 (далее употребляется название белок MG(RASSL)4, (RASSL)n, или - последовательность, в которой пептид RASSL повторно присоединяется друг к другу n раз), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49 или SEQ ID NO: 50. Также для получения плазмиды, способной экспрессировать ген, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO: 64 (далее употребляется название белок MG(RASSL)8), синтезируют олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 51, и олигонуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 52. Эти олигонуклеотиды синтезируют с помощью ДНК синтезатора (РЕ Applied Biosystems, модель 394 ДНК/РНК синтезатор) и очищают с помощью картриджа очистки олигонуклеотидов (РЕ Applied Biosystems, ОРС картридж).
Плазмида pRASSL4, способная экспрессировать ген, кодирующий белок MG(RASSL)4, была получена тем же способом, что и вышеописанная плазмида pHASYS4. Плазмида pRASSL8, способная экспрессировать ген, кодирующий белок MG(RASSL)8, также была получена тем же способом, что и вышеописанная плазмида pHASYS8.
Вышеуказанные плазмиды pHASYS4, pHASYS8, pRASSL4, pRASSL8 и pTV118N были введены в штамм ВТ3/pACYCSP E.coli, полученный в Примере 3, в соответствии с методом, описанным Hanahan D.J., Mol. Biol., 166; p 557 (1983). Штамм BT3/pACYCSP + pHASYS4, несущий плазмиды pACYCSP и pHASYS4, штамм BT3/pACYCSP + pRASSL4, несущий плазмиды pACYCSP и pRASSL4, штамм ВТ3/pACYCSP + pHASYSS, несущий плазмиды pACYCSP и pHASYS8, штамм BT3/pACYCSP + pRASSL8, несущий плазмиды pACYCSP и pRASSL8 и штамм BT3/pACYCSP + pTV118N, несущий плазмиды pACYCSP и pTV118N, E. coli получают с помощью культивирования вышеуказанных штаммов в среде YPT, содержащей 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола и 10 мкг/мл канамицина.
Эти штаммы E.coli помещают в YPT среду, содержащую 1 м.д. гербицидного соединения РРО-ингибиторного типа, представленного выше структурой 8, содержащую 100 мкг/мл ампициллина, 15 мкг/мл хлорамфеникола, 10 мкг/мл канамицина, 10 мкг/мл гемина и 50 мкг/мл аминолевулиновой кислоты, культивируют в условиях темноты или в условиях освещенности, тем же способом, что и в Примере 2. Затем через 18 часов после начала культивирования измеряют абсорбцию жидкой культуральной среды при 600 нм. Взяв абсорбцию среды без гербицидного соединения как 1, вычисляют относительное значение абсорбции среды, содержащей гербицидное соединение. Результаты представлены в Таблице 16.
Пример 32
Введение гена, кодирующего протопорфирин IX связывающий пептид, в табак.
Плазмида для введения гена, кодирующего протопорфирин IX связывающий пептид, в табак была сконструирована методом инфекции Aqrobacterium. Плазмида pHASYS8, полученная в Примере 31, была расщеплена ферментом рестрикции NcoI с последующим образованием тупых концов в ДНК путем добавления нуклеотидов к двухцепочечной бреши в ДНК с помощью ДНК полимеразы I. Затем ДНК дефосфорилируют с помощью щелочной фосфатазы, полученной из кишечника теленка, и циклизуют с помощью вставки фосфорилированного BamHI линкера (4610 Р, производитель Takara Shuzo Co., Ltd.) для конструирования плазмиды pHASYS8B. Плазмиду рВI121 (производитель Clontech) расщепляют ферментами рестрикции BamHI и SacI, чтобы удалить ген β-глюкуронидазы. С другой стороны, плазмиду pHASYS8B, расщепляют ферментами рестрикции BamHI и SacI, чтобы приготовить фрагмент ДНК, содержащий ген, кодирующий белок MG(HASYS)8, и образовавшийся фрагмент ДНК вставляют в плазмиду рВI121, замещая ген β-глюкуронидазы, для получения плазмиды pBIHASYS8 (Фиг.18), в которой ген, кодирующий протопорфирин IX связывающий белок MG(HASYS)8, присоединен под промотор 35S.
Плазмида для введения гена, кодирующего протопорфирин IX связывающий пептид MG(RASSL)8, в растение была сконструирована методом инфекции Agrobacterium. Плазмида pBIRASSL8 (Фиг.19), в которой ген, кодирующий протопорфирин IX связывающий белок MG(RASSL)8, присоединен под промотор 35S, была получена из pRASSL8 тем же способом, что и плазмида pBIHASYS8.
Вышеуказанные плазмиды pBIHASYS8 и pBIRASSL8 вводят в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивируют в среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина, с последующим выбором желаемых трансформантов, чтобы изолировать штамм Agrobacterium, несущий плазмиду pBIHASYS8 и pBIRASSL8 соответственно.
Кусочки листьев табака, выращенных стерильно, инфицируют штаммом Agrobacterium, тем же способом, что и в Примере 5, и получают табак, в который вставлен ген, кодирующий протопорфирин IX связывающий белок MG(HASYS)8, и табак, в который вставлен ген, кодирующий протопорфирин IX связывающий белок MG(RASSL)8.
Пример 33
Подтверждение резистентности к гербицидным соединениям табака, несущего встроенный ген, кодирующий пептид, связывающий протопорфирин IX.
Уровень резистентности к гербицидным соединениям, РРО-ингибиторного типа, количественно подтверждают тестированием табака, несущего ген, кодирующий пептид, связывающий протопорфирин IX, полученный в примере 32 так же, как и в Примере 14.
Как описано выше, в соответствии с настоящим изобретением, были получены растения, устойчивые к соединениям, подавляющим сорняки.
Список последовательностей свободный текст
SEQ ID NO: 1
Сконструированный олигонуклеотидный праймер для амплификации гена bchH
SEQ ID NO: 2
Сконструированный олигонуклеотидный праймер для амплификации гена bchH
SEQ ID NO: 3
Сконструированный олигонуклеотидный праймер для амплификации гена РРО соевых бобов
SEQ ID NO: 4
Сконструированный олигонуклеотидный праймер для амплификации гена РРО соевых бобов
SEQ ID NO: 7
Сконструированный олигонуклеотидный праймер для амплификации гена bchH
SEQ ID NO: 8
Сконструированный олигонуклеотидный праймер для амплификации гена bchH
SEQ ID NO: 9
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена chlH табака
SEQ ID NO: 10
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена chlH табака
SEQ ID NO: 11
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена РРО соевых бобов
SEQ ID NO: 12
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена РРО соевых бобов
SEQ ID NO: 13
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена РРО соевых бобов
SEQ ID NO: 14
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена РРО соевых бобов
SEQ ID NO: 15
Сконструированный олигонуклеотидный праймер для амплификации гена РРО Chlamydomonas
SEQ ID NO: 16
Сконструированный олигонуклеотидный праймер для амплификации гена РРО Chlamydomonas
SEQ ID NO: 19
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена РРО Chlamydomonas
SEQ ID NO: 20
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена РРО Chlamydomonas
SEQ ID NO: 21
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена феррохелатазы огурца
SEQ ID NO: 22
Сконструированный олигонуклеотидный праймер для амплификации фрагмента ДНК, имеющего частичную последовательность гена феррохелатазы огурца
SEQ ID NO: 23
Сконструированный олигонуклеотидный праймер для амплификации гена hemF Escherichia coli
SEQ ID NO: 24
Сконструированный олигонуклеотидный праймер для амплификации гена hemF Escherichia coli
SEQ ID NO: 25
Сконструированный олигонуклеотидный праймер для амплификации гена hemF Escherichia coli
SEQ ID NO: 26
Сконструированный олигонуклеотидный праймер для амплификации гена hemF Escherichia coli
SEQ ID NO: 27
Сконструированные олигонуклеотиды для синтеза генов, кодирующих редко встречающиеся пептиды, включающие 5 аминокислот
SEQ ID NO: 28
Сконструированные олигонуклеотиды для синтеза генов, кодирующих редко встречающиеся пептиды, включающие 5 аминокислот
SEQ ID NO: 29
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид HASYS
SEQ ID NO: 30
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид HASYS
SEQ ID NO: 31
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид RASSL
SEQ ID NO: 32
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид RASSL
SEQ ID NO: 33
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MGHASYS
SEQ ID NO: 34
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MGHASYS
SEQ ID NO: 35
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MGRASSL
SEQ ID NO: 36
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MGRASSL
SEQ ID NO: 37
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MGYAGY
SEQ ID NO: 38
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MGYAGY
SEQ ID NO: 39
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MGYAGF
SEQ ID NO: 40
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MGYAGF
SEQ ID NO: 41
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(HASYS)4
SEQ ID NO: 42
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(HASYS)4
SEQ ID NO: 43
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(HASYS)4
SEQ ID NO: 44
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(HASYS)4
SEQ ID NO: 45
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(HASYS)8
SEQ ID NO: 46
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(HASYS)8
SEQ ID NO: 47
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(RASSL)4
SEQ ID NO: 48
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(RASSL)4
SEQ ID NO: 49
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(RASSL)4
SEQ ID NO: 50
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(RASSL)4
SEQ ID NO: 51
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(RASSL)8
SEQ ID NO: 52
Сконструированный олигонуклеотид для синтеза гена, кодирующего пептид MG(RASSL)8
SEQ ID NO: 53
Аминокислотная последовательность; белок HASYS, связывающий протопорфирин IX
SEQ ID NO: 54
Аминокислотная последовательность; белок MGHASYS, связывающий протопорфирин IX
SEQ ID NO: 55
Аминокислотная последовательность; белок RASSL, связывающий протопорфирин IX
SEQ ID NO: 56
Аминокислотная последовательность; белок MGRASSL, связывающий протопорфирин IX
SEQ ID NO: 57
Аминокислотная последовательность; белок YAGY, связывающий Н2TMpyP
SEQ ID NO: 58
Аминокислотная последовательность; белок MGYAGY, связывающий H2TMpyP
SEQ ID NO: 59
Аминокислотная последовательность; белок YAGF, связывающий Н2TMpyP
SEQ ID NO: 60
Аминокислотная последовательность; белок MGYAGF, связывающий H2TMpyP
SEQ ID NO: 61
Аминокислотная последовательность; белок MG(HASYS)4, связывающий протопорфирин IX
SEQ ID NO: 62
Аминокислотная последовательность; белок MG(HASYS)8, связывающий протопорфирин IX
SEQ ID NO: 63
Аминокислотная последовательность; белок MG(RASSL)4, связывающий протопорфирин IX
SEQ ID NO: 64
Аминокислотная последовательность; белок MG(RASSL)8, связывающий протопорфирин IX













































| название | год | авторы | номер документа |
|---|---|---|---|
| МЕТАБОЛИЗИРУЮЩИЙ ГЕРБИЦИД БЕЛОК, ЕГО ГЕН И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2532104C2 |
| МАНИПУЛИРОВАНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТЬЮ ПРОТОПОРФИРИНОГЕНОКСИДАЗЫ У ЭУКАРИОТ | 1995 |
|
RU2192468C2 |
| МЕТАБОЛИЗИРУЮЩИЙ ГЕРБИЦИД БЕЛОК, ЕГО ГЕН И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2372404C2 |
| ХИМЕРНЫЙ ГЕН, СОДЕРЖАЩИЙ ЕГО РЕКОМБИНАНТНЫЙ ВЕКТОР И СЕМЕННОЙ МАТЕРИАЛ, И СПОСОБЫ, ПРЕДУСМАТРИВАЮЩИЕ ИСПОЛЬЗОВАНИЕ ЭТОГО ГЕНА | 1995 |
|
RU2266332C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ PPO-ГЕРБИЦИДНОЙ ТОЛЕРАНТНОСТИ | 2018 |
|
RU2797237C2 |
| НИТРИЛАЗА ИЗ RHODOCOCCUS RHODOCHROUS NCIMB 11216 | 2001 |
|
RU2283864C2 |
| СОБЫТИЕ 127 В ГЕНОМЕ СОИ И СВЯЗАННЫЕ С НИМ СПОСОБЫ | 2010 |
|
RU2574777C2 |
| Белок устойчивости к гербицидам, кодирующий его ген и их применение | 2016 |
|
RU2692553C2 |
| ГЕНЫ СИНТАЗЫ РАФФИНОЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 1997 |
|
RU2224022C2 |
| Белок устойчивости к гербицидам, кодирующие его гены и их применение | 2016 |
|
RU2681162C1 |
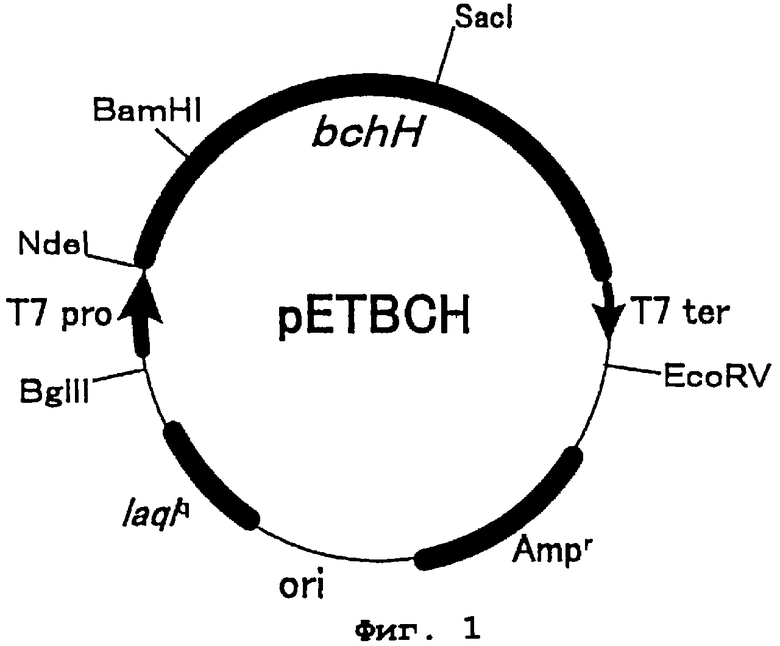
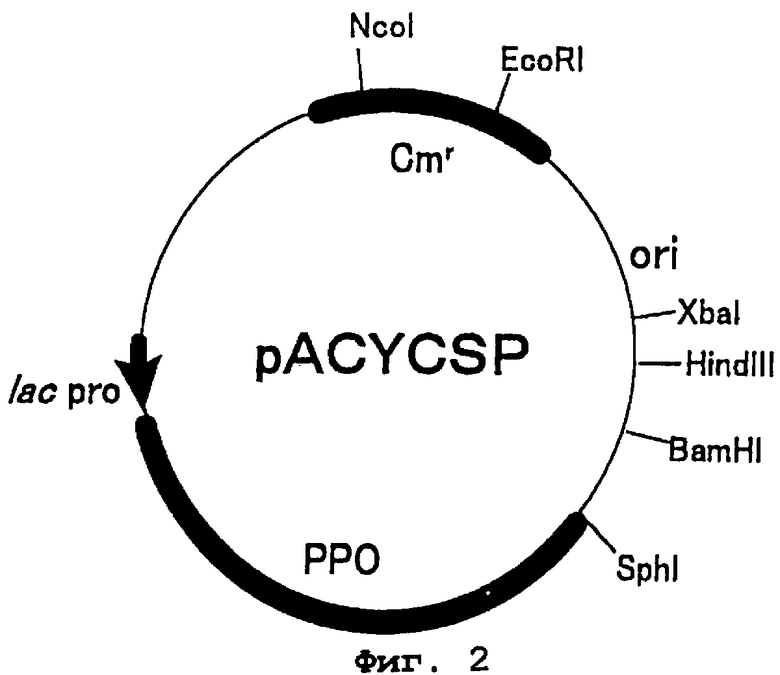
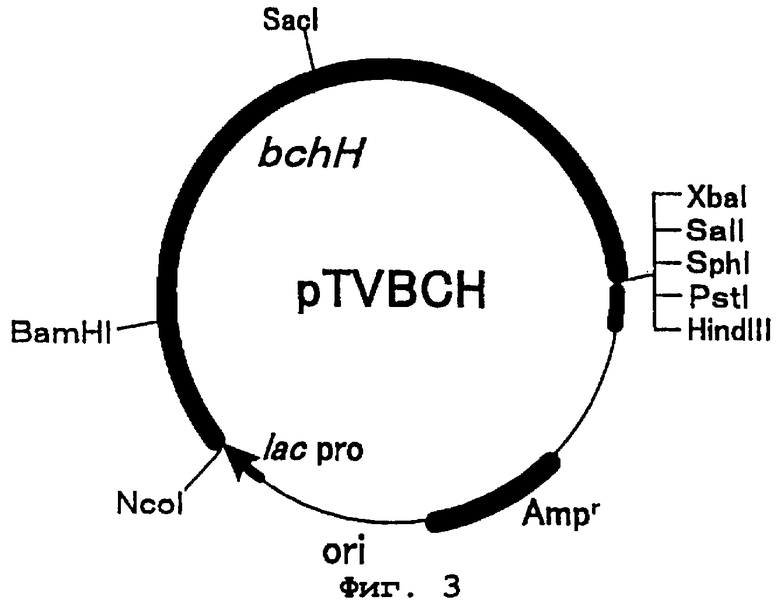

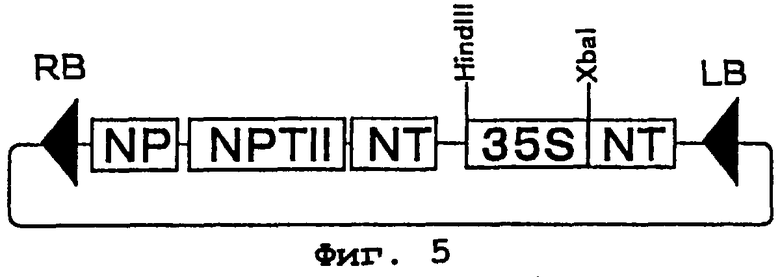
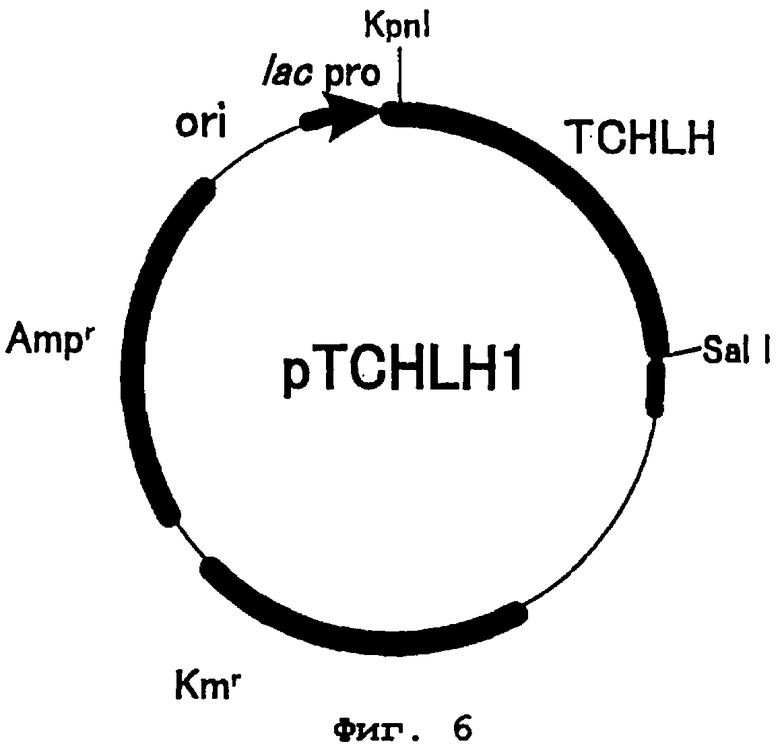







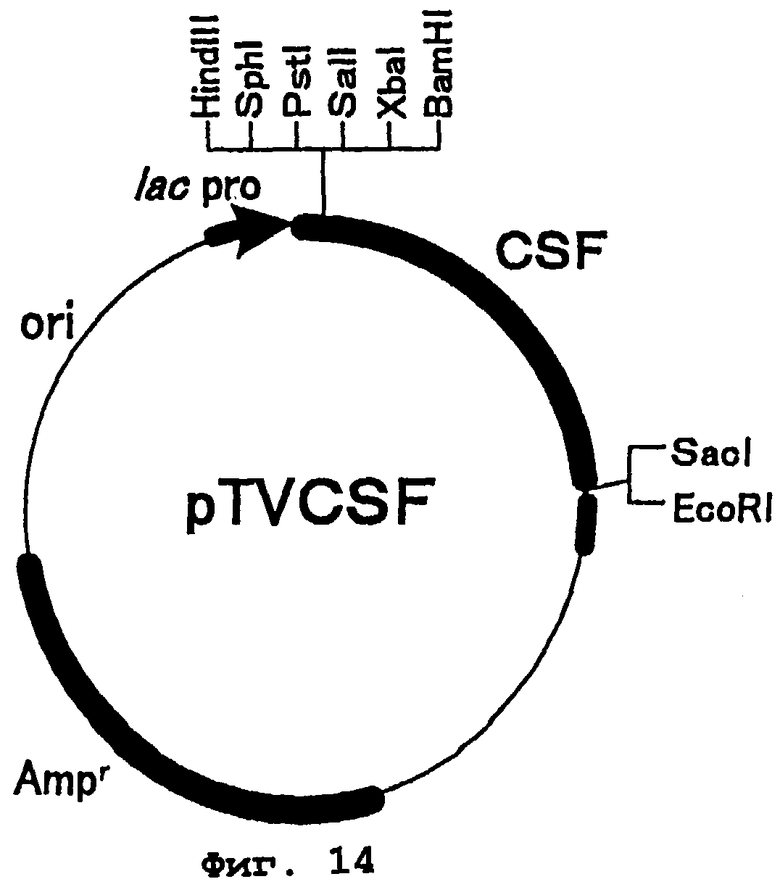
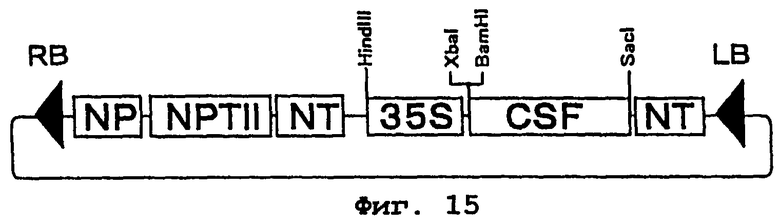
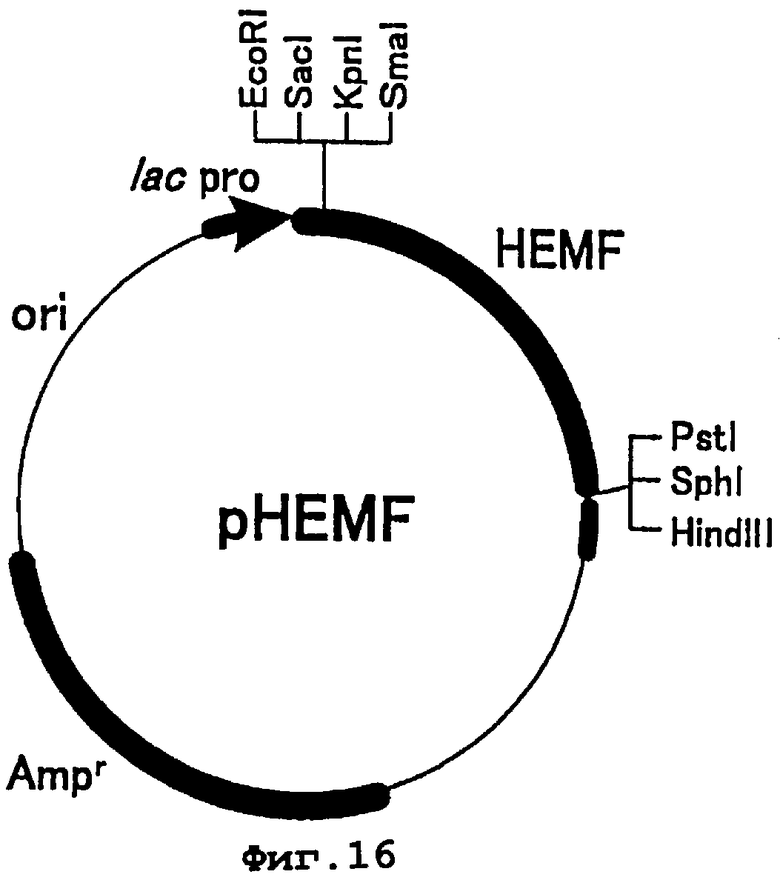
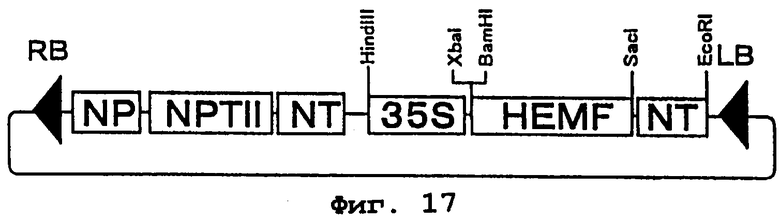
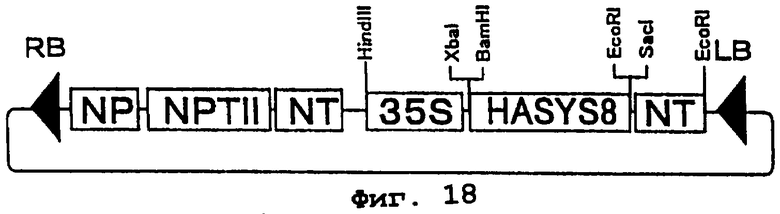
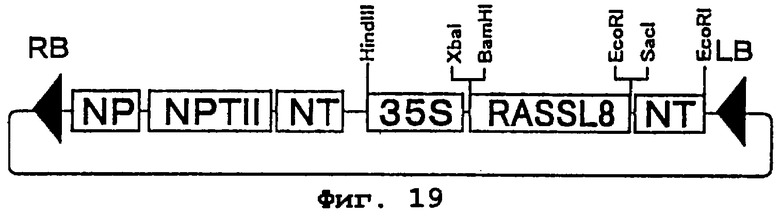
Изобретение может быть использовано в селекции растений. В клетку растения вводят ген, кодирующий белок, имеющий специфическое средство к веществу, имеющему активность в подавлении сорняков. Белок в значительной степени освобожден от каркасных участков вариабельных областей иммуноглобулина. Экспрессия данного белка в растении придает этому растению резистентность к соединениям, подавляющим сорняки. 5 н. и 40 з.п. ф-лы, 19 ил., 16 табл.
(a) наличием специфичного сродства к веществу, ответственному за подавляющую сорняки активность соединения, подавляющего сорняки;
(b) по существу отсутствием способности модифицировать вещество, к которому указанный белок имеет специфичное сродство, и
(c) по существу отсутствием каркасных участков вариабельных областей иммуноглобулина;
и экспрессии этого гена.
(a) наличием специфичного сродства к протопорфирину IX,
(b) по существу отсутствием способности модифицировать протопорфириноген IX, и
(c) по существу отсутствием каркасных участков вариабельных областей иммуноглобулина;
экспрессии гена.
(a) наличием специфичного сродства к протопорфириногену IX,
(b) по существу отсутствием способности модифицировать копропорфириноген III, и
(c) по существу отсутствием каркасных участков вариабельных областей иммуноглобулина;
и экспрессии гена.
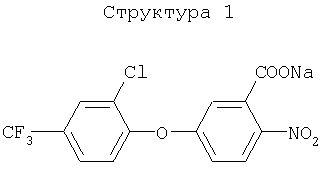
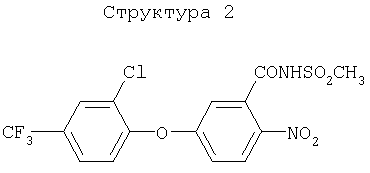




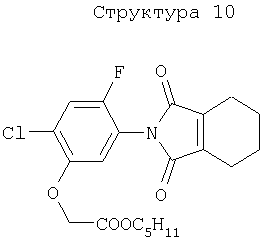
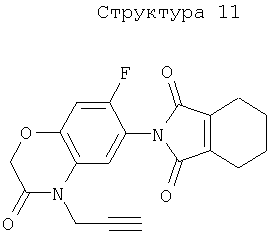

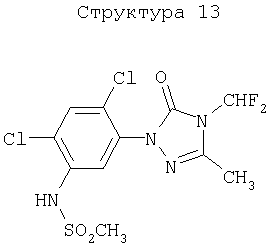

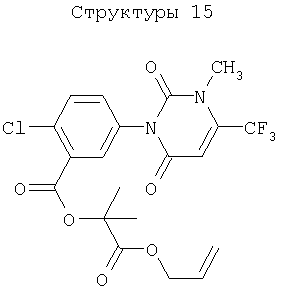
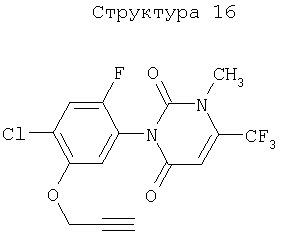

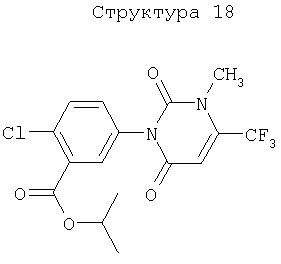
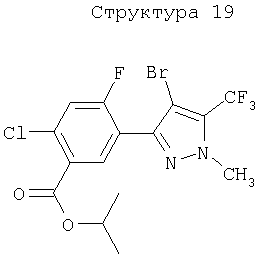

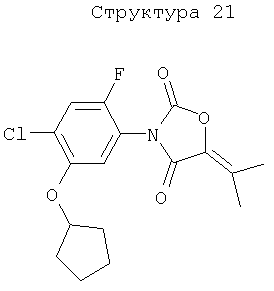



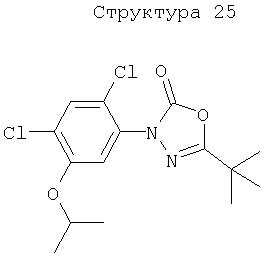


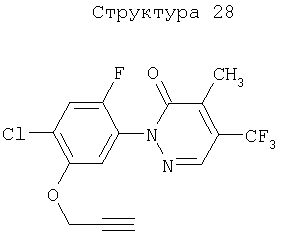

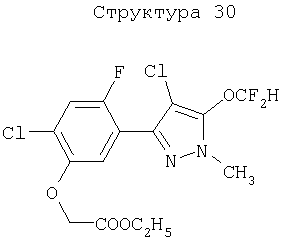
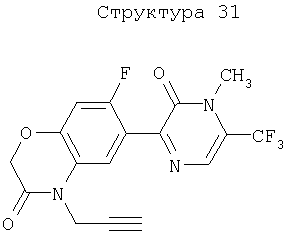
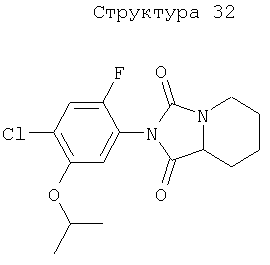

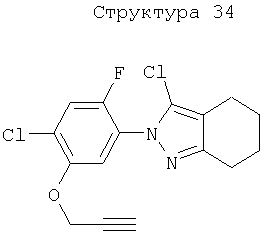
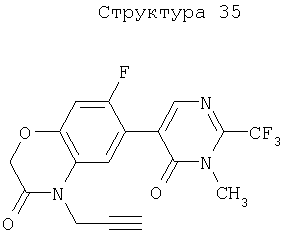

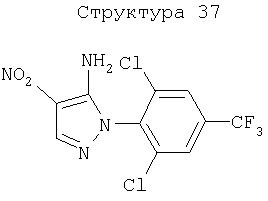
Приоритет по пунктам:
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Способ селективного определения биогенных порфиринов | 1990 |
|
SU1803832A1 |
Авторы
Даты
2007-01-27—Публикация
1999-04-29—Подача