Изобретение относится к области технологии получения органических перекисных соединений, которые могут быть использованы для отбеливания целлюлозы, крахмала, очистки масел, как антисептик в медицине, в сельском хозяйстве, как инициатор в реакциях полимеризации и конденсации, в органическом синтезе при гидроксилировании жирных кислот и олефинов, а также в производстве окиси пропилена, глицидола и других эпоксисоединений (реакция Прилежаева).
Известен способ получения надмуравьиной кислоты из муравьиной кислоты с использованием концентрированных растворов перекиси водорода (в чистом виде муравьиная кислота не получена) [1].
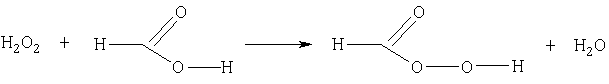
Сущность препаративного синтеза надмуравьиной кислоты химическим методом заключается в том, что стехиометрическую смесь 85%-ной кислоты и 90%-ной перекиси водорода сливают в стеклянную колбу (вначале вливают перекись водорода, а затем муравьиную кислоту), встряхивают и оставляют на 12-16 часов при температуре не выше 10°С. Повышения концентрации надмуравьиной кислоты добиваются декантацией полученного раствора при низких температурах.
Недостаток химического способа получения растворов надмуравьиной кислоты в том, что:
- синтез протекает в несколько стадий;
- используются агрессивные окислители;
- применяется сложное технологическое оборудование для предотвращения взрывов и для поддержания низких температур.
Наиболее близким по технической сущности способом получения пероксимуравьиной кислоты является способ получения пероксиуксусной кислоты [2], сущность которого состоит в том, что проводят электролиз водных растворов ацетата щелочного металла или аммония в анодном отделении диафрагменного электролизера в присутствии 0,5-2,0 г/л добавки роданида щелочного металла или аммония при плотности тока 0,05-1,0 А/см2 с последующим концентрированном образующегося водного раствора пероксикислоты выпариванием или вакуумной перегонкой.
Недостатком синтеза пероксиуксусной кислоты является ее электрохимическое получение из водных растворов солей уксусной кислоты в диафрагменном электролизере с использованием катионитовой мембраны при длительном электролизе. Электросинтез надуксусной кислоты непосредственно из уксусной не представляется возможным ввиду незначительной электропроводности последней.
Задачей настоящего изобретения является разработка способа электрохимического синтеза пероксимуравьиной кислоты и ее солей электролизом водных растворов муравьиной кислоты и ее солей щелочных металлов.
Техническим результатом данного изобретения являются селективность процесса синтеза и получение высокой чистоты конечных продуктов - пероксимуравьиной кислоты и ее солей. Электрохимический метод синтеза в отличие от химического протекает в одну стадию и может осуществляться непрерывно.
Сущностью предложенного способа получения пероксимуравьиной кислоты и ее солей является то, что проводят электролиз 0,5-2,0М водного раствора муравьиной кислоты и ее солей щелочных металлов в диафрагменном электролизере на диоксидно-свинцовом аноде при плотностях тока 0,05-0,5 А/см2 в присутствии роданида аммония при его концентрации 1,0-1,5 г/л.
Предложенный метод синтеза заключается в том, что надмуравьиную кислоту получают как из водных растворов формиатов, так и непосредственно из муравьиной кислоты, т.к. последняя обладает достаточной электропроводностью для проведения электролиза при небольших напряжениях на электролизере (следует отметить, что электросинтез надуксусной кислоты осуществляют только из водных растворов ее солей [2]). Пероксиформиаты щелочных металлов можно синтезировать из водных растворов соответствующих формиатов.
Электролиз муравьиной кислоты и ее солей также как электролиз и других карбоновых кислот и их солей протекает по реакции синтеза Кольбе.
Однако в отличие от всех остальных карбоновых кислот (в том числе и угольная) и их солей в молекуле муравьиной кислоты и ее солей имеется водородный радикал. Это отличие и приводит к тому, что реакция синтеза Кольбе протекает по следующей схеме:

Как известно из литературы [3], НСООН на электродах из платиновых металлов еще при низких анодных потенциалах подвергается каталитическому распаду. Чтобы исключить каталитический распад, необходимо использовать диоксидно-свинцовый электрод. На аноде из диоксида свинца в присутствии известных ингибирующих кислородную реакцию добавок (F-, Cl-, SCN-) реакция Кольбе в растворах муравьиной кислоты или ее солей протекает с участием молекул воды по следующей схеме:
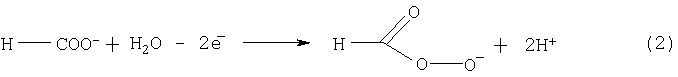
с образованием пероксиформиат-ионов.
Однако электролизу водных растворов муравьиной кислоты и ее солей должно предшествовать модифицирование диоксидно-свинцового анода при низких потенциалах в присутствии поверхностно-активных добавок (CSN-, F-, Cl-). На аноде с модифицированной поверхностью потенциал разряда молекул воды и выделения кислорода смещается в область высоких анодных потенциалов, где происходит окисление формиат-ионов до пероксиформиат-ионов по уравнению реакции (2).
Пример 1.
В анодное отделение электролизера с катионитовой мембраной, разделяющей анодную и катодную части, заливают 60 мл водного раствора роданистого аммония из расчета 1,0 г/л. Анодом служит диоксидно-свинцовый электрод с геометрической поверхностью 4 см2. В катодное отделение заливают столько же по объему 0,1М раствора серной или соляной кислоты. В качестве материала катода использовали платину (Sгеом.=5 см2) или пирографит с поверхностью 20 см2. После предварительной поляризации анода в исходном растворе плотностью тока 0,01 мА/см2 к анолиту добавляют 3,2 мл 86%-ного водного раствора муравьиной кислоты. Затем плотность тока повышают до 0,05 А/см2 и электролиз ведут в течение 3-х часов. Температура анолита в процессе электросинтеза поддерживается в пределах 10-20°С. При более высоких температурах выход конечного продукта падает из-за его постепенного разложения. Результаты электросинтеза надмуравьиной кислоты в зависимости от исходной концентрации НСООН представлены в табл.1.
Данные электросинтеза надмуравьиной кислоты в растворах муравьиной кислоты в зависимости от плотности тока и концентрации роданида аммония приведены в табл.3 и 4 соответственно.
Концентрирование полученных растворов пероксимуравьиной кислоты проводится выше описанным методом, как и в случае химического получения пероксимуравьиной кислоты.
Идентификацию конечного продукта осуществляли следующими качественными реакциями на перекисную группу:
1. Полученный раствор НСОООН взбалтывают, подкисляя несколькими каплями разбавленной серной кислоты с этиловым эфиром и несколькими каплями раствора бихромата калия; при этом эфирный слой окрашивается в темно-синий цвет от надхромовой кислоты, образовавшейся под влиянием пероксимуравьиной кислоты, растворившейся в эфире и придавшей ему указанную окраску. Хотя соли хромовых кислот являются окислителями, но при действии перекисей они способны окисляться в еще более богатую кислородом надхромовую кислоту Н2Cr2О8 по схеме:
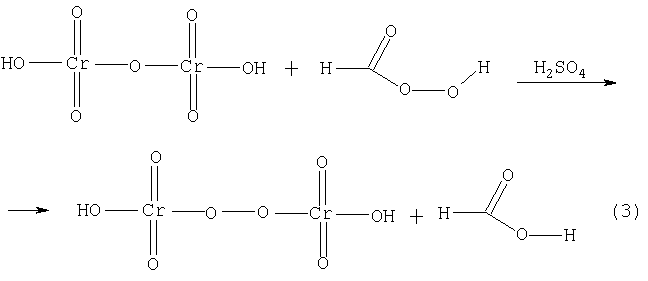
Данная реакция позволяет обнаружить перекисное соединение при концентрации 0,001%.
2. Реакция с йодистым калием в присутствии винной кислоты. К 2 мл 5%-ной винной кислоты добавляют 2 капли 5%-ного раствора FeSO4 и (NH4)2SO4. После смешения с раствором пероксимуравьиной кислоты добавляют 5-6 капель едкого натра; при этом появляется фиолетовое окрашивание. Сульфат железа добавляют для ускорения реакции [4].
При идентификации пероксимуравьиной кислоты также применялся метод ИК - спектроскопии. Для сравнительного исследования были синтезированы соли натрия пероксимуравьиной кислоты химическим и электрохимическим методами. Установлено, что в спектре пероксиформиата натрия полосы поглощения, связанные с -O-O- группой, проявляются в области 1550-1450 см-1 (широкая полоса), и отчетливые полосы в областях 2760 см-1 и 2830 см-1, которые отсутствуют в спектрах формиата натрия. Спектрометрическое определение проводили на спектрометре Infralum - FT-801 в диапазоне волн 500-4000 см-1. Аподизация - треугольная, частота - 8 скан/сек. Образцы для снятия спектров готовились растиранием продуктов электролиза - солей пероксимуравьиной кислоты с бромистым калием и прессованием в микротаблетки в пресс-форме. Химически пероксиформиат натрия получали из пероксимуравьиной кислоты, синтезируемой методом, описанным в [1].
Количественное определение содержания активного кислорода в полученной пероксимуравьиной кислоте определяли методом йодометрического титрования.
Метод йодометрии основан на реакции:
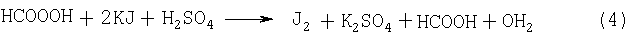
Выделившийся йод оттитровывали 0,1н. раствором тиосульфата натрия. Индикатором служит раствор крахмала, дающий с йодом характерное синее окрашивание. Исследуемые растворы также сравнивали с приготовленными стандартными растворами на сходимость результатов, определяемых вышеописанным методом.
Пример 2.
В анодное отделение электролизера с анионитовой мембраной, разделяющей анодную и катодную части, заливают 60 мл водного раствора роданистого аммония из расчета 1,3 г/л. В качестве анода использовали диоксидно-свинцовый электрод с поверхностью 4 см2. В катодное отделение заливают столько же по объему 0,1М раствора гидроксида натрия или калия. Катодом служит пластина из нержавеющей стали поверхностью 20 см2. После предварительной поляризации анода в растворе роданида аммония в течение 15-20 мин в анолите растворяли 4,08 г формиата натрия для получения 1,0 М раствора. Электролиз ведут при плотности тока 0,05 А/см2 в течение 3-х часов. Температура анолита в процессе электросинтеза поддерживается в пределах 10-20°С. Установлено, что повышение температуры на электролизере отрицательно влияет на выход конечного продукта.
Как видно из табл.1 и 2, в растворах муравьиной кислоты и формиатов щелочных металлов с повышением концентрации исходного электролита более 2,0 М выход по току уменьшается.
Пример 3.
Проводится аналогично примеру 2. Электролизу подвергались растворы солей муравьиной кислоты при различных значениях плотности тока. Результаты электролиза представлены в табл.3, по которым видно, что максимальные выходы по веществу и по току получаются при плотностях анодного тока 0,05-0,5 А/см2.
Пример 4.
Проводится аналогично примеру 2. Электролизу подвергаются растворы НСООН и ее солей при различных концентрациях роданида аммония. Без добавки CSN--ионов выход пероксимуравьиной кислоты и ее солей незначителен (табл.1 и 2). Из результатов опытов, представленных в табл.4, видно, что максимальные выходы по веществу и по току надмуравьиной кислоты с концентрациями добавки роданида аммония лежат в пределах 1,0-1,5 г/л, а для солей надмуравьиной кислоты - 0,5-2 г/л. При концентрациях NH4SCN>2 г/л выход по току падает и конечный продукт загрязняется роданидсодержащими соединениями.
Синтезируемые в водных растворах пероксимуравьиная кислота и ее соли по физическим и химическим свойствам идентичны соответствующим соединениям, получаемым известными химическими методами.
Приведенный метод электросинтеза пероксимуравьиной кислоты и ее солей перед традиционными химическими методами синтеза пероксимуравьиной кислоты имеет ряд преимуществ:
- исключает использование сильных окислителей (пероксид водорода, перманганат калия, надсерная кислота и т.д.);
- обладает селективностью для данного процесса синтеза и может регулироваться поддержанием тока или потенциала;
- осуществить процесс непрерывно;
- получение конечного продукта высокой чистоты, с которым и связано замедление его распада при комнатной температуре;
исключает взрывоопасность процесса синтеза; возможность автоматического контроля процесса синтеза.
Таблица 1
С, моль/л
С, г/л
Таблица 2
С, моль/л
С, г/л
Таблица 3
Таблица 4
С, г/л
Библиографические данные
1. Антоновский В.Л. Органические перекисные инициаторы. М., 1972, 341-361; Swern D., в кн. Organic peroxides, v.1, N.Y.-[a,o], 1970, p.313-474.
2. Патент РФ № 2216537, от 28.06.2002, бюл. № 32, 20.11.2003.
3. Смолин А.В., Подловченко Б.И., Максимов Ю.М. Электроокисление муравьиной кислоты в сернокислом электролите на электролитических осадках палладия. //Электрохимия. 1997. Т.33. № 4, с.477-484.
4. Перекись водорода и перекисные соединения. Под ред. проф. М.Е.Позина. ГНТИ ХЛ, М., 1951, с.482.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИУКСУСНОЙ КИСЛОТЫ | 2002 |
|
RU2216537C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАНСУЛЬФОКИСЛОТЫ | 2007 |
|
RU2344126C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛОВОГО ЭФИРА П-АМИНОБЕНЗОЙНОЙ КИСЛОТЫ (АНЕСТЕЗИН) | 2006 |
|
RU2302405C1 |
| ДИМЕТИЛДИСУЛЬФОПЕРОКСИД (ПЕРОКСИД ДИМЕЗИЛАТА) И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2018 |
|
RU2694545C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСОСОЕДИНЕНИЙ | 1997 |
|
RU2121526C1 |
| ПЕРОКСОМОНОКАРБОНОВАЯ КИСЛОТА В КАЧЕСТВЕ ОТБЕЛИВАЮЩЕГО И ДЕЗИНФИЦИРУЮЩЕГО СРЕДСТВА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1988 |
|
SU1589697A1 |
| Пероксомонокремниевая кислота и способ ее получения | 1989 |
|
SU1682305A1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАНСУЛЬФОКИСЛОТЫ | 2009 |
|
RU2412164C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАНСУЛЬФОКИСЛОТЫ | 2014 |
|
RU2554880C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСОМОНОКРЕМНИЕВОЙ КИСЛОТЫ | 1999 |
|
RU2154126C1 |
Настоящее изобретение относится к способу получения пероксимуравьиной кислоты и ее солей. Сущность предложенного способа заключается в том, что проводят электролиз 0,5-2,0 М водного раствора муравьиной кислоты или ее солей щелочных металлов в диафрагменном электролизере на диоксидно-свинцовом аноде при плотностях тока 0,05-0,5 А/см2 в присутствии роданида аммония при его концентрации 1,0-1,5 г/л. Технический результат - исключение использования сильных взрывоопасных окислителей, высокая селективность процесса синтеза, возможность непрерывного осуществления процесса и получение конечного продукта высокой чистоты. 4 табл.
Способ получения пероксимуравьиной кислоты и ее солей, отличающийся тем, что проводят электролиз 0,5-2,0 М водного раствора муравьиной кислоты или ее солей щелочных металлов в диафрагменном электролизере на диоксидно-свинцовом аноде при плотностях тока 0,05-0,5 А/см2 в присутствии роданида аммония при его концентрации 1,0-1,5 г/л.
| Шихта для изготовления огнеупоров | 1980 |
|
SU1127874A1 |
| ПЕРОКСОМОНОКАРБОНОВАЯ КИСЛОТА В КАЧЕСТВЕ ОТБЕЛИВАЮЩЕГО И ДЕЗИНФИЦИРУЮЩЕГО СРЕДСТВА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1988 |
|
SU1589697A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИУКСУСНОЙ КИСЛОТЫ | 2002 |
|
RU2216537C1 |
| Способ получения пероксиугольной кислоты | 1990 |
|
SU1815262A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
Авторы
Даты
2007-05-27—Публикация
2005-04-04—Подача