Областью настоящего изобретения является эффективный способ получения безводных галогенидов металлов, включая, например, хлорид марганца. Способ включает реакцию металлического порошка с галогенидом водорода в безводных условиях.
Уровень техники
Известные способы получения металлогалогенидных соединений обычно включают или синтез в водной среде, который часто дает продукт в виде гидрата, или, если галогеном является хлор, хлорирование чистого металла при 700-1000°С газообразным хлором. В случае синтеза MnCl2 исходным материалом, который реагирует с HCl (водный) обычно является чистый металлический марганец, оксид, гидроксид или карбонат. Если дальнейшее использование галогенида металла включает применение чувствительного к влаге восстанавливающего агента, такого как щелочной или щелочноземельный металл или их соответствующие алкилпроизводные, то исходный металлогалогенидный материал должен быть полностью свободным от воды. Это означает, что галогенид металла должен быть отделен и от водного растворителя, и от любой гидратной воды. В случае MnCl2 продукт отфильтровывают из водной среды, получая твердый тетрагидрат MnCl2·4H2O. Далее данный тетрагидрат сначала сушат в роторной сушилке ниже его температуры плавления 58°С для удаления растворителя, затем температуру поднимают до температуры выше 200°С для дегидратации твердого вещества до безводного MnCl2. Такой нагрев является энергоемкой стадией, которая значительно увеличивает затраты и снижает экономическую эффективность образования хлорида марганца и других галогенидов металлов.
Сущность изобретения
Данный способ может быть использован для синтеза безводных галогенидов металлов. Если целевой галогенид металла должен использоваться как исходный материал в последующем синтезе других более полезных соединений металла, то данный способ облегчает получение in situ галогенида металла, то есть исключает энергоемкую стадию дегидратации для удаления воды растворителя и гидратной воды. Безводные галогениды металлов являются полезными исходными материалами для синтеза соединений металлов низкой валентности, используемых и в гомогенном, и в гетерогенном катализе, и других пригодных форм низкой валентности для промышленного применения.
В одном примере способ получения хлорида марганца включает стадию взаимодействия порошка металлического марганца с хлористым водородом в безводных условиях реакции.
В другом примере способ получения безводного хлорида марганца включает стадии получения порошка металлического марганца, получения хлористого водорода и взаимодействия порошка металлического марганца с хлористым водородом в безводных условиях реакции.
Подробное описание изобретения
Одним примером безводного галогенида металла, полученного данным способом, является безводный хлорид марганца (II), полученный с высоким выходом в инертной атмосфере в растворителе диметилкарбитоле (ДМК) путем нагрева и интенсивного перемешивания порошка марганца с хлористым водородом, растворенным в ДМК. Реакция описывается уравнением [1].
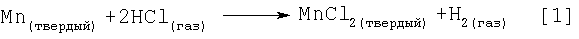
Существует по меньшей мере несколько способов приготовления такого безводного хлорида марганца. Так, получение данного продукта может быть осуществлено в интервале различных условий реакции.
Одним варьируемым условием реакции является давление, при котором протекает реакция. Реакцию можно проводить под атмосферным давлением, но предпочтительна реакция при более высоких давлениях из-за получаемых более высоких скоростей реакции. Было установлено, что наилучшим условием реакции является давление 689 КПа (100 psig). В одном примере интервал давлений реакции был между примерно 0 и примерно 1378 КПа.
Другим варьируемым условием реакции является температура реакции. Предпочтительной температурой реакции является температура около 100°С. В другом примере температура реакции находится между примерно 50°С и примерно 200°С.
Следующим варьируемым условием реакции является размер порошка марганца или другого металла в реакции. Чем меньше размер частиц, тем выше скорость реакции. Соответственно скорость реакции обратно пропорциональна размеру частиц марганца или другого металла. В одном примере порошок может иметь размер в интервале от примерно 50 до примерно 400 меш.
Хлористый водород (или другой галогенид водорода) по настоящей реакции может быть растворен в растворителе - простом эфире. Важным является то, что растворитель не содержит воду. Одним типом эфирного растворителя, который может быть использован, является диметилкарбитол (ДМК). Другие типы растворителей включают простые эфиры, такие как диметиловый эфир (ДМЭ), бутиловый эфир, амиловый эфир, ди-н-бутиловый эфир; глимовые полиэфиры, такие как метиловый эфир диэтиленгликоля (МЭДЭГ), диметиловый эфир триэтиленгликоля (триглим), диметиловый эфир диэтиленгликоля (диглим), 1,2-диметоксиэтан (глим), цетанер (смесь 96% глима и 4% диметоксиметана), моно-трет-бутиловый эфир этиленгликоля, моно-н-бутиловый эфир этиленгликоля; карбонаты, такие как диметилкарбонат и диэтилкарбонат; диацетаты, такие как ацетат этиленгликоля; ацетали, такие как диметоксиметан (ДММ или метилаля), 2-этилгексилацетат; сложные эфиры растительных и животных масел, такие как метилсойат.
Порошок марганца может быть введен в раствор ДМК, насыщенный HCl (2-33 мас.%) при интенсивном перемешивании. Кроме того, HCl можно вводить через барботер в реактор, содержащий взвесь Mn в насыщенном HCl растворе ДМК. Лепешка полученного MnCl2 включает MnCl2 (10-50 мас.%) и ДМК (0-60 мас.%) и может быть высушена при 150°С в вакуумном роторном испарителе.
Как показано в уравнении 2, описанный здесь способ может быть использован для синтеза других безводных галогенидов металлов. Если целевые галогениды металлов используются как исходные материалы в последующем синтезе других более полезных соединений металла, то данный способ облегчает получение in situ галогенидов металлов, то есть исключает энергоемкую стадию дегидратации, необходимую для удаления воды растворителя и гидратной воды.
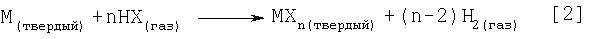
где:
М= переходный металл (Mn, Fe, Pt, Pd, Rh, Ru, Ti, Zr, Hf, Co, Ni, Cu и т.п.)
или щелочноземельный металл (Mg, Са, Sr и т.п.),
или металлоид (В, Al, Ga, Sn, Pb и т.п.),
или лантанид (La, Се, Yb, Lu, и т.п.),
или актинид (U, Pu, и т.п.)
Х= галоген
N= количество молей НХ, необходимое для поглощения всего М.
Пример 1
Способ атмосферного давления: безводный хлорид марганца (II) готовили следующим образом.
Порошок марганца (50 г, 325 меш) помещали в 2000 мл круглодонную трехгорлую колбу, снабженную обратным конденсатором, несущим байпас сухого газообразного азота и капельную воронку. Капельная воронка была заполнена 1000 г растворителя диметилкарбитола (ДМК), насыщенного HCl (около 31% HCl при комнатной температуре). Реакцию начинали добавлением раствора HCl/ДМК по каплям (˜18 мл/мин). После добавления примерно 200 мл раствора к порошку марганца реактор нагревали до 100°С. Если нагревание не проводили, то температура реакции выходила на плато при примерно 50°С благодаря экзотермичности реакции, температуре, при которой скорость реакции очень низкая. Реакционную массу интенсивно перемешивали, в то время как дополнительный HCl вводили через барботер для того, чтобы увеличить скорость реакции. HCl, покидающую реакционную массу при нагревании и перемешивании, улавливали в скруббере с ДМК для извлечения HCl. Насыщенный HCl ДМК из скруббера может быть затем возвращен в цикл на следующую загрузку. Реакция завершалась после примерно 8 часов, и полученный розовый твердый продукт в растворе HCl/ДМК центрифугировали (используя центрифугу с бронзовой корзиной). Розовую твердую лепешку промывали в центрифуге, разбрызгивая свежий ДМК растворитель для удаления остаточного HCl. Влажную лепешку затем сушили в роторном испарителе при 150°С под вакуумом для удаления всего растворителя. Химический анализ сухого твердого вещества показал количественный выход хлорида марганца (II).
Пример 2
Стехиометрическая реакция (добавление порошка Mn к "горячему" раствору HCl/ДМК):
В аппарате, подобном использованному в примере 1, навеску марганца (30 г, 325 меш) добавляли очень медленно (чтобы предотвратить возможное разбрызгивание или бурную реакцию) к 600 мл "горячего" (110°С) раствора HCl/ДМК, первоначально загруженного при температуре окружающей среды стехиометрическим количеством HCl (около 40 г). При нагревании раствора часть HCl улетучивается и улавливается в ДМК скруббере. Далее HCl улетучивается и улавливается подобным образом, когда к предварительно нагретому раствору HCl/ДМК добавляют марганец. Реакционную смесь интенсивно перемешивали (используя мешалку Talboy Stirrer, модель 267-344). После 4 часов реакции весь HCl был израсходован, но часть марганца еще оставалась непрореагировавшей. 100 мл маточника декантировали в другую колбу и 18 г HCl барботировали в него перед тем, как вернуть его в реакционную смесь. Реакцию продолжали еще 3 часа для того, чтобы провести ее полностью. Химический анализ показал отсутствие непрореагировавшего металлического марганца и менее 0,4% HCl, остающегося в маточнике. Оставшаяся кислота может быть удалена из реакции дополнительным добавлением порошка марганца или просто выпарена. Выбор первого варианта приводит к нескольким часам дополнительного времени реакции до полного израсходования оставшегося HCl. Для хорошего выхода хлорида марганца важно не допускать воздух и влагу в систему реактора.
Пример 3
Способ высокого давления: Безводный хлорид марганца (II) получали, используя систему высокого давления (˜689 КПа) для того, чтобы уменьшить время реакции. Порошок марганца (26 г, 325 меш) суспендировали в 50 мл ДМК. Суспензию переводили в 1000 мл автоклав из хастеллоя-С. Автоклав был снабжен магнитной мешалкой с двойным пропеллером, обогревающей рубашкой, регулятором температуры, охлаждающим змеевиком, линией сдувки и разрывной мембраной безопасности. Раствор HCl/ДМК (500 г, 400% избыток HCl) также переводили в автоклав через трубку для отбора проб из хастеллоя-С. Реактор закрывали и нагревали до 100°С, в то время как давление поддерживали ниже 689 КПа (100 psig) удалением газов из реактора. Спустя 1,5 часа реактор охлаждали до комнатной температуры и суспензию хлорида марганца (II) центрифугировали и сушили, как описано в вышеприведенном способе. Химический анализ образца показал результаты, подобные предшествующим способам, описанным в примерах 1-3 выше.
Было найдено, что способ высокого давления был наиболее эффективным благодаря тому, что он завершался за наиболее короткое время (1,5 часа вместо 8 и более часов при окружающем давлении). Для более высокой чистоты продукта реакцию следует проводить в атмосфере инертного газа, такого как азот, и с не содержащим воду растворителем. Когда реакцию проводили при атмосферном давлении, как описано в двух из вышеприведенных примеров, было найдено, что, если добавочную HCl барботируют через насыщенный HCl ДМК во время протекания реакции с металлическим марганцем, то эффективность реакции улучшается. Эффективность реакции также выше, если раствор HCl/ДМК предварительно подогрет, как в примере 2, благодаря тому что при более высоких температурах агломерация реагирующего марганца минимизирована, что предоставляет для реакции большую площадь поверхности металла. Для улучшения кинетики реакции температуру реакции можно поддерживать около 100°С.
Ключевыми параметрами, влияющими на эффективность реакции, являются размер частиц металлического марганца и относительно более высокое, чем атмосферное давление над реакционной смесью. Таблица 1 показывает изменение скорости реакции в зависимости от давления реакции.
Влияние размера частиц металлического марганца на эффективность реакции
Таблица 2 показывает состав и чистоту лепешки MnCl2, изготовленной описанными здесь способами. Количественные результаты в таблице 2 подчеркивают безводную природу полученного продукта. В конечных продуктах описанных здесь процессов действительно не присутствует вода. Для целей определения здесь, однако, термин "безводный" должен обозначать отсутствие и свободной воды в продуктовой смеси, и воды гидратации, связанной с кристаллической решеткой продуктового соединения, с учетом реальностей промышленного процесса, где по меньшей мере некоторые небольшие количества воды могут быть обнаружены в продуктах реакции.
Данные химического анализа MnCl2
Должно быть понятно, что реагенты и компоненты, обозначенные химическими наименованиями в любом месте описания или формулы изобретения, будь они указаны в единственном или во множественном числе, идентифицируются так, какими они существовали до вступления в контакт с другими веществами, обозначаемыми химическим наименованием или химическим типом (например, растворитель, и т.п.). Не имеет значения, какие химические изменения, трансформации и/или реакции, если происходят, имеют место в образующихся смеси, растворе или реакционной среде, поскольку такие изменения, трансформации и/или реакции являются естественным результатом объединения вместе конкретных реагентов и/или компонентов в условиях, призванных осуществить данное изобретение. Таким образом, реагенты и компоненты идентифицируются как ингредиенты, которые должны быть сведены вместе или при осуществлении желаемой химической реакции (такой как образование галогенида металла), или при образовании желаемой композиции (такой как промежуточный или исходный материал). Соответственно даже если в формуле изобретения здесь далее вещества, компоненты и/или ингредиенты могут указываться в настоящем времени ("включает", "представляет собой" и т.п.), указание относится к веществу, компоненту или ингредиенту в том виде, в каком оно существовало во время непосредственно до того, как было впервые смешано или перемешано с одним или несколькими из других веществ, компонентов и/или ингредиентов в соответствии с настоящим изобретением. Тот факт, что вещество, компонент или ингредиент может потерять свою первоначальную идентичность путем химической реакции или трансформации во время протекания таких операций смешения или перемешивания или немедленно после них, является, таким образом, совершенно несущественным для точного понимания и восприятия данного описания и формулы изобретения.
Данное изобретение допускает значительные вариации при его осуществлении. Поэтому предшествующее описание не предназначено для ограничения и не должно рассматриваться как ограничивающее изобретение до представленных здесь выше частных примеров. Скорее то, что предполагается защитить, представлено в последующей формуле изобретения и в ее эквивалентах, которые допускает закон.
Заявитель не намерен предоставлять публично любые защищенные осуществления, и вплоть до того, что некоторые раскрытые модификации или изменения могут не буквально попадать в объем формулы изобретения, они должны рассматриваться как часть изобретения под доктриной эквивалентов.
Изобретение может быть использовано в синтезе безводного хлорида марганца. Способ получения безводного хлорида марганца включает реакцию порошка металла с хлористым водородом в безводных условиях. По меньшей мере часть хлористого водорода может быть растворена в растворителе, который выбирают из группы, состоящей из простых эфиров, диметилового эфира (ДМЭ), бутилового эфира, амилового эфира, ди-н-бутилового эфира, глимовых полиэфиров, метилового эфира диэтиленгликоля (МЭДЭГ), диметилового эфира триэтиленгликоля (триглима), диметилового эфира диэтиленгликоля (диглима), 1,2-диметоксиэтана (глима), цетанера (смеси 96% глима и 4% диметоксиметана), моно-трет-бутилового эфира этиленгликоля, моно-н-бутилового эфира этиленгликоля, карбонатов, диметилкарбоната, диэтилкарбоната, диацетатов, ацетата этиленгликоля, ацеталей, диметоксиметана (ДММ или метилаля), 2-этилгексилацетата, сложных эфиров растительных масел, сложных эфиров животных жиров, метилсойата. Изобретение позволяет исключить энергоемкую стадию удаления гидратной воды при получении безводного хлорида марганца. 3 н. и 5 з.п. ф-лы, 2 табл.
| US 3453187 А, 01.07.1969 | |||
| ЛИДИН Р.А | |||
| и др | |||
| Химические свойства неорганических веществ | |||
| - М.: Химия, 1997, с.395 | |||
| 0 |
|
SU233647A1 | |
| Способ получения хлористого марганца | 1975 |
|
SU539840A1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЗВОДНОГО ХЛОРИСТОГО МАРГАНЦА | 1999 |
|
RU2183194C2 |
| КНУНЯНЦ И.Л | |||
| и др | |||
| Химическая энциклопедия | |||
| - М.: Советская энциклопедия, 1990, т.2, с.647, столбец 1286. | |||
Авторы
Даты
2007-07-20—Публикация
2005-03-10—Подача