Данное изобретение относится к новым пиридинсульфонамидам, способу их получения, фармацевтическим композициям, содержащим такие производные, и их применению в качестве терапевтически активного вещества при лечении заболеваний.
Новые производные пиридинсульфонамида согласно изобретению имеют общую формулу (I)
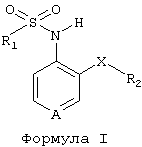
где А представляет собой азот или группу -N=O;
Х является кислородом, серой или заместителем, выбранным из группы, состоящей из -NR3, -CR3R4, -SO, -SO2 или СО; где каждый из R3 и R4, которые могут быть одинаковыми или различными, независимо означает один заместитель, выбранный из группы, состоящей из водорода, моно- или полигалогенированного C1-12-алкила, моно- или полигалогенированного С3-8-циклоалкила, C1-12-алкила или С3-8-циклоалкила;
R1 представляет собой моно- или полигалогенированную C1-12-алкильную или моно- или полигалогенированную С3-8-циклоалкильную группу;
R2 означает С3-8-циклоалкильную группу или арильную группу, замещенную или не замещенную одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-12-алкила, С3-8-циклоалкила, R1, гидроксильной группы, C1-6-алкокси, С1-6-алкокси-С1-6-алкила, нитро-, амино-, цианогруппы, цианометила, пергалогенметила, C1-6-моноалкил- или диалкиламиногруппы, сульфамоила, C1-6-алкилтио, C1-6-алкилсульфонила, формила, C1-6-алкилкарбониламиногруппы, R5-арилтио, R5-арилсульфинила, R5-арилсульфонила, C1-6-алкоксикарбонила, С1-6-алкоксикарбонил-С1-6-алкила, карбамила, карбамилметила, C1-6-моноалкил- или диалкиламинокарбонила, С1-6-моноалкил- или диалкиламинотиокарбонила, уреидо, C1-6-моноалкил- или диалкиламинокарбониламиногруппы, тиоуреидо, C1-6-моноалкил- или диалкиламинотиокарбониламиногруппы, C1-6-моноалкил- или диалкиламиносульфонила, карбоксильной группы, карбокси-С1-6-алкила, ацила, R5-арила, R5-арилалкила, R5-арилоксигруппы,
где R5 означает один или несколько заместителей, выбранных из группы, состоящей из водорода, С1-6-алкила, галогена, гидроксильной группы или C1-6-алкокси.
"C1-6-алкил" отдельно или в сочетании относится к прямой или разветвленной насыщенной углеводородной цепи, содержащей от 1 до 6 атомов углерода, такой как метил, пропил, бутил, изопентил, гексил, 1-метилбутил, 1,2-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил и т.п.
"C1-12-алкил" отдельно или в сочетании относится к прямой или разветвленной насыщенной углеводородной цепи, содержащей от 1 до 12 атомов углерода.
"С3-8-циклоалкил" представляет собой радикал насыщенной циклической углеводородной цепи, содержащей от 3 до 8 атомов углерода, такой как циклопропил, циклобутил, циклопентил, циклогексил и т.п.
"C1-6-алкокси" отдельно или в сочетании относится к прямому или разветвленному одновалентному заместителю, состоящему из C1-6-алкильной группы, присоединенной через эфирный кислород, имеющему свободную валентную связь от эфирного кислорода и содержащему от 1 до 6 атомов углерода, как, например, метокси, этокси, пропокси, изопропокси, бутокси, пентокси, третбутокси и т.п.
"С1-6-алкокси-С1-6-алкил" относится к группе из 2-12 атомов углерода, прерываемых атомом кислорода, такой как -СН2-О-СН3, -СН2СН2-О-СН3, -СН2-О-СН2СН3, -СН2-O-СН(СН3)2, -СН2СН2-O-СН(СН3)2, -СН(СН3)2СН2-O-СН3 и т.п.
"Галоген" означает фтор, хлор, бром или йод.
"Пергалогенметил" означает трифторметил, трихлорметил, трибромметил или трийодметил.
"C1-6-моноалкиламино" относится к аминогруппе, в которой один из атомов водорода замещен прямой или разветвленной насыщенной углеводородной цепью, содержащей от 1 до 6 атомов углерода, такой как метиламино, этиламино, пропиламино, изопропиламино, бутиламино, третбутиламино, изопентиламино, гексиламино и т.п.
"C1-6-диалкиламино" относится к аминогруппе, в которой два атома водорода замещены прямой или разветвленной насыщенной углеводородной цепью, содержащей от 1 до 6 атомов углерода, такой как диметиламино, N-этил-N-метиламино, N-метил-N-изопропиламино, N-бутил-N-метиламино, дигексиламино и т.п.
"C1-6-алкилтио" отдельно или в сочетании означает прямой или разветвленный одновалентный заместитель, состоящий из C1-6-алкильной группы, присоединенной через атом двухвалентной серы, имеющий свободную валентную связь от атома серы и содержащий от 1 до 6 атомов углерода, как, например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, пентилтио, 3-метилпентилтио и т.п.
"C1-6-алкилсульфонил" относится к одновалентному заместителю, состоящему из C1-6-алкильной группы, присоединенной через сульфонильную группу (-S(=O)2-), как, например, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, пентилсульфонил, 2-метилпентилсульфонил и т.п.
"C1-6-алкилсульфинил" относится к одновалентному заместителю, состоящему из C1-6-алкильной группы, присоединенной через сульфинильную группу (-S(=O)-), как, например, метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, третбутилсульфинил, пентилсульфинил, 2-этилбутилсульфинил и т.п.
"Ацил" относится к одновалентному заместителю, состоящему из C1-6-алкильной группы, присоединенной через карбонильную группу, как, например, ацетил, пропионил, бутирил, изобутирил, пивалоил, валерил и т.п.
"C1-6-алкилкарбониламино" означает аминогруппу, в которой один из атомов водорода замещен ацильной группой, как, например, ацетамидо, пропионамидо, изопропилкарбониламино, 2-этилбутилкарбониламино и т.п.
"Арил" в данном контексте означает фенил, 1-нафтил или 2-нафтил.
"Арилтио" отдельно или в сочетании означает арильную группу, присоединенную через атом двухвалентной серы, имеющую свободную валентную связь от атома серы, замещенную или не замещенную одним или несколькими заместителями R5, такую как пентилтио, 1-нафтилтио, 2-метилпентилтио, 3-метоксифенилтио и т.п.
"Арилсульфинил" отдельно или в сочетании относится к арильной группе, присоединенной через сульфинильную группу (-S(=O)-), замещенной или не замещенной одним или несколькими заместителями R5, такой как фенилсульфинил, 2-метилфенилсульфинил, 3-хлор-1-нафтилсульфинил и т.п.
"Арилсульфонил" отдельно или в сочетании относится к арильной группе, присоединенной через сульфонильную группу (-S(=O)2-), замещенной или не замещенной одним или несколькими заместителями R5, такой как фенилсульфонил, 2-метилфенилсульфонил, 4-йодфенилсульфонил, 2-нафтилсульфонил и т.п.
"C1-6-алкоксикарбонил" относится к одновалентному заместителю, состоящему из группы C1-6-алкокси, присоединенной через карбонильную группу, такому как метоксикарбонил, изопропоксикарбонил, бутоксикарбонил, третбутоксикарбонил, 2-метилпентоксикарбонил и т.п.
"C1-6-моноалкиламинокарбонил" относится к одновалентному заместителю, состоящему из C1-6-моноалкиламиногруппы, присоединенной через карбонильную группу, как, например, метиламинокарбонил, изопропиламинокарбонил, бутиламинокарбонил, 2-метилбутиламинокарбонил и т.п.
"C1-6-диалкиламинокарбонил" относится к одновалентному заместителю, состоящему из C1-6-диалкиламиногруппы, присоединенной через карбонильную группу, как, например, диметиламинокарбонил, диэтиламинокарбонил, N-метил-N-изопропиламинокарбонил, N-метил-N-бутиламинокарбонил, N-пропил-N-метилбутиламинокарбонил и т.п.
"C1-6-моноалкиламинотиокарбонил" относится к одновалентному заместителю, состоящему из C1-6-моноалкиламиногруппы, присоединенной через тиокарбонильную группу, как, например, метиламинотиокарбонил, изопропиламинотиокарбонил, бутиламинотиокарбонил, 3-метилпентиламинотиокарбонил, 1,2-диметилбутиламинотиокарбонил и т.п.
"C1-6-диалкиламинотиокарбонил" относится к одновалентному заместителю, состоящему из С1-6-диалкиламиногруппы, присоединенной через тиокарбонильную группу, как, например, диметиламинотиокарбонил, диэтиламинотиокарбонил, N-метил-N-изопропиламинотиокарбонил, N-метил-N-бутиламинотиокарбонил, N-третбутил-N-гексиламинотиокарбонил и т.п.
"C1-6-моноалкиламинокарбониламино" означает аминогруппу, в которой один из атомов водорода замещен C1-6-моноалкиламинокарбонильной группой, как, например, метиламинокарбониламино, этиламинокарбониламино, пропиламинокарбониламино, 3-метилбутиламинокарбониламино, 1,2-диметилбутиламинокарбониламино и т.п.
"C1-6-диалкиламинокарбониламино" означает аминогруппу, в которой один из атомов водорода замещен C1-6-диалкиламинокарбонильной группой, как, например, диметиламинокарбониламино, диэтиламинокарбониламино, N-метил-N-этиламинокарбониламино, N-метил-N-изопропиламинокарбониламино, N-пропил-N-пентиламинокарбониламино и т.п.
"C1-6-моноалкиламинотиокарбониламино" означает аминогруппу, в которой один из атомов водорода замещен С1-6-моноалкиламинотиокарбонильной группой, как, например, метиламинотиокарбониламино, этиламинотиокарбониламино, пропиламинотиокарбониламино, 3-метилпентиламинотиокарбониламино и т.п.
"C1-6-диалкиламинотиокарбониламино" означает аминогруппу, в которой один из атомов водорода замещен C1-6-диалкиламинотиокарбонильной группой, как, например, диметиламинотиокарбониламино, диэтиламинотиокарбониламино, N-метил-N-этиламинотиокарбониламино, N-метил-N-пропиламинотиокарбониламино, N-изопропил-N-гексиламинотиокарбониламино, N-3-метилпентил-N-пентиламинотиокарбониламино и т.п.
"C1-6-моноалкиламиносульфонил" относится к одновалентному заместителю, состоящему из C1-6-моноалкиламиногруппы, присоединенной через сульфонильную группу, как, например, метиламиносульфонил, этиламиносульфонил, пропиламиносульфонил, гексиламиносульфонил, третбутиламиносульфонил, 1,2-диметилбутиламиносульфонил и т.п.
"C1-6-диалкиламиносульфонил" относится к одновалентному заместителю, состоящему из C1-6-диалкиламиногруппы, присоединенной через сульфонильную группу, как, например, диметиламиносульфонил, диэтиламиносульфонил, N-метил-N-этиламиносульфонил, N-метил-N-пропиламиносульфонил, N-гексил-N-3-метилбутиламиносульфонил и т.п.
"Уреидо" в данном контексте означает -NH-CO-NH2.
"Тиоуреидо" в данном контексте означает -NH-CS-NH2.
"Арилалкил" в данном контексте относится к прямой или разветвленной насыщенной углеводородной цепи, содержащей от 1 до 6 атомов углерода, замещенной ароматическим углеводородом. Арильная группа замещена или не замещена одним или несколькими заместителями R5.
"Арилокси" в данном контексте означает фенокси, 1-нафтилокси или 2-нафтилокси, арильная группа замещена или не замещена одним или несколькими заместителями R5.
"R5-арил" в данном контексте относится к арилу, замещенному или не замещенному группой R5.
Изобретение также относится ко всем оптическим изомерам производных пиридинсульфонамида, описанных формулой (I), в частности к оптически активным изомерам и их смесям, включая рацемические смеси. Если производное общей формулы (I) содержит асимметричный атом углерода, изобретение в большей степени будет относиться к чистым оптическим изомерам, чем к рацемической смеси.
Кроме того, изобретение относится к таутомерным формам производных пиридинсульфонамида и к фармакологически приемлемым солям производных, описанных формулой (I).
Под фармакологически приемлемыми солями производных подразумеваются аддитивные соли фармацевтически приемлемых кислот, соли фармацевтически приемлемых металлов или алкилированные соли аммония.
Предпочтительным классом производных пиридинсульфонамида общей формулы I являются соединения, в которых заместитель R1 представляет собой трифторметил.
Наиболее предпочтительным пиридинсульфонамидом является (N-3-фенокси-4-пиридинил)трифторметансульфонамид.
Согласно еще одному аспекту изобретение также относится к способу получения указанных выше производных. Способ включает стадии:
a) превращения производного пиридина, не содержащего заместителей в положении 4, в N-оксид пиридина, и
b) взаимодействия полученного N-оксида пиридина с нитрующим агентом для получения 4-нитрозамещенного производного N-оксида пиридина.
В качестве производного пиридина может быть выбрано любое его производное, не замещенное по положению 4 и способное взаимодействовать с окислителем, таким как Н2О2.
Производным пиридина, не замещенным по положению 4, может быть, например, 3-бромпиридин или 3-метилпиридин, как показано на Фиг.1 и 2.
Превращение производного пиридина в N-оксид пиридина описано, например, в журнале Organic Syntheses, Coll. Vol.IV, p.828, 1963.
Под нитрующим агентом подразумевается смесь, содержащая концентрированную азотную и концентрированную серную кислоты в соотношении от 1:1 до 1:2, смесь следует прибавлять к N-оксиду пиридина в интервале температур от комнатной до 100°С при постоянном перемешивании.
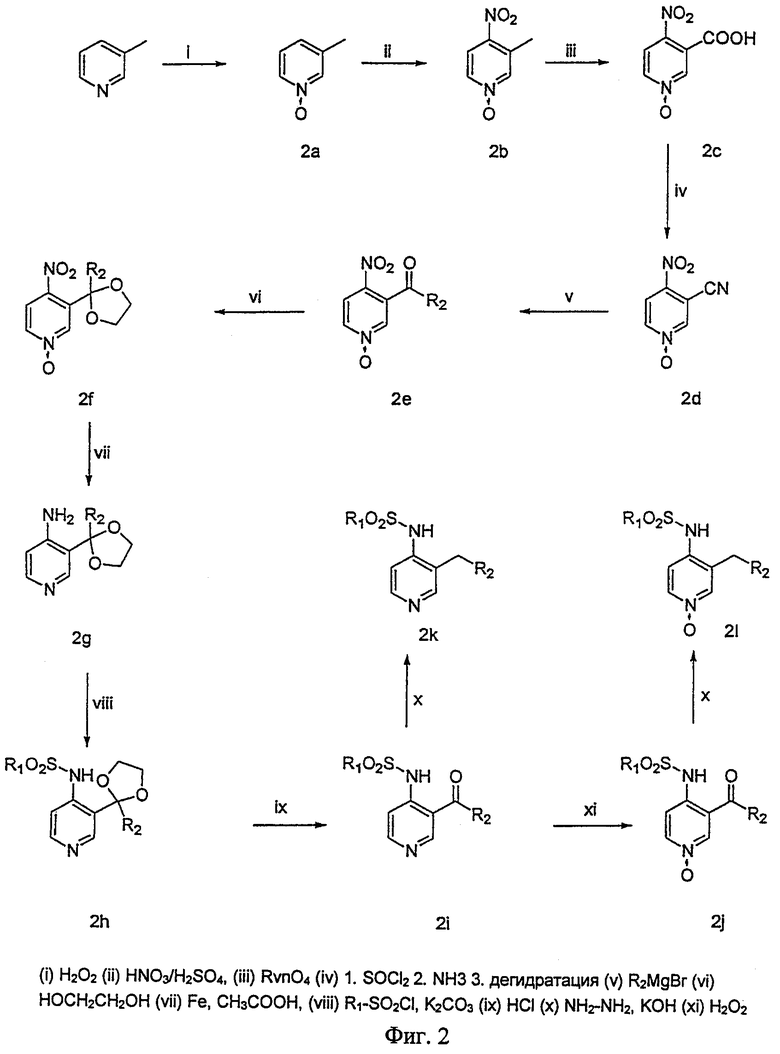
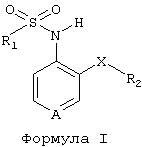
Способ получения производных пиридинсульфонамида проиллюстрирован далее на Фиг.1 и 2.
На Фиг.1 представлена схема синтеза соединений с О-, S-, SO-, SO2-, NR3- и CR3R4-связями, а на Фиг.2 - схема синтеза соединений с СО- и СН2-связями.
Фиг.1
N-оксид пиридина формулы 1а может быть получен окислением 3-бромпиридина различными окислителями, такими как Н2O2. Нитрование N-оксида пиридина в положение 4 с образованием соединения 1b может быть осуществлено с помощью смеси азотной и серной кислот. Производное 1с может быть синтезировано взаимодействием соединения 1b с циклоалканом, таким как циклопентан, циклогексан, циклогептан, или производным бензола в присутствии подходящего неорганического основания, такого как К2СО3 или NaOH, в инертном растворителе, таком как ацетонитрил или дихлорметан. N-оксид нитропиридина превращают в аминопиридин 1d реакцией восстановления, используя такой восстановитель, как железо в присутствии уксусной кислоты. При проведении этой реакции в смесь может быть добавлена вода, а температура может варьироваться от комнатной до температуры кипения растворителя. Синтез сульфонамида 1е завершают взаимодействием аминозамещенного производного пиридина 1d с подходящим сульфонилпроизводным, таким как хлористый сульфонил, фтористый сульфонил, или ангидрид сульфоновой кислотой, в присутствии подходящего неорганического основания, такого как К2СО3 или NaOH, в инертном безводном растворителе, таком как ацетонитрил, диоксан или дихлорметан. При окислении соединения 1е до соединения 1f используют такой окислитель, как Н2О2.
Синтез ряда сульфоксидов и сульфонов 1i и 1j проводят через окисление тиопроизводного 1с таким окислителем, как метахлорнадбензойная кислота, до соединения 1g с последующим восстановлением (1h) и образованием сульфонамида (1i) и, наконец, окислением пиридина до соединения 1j способами, аналогичными использованным для получения производных 1d, 1e и 1f.
Фиг.2
Синтез кетопроизводных проводят по схеме 2. Данная схема начинается со стадии окисления 3-метилпиридина перекисью водорода в присутствии уксусной кислоты (2а). Нитрованием смесью азотной и серной кислот в положение 4 N-оксида получают соединение 2b. Метальную группу соединения 2b окисляют KMnO4 и получают карбоновую кислоту 2с. Синтез цианопроизводного 2d проводят в три стадии. На первой стадии карбоновую кислоту превращают в галогенангидрид карбоновой кислоты действием SOCl2. На второй стадии происходит образование карбоксамида и на последней стадии - дегидратация амида с образованием нитрила 2d. Кетосвязь получают реакцией соединения 2d с магнийорганическим соединением, таким как магнийбромалкил или магнийбромарил. Далее кетогруппу защищают, превращая ее в ацетальную, взаимодействием соединения 2е с этиленгликолем в кислой среде. После этого нитрогруппу и NO-группу соединения 2f восстанавливают железом в присутствии уксусной кислоты и получают соединение 2g. В результате взаимодействия этого соединения с соответствующим хлористым сульфонилом, таким как хлористый алкилсульфонил или хлористый арилсульфонил, получают сульфонамид 2h. Для получения кетосоединения 2i ацеталь может быть гидролизован. Конечной стадией является окисление пиридина 2i действием Н2О2 с образованием соединения 2j. Превращение кетосоединений в соответствующие метиленпроизводные осуществляют по реакции Вольфа-Кижнера, как описано в Organic Reactions, vol.IV, р.378, 1948.
Далее способ получения также проиллюстрирован примерами.
Выполнен элементный анализ (С, Н, N, S), полученные результаты соответствуют теоретической формуле (±0,4%). Данные спектров ИК и 1Н ЯМР соответствуют предполагаемым формулам.
Инфракрасные спектры снимали для 1 мг различных веществ на приборе FT-IR Perkin Elmer 1750 в таблетках KBr весом 250 мг.
Спектры 1Н ЯМР молекул различных веществ снимали на приборе Bruker 400 в растворах ДМСО-d6.
Точки плавления полученных молекул определяли на приборе Büchi-Tottoli.
Пример 1: получение N-(3-фенокси-4-пиридинил)трифторметансульфонамида (соединение I).
Стадия 1: к 1,58 г 3-бромпиридина (10 ммоль), растворенного в 6 мл ледяной уксусной кислоты, прибавляют 4 мл 30% перекиси водорода. Раствор нагревают при кипении в течение 48 часов. Растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией, используя в качестве элюента этилацетат.
Выход: 64% (масло).
ИК (KBr): 3109 (С-Н), 1595 (C=N), 1468 (С=С), 1292 (N-O) см-1.
Стадия 2: к 1,74 г N-оксида 3-бромпиридина, растворенного в 4 мл концентрированной серной кислоты, при постоянном перемешивании прибавляют смесь 4 мл концентрированной серной кислоты и 6,7 мл концентрированной азотной кислоты. Раствор нагревают при 90°С в течение 90 минут. Затем раствор выливают в лед и добавляют 50% водный раствор NaOH до полного осаждения конечного продукта. Осадок желтого цвета отфильтровывают, промывают водой и получают 1,51 г N-оксида 3-бром-4-нитропиридина.
Выход: 69%. Т.пл. 149°С.
ИК (KBr): 3099 (С-Н), 1589 (C=N), 1552, 1338 (NO2), 1295 (N-O), 643 (С-Br) см-1.
Стадия 3: 4,8 мл 10% водного раствора NaOH прибавляют к 1,12 г фенола. После перемешивания в течение 5 минут отгоняют воду при пониженном давлении. Получают кристаллическое вещество белого цвета, которое обрабатывают 10 мл ацетонитрила, и в образовавшуюся суспензию добавляют 2,19 г N-оксида 3-бром-4-нитропиридина. Полученную смесь нагревают при кипении в течение 5 минут. Затем смесь выливают в лед и экстрагируют этилацетатом. Органические слои объединяют и сушат над безводным сульфатом магния. После упаривания растворителя твердый остаток очищают колоночной хроматографией, используя в качестве элюента этилацетат, и получают 1,27 г кристаллического вещества желтого цвета.
Выход: 54%. Т.пл. 109°C.
ИК (KBr): 3109 (С-Н), 1606 (C=N), 1507, 1313 (NO2), 1219 (N-O) см-1.
Стадия 4: раствор 2,32 г N-оксида 4-нитро-3-феноксипиридина в 55 мл уксусной кислоты и 14 мл воды нагревают при кипении. Затем прибавляют 3,48 г железного порошка и нагревают при кипении в течение 12 часов. Раствор фильтруют и упаривают при пониженном давлении. Маслянистый остаток обрабатывают водой и доводят pH до 10 добавлением 10% водного раствора NaOH. Суспензию фильтруют и фильтрат экстрагируют этилацетатом. Органические слои объединяют и сушат над безводным сульфатом магния. После упаривания получают 4-амино-3-феноксипиридин в виде масла желтого цвета.
Выход: 80-90%.
Стадия 5: к раствору 1,81 г 4-амино-3-феноксипиридина в 112 мл сухого ацетонитрила прибавляют 8,29 г безводного карбоната калия. Суспензию перемешивают в течение 5 минут и прибавляют 2,02 мл хлористого трифторметансульфонила. Смесь перемешивают в течение 12 часов, затем фильтруют и растворитель упаривают при пониженном давлении. Остаток обрабатывают 10% водным раствором NaOH, доводят pH раствора до 5 с помощью 1N раствора HCl, и выделяют 2,53 г конечного соединения в виде кристаллического вещества белого цвета.
Выход: 80%. Т.пл. 239°C.
ИК (KBr): 2807, 2728, 2648 (N+-H), 1633 (C=N), 1473 (С=С), 1343, 1129 (SO2) см-1.
1Н ЯМР (ДМСО-d6): δ 6,95 (д, 2Н, Н-2'+Н-6'), 7,11 (т, 1Н, Н-4'), 7,36 (т, 2Н, Н-3'+Н-5'), 7,81 (д, 1Н, Н-5), 8,30 (д, 1Н, Н-6), 8,43 (с, 1Н, Н-2), 13,90 (ушир.с., N-H).
Элементный анализ (C12H9N2O3SF3) С, Н, N, S.
Пример 2: получение N-(3-(4-хлорфенокси)-4-пиридинил)трифторметансульфонамида
Стадии 1 и 2: аналогичны примеру 1.
Стадия 3: 4 мл 10% водного раствора NaOH прибавляют к 1,4 г 4-хлорфенола. После перемешивания в течение 5 минут воду отгоняют при пониженном давлении. Получают кристаллическое вещество белого цвета, которое обрабатывают 10 мл ацетонитрила, в образовавшуюся суспензию добавляют 2 г N-оксида 3-бром-4-нитропиридина и получают смесь, которую затем нагревают при кипении в течение 5 минут. Далее смесь фильтруют и фильтрат концентрируют при пониженном давлении. Полученное кристаллическое вещество растворяют в минимальном количестве метанола и добавлением воды высаживают N-оксид 4-нитро-3-(4-хлорфенокси)пиридина. Осадок отфильтровывают и получают 1,15 г кристаллического вещества желтого цвета.
Выход: 47%. Т.пл. 101-102°С.
ИК (KBr): 3117, 3029 (С-Н), 1610 (C=N), 1213 (N-O), 1100 см-1.
Стадия 4: раствор 0,37 г N-оксида 4-нитро-3-(4-хлорфенокси)пиридина в 9 мл уксусной кислоты и 2 мл воды нагревают при кипении. К полученному горячему раствору прибавляют 0,5 г железного порошка и продолжают кипячение в течение 1 часа. Полученную суспензию фильтруют и фильтрат упаривают при пониженном давлении. Полученный маслянистый остаток обрабатывают водой и доводят pH до 10 добавлением 10% водного раствора NaOH. Образовавшуюся суспензию фильтруют и фильтрат экстрагируют этилацетатом. Органические слои объединяют и сушат над безводным сульфатом магния. После упаривания получают 4-амино-3-(4-хлорфенокси)пиридин в виде масла желтого цвета.
Выход: 80-90%.
Стадия 5: к раствору 0,56 г 4-амино-3-(4-хлорфенокси)пиридина в 20 мл сухого ацетонитрила прибавляют 1 г безводного карбоната калия. Суспензию перемешивают в течение 5 минут и прибавляют 0,794 мл хлористого трифторметансульфонила. Смесь перемешивают в течение 15 минут, затем фильтруют и фильтрат концентрируют при пониженном давлении. Остаток обрабатывают 10% водным раствором NaOH, pH раствора доводят до 7 1N раствором HCl и отделяют 0,61 г конечного продукта в виде кристаллического вещества белого цвета, которое отфильтровывают, промывают водой и сушат.
Выход: 68%. Т.пл. 222-223°С.
ИК (KBr): 2810, 2732, 2648 (N+-H), 1636 (C=N), 1474 (С=С), 1344, 1130 (SO2) см-1.
Пример 3: получение N-(3-(3,5-дихлорфенокси)-4-пиридинил)трифторметансульфонамида
Стадии 1 и 2: аналогичны примеру 1.
Стадия 3: 4,32 мл 10% водного раствора NaOH прибавляют к 1,76 г 3,5-дихлорфенола. После перемешивания в течение 5 минут воду отгоняют при пониженном давлении. Полученное кристаллическое вещество белого цвета обрабатывают 10 мл ацетонитрила и добавляют 2 г N-оксида 3-бром-4-нитропиридина, после чего нагревают при кипении в течение 20 часов. Смесь фильтруют и фильтрат концентрируют при пониженном давлении. Полученное кристаллическое вещество суспендируют в минимальном количестве охлажденного метанола и после фильтрации получают 1,25 г конечного N-оксида 4-нитро-3-(3,5-дихлорфенокси)пиридина в виде кристаллического вещества желтого цвета.
Выход: 47%. Т.пл. 160-161°С.
ИК (KBr): 3051, 3014 (С-Н), 1610 (C=N), 1584, 1309 (NO2), 1227 (N-O) см-1.
Стадия 4: раствор 0,95 г N-оксида 4-нитро-3-(3,5-дихлорфенокси)пиридина в 18 мл уксусной кислоты и 5 мл воды нагревают при кипении. К горячему раствору прибавляют 1,12 г железного порошка и смесь нагревают при кипении в течение 12 часов. Раствор фильтруют и фильтрат упаривают при пониженном давлении. Полученный маслянистый остаток обрабатывают водой и доводят pH до 10 добавлением 10% водного раствора NaOH. Образовавшуюся суспензию фильтруют и фильтрат экстрагируют этилацетатом. Органические слои объединяют и сушат над безводным сульфатом магния. После упаривания получают 4-амино-3-(3,5-дихлорфенокси)пиридин в виде масла желтого цвета.
Выход: 80-90%.
Стадия 5: к раствору 0,45 г 4-амино-3-(3,5-дихлорфенокси)пиридина в 20 мл сухого ацетонитрила прибавляют 0,73 г безводного карбоната калия. Суспензию перемешивают в течение 5 минут и прибавляют 0,551 мл хлористого трифторметансульфонила. Смесь перемешивают в течение 30 минут, затем фильтруют и фильтрат концентрируют при пониженном давлении. Остаток обрабатывают 10% водным раствором NaOH, pH раствора доводят до 7 1N раствором HCl и отделяют 0,33 г конечного продукта в виде кристаллического вещества белого цвета, которое отфильтровывают, промывают водой и сушат.
Выход: 49%. Т.пл. 219-220°С.
ИК (KBr): 2921, 2820, 2653 (N+ -H), 1633 (C=N), 1486 (C=C), 1344, 1126 (SO2) см-1.
Пример 4: получение N-(3-(4-бромфенокси)-4-пиридинил)трифторметансульфонамида
Стадии 1 и 2: аналогичны примеру 1.
Стадия 3: 5,5 мл 10% водного раствора NaOH прибавляют к 1,88 г 4-бромфенола. После перемешивания в течение 5 минут воду отгоняют при пониженном давлении. Получают кристаллическое вещество белого цвета, которое обрабатывают 10 мл ацетонитрила и в полученную суспензию добавляют 2 г N-оксида 3-бром-4-нитропиридина, после чего нагревают при кипении в течение 5 минут. Далее смесь фильтруют и фильтрат концентрируют при пониженном давлении. Полученное кристаллическое вещество растворяют в минимальном количестве метанола и добавлением воды высаживают N-оксид 4-нитро-3-(4-бромфенокси)пиридина. Осадок отфильтровывают, промывают водой, сушат и получают 1,15 г кристаллического вещества желтого цвета.
Выход: 34%. Т.пл. 124-125°С.
ИК (KBr): 3106 (С-Н), 1605 (C=N), 1565, 1312 (NO2), 1212 (N-O) см-1.
Стадия 4: раствор 3 г N-оксида 4-нитро-3-(4-бромфенокси)пиридина в 9 мл уксусной кислоты и 2 мл воды нагревают при кипении. К горячему раствору прибавляют 4,2 г железного порошка и продолжают кипячение в течение 12 часов. Раствор фильтруют и фильтрат упаривают при пониженном давлении. Полученный маслянистый остаток обрабатывают водой и доводят pH до 10 добавлением 10% водного раствора NaOH. Образовавшуюся суспензию фильтруют и фильтрат экстрагируют этилацетатом. Органические слои объединяют и сушат над безводным сульфатом магния. После упаривания получают 4-амино-3-(4-бромфенокси)пиридин в виде масла желтого цвета.
Выход: 80-90%.
Стадия 5: к раствору 0,2 г 4-амино-3-(4-бромфенокси)пиридина в 20 мл сухого ацетонитрила прибавляют 2,25 г безводного карбоната калия. Суспензию перемешивают в течение 5 минут и прибавляют 0,235 мл хлористого трифторметансульфонила. Смесь перемешивают в течение 1 часа, затем фильтруют и фильтрат концентрируют при пониженном давлении. Остаток обрабатывают 10% водным раствором NaOH, pH раствора доводят до 7 1N раствором HCl и отделяют 0,21 г конечного продукта в виде кристаллического вещества белого цвета.
Выход: 70%. Т.пл. 245-246°С.
ИК (KBr): 2809, 2732, 2648 (N+-Н), 1635 (C=N), 1473 (С=С), 1344, 1130 (SO2) см-1.
Пример 5: получение N-(3-(3-хлорфенокси)-4-пиридинил)трифторметансульфонамида
Стадии 1 и 2: аналогичны примеру 1.
Стадия 3: 4 мл 10% водного раствора NaOH прибавляют к 1,4 г 3-хлорфенола. После перемешивания в течение 5 минут воду отгоняют при пониженном давлении. Получают кристаллическое вещество белого цвета, которое обрабатывают 40 мл ацетонитрила, и в полученную суспензию добавляют 2 г N-оксида 3-бром-3-нитропиридина, после чего нагревают при кипении в течение 5 минут. Далее смесь фильтруют и фильтрат концентрируют при пониженном давлении. Полученное кристаллическое вещество растворяют в минимальном количестве охлажденного метанола и после фильтрации получают 1,06 г N-оксида 4-нитро-3-(4-бромфенокси)пиридина в виде кристаллического вещества желтого цвета.
Выход: 42%. Т.пл. 105-106°С.
ИК (KBr): 3056 (С-Н), 1604 (C=N), 1568, 1318 (NO2), 1219 (N-O) см-1.
Стадия 4: раствор 1 г N-оксида 4-нитро-3-(3-хлорфенокси)пиридина в 20 мл уксусной кислоты и 6 мл воды нагревают при кипении. К горячему раствору прибавляют 2,98 г железного порошка и продолжают кипячение в течение 3 часов. Суспензию фильтруют и фильтрат концентрируют при пониженном давлении. Полученный маслянистый остаток обрабатывают водой и доводят pH до 10 добавлением 10% водного раствора NaOH. Образовавшуюся суспензию фильтруют и фильтрат экстрагируют этилацетатом. Органические слои объединяют и сушат над безводным сульфатом магния. После упаривания получают 4-амино-3-(3-хлорфенокси)пиридин в виде масла желтого цвета.
Выход: 90%.
Стадия 5: к раствору 0,2 г 4-амино-3-(3-хлорфенокси)пиридина в 15 мл сухого дихлорметана прибавляют 0,5 мл триэтиламина. Раствор перемешивают в течение 5 минут и прибавляют 0,19 мл хлористого трифторметансульфонила. Смесь перемешивают в течение 12 часов, затем фильтруют и фильтрат концентрируют при пониженном давлении. Остаток обрабатывают 10% водным раствором NaOH, pH раствора доводят до 7 1N раствором HCl и отделяют 0,2 г конечного продукта в виде кристаллического вещества белого цвета, которое отфильтровывают, промывают водой и сушат.
Выход: 73%. Т.пл. 198-199°С.
ИК (KBr): 2896, 2815, 2650 (N+-H), 1632 (C=N), 1473 (С=С), 1343, 1129 (SO2) см-1.
Пример 6: получение N-(3-тиофенокси-4-пиридинил)трифторметансульфонамида
Стадии 1 и 2: аналогичны примеру 1.
Стадия 3: 2 мл тиофенола растворяют в 80 мл толуола. Прибавляют 2,5 г К2СО3 и нагревают суспензию до кипения. Затем прибавляют 4 г N-оксида 3-бром-3-нитропиридина и продолжают кипячение в течение 2 часов. Смесь фильтруют и фильтрат концентрируют при пониженном давлении. Остаток обрабатывают минимальным количеством охлажденного этанола и после фильтрации получают 2,52 г N-оксида 4-нитро-3-тиофеноксипиридина в виде кристаллического вещества желтого цвета.
Выход: 55%. Т.пл. 147-148°С.
ИК (KBr): 3065 (С-Н), 1588 (C=N), 1548, 1329 (NO2), 1230 (N-O) см-1.
Стадия 4: раствор 0,5 г N-оксида 4-нитро-3-тиофеноксипиридина в 20 мл ледяной уксусной кислоты нагревают при кипении. К горячему раствору прибавляют 0,37 г железного порошка и нагревают при кипении в течение 2 часов. Раствор фильтруют и фильтрат концентрируют при пониженном давлении. Полученный маслянистый остаток обрабатывают водой и доводят pH до 10 добавлением 10% водного раствора NaOH. Образовавшуюся суспензию фильтруют и фильтрат экстрагируют этилацетатом. Органические слои объединяют и сушат над безводным сульфатом магния. После упаривания получают 4-амино-3-тиофеноксипиридин в виде масла желтого цвета.
Выход: 90%.
Стадия 5: к раствору 0,45 г 4-амино-3-тиофеноксипиридина в 20 мл сухого дихлорметана прибавляют 1,84 г безводного карбоната калия. Суспензию перемешивают в течение 5 минут и прибавляют 0,47 мл хлористого трифторметансульфонила. Смесь перемешивают в течение 4 часов, затем фильтруют и при пониженном давлении отгоняют ацетонитрил. Остаток обрабатывают 10% водным раствором NaOH, pH раствора доводят до 5 1N раствором HCl и отделяют 0,36 г конечного продукта в виде кристаллического вещества белого цвета, которое отфильтровывают, промывают водой и сушат.
Выход: 50%. Т.пл. 188-189°С.
ИК (KBr): 2807, 2728, 2648 (N+-H), 1633 (C=N), 1473 (С=С), 1343, 1129 (SO2) см-1.
Пример 7: получение N-(3-фениламино-4-пиридинил)трифторметансульфонамида
900 мг 4-амино-3-(фениламино)пиридина (22) (4,86 ммоль) растворяют в 40 мл безводного ацетонитрила в присутствии 4,03 г безводного К2СО3 (29,15 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 617 мкл хлорида трифторметансульфонила (5,83 ммоль). Суспензию перемешивают в течение 1 часа и затем фильтруют. Фильтрат выпаривают в вакууме. Остаток извлекают 10% водным раствором гидрохлорида натрия. После фильтрации фильтрат нейтрализуют 6 N соляной кислотой. Нерастворимый остаток очищают в колонке с двуокисью кремния, используя в качестве элюента смесь хлороформа с метанолом (18:2). После выпаривания элюента получается маслянистое вещество, которое перекристаллизовывают смесью этанола и воды. N-(3-фениламино-4-пиридинил)трифторметансульфонамид осаждается в виде твердого белого вещества, которое извлекают фильтрацией и высушивают в сушильной камере.
Выход продукта: 52%. Т.пл. 188-189°С.
Элементный анализ: C12H10F3N3O2S
1Н ЯМР (ppm): 13,52 (s, 1H, -NHSO2CF3), 8,13 (s, 1H, 2-H), 7,96 (d, 1H, 6-H), 7,61 (d, 1H, 5-H), 7,40 (s, 1H, -NH), 7,35 (t, 2H, 3', 5'-H), 7,30 (d, 2H, 2', 6'-H), 7,05 (t, 1H, 4'-Н).
Пример 8: получение N-(3-(2-хлорофениламино)-4-пиридинил)трифторметансульфонамида
410 мг 4-амино-3-(2-хлорофениламино)пиридина (1,87 ммоль) растворяют в 20 мл безводного ацетонитрила в присутствии 1,55 г безводного К2СО3 (11,20 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 237 мкл хлорида трифторметансульфонила (2,24 ммоль). Суспензию перемешивают в течение 1 часа. По окончании реакции суспензию фильтруют и растворитель выпаривают в вакууме. Образовавшийся остаток очищают в колонке с двуокисью кремния с использованием этилацетата в качестве элюента. Элюент выпаривают в вакууме и полученное маслянистое вещество перекристаллизовывают смесью этанола и воды. N-(3-(2-хлорофениламино)-4-пиридинил)трифторметансульфонамид извлекают фильтрацией в виде твердого вещества белого цвета и высушивают в сушильной камере.
Выход продукта: 48%. Т.пл. 190-191°С.
Элементный анализ (%): C12H9ClF3N3O2S
1Н ЯМР (ppm): 13,64 (s, 1H, -NHSO2CF3), 8,14 (s, 1H, 2-Н), 8,03 (d, 1H, 6-Н), 7,62 (d, 1H, 5-Н), 7,55 (d, 2H, 3', 6'-H), 7,48 (s, 1H, -NH), 7,36 (t, 1H, 5'-Н), 7,11 (t, 1H, 4'-Н).
Пример 9: получение N-[3-(3-хлорфениламино)-4-пиридинил]трифторметансульфонамида
400 мг 4-амино-3-(3-хлорфениламино)пиридина (1,82 ммоль) растворяют в 20 мл сухого ацетонитрила в присутствии 1,51 г безводного К2СО3 (10,92 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 231 мкл хлорида трифторметансульфонила (1,81 ммоль). Суспензию перемешивают в течение 3 часов. По окончании реакции суспензию фильтруют и растворитель выпаривают в вакууме. Образовавшийся остаток очищают в колонке с двуокисью кремния, используя в качестве элюента смесь хлороформа с метанолом (18:2). Элюент выпаривают в вакууме и полученное маслянистое вещество перекристаллизовывают в смеси этилацетата и гексана. N-[3-(3-хлорофениламино)-4-пиридинил]трифторметансульфонамид фильтрацией извлекают в виде твердого вещества белого цвета и высушивают в сушильной камере.
Выход продукта: 65%. Т.пл. 211-213°С.
Элементный анализ (%): C12H9CIF3N3O2S
1Н ЯМР (ppm): 13,55 (s, 1H, -NHSO2CF3), 8,23 (s, 1H, 2-H), 8,01 (d, 1H, 6-H), 6,23 (m, 2H, 5-H и -NH), 7,31 (bm, 2Н, 2', 5'-H), 7,21 (d, 1H, 4'-H), 7,00 (d, 1H, 6'-H).
Пример 10: получение N-[3-(4-хлорфениламино)-4-пиридинил]трифторметансульфонамида
350 мг 4-амино-3-(4-хлорфениламина)пиридина (1,59 ммоль) растворяют в 20 мл безводного ацетонитрила. Добавляют 1,32 г безводного К2СО3 (9,56 ммоль) и перемешивают суспензию в течение 5 минут в стеклянном сосуде. Затем добавляют 202 мкл хлорида трифторметансульфонила (1,91 ммоль). Суспензию перемешивают в течение 4 часов, после чего по окончании реакции суспензию фильтруют и растворитель выпаривают в вакууме. Остаток извлекают 10% водным раствором гидрохлорида натрия. После фильтрации фильтрат нейтрализуют 6 N соляной кислотой. Затем остаток отфильтровывают и перекристаллизовывают смесью этанола и воды. N-[3-(4-хлорофениламино)-4-пиридинил]трифторметансульфонамид извлекают фильтрацией в виде твердого вещества белого цвета и высушивают в сушильной камере.
Выход продукта: 27%. Т.пл. 203-205°С.
Элементный анализ (%): C12H9ClF3N3O2S
1Н ЯМР (ppm): 13,54 (s, 1H, -NHSO2CF3), 8,13 (s, 1H, 2-H), 7,98 (d, 1H, 6-H), 7,62 (d, 1H, 5-H), 7,52 (s, 1H, -NH), 7,35 (d, 2Н, 3', 5'-H), 7,30 (d, 2H, 4', 6'-H).
Пример 11: получение N-[3-(2-метилфениламино)-4-пиридинил]трифторметансульфонамида
520 мг 4-амино-3-(2-метилфениламино)пиридина (2,61 ммоль) растворяют в 30 мл безводного ацетонитрила в присутствии 2,16 г безводного К2СО3 (15,66 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 331 мкл хлорида трифторметансульфонила (3,13 ммоль). После чего суспензию перемешивают в течение 2 часов и затем фильтруют. Фильтрат выпаривают в вакууме. Остаток извлекают 10% водным раствором гидрохлорида натрия. После фильтрации фильтрат нейтрализуют 6 N соляной кислотой. Затем остаток отфильтровывают и перекристаллизовывают смесью этанола и воды. Твердое вещество белого цвета извлекают фильтрацией и высушивают в сушильной камере.
Выход продукта: 48%. Т.пл. 212-213°С.
Элементный анализ (%): C13H12F3N3O2S
1Н ЯМР (ppm): 13,45 (s, 1H, -NHSO2CF3), 7,93 (d, 1H, 6-Н), 7,65 (s, 1H, 2-H), 7,59 (d, 1H, 5-H), 7,32 (m, 2Н, 3', 6'-H), 7,25 (t, 1H, 5'-Н), 7,10 (m, 2Н, 4'-H и -NH), 2,18 (s, 3Н, - СН3).
Пример 12: получение N-[3-(3-метилфениламино)-4-пиридинил]трифторметансульфонамида
525 мг 4-амино-3-(3-метилфениламино)пиридина (2,63 ммоль) растворяют в 30 мл безводного ацетонитрила, к которому добавляют 2,18 г безводного К2СО3 (15,81 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 334 мкл хлорида трифторметансульфонила (3,16 ммоль). Перемешивание продолжают в течение 2 часов, а затем суспензию фильтруют и фильтрат выпаривают в вакууме. Остаток извлекают 10% водным раствора гидрохлорида натрия. После фильтрации фильтрат нейтрализуют 6 N соляной кислотой. Образовавшийся остаток фильтруют и очищают в колонке с двуокисью кремния, используя в качестве элюента смесь хлороформа с метанолом (18:2). После выпаривания элюента в вакууме остаток перекристаллизовывают смесью этанола и воды. N-[3-(3-метилфениламино)-4-пиридинил]трифторметансульфонамид извлекают фильтрацией в виде твердого вещества белого цвета и высушивают в сушильной камере.
Выход продукта: 42%. Т.пл. 167-169°С.
Элементный анализ (%): C13H12F3N3O2S
1Н ЯМР (ppm): 13,50 (s, 1H, -NHSO2CF3), 8,13 (s, 1H, 2-H), 7,96 (d, 1H, 6-H), 7,6 (d, 1H, 5-H), 7,31 (s, 1H, -NH), 7,23 (t, 1H, 5'-H), 7,10 (s, 1H, 2'-H), 7,09 (d, 1H, 4'-H), 6,87 (d, 1H, 6'-H), 2,29 (s, 3H, -СН3).
Пример 13: получение N-[3-(4-метилфениламино)-4-пиридинил]трифторметансульфонамида
545 мг 4-амино-3-(4-метилфениламино)пиридина (2,73 ммоль) растворяют в 30 мл безводного ацетонитрила в присутствии 2,27 г безводного К2СО3 (16,41 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 347 мкл хлорида трифторметансульфонила (3,28 ммоль). Суспензию перемешивают в течение 1 часа. По окончании реакции суспензию фильтруют и фильтрат выпаривают в вакууме. Образовавшийся остаток очищают в колонке с двуокисью кремния, используя в качестве элюента смесь хлороформа с метанолом (18:2). После выпаривания элюента получается маслянистое вещество, которое перекристаллизовывают смесью этанола и воды. N-[3-(4-метилфениламино)-4-пиридинил]трифторметансульфонамид образуется в виде твердого вещества белого цвета, которое извлекают фильтрацией и высушивают в сушильной камере.
Выход продукта: 67%. Т.пл. 158-160°С.
Элементный анализ (%): C13H12F3N3O2S
1Н ЯМР (ppm): 13,49 (bs, 1H, -NHSO2CF3), 8,00 (s, 1H, 2-H), 7,93 (d, 1H, 6-H), 7,59 (d, 1H, 5-H), 7,28 (s, 1H, -NH), 7,19 (m, 4Н, 2', 3', 5', 6'-H), 2,28 (s, 3H, -CH3).
Пример 14: получение N-[3-(2-метоксифениламино)-4-пиридинил]трифторметансульфонамида
540 мг 4-амино-3-(2-метоксифениламино)пиридина (2,51 ммоль) растворяют в 30 мл безводного ацетонитрила в присутствии 2,08 г безводного К2СО3 (15,05 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 318 мкл хлорида трифторметансульфонила (3,01 ммоль). Суспензию перемешивают в течение 2 часов. По окончании реакции суспензию фильтруют и фильтрат выпаривают в вакууме. Остаток извлекают 10% водным раствором гидрохлорида натрия. После фильтрации фильтрат нейтрализуют 6 N соляной кислотой. Затем остаток отфильтровывают и перекристаллизовывают смесью этанола и воды. N-[3-(2-метоксифениламино)-4-пиридинил]трифторметансульфонамид извлекают фильтрацией в виде твердого вещества белого цвета и высушивают в сушильной камере.
Выход продукта: 52%.
1Н ЯМР (ppm): 13,56 (bs, 1H, -NHSO2CF3), 8,12 (s, 1H, 2-H), 7,97 (d, 1H, 6-H), 7,58 (d, 1H, 5-H), 7,43 (d, 1H, 3'-H), 7,38 (s, 1H, -NH), 7,10 (d, 1H, 6'-H), 7,06 (t, 1H, 5'-H), 6,99 (t, 1H, 4'-H), 3,84 (s, 3H, -OCH3).
Пример 15: получение N-[3-(4-метоксифениламино)-4-пиридинил]трифторметансульфонамида
660 мг 4-амино-3-(4-метоксифениламино)пиридина (3,07 ммоль) растворяют в 30 мл безводного ацетонитрила в присутствии 2,54 г безводного К2СО3 (18,41 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 389 мкл хлорида трифторметансульфонила (3,68 ммоль). Суспензию перемешивают в течение 2 часов. По окончании реакции суспензию фильтруют и фильтрат выпаривают в вакууме. Остаток извлекают 10% водным раствором гидрохлорида натрия. После фильтрации фильтрат нейтрализуют раствором соляной кислоты 6 N. Образовавшийся остаток очищают в колонке с двуокисью кремния, используя в качестве элюента смесь хлороформа с метанолом (19:1). Элюент выпаривают в вакууме и полученное маслянистое вещество перекристаллизовывают смесью этанола и воды. N-[3-(4-метоксифениламино)-4-пиридинил]трифторметансульфонамид фильтрацией извлекают в виде твердого белого вещества и высушивают в сушильной камере.
Выход продукта: 42%.
1Н ЯМР (ppm): 13,42 (s, 1H, -NHSO2CF3), 7,89 (d, 1H, 6-H), 7,78 (s, 1H, 2-H), 7,56 (d, 1H, 5-H), 7,24 (d, 2H, 2', 6'-H), 7,19 (s, 1H, NH), 6,95 (d, 2Н, 3', 5'-H), 3,76 (s, 3H, -ОСН3).
Пример 16: получение N-(3-циклопентиламино-4-пиридинил)трифторметансульфонамида
300 мг 4-амино-3-циклопентиламинопиридина (1,69 ммоль) растворяют в 20 мл безводного ацетонитрила в присутствии 1,4 г безводного К2СО3 (10,15 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 215 мкл хлорида трифторметансульфонила (2,03 ммоль). Суспензию перемешивают в течение 2 часов, фильтруют и фильтрат выпаривают в вакууме. Образовавшийся остаток очищают в колонке с двуокисью кремния с использованием этилацетата в качестве элюента. После выпаривания элюента получается маслянистое вещество, которое перекристаллизовывают смесью этилацетата и гексана. N-(3-циклопентиламино-4-пиридинил)трифторметансульфонамид извлекают фильтрацией в виде твердого вещества белого цвета и высушивают в сушильной камере.
Выход продукта: 50%. Т.пл. 133-136°С.
Элементный анализ (%): C11H14F3N3O2S
1Н ЯМР (ppm): 13,53 (s, 1H, -NHSO2CF3), 7,80 (d, 1H, 5-Н), 7,61 (s, 1H, 2-H), 7,44 (d, 1H, 6-H), 5,10 (d, 1H, -NH), 3,78 (m, 1H, 1'-H), 1,41-2,01 (bm, 8H, циклопентил-H).
Пример 17: получение гидрохлорида N-(3-циклогексиламино-4-пиридинил)трифторметансульфонамида
320 мг 4-амино-3-циклогексиламинопиридина (1,67 ммоль) растворяют в 20 мл безводного ацетонитрила в присутствии 1,39 г безводного К2СО3 (10,04 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 212 мкл хлорида трифторметансульфонила (2 ммоль). Суспензию перемешивают в течение 4 часов и по окончании реакции фильтруют. Фильтрат выпаривают в вакууме и извлекают получившееся маслянистое вещество водным раствором гидрохлорида натрия. После фильтрации фильтрат нейтрализуют 6 N соляной кислотой. N-(3-циклогексиламино-4-пиридинил)трифторметансульфонамид получают после фильтрации и растворяют в смеси этилацетата и гексана (50:50). Этот раствор подкисляют, продувая газообразным хлоридом водорода. Твердое белое вещество, представляющее собой N-(3-циклогексиламино-4-пиридинил)трифторметансульфонамид, извлекают фильтрацией в виде гидрохлорида и высушивают в сушильной камере.
Выход продукта: 71%. Т.пл. 217-218°С.
Элементный анализ (%): C12H17ClF3N3O2S
1Н ЯМР (ppm): 13,81 (bs, 1H, -NHSO2CF3), 7,80 (d, 1H, 5-H), 7,70 (s, 1H, 2-H), 7,44 (d, 1H, 6-H), 3,33 (m, 1H, 1'-Н), 1,15-1,95 (m, 10Н, циклогексил-H).
Пример 18: получение N-(3-циклогептиламино-4-пиридинил)трифторметансульфонамида
265 мг 4-амино-3-циклогептиламинопиридина (1,29 ммоль) растворяют в 20 мл безводного ацетонитрила в присутствии 1,07 г безводного К2СО3 (7,74 ммоль). Суспензию перемешивают в течение 5 минут в стеклянном сосуде, затем добавляют 164 мкл хлорида трифторметансульфонила (1,55 ммоль). Полученную суспензию перемешивают в течение 2 часов, фильтруют и фильтрат выпаривают в вакууме. Образовавшийся остаток очищают в колонке с двуокисью кремния, используя в качестве элюента смесь хлороформа с метанолом (18:2). После выпаривания элюента получается маслянистое вещество, которое перекристаллизовывают смесью этилацетата и гексана. N-(3-циклогептиламино-4-пиридинил)трифторметансульфонамид извлекают фильтрацией в виде твердого вещества белого цвета и высушивают в сушильной камере.
Выход продукта: 38%. Т.пл. 134-136°С.
Элементный анализ (%): C13H18F3N3O2S
1Н ЯМР (CDCl3) (ppm): 11,67 (s, 1H, -NHSO2CF3), 7,62 (d, 1Н, 5-H), 7,51 (t, 1H, 6-H), 7,18 (d, 1H, 2-H), 5,20 (bs, 1H, -NH), 3,29 (m, 1H, 1'-H), 1,44-1,92 (bm, 12H, цикслогептил-H).
Пример 19: получение N-[3-(1-нафтиламино)-4-пиридинил]трифторметансульфонамида
200 мг 4-амино-3-(1-нафтиламино)пиридина (0,85 ммоль) растворяют в 20 мл безводного ацетонитрила. Добавляют 705 мг безводного К2СО3 (5,10 ммоль) и перемешивают суспензию в течение 5 минут в стеклянном сосуде. Затем добавляют 108 мкл хлорида трифторметансульфонила (1,02 ммоль). По окончании реакции суспензию фильтруют и фильтрат выпаривают в вакууме. Образовавшийся остаток очищают в колонке с двуокисью кремния, используя в качестве элюента смесь хлороформа с метанолом (18:2). Элюент выпаривают в вакууме и полученное маслянистое вещество перекристаллизовывают смесью этанола и воды. Продукт извлекают фильтрацией в виде твердого вещества белого цвета и высушивают в сушильной камере.
Выход продукта: 13%. Т.пл. 232-234°С.
Элементный анализ (%): C13H18F3N3O2S
1Н ЯМР (ppm): 7,92-7,34 (bm, 11H, пиридин-H, 1-нафтил-H и -NH).
Изобретение также относится к применению производных пиридинсульфонамида общей формулы (I) и их солей для производства лекарственных препаратов для лечения и/или предупреждения таких заболеваний, как воспаление, артроз, злокачественные опухоли, ангиогенезис и астма, а также других патологий, в которых они выступают в роли селективных ингибиторов СОХ-2.
Простагландины (PG) являются ключевыми медиаторами, вовлеченными в воспалительный процесс. Согласно работе Bergström S.; Ryhage R.; Samuelsson В.; Sjövall J., опубликованной в журнале J. Biol. Chem., 1963, 238, р.3555-3563, простагландины синтезируются циклооксигеназами (СОХ) из арахидоновой кислоты.
Различные классы имеющихся в продаже противовоспалительных лекарственных средств тормозят синтез PG путем ингибирования этих ферментов.
Ферменты СОХ существуют в двух различных изоформах. СОХ-1 является конститутивным (нерегулируемым) ферментом, ответственным за физиологическое продуцирование PG. Этот фермент вовлечен в различные гомеостатические процессы и, таким образом, рассматривается как "домашний" фермент.СОХ-2, напротив, является индуцируемым ферментом, который, главным образом, продуцируется при воспалительных процессах. Кроме того, согласно работе Crofford L., Lipsky P., Brooks P., Abramson S., Simon L., van de Putte L., опубликованной в журнале Arthritis Rheum., 2000, 43, р.4-13, СОХ-2 экспрессируется при различных патологических процессах, таких как артроз, ангиогенезис и астма.
Проблема ингибирования СОХ-1 обычными нестероидными противовоспалительными средствами (НПВС) заключается в присущих им побочных эффектах, таких как язва желудка.
В настоящем изобретении используются новые селективные ингибиторы СОХ-2, представленные описанными выше производными пиридинсульфонамида.
Преимуществом таких новых селективных ингибиторов СОХ-2 является отсутствие указанных побочных эффектов.
Описанные выше производные пиридинсульфонамида оценены в качестве ингибиторов СОХ в тестах in vitro и тестах in vivo. Методика анализа in vitro описана X. de Leval, J.Delarge, P.Devel, P.Neven, C.Michaux, b.Masereel, B.Pirotte, J.-L.David, Y.Henrotin, J.-M.Dogné в журнале Prostaglandins, Leucot., Essent. Fatty Acids, 2001, 64, p.211-216.
Фармакологические характеристики N-(3-фенокси-4-пиридинил)трифторметансульфонамида (соединение 1) представлены в Таблице 1, отражающей расчетные значения IC50 для соединения 1, полученные при полном анализе крови.
Фармакологические характеристики ряда производных этого соединения, получение которых описано в приведеных выше дополнительных примерах, представлены в Таблице 2.
Активность производных также оценивали на фармакологической модели отека конечности крысы.
В модели каррагенин-индуцированного отека конечности крысы использовали крыс линии Вистар. Средний вес животных составлял 250 г. Лекарственный препарат соответствующей концентрации (раствор в ДМСО с концентрацией 10 мг/мл) инъецировали животным внутрибрюшинно. Через один час в плантарную (подошвенную) область правой передней конечности инъецировали лямбда-каррагенин (0,1 мл, 1%). Через три часа после этого крыс умерщвляли инъекцией нембутала (100 мг/кг), конечности отсекали по лодыжку. Величину отека вычисляли в процентах как увеличение веса по сравнению с контрольным опытом. В Таблице 3 показано влияние соединения 1 на отек конечности крысы.
Результаты, выраженные в процентах, показывают утолщение конечности после инъекции каррагенина (среднее значение ± стандартное отклонение, n=6).
Из таблиц видно, что соединение 1 активно в качестве ингибитора СОХ-2 и проявляет противовоспалительное действие in vivo.
Изобретение также относится к фармацевтической композиции, содержащей производное пиридинсульфонамида либо его фармацевтически приемлемую соль с фармацевтически приемлемой кислотой или основанием, либо его любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь, либо его любую таугомерную форму и один или более приемлемый носитель или разбавитель.
Фармацевтическая композиция может быть изготовлена в виде единицы дозы для перорального или парентерального применения.
Композиция по изобретению может быть представлена в виде таблеток, драже, капсул или любых других лекарственных форм, пригодных для перорального введения, включающих одно или более соединений по изобретению и носитель или связующее вещество, предпочтительно представляющее собой углеводород.
Предпочтительные примеры носителей для использования в композиции по изобретению включают лактозу, крахмал пшеницы и картофельный крахмал.
Также композицию можно использовать в форме сиропа или эликсира со сладким наполнителем.
Пример фармацевтической композиции, иллюстрирующий изобретение, но не ограничивающий его объем, представляет собой таблетку, приготовленную с помощью обычной техники таблетирования и содержащую:
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ГЕТЕРОЦИКЛИЛМЕТИЛХРОМАНА В ВИДЕ СМЕСИ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫХ ИЗОМЕРОВ ИЛИ ИХ СОЛИ | 1992 |
|
RU2089549C1 |
| ПРОИЗВОДНЫЕ ХИНОКСАЛИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ | 1995 |
|
RU2135484C1 |
| АНАЛОГИ КАМПТОТЕЦИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2190613C2 |
| ПРОИЗВОДНЫЕ ГИДРОХИНОНА В СВОБОДНОМ ВИДЕ ИЛИ В ВИДЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОИЗВОДНЫЕ ПИПЕРИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2095339C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МЕТИЛСУЛЬФОНОВЫЕ ПРОИЗВОДНЫЕ | 2004 |
|
RU2336270C2 |
| ПРОИЗВОДНЫЕ ГЛИЦИНАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2130923C1 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ГЛЮКОЗО-6-ФОСФАТАЗНОЙ СИСТЕМЫ ПЕЧЕНИ МЛЕКОПИТАЮЩИХ | 1993 |
|
RU2131248C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2110515C1 |
| ПРОЛЕКАРСТВА 3-АЦИЛ-2-ОКСИНДОЛ-1-КАРБОКСАМИДОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124514C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 6-АЛКИЛИДЕНПЕНЕМА | 2003 |
|
RU2317297C2 |
Изобретение относится к новым производным пиридинсульфонамида общей формулы (I)
где А представляет собой азот или группу -N=O;
Х является кислородом, серой или -NR3; где R3 означает заместитель, выбранный из группы, состоящей из водорода, С1-12-алкила или С3-8-циклоалкила; R1 представляет собой моно- или полигалогенированную С1-12-алкильную или моно- или полигалогенированную С3-8-циклоалкильную группу; R2 означает С3-8-циклоалкильную группу или арильную группу, замещенную или не замещенную одним или несколькими элементами, выбранными из группы, состоящей из галогена, C1-12-алкила, С3-8-циклоалкила, C1-6-алкокси и C1-6-алкокси-C1-6-алкила; а также их фармацевтически приемлемым солям с фармацевтически приемлемыми кислотами или основаниями, а также фармацевтической композиции на их основе и их применению в качестве терапевтически активного вещества при лечении воспалительных заболеваний. 5 н. и 5 з.п. ф-лы, 3 табл.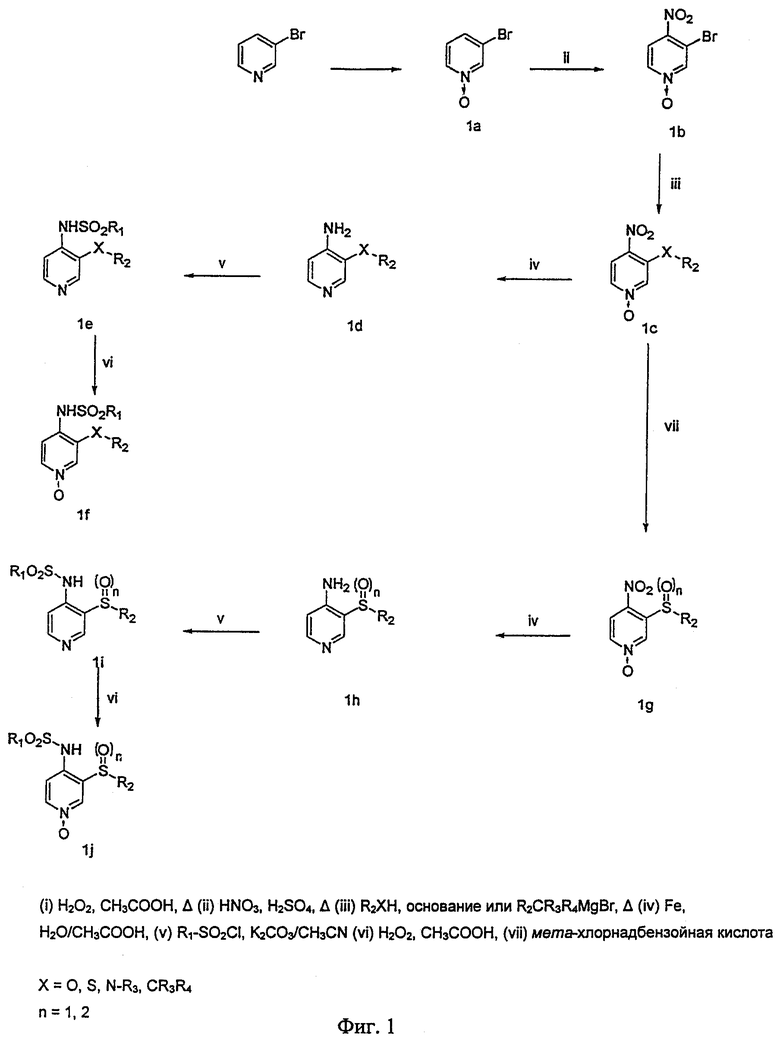
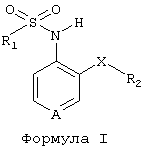
где А представляет собой азот или группу -N=O;
Х является кислородом, серой или -NR3, где R3 означает заместитель, выбранный из группы, состоящей из водорода, С1-12-алкила или С3-8-циклоалкила;
R1 представляет собой моно- или полигалогенированную С1-12-алкильную или моно- или полигалогенированную С3-8-циклоалкильную группу;
R2 означает С3-8-циклоалкильную группу или арильную группу, замещенную или не замещенную одним или несколькими элементами, выбранными из группы, состоящей из галогена, С1-12-алкила, С3-8-циклоалкила, C1-6-алкокси и С1-6-алкокси-С1-6-алкила,
а также их фармацевтически приемлемые соли с фармацевтически приемлемыми кислотами или основаниями.
| ПРОИЗВОДНЫЕ АРИЛ- И ГЕТЕРОАРИЛСУЛЬФОНАМИДОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2163598C2 |
| CIGNARELLA G | |||
| et al | |||
| Syntesis and pharmacological evaluation of nimesulide analogues | |||
| EUROP | |||
| JOURN OF MED | |||
| CHEM | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
Авторы
Даты
2007-10-27—Публикация
2002-09-19—Подача