Изобретение относится к препаративным формам для хранения посевного бактериального материала, питательным средам и способам получения биомасс рекомбинантных штаммов бактерий E.coli, содержащих плазмидные ДНК, кодирующие биосинтез белка TBI, и может быть использовано в биотехнологии и микробиологии.
Белок TBI (T- and B-cell epitopes containing immunogen) нарабатывается в прокариотических клетках Escherichia coli. Процесс биосинтеза белка включает стадию получения посевного материала и ферментацию, которые во многом определяют выход целевого продукта.
Производство вакцин имеет свою специфику, определяемую характером продукции и технологией производства, включающей процесс культивирования клеток. Уровень экспрессии рекомбинантного белка на стадии получения биомассы определяется качеством посевного материала штамма-продуцента, составом питательной среды и условиями культивирования.
Длительное культивирование и/или многократные пересевы рекомбинантных штаммов приводят к возрастанию гетерогенности популяции за счет сегрегационной и структурной нестабильности плазмид, а также изменения кинетических характеристик роста клеток. Изменчивость рекомбинантных штаммов особенно отчетливо проявляется и на стадии биосинтеза целевого продукта. Такого рода популяционная неустойчивость сказывается на уровне экспрессии рекомбинантного гена и, как следствие, конечном выходе целевого белка. Для предотвращения нежелательного изменения свойств культуры производство вакцинных препаратов должно быть основано, следуя надлежащей практике GMP, на системе основного производственного и рабочего банков культур.
Процесс микробиологического синтеза белка TBI играет ключевую роль в регламенте производства рекомбинантных вакцин, в частности вакцины КомбиВИЧвак, разработанной ФГУН ГНЦ ВБ «Вектор». Требования к получаемой биомассе достаточно высоки. От общего количества получаемых клеток и синтезированного белка зависят все дальнейшие стадии выделения и очистки рекомбинантного белка TBI, накапливаемого в тельцах включения, поэтому при отработке условий культивирования необходимо найти оптимальное сочетание параметров, обеспечивающих стабильное и высокопродуктивное получение целевого продукта.
Известны использование посевного материала рекомбинантного штамма бактерий в жидкой форме (наиболее близкий аналог) и способ его получения (Mohammadian-Mosaabadi J., Naderi-Manesh H., Maghsoudi N., Nassiri-Khalili M-A., Masoumian MR., Malek-Sabet N. Improving purification of recombinant human interferon γ expressed in Escherichia coli, effect of removal of impurity on the process yield // Protein Expression and Purification. - V.51, 2007. - P.147-156). При этом для получения посевного материала в производстве рекомбинантных белков используют свежеприготовленные трансформанты. При этом отбор высокопродуктивных моноизолятов проводят непосредственно перед наработкой посевного материала и/или засевом ферментера. Компетентные клетки штамма-реципиента трансформируют плазмидой, несущей ген целевого белка и селективный генетический маркер (обычно ген устойчивости к антибиотику). После проведения трансформации суспензию клеток высевают на питательный агар, содержащий ампициллин в концентрации 200 мкг/мл, и выращивают в течение 18-24 ч при температуре 37°С. В дальнейшем ампициллин добавляют на всех стадиях культивирования. Выросшими колониями засевают 150 мл L-бульона, инкубируют на качалке при скорости вращения платформы 180 об/мин, температуре 37°С в течение 18-24 ч и используют в качестве инокулята.
Однако посевной материал (инокулят) в жидкой форме и способ получения этого посевного материала имеют следующие недостатки. Во-первых, плохую воспроизводимость процесса ферментации: процесс отличается нестабильностью как по урожаю клеток, так и по содержанию целевого белка, которое колеблется в пределах 5-8% от суммы клеточных белков. Основной причиной нестабильности биомассы по продуктивности является сегрегация плазмид, во-вторых, опасность контаминации посевного материала посторонней микрофлорой, что объясняется длительностью и трудоемкостью процесса его получения.
Известна питательная среда YT (наиболее близкий аналог) для культивирования рекомбинантных штаммов бактерий Е.Coli (Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. - М.: Мир, 1984. - 480 с.), содержащая пептон - 16 г/л, дрожжевой экстракт - 10 г/л и натрий хлористый - 5,0 г/л.
Однако такая питательная среда не обеспечивает достаточный уровень накопления белка TBI.
Наиболее близким аналогом способа получения биомассы бактерий (прототипом) является способ получения биомассы рекомбинантного штамма бактерий Escherichia coli - продуцента белка TBI (Патент РФ №2317107, МПК C12N 15/48, опубл. 20.07.2007). Способ включает получение моноизолята путем трансформации реципиентного штамма Е. coli JM 103 плазмидой pTBI, посев его в 5 мл среды YT (Ар 200 мкг/мл). Далее выращивают ночной инокулят при температуре 37°С и перемешивании 180 об/мин. Качалочные колбы с ферментационной средой YT (объем среды 150 мл) засевают посевным материалом в дозе 1% от объема среды в колбе, добавляют ампициллин из расчета 200 мкг/мл. Процесс микробиологического синтеза ведут на качалке INFORS AS CH - 4015 BASEL при скорости вращения платформы 180 об/мин и температуре 37°С. Культуру выращивают до значения оптической плотности 0,6-0,7 и добавляют налидиксовую кислоту до конечной концентрации 90 мкг/мл. После индукции культивирование проводят еще 4,5 ч. После завершения процесса ферментации биомассу отделяют центрифугированием (8000 об/мин) в течение 15 мин. Уровень накопленного белка измеряют методом электрофореза в 12% ПААГ с последующим денситометрическим сканированием. При данном способе культивирования урожай клеток составил 2,8-3,0 г/л.
Однако количество белка TBI в биомассе при этом явно недостаточно и варьирует от 5,0% до 8,0% от суммы клеточных белков.
Техническим результатом заявляемого технического решения является создание такого посевного бактериального материала, который обеспечивал бы более высокий уровень накопления белка TBI в биомассе.
Указанный технический результат достигается тем, что посевной бактериальный материал для хранения и использования в качестве банка производственного штамма (БПШ) согласно изобретению выполнен в сухой форме и содержит биомассу моноизолята рекомбинантного штамма бактерий Escherichia coli - продуцента белка TBI, обладающего способностью к продукции указанного белка в количестве не менее 0,58 мг/мл и титром не менее 1*108 КОЕ/г с защитной средой. В качестве рекомбинантного штамма бактерий сухая форма содержит штамм E.coli JM 103/pTBI, а защитная среда включает LB-бульон с сахарозо-желатиновой добавкой в количестве не более 50 мас.% и соотношением сахарозы и желатина не более 5:1, а влажность посевного материала составляет не более 3 мас.%.
При получении биомассы рекомбинантного штамма бактерий Escherichia coli JM 103/pTBI - продуцента белка TBI посевная доза бактериального материала из банка рабочей культуры составляет 1% от объема питательной среды.
Причем оживление сухой формы бактериального материала штамма Escherichia coli JM 103/pTBI - продуцента белка TBI и его культивирование при получении биомассы для выделения белка TBI осуществляют при температуре 37°С.
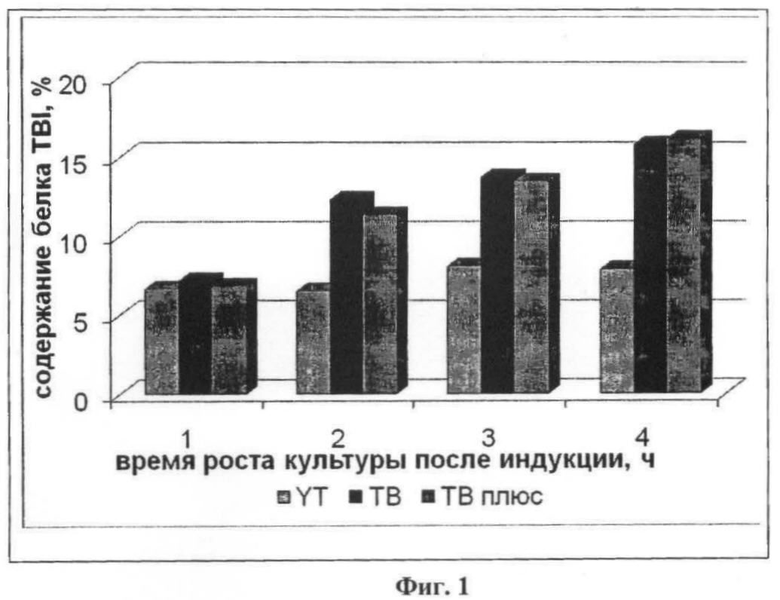
На фиг.1 приведена диаграмма накопления белка TBI при культивировании штамма на питательной среде.
Ниже приведены примеры конкретных составов сухой формы посевного бактериального материала штамма Е. coli JM 103/pTBI для выделения белка TBI.
Пример 1. Сухая форма посевного бактериального материала с влажностью не более 3 мас.%:
биомасса моноизолята рекомбинантного
Пример 2. Сухая форма посевного бактериального материала с влажностью не более 3 мас.%:
биомасса моноизолята рекомбинантного
штамма бактерий Escherichia coli JM
Особенность процесса получения посевного материала рекомбинантного штамма E.coli JM 103/pTBI заключается в предварительном отборе моноизолятов с наиболее выраженной способностью к продукции целевого белка. Получение высокоактивных моноизолятов рекомбинантного штамма E.coli JM-103/pTBI, их отбор и анализ представляют собой одну из основных первоначальных ступеней в создании банка производственного штамма, который в свою очередь является неотъемлемым этапом в подготовке посевного материала.
Введение стадии получения банка производственного штамма в лиофильно высушенной форме (состав по примерам 1 и 2) исключает необходимость получения свежих трансформантов при приготовлении посевного материала. Это, в свою очередь, значительно сокращает количество пассажей и время приготовления посевного материала, позволяет стабилизировать процесс биосинтеза, повысить выход целевого белка в биомассе до 10%-16% и постоянно получать качественную биомассу.
Получение банка производственного штамма (БПШ)
Отобранный трансформированный высокопродуктивный моноизолят выращивали на чашке Петри с агаризованной средой, содержащей ампициллин в концентрации 200 мкг/мл при температуре 37°С в течение 24 ч. По окончании выращивания полученную биомассу суспендировали в LB-бульоне с добавлением сахарозо-желатиновой среды в качестве криопротектора и собирали в стерильные флаконы, лиофильно высушивали, маркировали и закладывали на хранение в качестве БПШ.
Получение банка рабочей культуры (БРК)
Суспензию после оживления БПШ использовали для наработки банка рабочей культуры. С этой целью производили посев на твердую агаризованную среду с ампициллином в концентрации 200 мкг/мл и выращивали в термостате при 37°С в течение 24 ч. Биомассу суспендировали в LB-бульоне с добавлением 60% раствора глицерина в соотношении 1:1 по объему, разливали аликвотами по 100 мкл в микропробирки. Пробирки маркировали с указанием номера посевной серии и помещали в кельвинатор при - 60°С.
Пример. Получение биомассы штамма Е.coli JM 103/pTBI для выделения белка TBI. В работе использовали в качестве посевного материала рекомбинантный штамм Е.coli JM 103/pTBI из рабочего банка культуры. Для всех экспериментов выращивали ночной инокулят при температуре 37°С и перемешивании 180 об/мин. Качалочные колбы с ферментационными заявляемыми питательными средами (объем среды 150 мл) засевали посевным материалом из расчета 0,1% от объема среды в колбе. Для выращивания культуры использовали питательные среды, состав которых приводится в таблице 1.
Процесс микробиологического синтеза вели на качалке INFORS AS CH-4015 BASEL при скорости вращения платформы 180 об/мин и температуре 37°С. Оптическую плотность клеток измеряли при помощи спектрофотометра при длине волны 550 нм. Уровень накопленного белка измеряли методом электрофореза в 12% ПААГ с последующим денситометрическим сканированием. После завершения процесса ферментации биомассу отделяли центрифугированием (8000 об/мин, 15 мин), промывали физиологическим раствором и повторно осаждали в том же режиме. На первом этапе исследования изучали влияние различных сред культивирования на общий урожай клеток и накопление целевого белка. С этой целью после посева посевного материала в качалочные колбы со средой YT при достижении значения оптической плотности культуральной жидкости 0,8-0,9 в среду добавляли индуктор - налидиксовую кислоту. Накопление целевого белка TBI представлено в таблице 2, а также на диаграмме фиг.1.
Анализ полученных результатов показывает, что при культивировании E.coli JM 103/pTBI на питательной среде YT количество целевого белка составляет 8%.
Таким образом, заявляемый посевной материал (инокулят) в сухой форме имеет явные преимущества по сравнению с ее жидкой формой (прототипом). Во-первых, повышается воспроизводимость процесса ферментации: процесс отличается более высокой стабильностью как по урожаю клеток, так и по содержанию целевого белка, которое достигает 8% и выше от суммы клеточных белков. Во-вторых, устраняется возможность контаминации посевного материала посторонней микрофлорой.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pACYC-LANS(KM), ШТАММ Escherichia coli BL21(DE3), ТРАНСФОРМИРОВАННЫЙ РЕКОМБИНАНТНОЙ ДНК pACYC-LANS(KM), И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ L-АСПАРАГИНАЗЫ Erwinia carotovora | 2010 |
|
RU2441916C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА SAV-RGD | 2014 |
|
RU2577138C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ БАРНАЗЫ В КЛЕТКАХ ESCHERICHIA COLI, ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ БАРНАЗЫ И СПОСОБ ПОЛУЧЕНИЯ БАРНАЗЫ. | 2017 |
|
RU2650871C1 |
| Рекомбинантная плазмидная ДНК pET21-IFN-γ, содержащая ген, кодирующий гамма-интерферон человека, штамм E.coli BL21/pET21-IFN-γ - продуцент рекомбинантного гамма-интерферона человека и способ получения гамма-интерферона человека | 2023 |
|
RU2827613C1 |
| ПЛАЗМИДНЫЙ ВЕКТОР pE-Trx-Aur, ШТАММ ESCHERICHIA COLI ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АУРЕЛИНА И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2009 |
|
RU2412999C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТИВНЫХ КОЛИЧЕСТВ ПЛАЗМИДНОЙ ДНК ИЗ КЛЕТОК РЕКОМБИНАНТНЫХ МИКРООРГАНИЗМОВ | 2004 |
|
RU2295571C2 |
| ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ БЕЛКА ТЕПЛОВОГО ШОКА 70 И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БЕЛКА ТЕПЛОВОГО ШОКА ЧЕЛОВЕКА | 2013 |
|
RU2564120C2 |
| Рекомбинантная плазмидная ДНК pCSBrz4M, кодирующая полипептид со свойствами сладкого белка браззеина, и рекомбинантный штамм E. coli - продуцент полипептида со свойствами сладкого белка браззеина | 2022 |
|
RU2799530C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА SAV-RGD, СПЕЦИФИЧЕСКИ УЗНАЮЩЕГО КЛЕТКИ МЕЛАНОМЫ | 2013 |
|
RU2563540C2 |
| ГИДРОЛАЗА ПЕПТИДОГЛИКАНА, ЭКСПРЕССИОННАЯ ПЛАЗМИДА, СОДЕРЖАЩАЯ ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ГИДРОЛАЗУ ПЕПТИДОГЛИКАНА, БАКТЕРИЯ-ПРОДУЦЕНТ И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ГИДРОЛАЗЫ ПЕПТИДОГЛИКАНА | 2012 |
|
RU2547584C2 |
Сухая форма посевного материала рекомбинантного штамма бактерий Escherichia coli JM 103/pTBI - продуцента белка ТВI содержит биомассу моноизолята рекомбинантного штамма бактерий Escherichia coli JM 103/pTBI с титром не менее 1·108 КОЕ/г и защитную среду. Защитная среда содержит LB-бульон с сахарозо-желатиновой добавкой в количестве не более 50% и соотношением сахарозы и желатина не более 5:1. Изобретение обеспечивает более высокий уровень накопления белка TBI в биомассе. 1 ил., 2 табл., 2 пр.
Сухая форма посевного бактериального материала рекомбинантного штамма бактерий Escherichia coli JM 103/ pTBI - продуцента белка TBI, характеризующаяся тем, что она содержит биомассу моноизолята рекомбинантного штамма бактерий Escherichia coli JM 103/pTBI - продуцента белка TBI, обладающего способностью к продукции указанного белка с титром не менее 1-108 КОЕ/г и защитную среду, содержащую LB-бульон с сахарозо-желатиновой добавкой в количестве не более 50 мас.% и соотношением сахарозы и желатина не более 5:1.
| РЕКОМБИНАНТНАЯ ВАКЦИНА ПРОТИВ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА 1 ТИПА | 2006 |
|
RU2317107C2 |
| ЛЕБЕДЕВ Л.Р., ЕРОШКИН A.M., ГШЕВА И.П | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Биотехнология, 1997, N7-8, с.38-42 | |||
| МАНИАТИС Т., ФРИЧ Э., СЭМБРУК Дж | |||
| Молекулярное клонирование | |||
| - М.: Мир, 1984, с.84 | |||
| MOCHAAADIAN-MOSAABADI J., NADERI-MANESH H., MAGHSOUDI N | |||
| NASSIRI-KHALILI M-A.et al. | |||
Авторы
Даты
2012-09-10—Публикация
2010-09-10—Подача