Изобретение относится к медицине, а именно к пульмонологии и иммунологии, может быть использовано при оценке эффективности действия фармацевтических препаратов и биологически активных добавок на иммунную систему больных бронхолегочными заболеваниями.
Для правильного назначения терапии и контроля ее эффективности рекомендуется оценка иммунного статуса пациента в динамике. В настоящее время стандарты исследования включают определение общего количества лейкоцитов, лимфоцитов, субпопуляций Т-лимфоцитов, В-лимфоцитов, уровня иммуноглобулинов А, М, G, фагоцитарного числа и фагоцитарного показателя (Медицинские стандарты (протоколы) диагностики и лечения больных с аллергическими заболеваниями и нарушениями иммунной системы. - Москва, 2000; Справочник по иммунотерапии для практического врача. / Н.Н.Володин, М.В.Дегтярева, И.В.Нестерова и др. // М. Диалог. - 2002. - 480 с). Перечисленные методы контроля состояния иммунитета больного фиксируют только системные нарушения, а при назначении терапии больным бронхолегочными заболеваниями, врачу необходимо знать динамику показателей резистентности клеток не только системного кровотока, но и непосредственно органа-мишени (легких). Состояние местного иммунитета после различных видов терапий (антибактериальной, противовоспалительной, иммуномодулирующей) может служить одним из критериев эффективности лечения, а также показателем влияния самого препарата или его компонентов на местный иммунитет органов дыхания.
Также следует отметить, что перечисленные методы являются ориентировочными (скриннинговыми), с их помощью можно определить только грубые нарушения в иммунной системе больного. При этом функциональная активность фагоцитов остается вне поля зрения. Вместе с тем, роль этих клеток в противоинфекционном иммунитете трудно переоценить. Большинство проникающих в организм бактериальных агентов подвергаются утилизации фагоцитами даже без заметной стимуляции других звеньев иммунитета, т.е. эти клетки наиболее чувствительны к любым внешним воздействиям.
Поэтому в настоящее время актуален поиск доступных методов, позволяющих в короткие сроки объективно оценить динамику показателей местного иммунитета больных бронхолегочными заболеваниями, для правильного назначения и контроля эффективности терапии. При этом желательно оценивать именно состояние фагоцитов очага воспаления как наиболее чутко реагирующих на различные внешние воздействия. Причем активность фагоцитов данного очага воспаления можно оценить только при этом виде патологии, так как при других извлечение фагоцитов из очага воспаления затруднительно.
Известны способы оценки местной неспецифической резистентности больных, при применении фармакологических препаратов, по изменению количественных показателей фагоцитов.
1. При этом изучалось содержание нейтрофилов в спонтанной и индуцированной мокроте для оценки влияния эреспала при включении его в режим терапии больных хроническим обструктивным бронхитом (Эффективность фенспирида (эреспала) в базисной терапии хронического обструктивного бронхита. / Л.А.Яшина, Ю.И.Фещенко, М.А.Полянская и др. // Украинский пульмонологический журнал. - 2003. - №3. - с.30-37). По уменьшению содержания нейтрофилов в спонтанной и индуцированной мокроте данных больных судили о положительном эффекте этого препарата.
Недостатками данного способа является его субъективность, т.к. результаты в большой степени зависят от квалификации специалиста, выполняющего его. Также определяется количество только нейтрофилов, без учета других клеток мокроты, и не исследуются функциональные способности нейтрофилов.
2. При этом проводился сравнительный анализ мобильности клеточного композиционного состава индуцированной мокроты (Клинико-иммунологическая эффективность БАД «АСТИН» у больных с бронхообструктивными заболеваниями. / К.Н.Конторщикова. // Отчет по НИР №68 от 28 июня 2004 г.) в динамике у пациентов с бронхиальной астмой и хронической обструктивной болезнью легких при применении БАД «АСТИН». По статистически значимому изменению количества нейтрофилов, лимфоцитов и макрофагов судили об эффективности данного препарата. В частности, зарегистрированы положительные сдвиги процентного содержания альвеолярных макрофагов на фоне лечения у больных, получавших БАД, что было расценено как его благоприятный эффект.
Недостатком этого способа является отсутствие учета функциональной активности клеток индуцированной мокроты и, опять же, субъективность оценки.
Известны способы оценки неспецифической резистентности фагоцитов крови, при применении фармакологических препаратов, по изменению активности отдельных ферментных систем фагоцитов крови больных.
1. Способ определения спонтанного и индуцированного продигиозаном НСТ-теста фагоцитов крови до и после лечения для оценки влияния препарата на метаболические процессы, обеспечивающие внутриклеточную выработку Н2O2 (А.С.Возианов и соавт. Клинико-иммунологические эффекты лейкинферона при лечении больных острым гнойным пиелонефритом. Урология и нефрология №3, 1994; А.С.Борзенко и соавт.; Применение полиоксидония в комплексном лечении больных туберкулезом легких. Иммунология №2, 1999). По изменению показателей стимулированных фагоцитов, относительно нестимулированных, до и после терапии изучаемым модулятором, судят о резервных возможностях этих клеток.
Недостатком данного способа является его необъективность, т.к. исследуются фагоциты крови всего организма, а не очага воспаления, следовательно, нельзя исключить влияние на полученные результаты других факторов, например сопутствующих хронических заболеваний других органов и систем, учитываются изменения только одной ферментативной системы и нет сравнения индексов стимуляции с соответствующими показателями здоровых доноров. Это не позволяет учесть индивидуальные особенности течения заболевания больного и снижает информативность и достоверность способа.
Задача, на решение которой направлено изобретение, это в короткие сроки объективно оценить динамику показателей местного иммунитета, связанного с фагоцитами очага воспаления, больных бронхолегочными заболеваниями для правильного назначения и контроля эффективности лечения, а также повысить достоверность оценки действия фармакологического препарата.
Сущность данного изобретения заключается в том, что оценку действия фармакологических препаратов на местные факторы защиты организма человека на примере больных бронхолегочными заболеваниями согласно изобретению производят путем определения ферментативной активности фагоцитов, выделенных от больного, не менее чем по пяти ферментным системам, стимулированных и не стимулированных бактериями, до и после лечения фармокологическим препаратом, причем дополнительно определяют ферментативную активность таких же фагоцитов у здоровых людей, рассчитывают показатель резервных возможностей фагоцитов для каждой ферментной системы по формуле: 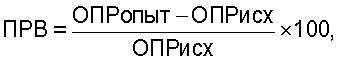
где ОПРопыт - оптическая плотность фагоцитов, стимулированных бактериями, ОПРисх - нестимулированных клеток (OD×10-3),
где ПРВ - показатель резервных фагоцитов;
полученные показатели резервных возможностей фагоцитов сравнивают с показателями резервных возможностей фагоцитов у здоровых людей и по их изменениям судят о действии фармакологического препарата на местные факторы защиты. При этом ферментативную активность фагоцитов определяют спектрофотометрически.
Технический результат данного изобретения выполняется за счет того, что:
1) отбор исследуемого материала осуществляют из индуцируемой мокроты человека, а этот материал, максимально точно отражает воспалительный процесс в дыхательных путях, и забор его осуществляется неинвазивным способом;
2) определение функциональной, в том числе ферментативной, активности фагоцитов больного проводят не менее чем по пяти параметрам, что повышает достоверность и информативность способа;
3) дополнительно определяют функциональную активность фагоцитов индуцированной мокроты здоровых людей для расчета эталонных показателей резервных возможностей фагоцитов;
4) показатели резервных возможностей фагоцитов больного для каждой ферментной системы сравнивают с соответствующими значениями здоровых лиц, что позволяет оценить не только характер действия фармакологического препарата, но и степень его влияния на состояние местного иммунитета больного, наличие или отсутствие нормализации местных факторов защиты, что необходимо для коррекции назначенной терапии, и, таким образом, повышает информативность данного способа;
5) функциональную активность фагоцитов определяют спектрофотометрически, в результате чего способ упрощается, повышается его оперативность, информативность и достоверность.
Сущность способа поясняется следующей последовательностью операций.
В качестве материала для исследования используют индуцированную мокроту (ИМ) больных бронхолегочными заболеваниями до начала приема препарата и после проведенного курса лечения. ИМ получают ингаляциями 3-5% стерильного гипертонического солевого раствора с помощью компрессионного небулайзера "Omron CX-3" (Япония). Ингаляции проводятся сеансами по 7 минут, общая продолжительность ингаляции обычно не превышает 30 минут. После каждого сеанса пациенты тщательно поласкают рот и откашливают мокроту в стерильную полимерную одноразовую чашку Петри диаметром не меньше 90 мм (GREINER BIO-ONE, Германия). Затем ИМ с помощью стерильного одноразового шприца (5 или 10 мл) переносят в центрифужные градуированные пластиковые пробирки с завинчивающейся крышкой (10 мл).
Для диспергирования и гомогенизации мокроты используют 0,1% раствор дитиотреитола, который добавляют к мокроте в соотношении 1:1. Затем смесь встряхивают в течение 10 минут и фильтруют через нейлоновую марлю. Исследование мокроты проводили не позднее 3 часов после получения материала, на протяжении всего этого времени образцы хранились при температуре +4°С.
Отфильтрованную ИМ центрифугируют при 1200 об/мин в течение 10 минут, затем супернатант сливают, а взвесь фагоцитов промывают 3 раза в 1 мл сбалансированного солевого раствора Хенкса без фенолового красного при 1200 об/мин по 10 минут. В камере Горяева подсчитывают концентрацию ядросодержащих клеток. Разбавлением (добавлением стерильного физиологического раствора или раствора Хенкса без фенолового красного) получают необходимую для исследований взвесь фагоцитов в концентрации 2×106 кл/мл.
В качестве объекта фагоцитоза используют Staphylococcus aureus. Суспензия S.aureus разводится до концентрации 2×107 м. к./мл физиологическим раствором.
Оценивают функциональную активность фагоцитов с помощью спектрофотометрического исследования показателей теста с нитро-синим тетразолием (НСТ-теста), внутриклеточного содержания кислой фосфатазы (КФ), катионных белков (КБ), 5'-нуклеотидазы и миелопероксидазы (МПО). Реакции ставятся в триплетах лунок плоскодонного 96-луночного планшета с нестимулированными и стимулированными клетками.
1. Прижизненные тесты (НСТ-тест)
Выделенная суспензия фагоцитов в концентрации 2×106 кл/мл вносится в лунки плоскодонного 96-луночного планшета по 100 мкл на лунку. Затем в эти лунки добавляют по 100 мкл раствора НСТ (nitro blue tetrazolium 0,5 мг/мл на основе физиологического раствора). После этого в первый триплет лунок вносят по 50 мкл физиологического раствора, во второй - 50 мкл рабочего раствора бактерий S.aureus с концентрацией 2×107 м. к./мл. После инкубации при 37°С в течение 45 мин монослой фагоцитов трижды отмывается теплым раствором Хенкса без фенолового красного от раствора НСТ и непоглощенных бактерий и высушивается.
Затем фагоциты разрушают путем добавления в лунки предварительно разогретого до 83°С диметилсульфамида (DMSO, производство «ICN») по 50 мкл. Оптическая плотность полученных субстратов измеряется на спектрофотометре "Multiscan Titertek Plus" ("Flow lab.") при длине волны 540 нм.
2. Тесты на фиксированных образцах
Определение активности ферментов проводилось на фиксированных образцах, которые приготовляются следующим образом:
Выделенная суспензия фагоцитов в концентрации 2×106 кл/мл вносится в лунки плоскодонного 96-лу ночного планшета по 100 мкл на лунку. Реакция ставится в триплетах с нестимулированными и стимулированными фагоцитами. Соответственно в первый триплет с монослоем фагоцитов вносят контрольное вещество (физиологический раствор в количестве 100 мкл), во второй - 100 мкл рабочего раствора бактерий S.aureus с концентрацией 2×107 м. к./мл. Планшеты инкубируют в термостате в течение 45 мин при температуре 37°С. Затем надосадок удаляют и монослой фагоцитов трижды осторожно промывают от непоглощенных бактерий теплым раствором Хенкса без фенолового красного. Монослой фагоцитов высушивают и фиксируют в парах формалина в течение 15 мин, после чего исследуют ферментативную активность.
а) определение активности 5'-нуклеотидазы
К адгезированным на пластике 96-луночного планшета и фиксированным нестимулированным и стимулированным фагоцитам ИМ добавляют по 50 мкл субстрата для 5'-нуклеотидазы (4 мг adenosine-5'-mono phosphate (ICN) на 1 мл субстратного раствора, который готовится на основе 0,05 М трис-HCl-буфера (рН 7,8), путем растворения в 100 мл этого буфера 87 мг NaCl и 70 мг MgCl2). Образцы оставляют в термостате при 37°С на 60 мин. Реакция останавливается добавлением 100 мкл смеси аскорбиновой и молибденовой кислот в соотношении 1:1. Через 20 мин измеряется оптическая плотность полученных субстратов на спектрофотометре "Multiscan Titertek Plus" ("Flow lab.") при длине волны 620 нм.
б) определение активности миелопероксидазы
Свежеприготовленный субстратный раствор (к 10 мл фосфатно-цитратного буфера (рН 5,0) добавляем 4 мг o-phenylenediamine (ICN) и 500 мкл 0,33% перекиси водорода) по 100 мкл вносится в лунки планшета, содержащие адгезированные на пластик и фиксированные фагоциты. Планшет инкубируется при комнатной температуре в течение 10 мин, затем реакция останавливается добавлением 10% раствора серной кислоты по 100 мкл на лунку. Оптическая плотность определяется на спектрофотометре "Multiscan Titertek Plus" ("Flow lab.") при длине волны 492 нм.
в) определение активности катионных белков
В лунки с фиксированными на пластике фагоцитами вносится по 50 мкл раствора, содержащего 10 мг прочного зеленого ("Fast Green", "Serva"), растворенного в 10 мл метанолового трис-буфера (рН 8,0-8,2). Планшет инкубируется в течение 30 мин при 37°С. Затем невключившийся краситель отмывается раствором Хенкса дважды. Связанный с катионными белками фагоцитов краситель растворяется добавлением диметилсульфоксида (50 мкл), предварительно разогретого на водяной бане до 80°С. Результаты учитываются с помощью спектрофотометра «Titertek Multiscan Plus» при длине волны при длине волны 620 нм.
г) определение активности кислой фосфатазы
В лунки плоскодонного 96-луночного планшета, содержавшего фиксированные фагоциты, вносится по 50 мкл раствора паранитрофенилфосфата (ПНФФ-раствор, ICN). Для его приготовления 0,09 г ПНФФ и 0,31 г NaCl растворялось в 37 мл 1М натрий-цитратного буфера (рН 5,5). Образцы инкубируются при 37° в течение 30 мин. Затем, добавлением 0,2 М раствора NaOH по 100 мкл на лунку, реакция останавливается. Оптическая плотность раствора измеряется на спектрофотометре "Multiscan Titertek Plus" ("Flow lab.") при длине волны 405 нм.
Результаты спектрофотометрического анализа активности ферментов выражают в виде унифицированного показателя резервных возможностей клеток (ПРВ) по формуле:
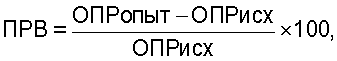
где ОПРопыт - оптическая плотность раствора фагоцитов, стимулированных бактериями (OD×10-3),
ОПРисх - нестимулированных фагоцитов (OD×10-3),
ПРВ - показатель резервных возможностей фагоцитов.
Затем сравнивают ПРВ ИМ больного до начала терапии, получавших изучаемый препарат, и здоровых лиц (контроль).
Снижение ПРВ фагоцитов ИМ у больного, по сравнению со значениями здоровых доноров, свидетельствует о нарушении местной противоинфекционной защиты его легких.
Изменение значений ПРВ при проведении терапии, по сравнению с начальными показателями больного, свидетельствуют о влиянии изучаемого препарата на местные факторы защиты организма. При этом наличие положительной динамики (увеличение ПРВ фагоцитов, рассчитанных по значениям НСТ-теста, МПО, КФ и КБ, и снижение ПРВ по 5'-нуклеотидазе) свидетельствует о благоприятном действии препарата на факторы местного иммунитета, а отрицательная динамика ПРВ (снижение ПРВ фагоцитов, рассчитанных по значениям НСТ-теста, МПО, КФ и КБ, и увеличение ПРВ по 5'-нуклеотидазе) наоборот, демонстрирует ухудшение противоинфекционной защиты легких под воздействием данной терапии.
Повышение сниженных начальных значений ПРВ до показателей здоровых доноров после приема препарата свидетельствует о восстановлении функциональных резервов иммунных фагоцитов и, соответственно, нормализации местной защиты легких.
Таким образом, данный способ позволяет сделать объективные выводы о степени влияния исследуемых препаратов или биологически активных веществ на местные факторы защиты организма.
Примеры конкретного выполнения.
Нами проведены исследования влияния лекарственных средств различных групп (антибактериальные, иммуномодулирующие) и биологически активной добавки на резервные возможности фагоцитов индуцированной мокроты больных внебольничной пневмонией средней и тяжелой степени и острым бронхитом, находившихся на стационарном лечении в пульмонологических отделениях Главного госпиталя Тихоокеанского флота (г.Владивосток) и Госпиталя ТОРПУ ФПС РФ (г.Владивосток) в период с 2002 по 2004 гг. Диагноз внебольничной пневмонии устанавливался на основании общепринятых критериев (Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. / А.Г.Чучалин, А.И.Синопальников, С.В.Яковлев и др. - Смоленск: Авентис, 2003. - 54 с.). Оценка тяжести состояния больных на момент поступления проводилась по критериям, предложенным Л.И.Дворецким в 1996 году (Окороков, А.Н. Диагностика болезней органов дыхания / А.Н.Окороков. - М.: Мед. лит., 2000. - 448 с.).
Пример №1
Больной Данилин В.П., возраст 19 лет.
Диагноз: Внебольничная пневмония средней степени тяжести.
Оценивалось влияние фармацевтического препарата бензилпенициллина натриевая соль (порошок для растворения, для в/в и в/м введ., 1 млн ЕД; производство Синтез АКО, Россия) на местные факторы защиты легких больного внебольничной пневмонией средней степени тяжести.
Больной получал препарат бензилпенициллина натриевую соль по 1 млн ед. внутримышечно, 6 раз в день, в течение 10 дней. Индуцированную мокроту брали в первый день поступления больного в стационар, до начала антибиотикотерапии (АБТ), и на 10 день терапии.
Пациенту проводились ингаляции 3-5% стерильного гипертонического солевого раствора с помощью компрессионного небулайзера "Omron СХ-3" (Япония) сеансами по 7 минут. Затем он поласкал рот и откашливал мокроту в стерильную полимерную одноразовую чашку Петри, диаметром 90 мм (GREINER BIO-ONE, Германия). После этого ИМ с помощью стерильного одноразового 10 мл шприца переносили в центрифужные градуированные пластиковые пробирки с завинчивающейся крышкой. Добавляли 0,1% раствор дитиотреитола в соотношении 1:1. Встряхивали смесь в течение 10 минут и фильтровали через нейлоновую марлю.
Отфильтрованную ИМ центрифугиролвали при 1200 об/мин в течение 10 минут, затем супернатант сливали, а клеточную взвесь промывали 3 раза по 10 минут в 1 мл сбалансированного солевого раствора Хенкса без фенолового красного при 1200 об/мин. В камере Горяева подсчитывали концентрацию ядросодержащих фагоцитов. Разбавлением (добавлением стерильного физиологического раствора) получали необходимую для исследований взвесь фагоцитов в концентрации 2×10 кл/мл.
В качестве объекта фагоцитоза использовали Staphylococcus aureus. Суспензию S.aureus разводили до концентрации 2×107 м. к./мл физиологическим раствором.
Оценивали ферментативную активность фагоцитов ИМ больного ВП средней степени с помощью спектрофотометрических исследований показателей теста с нитро-синим тетразолием, внутриклеточного содержания КФ, КБ, 5'-нуклеотидазы и МПО. Реакции ставили в триплетах лунок плоскодонного 96-луночного планшета с нестимулированными и стимулированными S.aureus фагоцитами.
1. Проводили НСТ-тест на нефиксированных фагоцитах:
выделенную суспензию фагоцитов в концентрации 2×106 кл/мл вносили в лунки плоскодонного 96-луночного планшета по 100 мкл на лунку. Затем в эти лунки добавляли по 100 мкл раствора НСТ (nitro blue tetrazolium 0,5 мг/мл на основе физиологического раствора). После этого в первый триплет лунок вносили по 50 мкл физиологического раствора, во второй - 50 мкл рабочего раствора бактерий S.aureus в концентрации 2×107 м. к./мл. После инкубации при 37°С в течение 45 мин монослой фагоцитов трижды отмывали теплым раствором Хенкса без фенолового красного от раствора НСТ и непоглощенных бактерий и высушивали планшеты при комнатной температуре.
Затем добавляли в лунки предварительно разогретый до 83°С диметилсульфамид (DMSO, производство «ICN») по 50 мкл. Измеряли оптическую плотность полученных субстратов на спектрофотометре "Multiscan Titertek Plus" ("Flow lab.") при длине волны 540 нм.
Затем рассчитывались показатели резервных возможностей фагоцитов ИМ для НСТ-теста по формуле
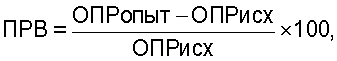
где ОПРопыт - оптическая плотность раствора фагоцитов, стимулированных бактериями,
ОПРисх - нестимулированных фагоцитов (OD×10-3).
2. Определяли активность ферментов 5'-нуклеотидазы, МПО КФ и КБ.
Выделенную суспензию фагоцитов в концентрации 2×106 кл/мл вносили в лунки четырех плоскодонных 96-луночных планшетов, по 100 мкл на лунку, по два триплета (с нестимулированными и стимулированными фагоцитами). Затем в первый триплет с взвесью фагоцитов вносили физиологический раствор в количестве 100 мкл, во второй - 100 мкл рабочего раствора бактерий S.aureus с концентрацией 2×107 м. к./мл. Планшеты инкубировали в термостате в течение 45 мин при температуре 37°С. Затем надосадок удаляли и клеточный монослой трижды осторожно промывали от непоглощенных бактерий теплым раствором Хенкса без фенолового красного. Монослой фагоцитов высушивали и фиксировали в парах формалина в течение 15 мин, после чего исследовали ферментативную активность.
а) определение активности 5'-нуклеотидазы
В лунки планшета добавляли по 50 мкл субстрата для 5'-нуклеотидазы (4 мг adenosine-5'-mono phosphate (ICN) на 1 мл субстратного раствора, который готовится на основе 0,05 М трис-HCl-буфера (рН 7,8), путем растворения в 100 мл этого буфера 87 мг NaCl и 70 мг MgCl2). Образцы оставляли в термостате при 37°С на 60 мин. Затем добавляли по 100 мкл смеси аскорбиновой и молибденовой кислот в соотношении 1:1. Через 20 мин измеряли оптическую плотность полученных субстратов на спектрофотометре "Multiscan Titertek Plus" ("Flow lab.") при длине волны 620 нм.
б) определение активности миелопероксидазы
Свежеприготовленный субстратный раствор (к 10 мл фосфатно-цитратного буфера (рН 5,0) добавляем 4 мг o-phenylenediamine (ICN) и 500 мкл 0,33% перекиси водорода) по 100 мкл вносили в лунки планшета. Затем его оставляли при комнатной температуре в течение 10 мин, после чего добавляли 10% раствор серной кислоты по 100 мкл на лунку. Определяли оптическую плотность на спектрофотометре "Multiscan Titertek Plus" ("Flow lab.") при длине волны 492 нм.
в) определение активности катионных белков
В лунки с фиксированными на пластике фагоцитами вносили по 50 мкл раствора, содержащего 10 мг прочного зеленого ("Fast Green", "Serva"), растворенного в 10 мл метанолового трис-буфера (рН 8,0-8,2). Планшет инкубировали в течение 30 мин при 37°С. Затем невключившийся краситель отмывали раствором Хенкса дважды, после чего добавляли 50 мкл диметилсульфоксида (DMSO, производство «ICN»), предварительно разогретого на водяной бане до 80°С. Результаты учитывали с помощью спектрофотометра «Titertek Multiscan Plus» при длине волны при длине волны 620 нм.
г) определение активности кислой фосфатазы
В лунки планшета с фиксированными фагоцитами вносили по 50 мкл раствора паранитрофенилфосфата (ПНФФ-раствор, ICN). Для его приготовления 0,09 г ПНФФ и 0,31 г NaCl растворяли в 37 мл 1М натрий-цитратного буфера (рН 5,5). Образцы инкубировали при 37° в течение 30 мин. Затем добавляли 0,2 М раствора NaOH по 100 мкл на лунку. Оптическую плотность раствора измеряли на спектрофотометре "Multiscan Titertek Plus" ("Flow lab.") при длине волны 405 нм.
Затем рассчитывались показатели резервных возможностей фагоцитов ИМ для 5'-нуклеотидазы, МПО КФ и КБ по формуле
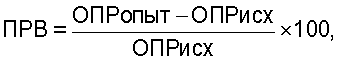
где ОПРопыт - оптическая плотность раствора фагоцитов, стимулированных бактериями,
ОПРисх - нестимулированных фагоцитов (OD×10-3).
Контролем в исследованиях служили средние значения ПРВ фагоцитов индуцированной мокроты 30 здоровых молодых людей, рассчитанных по показателям оптической плотности для каждого фермента.
Результаты представлены в таблице 1.
Сравнение ПРВ больного до начала АБТ и соответствующих показателей здоровых лиц свидетельствовало об изначально сниженной местной противоинфекционной защите легких пациента. Положительная динамика значений ПРВ после проведения терапии (увеличение ПРВ фагоцитов, рассчитанных по значениям НСТ-теста, МПО, КФ и КБ, и снижение ПРВ по 5'-нуклеотидазе), по сравнению с начальными показателями больного свидетельствует о благоприятном действии препарата на факторы местного иммунитета. Однако ПРВ не достигли соответствующих контрольных значений, что свидетельствует об отсутствии нормализации местного иммунитета больного.
Пример №2
Больной Помовцев А. В., возраст 19 лет.
Диагноз: Внебольничная пневмония средней степени тяжести.
Оценивалось влияние фармацевтического препарата бензилпенициллина натриевая соль (порошок для растворения, для в/в и в/м введ., 1 млн ЕД; производство Синтез АКО, Россия) и препарата ликопид (Пептек, Россия) на местные факторы защиты легких больного внебольничной пневмонией средней степени тяжести.
Больной получал препарат бензилпенициллина натриевую соль по 1 млн ед. внутримышечно, 6 раз в день, в течение 10 дней. Индуцированную мокроту брали в первый день поступления больного в стационар, до начала антибиотикотерапии (АБТ), и на 3 день терапии.
Оценка влияние фармацевтического препарата на местные факторы защиты легких больного производилась аналогично примеру №1. Данные представлены в таблице 2.
Сравнение ПРВ больного до начала АБТ и соответствующих показателей здоровых лиц свидетельствовало об изначально сниженной местной противоинфекционной защите легких пациента.
Отрицательная динамика ПРВ (снижение ПРВ фагоцитов, рассчитанных по значениям НСТ-теста, МПО и КБ, и увеличение ПРВ по 5'-нуклеотидазе) на третий день АБТ демонстрирует ухудшение противоинфекционной защиты легких под воздействием данной терапии.
Учитывая полученные данные, в схему лечения больного с 4 дня госпитализации был добавлен иммуномодулятор ликопид, принимался сублингвально по 1 мг ежедневно утром в течение 10 дней. Оценка влияния ликопида на местные факторы защиты легких больного производилась на 10 день терапии аналогично примеру №1. Данные представлены в таблице 3.
После терапии иммуномодулятором ликопид у больного наблюдалось повышение ПРВ, следовательно, действие изучаемого фармакологического препарата оценивается как повышающее местную противоинфекционную защиту организма, при этом показатели резервных возможностей по трем параметрам достигли значений здоровых лиц - можно констатировать нормализацию изначально нарушенной местной противоинфекционной защиты легких данного больного, а действие ликопида оценить как повышающее местный иммунитет.
Пример №3
Больной Блохин Г. В., возраст 20 лет.
Диагноз: Внебольничная пневмония, тяжелое течение.
Оценивалось влияние фармацевтического препарата лифоран (Cefotaxime; порошок для приготовления инъекционного раствора во флаконах по 1,0 г, «Лайка Лэбс Лимитед», Мумбай, Индия) на местные факторы защиты легких больного тяжелой внебольничной пневмонией.
Больной получал препарат лифоран по 1,0 г, внутримышечно, 3 раз в день, в течение 5 дней. Индуцированную мокроту брали в первый день поступления больного в стационар, до начала антибиотикотерапии (АБТ), и на 3 день терапии.
Оценка влияние фармацевтического препарата на местные факторы защиты легких больного производилась аналогично примеру №1. Данные представлены в таблице 4.
Сравнение ПРВ больного до начала АБТ и соответствующих показателей здоровых лиц свидетельствовало о резко сниженном местном иммунитете пациента. Отрицательная динамика ПРВ (снижение ПРВ фагоцитов, рассчитанных по значениям НСТ-теста и КБ, и увеличение ПРВ по 5'-нуклеотидазе) на третий день АБТ демонстрирует снижение противоинфекционной защиты легких под воздействием данной терапии, что позволяет оценить действие лифорана как угнетающее местный иммунитет.
Учитывая полученные данные, в схему лечения больного с 4 дня госпитализации был добавлен иммуномодулятор ронколейкин (0,5 мг - 500000 ME рекомбинантного ИЛ-2, Биотех, Россия), ингаляционно, с помощью небулайзера, по 500 тыс. ME (0,5 мг) на 1 ингаляцию ежедневно 1 раз в день в течение 3 дней.
Индуцированную мокроту брали после курса терапии ронколейкином. Оценка влияния фармацевтического препарата ронколейкин (500000 ME, Биотех, Россия) на местные факторы защиты легких больного тяжелой внебольничной пневмонией производилась аналогично примеру №1. Данные представлены в таблице 5.
После терапии иммуномодулятором ронколейкин у больного наблюдалось повышение ПРВ, следовательно, действие изучаемого фармакологического препарата можно оценить как повышающее местную противоинфекционную защиту организма. При этом показатели резервных возможностей по трем параметрам практически достигли значений здоровых лиц, следовательно, можно констатировать нормализацию изначально нарушенной местной противоинфекционной защиты легких данного больного, а действие ронколейкина оценить как повышающее и нормализующее местный иммунитет.
Пример №4
Больной Кульков Л.С., возраст 18 лет.
Диагноз: Острый бронхит.
Оценивалось влияние биологически активной добавки (БАД) Тинростим-СТ+ (табл.0,2 г; ТИНРО-центр, Россия) на местные факторы защиты легких больного острым бронхитом.
Больной получал препарат Тинростим-СТ+ по 0,2 г, 2 раза в день, в течение 10 дней. Индуцированную мокроту брали в первый день поступления больного в стационар и на 10 день терапии. Оценка влияние БАД на местные факторы защиты легких больного производилась аналогично примеру №1.
Данные представлены в таблице 6.
Сравнение ПРВ больного до начала терапии и соответствующих показателей здоровых лиц свидетельствовало об изначально сниженной местной противоинфекционной защите легких пациента. Положительная динамика значений ПРВ после проведения терапии с БАД Тинростим-СТ+ (увеличение ПРВ фагоцитов, рассчитанных по значениям НСТ-теста, МПО, КФ и КБ, и снижение ПРВ по 5'-нуклеотидазе), по сравнению с начальными показателями больного, свидетельствует о благоприятном действии препарата на факторы местного иммунитета. Повышение сниженных начальных значений ПРВ до показателей здоровых доноров после приема препарата свидетельствует о восстановлении функциональных резервов иммунных фагоцитов и, соответственно, нормализации местной защиты легких, следовательно, действие БАД Тинростим-СТ+ можно оценить как повышающее местный иммунитет.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ ИММУНИТЕТА | 2007 |
|
RU2371727C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БИОСОВМЕСТИМОСТИ ИНОРОДНОГО МАТЕРИАЛА С ОРГАНИЗМОМ | 2008 |
|
RU2402773C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИЕЙ | 2014 |
|
RU2565107C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТЯЖЕСТИ ЗАБОЛЕВАНИЯ У БОЛЬНЫХ БРОНХОЛЕГОЧНЫМИ ЗАБОЛЕВАНИЯМИ | 2010 |
|
RU2456598C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОБЩЕЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ АКТИВНОСТИ ФАГОЦИТОВ В ТЕСТЕ ВОССТАНОВЛЕНИЯ НИТРОСИНЕГО ТЕТРАЗОЛИЯ ПРИ ЛЕЙКОЗЕ КРУПНОГО РОГАТОГО СКОТА | 2013 |
|
RU2564437C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ДИСБАКТЕРИОЗА | 1997 |
|
RU2123345C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ СПОСОБНОСТИ ФАГОЦИТИРУЮЩИХ КЛЕТОК | 2011 |
|
RU2445626C1 |
| СПОСОБ ЛЕЧЕНИЯ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ У ДЕТЕЙ | 2012 |
|
RU2529782C2 |
| СПОСОБ ДИАГНОСТИКИ ОГРАНИЧЕННЫХ ФОРМ ТУБЕРКУЛЕЗА ЛЕГКИХ | 1997 |
|
RU2143699C1 |
| СПОСОБ ЛОКАЛЬНОЙ ИММУНОТЕРАПИИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ МЯГКИХ ТКАНЕЙ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ | 2007 |
|
RU2361607C2 |
Изобретение относится к медицине, а именно к пульмонологии, иммунологии и может быть использовано при оценке эффективности действия фармацевтических препаратов на иммунную систему больных бронхолегочными заболеваниями. Для этого до и после лечения фармакологическим препаратом спектрофотометрически определяют ферментативную активность выделенных из больного фагоцитов, стимулированных и не стимулированных бактериями. Данную активность определяют не менее чем по пяти ферментным системам. Дополнительно определяют ферментативную активность таких же фагоцитов у здоровых людей. Затем рассчитывают показатель резервных возможностей фагоцитов для каждой ферментной системы по формуле 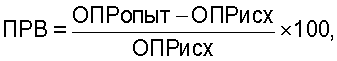 где ОПРопыт - оптическая плотность фагоцитов, стимулированных бактериями (OD×10-3), ОПРисх нестимулированных фагоцитов (OD×10-3), где ПРВ - показатель резервных возможностей фагоцитов. Полученные показатели резервных возможностей фагоцитов сравнивают с показателями резервных возможностей фагоцитов у здоровых людей и по их изменениям судят о действии фармакологического препарата на местные факторы защиты. Способ позволяет в короткие сроки объективно оценить динамику показателей местного иммунитета для правильного назначения препаратов, а также повысить достоверность оценки действия фармакологического препарата. 1 з.п. ф-лы, 6 табл.
где ОПРопыт - оптическая плотность фагоцитов, стимулированных бактериями (OD×10-3), ОПРисх нестимулированных фагоцитов (OD×10-3), где ПРВ - показатель резервных возможностей фагоцитов. Полученные показатели резервных возможностей фагоцитов сравнивают с показателями резервных возможностей фагоцитов у здоровых людей и по их изменениям судят о действии фармакологического препарата на местные факторы защиты. Способ позволяет в короткие сроки объективно оценить динамику показателей местного иммунитета для правильного назначения препаратов, а также повысить достоверность оценки действия фармакологического препарата. 1 з.п. ф-лы, 6 табл.
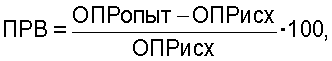
где ОПРопыт - оптическая плотность фагоцитов, стимулированных бактериями (OD·10-3), ОПРисх - нестимулированных клеток (OD·10-3),
где ПРВ - показатель резервных возможностей фагоцитов;
полученные показатели резервных возможностей фагоцитов сравнивают с показателями резервных возможностей фагоцитов у здоровых людей и по их изменениям судят о действии фармакологического препарата на местные факторы защиты.
| СПОСОБ ПОДБОРА ИММУНОКОРРЕКТОРА И ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ИММУНОТЕРАПИИ ПРИ УРОГЕНИТАЛЬНЫХ ИНФЕКЦИЯХ | 2001 |
|
RU2216739C2 |
| Способ лечения бронхолегочных заболеваний | 1990 |
|
SU1836952A1 |
| Способ индивидуального подбора эффективных стимуляторов иммунитета | 1987 |
|
SU1642390A1 |
| Способ получения сернистых красителей защитного цвета | 1935 |
|
SU43988A1 |
| ЯШИНА Л.А | |||
| Современный подход к медикаментозной терапии бронхиальной астмы | |||
| Украинский пульмонологический журнал, №1, 1993, с.34-37 | |||
| ДЕМИДОВ А.А | |||
| и др | |||
| Ферментативная активность нейтрофилов и моноцитов крови у больных сахарным диабетом. | |||
Авторы
Даты
2008-11-10—Публикация
2007-01-09—Подача