Изобретение относится к биологической или медицинской промышленности, в частности к технологии хранения плазмы или сыворотки крови, предназначенной для производства иммуноглобулиновых и альбуминовых биопрепаратов.
Хранение плазмы (сыворотки) крови для производства биопрепаратов медицинского, ветеринарного назначения в зависимости от сроков использования сырьевой заготовки регламентировано температурным режимом: от (-20)°С до (-30)°С (сборник «Препараты крови. Инструктивно-методические материалы по контролю и производству» Под редакцией Буренкова С.П., Изд-во Москва, 1976, стр.203-218; Русанов В.Н., Скобелев Л.И. «Фракционирование белков плазмы в производстве препаратов крови». - М.: Медицина, 1983, стр.49-83; Инструкция по фракционированию консервированной крови на клеточные компоненты и плазму. - М.: МЗ СССР, 1987; Приказ министерства здравоохранения РФ от 7 мая 2003 года №193).
За счет быстрого замораживания плазмы (сыворотки) крови до температуры (-35)°С-(-40)°С или (-196)°С возможно увеличить сроки их хранения в замороженном состоянии без потери физиологической активности белков (патент RU №2151617, А61М 1/38, опубл. 27.06.2000; Чардт Т., Радиоиммунологические методы, М.: Мир, 1981, стр.48).
Недостатком известных способов хранения является их энергозатратность и зависимость от бесперебойного энергообеспечения. В случае сбоев с подачей электроэнергии замороженные образцы подвергаются оттаиванию и последующей заморозке, что оказывает неблагоприятное денатурирующее воздействие на структуру-функцию белков, в частности, на активность и специфичность антител.
Задача изобретения состоит в создании способа хранения плазмы (сыворотки) крови при температуре (10±2)°С без денатурации иммуноглобулинов и альбуминов и на основе ресурсосберегающих подходов, исключающих низкотемпературный режим в процессе хранения, и без использования дорогостоящего оборудования и комплектующих для удаления примесей технологических реагентов, обеспечивающих стабилизацию белков и инактивацию инфекционных агентов.
Поставленная задача решается тем, что в способе хранения плазмы или сыворотки крови для получения иммуноглобулиновых и альбуминовых биопрепаратов путем воздействия химическими реагентами в качестве химических реагентов используют фенол и сульфат аммония, при этом воздействие осуществляют последовательным введением фенола и сульфата аммония, полученную суспензию с иммуноглобулинами в осадке и альбумином в надосадочной жидкости хранят при температуре (10±2)°С, затем избирательно переводят в полуфабрикаты для получения биопрепаратов иммуноглобулинов и альбумина.
Фенол вводят до его конечной концентрации (0,7±0,2)% в заготовке плазмы или сыворотки крови и выдерживают в течение 5 суток.
Сульфат аммония вносят до концентрации 50% от насыщения.
Перевод в полуфабрикаты для получения биопрепаратов иммуноглобулинов и альбумина осуществляют путем экстракции осадков целевых белков раствором хлорида кальция и переосаждением их из растворов полиэтиленгликолем.
Перевод в полуфабрикаты для получения биопрепаратов иммуноглобулинов и альбумина осуществляют на любом сроке хранения в течение 12 месяцев.
Изложенный подход апробирован при хранении донорской плазмы (сыворотки) крови человека, боенской плазмы (сыворотки) крови сельскохозяйственных животных (крупный и мелкий рогатый скот, свинья), мелких домашних животных и пушных зверей из семейства псовых и куньих.
Из анализа уровня техники следует, что фенол используется для инактивации вирусов и бактерий (Avram N., Paunescu GH., Gradinary D., et al. La resistance du virus de la leucose bovine (VLB) a certains agents physiques et chimiques/Bull. Acad. Sc. Agr. Forest, 1980, 10, p.205-209.; Европейская заявка №0281978 «Инактивирование вируса СПИД в содержащих белок растворах при помощи фенола». Опубликовано РЖ ИСМ 44-65-89; А.П.Красильников «Справочник по антисептике», Минск, «Вышейшая школа», 1995, стр.122-123). Известны также условия применения сульфата аммония с целью получения фракций плазмы (сыворотки) крови, обогащенных иммуноглобулинами или альбумином, в т.ч. технические трудности, обусловленные удалением из состава фракций фенола и сульфата аммония (Н. Suomela. An Ion Exchange Method for Immunoglobulin G production. In: Methods of Plasma Protein Fractionation / Ed. J.M. Curling / Academic Press, London, UK, 1980, pp.107-116.; P.K. Скоупс. Методы очистки белков. - М.: Мир, 1985. - 358 стр.; А.И. Черкасов, В.А. Пасечник. Мембраны и сорбенты в биотехнологии. - Л.: Химия, 1991. - 240 с.). Однако использование указанных реагентов для обеспечения надлежащего хранения плазмы (сыворотки) крови и нехроматографическое удаление их осаждением и переосаждением целевых белков в процессе формирования полуфабрикатов для производства иммуноглобулиновых или альбуминовых биопрепаратов на современном этапе развития уровня техники не известны.
Помимо прямого энергосберегающего эффекта, связанного с исключением низкотемпературного режима хранения, в техническом решении изобретения реализован и ресурсосберегающий эффект на стадии удаления низкомолекулярных технологических примесей. Перевод фенольно-сульфатной суспензии в полуфабрикаты осуществляют с помощью нехроматографических методов фракционирования. Удаление примесей SO4 2- за счет формирования малорастворимого CaSO4 в процессе экстракции осадков раствором хлорида кальция и переосаждение целевых белков с помощью полиэтиленгликоля (ПЭГ-6000) успешно заменяет известные и дорогостоящие приемы типа гель-фильтрации или ультрадиафильтрации на полых волокнах.
Способ осуществляется следующим образом.
В плазму (сыворотку) крови человека и указанных ранее животных вносят 40% раствор фенола в глицерине до его конечной концентрации (0,7±0,2)%. После экспозиции в течение 5 суток в обработанную фенолом плазму добавляют сухой сульфат аммония до 50%-ной концентрации от насыщения. Полученную таким образом фенольно-сульфатную суспензию хранят при температуре (10±2)°C и используют для производства биопрепаратов в течение 12 месяцев. Для использования в технологическом процессе фенольно-сульфатную суспензию подвергают последовательному центрифугированию, в условиях избирательного осаждения фракций, обогащенных иммуноглобулинами и альбумином. При экстракции осадков в 1-2%-ном растворе хлорида кальция центрифугированием удаляют малорастворимый сульфат кальция, а целевые белки переосаждают с помощью ПЭГ-6000. Растворы конечных осадков обладают заданными характеристиками для дальнейшего их фракционирования и производства иммуноглобулиновых или альбуминовых биопрепаратов либо с помощью хроматографических подходов, либо с помощью нехроматографических технологий на основе этанола, риванола или каприловой кислоты.
Примеры конкретного выполнения способа хранения донорской или боенской плазмы (сыворотки) крови для производства иммуноглобулиновых или альбуминовых биопрепаратов
В промышленном варианте к плазме (сыворотке) крови человека или животных постепенно при постоянном перемешивании механической мешалкой якорного типа со скоростью 60-70 об/мин добавляют 40%-ный раствор фенола в глицерине до его конечной концентрации (0,7±0,2)%. В лабораторном варианте для перемешивания используют магнитную мешалку типа ММ-5. Обработанную фенолом плазму (сыворотку) крови выдерживают при температуре (10±2)°С в течение 5 суток. После чего добавляют сухой сульфат аммония квалификации «хч» или «чда» из расчета 300 г порошка на 1 литр плазмы (сыворотки) крови. Порошок добавляют порционно при перемешивании ранее указанным способом, дополнительное перемешивание ведут еще 1,5-2 часа после полного растворения внесенного реагента. Под действием сульфата аммония уже через 2 часа формируется осадок и надосадочный раствор, обогащенные соответственно иммуноглобулинами и альбумином. Видовые фенольно-сульфатные суспензии плазмы (сыворотки) крови хранят при температуре (10±2)°С и используют в течение 12 месяцев для производства полуфабрикатов иммуноглобулинов и альбуминов.
Для получения полуфабриката иммуноглобулина фенольно-сульфатную суспензию подвергают центрифугированию. В лабораторных условиях используют центрифугу с охлаждением: 3000 об/мин, 30 минут, при температуре (+10)°С. В промышленном варианте центрифугирование с охлаждением осуществляют на проточной центрифуге типа ОТР при 15000 об/мин и скорости потока 60-70 литров/час. Сульфатный осадок в лабораторных условиях суспендируют в 1%-ном растворе хлорида кальция в объеме 1/10 от исходного объема плазмы (сыворотки) крови. В промышленном варианте собранный на проточной центрифуге осадок экстрагируют в трех объемах (вес/объем) 2%-ного раствора хлорида кальция. Перемешивание осуществляют в течение 2 часов ранее указанным образом. Малорастворимый осадок сульфата кальция удаляют центрифугированием. К центрифугату добавляют ПЭГ-6000, который вносят в объемно-весовом соотношении до конечной концентрации 15%. Внесение реагента ведут при постоянном перемешивании указанным ранее образом. По истечении дополнительных 1,5-2 часов после полного растворения ПЭГ-6000 суспензию центрифугируют, как указано ранее. Осадок представляет собой полуфабрикат для использования его в дальнейших стадиях производства иммуноглобулиновых биопрепаратов. Надосадочная жидкость является дополнительным источником при производстве альбуминового полуфабриката.
Для получения полуфабриката альбумина к надосадочной жидкости, полученной после центрифугирования фенольно-сульфатной суспензии, вносят сухой сульфат аммония указанной квалификации из расчета 100 г порошка на 1 литр центрифугата. Перемешивают, как указано ранее, до полного растворения реагента. С помощью 1 моль/л соляной или уксусной кислоты устанавливают рН инкубационной среды в пределах (4,7±0,1). Величину рН контролируют общепринятым способом, разводя пробу инкубационной среды в 25 раз с помощью дистиллированной воды. После дополнительного перемешивания в течение 1,5-2 часов сформировавшуюся суспензию центрифугируют. Сульфатный осадок экстрагируют при постоянном перемешивании в 5 объемах (1-2)%-ного раствора хлорида кальция в зависимости от масштабов (лабораторная и промышленная) схемы производства. Экстрагирование ведут при рН (6,8±0,2), контролируя рН, как указано ранее, с помощью защелачивания 1 моль/л раствором гидроксида кальция. После доведения рН перемешивание продолжают еще 1,5-2 часа и затем малорастворимый осадок удаляют центрифугированием. Надосадочную жидкость, полученную на данной стадии, объединяют с надосадочной жидкостью, полученной на стадии осаждения иммуноглобулинов ПЭГ-6000. Величину рН инкубационной среды доводят, как указано ранее, до значений (4,6±0,1) и добавляют сухой ПЭГ-6000, который вносят в объемно-весовом соотношении до конечной концентрации 20%. После дополнительного перемешивания в течение 1,5-2 часов суспензию центрифугируют для получения осадка альбумина.
В хроматографических схемах производства особое значение имеют рН, ионный состав и ионная сила буферных растворов целевых белков. Для достижения оптимального и наперед заданного состава растворов иммуноглобулинов и альбуминов полученные осадки растворяют в стартовых буферных растворах и переосаждают ПЭГ-6000.
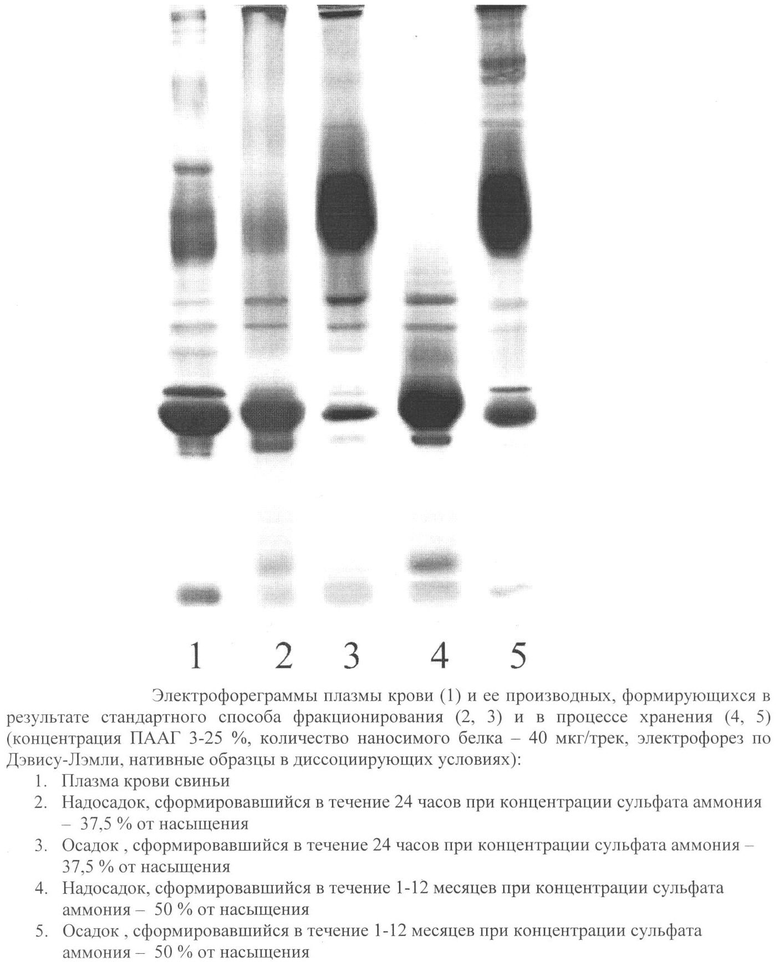
На чертеже приведено распределение белков плазмы (сыворотки) крови при известной (37,5%) и предлагаемой (50%) концентрациях сульфата аммония. В таблице 1 в количественных критериях приводится перераспределение иммуноглобулинов и альбуминов между фракциями фенольно-сульфатной суспензии, а также титр антител в известном и предлагаемом способе хранения плазмы (сыворотки) крови. В таблице 2 представлены данные, характеризующие наиболее значимые характеристики полуфабрикатов иммуноглобулиновых и альбуминовых биопрепаратов.
Из приведенных на чертеже и в таблицах 1 и 2 данных следует, что в составе осадка фенольно-сульфатной суспензии регистрируется альбумин, а в надосадочном растворе IgG не обнаруживается. Уровни активности антител при хранении плазмы (сыворотки) крови известным способом и в форме фенольно-сульфатной суспензии характеризуются сходными величинами. В таблице 2 приведены характеристики полуфабрикатов иммуноглобулинов и альбуминов, необходимые для дальнейшего их фракционирования с целью производства конечных продуктов, в т.ч. установлено отсутствие бактериальной обсемененности и активности протеаз при хранении плазмы (сыворотки) крови в форме фенольно-сульфатной суспензии.
Таким образом, предложенный способ хранения плазмы (сыворотки) крови обладает выраженным ресурсосберегающим эффектом, в т.ч. не требует оборудования для замораживания плазмы (сыворотки) крови при транспортировке к месту их переработки. Фенольно-сульфатная суспензия сохраняет структуру-функцию белков иммуноглобулиновой и альбуминовой природы в течение 12 месяцев при температуре хранения (10±2)°С. Фракционный состав фенольно-сульфатной суспензии позволяет избирательно получать иммуноглобулиновые и альбуминовые полуфабрикаты для их дальнейшего фракционирования и производства биопрепаратов крови. При этом во фракционном составе фенольно-сульфатной суспензии имеет место увеличение % чистоты целевых белков, как правило, в 2 раза и более.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ изготовления полуфабрикатов иммуноглобулиновых и альбуминовых биопрепаратов из боенской, трупной крови животных, абортной и плацентарной крови человека | 2016 |
|
RU2703537C2 |
| Способ производства гамма-глобулинового полуфабриката с повышенным содержанием противовирусных антител из боенской крови вакцинированных коров | 2018 |
|
RU2696480C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И ДРУГИЕ ИММУНОГЛОБУЛИНОВЫЕ ПРОДУКТЫ | 1999 |
|
RU2197500C2 |
| ИММУНОГЛОБУЛИНОВАЯ ОСНОВА ДЛЯ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ, СУППОЗИТОРИИ И МАЗЬ ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ БАКТЕРИАЛЬНЫХ И ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2361612C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА | 2000 |
|
RU2189833C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОРЕГУЛЯТОРНОГО ГЛОБУЛИНА | 1996 |
|
RU2122863C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА | 2004 |
|
RU2252780C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИТИМОЦИТАРНОГО ГЛОБУЛИНА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ | 2012 |
|
RU2519765C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВ ИЗ ФРАКЦИЙ, КОТОРЫЕ ОБРАЗУЮТСЯ ПРИ ФРАКЦИОНИРОВАНИИ ЧЕЛОВЕЧЕСКОЙ ПЛАЗМЫ КРОВИ | 1996 |
|
RU2157240C2 |
| ПРОТИВОВИРУСНЫЙ ПРЕПАРАТ И СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 1999 |
|
RU2144379C1 |
Изобретение относится к биологической и медицинской промышленности, в частности к технологии хранения и обработки плазмы или сыворотки крови, предназначенной для получения иммуноглобулиновых, альбуминовых и других биопрепаратов крови. Способ заключается в том, что нативную плазму или сыворотку крови обрабатывают химическими реагентами: последовательно вносят фенол до его конечной концентрации (0,7±0,2)%, выдерживают в течение 5 суток при температуре (10±2)°С и затем добавляют сульфат аммония до концентрации 50% от насыщения, полученную суспензию белков хранят при температуре (10±2)°С и избирательно переводят в иммуноглобулиновые и альбуминовые полуфабрикаты путем центрифугирования сульфатных суспензий, с целью раздельного получения осадков иммуноглобуоинов и альбуминов осадки экстрагируют в 1-2% растворе хлорида кальция, малорастворимый сульфат кальция удаляют центрифугированием и целевые белки из надосадочного раствора переосаждают полиэтиленгликолем-6000. Изобретение позволяет хранить плазму или сыворотку крови при 10±2°С без денатурации иммуноглобулинов и альбуминов и на основе ресурсосберегающих подходов, исключающих низкотемпературный режим в процессе хранения, и без использования дорогостоящего оборудования и комплектующих для удаления примесей технологических реагентов, обеспечивающих стабилизацию белков и инактивацию инфекционных агентов. 1 з.п. ф-лы, 2 табл., 1 ил.
| Препараты крови | |||
| Инструктивно-методические материалы по контролю и производству/ Под рук | |||
| С.П | |||
| Буренкова | |||
| - М., 1976, с.203-218 | |||
| СПОСОБ ПРОИЗВОДСТВА ПЛАЗМЫ И ЭРИТРОЦИТНОЙ МАССЫ | 1999 |
|
RU2151617C1 |
| СПОСОБ ПРОИЗВОДСТВА ПЛАЗМЫ И ЭРИТРОЦИТНОЙ МАССЫ | 1999 |
|
RU2151617C1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Способ получения фосфата алюминия | 1974 |
|
SU559895A1 |
| Устройство для автоматического регулирования формы полосы | 1984 |
|
SU1235577A1 |
| Устройство станционной централизации и блокировочной сигнализации | 1915 |
|
SU1971A1 |
| Устройство для автоматического разгона и торможения двигателя станка с ЧПУ | 1985 |
|
SU1297011A1 |
Авторы
Даты
2008-11-20—Публикация
2006-09-04—Подача