Изобретение относится к способу получения иммуноглобулинов из фракций, которые не используют в случае обычного в настоящее время способа фракционирования плазмы для получения клинических препаратов или по меньшей мере не находят применения при получении иммуноглобулиновых препаратов.
В человеческой плазме крови находят свыше ста различных протеинов. Некоторые из них из пулов плазмы донора можно очищать путем фракционирования и применять в качестве терапевтических продуктов. Известны следующие примеры: альбумин используют для компенсации онкотического дефицита при гипопротеинемии или при гиповолемии. Фактор свертывания крови VIII, соответственно IX, вводят для профилактики и терапии кровотечений при гемофилии A, соответственно B. Иммуноглобулины применяют при заболеваниях, связанных с дефицитом антител, для профилактики и терапии инфекций, а также в случае идиопатической тромбоцитопенической пурпуры. Иммуноглобулины от выбранных доноров с высокими содержаниями специфических иммуноглобулинов используют в качестве гипериммуноглобулиновых препаратов для профилактики и лечения специфических инфекций, как, например, гепатит A или B.
Выделение терапевтически применяемых протеинов плазмы можно осуществлять, например, известными методами фракционирования в этаноле (Сonh. E.G. и др. J.Am. Chem. Soc., 68, 459, 1946, а также Kistler P. и Nitschmann H., Vox Sang, 7, 414, 1962). С помощью обоих способов можно выделять большие количества функциональных протеинов плазмы, как альбумин или иммуноглобулины, которые клинически полезны в пригодных формулировках. Однако при переработке по этим методам образуются осадки, соответственно надосадочные жидкости, которые не используют при обычной обработке. Состав этих фракций очень различен.
В то время как, например, человеческий аполипопротеин A-1 (Apo A-I) при осаждении плазмы крови с помощью 19% этанола при pH-значении 5,8 можно обнаружить примерно в равных долях в надосадочной жидкости "а" (примерно 50% Apo-A-1 плазмы) и в осадке A (примерно 40%), тот же самый протеин после самых ближайших стадий фракционирования по Kistler и Nitschmann затем находится в тех фракциях, которые до сих пор коммерчески не использовались: осадок IV и осадок B (примерно по 40%) (Lerch и др., Protides in the Biological Fluids, 36, 409, 1989).
Подобный пример распределения получается для белка caeruI0-плазмина, переносящего медь. После фракционирования находят 20% исходного материала в осадке IV и 40% - осадка B.
Трансферрин является примером протеина плазмы, который в случае этих же способов фракционирования практически до 100% накапливается в осадке IV, в то время как альбумин в количестве вплоть до 80% должен находиться в используемом в настоящее время осадке C.
Иммуноглобулины можно получать путем фракционирования по Kistler-Nitschmann или Cohn в количестве до 50-60% в осадке GG. Остальные 30-40% согласно этим способам распределяются на осадок IV (5%), осадок B (30%) и фильтрат GG (5%).
Вышеуказанные данные в процентах должны иллюстрировать градацию распределения и их не нужно понимать как ограничение; эти данные изменяются в зависимости от применяемых условий и методов.
Эти примеры показывают, что значительные количества терапевтически пригодных протеинов могут находиться отчасти во фракциях осадка IV, осадка В, надосадочной жидкости "с" и надосадочной жидкости GG или в соответствующих фракциях от фракционирования плазмы по Cohn (фракция IV-1, фракция II+III, надосадочная жидкость V и надосадочная жидкость II-1,2). По этическим соображениям, однако также из-за недостатка во всем мире человеческой плазмы крови и известных компонентов плазмы, нужно стремиться к улучшению до сих пор не очень высокого выхода иммуноглобулинов.
Иммуноглобулины играют центральную роль при защите от инфекций. Они либо блокируют вирусспецифические, нейтрализующие антитела, адсорбцию вирусов на клеточных рецепторах и таким образом предотвращают инфекцию, либо затем опсонизируют специфические к бактериям антитела, возбудители и таким образом делают возможным их удаление и гибель за счет нейтрофилов и макрофагов. Пулы плазмы из нескольких тысяч доноров содержат иммуноглобулины очень многочисленных различных специфичностей, и иммуноглобулиновые препараты из таких пулов вследствие этого содержат также измеримые количества иммуноглобулинов, которые направлены против эпитопов вирусов, бактерий, токсинов, однако также против аутоантигенов. Вследствие этого они эффективны против многих инфекций и при самых различных других патологических состояниях. При определенных обстоятельствах, однако, теперь желательно применять иммуноглобулиновый препарат с высокими содержаниями (титрами) специфических антител, так называемый гипериммуноглобулиновый препарат. До сих пор получение таких препаратов было связано с большими затратами, трудностями и высокой стоимостью специальных пулов плазмы доноров с повышенными содержаниями специфических антител. Если, как в случае препарата против гепатита В, имеются известные способы прививки, то нужно делать прививки донорам, производить отбор и доноров обрабатывать отдельно. В случае многих других показаний, однако, иммунизацию доноров не осуществляют по этическим соображениям. Только редко здесь можно обнаруживать путем дорогостоящей операции отбора доноров (например, после перенесения специфической болезни) доноров с высоким титром (содержанием) и путем их обработки получать препарат.
Таким образом задачей настоящего изобретения является способ получения ценных иммуноглобулиновых препаратов из вышеуказанных, до сих пор едва используемых фракций и осадков, которые образуются при промышленных способах фракционирования плазмы, доступны и могут быть выделены. Эти препараты, которые соответствуют гипериммуноглобулиновым препаратам, затем можно перерабатывать в приемлемый, в особенности приемлемый для внутривенного введения, защищающий от вирусов, жидкий или лиофилизированный препарат.
В настоящее время найдено, что получение гипериммуноглобулиновых препаратов, соответственно, иммуноглобулиновых препаратов с высоким содержанием иммуноглобулинов, возможно различными путями по одному из до сих пор известных способов. В этих новых методах применяют иммуноглобулины из общих пулов плазмы, за счет применения фракций - "отходов" улучшают использование ценного сырья плазмы крови и даже имеют возможность получения гипериммуноглобулиновых препаратов с намного более высокими удельными активностями, чем таковые до сих пор известные препараты. Это означает, что с помощью малых вливаемых объемов и незначительных количеств введенных протеинов, т.е. соответственно при незначительной нагрузке реципиента, за короткое время можно вводить высокие дозы специфических иммуноглобулинов. Это становится возможным в предлагаемом согласно изобретению способе за счет наколения специфических иммуноглобулинов благодаря адсорбции на иммобилизированных антигенах, следовательно, благодаря применению обрабатываемых фракций - "отходов" по способу аффинной хроматографии.
Предметом настоящего изобретения является указанный в п.1 формулы изобретения способ.
В предлагаемом согласно изобретению способе впервые обрабатывают получаемую в случае способа фракционирования плазмы фракцию, в особенности являющуюся отходами фракцию, таким образом, что для нее можно применять аффинную хроматографию. В зависимости от происхождения фракции ее обработка может быть различной. Так, например, надосадочную жидкость GG можно концентрировать, диализовать в приемлемом буфере и отфильтровывать. Осадки или осадки на фильтрах (перечни примеров таких исходных материалов приводятся в табл. 1 и 2), напротив, сначала пригодным образом, т.е., например, путем изменения ионной силы (менее 5 М) pH-значения, температуры, путем добавки детергентов и солей, нужно суспендировать таким образом, чтобы солюбилизировать целевые иммуноглобулины. Например, их можно перемешивать в течение ночи при pH 3.0-9.0, при электропроводности 5-20 MS/см, при 4oC и затем осветлять путем центрифугирования и/или фильтрации. Как надосадочные жидкости, так и также суспензии на этой стадии можно подвергать способу инактивации вирусов по методу растворитель/детергент Horowitz (Thrombosis and Haemostasis, 65, 1163, 1991), по способу с метиленовым синим (Mohr и др., Influsionsther. Influsionsmed, 20, 19 (1993)) или другому методу. Иммуноглолубины после суспендирования также можно подвергать предварительной очистке путем предварительной адсорбции на колоночной матрице или путем обработки с помощью пригодного для фильтрации средства или адсорбента, как, например, гидроксид алюминия, путем хроматографирования через протеин A или G для обогащения (накапливания) или путем одного или нескольких осаждений с помощью обычных способов осаждения сульфатом аммония, полиэтиленгликолем или этанолом или путем их комбинации для обогащения, концентрирования или удаления мешающих компонентов.
В нижеследующем перечне указывают примеры возможных лигандов для предлагаемой согласно изобретению аффинной хроматографии:
Антигенные детерминанты:
Haemophilus influenza b, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus agalactiae, Streptococcus pneumonias, Streptococcus pyogenes и другие патогенные штаммы бактерий; Tetanus Toxin, Staphylococcus aureus toxic shock Toxin, и другие патогенные бактериальные или другие токсины, вирус гепатита A, вирус гепатита B, вирус гепатита C, вирус ветряной оспы и опоясывающего лишая, цитомегаловирус, респираторный синцитиальный вирус, парвовирус B19, вирус простого герпеса 1, вирус простого герпеса 2, Tollwut-вирус, и другие патогенные вирусы,
CD2, CD3, CD4, CD5, CD28, CD40, CD72, ICAM: LFA-1, LFA-3, ДНК, фосфолипиды и другие потенциальные человеческие аутоантигены.
После приготовления геля для аффинной хроматографии путем иммобилизации модифицированных или немодифицированных лигандов (примеры таких лигандов приводятся в вышеуказанном перечне) с помощью известных методов их "нагружают" с помощью подготовленных надосадочных жидкостей и суспензий в концентрированной или разбавленной форме, если необходимо, также путем неоднократного введения количества протекающей жидкости. Если необходимо, можно последовательно нагружать одной и той же суспензией различные гели для аффинной хроматографии. Гели затем промывают таким образом, чтобы преобладающе или в достаточном количестве удалить неспецифически связываемые протеины. Это можно осуществлять, например, путем увеличения концентрации соли, путем добавки детергента и/или сдвига pH-значения в промывочном растворе. Связанные протеины теперь отделяют от лигандов, например, путем элюирования при низком или высоком значении pH за счет добавки хаотропных солевых растворов, как тиоцианат натрия или хлорид магния, денатурирующих агентов, как SDS или мочевина, растворителей, как этиленгликоль, путем изменения температуры или путем комбинации этих мер.
В некоторых случаях может оказаться желательным модифицирование иммобилизуемых лигандов благодаря мутагенезу или путем химических или физических способов, так чтобы специфические иммуноглобулины могли связываться со своими эпитопами, однако с меньшим сродством, так что элюирование можно осуществлять при более мягких условиях, чем в случат неизмененных лигандов. Модификацию лигандов можно осуществлять также для того, чтобы облегчить и улучшить их иммобилизацию и/или "представление" их эпитопов. Технические подробности и основы способа аффинной хроматографии в общем описаны в: Cuatrecasas P. и Anfinsen C.B. /1971/ Ann. Rev. Biochem. 40. 259; Kull F.C. и Cuatrecasas P. /1981/, J.Immunol. 126, 1279; Ziebig и др. /1994/, Vox Sang, 67, 117.
Специфические, отделенные иммуноглобулины, при необходимости с помощью дополнительной фильтрации для удаления вирусов, перерабатывают в целевой продукт, который можно применять предпочтительно внутривенно и который пирогенно свободен, защищает от вирусов и стабилен с добавкой или без нее стабилизаторов, как альбумин, аминокислоты или углеводы, в жидкой или лиофилизированной форме. Однако, также можно применять формулировки, которые позволяют осуществлять внутримышечное или топическое применение.
Настоящее изобретение поясняется подробнее, руководствуясь следующими примерами, которые не ограничивают объема охраны изобретения.
Пример 1
Готовят HBS Ag-сефарозу, иммобилизуя 5 мг рекомбинантного поверхностного антигена вируса гепатита B (HBs Ag, Abbott Diagnostics) путем связывания первичных аминогрупп с 1 мл активированной CH-сефарозы по методике изготовителя (Pharmacia Biotech, Ynncana, Швеция), "Плацебо"-сефарозу получают по той же методике, связывая с другой аликвотой геля, но без добавления HBs Ag. Хранят готовые гели в PBS (физиологический раствор с фосфатным буфером) с 0,02% NaN3 при 4oC.
70 г Осадка B из процесса фракционирования плазмы по Kistler-Nitschmann (NB Lot 4.030.216) суспендируют в 210 мл раствора, содержащего 100 мМ лимонной кислоты, pH 4,0, 0,25% Тритона Х-100, 10 мМ N-этилмалеинимида (NEM), 1 мМ фенилметилсульфонилфторида (PMSF), в течение ночи при 4oC, при непрерывном перемешивании. После отделения нерастворимых компонентов путем центрифугирования (5000 g, 4oC, 10 минут) и фильтрации (размер пор 1,2 мкм), при нейтральном значении pH согласно Horowitz и др. (Thrombosis and Haemostasis, 65, 1163, 1991) добавляют 1% три-н-бутил-фосфат (Мерк, Дармштадт, Германия) и 1% Тритон Х-100 и инкубируют при 30oC и при перемешивании в течение 4-х часов. Затем в течение ночи при 37oC осуществляют разделение фаз, отделяют прозрачную надосадочную жидкость и фильтруют через фильтр с размерами пор 0,45 мкм и хранят при 4oC.
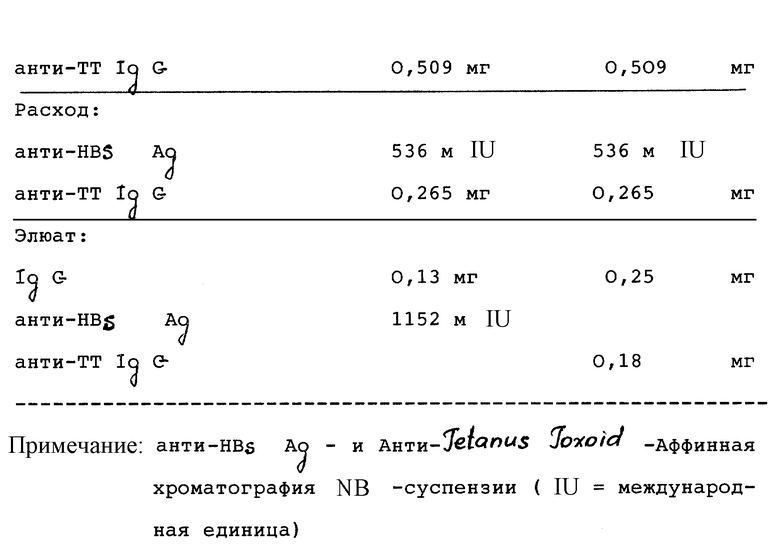
130 мл получившейся NB-суспензии разбавляют 280 мл PBS (буферированный фосфатом солевой раствор, содержащий: 150 мМ NaCl, 10 мМ фосфата натрия, pH 7,1) и при 4oC пропускают через колонку с плацебо-сефарозой и затем через колонку с HBsAg-сефарозой так, чтобы протекающее через колонку количество жидкости снова попадало в сборник. Скорость потока составляет 8 мл/мин в течение 144 часов. NB-суспензию таким образом прокачивают через обе колонки в целом 3 раза. Спустя 90 часов нагружение (заполнение) прерывают и колонки промывают по отдельности сначала PBS и затем раствором, содержащим 200 мМ NaCl, 50 мМ Трис-HCl, pH 7,4, до тех пор, пока оптическую плотность раствора при 280 нм (ОД280) будет менее чем 0,01. После завершения загрузки снова промывают с помощью PBS и раствора, содержащего 200 мМ NaCl, 50 мМ Трис-HCl, pH 7,4. Связанные протеины отделяют с помощью 5 мл 200 мМ глицин-HCl, pH 2,5, тотчас нейтрализуют и обрабатывают. Результаты представлены в таблице 3.
Пример 2
Исходя из Cohn фракции II+III (вместо плазмы крови в качестве исходного материала) осуществляют фракционирование по Kistler-Nitschmann 70 г осадка B (HB Lot 4.044.488)? из этого процесса фракционирования по Kistler-Nitschmann в течение ночи при 4oC во вращающемся аппарате для смешения суспендируют в 210 мл раствора, содержащего 100 мМ лимонной кислоты, pH 4,0, 0,25% Тритона Х-100, 10 мМ NEM, 1 мМ PMSF. После осветления и частичного удаления липидов с помощью ультрацентрифугирования (100000 g, 3 часа, 4oC: прозрачную фазу отбирают путем введения сбоку трубочки с канюлей) суспензию фильтруют (0,45 мкм) и хранят при 4oC.
125 мл NB-суспензии разбавляют в помощью 375 мл PBS и устанавливают pH 7,1 с помощью 0,1 М раствора гидроксида натрия, отфильтровывают и со скоростью 14,5 мл/ч аналогично примеру 1 прокачивают сначала через плацебо-сефароза-гель и затем через HBSAg-сефароза-гель, которые готовят аналогично примеру 3. После этого гели раздельно промывают с помощью PBS и раствора, содержащего 200 мМ NaCl, 50 мМ Трис-HCl, pH 7,4. Связанные протеины выделяют с помощью 5 мл 200 мМ глицин-HCl, pH=2,5. Данные представлены в таблице 4.
Пример 3
30 л Надосадочной жидкости GG (Lot N X95.31.286.1) диафильтруют в PBS и концентрируют до обьема 500 мл. Соответственно примеру 1 концентрат со скоростью 21 мл/ч в течение 118 часов прокачивают через колонки с плацебо и HBS Ag. Колонки промывают и отделяют связанные протеины аналогично приведенной в примере 1 методике, однако, осуществляют дополнительную стадию промывки с помощью раствора, содержащего 500 мМ NaCl, 50 мМ Трис-HCl, pH 7,4. Результаты представлены в табл. 5.
Пример 4
17,5 г DEAE-осадка на фильтре (Lot 4.422.006.0) суспендируют 52,5 мл суспендирующего буфера согласно примеру 1 и обрабатывают. 40 мл суспензии разбавляют с помощью 160 мл PBS, устанавливают pH 7,1 и затем фильтруют. Соответственно примеру 3 суспензию прокачивают в течение 97 часов со скоростью 21 мл/ч через колонки с плацебо и HBS Ag. Колонки промывают и отделяют связанные протеины аналогично приведенной в примере 1 методике. Результаты представлены в табл. 6.
Пример 5
Tetanus Toxoid-C-Сефарозу получают, иммобилизуя 11,5 мг очищенного Tetanus Toxoid (TT) путем связывания карбоксильных групп с 1 мл EAH-сефарозы (Pharmacia Biotech. , Уппсала, Швеция) с помощью 0,1 м N-этил-N' -(3-диметиламинопропил)-карбодимид-HCl по инструкции изготовителя. Готовые гели хранят в PBS с 0,02% NaN3 при 4oC.
Концентрат из надосадочной жидкости GG обрабатывают аналогично методике примера 3 и применяют для аффинной хроматографии с TT-сефарозой аналогично примеру 2. Загрузку осуществляют со скоростью 23,5 мл/ч в течение 159 часов при 4oC. Результаты представлены в табл 7.
Пример 6
Tetanus Toxoid-N-Сефарозу готовят тем, что 11,5 мг очищенного Tetanus Toxoid (TT) иммобилизируют путем связывания первичных аминогрупп с 1 мл активированной CH-сефарозы согласно инструкции изготовителя (Pharmacia Biotech., Уппсала, Швеция). "Плацебо"-сефарозу готовят тем, что осуществляют такой же способ связывания с другой аликвотой геля, но без добавки TT. Хранят готовые гели в PBS с 0,02% NaN3 при 4oC.
Осадок B суспендируют согласно примеру 2. После фильтрации (1.2 мкм) 115 мл этой суспензии разбавляют с помощью 200 мл PBS, устанавливают pH 7,1 и со скоростью 3,5 мл/ч в течение 165 часов прокачивают сначала через Плацебо-сефарозу так, чтобы поток суспензии затем непосредственно проходил через колонку с TT-N-сефарозой и после этого снова попадал в сборник. Колонки промывают раздельно с помощью PBS и затем с помощью раствора, содержащего 0,5 M NaCl, 50 мМ Трис-HCl, pH 7,1, до тех пор, пока ОД280 потока не будет меньше чем 0,01. Результаты представлены в табл. 8.
Пример 7
Осадок В суспендируют согласно методике примера 2. После фильтрации (размер пор фильтра 1,2 мкм) 115 мл этой суспензии разбавляют 200 мл PBS, устанавливают pH 7,1 и со скоростью 5 мл/ч в течение 165 часов прокачивают сначала через HBSAg-сефарозу так, чтобы поток суспензии затем непосредственно проходил через колонку с TT-сефарозой и после этого снова попадал в сборник. Колонки промывают раздельно с помощью PBS и затем с помощью раствора, содержащего 0,5 M NaCl, 50 мМ Трис-HCl, pH 7,1, до тех пор, пока ОД280 потока не будет меньше чем 0,01. Результаты представлены в табл. 9.
Пример 8
15 мг Осадка В из процесса фракционирования по Kistle-Nitschmann (Lot N 5.043.303) в течение ночи при 4oC с помощью вибросмесителя суспендируют в 45 л раствора, содержащего 0,1 M лимонной кислоты, pH 4,0, 0,25% Тритон-Х-100, 10 мМ NEM, 1 мМ PMSF. После отделения нерастворимых компонентов путем добавки вспомогательного для фильтрации средства и фильтрации (размер пор 1,2 мкм) при нейтральном значении pH для удаления липидов и инактивации вирусов согласно Horowitz добавляют 1% три-н-бутилфосфат и 1% Тритон Х-100 и инкубируют при 30oС при перемешивании в течение 4-х часов. После этого в течение ночи при 37oC осуществляют разделение фаз, откачивают прозрачную надосадочную жидкость, фильтруют через фильтр с размерами пор 0,45 мкм и хранят при 4oC.
pH-Значение 40 мл этой HB-суспензии с помощью гидроксида натрия доводят до значения 7,1 и при 4oC прокачивают через колонну с HBS Ag и колонку с Tetanus Toxoid, приготовленные для аффинной хроматографии так, чтобы поток из колонок снова попадал в сборник. Колонки для аффинной хроматографии (50 х 13 мм) готовят путем связывания 250 мг рекомбинантного HBSA, соответственно Tetanus Toxoid, с 25 мл Affiprep-геля (Bio-Rad Lab. Jnc. Hercules CA 94547). Скорость протекающей жидкости составляет 6 л/ч в течение 62 часов. NB-Суспензию таким образом прокачивают в целом 3 раза через колонки. После прекращения загрузки, колонки промывают раздельно сначала с помощью PBS и затем с помощью раствора, содержащего 500 мМ NaCl, 50 мМ Трис-HCl, pH 7,4, до тех пор, пока промывные растворы не будут иметь оптическую плотность при 280 нм (ОД280) меньше чем 0,01. Связанные протеины отделяют с помощью 200 мМ глицин-HCl, pH 2,5 и тотчас устанавливают pH-значение фракций равным 5,2. Результаты представлены в табл. 10. Обработку иммуноглобулинов до стабильных препаратов осуществляют благодаря пулам, содержащим IgG фракций, диафильтрации и концентрирования с 20 мМ NaCl до раствора с 100 IU/мл, соответственно 2,5 мг анти-TT-IgG/мл. Добавляют 10% сахарозы и растворы лиофилизируют до единиц с 200 IU, соответственно 5 мг анти-TT-IgG.
Пример 9
50 г Осадка IV из процесса фракционирования плазмы по Kistler-Nitschmann суспендируют в 500 мл воды. С помощью лимонной кислоты устанавливают pH-значение, равное 5,0, и устанавливают электропроводность = 13 мS с помощью NaCl. После перемешивания в течение ночи при 4oC путем центрифугирования в течение 30 минут при 30000 g и при 4oC достигают осветления и частично удаления липидов. Осуществляют определение содержания в суспензии растворенных протеинов, Ig M, Ig A, Ig G, трансферрина и Caerulo-плазмина, и данные представлены в табл. 11.
Пример 10
50 г Осадка B из процесса фракционирования плазмы по Kistler-Nitschmann (Lot 4.030.204.0) перемешивают в течение ночи при 4oC в 100 мМ раствора лимонной кислоты при различных pH, осветляют путем ультрацентрифугирования при 100000 g при 4oC в течение 3-х часов и частично при этом удаляют липиды. Отбирают прозрачную среднюю фазу и определяют в ней содержание растворенных протеинов, Ig M, Ig A, Ig G, трансферрина и Caerulo-плазмина (табл. 12).
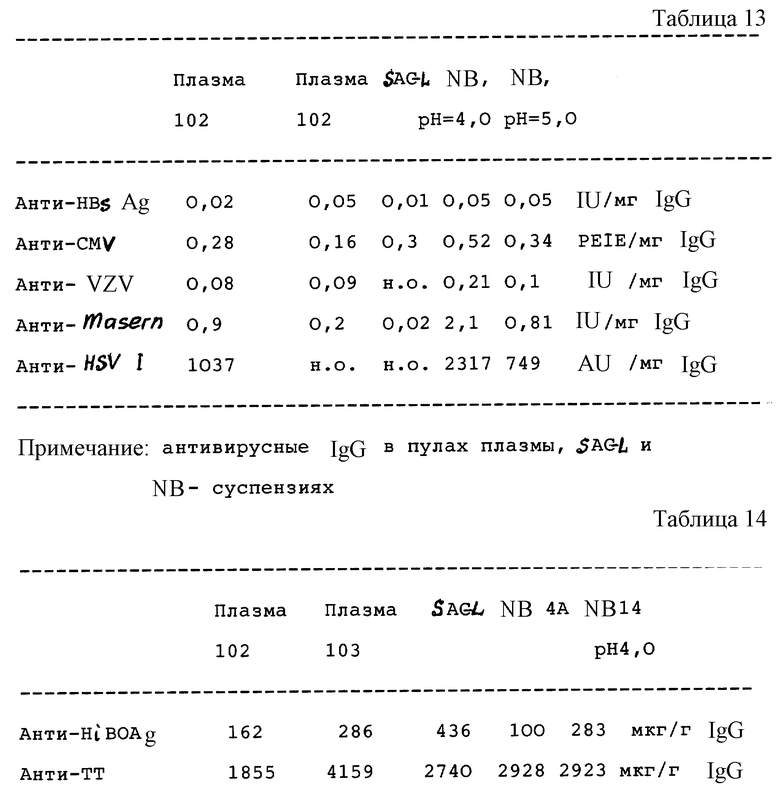
Титр IgG против определенных вирусных (табл. 13) и бактериальных (табл. 14) антигенов определяют и сравнивают с таковым в исходной плазме и существующими иммуноглобулиновыми препаратами.
Плазма 102/103 - пулы плазмы; SAGL-Sando-глобулин: NB, pH 4,0/5,0 - суспензия из осадка B при pH 4,0, соответственно 5,0; IU = международные единицы, PEIE - единицы из Института Paul Ehrlich; AU = произвольные единицы; н.о. - не определено.
Плазма 102/103 - пулы плазмы; SAGL-Sando-глобулин, NB 4A - суспензия из осадка B при pH 4,0; NB 14, pH 4,0 - суспензия из осадка B при pH 4,0 с инактивацией вируса; HiBOAg - Haemophilus influenza B - олигосахарид - антиген; TT - Tetanus Toxoid: SEB - стафилококковый энтеротоксин В; AU - произвольные (примерные) единицы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И ДРУГИЕ ИММУНОГЛОБУЛИНОВЫЕ ПРОДУКТЫ | 1999 |
|
RU2197500C2 |
| ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДИФТЕРИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1999 |
|
RU2174408C2 |
| СПОСОБ ХРАНЕНИЯ ПЛАЗМЫ ИЛИ СЫВОРОТКИ КРОВИ ДЛЯ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВЫХ И АЛЬБУМИНОВЫХ БИОПРЕПАРАТОВ | 2006 |
|
RU2338375C2 |
| ПРОТИВОВИРУСНЫЙ ПРЕПАРАТ И СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 1999 |
|
RU2144379C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ИНГИБИТОРОВ ЛЕЙКОЦИТАРНЫХ ПРОТЕИНАЗ | 1995 |
|
RU2086650C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ЧЕЛОВЕКА ПРОТИВ КЛЕЩЕВОГО ЭНЦЕФАЛИТА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ | 1996 |
|
RU2141342C1 |
| Способ получения иммуноглобулинов | 2016 |
|
RU2708394C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА | 2000 |
|
RU2189833C2 |
| ИММУНОГЛОБУЛИНОВАЯ ОСНОВА ДЛЯ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ, СУППОЗИТОРИИ И МАЗЬ ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ БАКТЕРИАЛЬНЫХ И ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2361612C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ЧЕЛОВЕКА АНТИСТАФИЛОКОККОВОГО ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ | 1996 |
|
RU2141341C1 |











Изобретение относится к способу получения иммуноглобулинов. Получают иммуноглобулиновые препараты с высоким титром тем, что осуществляют последовательно следующие стадии: фракционирование плазмы крови из пула плазмы, при котором отделяют фракцию, которая может быть использована в промышленности и которая содержит поликлональный иммуноглобулин G; приготовление протеинового раствора из протеиновых компонентов; проведение аффинной хроматографии. Полученные иммуноглобулины можно перерабатывать в приемлемый для внутривенного введения, устойчивый при хранении продукт. Технический результат: способ обеспечивает получение иммуноглобулинового препарата, использование фракции человеческой плазмы, которые до сих пор отбрасывались при обычных промышленных способах фракционирования плазмы. 2 с. и 20 з.п. ф-лы, 14 табл.
| Способ получения иммуноглобулинового препарата | 1978 |
|
SU836831A1 |
| US 4617379 A, 14.10.86 | |||
| 0 |
|
SU262555A1 | |
| Способ крашения тканей | 1922 |
|
SU62A1 |
Авторы
Даты
2000-10-10—Публикация
1996-09-23—Подача