Изобретение относится к области химии гетероциклических соединений, а именно, к способу синтеза неизвестных ранее соединений: 3-амино-6-ароилметилен-5-гидрокси-1,2,4-триазинов.
Известные производные 3-амино-1,2,4-триазина получают взаимодействием алифатических дикарбонильных соединений с аминогуанидином в присутствии натриевой щелочи (Merck & Co. Inc., Brit. Pat. 755036; Chem. Abstr 51,8151, 1957). Из доступных заявителю источников известен способ получения 3-амино-6-фенил-1,2,4-триазина взаимодействием водного раствора гидрохлорида аминогуанидина с фенилглиоксальгидратом в присутствии калиевой щелочи (J.B.Ekeley, R.E.Carlson, A.R.Ronzio. Recueil Trav. Chim. Pays-Bas. 59, 496, 1940)
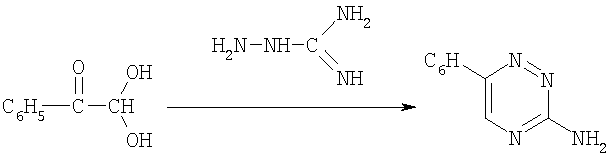
Сведения о биологической активности структурных аналогов не известны.
Недостатком указанных способов является невозможность получения 3-амино-6-ароилметил-5-гидрокси-1,2,4-триазинов в отсутствие экологически опасной щелочи.
Задачей настоящего изобретения является разработка простого способа получения не описанных в литературе 3-амино-6-ароилметил-5-гидрокси-1,2,4-триазинов.
Указанная задача достигается тем, что гидрокарбонат аминогуанидина вводят в реакцию с 5-арил-2,3-дигидрофуран-2,3-дионами или ароилпировиноградными кислотами (R=СН3, ОСН3, ОС2Н5, Cl) при кипячении в безводном диоксане в течение 20-30 минут.
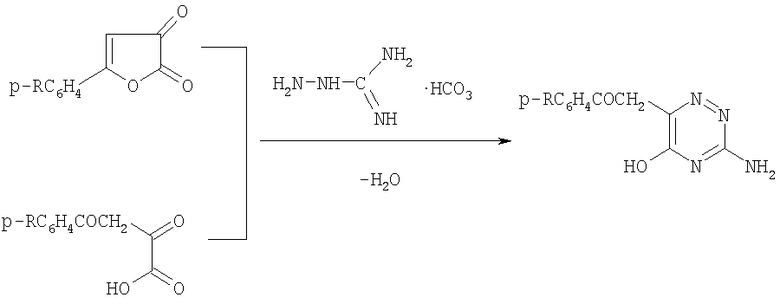
R=СН3, ОСН3, ОС2Н5, Cl
Ниже приведены примеры осуществления предлагаемого способа.
Пример 1. Получение 3-амино-6-п-толуоилметил-5-гидрокси-1,2,4-триазина. К раствору 0.94 г (0.005 М) 5-п-толил-2,3-дигидрофуран-2,3-диона или 1.03 г (0.005 М) п-толуоилпировиноградной кислоты в 20 мл безводного диоксана добавляют 0.61 г (0.005 М) гидрокарбоната аминогуанидина и кипятят 20 мин. Раствор охлаждают, выпавший осадок отфильтровывают и перекристаллизовывают из ДМФА. Получают 1.36 г (83%) вещества. C12H13N4O2. Т.пл. 298-300°С (ДМФА).
Вычислено, %: С = 58.7; Н = 5.3; N = 22.9;
Найдено, %: 058.8; Н = 5.4; N = 22.8.
Пример 2. Получение 3-амино-6-п-метоксибензоилметил-5-гидрокси-1,2,4-триазина. К раствору 1.02 г (0.005 М) 5-п-метоксифенил-2,3-дигидрофуран-2,3-диона или 1.11 г (0.005 М) п-метоксибензоилпировиноградной кислоты в 30 мл безводного диоксана добавляют 0.61 г (0.005 М) гидрокарбоната аминогуанидина и кипятят 30 мин. Раствор охлаждают, выпавший осадок отфильтровывают и перекристаллизовывают из ДМФА. Получают 1.37 г (80%) вещества. C12H13N4O3. Т.пл. 293-295°С (ДМФА).
Вычислено, %: С = 55.1; Н = 5.0; N=21.5;
Найдено, %: С = 55.2; Н = 5.1; N = 21.6.
Пример 3. Получение 3-амино-6-п-этоксибензоилметил-5-гидрокси-1,2,4-триазина. К раствору 1.09 г (0.005 М) 5-п-этоксифенил-2,3-дигидрофуран-2,3-диона или 1.18 г (0.005 М) п-этоксибензоилпировиноградной кислоты в 30 мл безводного диоксана добавляют 0.61 г (0.005 М) гидрокарбоната аминогуанидина и кипятят 30 мин. Раствор охлаждают, выпавший осадок отфильтровывают и перекристаллизовывают из ДМФА. Получают 1.70 г (90%) вещества. С13Н15N4O3. Т.пл. 296-297°С (ДМФА).
Вычислено, %: С = 56.7; Н = 5.4; N = 20.3;
Найдено, %: С = 55.4; Н = 5.2; N = 19.6.
Пример 4. Получение 3-амино-6-п-хлорбензоилметил-5-гидрокси-1,2,4-триазина. К раствору 1.04 г (0.005 М) 5-п-хлорфенил-2,3-дигидрофуран-2,3-диона или 1.13 г (0.005 М) п-метоксибензоилпировиноградной кислоты в 30 мл безводного диоксана добавляют 0.61 г (0.005 М) гидрокарбоната аминогуанидина и кипятят 30 мин. Раствор охлаждают, выпавший осадок отфильтровывают и перекристаллизовывают из ДМФА. Получают 1.48 г (85%) вещества. С11Н10ClN4O2. Т.пл. 300-302°С (ДМФА).
Вычислено, %: С = 49.7; Н = 3.8; N = 21.2; Cl = 13.3;
Найдено, %: С = 49.8; Н = 3.9; N = 21.4; Cl = 13.4.
Спектральные характеристики, подтверждающие структуру 3-амино-6-ароилметил-5-гидрокси-1,2,4-триазинов приведены в таблице 1. ИК спектры соединений сняты на приборе UR-20 в виде пасты в вазелиновом масле, а спектры ПМР на спектрометре РС-60 в растворе ДМСО-d6, внутренний стандарт ГМДС.
Промышленная применимость новых соединений и эффективность предлагаемого способа получения 3-амино-6-ароилметил-5-гидрокси-1,2,4-триазинов подтверждается скринингом на анальгетическую активность по методу «горячей пластинки» (Н.В.Эдди, Д.Леймбах. Фармакология и токсикология. 311, 1960) и противовоспалительной активности на модели «каррагенинового отека» (Методические рекомендации по экспериментальному изучению нестероидных противовоспалительных веществю. Фармкомитет, Москва, 1982). Результаты биологической активности приведены в таблице 2.
2
3
1500
1500
50
25
50
25
43,2
20,3
38,4
18,7
14,8
20,8
Соединения 1-3 в 4,2 раза менее токсичны по сравнению с эталоном сравнения (медицинским препаратом вольтарен). По анальгетической активности они сопоставимы и несколько уступают по противовоспалительному действию. За счет низкой токсичности исследованные соединения превосходят вольтарен по широте терапевтического действия.
Изобретение относится к способу получения неизвестных ранее 3-амино-6-ароилметил-5-гидрокси-1,2,4-триазинов общей формулы:
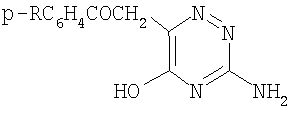
где R = СН3, СН3О, C2H5O, Cl, заключающийся в том, что гидрокарбонат аминогуанидина подвергают взаимодействию с соответствующим 5-арил-2,3-дигидрофуран-2,3-дионом или ароилпировиноградной кислотой при кипячении в безводном диоксане в течение 25-30 минут. Описываемый способ позволяет получать с высоким выходом новые соединения формулы (1), которые проявляют противовоспалительную и анальгетическую активность. 2 н.п. ф-лы, 2 табл.
1. 3-Амино-6-ароилметил-5-гидрокси-1,2,4-триазины общей формулы:
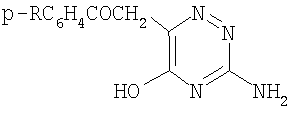
где R - СН3, СН3O, C2H5O, Cl.
2. Способ получения 3-амино-6-ароилметил-5-гидрокси-1,2,4-триазинов общей формулы:

где R - СН3, СН3O, C2H5O, Cl,
заключающийся в том, что гидрокарбонат аминогуанидина вводят в реакцию с 5-арил-2,3-дигидрофуран-2,3-дионом или ароилпировиноградной кислотой при кипячении в безводном диоксане в течение 20-30 мин с последующим выделением целевого продукта известными приемами.
| Catalog Aurora Screening Library, RN 721413-34-9,06.09.2007 | |||
| GB 755036 A Merk @ Co Inc 15.08.1956 | |||
| СПОСОБЫ ПОЛУЧЕНИЯ ЛАМОТРИДЖИНА, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ | 1995 |
|
RU2145602C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3,5-ДИАМИНО-6-(2,3- ДИХЛОРФЕНИЛ)-1,2,4-ТРИАЗИНА | 1999 |
|
RU2231526C2 |
Авторы
Даты
2009-04-20—Публикация
2007-10-08—Подача