Настоящее изобретение относится к получению низших спиртов, особенно к способу получения метанола гетерогенным синтезом с использованием синтез-газа.
Гетерогенный синтез метанола в сегодняшней практике проводят взаимодействием оксидов углерода с водородом в присутствии катализаторов на основе меди в соответствии со следующими уравнениями:

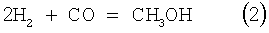
Катализатор синтеза метанола также катализирует реакцию конверсии водяного газа (КВГ),
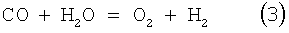
и
обратную реакцию конверсии водяного газа (ОКВГ),

На крупномасштабных заводах получения метанола реактор синтеза в газовой фазе обычно представляет собой охлаждаемый трубчатый реактор или многоступенчатый адиабатический реактор. Типичный интервал температур для синтеза метанола составляет 200-300°С. Охлаждаемые реакторы обычно эксплуатируют при, приблизительно, 250°С, в то время как адиабатические реакторы обычно работают при температуре между 220°С и 300°С. Реакция образования метанола является сильно экзотермической, и эффективный отвод тепла представляет собой проблему. Это ограничивает интервал состава подаваемого газа, который может быть переработан в трубчатом реакторе, например, газы, обогащенные СО, являются очень экзотермическими, и их трудно перерабатывать. Неэффективный отвод тепла ведет к перегреву зон в реакторе, и катализатор может тем самым дезактивироваться быстрее. Серьезную проблему представляет собой образование побочного продукта, которое стимулируется при высоких температурах, возникающих особенно в зонах перегрева. Например, увеличивается при повышенных температурах образование этилового спирта и метилформиата. Спирты, сложные эфиры и кетоны трудно отделять от смесей метанола и воды, которые извлекают из процесса, вследствие образования азеотропов.
Обычное рабочее давление при синтезе метанола лежит в пределах 50-100 бар. Охлаждаемые реакторы работают при давлении около 50 бар, в то время как адиабатические реакторы обычно работают при более высоком давлении, обычно около 80 бар.
Синтез-газ, используемый в синтезе метанола, может быть получен из природного газа либо реформингом природного газа с водяным паром, либо автотермическим реформингом.
Скорость конверсии в метанол определяется константой термодинамического равновесия, которая обычно приводит к концентрациям на выходе из процесса в интервале между 4% и 10% во всех случаях, при только частичной конверсии оксидов углерода. Таким образом, чтобы получить максимальное использование произведенного синтез-газа, необходима рециркуляция непрореагировавшего газа. Высокий коэффициент рециркуляции гарантирует высокую конверсию. Высокий поток рециркуляции через реактор увеличивает расходы на сжатие. Перед рециркуляцией отходящий газ охлаждают и отделяют от жидкого продукта. Отходящий газ может быть обогащен водородом использованием, например, мембранного разделения. Обогащенный газ возвращают в реактор получения метанола. Уровень инертных газов, в частности метана контролируют продувкой.
Кроме указанного выше трубчатого реактора синтеза метанола, обычно используемого в промышленном производстве метанола, в литературе было также предложено использование реакторов синтеза метанола с суспензионным слоем.
Первое изобретение суспензионного реактора было сделано Chem Systems и описано в патенте США US 3888896. В патенте описан процесс получения с использованием инертной органической жидкости, такой как псевдокумол в качестве суспензионной среды.
Самая близкая предшествующая технология представляет собой способ получения метанола и горючего газа (остаточного газа нефтехимического процесса), включающий:
(а) взаимодействие водорода и оксидов углерода при повышенном давлении в жидкофазной системе реакторов в присутствии катализатора синтеза метанола, суспендированного в инертной жидкости, особенно высокомолекулярном углеводороде, с получением метанола и непрореагировавшего синтез-газа, где указанные водород и оксиды углерода подают в поставляемый в реактор синтез-газ, включающий свежий подаваемый синтез-газ, с образованием горючего газа и рециркулирующего синтез-газа; и
(б) отделение указанного метанола от указанного непрореагировавшего синтез-газа и разделение указанного непрореагировавшего синтез-газа на готовый горючий газ и указанный рециркулирующий синтез-газ;
где каждый из указанного подаваемого в реактор синтез-газа, свежего подаваемого синтез-газа и рециркулирующего синтез-газа имеет мольное соотношение R, которое больше 0,1 и меньше 2,0, где R определяют как (Н2-CO2)/(CO2+CO2) относительно мольной концентрации водорода и оксидов углерода.
Эту реакцию проводят при температуре от, приблизительно, 26°С до, приблизительно, 315°С при давлении от, приблизительно, 35 до, приблизительно, 106 бар (см. патент США US 5284878, C07L 27/06, 1994).
Недостаток известного способа состоит в том, что жидкая фаза, в которой суспендирован катализатор, представляет собой дополнительное вещество, которое должно быть введено в реакционную систему и после реакции должно быть отделено от конечного продукта. Эти дополнительные операции усложняют процесс.
Задача изобретения состоит в том, чтобы упростить гетерогенный синтез метанола.
Эту задачу решают предложенным способом получения метанола взаимодействием водорода и оксидов углерода, подаваемых в качестве синтез-газа, в присутствии твердого катализатора, суспендированного в жидкой фазе, с последующим удалением жидкой фазы, содержащей полученный метанол, из реакционной зоны, причем способ характеризуется тем, что взаимодействие водорода и оксидов углерода осуществляют при давлении и температуре, когда метанол, образующийся на катализаторе, конденсируется в жидкую фазу, включающую метанол и воду.
Условия конденсации определяют как рабочие условия синтеза метанола, где насыщенного давления метанола достигают перед тем, как достигают равновесия реакции по составу синтез-газа. Критическая температура для метанола составляет 240°С. Условия неконденсации и конденсации разделяются для данного состава синтез-газа при данной рабочей температуре за счет давления, Plim. Выше этого давления условия конденсации присутствуют, в то время как ниже этого давления существуют условия отсутствия конденсации (см. чертеж).
Поскольку насыщенное давление метанола увеличивается с температурой, а равновесное давление метанола уменьшается с температурой, Plim растет с температурой. Выше кривой насыщения полная мольная фракция метанола в равновесной смеси изображена в виде штриховой линии. Характеристика предпочтительного состава синтез-газа представляет собой нижнее Plim. Типичные условия конденсации для предпочтительных составов синтез-газа лежат при температурах 190-240°С и при давлениях 60-140 бар. В общем, давление в реакторе с суспензионным слоем составляет 50-290 бар, а температура там составляет 150-240°С.
В одном варианте осуществления настоящего изобретения синтез-газ сжимают до давления выше Plim,t и подают в суспензионный реактор синтеза метанола, работающий при температуре t; синтез-газ превращают при контакте с катализатором, активным в синтезе метанола, до степени, где имеют место условия конденсации, получая непосредственно конденсированный готовый метанол и отходящий синтез-газ, насыщенный метанолом; непосредственно конденсированный готовый метанол (состоящий, в основном, из метанола, воды и CO2) составляет жидкую суспендирующую среду для катализатора, активного в синтезе метанола; поток отходящего синтез-газа, обогащенного метанолом, охлаждают и разделяют, достигая дальнейшего улучшения продукта. Непосредственно конденсированный готовый метанол, используемый в качестве суспендирующей жидкости, разделяют обычными способами и отделяют от частиц твердого катализатора, например, фильтрацией. Частицы твердого катализатора возвращают в суспензионный реактор. Образующийся готовый метанол получают как из непосредственно конденсированного метанола, так и метанола, выделенного из отходящего синтез-газа.
Жидкофазный суспензионный реактор представляет собой решение задачи отвода тепла, известной из процессов газофазного синтеза метанола. Реакции образования метанола из оксида углерода и/или диоксида углерода являются сильно экзотермическими. В газофазных реакторах сильно экзотермическая реакция создает зону с высокой температурой, обычно около 280°С или выше внутри трубки с катализатором, которая стимулирует образование побочных продуктов. Получаемые побочные продукты представляют собой, главным образом, высшие спирты, такие как этиловый спирт, пропанол, бутанол, различные сложные эфиры и кетоны. Дорого отделять эти компоненты от готового метанола вследствие образования азеотропов между кетонами, сложными эфирами и метанолом, этиловым спиртом и водой. В качестве другого недостатка катализаторы внутри зон перегрева дезактивируются быстрее. В жидкофазном реакторе тепло реакции поглощается жидкой фазой в жидкости. Температуру можно лучше контролировать, и не образуется зон перегрева. Следовательно, образование побочных продуктов поддерживается на минимальном уровне.
Так как отвод тепла более эффективен в жидкофазном процессе, можно перерабатывать смеси в широком интервале составов газа. В соответствии с этим изобретением можно также использовать синтез-газ, обогащенный СО. Обрабатывали составы смеси синтез-газа в интервале 15-30 об.% СО, 60-74 об.% водорода и 0,5-15 об.% диоксида углерода. При низком содержании диоксида углерода концентрация воды в готовом метаноле будет низкой. В общем, можно использовать синтез-газ, имеющий мольное соотношение CO2/СО 0,02-1,0 и мольное соотношение Н2/СО 2-4.
Способ в соответствии с изобретением обеспечивает высокую конверсию за один проход. Высокую конверсию получают, поскольку конверсия метанола не ограничивается термодинамическим равновесием при условиях конденсации.
По способу в соответствии с изобретением можно обрабатывать синтез-газ, содержащий диоксид углерода. Это выгодно, потому что дорого производить синтез-газ с низким содержанием CO2.
Охлаждение этого процесса можно проводить с использованием охлаждающих труб, производящих среду или пар низкого давления. Эти трубы могут быть расположены в суспензии метанол/вода, и это гарантирует, что температура сохраняется почти на постоянном уровне. Циркуляция жидкости около труб обеспечивает улучшенное распределение и контроль температуры. В трубчатом реакторе с неподвижным слоем зоны перегрева обычно формируются в центре трубки с катализатором, так как реакция является очень экзотермической. Это стимулирует образование побочного продукта, как уже обсуждалось выше.
Даже эффективное регулирование температуры, однако, не предотвращает образование некоторых малых количеств побочных продуктов, включая вышеупомянутые высшие спирты, кетоны и сложноэфирные соединения.
Главное преимущество процесса в соответствии с изобретением состоит в том, что побочные продукты, которые образуются в ходе реакции получения метанола, могут быть повторно возвращены в реактор, и реакционная суспензия, которая посредством химического равновесия между метанолом и побочными продуктами, которые образуются при реакции метанола с реагентами, присутствующими в суспензии, предотвращает массовое образование побочных продуктов, как обсуждается более подробно ниже.
Отделение готового метанола от катализатора может быть выполнено введением фильтров внутрь реактора. Это будет предотвращать уход катализатор из реактора. Другие системы могут включать фильтрацию продукта или его обработку в циклонном сепараторе вне реактора.
Синтез-газ с низким содержанием диоксида углерода дает продукт с низким содержанием воды. Результаты показали, что образование воды составляет около 0,02 г на 1 г метанола
Низкое содержание воды указывает, что реакция конверсии водяного газа протекает активно, и что большая часть получаемой воды потребляется этой реакцией.
Результаты также показывают, что воде (до 10% по массе) можно позволять быть в жидкой фазе без существенной дезактивации катализатора. Концентрация воды в 0,55%
по массе не понижает скорость реакции в высокой степени.
Готовый метанол после реакции при, например, 202°С и давлении 116 бар в процессе в один проход содержит небольшие количества воды (1,64% по массе), диметилового эфира (0,19% по массе), метилформиата (0,92% по массе), этилового спирта (0,29% по массе), метилового эфира уксусной кислоты (0,09% по массе) и диметилового эфира угольной кислоты (0,06% по массе). Кроме того, могут быть обнаружены следы ацетона, диметоксиметана, 1-пропанола, муравьиной кислоты (2-метилэтиловый эфир) и диметилового эфира угольной кислоты (менее 0,03% по массе).
Настоящее новшество обеспечивает средства сохранения концентрации побочного продукта, такой как концентрация метилформиата, на постоянном уровне в реакторе. Метилформиат может быть отделен от готового метанола и повторно возвращен в реактор. При рециркуляции потока, обогащенного метилформиатом, в реактор, будет устанавливаться в реакторе химическое равновесие и не будет происходить массового образования метилформиата. Пример 7 показывает снижение содержания метилформиата в жидкой фазе с 35 мол.% до 5 мол.% при 200°С и давлении 132 бара. При этих условиях реакции (10) и (11) сдвигаются в сторону образования метанола.

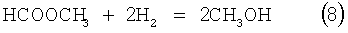
В этом случае активированный коммерческий катализатор, доступный от Haldor Tops⌀e A/S под торговой маркой МК-101Р, используют для получения метанола. Это катализатор на основе Cu/Zn/Al. Также может быть использован ряд других катализаторов для получения метанола.
Полученный сырой метанол может быть использован либо в качестве метанола для топлива, либо может быть ректифицирован в химически чистый метанол.
Примеры
Следующие примеры иллюстрируют результаты, полученные с системой периодического процесса. Состав газов, которые были подвергнуты переработке, приведен в Таблице 1.
Состав синтез-газа
Пример 1
В автоклавный реактор объемом 120 мл загружали активный катализатор и метанол. Активированный МК-101 (в виде порошка) используют в качестве катализатора. Автоклав соединяли с газовым резервуаром, который содержал смесь синтез-газа "А", состоявшую из водорода (60 об.%), азота (5 об.%), оксида углерода (30 об.%) и диоксида углерода (5 об.%), при 21°С и давлении 162 бара. Объем газового резервуара составлял 0,5 л. Процесс проводили в закрытой периодической системе, так что ни газ, ни жидкость не удаляли из системы до тех пор, пока реакция не заканчивалась. Соединение между реактором и газовым резервуаром было открыто. Реакция происходила в автоклаве при постоянном давлении 116 бар и постоянной температуре 202°С. Автоклав перемешивали со скоростью 500 об/мин. Когда протекала реакция, диоксид углерода и водород превращались в метанол и воду. Полученные метанол и воду конденсировали в жидкости. Оксид углерода реагировала с водой, давая водород и диоксид углерода в реакции конверсии водяного газа. Реагенты брали из газового резервуара. Падение давления в газовом резервуаре контролировали и использовали для определения количества использованного газа и, следовательно, количества полученного метанола. По падению давления рассчитывали количество полученного метанола, принимая, что к падению давления приводила реакция (7). Когда давление в газовом резервуаре падало до 121 бара, его снова наполняли до 162 бар, и реакция самопроизвольно протекала до тех пор, пока давление газа в резервуаре не снижалось до 120 бар. Так как состав газа в реакторе изменялся со временем, скорость реакции со временем медленно снижалась. Падение давления, соответствующее расходу 1,7 молей синтез-газа, приводило к образованию 13,4 г готового метанола.
Таблица 2 иллюстрирует количество полученного метанола для выбранных рабочих температур и давлений в представленных примерах.
Пример 2
Пример 1 повторяли при давлении 109 бар и температуре 180°С, но со смесью синтез-газа "Б", состоящей из 74 об.% водорода, 25,5 об.% оксида углерода и 0,5 об.% диоксида углерода. Использовали свежую суспензию катализатора Р с активированным катализатором. Газ брали из газового резервуара при 21,2°С и давлении 168,9 бара. Перемешивание проводили при 500 об/мин. Реакция протекала самопроизвольно до давления в газовом резервуаре 130,6 бара. Получали 6,3 г готового метанола.
Пример 3
Пример 1 повторяли при давлении 137 бар и температуре 200°С с синтез-газом Б из примера 2. Суспензия метанола, содержавшая около 0,8% по массе воды, была из предыдущего эксперимента. Использовали ту же самую суспензию катализатора, как в примере 2. Газ брали из резервуара при давлении 170,4 бара и 21,6°С. Скорость перемешивания была 500 об/мин. При давлении в реакторе 131,4 бара реакцию завершали. Рассчитанный продукт составлял 6,3 г.
Условия получения метанола
Пример 4
Пример 1 повторяли, но при давлении 137 бар и температуре 210°С со смесью синтез-газа "В", состоящей из 60 об.%, водорода, 10 об.% азота, 25 об.% оксида углерода и 5 об.% диоксида углерода. Ту же самую суспензию использовали для 5 предыдущих экспериментов. Газ брали из газового резервуара при 21,2°С и давлении 168 бар. Перемешивание проводили при 500 об/мин. Давление в газовом резервуаре снижалось до 138,4 бар, и резервуар снова наполняли до 167 бар. Реакция протекала самопроизвольно до давления в газовом резервуаре 149 бар. Получали 7,8 г готового метанола.
Пример 5
Пример 1 повторяли, но при давлении 109 бар и температуре 180°С со смесью синтез-газа "Г", состоящей из 60 об.% водорода, 10 об.% азота, 15 об.% оксида углерода и 15 об.% диоксида углерода. Использовали ту же суспензию катализатора, как и в предыдущих экспериментах. Газ брали из газового резервуара при 21,3°С и давлении 162 бара. Перемешивание проводили при 500 об/мин. Реакция протекала самопроизвольно до давления в резервуаре 122 бара. Получали 6,8 г метанола.
Пример 6
Влияние концентрации воды.
Исследовали влияние концентрации воды. Результаты приведены в
Таблице 3.
(6а) Раствор метанола менее 0,05% по массе воды.
Использовали свежий активированный катализатор в суспензии в метаноле с содержанием воды ниже 0,05% по массе. Добавляли синтез-газ Б при рабочих условиях 138 бар и 200°С. Газ брали из газового резервуара при 19,5°С и давлении 167 бар. Давление в резервуаре снижалось до 137 бар. Резервуар снова наполняли дважды до 166 бар. Падение давления составляло 30,2, 21,4 и 4 бара, соответственно, за каждый период. Получали 9,1 г метанола. Концентрация воды в метаноле после эксперимента была 0,48% по массе.
(6б) Раствор метанола 5% по массе воды.
Пример 6а повторяли, но при давлении 139 бар и 200°С, повторно используя тот же самый катализатор, который использовали в примере 6а. Добавляли воду до начальной концентрации 5% по массе в метаноле. Падение давления составляло в целом 48,3 бара, и получили 7,9 г метанола. Концентрация воды в метаноле после эксперимента была 3,6% по массе.
(6в) Раствор метанола 9% по массе воды.
Пример 6а повторяли при давлении 141 бар и 200°С, повторно используя тот же самый катализатор, который использовали в примерах 6а и 6б. Добавляли воду до начальной концентрации 9% по массе в метаноле. Падение давления составляло в целом 47,8 бара, и получили 7,8 г метанола. Концентрация воды после эксперимента была 7,6% по массе.
Получение метанола в присутствии воды для газа Б
Пример 7
Понижение концентрации метилформиата.
Этот пример иллюстрирует, что концентрация избыточного побочного продукта метилформиата может быть существенно понижена путем химического равновесия между водородом, оксидом углерода, метилформиатом и метанолом в реакциях (7) и (8). Следовательно, если поток, обогащенный метилформиатом, рециркулирует в реактор, не будет массового образования метилформиата в реакторе.
Эксперимент протекал с начальной концентрацией метилформиата 34,8 мол.% в суспензии метанола. Эксперимент проводили при 200°С и давлении 132 бара, используя ту же самую процедуру, как в примерах выше. При давлении 132 бара и 200°С реакции (1) и (2) сдвигались в направлении образования метанола. Применяли свежий активированный катализатор. Использовали обогащенный водородом синтез-газ Б. Падение давления в резервуаре составляло 29 бар. Конечная концентрация метилформиата понижалась до 5,4% мол. в жидкой фазе. Это соответствует анализируемой концентрации водорода в сухом газе на выходе около 24 мол.%.
Концентрация в жидкости метилформиата и метанола до и после эксперимента
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ | 1999 |
|
RU2203264C2 |
| СПОСОБ ПРОИЗВОДСТВА МОЧЕВИНЫ, СТАБИЛИЗИРОВАННОЙ ФОРМАЛЬДЕГИДОМ | 2018 |
|
RU2758773C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОЛЕФИНОВ | 2010 |
|
RU2554511C2 |
| СПОСОБ И УСТАНОВКА ДЛЯ КОНВЕРСИИ МОНОКСИДА УГЛЕРОДА И ВОДЫ В ДИОКСИД УГЛЕРОДА И ВОДОРОД С УДАЛЕНИЕМ, ПО МЕНЬШЕЙ МЕРЕ, ОДНОГО ПОЛУЧАЕМОГО ГАЗА | 2010 |
|
RU2532555C2 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ГАЗООБРАЗНОГО УГЛЕРОДСОДЕРЖАЩЕГО СЫРЬЯ (ВАРИАНТЫ) | 2011 |
|
RU2473663C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛЕНОКСИДА | 2010 |
|
RU2547146C2 |
| ОБЪЕДИНЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ МЕТИЛАЦЕТАТА И МЕТАНОЛА ИЗ СИНТЕЗ-ГАЗА И ДИМЕТИЛОВОГО ЭФИРА | 2013 |
|
RU2687234C2 |
| СПОСОБ СИНТЕЗА МЕТАНОЛА | 2003 |
|
RU2345056C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ И ДИМЕТИЛОВОГО ЭФИРА | 2015 |
|
RU2673463C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛМЕРКАПТАНА | 2004 |
|
RU2394023C2 |
Изобретение относится к способу получения метанола взаимодействием водорода и оксидов углерода, подаваемых в виде синтез-газа, в присутствии твердого катализатора, суспендированного в жидкой фазе, с последующим удалением жидкой фазы, содержащей полученный метанол, из зоны реакции. При этом взаимодействие водорода и оксидов углерода проводят при давлении и температуре, обеспечивающих конденсацию образующегося на катализаторе метанола в жидкую фазу, включающую метанол и воду, при этом в зону реакции рециркулируют поток, содержащий метанол и, по меньшей мере, одно из соединений метилформиата и этилового спирта. Изобретение позволяет простым способом получать метанол при высокой конверсии за один проход и избежать массового образования побочных продуктов. 8 з.п. ф-лы, 4 табл., 1 ил.
1. Способ получения метанола взаимодействием водорода и оксидов углерода, подаваемых в виде синтез-газа, в присутствии твердого катализатора, суспендированного в жидкой фазе, с последующим удалением жидкой фазы, содержащей полученный метанол, из зоны реакции, отличающийся тем, что взаимодействие водорода и оксидов углерода проводят при давлении и температуре, обеспечивающих конденсацию образующегося на катализаторе метанола в жидкую фазу, включающую метанол и воду, при этом в зону реакции рециркулируют поток, содержащий метанол и, по меньшей мере, одно из соединений метилформиата и этилового спирта.
2. Способ по п.1, отличающийся тем, что количество воды, присутствующее в жидкой фазе, составляет до 10 мас.%, предпочтительно, до 3 мас.%.
3. Способ по п.1, отличающийся тем, что реакцию проводят при давлении 50-290 бар, предпочтительно 60-140 бар.
4. Способ по п.1, отличающийся тем, что реакцию проводят при температуре 150-240°С, предпочтительно 180-225°С.
5. Способ по п.1, отличающийся тем, что подают синтез-газ, имеющий мольное соотношение СО2/СО 0,02-1,0 и мольное соотношение Н2/СО 2-4.
6. Способ по п.1, отличающийся тем, что подают синтез-газ, содержащий 15-35 об.% СО, 60-74 об.% Н2 и 0-15 об.% CO2.
7. Способ по п.1, отличающийся тем, что он дополнительно включает стадию рециркуляции отходящего газового потока, который выводят из зоны реакции.
8. Способ по п.1, отличающийся тем, что зону реакции охлаждают путем внутреннего охлаждения.
9. Способ по п.1, отличающийся тем, что метанол и/или катализатор добавляют в виде свежего вещества или рециркулируют в зону реакции.
| Способ получения метанола | 1991 |
|
SU1799865A1 |
| US 5284878 A, 08.02.1994 | |||
| 0 |
|
SU306113A1 | |
| US 4312955 A, 26.01.1982. | |||
Авторы
Даты
2009-07-10—Публикация
2004-04-06—Подача