Изобретение относится к области охраны окружающей среды, а именно к очистке отходящих газов предприятий цветной металлургии от диоксида серы с получением элементарной серы. Газы с высоким содержанием диоксида серы образуются при производстве меди, никеля, других металлов из сульфидных руд.
Прямое каталитическое восстановление диоксида серы до элементарной серы с помощью различных восстановителей, в частности сероводорода, монооксида углерода, метана и/или синтез-газа, известно давно. Среди перечисленных газов-восстановителей наибольшее применение на практике нашел сероводород, используемый для восстановления диоксида серы в процессе Клауса. Однако процесс Клауса используется в основном на предприятиях по переработке нефти и природного газа (НПЗ и ГПЗ) прежде всего как способ утилизации сероводорода, а его применение на предприятиях металлургической промышленности ограничено ввиду необходимости создания производства сероводорода для целей очистки. Каталитические процессы с участием метана, монооксида углерода и водорода для извлечения серы широко исследуются в последние годы и рассматриваются как наиболее перспективные и технически приемлемые решения практической реализации процесса десульфуризации отходящих газов химических и металлургических производств.
Преимуществом процесса восстановления диоксида серы метаном является использование в качестве восстановителя доступного и дешевого сырья - природного газа, причем преимущества этого процесса возрастают с повышением концентрации
SO2. К недостаткам процесса восстановления диоксида серы метаном можно отнести высокие рабочие температуры, обычно 780-950°С, что обусловлено необходимостью активации метана, поэтому процесс требует больших энергозатрат на разогрев реакторов. В результате протекания при высоких температурах побочных реакций образуются С, CS и H2S, а в присутствии паров воды возможно также образование СО и COS. Эти и другие причины обусловливают низкий выход серы, не более 65%, и низкую эффективность очистки промышленных газов, что требует установку дополнительных стадий очистки, в том числе от H2S, или увеличения числа реакторов.
В отличие от восстановления диоксида серы метаном процесс восстановления диоксида серы монооксидом углерода и/или водородом можно проводить при низких рабочих температурах, 350-600°С, обеспечивая степень извлечения серы на уровне 85-95%. Существенными недостатками данного процесса являются сильный экзотермический эффект и образование в результате взаимодействия образовавшейся серы с водородом и монооксидом углерода побочных продуктов: H2S и COS, последний из которых является более токсичным, чем SO2. Вместе с этим при определенных условиях проведения процесса, в частности температурах выше 400°С и мольном соотношении восстановителей к диоксиду серы, близком к стехиометрическому значению, CO(H2)/SO2=2, можно снизить образование сероводорода и сульфида карбонила до минимума даже при конверсии диоксида серы на уровне 85-98%. Сульфид карбонила можно также возвращать в цикл, обеспечивая его взаимодействие с диоксидом серы с образованием элементной серы. Минимизировать образование побочных продуктов можно также оптимизацией состава и свойств катализатора.
Катализатор для процесса очистки металлургических газов от диоксида серы путем его восстановления монооксидом углерода и/или водородом должен обладать рядом свойств. Во-первых, иметь высокую активность и селективность по отношению к элементарной сере в широком интервале концентраций диоксида серы от 3.5 об.% (низкоконцентрированные) до 10-40 об.% (высококонцентрированные). Для практического применения катализатор должен обеспечивать высокую конверсию SO2, по крайней мере, 90% и селективность в отношении элементарной серы не менее 90% при температурах 400-500°С и объемных скоростях потока 500-5000 ч-1. Во-вторых, катализатор должен иметь низкую активность по отношению к побочным реакциям, приводящим к образованию H2S и COS при взаимодействии с парообразной серой. В-третьих, обладать устойчивостью к воздействию триоксида серы, кислорода и паров воды, присутствующих в отработанных газах металлургических производств. Указанные соединения могут быть удалены из отработанных газов до их подачи на катализатор сорбционными методами. Триоксид серы можно также удалять термической деструкцией при высоких температурах (около 900°С). Однако описанные выше приемы существенно усложняют технологическое осуществление каталитического процесса очистки металлургических газов от диоксида серы.
В качестве катализаторов в процессах СКВ SO2 монооксидом углерода и/или водородом рассматривают активированный оксид алюминия [Khalafalla, S.E., Haas, L.A., J. Catal. 24 (1972) 115-120], смеси оксидов алюминия и железа, металлы группы железа, нанесенные на оксид алюминия [Doumani, Т.F., hid. Eng. Chem. 36 (1944)
329-332], смешанные оксиды [Kim, H., Appl. Catal. В: Env. 19 (1998) P.233-243; Hibbert, D.B., Campbell, R.H., Appl. Catal. 41 (1988) 289-299] и др. Катализаторы на основе смешанных оксидов переходных металлов, нанесенные на оксид алюминия, являются наиболее активными в реакции восстановления диоксида серы среди изученных катализаторов.
В патентах US 3653833, B01D 53/50, С01В 17/04, 04.04.72 и US 4039650, B01D 53/50, С01В 17/04, 02.08.77 для проведения непрерывного процесса восстановления SO2 в элементарную серу восстановительным газом, выбранным из группы СО, водород, углеводороды C1-C4 и их смеси, преимущественно метан или природный газ, предлагается использовать в качестве катализатора алюминат кальция, боксит, Al2O3, SiO2, V2O5. Описанный способ позволяет очищать газы с содержанием SO2 не менее 30 об.% (в расчете на сухой газ). Для увеличения эффективности очистки в US 3653833 и US 4039650 предлагается использовать последовательно три реактора, при этом на входе во второй и третий реактора в газовую смесь дополнительно подается восстановительная смесь и возможно попеременное изменение потока (реверс потока), что позволяет исключить перегрев реакторов и снизить протекание побочных реакций. Добавление паров элементарной серы в первый реактор позволяет снизить температуру начала реакции и ускорить реакцию в первом реакторе. Недостатком данного процесса является то, что высокая эффективность катализатора достигается преимущественно при 510-1090°С.
В патенте US 4147763, F02M 7/22, 03.04.79 предложен катализатор со структурой шпинели: прямой (А[В]2O4), обращенной (В[АВ]O4) и разупорядоченной, проявляющий высокую активность и селективность в реакции восстановления SO2 монооксидом углерода или водородом из высококонцентрированных смесей (3-20 об.%) в присутствии кислорода и паров воды 450-700°С, скоростях потока
2000-36000 ч-1. Перед использованием проводят восстановительную обработку катализатора в СО или реакционной среде при 700°С в течение 15-45 мин. Катализатор на основе Co3O4 имеет высокую активность в отсутствии кислорода, a CoFe2O4, CoCr2O4 и CoV2O4 - в присутствии кислорода.
В патенте US 5384301, B01D 53/86, B01J 23/10, 24.01.95 описаны катализаторы для процесса извлечения серы из промышленных газовых выбросов, содержащих 1-10 об.% SO2, путем каталитического восстановления SO2 газом-восстановителем: СО, водород, природный газ или их смеси. Предлагаемые катализаторы имеют общую формулу:
[(FO2)l-n(RO)n]l-kMk, либо [(FO2)l-n(RO1,5)n]l-kMk, либо [LnxZrl-xO2-0,5x]l-kMk, где "F" - Се, Th, Hf, Та, Zr; "R" - Be, Mg, Ca, Sr, Ba; "M" - Mn, Fe, Co, Ni, Cu, Zn, Mo, Rh, Pd, Ag и Pt. Катализаторы обладают высокой активностью при соотношении СО/SO2, близком к стехиометрическому (~2), 300-800°С и скорости потока 500-100000 ч-1.
В патенте US 5494879, B01J 23/74, 37.02.96 предлагается оксидный катализатор сложного состава, содержащий оксиды Fe, Ni и Со с оксидами Mo, Mn или Cr, нанесенные на носители на основе SiO2, γ-Al2O3, молекулярные сита 5А и 13Х. Катализатор готовят методом пропитки растворами нитратов соответствующих солей с последующим прокаливанием при 600-1000°С, что приводит к стабилизации активного компонента в кристаллических структурах типа шпинели или перовскита. Катализатор оптимального состава 30 мас.% Fe4CoNiMoCr2Mn2O18/γ-Al2O3 в широком интервале эксплуатационных параметров 5000-15000 ч-1, 440-480°С и (Н2+СО)/SO2=2 и Н2/СО=0.75 обеспечивает высокую конверсию SO2 (90-94%) и выход элементарной серы (до 93-96%). Для повышения эффективности предложено первоначально нагревать катализатор до 700-800°С в течение 2 ч, а потом поддерживать температуру процесса в области 440-480°С. Для повышения эффективности очистки предлагается возвращать H2S и COS обратно в реакционную среду.
Катализатор, описанный в US 5494879, является наиболее близким к заявляемому по технической сущности. К недостаткам известного катализатора можно отнести узкий диапазон температур (440-480°С), в которых катализатор обеспечивает высокую степень извлечения серы, и необходимость высокотемпературной активации катализатора.
Задача, решаемая изобретением: достижение высокой эффективности очистки металлургических газов, содержащих не менее 15 об.% диоксида серы, путем восстановления на катализаторе диоксида серы в элементарную серу монооксидом углерода и/или водородом при варьировании соотношения СО/водород от 1/1 до 1/3 и при температурах от 450 до 700°С.
Поставленная задача решается следующим образом. Катализатор для восстановления диоксида серы в металлургических газовых выбросах, в том числе предприятий цветной металлургии, включающий оксиды переходных металлов, и носитель, в качестве оксидов содержит оксид Cu1-xMxCr2O4 со структурой шпинели в количестве 5-35 мас.%, где М - переходный металл, выбранный из группы Fe, Co, Ni, значение х изменяется от 0-0,5; а в качестве носителя - оксид алюминия, в том числе модифицированный добавкой оксида церия; при следующем соотношении компонентов, мас.%: Cr - 3-12, Cu - 0,1-5,0; металл переходной группы - 0,01-2,50, РЗМ - 0-15, оксид алюминия - остальное.
В частном случае катализатор дополнительно содержит оксиды хрома (III, VI) в количестве не более 7.5 мас.%. В частном случае катализатор дополнительно содержит оксиды меди (I, II) в количестве не более 4.5 мас.%.
Процесс СКВ SO2 смесью СО и Н2 проводят на катализаторе при температурах 450-650°С и скоростях газового потока 500-5000 ч-1, соотношениях H2/CO в интервале 1-3 (синтез-газ, коксовый газ), обеспечивая выход элементной серы на уровне 85-95% при соотношении СО+Н2/SO2, близком к стехиометрическому (1,8-2,25).
Заявляемый катализатор готовят следующим образом.
В качестве носителя используют оксид алюминия, чистый или модифицированный добавками оксида церия, с удельной поверхностью 150-250 м2/г. Модифицирование гранул пористого алюмооксидного носителя добавками оксида РЗМ проводят методом пропитки по влагоемкости раствором соответствующей соли нитрата РЗМ (в частности, Се) заданной концентрации. Пропитанные гранулы сушат на воздухе при 70-120°С и прокаливают при 500°С в течение 4 ч. Содержание оксидов РЗМ в носителе варьируют в интервале от 1 до 15 мас.%.
Метод капиллярной пропитки по влагоемкости (способ 1)
Гранулы пористого алюмооксидного носителя, в том числе модифицированного добавкой оксида церия, пропитывают по влагоемкости раствором бихроматов меди и/или переходного металла из группы Fe, Со, Ni, заданной концентрации. Пропитанные гранулы сушат на воздухе при 70-120°С и прокаливают при 600-900°С в течение 3-4 ч для формирования структуры шпинели. Содержание хромата меди в катализаторах, рассчитанное из данных атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой (АЭС-ИСП), варьируют в интервале от 5 до 35 мас.%. Метод пропитки по влагоемкости является наиболее простым в технологическом исполнении и наиболее безотходным.
Метод последовательной капиллярной пропитки по влагоемкости (способ 2)
Гранулы пористого алюмооксидного носителя, в том числе модифицированного добавкой оксида церия, пропитывают по влагоемкости в две стадии, сначала смешанным раствором солей меди или переходного металла из группы Fe, Co, Ni. Пропитанные гранулы сушат на воздухе при 70-120°С и прокаливают при 400°С в течение 4 ч. Далее гранулы пропитывают раствором соединения хрома, заданной концентрации; сушат и прокаливают при 600-900°С в течение 4 ч для формирования структуры шпинели. Пропитку можно проводить наоборот. В качестве пропиточных растворов используют смешанные растворы нитратов меди и/или переходного металла из группы Fe, Co, Ni, раствор нитрата хрома или раствор хромовой кислоты или ее водорастворимых солей. Содержание хромата меди в катализаторах, рассчитанное из данных АЭС-ИСП, варьируют от 5 до 20 мас.%. Описанный метод позволяет готовить катализаторы с соотношением Cu/Cr в интервале 0,25-2,0.
Метод наосаждения на поверхность носителя (способ 3)
Гранулы пористого алюмооксидного носителя, в том числе модифицированного добавкой оксида церия, пропитывают по влагоемкости совместным раствором азотнокислых солей меди и хрома с мольным соотношением Cu/Cr в растворе в пределах 0,48-0,52.. Пропитанные гранулы сушат на воздухе при 70-120°С и обрабатывают 10%-ным раствором карбоната или гидрокарбоната аммония с рН 6,5-7,5 при температуре 70-80°С. Катализатор промывают дистиллированной водой, сушат и прокаливают при 700°С в течение 3-4 ч для формирования структуры шпинели. Содержание хромата меди в катализаторах, рассчитанное из данных АЭС-ИСП, варьируют в интервале от 5 до 20 мас.%.
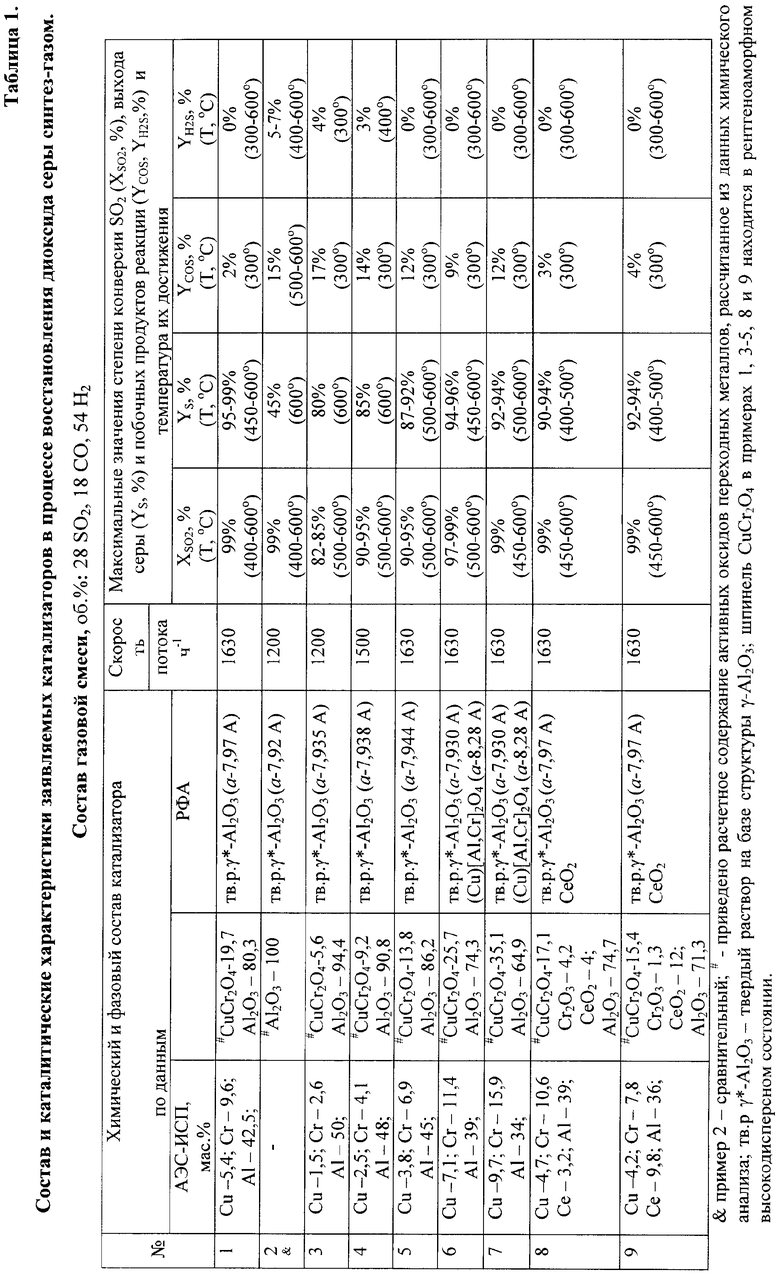
Каталитические свойства образцов изучали на лабораторной установке, оборудованной проточным реактором, в интервале температур от 300 до 600°С и объемной скорости потока 500-5000 ч-1. Реакционная газовая смесь содержала, об.%: SO2 (15-30), монооксида углерода (15-54), водорода (15-54), пары воды (до 15), CO2 (до 15) и аргон, при соотношении (СО+Н2)/SO2 в интервале 1,8-2,25. Активность образцов характеризовали степенью превращения SO2 (XSO2, %), монооксида углерода (ХСО, %) и водорода (ХН2, %) и выходом элементарной серы (YS, %), COS
(YCOS, %) и сероводорода (YH2S, %).
Сущность изобретения иллюстрируется следующими примерами.
Пример 1. Катализатор готовят по методу 1.
В качестве пористого алюмооксидного носителя используют сферический γ-Al2O3 с удельной поверхностью 180 м2/г, который пропитывают раствором бихромата меди и прокаливают при 700°С. Содержание Cu и Cr по данным АЭС-ИСП составляет 5,4 и 9,6 мас.%, соответственно или 19,7 мас.% в расчете на CuCr2O4 и 1,1 мас.% в расчете на Cr2O3. Оксид алюминия Al2O3 - остальное. Катализатор имеет форму сферических гранул диаметром 1,5-1,8 мм.
Для исследования активности фракцию катализатора (1,5-1,8 мм) в количестве 1 см3 загружают в проточный реактор диаметром 20 мм. Со скоростью 20 см3/мин подают реакционную смесь, содержащую, об.%: 28 SO2, 18 СО и 54 Н2. Поднимают температуру от 300 до 600°С и проводят хроматографический анализ газовой смеси при каждой температуре. По данным хроматографического анализа с учетом изменения объема реагентов и продуктов реакции проводят расчет степени превращения SO2 (XSO2, %) монооксида углерода (ХСО, %) и водорода (ХН2, %), и выхода элементарной серы (YS, %), сульфида карбонила (YCOS, %) и сероводорода
(YH2S, %).
При 1630 ч-1 и составе газовой смеси, об.%: 28 SO2, 18 СО и 54 Н2 катализатор обеспечивает конверсию SO2 на уровне 92% при 400°С и 99,5% при 450°С и выше; выход серы составляет 91-93% при 400°С и 99% при 450-600°С; максимальный выход COS достигается при 300°С и составляет 2%, при 400°С и более высоких температурах образования COS и H2S не наблюдается.
Примеры 2-7. (0, 5, 10, 15, 25 и 35 мас.% CuCr2O4).
Способ приготовления катализатора аналогичен примеру 1, отличие заключается в содержании оксида CuCr2O4 шпинельной структуры. Содержание оксида CuCr2O4 составляет 0, 5, 10, 15, 25 и 35 мас.%. Каталитические свойства приведены в таблице 1.
Из данных таблицы 1 видно, что степень превращения диоксида серы и выход серы возрастают с увеличением содержания оксида CuCr2O4 до 15-20 мас.% и практически не изменяются при более высоких содержаниях активного оксида. При температурах 450-600°С выход серы составляет 92-99%. Максимальное образование COS наблюдается при температуре 300°С и существенно снижается при температурах выше 300°С, при этом минимальный выход COS обеспечивают катализаторы с содержанием оксида CuCr2O4, близким к 20 мас.%.
Примеры 8-9. Аналогичны примеру 1, отличие заключается в том, что для приготовления катализатора используют носитель на основе γ-Al2O3, модифицированного оксидом церия. Удельная поверхность модифицированного оксида алюминия 210 м2/г. Содержание оксида церия составляет 4,0 мас.% (здесь и далее в расчете на СеО2) в примере 8 и 12 мас.% в примере 9.
При условиях, указанных в примере 1, катализаторы обеспечивают конверсию SO2 на уровне 99,5% при 450°С, выход серы на уровне 90-94% в интервале температур 400-600°С, помимо серы при 300°С в продуктах реакции фиксируется COS (YCOS=3%).
Из примеров №№8 и 9 (таблица 1) видно, что приготовление катализатора на пористом алюмооксидном носителе, модифицированном добавками оксидов РЗМ, в основном церия, обеспечивает снижение температуры, при которой наблюдается высокая селективность образования элементарной серы (до 400°С), и высокую эффективность удаления серы при высоких температурах.
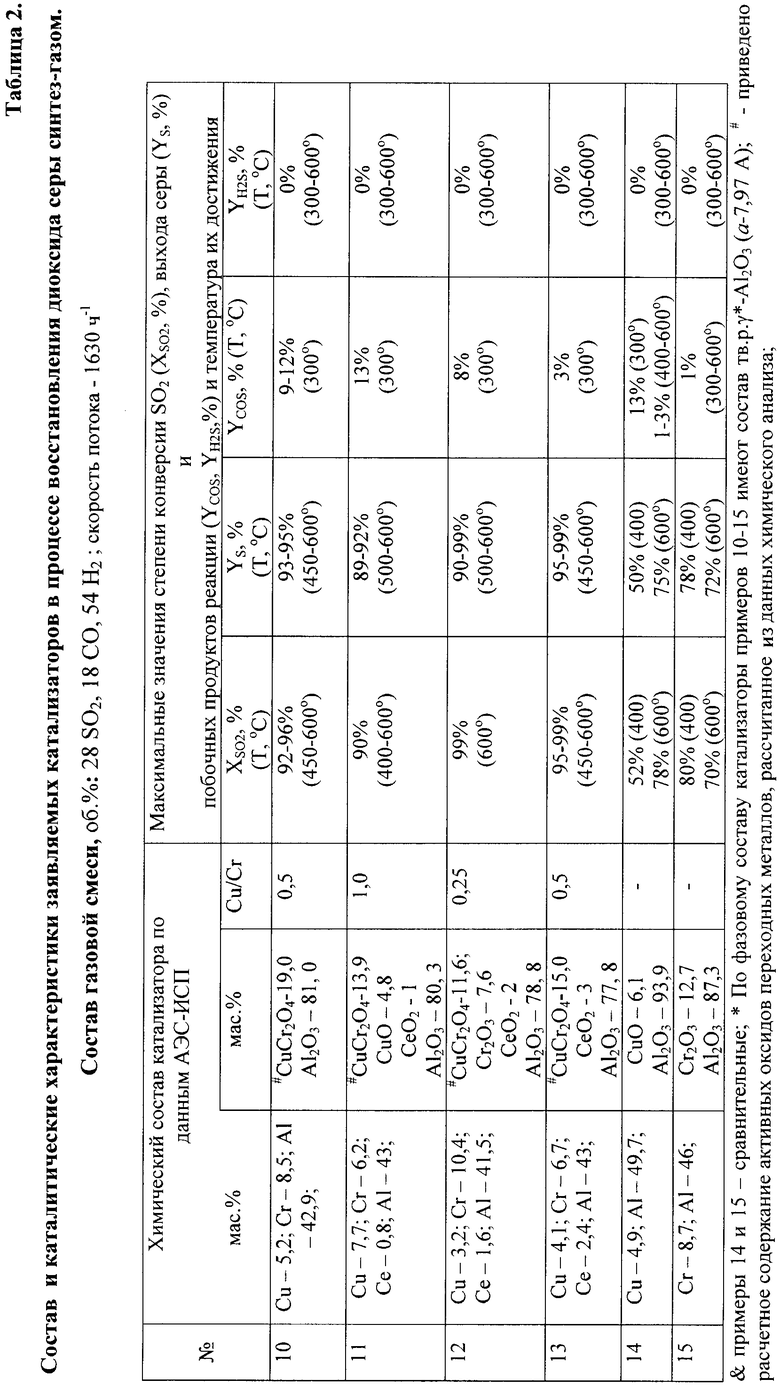
Пример 10. Катализатор готовят по методу 2.
В качестве пористого алюмооксидного носителя используют сферический γ-Al2O3 с влагоемкостью 0,5 см3/г, который пропитывают раствором нитрата меди с концентрацией 105 мг Cu/см3, сушат и прокаливают при 400°С. Далее пропитывают раствором хромой кислоты, H2Cr2O7, с концентрацией 170 мг Cr/см3, сушат и прокаливают при 700°С. Содержание Cu и Cr по данным АЭС-ИСП составляет 5,2 и 8,5 мас.%, соответственно, или 19,0 мас.% в расчете на CuCr2O4; носитель - остальное. Катализатор имеет форму колец с внешним диаметром 6-8 мм, внутренним диаметром 3-5 мм и длиной 5-7 мм, для измерения активности используют фракцию катализатора размером 1,5-1,8 мм.
При условиях, аналогичных примеру 1, катализатор обеспечивает конверсию SO2 на уровне 86% при 400°С и 92-96% при 450-600°С; выход серы составляет 86% при 400°С и 93-95% при 450-600°С; выход COS составляет 9-12% при 300°С, при 400°С и более высоких температурах образования COS и H2S не наблюдается.
Пример 11. Аналогичен примеру 10. Отличие заключается в том, что носитель последовательно пропитывают растворами хромовой кислоты с концентрацией 138 мг Cr/см3, а затем раствором нитрата меди с концентрацией 170 мг Cu/см3. В качестве пористого носителя используют сферический γ-Al2O3, модифицированный оксидом церия 1 мас.%, с влагоемкостью 0,45 см3/г. Содержание Cu и Cr по данным АЭС-ИСП составляет 7,7 и 6,2 мас.%, соответственно, атомное соотношение Cu/Cr - 1; оксид алюминия - остальное. Расчетное содержание CuCr2O4 составляет 13,9 мас.%, излишек меди, не связанный в структуру шпинели, кристаллизуется в виде оксида меди, его расчетное содержание составляет 4,8 мас.%.
При условиях, аналогичных примеру 1, катализатор обеспечивает конверсию SO2 на уровне 60% при 400°С и 90% при 500-600°С; выход серы составляет 89-92% при 500-600°С; максимальный выход COS достигается при 300°С и составляет 13%, при 400°С и более высоких температурах образования COS и H2S не наблюдается.
Пример 12. Аналогичен примеру 10. Отличие заключается в том, что носитель последовательно пропитывают растворами хромовой кислоты с концентрацией 208 мг Cr/см3, а затем раствором нитрата меди с концентрацией 64 мг Cu/см3. В качестве пористого алюмооксидного носителя используют сферический γ-Al2O3, модифицированный оксидом церия 2 мас.%, с влагоемкостью 0,5 см3/г. Содержание Cu и Cr по данным АЭС-ИСП составляет 3,2 и 10,4 мас.%, соответственно, атомное соотношение Cu/Cr - 0,25; Al2O3 - остальное. Расчетное содержание CuCr2O4 составляет 11,6 мас.%, излишек хрома, несвязанный в структуру шпинели, кристаллизуется в виде оксида хрома (III), его расчетное содержание - 7,6 мас.%.
При условиях, аналогичных примеру 1, катализатор обеспечивает конверсию SO2 на уровне 82% при 400°С и 99% при 600°С; выход серы составляет 80% при 400°С, 90 при 500°С и 99% при 600°С; максимальный выход COS достигается при 300°С и составляет 8%, при 400°С и более высоких температурах образования COS и H2S не наблюдается.
Пример 13. Катализатор готовят по способу 3.
Для этого 85 г гранул пористого алюмооксидного носителя, модифицированного добавкой оксида церия в количестве 3 мас.% и имеющего влагоемкость 0,52 см3/г, пропитывают 45 мл раствора, содержащего азотнокислые соли меди и хрома с концентрацией 93,5 мг Cu/мл и 152 мг Cr/мл, соответственно. Пропитанные гранулы сушат на воздухе при 70-120°С и обрабатывают 500 мл 10%-ного раствора карбоната или гидрокарбоната аммония с рН 6,8 при температуре 80°С. Катализатор промывают дистиллированной водой, сушат и прокаливают при 700°С в течение 4 ч для формирования структуры шпинели. Содержание Cu и Cr по данным АЭС-ИСП составляет 4,1 и 6,7 мас.%, соответственно, или 15,0 мас.% в расчете на CuCr2O4. Катализатор имеет форму сферических гранул диаметром 1,5-1,8 мм.
При условиях, аналогичных примеру 1, катализатор обеспечивает конверсию SO2 на уровне 90% при 400°С и 95-99% при 450°С и выше; выход серы составляет 90% при 400°С и 95-99% при 450-600°С; выход COS составляет 3% при 300°С, при 400°С и более высоких температурах образования COS и H2S не наблюдается.
Пример 14. (сравнительный). Катализатор готовят по способу 2.
Для этого гранулы алюмооксидного носителя с влагоемкостью 0,4 см3/г пропитывают раствором меди азотнокислой с концентрацией 129 мг Cu/мл, далее сушат и прокаливают при 700°С в течение 4 ч. Содержание Cu по данным АЭС-ИСП составляет 4,9 мас.%; оксид алюминия - остальное. Медь по данным РФА кристаллизуется в виде высокодисперсного оксида меди (II). Катализатор имеет форму сферических гранул диаметром 1,5-1,8 мм.
При условиях, аналогичных примеру 1, катализатор обеспечивает конверсию SO2 на уровне 52% при 400°С и 78% при 600°С; выход серы составляет 50% при 400°С и 75% при 600°С; выход COS составляет 13-15% при 300°С и 3-1% при 400-600°С; образования H2S не наблюдается.
Пример 15. (сравнительный). Катализатор готовят по способу 2.
Гранулы алюмооксидного носителя с влагоемкостью 0,6 см3/г пропитывают раствором хромовой кислоты с концентрацией 159 мг Cr/мл, сушат и прокаливают 4 ч при 700°С. Содержание Cr по данным АЭС-ИСП составляет 8,7 мас.%; оксид алюминия - остальное. Хром по данным РФА кристаллизуется в виде высокодисперсного оксида хрома (III), а по данным ЭПР входит в состав твердого раствора ионов хрома (III) в оксиде алюминия и в состав Cr2O3. Катализатор имеет форму сферических гранул размером 1,5-1,8 мм.
При условиях, аналогичных примеру 1, катализатор обеспечивает конверсию SO2 на уровне 80% при 400°С и 70% при 600°С; выход серы составляет 78% при 400°С и 72% при 600°С; максимальный выход COS составляет 1% при 300-600°С.
Из данных таблицы 2 видно, что каталитические свойства катализатора, содержащего оксид CuCr2O4 в количестве 10-20 мас.%, практически не зависит от способа приготовления катализатора, в частности: капиллярной пропитки раствором бихромата меди (пример №1), капиллярной пропитки растворами меди и хрома азотнокислого (пример №10) и наосаждения (пример №13). Степень превращения диоксида серы и выход серы составляют 92-99% в интервале температур 400-600°С. От способа приготовления и соотношения Cu/Cr зависит селективность по отношению к сульфиду карбонила, количество COS минимально в случае использования способов 1 и 3 для приготовления катализаторов. Во всех случаях эксплуатация катализаторов температурах выше 400°С позволяет исключить образование сульфида карбонила. Снижение или увеличение соотношения Cu/Cr от значения 0,5, характерного оксиду CuCr2O4 со шпинельной структурой, приводит к изменению каталитических свойств, при этом увеличение содержания оксида меди (II) и оксида хрома (III) способствуют увеличению низкотемпературной активности (400°С, пример №11) и стабильности катализатора в области высоких температур (600°С, пример №12), соответственно. Таким образом, формирование оксида CuCr2O4 со шпинельной структурой (примеры №1, 10-13) позволяет расширить температурную область параметров эксплуатации катализатора 400-600°С и существенно улучшить каталитические характеристики системы (конверсию диоксида серы и выход серы), например, по сравнению с однокомпонентными катализаторами (примеры №14 и №15).
Пример 16-19. Аналогичны примеру 1, отличие заключается в том, что для приготовления катализатора используют смешанный раствор бихромата меди и кобальта (или железа, или никеля). Катализатор содержит 18-21 мас.% Cu1-xMxCr2O4, где М - катион кобальта, железа или никеля; соотношение М/Cu составляет 0,05-0,50. Химический состав и каталитические характеристики приведены в таблице 3.
При условиях, аналогичных примеру 1, катализатор обеспечивает в зависимости от природы катиона М (Со, Fe, Ni) конверсию SO2 на уровне 89-99% при 600°С, выход серы 82-99% при 500-600°С, сульфида карбонила - не более 5% при 300°С и выход H2S не фиксируется при 300-600°С.
Из данных таблицы 3 видно, что введение второго катиона в шпинель (примеры №16-19) позволяет варьировать оптимальную рабочую температуру при эксплуатации катализатора без существенного снижения каталитических характеристик (конверсии диоксида серы и селективности по сере). Это позволяет снизить экзотермический эффект реакции и тем самым предотвратить перегрев катализатора.
Видно, что заявляемые составы катализаторов на основе оксида со структурой шпинели CuCr2O4 или Cu1-xMxCr2O4, где М - катион переходного металла (Fe, Co, Ni), обеспечивают конверсию диоксида серы на уровне не ниже 99% при температуре не выше 600°С из газовых смесей, содержащих до 33 об.% SO2 и выход элементарной серы на уровне не ниже 87% при температуре 400-600°С. Оптимальный состав заявляемых катализаторов определяется требованиями технологического процесса восстановления диоксида серы из промышленных газов: температура и степень очистки. Катализатор может иметь различную геометрическую форму: сферические гранулы, черенки, кольца, блоки сотовой структуры.
Преимуществом предлагаемых составов катализатора является их высокая активность и селективность в процессе восстановления диоксида серы монооксидом углерода и/или водородом при температурах 400-600°С, скорости потока 500-5000 ч-1 и при различном составе восстановительной смеси, в качестве которой могут быть использованы синтез-газ с соотношением Н2/СО:
1) равным 3 и характерным для парового риформинга метана (H2/СО=3);
2) равным 2 и характерным для парциального окисления метана (Н2/СО=2);
3) равным 1 и характерным для паровой конверсии углей (Н2/СО=1).
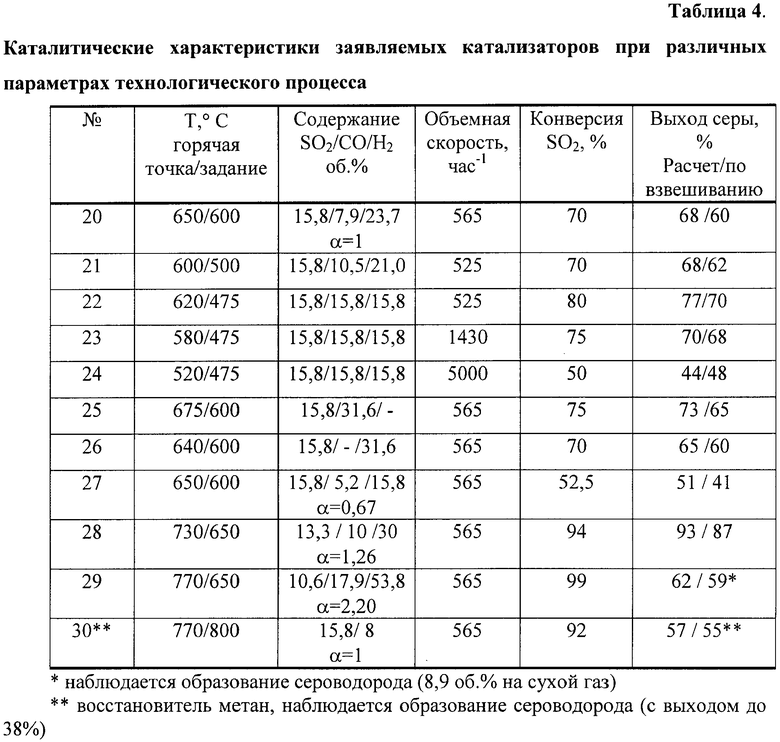
Это иллюстрируется примерами №20-27 (таблица 4).
Пример 20. Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно; оксид алюминия - остальное. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Образец в количестве 220 см3 загружают в проточный реактор диаметром 60 мм. Со скоростью 124 л/ч (объемная скорость 565 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 7,9 СО и 23,7 На (СО/Н2=1/3), азот - остальное. Поднимают температуру на обмотке печи до 600°С, при этом температура в печи составляет 650°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 650/600°С обеспечивает конверсию SO2 на уровне 70%, выход серы составляет 70%, в продуктах реакции фиксируется образование COS в количестве не более 0,6 об.%.
Пример 21. Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно; оксид алюминия - остальное. Катализатор имеет форму цилиндров диаметром 4-5 мм и длиной 4-5 мм. Отличие составляют условия испытаний образца катализатора.
Образец в количестве 220 см3 загружают в проточный реактор диаметром 60 мм. Со скоростью 115 л/ч (объемная скорость 525 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 10,5 СО и 21,0 Н2 (CO/H2=1/2), азот - остальное. Поднимают температуру на обмотке печи до 500°С, при этом температура в печи составляет 600°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 600/500°С обеспечивает конверсию SO2 на уровне 70%, выход серы составляет 68%, в продуктах реакции фиксируется COS и H2S в количестве не более 0,8 об.%.
Пример 22. Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно; оксид алюминия - остальное. Катализатор имеет форму сферических гранул диаметром 4-5 мм. Отличие составляют условия испытаний образца катализатора.
Образец в количестве 220 см3 загружают в проточный реактор диаметром 60 мм. Со скоростью 115 л/ч (объемная скорость 525 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 15,8 СО и 15,8 Н2 (CO/H2=1/1), азот - остальное. Поднимают температуру на обмотке печи до 475°С, при этом температура в печи составляет 620°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 620/475°С обеспечивает конверсию SO2 на уровне 80%, выход серы составляет 77%, в продуктах реакции не фиксируется COS и H2S.
Пример 23. Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Условия испытаний катализатора аналогичны таковым из примера 22, отличие заключается в том, что газовую смесь подают на катализатор со скоростью 315 л/ч, т.е. объемная скорость потока составляет 1430 ч-1. Поднимают температуру на обмотке печи до 475°С, при этом температура в печи составляет 580°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 580/475°С обеспечивает конверсию SO2 на уровне 75%, выход серы составляет 70%, в продуктах реакции не фиксируется COS и H2S.
Пример 24. Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Условия испытаний катализатора аналогичны таковым из примера 22, отличие заключается в том, что газовую смесь подают на катализатор со скоростью 1100 л/ч, т.е. объемная скорость потока составляет 5000 ч-1. Поднимают температуру на обмотке печи до 475°С, при этом температура в печи составляет 520°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 520/475°С обеспечивает конверсию SO2 на уровне 50%, выход серы составляет 44%, в продуктах реакции не фиксируется COS и H2S.
Пример 25 (сравнительный). Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно; оксид алюминия - остальное. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Отличие заключается в условиях тестирования. Образец в количестве 220 см3 загружают в проточный реактор диаметром 60 мм. Со скоростью 115 л/ч (объемная скорость 565 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 31,6 СО (CO/H2=1/0), азот - остальное. Поднимают температуру на обмотке печи до 600°С, при этом температура в печи составляет 675°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 600/675°С обеспечивает конверсию SO2 на уровне 75%, выход серы составляет 73%, в продуктах реакции фиксируется образование COS в количестве 3-4 об.% при 400-600°С.
Пример 26 (сравнительный). Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Отличие заключается в условиях тестирования. Образец в количестве 220 см3 загружают в проточный реактор диаметром 60 мм. Со скоростью 115 л/ч (объемная скорость 565 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 31,6 H2 (СО/Н2=0/1), азот - остальное. Поднимают температуру на обмотке печи до 600°С, при этом температура в печи составляет 640°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 600/640°С обеспечивает конверсию SO2 на уровне 70%, выход серы составляет 65%, в продуктах реакции фиксируется образование H2S в количестве не более 1 об.% при 400-600°С.
Пример 27 (сравнительный). Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Отличие заключается в условиях тестирования, а именно соотношение SO2/восстановитель отличается от стехиометрического значения (1/2, α=1).
Образец в количестве 220 см3 загружают в проточный реактор диаметром 60 мм. Со скоростью 115 л/ч (объемная скорость 565 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 5,2 СО, 15,8 Н2 (СО/Н2=1/3, α=0,67), азот - остальное. Поднимают температуру на обмотке печи до 600°С, при этом температура в печи составляет 650°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 600/650°С обеспечивает конверсию SO2 на уровне 52,5%, выход серы составляет 51%, в продуктах реакции не фиксируется образование COS и H2S.
Пример 28. Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Отличие заключается в условиях тестирования, а именно соотношение SO2/восстановитель отличается от стехиометрического значения (1/2, α=1).
Образец в количестве 220 см3 загружают в проточный реактор диаметром 60 мм. Со скоростью 115 л/ч (объемная скорость 565 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 5,2 СО, 15,8 Н2 (СО/Н2=1/3, α=1,26), азот - остальное. Поднимают температуру на обмотке печи до 650°С, при этом температура в печи составляет 730°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 650/730°С обеспечивает конверсию SO2 на уровне 94%, выход серы составляет 93%, в продуктах реакции не фиксируется образование COS и H2S.
Пример 29 (сравнительный). Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Отличие заключается в условиях тестирования, а именно соотношение SO2/восстановитель отличается от стехиометрического значения (1/2, α=1).
Образец в количестве 220 см3 загружают в проточный реактор диаметром 60 мм. Со скоростью 115 л/ч (объемная скорость 565 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 17,9 СО, 53,8 Н2 (CO/H2=1/3, α=2,2), азот - остальное. Поднимают температуру на обмотке печи до 650°С, при этом температура в печи составляет 770°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 650/770°С обеспечивает конверсию SO2 на уровне 99%, выход серы составляет 62%, в продуктах реакции фиксируется образование H2S в количестве 9 об.% на сухой газ.
Пример 30 (сравнительный). Состав катализатора аналогичен примеру 9. Содержание Cu, Cr и Се составляет 4,2; 7,8 и 12, соответственно. Катализатор имеет форму сферических гранул диаметром 4-5 мм.
Отличие заключается в условиях тестирования, а именно в качестве восстановителя используют метан, например из природного газа. Соотношение SO2/метан соответствует стехиометрическому значению (2/1, α=1).
Образец в количестве 220 см3 загружали в проточный реактор диаметром 60 мм. Со скоростью 115 л/ч (объемная скорость 565 ч-1) подают реакционную смесь, содержащую, об.%: 15,8 SO2; 8 метана, азот - остальное. Поднимают температуру на обмотке печи до 800°С, при этом температура в печи составляет 770°С, проводят хроматографический анализ газовой смеси.
Катализатор при температуре 800/770°С обеспечивает конверсию SO2 на уровне 92%, выход серы составляет 57%, в продуктах реакции фиксируется образование H2S с выходом до 38%.
Из примеров №20-24 и №27-29 видно, что использование в качестве восстановителя синтез-газа с соотношением монооксид углерода к водороду в пределах от 1/1 до 1/3 позволяет проводить процесс восстановления диоксида серы при температуре 500-600°С, при этом варьирование содержания монооксида углерода позволяет регулировать количество выделяющего тепла и выход серы. Процесс восстановления диоксида серы преимущественно требует присутствия обоих восстановителей - монооксида углерода и водорода - в газовой смеси, что позволяет увеличивать конверсию диоксида серы и выход серы. Использование в качестве восстановителя метана (пример №30) приводит к необходимости увеличения энергозатрат на обогрев реакторов до температур 800°С и выше и к необходимости введения дополнительных стадий очистки от побочных продуктов реакции.
Из примеров №22-24 видно, что процесс восстановления диоксида серы на заявляемых катализаторах имеет удовлетворительные характеристики при скоростях потока до 5000 ч-1, хотя предпочтительным является организация процесса при скорости потока до 1500 ч-1, поскольку с увеличением скорости потока наблюдается снижение выхода серы.
Из примеров №27-29 видно, что предпочтительными являются использование катализатора и проведение процесса при соотношениях восстановитель/SO2, близких к стехиометрическому значению (CO+H2)/SO2=2, т.е. α=1. Незначительное уменьшение или увеличение коэффициента избытка восстановителя от α=1 (например, до 1,26 в примере 28) не влияет на конверсию диоксида серы и селективность процесса к элементарной сере, выход серы составляет около 93% (см. примеры №22 и №28). В то время как значительное уменьшение коэффициента избытка восстановителя от α=1 (например, до 0,67 в примере 27) приводит к существенному снижению конверсии диоксида серы с 94% (пример 28) до 52,5% (пример 27) и, следовательно, к снижению эффективности процесса очистки металлургических газов от диоксида серы. Значительное увеличение коэффициента избытка восстановителя от α=1 (например, до 2,2 в примере 29) приводит к существенному снижению селективности процесса по отношению к элементарной сере, например, с 93% (пример 28) до 62% (пример 29), и, следовательно, к снижению степени извлечения элементарной серы. Снижение селективности процесса восстановления диоксида серы приводит к образованию побочных серосодержащих соединений, таких как сероводород и сульфид карбонила, что требует дополнительных стадий очистки.
Заявляемый процесс восстановления диоксида серы синтез-газом различного состава на заявляемых составах катализатора, содержащего оксиды Cu1-xMxCr2O4 со структурой шпинели и оксид алюминия, в том числе модифицированный добавками редкоземельных элементов в качестве носителя, имеет следующие преимущества:
1) процесс протекает при температурах 400-600°С, что на 200-300°С ниже по сравнению с процессом восстановления диоксида серы метаном (650-900°С), это делает заявляемый процесс привлекательным с точки зрения энергосбережения;
2) при оптимальных условиях процесс восстановления диоксида серы синтез-газом обеспечивает высокие выходы серы, более 80%.

| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ОЧИСТКИ ГАЗОВЫХ ВЫБРОСОВ ОТ ДИОКСИДА СЕРЫ | 2008 |
|
RU2369436C1 |
| КАТАЛИЗАТОР И СПОСОБ ВОССТАНОВЛЕНИЯ ДИОКСИДА СЕРЫ | 2008 |
|
RU2369435C1 |
| КАТАЛИЗАТОР (ВАРИАНТЫ) И СПОСОБ ВОССТАНОВЛЕНИЯ ДИОКСИДА СЕРЫ ИЗ СЕРОСОДЕРЖАЩИХ ГАЗОВ (ВАРИАНТЫ) | 2010 |
|
RU2445162C2 |
| Каталитическая композиция на основе оксидных соединений титана и алюминия и ее применение | 2021 |
|
RU2775472C1 |
| СПОСОБ ДОЖИГАНИЯ ОТХОДЯЩИХ ГАЗОВ | 2003 |
|
RU2232129C1 |
| КАТАЛИТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРИГОДНАЯ ДЛЯ КАТАЛИТИЧЕСКОГО ВОССТАНОВЛЕНИЯ СЕРНИСТОГО СОЕДИНЕНИЯ, СОДЕРЖАЩЕГОСЯ В ГАЗОВОМ ПОТОКЕ, И СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ТАКОЙ КОМПОЗИЦИИ | 2008 |
|
RU2461424C2 |
| СПОСОБ СНИЖЕНИЯ ОБЩЕГО СОДЕРЖАНИЯ СЕРЫ В ГАЗАХ, ВКЛЮЧАЮЩИХ СЕРОВОДОРОД И ДРУГИЕ СОДЕРЖАЩИЕ СЕРУ КОМПОНЕНТЫ | 1997 |
|
RU2177361C2 |
| Катализатор гидрирования и гидролиза сернистых соединений в отходящих газах процесса Клауса и способ его применения | 2023 |
|
RU2812535C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛМЕРКАПТАНА | 2004 |
|
RU2394023C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ МЕТИЛМЕРКАПТАНА | 2008 |
|
RU2497588C2 |
Изобретение относится к области охраны окружающей среды, а именно к очистке отходящих газов предприятий цветной металлургии от диоксида серы с получением элементарной серы. Описан катализатор очистки газовых выбросов от диоксида серы в процессе восстановления диоксида серы до элементарной серы смесью монооксида углерода и водорода, содержащий оксиды переходных металлов и носитель, в качестве оксида он содержит оксид Cu1-xMxCr2O4 со структурой шпинели в количестве 5-35 мас.%, где М - переходный металл, выбранный из группы Fe, Co, Ni, x=0-0,5; а в качестве носителя - оксид алюминия, в том числе модифицированный добавкой оксида церия; при следующем соотношении компонентов, мас.%: Cr 3-12, Cu 0,1-5,0; металл переходной группы 0,01-2,50, церий 1-15, оксид алюминия - остальное. Описаны три варианта способа приготовления этого катализатора и его применение в процессе очистки газовых выбросов. Технический результат - процесс протекает при температуре 400-600°С, обеспечивает выходы серы более 80%. 5 н. и 3 з.п. ф-лы, 4 табл.
1. Катализатор очистки газовых выбросов от диоксида серы в процессе восстановления диоксида серы до элементарной серы смесью монооксида углерода и водорода, включающий оксиды переходных металлов и носитель, отличающийся тем, что в качестве оксида он содержит оксид Сu1-xMxCr2O4 со структурой шпинели в количестве 5-35 мас.%, где М - переходный металл, выбранный из группы: Fe, Co, Ni, x=0-0,5; а в качестве носителя - оксид алюминия, в том числе модифицированный добавкой оксида церия; при следующем соотношении компонентов, мас.%: Cr 3-12, Cu 0,1-5,0; металл переходной группы 0,01-2,50, церий 1-15, оксид алюминия - остальное.
2. Катализатор по п.1, отличающийся тем, что он дополнительно содержит оксиды хрома (III, VI) в количестве не более 7,5 мас.%.
3. Катализатор по п.1, отличающийся тем, что он дополнительно содержит оксиды меди (I, II) в количестве не более 4,5 мас.%.
4. Катализатор по п.1, отличающийся тем, что катализатор имеет форму сферических, кольцеобразных, цилиндрических гранул или блоков сотовой структуры.
5. Способ приготовления катализатора очистки газовых выбросов от диоксида серы в процессе восстановления диоксида серы до элементарной серы смесью монооксида углерода и водорода, включающий пропитку носителя растворами предшественника оксидов переходных металлов, сушку и термообработку, отличающийся тем, что в качестве пропиточного раствора используют раствор бихроматов меди и/или переходного металла из группы Fe, Co, Ni; сушку катализатора проводят при температуре 70-120°С, а термообработку при 600-900°С в течение 3-4 ч для формирования шпинельной структуры, при этом получают катализатор со структурой шпинели состава: Cu1-xMxCr2O4 в количестве 5-35 мас.%, где М - переходный металл, выбранный из группы: Fe, Со, Ni, х=0-0,5; а в качестве носителя - оксид алюминия, в том числе модифицированный добавкой оксида церия; при следующем соотношении компонентов, мас.%: Cr 3-12, Cu 0,1-5,0; металл переходной группы 0,01-2,50, церий 1-15, оксид алюминия - остальное.
6. Способ приготовления катализатора очистки газовых выбросов от диоксида серы в процессе восстановления диоксида серы до элементарной серы смесью монооксида углерода и водорода, включающий пропитку носителя растворами предшественника оксидов переходных металлов, сушку и термообработку, отличающийся тем, что нанесение оксида со структурой шпинели проводят пропиткой носителя в две стадии, сначала смешанным раствором солей меди или переходного металла из группы Fe, Со, Ni, затем раствором соединения хрома, или наоборот; в качестве пропиточных растворов используют смешанные растворы нитратов меди и/или переходного металла из группы Fe, Со, Ni, раствор нитрата хрома или раствор хромовой кислоты или ее водорастворимых солей; сушку катализатора проводят при температуре 70-120°С, а термообработку при температуре 600-900°С для формирования шпинельной структуры, при этом получают катализатор со структурой шпинели состава: Cu1-xMxCr2O4 в количестве 5-35 мас.%, где М - переходный металл, выбранный из группы: Fe, Со, Ni, х=0-0,5; а в качестве носителя - оксид алюминия, в том числе модифицированный добавкой оксида церия; при следующем соотношении компонентов, мас.%: Cr 3-12, Cu 0,1-5,0; металл переходной группы 0,01-2,50, церий 1-15, оксид алюминия - остальное.
7. Способ приготовления катализатора очистки газовых выбросов от диоксида серы в процессе восстановления диоксида серы до элементарной серы смесью монооксида углерода и водорода, включающий пропитку носителя растворами предшественника оксидов переходных металлов, сушку и термообработку, отличающийся тем, что носитель пропитывают совместным раствором азотнокислых солей меди и хрома с мольным соотношением Cu/Cr в растворе в пределах 0,48-0,52; пропитанные гранулы сушат на воздухе при 70-120°С и обрабатывают 10%-ным раствором карбоната или гидрокарбоната аммония с рН 6,5-7,5 при температуре 70-80°С; гранулы промывают дистиллированной водой, сушат и прокаливают при 700°С в течение 3-4 ч для формирования структуры шпинели, при этом получают катализатор со структурой шпинели состава: Cu1-xMxCr2O4 в количестве 5-35 мас.%, где М - переходный металл, выбранный из группы: Fe, Co, Ni, x=0-0,5; а в качестве носителя - оксид алюминия, в том числе модифицированный добавкой оксида церия; при следующем соотношении компонентов, мас.%: Cr 3-12, Cu 0,1-5,0; металл переходной группы 0,01-2,50, церий 1-15, оксид алюминия - остальное.
8. Способ очистки газовых выбросов от диоксида серы в процессе восстановления диоксида серы до элементарной серы смесью монооксида углерода и водорода в присутствии катализатора, включающего в свой состав оксиды переходных металлов и носитель, отличающийся тем, что процесс используют для очистки промышленных газовых выбросов, содержащих 5-35 об.% диоксида серы, включая металлургические газы, процесс проводят при объемной скорости потока 500-5000 ч1, соотношении восстановитель/SO2=1,8-2,25 и температуре 450-700°С, в качестве восстановителя используют смесь монооксида углерода и водорода с соотношением СО/Н2 в пределах 1/1-1/3, а в качестве катализатора используют катализатор по любому из пп.1-4 или приготовленный по любому из пп.5-7.
| US 5494879 A, 27.02.1996 | |||
| US 4147763 A, 03.04.1979 | |||
| КАТАЛИЗАТОР ДЛЯ СЕЛЕКТИВНОГО ОКИСЛЕНИЯ СОЕДИНЕНИЙ СЕРЫ И СПОСОБ СЕЛЕКТИВНОГО ОКИСЛЕНИЯ СОЕДИНЕНИЙ СЕРЫ ДО ЭЛЕМЕНТАРНОЙ СЕРЫ | 1990 |
|
RU2070089C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭЛЕМЕНТНОЙ СЕРЫ ИЗ ОТХОДЯЩИХ ГАЗОВ, СОДЕРЖАЩИХ ДИОКСИД СЕРЫ | 2002 |
|
RU2221742C2 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2009-11-20—Публикация
2008-08-14—Подача