ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам производства, очистки и получения белков-протеаз.
УРОВЕНЬ ТЕХНИКИ
Доказано, что многие белки, вовлеченные в коагуляционный каскад, в том числе, например, фактор VII, фактор VIII, фактор IX, фактор X, и фактор XIII, являются эффективными терапевтическими средствами для лечения различных патологических состояний. В целом, компоненты крови, принимающие участие в коагуляционном “каскаде”, являются проферментами или зимогенами, ферментативно неактивными белками, которые преобразуются в протеолитические ферменты под воздействием активатора, который сам является активирующимся фактором свертывания крови. Факторы коагуляции, которые подвергались такому преобразованию, в целом относятся к «активированным факторам» и обозначаются добавлением строчной буквы «а» (например, активированный фактор VII (FVIIa)).
Из-за множества неудобств, возникающих при использовании человеческой плазмы в качестве источника фармацевтических препаратов, предпочтительно получать такие белки в рекомбинантных системах. Однако белки коагуляции подвергаются различным котрансляционным и постранляционным модификациям, включая, например, аспарагин-связанное (N-связанное) гликозилирование, О-связанное гликозилирование, и γ-карбоксилирование остатков глутаминовой кислоты. По этой причине предпочтительно получать их в клетках млекопитающих, которые способны изменить рекомбинантные белки соответствующим образом.
При получении белков коагуляции из культур микроорганизмов или клеточных линий заключительным шагом получения является извлечение и, необязательно, концентрирование интересующего продукта. Культуральная среда, в которой росли клетки и которая содержит секретированные белки, и, в частности, клеточные лизаты, содержащие интересующие внутриклеточные белки, также содержит, в большей или меньшей степени, другие белки, продуцирующиеся клетками, а также другие примеси, такие как компоненты среды, нуклеиновые кислоты и тому подобное. Для получения очищенного белкового продукта необходимо отделить интересующий белок от других белков и полипептидов и других примесей сырого материала, содержащего интересующий белок.
Патент США 5700914 относится к способу очистки FVII, где, по крайней мере, присутствует цинк на одной из стадий очистки.
Обычно, на стадиях культивирования, очистки и в общепринятых способах получения лекарственных средств, активированные белки коагуляции имеют тенденцию деградировать из-за протеолитической функции белков. Таким образом, в данной области существует необходимость в улучшении способов культивирования, очистки и получения лекарственных средств, содержащих активированные белки коагуляции с целью снижения деградации при получении белков коагуляции, особенно рекомбинантных полипептидов фактора VII человека или пептидов, связанных с фактором VII.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в широком аспекте к очистке протеаз. Процесс, описанный здесь, может использоваться для очистки любой протеазы, в том числе факторов коагуляции FXII/FXIIa, FXI/FXIa, FX/FXa, FIX/FIXa, FVII/FVIIa, тромбина, и антикоагулянтов С-белкового происхождения. Предпочтительно процесс может использоваться для очистки рекомбинантных протеаз, полученных из клеточной культуры. Предпочтительно процесс может использоваться для очистки сериновых протеаз, содержащих остатки GLA (гамма-карбоксиглутаминовой кислоты), витамин К-зависимых факторов коагуляции VIIa, IXa, Xa, активированного белка С и тромбина.
Более предпочтительными сериновыми протеазами, содержащими домен с остатками GLA (гамма-карбоксиглутамат), являются полипептид фактора IX, а именно FIXa. Еще более предпочтительными сериновыми протеазами, содержащими домен с остатками GLA (гамма-карбоксиглутамат), являются полипептид фактора VII, а именно FVIIa.
В первом аспекте настоящее изобретение относится к способу получения очищенной сериновой протеазы, содержащей GLA-остаток, где способ включает:
(i) культивирование клетки-хозяина, экспрессирующей сериновую протеазу, содержащую GLA-остаток, в культуральной среде в условиях, подходящих для экспрессии сериновой протеазы, содержащей GLA-остаток;
(ii) восстановление всей или части культуральной среды, включающей сериновую протеазу, содержащую GLA-остаток; и
(iii) очистку сериновой протеазы, содержащей GLA-остаток, от культуральной среды;
где концентрация свободных ионов кальция в стадии (iii) выше 1,2 мM или ниже 0,10 мM; и/или
где концентрация свободных ионов другого двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (iii) выше 0,025 мM; и/или
где pH в стадии (iii) ниже 7,5 или выше 8,6.
Во втором аспекте настоящее изобретение относится к способу получения очищенного полипептида фактора VII, где способ включает:
(i) культивирование клетки-хозяина, экспрессирующей полипептид фактора VII, в культуральной среде в условиях, подходящих для экспрессии полипептида фактора VII;
(ii) восстановление всей или части культуральной среды, содержащей полипептид фактора VII; и
(iii) очистку полипептида фактора VII от культуральной среды;
где концентрации свободных ионов кальция в стадии (iii) выше 1,2 мM или ниже 0,10 мM; и/или
где концентрация свободных ионов другого двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (iii) выше 0,025 мМ; и/или
где pH в стадии (iii) ниже 7,5 или выше 8,6.
В третьем аспекте настоящее изобретение относится к способу получения очищенной сериновой протеазы, содержащей GLA-остаток, включающему:
(i) культивирование клетки-хозяина, экспрессирующей сериновую протеазу, содержащую GLA-остаток, в культуральной среде в условиях, подходящих для экспрессии сериновой протеазы, содержащей GLA-остаток;
(ii) восстановление всей или части культуральной среды, содержащей сериновую протеазу, содержащую GLA-остаток; и
(iii) очистку сериновой протеазы, содержащей GLA-остаток от культуральной среды;
где молярное отношение ионов кальция и сериновой протеазы, содержащей GLA-остаток (Ca2+:сериновая протеаза, содержащая GLA-остаток) в стадии (iii) выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (iii) выше 0,025 мМ; и/или
где pH в стадии (iii) ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу получения очищенного полипептида фактора VII, где способ включают:
(i) культивирование клетки-хозяина, экспрессирующей полипептид фактора VII, в культуральной среде в условиях, подходящих для экспрессии полипептида фактора VII;
(ii) восстановление всей или части культуральной среды, содержащей полипептид фактора VII; и
(iii) очистку полипептида фактора VII из культуральной среды;
где молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII) в стадии (iii) выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (iii) выше 0,025 мМ; и/или
где pH в стадии (iii) ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу очистки сериновой протеазы, содержащей GLA-остаток, где способ включает:
(i) восстановление всего или части раствора, содержащего сериновую протеазу, содержащую GLA-остаток; и
(ii) очистку сериновой протеазы, содержащей GLA-остаток, из расвора;
где молярное отношение ионов кальция и сериновой протеазы, содержащей GLA-остаток (Ca2+:сериновая протеаза, содержащая GLA-остаток) в стадии (ii) выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (ii) выше 0,025 мМ; и/или
где pH в стадии (ii) ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу очистки полипептида фактора VII, где способ включает:
(i) восстановление всего или части раствора, содержащего полипептид фактора VII; и
(ii) очистку полипептида фактора VII из раствора;
где молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII) в стадии (ii) выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (ii) выше 0,025 мМ; и/или
где pH в стадии (ii) ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу очистки сериновой протеазы, содержащей GLA-остаток, включающему:
(i) восстановление всего или части раствора, содержащего сериновую протеазу, содержащую GLA-остаток; и
(ii) очистку сериновой протеазы, содержащей GLA-остаток из расвора;
где концентрация свободных ионов кальция в стадии (ii) выше 1,2 мМ или ниже 0,10 мМ; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (ii) выше 0,025 мМ; и/или
где pH в стадии (ii) ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу очистки полипептида фактора VII, включающему:
(i) восстановление всего или части раствора, содержащего полипептид фактора VII; и
(ii) очистку полипептида фактора VII из раствора;
концентрация свободных ионов кальция в стадии (ii) выше 1,2 мМ или ниже 0,10 мМ; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (ii) выше 0,025 мМ; и/или
где pH в стадии (ii) ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение касается процесса очистки сериновой протеазы, содержащей GLA-остаток, в результате чего раствор сериновой протеазы, содержащей GLA-остаток, подвергается ряду стадий очистки, где концентрация свободных ионов кальция, по крайней мере, на одной из стадий очистки, выше 1,2 мМ или ниже 0,10 мМ; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, по крайней мере, на одной из стадий очистки 0,025 мМ; и/или
где pH, по крайней мере, на одной из стадий очистки, ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к процессу очистки полипептида фактора VII, в результате чего раствор полипептида фактора VII подвергается ряду стадий очистки, где концентрация свободных ионов кальция, по крайней мере, на одной из стадий очистки, выше 1,2 мМ или ниже 0,10 мМ; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, по крайней мере, на одной из стадий очистки, выше 0,025 мМ; и/или
где pH, по крайней мере, на одной из стадий очистки, ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к процессу очистки сериновой протеазы, содержащей GLA-остаток, в результате чего раствор сериновой протеазы, содержащей GLA-остаток, подвергается ряду стадий очистки, где молярное отношение ионов кальция и сериновой протеазы, содержащей GLA-остаток (Ca2+:сериновая протеаза, содержащая GLA-остаток), по крайней мере, на одной из стадий очистки, выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, по крайней мере, на одной из стадий очистки, выше 0,025 мМ; и/или
где pH, по крайней мере, на одной из стадий очистки, ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к процессу очистки полипептида фактора VII, в результате чего раствор полипептида фактора VII подвергается ряду стадий очистки, где молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII), по крайней мере, на одной из стадий очистки, выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, по крайней мере, на одной из стадий очистки, выше 0,025 мМ; и/или
где pH, по крайней мере, на одной из стадий очистки, ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу стабилизации сериновой протеазы, содержащей GLA-остаток, в растворе, содержащем сериновую протеазу, содержащую GLA-остаток, таким образом, указанный раствор, содержащий сериновую протеазу, содержащую GLA-остаток, подвергается стадиям добавления кальция с получением концентрации свободных ионов кальция выше 1,2 мМ или ниже 0,10 мМ; и/или
добавления двухвалентного металла, отличного от иона цинка и иона кальция, с получением концентрации свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, выше 0,025 мМ; и/или
доведение pH раствора, содержащего сериновую протеазу, содержащую GLA-остаток, до pH ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу стабилизации полипептида фактора VII в растворе, содержащем полипептид фактора VII, таким образом указанный раствор, содержащий полипептид фактора VII, подвергается стадиям добавления кальция с получением концентрации свободных ионов кальция выше 1,2 мМ или ниже 0,10 мМ; и/или
добавления двухвалентного металла, отличного от иона цинка и иона кальция, с достижением концентрации свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, выше 0,025 мМ; и/или
доведения pH раствора, содержащего полипептид фактора VII, до значения pH ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к композиции, включающей (i) сериновую протеазу, содержащую GLA-остаток, (ii) свободные ионы кальция в концентрации выше 1,2 мМ или ниже 0,10 мМ; и/или
свободный катион двухвалентного металла, отличный от иона цинка и иона кальция, в концентрации выше 0,025 мМ; и/или
где pH композиции имеет значение ниже 7,5, или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к композиции, включающей (i) полипептид фактора VII, (ii) свободные ионы кальция в концентрации выше 1,2 мМ или ниже 0,10 мМ; и/или
свободный катион двухвалентного металла, отличный от иона цинка и иона кальция, в концентрации выше 0,025 мМ; и/или
где pH композиции имеет значение ниже 7,5 или выше 8,6.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для уменьшения деградации гиперактивных аналогов FVII(a), например, вариантов полипептида FVII с протеолитической активностью выше активности неизмененного FVII человека, активность и лабильность снижаются обработкой a) в присутствии >25 микромоль катиона двухвалентного металла, отличного от иона цинка и иона кальция, например Cu2+, во время очистки, и/или b) в присутствии >1,2 мМ Ca2+ во время очистки, и/или c) в присутствии <0,1 мМ Ca2+ во время очистки, и/или d) при pH ниже 7,5 во время очистки, и/или e) при значении pH во время очистки выше 8,6.
Деградация гиперактивных аналогов FVIIa повышена при нейтральном значении pH (pH=7,5) и является причиной значительного сокращения выхода продукта в процессе очистки. Известными решениями этого является введение в процессе очистки либо высокотоксичных ингибиторов протеазы, либо дорогостоящих «адаптированных» ингибиторов, или пептидов/белков-поглотителей.
Стабилизация культурального супернатанта, иммуноаффинный захват и очистка путем анионного обмена, осуществляемая при рН 6 авторами настоящего изобретения, показали огромное преимущество перед известными методами очистки FVII.
Один из аспектов настоящего изобретения относится к способу получения очищенного пептида фактора VII, где способ включает:
(i) культивирование клетки-хозяина, экспрессирующей полипептид фактора VII, в культуральной среде в условиях, пригодных для экспрессии полипептида фактора VII;
(ii) восстановление всей или части культуральной среды, содержащей полипептид фактора VII; и
(iii) очистку полипептида фактора VII из культуральной среды;
где концентрация свободных ионов кальция в стадии (iii) выше 1,2 мМ или ниже 0,10 мМ; и/или
концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (iii) выше 0,025 мМ; и/или
где pH в стадии (iii) ниже 7,5 или выше 8,6.
Во втором аспекте настоящее изобретение относится к способу очистки полипептида фактора VII, где способ включает:
(i) культивирование клетки-хозяина, экспрессирующей полипептид фактора VII, в культуральной среде в условиях, пригодных для экспрессии полипептида фактора VII;
(ii) восстановление всей или части культуральной среды, содержащей полипептид фактора VII; и
(iii) очистку полипептида фактора VII из культуральной среды;
где молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII) в стадии (iii) выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка или иона кальция, в стадии (iii) выше 0,025 мМ;
и/или где pH в стадии (iii) ниже 7,5 или выше 8,6.
В третьем аспекте настоящее изобретение относится к способу очистки полипептида фактора VII, где способ включает:
(i) восстановление всего или части раствора, содержащего полипептид фактора VII; и
(ii) очистку полипептида фактора VII из раствора, где молярное отношение ионов кальция и полипептида фактора VII (Ca2+:плипептид FVII) в стадии (ii) выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (ii) выше 0,025 мМ; и/или
где pH в стадии (ii) ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу очистки полипептида фактора VII, где способ включает:
(i) восстановление всего или части раствора, содержащего полипептид фактора VII; и
(ii) очистку полипептида фактора VII из раствора;
где концентрация свободных ионов кальция в стадии (ii) выше 1,2 мМ или ниже 0,10 мМ; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, в стадии (ii) выше 0,025 мМ; и/или
где pH в стадии (ii) ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к процессу очистки полипептида фактора VII, в котором раствор полипептида фактора VII подвергается ряду стадий очистки, где концентрация свободных ионов кальция, по крайней мере, на одной из стадий очистки, выше 1,2 мМ или ниже 0,10 мМ; и/или
где концентрация двухвалентного металла, отличного от иона цинка и иона кальция, по крайней мере, на одной из стадий очистки, выше 0,025 мМ; и/или
где pH по крайней мере, на одной из стадий очистки ниже 7,5, или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к процессу очистки полипептида фактора VII, в котором раствор полипептида фактора VII подвергается ряду стадий очистки, где молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII), по крайней мере, на одной из стадий очистки, выше 20 или ниже 0,50; и/или
где концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, по крайней мере, на одной из стадий очистки, выше 0,025 мМ; и/или
где pH, по крайней мере, на одной из стадий очистки, ниже 7,5 или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу стабилизации полипептида фактора VII в растворе, содержащем полипептид фактора VII, при котором вышеуказанный раствор, содержащий полипептид фактора VII, подвергается стадиям добавления кальция для достижения концентрации свободных ионов кальция выше 1,2 мМ или ниже 0,10 мМ; и/или
добавления двухвалентного металла, отличного от иона цинка и иона кальция, для достижения концентрации свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, выше 0,025 мМ; и/или
доведения pH раствора, содержащего полипептид фактора VII, до pH ниже 7,5, или выше 8,6.
Еще в одном аспекте настоящее изобретение относится к способу получения очищенной сериновой протеазы, содержащей GLA-остаток. Вышеуказанный способ включает:
(i) культивирование клетки-хозяина, экспрессирующей вышеуказанную сериновую протеазу, содержащую GLA-остаток, в культуральной среде в условиях, пригодных для экспрессии вышеуказанной сериновой протеазы, содержащей GLA-остаток;
(ii) восстановление всей или части культуральной среды, содержащей вышеуказанную сериновую протеазу, содержащую GLA-остаток; и
(iii) очистку вышеуказанной сериновой протеазы, содержащей GLA-остаток, из культуральной среды,
где рН в стадии (iii) имеет значение между 4,5 и 6 между 8,6 и 10.
Еще в одном аспекте настоящее изобретение относится к способу очистки сериновой протеазы, содержащей GLA-остаток, при котором раствор сериновой протеазы, содержащей GLA-остаток, подвергается ряду стадий очистки, где рН, по крайней мере, на одной из стадий очистки, имеет значение между 4,5 и 6,9, или имеет значение между 8,6 и 10.
Еще в одном аспекте настоящее изобретение относится к способу стабилизации сериновой протеазы, содержащей GLA-остаток, в растворе, включающем сериновую протеазу, содержащую GLA-остаток, при котором названный раствор, включающий сериновую протеазу, содержащую GLA-остаток, подвергается ряду этапов добавления кальция для достижения концентрации свободных ионов кальция выше 1,2 мМ, или ниже 0,10 мМ; и/или
добавления двухвалентного металла, отличного от иона цинка и иона кальция, для достижения концентрации свободных ионов двухвалентного металла, отличных от иона цинка и иона кальция, выше 0,025 мМ; и/или
доведения pH раствора, содержащего сериновую протеазу, содержащую GLA-остаток, до значения между 4,5 и 6,9 или до значения между 8,6 и 10.
Еще в одном аспекте настоящее изобретение относится к композиции, содержащей сериновую протеазу, содержащую GLA-остаток, в растворе со значением рН между 4,5 и 6,9, или между 8,6 и 10.
Термин «сериновая протеаза, содержащая GLA-остаток», употребляемый здесь, обозначает белок, выбранный из группы, включающей полипептиды фактора VII, полипептиды фактора IX, фактора Х и их варианты и производные, белок С и вариант и производные, и протромбин/тромбин и их вариант и производные, где белок содержит один или более аминокислотный остаток гамма-карбоксиглутаминовой кислоты (GLA). В одном из вариантов осуществления сериновая протеаза, содержащая GLA-остаток, является активной формой белка, как, например, фактор VIIa, фактор IXa, фактор Xa, активированный белок C, и тромбин. В одном из вариантов осуществления, сериновая протеаза, содержащая GLA-остаток, является человеческой.
Под «стабилизацией» сериновой протеазы, содержащей GLA-остаток, как, например, полипептид фактора VII, или полипептид фактора IX, в композиции, включающей сериновую протеазу, подразумевается снижение степени деградации (то есть количество продукта деградации в единицу времени) сериновой протеазы в композиции, например протеолитической или химической деградации. Предпочтительно деградация, измеренная в анализе скорости образования GD-FVIIa, описанном здесь, составляет менее 60% от максимума образования GD-FVIIa, как, например, 50% от максимума образования GD-FVIIa, например 40% от максимума образования GD-FVIIa, например 30% от максимума образования GD-FVIIa, например 20% от максимума образования GD-FVIIa, например 10% от максимума образования GD-FVIIa.
Понятно, что под «стабилизацией» сериновой протеазы, содержащей GLA-остаток, в композиции подразумевается повышение стабильности на любой стадии процесса получения рекомбинантного белка, где стадия выбрана из группы, включающей сбор клеток, фиксацию, хранение, обработку, переработку, очистку, предварительного получения основной массы; получения основной массы, ультра-/диафильтрации, ионный обмен, фиксацию анионным обменом, гель-хроматрографию, гидрофобную хроматографию, осаждение и аффинную очистку.
Термин «очищенная сериновая протеаза, содержащая GLA-остаток», как используется здесь, подразумевает сериновую протеазу, содержащую GLA-остаток, которая была отделена, по крайней мере, от приблизительно 50% по массе полинуклеотидов, липидов, углеводов и любых других примесей полипептидов или других примесей, которые могут быть обнаружены в культуральной среде после экспрессии в эукариотических клетках-хозяина, которые могут оказывать негативное влияние на его терапевтическое, диагностическое, профилактическое или научно-исследовательское применения. Сериновая протеаза, содержащая GLA-остаток, может быть очищена от культуральной среды и быть по существу свободной от естественных примесей, с помощью любого из многочисленных способов. На некоторых стадиях очистки, также может быть использована технология стандартного хроматографического разделения для очистки сериновой протеазы, содержащей GLA-остаток.
Термин «очищенный полипептид фактора VII», как используется здесь, подразумевает полипептид фактора VII, который был отделен, по крайней мере, от 50% по массе полинуклеотидов, липидов, углеводов и любых других примесных полипептидов или других примесей, которые могут быть обнаружены в культуральной среде после экспрессии в эукариотических клетках-хозяевах, которые могут оказывать негативное влияние на его терапевтическое, диагностическое, профилактическое или научно-исследовательское применение. Полипептид фактора VII может быть очищен от культуральной среды и быть по существу свободным от естественных примесей любым из многочисленных способов. На некоторых стадиях очистки также может быть использована технология стандартного хроматографического разделения для очистки полипептида фактора VII.
Под «очисткой» полипептида от композиции, содержащей полипептид и один или несколько примесей, подразумевается повышение степени чистоты полипептида в композиции путем удаления (полного или частичного), по крайней мере, одного загрязнителя из композиции. «Стадия очистки» может быть частью всего процесса очистки, приводящей к «гомогенной» композиции, которая может использоваться здесь в отношении композиции, включающей по массе, по крайней мере, около 70% массы интересующего полипептида, исходя из общей массы композиции предпочтительно, по крайней мере, около 80% по массе.
Под термином «концентрация свободных ионов кальция», как используется здесь, понимают концентрацию двухвалентных положительных ионов кальция (Ca2+), окруженных молекулами воды. Термин не включает кальций в твердой форме, то есть кристаллическую структуру или кальций, связанный в белках, как, например FVII.
Термин «концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция», как используется здесь, подразумевает концентрацию двухвалентного положительного иона, окруженного молекулами воды, который не является ионом кальция или ионом цинка. Термин не относится к двухвалентному положительному иону в твердой форме, то есть кристаллической структуре или ионам, связанным в белках.
В одном из вариантов осуществления изобретения, стадии очистки являются стадиями хроматографической очистки.
В одном из вариантов осуществления изобретения, по крайней мере, одна стадия очистки является гидрофобной хроматографией.
В одном из вариантов осуществления изобретения, по крайней мере, одна стадия очистки является гель-хроматографией.
В одном из вариантов осуществления изобретения, по крайней мере, одна стадия очистки является анионообменной хроматографией.
В одном из вариантов осуществления изобретения, по крайней мере, одна стадия очистки является ультрафильтрацией.
В одном из вариантов осуществления изобретения, по крайней мере, одна стадия очистки является иммуноаффинной очисткой.
В одном из вариантов осуществления изобретения, по крайней мере, одна стадия очистки является диафильтрацией.
В одном из вариантов осуществления изобретения, концентрация свободных ионов кальция на стадии (iii) выше 1,2 мМ. В одном из вариантов осуществления изобретения концентрация свободных ионов кальция на стадии (iii) выше 1,3 мМ, например, выше 1,4 мМ, например, выше 1,5 мМ, например, выше 1,6 мМ, например, выше 1,7 мМ, например, выше 1,8 мМ, например, выше 1,9 мМ, например, выше 2,0 мМ, например, выше 2,1 мМ, например, выше 2,2 мМ, например, выше 2,3 мМ, например, выше 2,4 мМ, например, выше 2,5 мМ, например, выше 2,6 мМ, например, выше 3,0 мМ, например, выше 4,0 мМ, например, выше 5,0 мМ, например, выше 6,0 мМ, например, выше 7,0 мМ, например, выше 8,0 мМ, например, выше 9,0 мМ, например, выше 10,0 мМ, например, выше 20 мМ, например, выше 40,0 мМ, например, выше 60,0 мМ, например, выше 80,0 мМ, например, выше 0,1 M, например, выше 1 M, как например, концентрация свободных ионов кальция, при которой происходит насыщение раствора.
Термин «концентрация свободных ионов кальция, при которой происходит насыщение раствора», как используется здесь, подразумевает концентрацию свободных ионов кальция, при которой растворенные свободные ионы кальция находятся в равновесии с нерастворенным ионом кальция в твердой форме.
В одном из вариантов осуществления изобретения, концентрация свободных ионов кальция на стадии (iii) ниже 0,10 мМ. В одном из вариантов осуществления изобретения, концентрация свободных ионов кальция на стадии (iii) ниже 0,09, например, ниже 0,08, например, ниже 0,07, например, ниже 0,06, например, ниже 0,05, например, ниже 0,04, например, ниже 0,03, например, ниже 0,02, например, ниже 0,01, например, ниже 0,00.
В одном из вариантов осуществления изобретения, концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, на стадии (iii) выше 0,025 мМ. В одном из вариантов осуществления изобретения двухвалентный металл выбран из списка, включающего Mg 2+, Cu 2+, Mn2+, Co2+, Fe2+, Sm2+, Ni2+, Cd2+, Hg2+, Sm2+, и Uo2+. В одном из вариантов осуществления изобретения двухвалентный металл выбран из списка, включающего Mg2+, Cu2+, и Mn2+. В одном из вариантов осуществления изобретения концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, на стадии (iii) выше 0,025 мМ, например, выше 0,03 мМ, например, выше 0,035 мМ, например, выше 0,04 мМ, например, выше 0,045 мМ, например, выше 0,05 мМ, например, выше 0,055 мМ, например, выше 0,06 мМ, например, выше 0,1 мМ, например, выше 0,15 мМ, например, выше 0,2 мМ, например, выше 0,25 мМ, например, выше 0,3, мМ, например, выше 0,5 мМ, например, выше 1,0 мМ.
В одном из вариантов осуществления изобретения, сериновая протеаза, содержащая GLA-остаток, очищают на стадии (iii) в присутствии дополнительного хелатора иона двухвалентного металла.
В одном из вариантов осуществления изобретения полипептид фактора VII очищают на стадии (iii) в присутствии дополнительного хелатора иона двухвалентного металла.
Термин «хелатор иона двухвалентного металла», как используется здесь, подразумевает любое вещество или соединение, которое удаляет или связывает ионы двухвалентного металла, как, например, ионы кальция или ионы цинка. Хелатором иона двухвалентного металла может быть поликарбоновая кислота, цитрат, батокупроин, батофенантролин, DTPA, этилендиаминтетрауксусная кислота (EDTA), EGTA, пеницилламин, TETA (триэтилентетрамин), TPEN и их производные.
В одном из вариантов осуществления изобретения сериновую протеазу, содержащую GLA-остаток, очищают на стадии (iii) при pH ниже 7,5. В одном из вариантов осуществления изобретения pH ниже 7,4, например, ниже 7,3, например, ниже 7,2, например, ниже 7,1, например, ниже 7,0, например, ниже 6,8, например, ниже 6,6, например, ниже 6,4, например, ниже 6,2, например, ниже 6,0, например, 5,5.
В одном из вариантов осуществления изобретения, сериновую протеазу, содержащую GLA-остаток, очищают на стадии (iii) при pH выше 8,6. В одном из вариантов осуществления изобретения pH выше 8,7, например, выше 8,8, например, выше 8,9, например, выше 9,0, например, выше 9,1, например, выше 9,2, например, выше 9,4, например, выше 9,6, например, выше 9,8, например, выше 10,0, например, выше 10,2, например, выше 10,4, например, выше 10,8, например, 11,0.
В одном из вариантов осуществления изобретения, полипептид фактора VII очищают на стадии (iii) при pH ниже 7,5. В одном из вариантов осуществления изобретения pH ниже 7,4, например, ниже 7,3, например, ниже 7,2, например, ниже 7,1, например, ниже 7,0, например, ниже 6,8, например, ниже 6,6, например, ниже 6,4, например, ниже 6,2, например, ниже 6,0, например, 5,5.
В одном из вариантов осуществления изобретения полипептид фактора VII очищают на стадии (iii) при pH выше 8,6. В одном из вариантов осуществления изобретения pH выше 8,7, например, выше 8,8, например, выше 8,9, например, выше 9,0, например, выше 9,1, например, выше 9,2, например, выше 9,4, например, выше 9,6, например, выше 9,8, например, выше 10,0, например, выше 10,2, например, выше 10,4, например, выше 10,8, например, 11,0.
В одном из вариантов осуществления изобретения сериновую протеазу, содержащую GLA-остаток, очищают при значении pH между 4,5 и 6,9. В одном из вариантов осуществления изобретения полипептид фактора VII очищают при pH между 4,5 и 6,9. В одном из вариантов осуществления изобретения pH имеет значение между 4,7 и 6,8, например между 4,9 и 6,7, например, между 5,1 и 6,6, например, между 5,3 и 6,5, например, между 5,5 и 6,4, например, между 5,7 и 6,3, например, между 5,8 и 6,2, например, между 5,9 и 6,1, например, около 6,0.
В одном из вариантов осуществления изобретения сериновую протеазу, содержащую GLA-остаток, очищают при значении pH между 8,6 и 10. В одном из вариантов осуществления изобретения полипептид фактора VII очищают при значении pH между 8,6 и 10. В одном из вариантов осуществления изобретения pH имеет значение между 8,7 и 9,9, например, между 8,8 и 9,8, например, между 8,9 и 9,7, например, между 9,0 и 9,6, например между 9,1 и 9,5, например между 8,7 и 9,8, например, между 8,7 и 9,7, например, между 8,7 и 9,6, например, между 8,8 и 9,5, например, между 8,9 и 9,4, например, между 9,0 и 9,2, например, около 9,2.
В одном из вариантов осуществления изобретения сериновую протеазу, содержащую GLA-остаток, очищают в присутствии гистидина. Понятно, что гистидин может служить буферным агентом и поддерживать рН в диапазоне 5-7 или 8-10.
В одном из вариантов осуществления изобретения полипептид фактора VII очищают в присутствии гистидина. Понятно, что гистидин может служить буферным агентом и поддерживать рН в диапазоне 5-7 или 8-10.
В одном из вариантов осуществления изобретения клеткой-хозяином является эукариотическая клетка-хозяин.
В одном из вариантов осуществления изобретения эукариотической клеткой-хозяином является клетка млекопитающего. В одном из вариантов осуществления изобретения клетка млекопитающего выбрана из группы, включающей клетки HEK, клетки BHK, клетки CHO, клетки COS, и клетки миеломы, например SP2-0.
В одном из вариантов осуществления изобретения полипептидом фактора VII является неизмененным фактором VII человека.
В одном из вариантов осуществления изобретения полипептид фактора VII имеет протеолитическую активность выше неизмененный FVIIa человека.
В одном из вариантов осуществления изобретения полипептидом фактора VII является фактор VII-связанным полипептидом, выбранным из группы, включающей:
L305V-FVII, L305V/M306D/D309S-FVII,




R152E-Фактор VII, S344A-Фактор VII, фактор VIIa, лишенный Gla домена; и P11Q/K33E- FVII, T106N-FVII, K143N/N145T-FVII, V253N-FVII, R290N/A292T-FVII, G291N-FVII, R315N/V317T-FVII, K143N/N145T/R315N/V317T-FVII; и FVII, имеющий замены, вставки или делеции в аминокислотной последовательности с 233Thr по 240Asn, FVII, имеющий замены, вставки или делеции в аминокислотной последовательности с 304Arg по 329Cys.
В одном из вариантов осуществления изобретения молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII) на стадии (iii) выше 20. В одном из вариантов осуществления изобретения молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII) на стадии (iii) выше 20, например, выше 22, например, выше 24, например, выше 26, например, выше 28, например, выше 30, например, выше 34, например, выше 38, например, выше 42, например, выше 45, например, выше 50, например, выше 55, например, выше 60, например, выше 65, например, выше 70, например, выше 76, например, выше 82, например, выше 90, например, выше 95, например, выше 100.
В одном из вариантов осуществления изобретения молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII) на стадии (iii) ниже 0,50. В одном из вариантов осуществления изобретения молярное отношение ионов кальция и полипептида фактора VII (Ca2+:полипептид FVII) на стадии (iii) ниже 0,50, например, ниже 0,45, например, ниже 0,40, например, ниже 0,35, например, ниже 0,30, например, ниже 0,25, например, ниже 0,20, например, ниже 0,15, например, ниже 0,10, например, ниже 0,05, например, 0,00.
В одном из вариантов осуществления изобретения концентрация свободных ионов кальция, по крайней мере, на одной из стадий очистки выше 1,2 мМ. В одном из вариантов осуществления изобретения концентрация свободных ионов кальция, по крайней мере, на одной из стадий очистки выше 1,3 мМ, например, выше 1,4 мМ, например, выше 1,5 мМ, например, выше 1,6 мМ, например, выше 1,7 мМ, например, выше 1,8 мМ, например, выше 1,9 мМ, например, выше 2,0 мМ, например, выше 2,1 мМ, например, выше 2,2 мМ, например, выше 2,3 мМ, например, выше 2,4 мМ, например, выше 2,5 мМ, например, выше 2,6 мМ, например, выше 3,0 мМ, например, выше 4,0 мМ, например, выше 5,0 мМ, например, выше 6,0 мМ, например, выше 7,0 мМ, например, выше 8,0 мМ, например, выше 9,0 мМ, например, выше 10,0 мМ, например, выше 20 мМ, например, выше 40,0 мМ, например, выше 60,0 мМ, например, выше 80,0 мМ, например, выше 0,1 M, например, выше 1 M, как например, концентрация свободных ионов кальция, при которой происходит насыщение раствора.
В одном из вариантов осуществления изобретения концентрация свободных ионов кальция, по крайней мере, на одной из стадий очистки ниже 0,10 мМ. В одном из вариантов осуществления изобретения концентрация свободных ионов кальция, по крайней мере, на одной из стадий очистки ниже 0,09, например, ниже 0,08, например, ниже 0,07, например, ниже 0,06, например, ниже 0,05, например, ниже 0,04, например, ниже 0,03, например, ниже 0,02, например, ниже 0,01, например, ниже 0,00.
В одном из вариантов осуществления изобретения концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, по крайней мере, на одной из стадий очистки выше 0,025 мМ. В одном из вариантов осуществления изобретения катион двухвалентного металла выбран из списка, включающего Mg2+,
Cu2+, Mn2+, Co2+, Fe2+, Sm2+, Ni2+, Cd2+, Hg2+, Sm2+, и Uo2. В одном из вариантов осуществления изобретения катион двухвалентного металла выбран из списка, включающего Mg2+, Cu2+ и Mn2+.
В одном из вариантов осуществления изобретения концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, по крайней мере, на одной из стадий очистки выше 0,025 мМ, например, выше 0,03 мМ, например, выше 0,035 мМ, например, выше 0,04 мМ, например, выше 0,045 мМ, например, выше 0,05 мМ, например, выше 0,055 мМ, например, выше 0,06 мМ, например, выше 0,1 мМ, например, выше 0,15 мМ, например, выше 0,2 мМ, например, выше 0,25 мМ, например, выше 0,3 мМ, например, выше 0,5 мМ, например, выше 1,0 мМ.
В одном из вариантов осуществления изобретения полипептид фактора VII очищают, по крайней мере, на одной из стадий очистки в присутствии дополнительного хелатора иона двухвалентного металла.
В одном из вариантов осуществления изобретения полипептид фактора VII очищают, по крайней мере, на одной из стадий очистки при pH ниже 7,5. В одном варианте осуществления изобретения значение pH ниже 7,4, например, ниже 7,3, например, ниже 7,2, например, ниже 7,1, например, ниже 7,0, например, ниже 6,8, например, ниже 6,6, например, ниже 6,4, например, ниже 6,2, например, ниже 6,0, например 5,5.
В одном из вариантов осуществления изобретения полипептид фактора VII очищают, по крайней мере, на одной из стадий очистки при pH выше 8,6. В одном из вариантов осуществления изобретения значение pH выше 8,7, например, выше 8,8, например, выше 8,9, например, выше 9,0, например, выше 9,1, например, выше 9,2, например, выше 9,4, например, выше 9,6, например, выше 9,8, например, выше 10,0, например, выше 10,2, например, выше 10,4, например, выше 10,8, например, 11,0.
В одном из вариантов осуществления изобретения полипептид фактора VII очищают, по крайней мере, на одной из стадий очистки в присутствии гистидина.
В одном из вариантов осуществления изобретения получена концентрация свободных ионов кальция выше 1,2 мМ. В одном из вариантов осуществления изобретения полученная концентрация свободных ионов кальция выше 1,3 мМ, например, выше 1,4 мМ, например, выше 1,5 мМ, например, выше 1,6 мМ, например, выше 1,7 мМ, например, выше 1,8 мМ, например, выше 1,9 мМ, например, выше 2,0 мМ, например, выше 2,1 мМ, например, выше 2,2 мМ, например, выше 2,3 мМ, например, выше 2,4 мМ, например, выше 2,5 мМ, например, выше 2,6 мМ, например, выше 3,0 мМ, например, выше 4,0 мМ, например, выше 5,0 мМ, например, выше 6,0 мМ, например, выше 7,0 мМ, например, выше 8,0 мМ, например, выше 9,0 мМ, например, выше 10,0 мМ, например, выше 20 мМ, например, выше 40,0 мМ, например, выше 60,0 мМ, например, выше 80,0 мМ, например, выше 0,1 M, например, выше 1 M, например, концентрация свободных ионов кальция, при которой происходит насыщение раствора.
В одном из вариантов осуществления изобретения полученная концентрация свободных ионов кальция ниже 0,10 мМ. В одном из вариантов осуществления изобретения полученная концентрация свободных ионов кальция ниже 0,09, например, ниже 0,08, например, ниже 0,07, например, ниже 0,06, например, ниже 0,05, например, ниже 0,04, например, ниже 0,03, например, ниже 0,02, например, ниже 0,01, например, ниже 0,00.
В одном из вариантов осуществления изобретения полученная концентрация свободных ионов двухвалентного металла, отличного от иона цинка и иона кальция, выше 0,025 мМ.
В одном из вариантов осуществления изобретения катион двухвалентного металла выбран из списка, включающего Mg2+, Cu2+, Mn2+, Co2+, Fe2+, Sm2+, Ni2+, Cd2+, Hg2+, Sm2+, и Uo2+. В одном из вариантов осуществления изобретения катион двухвалентного металла выбран из списка, включающего Mg 2+, Cu2+, и Mn2+. В одном из вариантов осуществления изобретения полученная концентрация катиона двухвалентного металла, отличного от иона цинка и иона кальция, выше 0,025 мМ, например, выше 0,03 мМ, например, выше 0,035 мМ, например, выше 0,04 мМ, например, выше 0,045 мМ, например, выше 0,05 мМ, например, выше 0,055 мМ, например, выше 0,06 мМ, например, выше 0,1 мМ, например, выше 0,15 мМ, например, выше 0,2 мМ, например, выше 0,25 мМ, например, выше 0,3 мМ, например, выше 0,5 мМ, например, выше 1,0 мМ.
В одном из вариантов осуществления изобретения полипептид фактора VII стабилизируют в присутствии дополнительного хелатора иона двухвалентного металла.
В одном воплощении полипептид фактора VII стабилизируют при значении рН ниже 7,5. В одном из вариантов осуществления изобретения значение pH ниже 7,4, например, ниже 7,3, например, ниже 7,2, например, ниже 7,1, например, ниже 7,0, например, ниже 6,8, например, ниже 6,6, например, ниже 6,4, например, ниже 6,2, например, ниже 6,0, например 5,5. В одном из вариантов осуществления изобретения полипептид фактора VII стабилизируют при значении pH выше 8,6. В одном из вариантов осуществления изобретения значение pH выше 8,7, например, выше 8,8, например, выше 8,9, например, выше 9,0, например, выше 9,1, например, выше 9,2, например, выше 9,4, например, выше 9,6, например, выше 9,8, например, выше 10,0, например, выше 10,2, например, выше 10,4, например, выше 10,8, например, 11,0.
В одном из вариантов осуществления изобретения полипептид фактора VII стабилизируют в присутствии гистидина.
Под термином «полипептид фактора IX», как используется здесь, подразумевают неизмененный фактор IX человека, а также варианты фактора IX, проявляющие в основном такую же или повышенную биологическую активность по сравнению с неизменным фактором IX, фактор IX-связанные полипептиды, а так же производные фактора IX и конъюгаты фактора IX. Термин «фактор IX» охватывает полипептиды фактора IX в их нерасщепленной форме (зимоген), также формы, которые были протеолитически обработаны, с получением их соответствующих биологически активных форм, которые могут быть обозначены как фактор IXa. Такие варианты фактора IX могут проявлять различные свойства по сравнению с фактором IX человека, включая стабильность, связывание с фосфолипидом, измененную удельную активность и тому подобное.
Под термином «полипептид фактора VII», как употребляется здесь, подразумевают неизмененный фактор VII (то есть полипептид с аминокислотной последовательностью, заявленной в патенте США № 4784950), а также варианты фактора VII, проявляющие в основном такую же или повышенную биологическую активность по сравнению с неизмененным фактором VII, фактор VII-связанные полипептиды также, как производные фактора VII и конъюгаты фактора VII. Термин «фактор VII» охватывает полипептиды фактора VII в их нерасщепленной (зимоген) форме, также формы, которые были протеолитически обработаны, с получением их соответствующих биологически активных форм, которые могут быть обозначены как фактор VIIa. Обычно фактор VII расщепляется между остатками 152 и 153 с получением фактора VIIa. Такие варианты фактора VII могут проявлять отличные свойства по сравнению с фактором VII человека, включая стабильность, связывание фосфолипида, измененную удельную активность и тому подобное.
Как используется здесь, «фактор VII-связанные полипептиды» включают полипептиды, в том числе варианты, в которых биологическая активность фактора VIIa была существенно изменена или снижена по сравнению с активностью неизмененного фактора VIIa. Эти полипептиды включают, без ограничения, фактор VII или фактор VIIа, в которых представленные замены последовательности специфической аминокислоты, изменяют или нарушают биологическую активность полипептида.
Под термином «производное фактора VII», как используется здесь, понимают неизмененный фактор VII, варианты фактора VII показывающие по существу такую же или улучшенную биологическую активность по сравнению с неизмененным фактором VII и фактором VII-связанные полипептиды, в которых одна или несколько аминокислот родительского пептида были химически изменены, например алкилированы, пегилированы, ацилированы, этерифицированы или амидированы, или тому подобное. К таким вариантам относятся, но ими не ограничивают, пегилированный фактор VIIa человека, пегилированный цистеин фактора VIIa человека и их варианты.
Под термином «пегилированный фактор VIIa человека» подразумевают фактор VIIa человека с молекулой ПЭГ, конъюгированную с полипептидом фактора VIIa. Понятно, что молекула ПЭГ может быть присоединена к любой части полипептида фактора VIIa, включая любой остаток аминокислоты или функциональную группу углевода полипептида фактора VIIa. Под термином «фактор VIIa человека с пегилированным цистеином» подразумевают фактор VIIa с молекулой ПЭГ, присоединенной к сульфгидрильной группе цистеина, введенной в фактор VIIa человека.
Биологическая активность фактора VIIa в свертывании крови связана с его способностью к (i) связыванию с тканевым фактором (TF) и (ii) катализированию протеолитического расщепления фактора IX или фактора Х с образованием активированных факторов IX или Х (Фактор IXa или Xa, соответственно). Для целей изобретения биологическая активность фактора VIIa может быть количественно определена путем измерения способности препарата стимулировать свертывание крови, используя плазму, дефицитную по фактору VII, и тромбопластин, как описано, например, в патенте США № 5997864. В этом исследовании биологическая активность выражается как уменьшение времени свертываемости по сравнению с контрольным образцом и преобразована в «единицы фактора VII» по сравнению с суммарной стандартной сывороткой человека с активностью фактора VII, равной 1 ед/мл. Альтернативно биологическая активность фактора VIIa может быть количественно определена (i) измерением способности фактора VIIa продуцировать фактор Xa в системе, содержащей TF, встроенный в липидную мембрану и фактор Х (Persson et al., J. Biol. Chem. 272: 19919-19924, 1997); (ii) измеряя гидролиз фактора Х в водной системе; (iii) измеряя его физическое связывание с TF, используя прибор, основанный на резонансе поверхности плазменной волны; (Persson, FEBS Letts. 413: 359-363,1997) и (iv) оценивая гидролиз синтетического субстрата.
Варианты фактора VII, имеющие по существу такую же или повышенную биологическую активность по сравнению с неизмененным фактором VIIa, включают в себя варианты, которые проявляют, по меньшей мере, около 25%, предпочтительно, по меньшей мере, около 50%, более предпочтительно, по меньшей мере, около 75% и наиболее предпочтительно, по меньшей мере, около 90% специфической активности фактора VIIа, продуцируемой тем же клеточным типом, при тестировании в одном и нескольких анализах коагулирующей активности, протеолитическом анализе, или TF-связанном анализе, как описано выше. Вариантами фактора VII, имеющими существенно сниженную биологическую активность по сравнению с неизмененным фактором VIIa, являются те, которые проявляют менее, около 25%, предпочтительно менее около 10%, предпочтительно менее около 5% и наиболее предпочтительно менее около 1% от специфической активности неизмененного фактора VIIa, вырабатываемого тем же клеточным типом, при тестировании в одном и нескольких анализах коагулирующей активности, протеолитическом анализе или TF-связанном анализе, как описано выше. Варианты фактора VII, имеющие существенно измененную биологическую активность по сравнению с неизмененным фактором VII, включают, без ограничений, варианты фактора VII, которые проявляют TF- независимую протеолитическую активность фактора Х, и те, которые связывают TF, но не расщепляют фактор Х.
Варианты фактора VII, демонстрирующие по существу ту же или большую биологическую активность, чем неизмененный фактор VII, или альтернативно демонстрирующие существенно измененную или сниженную биологическую активность по сравнению с неизмененным фактором VII, включают без ограничения полипептиды с аминокислотной последовательностью, которая отличается от последовательности неизмененного фактора VII наличием вставки, делеции или замены одной или нескольких аминокислот.
Неограничивающие примеры вариантов фактора VII, имеющих, по существу, такую же биологическую активность, как и неизмененный фактор VII, включают в себя S52A-FVIIa, S60A-FVIIa (Lino et al., Arch. Biochem. Biophys. 352: 182-192, 1998); варианты FVIIa, проявляющие повышенную протеолитическую стабильность, которые описаны в патенте США № 5580560; фактор VIIa, который был протеолитически расщеплен между остатками 290 и 291 или между остатками 315 и 316 (Mollerup et al., Biotechnol. Bioeng. 48: 501-505,1995); окисленные формы фактора VIIa (Kornfelt et aI., Arch. Biochem. Biophys. 363: 43-54, 1999); варианты FVII, которые описаны в PCT/DK02/00189; и варианты FVII, проявляющие повышенную протеолитическую стабильность, которые описаны в WO 02/38162 (Scripps Research Institute); варианты FVII, имеющие измененный GLA-домен и проявляющие усиленное мембранное связывание, которые описаны в WO 99/20767 (University of Minnesota); и варианты FVII, которые описаны в WO 01/58935 (Maxygen ApS).
Неограничивающие примеры вариантов фактора VII, имеющих повышенную биологическую активность по сравнению с неизмененным фактором VIIа, включают в себя варианты FVII, которые описаны в WO 01/83725, WO 02/22776, WO 02/077218, PCT/DK02/00635, патентной заявке Дании PA 2002 01423, патентной заявке Дании PA 2001 01627; WO 02/38162 (Scripps Research Institute); и варианты FVIIa с усиленной активностью, которые описаны в JP 2001061479 (Chemo-Sero-Therapeutic Res Inst.). Неограничивающие примеры вариантов фактора VII с существенно пониженной или измененной биологической активностью по сравнению с неизмененным фактором VII человека включают в себя R152E-FVIIa (Wildgoose et al., Biochem 29: 3413-3420,1990), S344A-FVIIa (Kazama et al., J. Biol. Chem. 270: 66-72, 1995), FFR-FVIIa (Holst et al., Eur. J. Vasc. Endovasc. Surg. 15: 515-520, 1998), и фактор VIIa, лишенный GLA-домена (Nicolaisen et al., FEBS Letts. 317: 245-249, 1993).
Примеры фактора VII или фактор VII-связанных полипептидов включают, без ограничения, неизмененный фактор VII,




R152E-Фактор VII, S344A-Фактор VII, фактор VIIa, лишенный Gla домена; и P11Q/K33E-FVII, T106N-FVII, K143N/N145T-FVII, V253N-FVII, R290N/A292T-FVII, G291N-FVII, R315N/V317T-FVII, K143N/N145T/R315N/V317T-FVII; и FVII, имеющий замены, вставки или делеции в аминокислотной последовательности с 233Thr по 240Asn, FVII, имеющий замены, вставки или делеции в аминокислотной последовательности с 304Arg по 329Cys.
Для аминокислотных замен была использована следующая терминология. Первая буква представляет аминокислоту, находящуюся в этом положении в неизмененном FVII человека. Следующий номер означает положение в неизмененном FVII человека. Вторая буква означает другую аминокислоту, замещающую (заменяющую) природную аминокислоту. Примером является M298Q, где метионин в положении 298 неизмененного FVII человека заменен на глутамин. В другом примере, V158T/M298Q, валин в положении 158 неизмененного FVII человека заменен на треонин, а метионин в положении 298 неизмененного FVII человека заменен на глутамин в том же полипептиде фактора VII.
Еще в одном из вариантов осуществления изобретения, полипептид фактора VII является полипептидом, где отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIа человека составляет, по крайней мере, около 1,25. В одном из вариантов осуществления отношение между активностью полипептида фактора VII и активность неизмененного фактора VIIа человека, по крайней мере, равна около 2,0. В еще одном воплощении отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIа человека, по крайней мере, около 4,0.
В еще одном из вариантов осуществления изобретения, полипептид фактора VII является полипептидом, для которого, при проведении анализа активности фактора VIIa, отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIа человека составляет, по крайней мере, около 1,25. В еще одном из вариантов осуществления, при проведении анализа активности фактора VIIa, отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIа человека составляет, по крайней мере, около 2,0. Еще в одном из вариантов осуществления, при проведении анализа активности фактора VIIa, отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIа человека составляет, по крайней мере, около 4,0. Активность фактора VIIа может быть измерена способами, описанными в разделе «Способы».
Еще в одном из вариантов осуществления изобретения, полипептид фактора VII представляет собой полипептид, для которого, при проведении «гидролиза in vitro», отношение между активностью полипептида фактора VII и активностью человеческого фактора VIIa составляет, по крайней мере, около 1,25. В одном из вариантов осуществления, при проведении «гидролиза in vitro», отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIa человека составляет, по крайней мере, около 2,0. Еще в одном из вариантов осуществления, при проведении «гидролиза in vitro», отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIa человека составляет, по крайней мере, около 4,0.
Еще в одном из вариантов осуществления изобретения, полипептид фактора VII является полипептидом, для которого, при проведении «протеолиза in vitro», отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIa человека составляет, по крайней мере, около 1,25. В одном из вариантов осуществления, при проведении «протеолиза in vitro», отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIa человека составляет, по крайней мере, около 2,0. Еще в одном из вариантов осуществления, при проведении «протеолиза in vitro», отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIa человека составляет, по крайней мере, около 4,0. Еще в одном из вариантов осуществления, при проведении «протеолиза in vitro», отношение между активностью полипептида фактора VII и активностью неизмененного фактора VIIa человека составляет, по крайней мере, около 8,0.
Настоящее изобретение может быть применимо для вариантов фактора VII/VIIa с повышенной активностью по сравнению с неизмененным фактором. Варианты фактора VII/VIIa с повышенной активностью могут быть обнаружены при проведении соответствующих исследований, описанных ниже. Эти исследования могут быть выполнены как простой предварительный тест in vitro. Таким образом, в разделе «Способы» описан простой тест (названный как «проведение гидролиза in vitro») для определения активности вариантов фактора VIIa по изобретению. Исходя из этого, варианты фактора VIIa, которые представляют особенный интерес, являются такими вариантами, для которых при проведении «гидролиза in vitro», отношение между активностью варианта и активностью неизмененного фактора VII более 1,0 составляет, например, по крайней мере, около 1,25, предпочтительно, по крайней мере, около 2,0, например, по крайней мере, около 3,0 или еще более предпочтительно, по крайней мере, около 4,0.
Активность вариантов также может быть измерена с использованием физиологических субстратов, например фактора X (способ «протеолиз in vitro») (смотри в разделе «Способы»), целесообразно при концентрации 100-1000 нM, где образование фактора Ха определяют после добавления подходящего хромогена (например, S-2765). Кроме того, анализ активности может осуществляться при физиологической температуре.
Способность вариантов фактора VIIa вырабатывать тромбин может также быть определена в анализе, включающем все необходимые факторы коагуляции и ингибиторы в физиологических концентрациях (без фактора VII, когда имитируют состояния гемофилии А) и активированные тромбоциты (как описано на стр.543, Monroe et al. (1997) Brit. J. Haematol. 99,542-547, приведенной здесь в качестве ссылки).
Полипептиды фактора VII, описанные здесь, могут быть получены посредством технологий рекомбинантных нуклеиновых кислот. В целом, последовательность нуклеиновых кислот клонированного неизмененного фактора VII модифицируют, и таким образом, кодируют желаемый белок. Эту модифицированную последовательность затем встраивают в вектор экспрессии, который в свою очередь трансформируют или трансфектируют в клетки-хозяева. В качестве клеток-хозяев предпочтительными являются клетки высших эукариотов, в особенности культивированные клетки млекопитающих. Полные последовательности нуклеотидов и аминокислот фактора VII человека известны (смотри патент США 4784950, где описаны клонирование и экспрессия рекомбинантного фактора VII человека). Последовательность бычьего фактора VII описана у Takeya et al., J. Biol. Chem. 263: 14868- 14872 (1988)).
Изменения аминокислотной последовательности могут быть получены различными способами. Изменение последовательности нуклеиновых кислот может проводиться посредством сайт-специфического мутагенеза. Технология сайт-специфического мутагенеза хорошо известна в данной области и описана в, например, Zoller and Smith (DNA 3: 479-488, 1984) или в "Splicing by extension overlap", Horton et al., Gene 77,1989, pp. 61-68. Таким образом, используя последовательности нуклеотидов и аминокислот фактора VII, можно ввести выбранное изменение(я). Аналогично специалисту в данной области хорошо известны процедуры получения конструкции ДНК, проводимые с помощью полимеразной цепной реакции с использованием специфических праймеров. (cf. PCR Protocols, 1990, Academic Press, San Diego, California, USA).
Конструкция нуклеиновой кислоты, кодирующей полипептид фактора VII, по изобретению, соответственно может происходить из геномной или кДНК, например, она может быть получена путем создания библиотеки геномной или кДНК и скрининга последовательностей ДНК, кодирующих весь полипептид или его часть, путем гибридизации с использованием синтетических олигонуклеотидных зондов в соответствии со стандартными методиками. (cf. Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd. Ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989).
Конструкция нуклеиновых кислот, кодирующих полипептид фактора VII, может быть также получена синтетически установленными стандартными способами, например фосфоамидитным способом, описанным Beaucage и Caruthers, Tetrahedron Letters 22 (1981), 1859-1869, или способом, описанным Matthes et al., EMBO Journal 3 (1984), 801-805. Согласно фосфоамидитному способу, олигонуклеотиды синтезируют, например, в автоматическом ДНК-синтезаторе, очищают, подвергают отжигу, лигируют и клонируют в подходящие векторы.
Кроме того, состав нуклеиновой кислоты конструкции может быть смесью синтетической и геномной ДНК, синтетической и кДНК или смесью геномной и кДНК (соответственно), с получением лигированием стандартными способами фрагментов синтетической, геномной или кДНК (в зависимости от ситуации), соответствующих различным частям целой конструкции нуклеиновой кислоты.
Конструкция нуклеиновых кислот предпочтительно является конструкцией ДНК. Последовательности ДНК, которая может использоваться для получения полипептидов фактора VII по настоящему изобретению, в основном будут кодировать пре-прополипептид на аминоконце фактора VII для получения оптимального просттрансляционного процессинга (например, гамма-карбоксилирования остатков глутаминовой кислоты) и секреции из клетки-хозяина. Пре-прополипептид может быть этим фактором VII или другим витамин К-зависимым белком плазмы, как, например, фактор IX, фактор Х, протромбин, белок С или белок S. Как понятно специалисту в данной области, в аминокислотной последовательности полипептидов фактора VII могут быть проведены дополнительные модификации, где такие модификации не снижают значительно способность белка действовать в качестве коагулянта. Например, полипептиды фактора VII могут также быть модифицированы на сайте активации расщепления и, таким образом, ингибировать превращение зимогена фактора VII в его активированную двухцепочечную форму, как это в целом описано в патенте США 5288629.
Векторы экспрессии, которые могут использоваться для экспрессии вариантов фактора VIIа, включают промотор, способный направлять транскрипцию клонированного гена или кДНК. Предпочтительные промоторы для использования в культивированных клетках млекопитающих включают вирусные промоторы и клеточные промоторы. Вирусные промоторы включают в себя промотор SV40 (Subramani et al., Mol. Cell. Biol. 1: 854-864,1981) и промотор CMV (Boshart et al., Cell 41: 521-530,1985). Особенно предпочтительным вирусным промотором является основной поздний промотор аденовируса 2 (Kaufman and Sharp, Mol. Cell. Biol. 2: 1304-1319, 1982). Клеточные промоторы включают в себя мышиный промотор гена-каппа (Bergman et al., Proc. Natl. Acad. Sci. USA 81: 7041-7045,1983) и мышиный промотор VH (Loh et al., Cell 33: 85-93,1983). Особенно предпочтительным клеточным промотором является мышиный промотор металлотионеина-I. (Palmiter et al., Science 222: 809-814, 1983). Векторы экспрессии могут также содержать последовательность сайтов сплайсинга РНК, расположенную ниже (5'-3' направление) от промотора и выше (3'-5' направление) от участка вставки непосредственно для последовательности фактора VII. Предпочтительные сайты сплайсинга РНК могут быть получены у аденовируса и/или генов иммуноглобулина. Сигнал полиаденилирования, также содержащийся в векторах экспрессии, расположен в направлении 5'-3' от сайта инсерции. Особенно предпочтительные сигналы полиаденилирования включают в себя сигнал раннего или позднего полиаденилирования SV40 (Kaufman and Sharp, ibid.), сигнал полиаденилирования области 5 Elb аденовируса, терминатора гена гормона роста человека (DeNoto et al. Nucl. Acids Res. 9: 3719-3730, 1981) или сигнал полиаденилирования гена фактора VII человека или гена бычьего фактора VII. Векторы экспрессии могут также включать некодирующую вирусную лидерную последовательность, такую как трехчастная лидерная последовательность аденовируса 2, расположенная между промотором и сайтами сплайсинга РНК; и энхансерные последовательности, такие как энхансер SV40.
Клонированные последовательности ДНК вводят в культивированные клетки млекопитающих, например, посредством фосфат кальция-опосредованной трансфекции (Wigler et al., Cell 14: 725-732, 1978; Corsaro and Pearson, Somatic Cell Genetics 7: 603-616, 1981; Graham and Van der Eb, Virology 52d: 456-467,1973) или электропорации (Neumann et al., EMBO J. 1: 841-845,1982). Для идентификации и отбора клеток, которые экспрессируют экзогенную ДНК, ген, ответственный за селективный фенотип (селективный маркер), как правило, вводят в клетки наряду с интересующим геном или кДНК. Предпочтительные селективные маркеры включают в себя гены, ответственные за устойчивость к таким лекарствам, как, например, неомицин, гигромицин и метотрексат. Селективным маркером может быть селективный маркер, способный к амплификации. Предпочтительным селективным маркером, способным к амплификации, является последовательность дигидрофолат-редуктазы (DHFR). Селективные маркеры описаны в Thilly (Mammalian Cell Tecnology, Butterworth Publishers, Stoneham, MA, приведенной здесь в качестве ссылки). Специалисту в данной области будет нетрудно выбрать подходящие селективные маркеры.
Селективные маркеры можно вводить в клетку отдельной плазмидой в одно и то же время с введением плазмиды с интересующим геном, или можно вводить одной и той же плазмидой. Если введение осуществляют с помощью общей плазмиды, то селективный маркер и интересующий ген могут находиться под контролем различных промоторов или одного и того же промотора, в последнем случае происходит продукция двухцистронного транскрипта. Конструкции такого типа хорошо известны в данной области (например, Levinson and Simonsen, US 4713339). Также может быть полезно добавить дополнительно ДНК, так называемый «ДНК-носитель», смесь, которую вводят в клетки. После поглощения ДНК клетки растут в соответствующей среде для выращивания, обычно через 1-2 дня они начинают экспрессировать интересующий ген. Средой, используемой для культивирования клеток, может быть любая удобная питательная среда, подходящая для выращивания клеток-хозяев, как, например, минимальная среда или комплексная среда, содержащая соответствующие добавки. Подходящая культуральная среда является коммерчески доступной или может быть получена в соответствии с опубликованными прописями (например, в каталогах American Type Culture Collection). Среды получают с использованием методик, хорошо известных в данной области (смотри, например, справочники для бактерий и дрожжей; Bennett, J. W. and LaSure, L., editors, More Gene Manipulations in Fungi, Academic Press, CA, 1991). Среда для выращивания обычно включает в себя источник углерода, источник азота, незаменимые аминокислоты, необходимые сахара, витамины, соли, фосфолипиды, белки и факторы роста. Для получения гамма-карбоксилированных полипептидов фактора VII культуральная среда будет содержать витамин К, предпочтительно при концентрации около 0,1 мг/мл до около 5 мг/мл. Затем применяют лекарственную селекцию для отбора культуры клеток, стабильно экспрессирующих селективный маркер. Для клеток, которые были трансфецированы селективным маркером, способным к амплификации, концентрация лекарственного средства может быть увеличена, для увеличения числа копий клонированных последовательностей и повышения уровней экспрессии. Затем проводят скрининг клонов стабильно трансфецированных клеток на экспрессию желаемого полипептида фактора VII.
Предпочтительные клеточные линии млекопитающих включают клеточные линии CHO (ATCC CCL 61), COS-1 (ATCC CRL 1650), клетки почки детеныша хомяка (BHK) и 293 (ATCC CRL 1573; Graham et al., J. Gen. Virol. 36: 59-72,1977). Предпочтительно клеточная линия BHK является клеточной линией tk-ts13 BHK (Waechter and Baserga, Proc. Natl. Acad. Sci. USA 79: 1106-1110, 1982), в дальнейшем называемые как клетки BHK 570. Клеточная линия BHK 570 имеется в наличии в American Type Culture Collection (ATСС), 12301 Parklawn Dr., Rockville, MD 20852, под входящим номером CRL 10314. Клеточная линия tk-ts1 3 BHK также имеется в наличии в АТСС под входящим номером CRL 1632. Кроме того, может быть использован ряд других клеточных линий, в том числе Rat Hep I (клетки крысиной гепатомы; ATCC CRL 1600), Rat Hep II (клетки крысиной гепатомы; ATCC CRL 1548), TCMK (ATCC CCL 139), клеточная линия легкого человека (ATCC HB 8065), NCTC 1469 (ATCC CCL 9.1) и клетки DUKX (Urlaub and Chasin, Proc. Natl. Acad. Sci. USA 77: 4216-4220, 1980).
По настоящему изобретению для получения полипептидов фактора VII может быть использована технология трансгенных животных. Предпочтительно получать белки внутри молочных желез самок млекопитающего-хозяина. Экспрессия в молочной железе и последующая секреция интересующего белка с молоком решает многие проблемы, которые возникают при выделении белков из других источников. Молоко легко собирать, оно доступно в больших количествах и биохимически хорошо описано. Более того, главные молочные белки присутствуют в молоке при высоких концентрациях (обычно приблизительно от 1 до 15 г/л).
С коммерческой точки зрения, несомненно, предпочтительно использовать в качестве хозяина биологический вид, имеющий большую молочную продуктивность. Несмотря на то, что могут быть использованы более мелкие животные, как, например, мыши и крысы, (и они являются предпочтительными для проверки основных стадий), предпочтительно использовать домашний скот, в том числе, но ими не ограничиваясь, свиней, коз, овец и коров. Овцы являются особенно предпочтительными вследствие таких факторов, как предшествующие данные о трансгенезе у этого вида, молочная продуктивность, стоимость и легкая доступность оборудования для сбора овечьего молока (смотри, например, WO 88/00239 для сравнения факторов, влияющих на выбор вида хозяина). Как правило, желательно выбирать породу животного-хозяина, которая была выведена для получения молока, как, например, овца East Friesland, или применять трансгенные линии молочного скота, выведенные в настоящее время. В любом случае, должны использоваться изученные, здоровые животные.
Чтобы добиться экспрессии в молочной железе, используется промотор транскрипции гена молочного белка. Гены молочного белка включают те гены, которые кодируют казеины (смотри патент США 5304489), бета лактоглобулин, лактальбумин и сывороточно-кислый белок. Промотор бета лактоглобулина (BLG) является предпочтительным. В случае овечьего бета лактоглобулина, как правило, будут использоваться, по крайней мере, проксимальные области 406 п.н. 5'-фланкирующей последовательности гена, хотя более крупные области, 5'-фланкирующей последовательности, до 5 т.п.н., являются предпочтительными, например фрагмент ДНК, включающий приблизительно 4,25 т.п.н. 5'-фланкирующего промотора и некодирующую область гена бета лактоглобулина (смотри Whitelaw et al., Biochem. J. 286: 31 39 (1992)). Аналогичные фрагменты промоторов ДНК других видов также могут использоваться.
Другие области гена бета лактоглобулина также могут быть включены в конструкции, как, например, геномные области экспрессируемого гена. В данной области общепринятыми являются конструкции, лишенные интронов, например, слабо экспрессирующие по сравнению с теми, которые содержат такие последовательности ДНК (смотри Brinster et al., Proc. Natl. Acad. Sci. USA 85: 836 840 (1988); Palmiter et al., Proc. Natl. Acad. Sci. USA 88: 478 482 (1991); Whitelaw et al., Transgenic Res. 1: 3 13 (1991); WO 89/01343; и WO 91/02318, каждый из которых приведен здесь в качестве ссылки). В этом отношении, в основном предпочтительно использовать геномные последовательности, содержащие все или некоторые нативные интроны гена, кодирующего интересующий белок или полипептид, таким образом, дальнейшее включение, по крайней мере, некоторых интронов, например гена бета лактоглобулина, является предпочтительным. Одной из таких областей является участок ДНК, который обеспечивает сплайсинг интронов и полиаденилирование РНК 3'-некодирующей области овечьего гена бета лактоглобулина. Если заменена природная 3'-некодирующая последовательность гена, то этот сегмент овечьего бета лактоглобулина может и увеличивать, и стабилизировать уровни экспрессии интересующего белка или полипептида. В других вариантах осуществления, область, окружающая последовательности инициации ATG варианта фактора VII, заменена соответствующими последовательностями гена определенного белка молока. Такая замена обеспечивает ткань-специфическую стимуляцию, приводящую к усилению экспрессии. Удобно заменить полностью препровариант фактора VII и 5'-некодирующие последовательности, соответственно, последовательностями, например ген BLG, хотя меньшие области могут быть заменены.
Для экспрессии полипептидов фактора VII трансгенных животных участок ДНК, кодирующий вариант фактора VII, функционально связан с дополнительными участками ДНК, необходимыми для его экспрессии и продукции единиц экспрессии. Такие дополнительные участки включают в себя вышеуказанный промотор, а также последовательности, которые обеспечивают терминацию транскрипции и полиаденирование мРНК. Единицы экспрессии дополнительно могут включать участок ДНК, кодирующий секреторную сигнальную последовательность, функционально связанную с участком, кодирующим модифицированный фактор VII. Секреторная сигнальная последовательность может быть нативной секреторной сигнальной последовательностью фактора VII, или может быть секреторной сигнальной последовательностью другого белка, например белка молока (см., например, von Heijne, Nucl. Acids Res. 14: 4683 4690 (1986); и Meade et al., U. S. 4,873, 316, которые приведены здесь в качестве ссылки).
Конструирование единиц экспрессии для использования у трансгенных животных обычно проводят путем вставки последовательности варианта фактора VII в плазмиду или фаговый вектор, содержащий дополнительные ДНК сегменты, хотя единица экспрессии может быть сконструирована по существу любой последовательностью лигирований. Особенно удобно использовать вектор, содержащий ДНК сегмент, кодирующий молочный белок, и заменить кодирующую последовательность молочного белка последовательностью варианта полипептида фактора VII; создавая, тем самым, слитый ген, который включает в себя экспрессию контрольных последовательностей гена молочного белка. В любом случае, клонирование единиц экспрессии в плазмидах или других векторах облегчает амплификацию последовательности варианта фактора VII. Амплификацию обычно проводят в бактериальных (например, E. coli) клетках-хозяевах, следовательно, векторы в основном будут содержать область начала репликации и селективный маркер, который может функционировать в бактериальных клетках-хозяевах. Затем единицу экспрессии вводят в оплодотворенные яйцеклетки (включая эмбрионы на ранней стадии) выбранных видов-хозяев. Введение гетерологичной ДНК может осуществляться несколькими путями, включая микроинъекцию (например, патент США № 4873191), инфекцию ретровирусом (Jaenisch, Science 240: 1468 1474 (1988)) или сайт-направленную интеграцию с использованием эмбриональных стволовых клеток (ES) (рассмотрено Bradley et al., Bio/Technology 10: 534 539 (1992)). Затем яйцеклетки имплантируют в фаллопиевы трубы или матку псевдобеременных самок и дают им развиваться. Потомство, которое несет ДНК, введенную в их зародышевую линию, может передавать эту ДНК своим потомкам нормальным, менделевским путем, что обеспечивает развитие трансгенных популяций. Общие методики получения трансгенных животных хорошо известны в данной области (смотри, например, Hogan et al., Manipulating the Mouse Embryo: A Laboratory Manual, Cold Spring Harbor Laboratory, 1986; Simons et al., Bio/Technology 6: 179 183 (1988); Wall et al., Biol. Reprod. 32: 645 651 (1985); Buhler et al., Bio/Technology 8: 140 143 (1990); Ebert et al., Bio/Technology 9: 835 838 (1991); Krimpenfort et al., Bio/Technology 9: 844 847 (1991); Wall et al., J. Cell. Biochem. 49: 113 120 (1992); US 4873191; US 4873316; WO 88/00239, WO 90/05188, WO 92/11757; и GB 87/00458). Методики введения последовательностей чужеродных ДНК млекопитающим и в их гаметы были первоначально разработаны на мыши (смотри, например, Gordon et al., Proc. Natl. Acad. Sci. USA 77: 7380 7384 (1980); Gordon and Ruddle, Science 214: 1244 1246 (1981); Palmiter and Brinster, Cell 41: 343 345 (1985); Brinster et al., Proc. Natl. Acad. Sci. USA 82: 4438 4442 (1985); и Hogan et al. (ibid.)). Эти методики были по существу адаптированы для использования у крупных животных, в том числе разновидностей домашнего скота (смотри, например, WO 88/00239, WO 90/05188 и WO 92/11757; и Simons et al., Bio/Technology 6: 179 183 (1988)). Подводя итоги, в наиболее эффективном способе, используемом к настоящему времени, для получения трансгенных мышей или домашнего скота в одно из проядер оплодотворенного яйца инъецировано несколько сотен интересующих линейных молекул ДНК, в соответствии с принятыми методиками. Также можно использовать инъецирование ДНК в цитоплазму зиготы.
Также может использоваться получение в трансгенных растениях. Экспрессия может быть генерализована или направлена на конкретный орган, например клубень (смотри, Hiatt, Nature 344: 469 479 (1990); Edelbaum et al., J. Interferon Res. 12: 449 453 (1992); Sijmons et al., Bio/Tech№logy 8: 217 221 (1990); и EP 0255378).
Полипептиды фактора VII по изобретению восстанавливают из клеточной культуральной среды или молока. Полипептиды фактора VII по изобретению могут быть очищены различными способами, известными в данной области, в том числе, но ими не ограничиваясь, хроматографией (например, ионообменной, аффинной, гидрофобной, хроматофокусированием и гель-хроматографией), электрофоретическими способами (например, препаративным изоэлектрофокусированием (IEF), дифференциальной растворимостью (например, осаждением сульфатом аммония) или экстракцией (смотри, например, Protein Purification, J. -C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989). Предпочтительно их можно очистить аффинной хроматографией на колонке с антителом к фактору VII. Применение кальций-зависимых моноклональных антител описано у Wakabayashi et al., J. Biol. Chem. 261: 11097-11108, (1986) и Thim et al., Biochemistry 27: 7785-7793, (1988). Дополнительная очистка может быть осуществлена обычными способами химической очистки, такими как высокоэффективная жидкостная хроматография. В данной области известны другие способы очистки, в том числе осаждение цитратом бария, и они могут быть использованы для очистки новых полипептидов фактора VII, описанных здесь (смотри, например, Scopes, R., Protein Purification, Springer-Verlag, N. Y., 1982).
Для терапевтических целей предпочтительно, чтобы полипептиды фактора VII изобретения были по существу очищены. Таким образом, в предпочтительном варианте осуществления изобретения полипептиды фактора VII изобретения являются очищенными по меньшей мере на 90-95% гомогенности, предпочтительно по меньшей мере на 98% гомогенности. Чистота может быть оценена, например, гель-электрофорезом и секвенированием аминоконца аминокислоты.
Полипептиды фактора VII расщеплены в сайтах активации, для преобразования в двухцепочечную форму. Активирование может проводиться в соответствии с процедурами, известными в области применения, как, например, те, что описаны у Osterud, et al., Biochemistry 11: 2853-2857 (1972); Thomas, патент США № 4456591; Hedner and Kisiel, J. Clin. Invest. 71: 1836-1841 (1983); or Kisiel and Fujikawa, Behring Inst. Mitt. 73: 29-42 (1983). Альтернативно, как описано у Bjoern et al. (Research Disclosure, 269 September 1986, pp. 564-565), фактор VII может быть активирован при прохождении через ионообменную хроматографическую колонку, например Mono Q (Pharmacia fine Chemicals), или в этом роде. Полученный полипептид активированного фактора VII может быть затем введен в состав лекарственного средства и использован как описано ниже.
Способы
Гидролиз in vitro.
Неизмененный фактор VIIa (нативный) и вариант VIIa фактора (оба называемые здесь «фактор VIIa») исследовали параллельно, для непосредственного сравнения их удельных активностей. Исследование осуществляли в титрационном микропланшете. (MaxiSorp, Nunc, Denmark). Хромогенное вещество D-Ile-Pro-Arg-p-nitroanilide (S-2288, Chromogenix, Sweden), с конечной концентрацией 1 мМ, добавляли к фактору VIIа (конечная концентрация 100 нM) в 50 мМ Hepes, pH 7,4, содержащем 0,1 M NaCl, 5 мМ CaCl2 и 1 мг/мл бычьего сывороточного альбумина. Абсорбцию при 405 нм измеряли непрерывно на SpectraMax 340 планшет-ридере (Molecular Devices, USA). Абсорбцию, развивающуюся в течение 20-минутной инкубации, после вычитания абсорбции в контрольной лунке, не содержащей фермент, использовали для вычисления отношения между активностью варианта фактора VIIa и неизмененного фактора VIIa:
Отношение = (A405 нм варианта фактора VIIa)/(A405 нм неизмененного фактора VIIa).
Протеолиз in vitro
Неизмененный фактор VIIa (Нативный) и вариант VIIa фактора (оба называемые здесь «фактор VIIa») исследовали параллельно, для непосредственного сравнения их удельных активностей. Исследование осуществляли в титрационном микропланшете (MaxiSorp, Nunc, Denmark). Фактор VIIa (10 нM) и фактор X (0,8 мкM) в 100 мкл 50 мМ Hepes, pH 7,4, содержащем 0,1 M NaCl, 5 мМ CaCl2 и 1 мг/мл бычьего сывороточного альбумина, инкубировали 15 минут. Расщепление фактора X затем останавливали добавлением 50 мкл 50 мМ Hepes, pH 7,4, включающего 0,1 M NaCl, 20 мМ EDTA и 1 мг/мл бычьего сывороточного альбумина. Количество синтезированного фактора Xa определяли добавлением хромогенного вещества Z-D-Arg-Gly-Arg-p-nitroanilide (S-2765, Chromogenix, Swe-den), с конечной концентрацией 0,5 мМ. Абсорбцию при 405 нм непрерывно измеряли на SpectraMax 340 планшет-ридере (Molecular Devices, USA). Абсорбцию, развивающуюся в течение 10 минут, после вычитания абсорбции бланка, не содержащего FVIIa, использовали для вычисления отношения между протеолитической активностью варианта фактора VIIa и неизмененного фактора VIIa:
Отношение = (A405 нм варианта фактора VIIa)/(A405 нм неизмененного фактора VIIa).
Анализ скорости образования GD-FVIIa
Скорость образования GD-FVIIa (FVIIa, лишенный GLA-домена, фрагмен 39-406) определяли как повышение относительного содержания GD-FVIIa в данный период времени. Анализ раствора FVIIa, в котором определяли скорость образования GD-FVIIa, проводили дважды. Один исходный образец и один после инкубации при исследуемых условиях (pH, концентрация, температура и т.д). Сразу же после взятия образцов их кипятили в буфере для образца, для остановки любой дальнейшей деградации во время проведения анализа. Два образца анализировали в невосстановленном SDS-PAGE и зону полосы GD-FVIIa определяли относительно FVIIa. Для получения скорости образования GD-FVIIa увеличение содержания GD-FVIIa в течение инкубации во время между начальной и конечной пробами затем может быть разделено на время инкубации. SDS-PAGE проводили для образцов с приблизительной концентрацией FVIIa 1 мг/мл, которые смешивали с равным количеством нагрузочного буфера и кипятили 5 минут. Образец перемещали в лунку образца в 12% NuPAGE Bis-Tris в рабочем буфере MOPS. Электрическое поле поддерживали до тех пор, пока фронт образца мигрировал к основанию геля. Кассету с гелем демонтировали, гель извлекали и фиксировали, окрашивали раствором Кумасси и, наконец, удаляли краситель перед высушиванием геля. В 1,3 мг/мл растворе FVIIa в буфере, содержащем 125 микромолярный CaCl2, 75 мМ NaCl, 10 мМ глицерин, pH 8,6 начальное содержание GD-FVIIa составляло 10%, а после 24-часовой инкубации содержание GD-FVIIa повышалось до 70%. Следовательно, скорость образования определялась как 60% GD-FVIIa/24 ч. Сходный образец с концентрацией CaCl2 2,5 мМ показывал увеличение содержания GD-FVII с 6,6% до 8,2% в течение 24 часов, со скоростью образования GD-FVIIa 1,6% GD-FVIIa/24 ч.
Объем описанного и заявленного здесь изобретения не ограничивается описанными здесь отдельными вариантами осуществления, поскольку эти варианты осуществления предназначены для иллюстрации некоторых аспектов изобретения. Любые аналогичные варианты входят в состав настоящего изобретения. Действительно, различные модификации изобретения в дополнение к показанным и описанным здесь станут очевидными для специалиста из предшествующего описания. Такие модификации также входят в рамки приведенной формулы изобретения. В случае конфликта, настоящее изобретение, включая определения, будет иметь преимущественную силу.
Настоящее изобретение дополнительно описано следующими примерами, которые не должны рассматриваться как ограничивающие область применения изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Образование FVIIa без домена GLA (GD-FVIIa). На фигуре 1 показана скорость образования GD-FVIIa в зависимости от молярного соотношения FVIIa и Ca2+ (Кальциевые эквиваленты = FVIIa:Ca2+). Условия проведения эксперимента: 1,3 мг/мл FVIIa, 75 мМ NaCl, 10 мМ глицерина, pH 8,5.
ПРИМЕРЫ
Из следующих примеров понятно, что способ может быть использован для любого полипептида FVII на основании настоящего изобретения. Также понятно, что стадии примеров 2-19 могут быть объединены в произвольном порядке для достижения определенной степени чистоты полипептида FVII.
Пример 1
Стабилизация собранной клеточной культуры, путем установления концентрации
Cu2+, равной 200 микромоль.
500 мл порцию супернатанта клеточной культуры ВНК-21 с аналогичной концентрацией FVII 20 мг/л профильтровали через 0,45 микронный фильтр с «глухим» концом. Собранные клетки, выросшие в культуре, содержащей свободные ионы Ca2+ в концентрации 2 мМ, затем стабилизировали добавлением раствора нитрата меди (II) до концентрации Cu2+ 200 микромоль. Стабилизированный супернатант культуры хранили при температуре 5°С перед дальнейшей обработкой.
Пример 2
Очистка полипептида FVII при помощи гидрофобной хроматографии (HIC) в присутствии Cu2+ и элюирование при низких значениях рН.
Гидрофобную хроматографию (HIC) проводили на колонке (1 см внутренний диаметр × 7 см длина = 5,5 мл), заполненной смолой Toyopearl MD-G Butyl. Колонку уравновешивали 10 объемами колонки раствора, включающего 35 мМ CaCl2, 0,1 мМ Cu(N03)2·3 H2O, 1,5 M NaCl, 10 мМ трис, pH 7,5. После уравновешивания 42 мл раствора, содержащего 0,1 мг/мл FVIIa, вносили на колонку. После внесения колонку отмывали 10 объемами колонки уравновешивающего буфера.
Связанный FVII(a) элюировали с использованием 20 мМ EDTA, 50 мМ гистидина, pH 6,0.
Пример 3
Выполнение гель-хроматографии в присутствии ионов Cu2+.
Гель-хроматографию проводили на 3 мл (1 мг/мл) образца аналога гиперактивного FVIIa в буферном растворе, содержащем гистидин, при рН 6,0. Образец фильтровали через 1 микронный фильтр с «глухим» концом перед нанесением в Toyopearl HW-55F (1 см внутренний диаметр × 100 см длина = 79 мл ОК) (объем колонки)), уравновешенной в буфере, содержащем 50 мМ NaCl, 0,1 мМ нитрат меди (II), 10 мМ гистидина, pH 6,0. Рабочий буфер был идентичен буферу для уравновешивания. Все звенья очистки выполняли при скорости потока 12 см/ч и температуре 5°C.
Пример 4
Стабилизация собранной клеточной культуры, адаптируя к рН 6.
500 мл порцию супернатанта клеточной культуры CHO K1 с концентрацией аналога FVIIa 50 мг/л стабилизировали путем добавления 20 мМ гистидина и последующим доведением рН до значения 6,0. Стабилизированный супернатант культуры фильтровали через 0,45 микронный фильтр с «глухим» концом и хранили при 5°C перед дальнейшей обработкой.
Пример 5
Проведение анионообменной хроматографии при pH 6.
Анионообменную хроматографию проводили на колонке (1 см внутренний диаметр × 10 см длина = 7,85 мл объем колонки (ОК)), заполненной Pharmacia Q-Sepharose Fast Flow, уравновешенной 5 ОК буфера, содержащего 5 мМ EDTA, 10 мМ гистидина, pH 6,0. Колонку нагружали 40 ОК профильтрованного раствора, содержащего 1 мг/мл аналога FVIIa, с последующим отмыванием 5 ОК с использованием 50 мМ NaCl, 10 мМ гистидина, pH 6,0. Элюцию выполняли с использованием 40 ОК NaCl с градиентом от 50 мМ NaCl до 750 мМ NaCl, буфферным раствором, содержащим 10 мМ гистидина, рН 6,0. Полную очистку выполняли при скорости потока 20 ОК/ч и температуре 5°C.
Пример 6
Проведение анионообменной хроматографии при pH 9.
Анионообменную хроматографию проводили на колонке (1 см внутренний диаметр × 10 см длина = 7,85 мл объем колонки (ОК)), заполненной Pharmacia Q-Sepharose Fast Flow, уравновешенной 5 ОК буфера, содержащего 5 мМ EDTA, 10 мМ гистидина, pH 9.0. Колонку нагружали 40 ОК профильтрованного раствора, содержащего 1 мг/мл аналога FVIIa, с последующим отмыванием 5 ОК с использованием 50 мМ NaCl, 10 мМ гистидина, pH 9,0. Элюцию выполняли с использованием 40 ОК NaCl с градиентом от 50 мМ NaCl до 750 мМ NaCl, буферным раствором, содержащим 10 мМ гистидин, рН 9,0. Полную очистку выполняли при скорости потока 20 ОК/ч и температуре 5°C
Пример 7
Проведение гель-хроматографии при pH 6.
Гель-хроматографию проводили на 1,5 мл образца (1 мг/мл) аналога гиперактивного FVIIa, в буферном растворе, содержащем гистидин при pH 6. Образец фильтровали через 0,45 микронный фильтр с «глухим» концом перед нанесением на Pharmacia Superdex 200 колонку (1 см внутренний диаметр × 60 см длина = 47 мл ОК), уравновешенную буфером, включающим 50 мМ NaCl, 10 мМ CaCl2, 10 мМ гистидина, pH 6,0. Рабочий буфер был идентичен уравновешивающему буферу. Все звенья очистки выполняли при скорости потока 0,3 ОК/ч и температуре 5°C.
Пример 8
Проведение гель-хроматографии при pH 9.
Гель-хроматографию проводили на 1,5 мл образца (1 мг/мл) аналога гиперактивного FVIIa, в буферном растворе, содержащем гистидин при pH 9,0. Образец фильтровали через 0,45 микронный фильтр с «глухим» концом перед нанесением на Pharmacia Superdex 200 колонку (1 см внутренний диаметр × 60 см длина = 47 мл ОК), уравновешенную буфером, включающим 50 мМ NaCl, 10 мМ CaCl2, 10 мМ гистидина, pH 9,0. Рабочий буфер был идентичен уравновешивающему буферу. Все звенья очистки выполняли при скорости потока 0,3 ОК/ч и температуре 5°C.
Пример 9
Проведение ультрафильтрации при pH 6.
Ультрафильтрацию супернатанта культуры HEK293, содержащей гиперактивный аналог FVIIa, проводили в системе Millipore lab scale Tangential Flow Filtration (TFF), с использованием 50 см2 30 кДа Biomax фильтровальной кассеты. Клетки, выросшие в культуре, фильтровали через фильтр с «глухим» концом и стабилизировали добавлением гистидина до концентрации 20 мМ и доведением значения рН до 6,0. 500 граммов профильтрованных через фильтр с «глухим» концом и стабилизированных клеток, выросших в культуре, подвергали ультрафильтрации при транс-мембранном давлении (ТМР) 2 бара, до конечной массы ультраконцентрата приблизительно 25 г, что эквивалентно 20-кратной концентрации гиперактивного аналога FVIIa. Полный процесс протекал при температуре окружающей среды (20°С).
Пример 10
Проведение иммуноаффинной очистки при pH 6.
Порцию 1500 мл супернатанта культуры HEK293 стабилизировали добавлением кальция в концентрации 10 мМ Ca2+ и добавлением буфера, содержащего гистидин в концентрации 10 мМ, доведением рН до 6,0 соляной кислотой (HCl) и фильтровали через 0,45 микронный фильтр с «глухим» концом. Стабилизированный супернатант культуры наносили на колонку (1,6 см внутренний диаметр × 10 см длина = 20 мл ОК), заполненную Ca2+-зависимым анти-FVIIa моноклональным антителом, иммобилизированным на Pharmacia Sepharose 4B. Перед нагружением колонку уравновешивали 5 ОК буфера, содержащего 10 мМ CaCl2, 10 мМ гистидин, pH 6,0. После нагружения колонку отмывали 10ОК буфера, содержащего 2 M NaCl, 10 мМ CaCl2, 10 мМ гистидин, pH 6,0. Связанный FVII(a) элюировали 10ОК буфера, содержащего 30 мМ EDTA, 50 мМ гистидин, pH 6,0. Во время очистки использовали скорость потока 12 ОК/ч и температуру 5°С.
Пример 11
Проведение иммуноаффинной очистки при pH 9.
Порцию 1500 мл супернатанта культуры HEK293 стабилизировали добавлением кальция в концентрации 10 мМ Ca2+ и добавлением буфера, содержащего гистидин в концентрации 10 мМ, доведением рН до 9,0 соляной кислотой (HCl) и фильтровали через 0,45 микронный фильтр с «глухим» концом. Стабилизированный супернатант культуры наносили на колонку (1,6 см внутренний диаметр × 10 см длина = 20 мл ОК), заполненную Ca2+-зависимым анти-FVIIa моноклональным антителом, иммобилизированным на Pharmacia Sepharose 4B. Перед нагружением колонку уравновешивали 5 ОК буфера, содержащего 10 мМ CaCl2, 10 мМ гистидин, pH 9,0. После нагружения колонку отмывали 10ОК буфера, содержащего 2 M NaCl, 10 мМ CaCl2, 10 мМ гистидин, pH 9,0. Связанный FVII(a) элюировали 10ОК буфера, содержащего 30 мМ EDTA, 50 мМ гистидин, pH 9,0. Во время очистки использовали скорость потока 12 ОК/ч и температуру 5°С.
Пример 12
Стабилизация собранной клеточной культуры путем доведения концентрации Ca2+ до 10 мМ.
450 мл порцию супернатанта клеточной культуры HEK293, содержащую аналог FVIIa (концентрация 50 мг/мл) и ионы кальция (концентрация приблизительно 2 мМ), стабилизировали добавлением раствора CaCl2 до конечной концентрации 10 мМ Ca2+. Раствор фильтровали через 0,45 микронный фильтр с «глухим» концом и хранили при температуре 5°С перед последующей обработкой.
Пример 13
Проведение ультра- и диафильтрации в присутствии 20 мМ Ca2+. Ультрафильтрацию гиперактивного аналога FVIIa проводили на системе Millipore lab scale Tangential Flow Filtration (TFF) с использованием 50 см2 30 кДа Biomax фильтрационной кассеты.
Элюат аналога FVIIa стабилизировали добавлением раствора кальция до концентрации 20 мМ Ca2+, гистидина до концентрации 10 мМ и доведением значения pH до 6,0. 400 граммов стабилизированного аналога FVIIa подвергали ультрафильтрации при транс-мембранном давлении (TMP) 2 бара до конечной массы ультраконцентрата приблизительно 25 г, что эквивалентно 16-кратной концентрации. Ультрафильтрацию сопровождали трижды проведенной циклической диафильтрацией с буфером, содержащим 20 мМ CaCl2, 10 мМ гистидина, pH 6,0. Для обеих манипуляций использовали одинаковое TMP. Полный процесс происходил при окружающей температуре (20°С).
Пример 14
Проведение иммуноаффинной очистки в присутствии 20 мМ Ca2+.
1000 мл порцию супернатанта культуры BHK-21 стабилизировали добавлением кальция до концентрации 10 мМ Ca2+ и добавлением буфера трис до концентрации 10 мМ и с последующим доведением соляной кислотой (HCl) pH до значения 8, фильтровали через 0,45 микронный фильтр с «глухим» концом. Стабилизированный культуральный супернатант нагружали на колонку (1,6 см внутренний диаметр × 10 см длина = 20 мл ОК), заполненную Ca2+-зависимым анти-FVIIa моноклональным антителом, иммобилизированным на Pharmacia Sepharose 4B. Перед нагружением колонку уравновешивали 5 ОК буфера, содержащего 10 мМ CaCl2, 10 мМ трис, pH 8. После нагружения колонку отмывали 10 ОК буфера, содержащего 2 M NaCl, 10 мМ CaCl2, 10 мМ трис, pH 8. Связанный FVII(a) элюировали с помощью 10 ОК буфера, содержащего 30 мМ EDTA, 50 мМ трис, pH 8. На всем протяжении очистку проводили при скорости потока 12 ОК/h и температуре 5°С. Элюат сразу же стабилизировали добавлением хлорида кальция до конечной концентрации 50 мМ.
Пример 15
Проведение иммуноаффинной очистки с нагрузкой и отмывкой в присутствии 20 мМ Ca2+ с последующим элюированием при pH 6.
800 мл порцию супернатанта культуры CHO K1 стабилизировали добавлением кальция до конечной концентрации Ca2+ 10 мМ. Затем добавляли буфер Трис до концентрации 10 мМ, соляной кислотой (HCI) значение рН доводили до 7,5 и фильтровали через 0,45 микронный фильтр с «глухим» концом. Стабилизированный культуральный супернатант нагружали на колонку (1,6 см внутренний диаметр × 2 см длина = 4 мл ОК), заполненную Ca2+-зависимым анти-FVIIa моноклональным антителом, иммобилизированным на Pharmacia Sepharose 4B. Перед нагружением колонку уравновешивали 5 ОК буфера, содержащего 10 мМ CaCl2, 10 мМ трис, pH 7,5. После нагружения колонку отмывали с использованием 10 ОК буфера, содержащего 2 M NaCl, 10 мМ CaCl2, 10 мМ трис, pH 7,5, с последующей второй отмывкой 10 ОК буфера, содержащего 2 M NaCl, 10 мМ CaCl2, 10 мМ гистидина, pH 6,0. Связанный FVII(a) элюировали с помощью 10 ОК буфера, содержащего 30 мМ EDTA, 50 мМ гистидин, pH 6,0. На всем протяжении очистку проводили при скорости потока 12 ОК/ч и температуре 5°С.
Пример 16
Проведение гель-хромотографии в присутствии Ca2+.
Гель-хромотографию проводили на 5 мл образца (1 мг/мл) гиперактивного аналога FVIIa в буферном растворе, содержащем гистидин при pH 6,0. Образец фильтровали через 1 микронный фильтр с «глухим» концом, перед его нанесением на Pharmacia Superdex 200 (1 см внутренний диаметр × 80 см длина = 63 мл ОК), уравновешенной буфером, включающим 50 мМ NaCl, 35 мМ CaCl2, 10 мМ гистидин, pH 6,0. Рабочий буфер был идентичен уравновешивающему буферу. Все стадии очистки проводили при скорости потока 15 см/ч и температуре 5°С.
Пример 17
Проведение ультрафильтрации и диафильтрации при pH 6 с высокой концентрацией Ca2+.
Ультрафильтрацию супернатанта культуры HEK293, содержащей гиперактивный аналог FVIIa, проводили на системе Millipore lab scale Tangential Flow Filtration (TFF), с использованием 50 см2 30 кДа Biomax фильтрационной кассеты. Профильтрованные через фильтр с «глухим» концом клетки, выросшие в культуре, стабилизировали добавлением гистидина до концентрации 20 мМ и доведением pH до 6,0. К 500 граммам профильтрованных через фильтр с «глухим» концом и стабилизированных клеток, выросших в культуре, добавляли кальций до концентрации 35 мМ и ультра-фильтровали при транс-мембранном давлении (TMP) в 2 бара до конечной массы ультраконцентрата приблизительно 25 г, что эквивалентно 20-кратной концентрации гиперактивного аналога FVIIa. Ультрафильтрацию сопровождали проведенной трижды циклической диафильтрацией, в буфере, включающем 35 мМ CaCl2, 10 мМ гистидина, pH 6,0. Обе операции выполняли при одинаковом TMP. Полный процесс проводили при окружающей температуре (20°С).
Пример 18
Стабилизация клеток, выросших в культуре, используя и доведение pH до 6 и добавление Cu2+.
500 мл порцию супернантанта клеточной культуры CHO-K1, содержащей 50 мг/л аналога FVIIa, фильтровали через 0,45 микронный фильтр с «глухим» концом. К клеткам, выросшим в культуре, содержащим 2 мМ Ca2+, добавляли 10 мМ гистидин, с последующим доведением рН с помощью HCl до значения 6,0. Клетки, выросшие в культуре, затем стабилизировали добавлением раствора нитрата меди (II) (концентрация Cu2+ 200 микромоль). Стабилизированный супернатант культуры хранили при температуре 5°С перед последующей обработкой.
Пример 19
Стабилизация клеток, выросших в культуре, используя и доведение pH до 6 и добавление Cа2+.
1000 мл порцию супернатанта клеточной культуры HEK293, содержащей 50 мг/мл аналога FVIIa и ионы кальция в концентрации приблизительно 2 мМ, стабилизировали добавлением раствора CaCl2 до конечной концентрации 10 мМ Ca2+. Добавляли гистидин до концентрации 10 мМ, с последующим доведением рН с помощью HCl до значения 6,0. Раствор фильтровали через 0,45 микронный фильтр с «глухим» концом и хранили при температуре 5°С перед последующей обработкой.
Пример 20
Влияние Cu2+ на стабильность полипептида FVII проверяли в эксперименте, в котором очищенный полипептид FVII адсорбировали на Q-Sepharose FF матрице при различных концентрациях Cu2+.
В 1,5 мл пробирках инкубировали 500 мкг полипептида FVII с 50 мкл Q-Sepharose FF в 800 мкл буфера, содержащего 10 мМ Трис, 50 мМ NaCl, 2 мМ CaCl2 и различные концентрации нитрата меди (II). Через 1 час и 2 часа матрицу осаждали центрифугированием, супернатант отбирали. Добавляли 800 мкл буфера (10 мМ Tрис, 50 мМ NaCl, 25 мМ CaCl2 pH 8,0), после смешивания и центрифугирования образцы супернатанта собирали и анализировали на SDS-PAGE.
Пример 21
Очистку и активирование полипептида FVII проводили через следующие четыре хромотографические стадии:
Стадия 1: ионную силу культуральной клеточной среды, содержащей полипептид FVII, разведением доводили до значения ниже 10 мСм/см и наносили на Q-Sepharose колонку, предварительно уравновешенную буфером A: 10 мМ тригидроксиметиламинометан (Трис); 150 мМ NaCl pH 8.
После стадии отмывки с 175 мМ NaCl в том же самом буфере полипептид FVII элюировали буфером B: 10 мМ Трис; 150 мМ NaCl; 25мМ CaC12, pH 8.
Стадия 2: Раствор элюата, содержащий 104 мг/л полипептида FVII, доводили до конечного состава: 10 мМ Трис; 1M NaCl; 25мМ CaC12; 70 мкМ нитрата меди (II), pH 7,5, и наносили на Sepharose колонку с иммобилизированным анти-FVII моноклональным антителом.
Колонку с антителом предварительно уравновешивали буфером C: 10 мМ Tрис; 100 мМ NaCl; 20мМ CaCl2; 70 мкМ нитрата меди (II), pH 7,5. Затем колонку отмывали с помощью буфера, содержащего 10 мМ Трис; 2 M NaCl; 20мМ CaCl2; 70 мкМ нитрата меди (II), pH 7,5 с последующей отмывкой буфером С. Затем полипептид FVII элюировали буфером, содержащим 75 мМ Трис; 30 мМ тринатрийцитрата; 70 мкМ нитрата меди (II), pH 7,5.
Стадия 3: Элюат сразу же наносили на Q-Sepharose колонку, предварительно уравновешенную буфером: 10 мМ Трис; 150 мМ NaCl; 70 мкМ нитрата меди (II), pH 8,6.
Колонку отмывали тем же самым буфером и полипептид FVII, элюировали в линейном градиенте из буфера А в буфер D: 10 мМ Трис; 500 мМ NaCl; 70 мкМ нитрата меди (II), pH 8,6.
Стадия 4: ионную силу фракции, содержащей полипептид FVII, разведением доводили до значения ниже 10 мСм/см, и сразу же наносили на Q-Sepharose колонку, предварительно уравновешенную буфером: 10 мМ глицил-глицин; 150 мМ NaCl; 70 мкМ нитрата меди (II), pH 8,6.
После отмывки буфером: 10 мМ глицил-глицин; 175 мМ NaCl; 70 мкМ нитрата меди (II), pH 8,6; и буфером E: 10 мМ глицил-глицин; 100 мМ NaCl; 70 мкМ нитрата меди (II), pH 8,6, полипептид FVII элюировали в линейном градиенте из буфера E в буфер: 10 мМ глицил-глицин; 100 мМ NaCl; 15 мМ CaCl2; 70 мкМ нитрата меди (II), pH 8,6. Скорость потока 1 об/ч.
Пример 22
Очистку и активирование полипептида FVII проводили через следующие четыре хроматографические стадии:
Стадия 1: ионную силу культуральной клеточной среды, содержащей полипептид FVII, разведением доводили до значения ниже 10 мСм/см и наносили на Q-Sepharose колонку, предварительно уравновешенную буфером A: 10 мМ тригидроксиметиламинометан (Трис); 150 мМ NaCl pH 8.
После стадии отмывки с 175 мМ NaCl в том же самом буфере, полипептид FVII элюировали буфером B: 10 мМ Трис; 150 мМ NaCl; 25 мМ CaCl2 pH 8.
Стадия 2: Раствор элюата, содержащий 104 мг/л полипептида FVII, доводили до конечного состава: 10 мМ Трис; 1M NaCl; 25мМ CaCl2; 70 мкМ нитрата меди (II), pH 7,5, и наносили на Sepharose колонку с иммобилизированным анти-FVII моноклональным антителом.
Колонку с антителом предварительно уравновешивали буфером C: 10 мМ Трис; 100 мМ NaCl; 20мМ CaCl2; 70 мкМ нитрата меди (II), pH 7,5. Затем колонку отмывали с помощью буфера, содержащего 10 мМ Трис; 2 M NaCl; 20мМ CaCl2; 70 мкМ нитрата меди (II), pH 7,5 с последующей отмывкой буфером С. Затем полипептид FVII элюировали буфером: 75 мМ Трис; 30 мМ тринатрийцитрат; 70 мкМ нитрата меди (II), pH 7,5.
Стадия 3: Элюат сразу же наносили на Q-Sepharose колонку, предварительно уравновешенную буфером: 10 мМ Трис; 150 мМ NaCl; 70 мкМ нитрата меди (II), pH 8,6.
Колонку отмывали тем же самым буфером и полипептид FVII элюировали в линейном градиенте из буфера А в буфер D: 10 мМ Трис; 500 мМ NaCl; 70 мкМ нитрата меди (II), pH 8,6.
Стадия 4: Фракию, содержащую полипептид FVII, доводили до концентрации EDTA 2 мМ и ионной силы фракции ниже 10 мСм/см путем разведения, и сразу же наносили на Q-Sepharose колонку, предварительно уравновешенную буфером: 10 мМ глицил-глицин; 150 мМ NaCl pH 8,6.
После отмывки буфером, содержащим 10 мМ глицил-глицина; 175 мМ NaCl, pH 8,6 и буфером E, содержащим 10 мМ глицил-глицина; 100 мМ NaCl pH 8,6, полипептид FVII элюировали в линейном градиенте из буфера E в буфер, содержащий 10 мМ глицил-глицина; 100 мМ NaCl; 15 мМ CaCl2 pH 8,6. Скорость потока 1 об/ч.
Пример 23
Очистку и активирование полипептида FVII проводили через следующие четыре хроматографические стадии:
Стадия 1: ионную силу культуральной клеточной среды, содержащей полипептид FVII, разведением доводили до значения ниже 10 мСм/см и наносили на Q-Sepharose колонку, предварительно уравновешенную буфером A: 10 мМ тригидроксиметиламинометан (Трис); 150 мМ NaCl pH 8.
После стадии отмывки с 175 мМ NaCl в том же самом буфере полипептид FVII элюировали буфером B: 10 мМ Трис; 150 мМ NaCl; 25мМ CaC12, pH 8.
Стадия 2: Раствор элюата, содержащий 104 мг/л полипептида FVII, доводили до конечного состава: 10 мМ Tris; 1M NaCl; 25 мМ CaCl2; 70 мкМ нитрата меди (II), pH 7,5, и наносили на Sepharose колонку с иммобилизированным анти-FVII моноклональным антителом.
Колонку с антителом предварительно уравновешивали буфером C: 10 мМ Трис; 100 мМ NaCl; 20мМ CaCl2; 70 мкМ нитрата меди (II), pH 7,5. Затем колонку отмывали буфером: 10 мМ Трис; 2 M NaCl; 20мМ CaCl2; 70 мкМ нитрата меди (II), pH 7,5; затем следовала отмывка буфером С. Затем полипептид FVII элюировали буфером: 75 мМ Трис; 30 мМ тринатрийцитрат; 70 мкМ нитрата меди (II), pH 7,5.
Стадия 3: Элюат адаптировали до 2 мМ EDTA, и сразу же наносили на Q-Sepharose колонку, предварительно уравновешенную буфером: 10 мМ Трис; 150 мМ NaCl pH 8,6.
Колонку отмывали тем же самым буфером и полипептид FVII элюировали в линейном градиенте из буфера A в буфер D: 10 мМ Трис; 500 мМ NaCl pH 8,6.
Стадия 4: Ионную силу фракции, содержащей полипептид FVII, разведением доводили до значения ниже 10 мСм/см и сразу же наносили на Q-Sepharose колонку, предварительно уравновешенную буфером: 10 мМ глицил-глицин; 150 мМ NaCl pH 8,6.
После отмывки буфером: 10 мМ глицил-глицин; 175 мМ NaCl pH 8,6 и буфером E: 10 мМ глицил-глицин; 100 мМ NaCl pH 8,6, полипептид FVII элюировали в линейном градиенте из буфера E в буфер: 10 мМ глицил-глицин; 100 мМ NaCl; 15 мМ CaCl2 pH 8,6. Скорость потока 1 об/ч.
Пример 24
Ультра- и диафильтрация полипептидов фактора VII.
Собирали 130 литров супернатанта клеточной культуры CHO, содержащей полипептид фактора VII.
Клетки, выросшие в культуре, стабилизировали добавлением гистидина до концентрации 10 мМ, доведением значения pH до 6,0 и добавлением 1 мМ CaCl2. Супернатант фильтровали через ряд фильтров, в том числе 3,0 мкм, 1,0 мкм и 0,3 мкм Millipore осветляющие фильтры. Прозрачный супернатант подвергали ультрафильтрации через 0,2 м2 Millipore Biomax 50 мембрану до 10-кратного уменьшения объема. Ультрафильтрацию проводили при заданной величине TMP, равной 32 фунтам на кв. дюйм и при заданной величине перекрестного потока, равной 600 мл/мин. После достижения желаемого объема ультраконцентрата трижды проводили циклическую диафильтрацию. Диафильтрационный буфер состоял из 5 мМ гистидина, 20 мМ NaCl, 1 мМ CaCl2, 0,07 г/л Tween 80, pH 6,0.
Ультра- и диафильтрация неизмененного FVIIа (wt-FVIIa).
100 литров супернатанта клеточной культуры CHO, содержащей неизмененный FVIIa, собирали и стабилизировали добавлением гистидина до концентрации 10 мМ, доведением значения pH до 6,0 и добавлением 1 мМ CaCl2. Супернатант подвергали фильтрации и ультрафильтрации через 0,2 м2 Millipore Biomax 50 мембрану до 10-кратного уменьшения объема. После достижения желаемого объема ультраконцентрата, трижды проводили циклическую диафильтрацию. Диафильтрационный буфер состоял из 5 мМ гистидина, 20 мМ NaCl, 1 мМ CaCl2, 0,07 г/л Tween 80, pH 6,0.
Изобретение относится к области биотехнологии, конкретно к выделению сериновых протеаз, содержащих GLA-остаток, и может быть использовано в медицине. Очищенную сериновую протеазу, содержащую GLA-остаток, получают путем культивирования клетки-хозяина млекопитающего, экспрессирующей указанную сериновую протеазу в культуральной среде, сбора культуральной среды, содержащей указанную сериновую протеазу, и очистки указанной сериновой протеазы от культуральной среды при рН от 4,5 до 6,9 или от 8,6 до 10 и концентрации свободных ионов кальция либо выше 20 мМ, либо ниже 1 мМ. Изобретение позволяет получить стабильный очищенный полипептид фактора VII, IX или X. 3 н. и 39 з.п. ф-лы, 1 ил.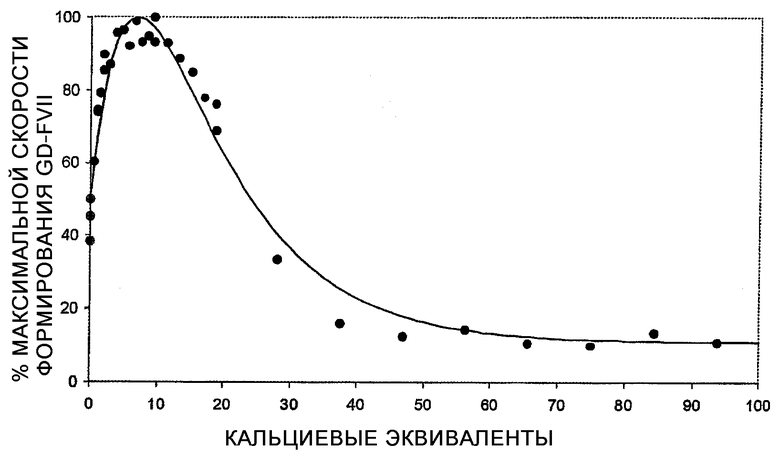
1. Способ получения очищенной сериновой протеазы, содержащей GLA-остаток, которая представляет собой очищенный полипептид фактора VII, очищенный полипептид фактора IX или очищенный полипептид FX, где указанный способ включает:
(i) культивирование клетки-хозяина млекопитающего, экспрессирующей указанную сериновую протеазу, содержащую GLA-остаток, в культуральной среде;
(ii) сбор всей или части культуральной среды, содержащей указанную сериновую протеазу, содержащую GLA-остаток; и
(iii) очистку указанной сериновой протеазы, содержащей GLA-остаток, от культуральной среды;
где рН имеет значение между 4,5 и 6,9, или значение между 8,6 и 10, а концентрация свободных ионов кальция либо выше 20 мМ, либо ниже 1 мМ.
2. Способ по п.1, где концентрация свободных ионов кальция на стадии (iii) ниже 0,10 мМ.
3. Способ по п.1, где концентрация свободных ионов Са2+ на стадии (iii) выше 0,025 мМ.
4. Способ по п.1, где указанную сериновую протеазу, содержащую GLA-остаток, очищают на стадии (iii) в присутствии дополнительного хелатора иона двухвалентного металла.
5. Способ по п.1, где значение рН находится между 4,7 и 6,8.
6. Способ по п.1, где указанную сериновую протеазу, содержащую GLA-остаток, очищают на стадии (iii) при значении рН между 8,6 и 10.
7. Способ по п.6, где указанную сериновую протеазу, содержащую GLA-остаток, очищают в присутствии гистидина.
8. Способ по п.1, где указанная клетка млекопитающего выбрана из группы, состоящей из клетки НЕК, клетки ВНК, клетки СНО, клетки COS и клетки миеломы, например, SP2-0.
9. Способ по п.1, где указанная сериновая протеаза, содержащая GLA-остаток, является полипептидом фактора IX.
10. Способ по п.1, где указанная сериновая протеаза, содержащая GLA-остаток, является полипептидом фактора VII.
11. Способ по п.10, где указанный полипептид фактора VII является неизмененным фактором VII человека.
12. Способ по п.10, где протеолитическая активность указанного полипептида фактора VII выше протеолитической активности неизмененного FVIIa человека.
13. Способ по п.10, где указанный полипептид фактора VII является полипептидом, связанным с фактором VII, выбранным из группы, состоящей из:
L305V-FVII, L305V/M306D/D309S-FVII, L305I-FVII, L305T-FVII, F374P-FVII, V158T/M298Q-FVII, V158D/E296V/M298Q-FVII, K337A-FVII, M298Q-FVII, V158D/M298Q-FVII, L305V/K337A-FVII, V158D/E296V/M298Q/L305V-FVII, V158D/E296V/M298Q/K337A-FVII, V158D/E296V/M298Q/L305V/K337A-FVII, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII, and S336G-FVII, L305V/K337A-FVII, L305V/V158D-FVII, L305V/E296V-FVII, L305V/M298Q-FVII, L305V/V158T-FVII, L305V/K337A/V158T-FVII, L305V/K337A/M298Q-FVII, L305V/K337A/E296V-FVII, L305V/K337A/V158D-FVII, L305V/V158D/M298Q-FVII, L305V/V158D/E296V-FVII, L305V/V158T/M298Q-FVII, L305V/V158T/E296V-FVII, L305V/E296V/M298Q-FVII, L305V/V158D/E296V/M298Q-FVII, L305V/V158T/E296V/M298Q-FVII, L305V/V158T/K337A/M298Q-FVII, L305V/V158T/E296V/K337A-FVII, L305V/V158D/K337A/M298Q-FVII, L305V/V158D/E296V/K337A-FVII, L305V/V158D/E296V/M298Q/K337A-FVII, L305V/V158T/E296V/M298Q/K337A-FVII, S314E/K316H-FVII, S314E/K316Q-FVII, S314E/L305V-FVII, S314E/K337A-FVII, S314E/V158D-FVII, S314E/E296V-FVII, S314E/M298Q-FVII, S314E/V158T-FVII, K316H/L305V-FVII, K316H/K337A-FVII, K316H/V158D-FVII, K316H/E296V-FVII, K316H/M298Q-FVII, K316H/V158T-FVII, K316Q/L305V-FVII, K316Q/K337A-FVII, K316Q/V158D-FVII, K316Q/E296V-FVII, K316Q/M298Q-FVII, K316Q/V158T-FVII, S314E/L305V/K337A-FVII, S314E/L305V/V158D-FVII, S314E/L305V/E296V-FVII, S314E/L305V/M298Q-FVII, S314E/L305V/V158T-FVII, S314E/L305V/K337A/V158T-FVII, S314E/L305V/K337A/M298Q-FVII, S314E/L305V/K337A/E296V-FVII, S314E/L305V/K337A/V158D-FVII, S314E/L305V/V158D/M298Q-FVII, S314E/L305V/V158D/E296V-FVII, S314E/L305V/V158T/M298Q-FVII, S314E/L305V/V158T/E296V-FVII, S314E/L305V/E296V/M298Q-FVII, S314E/L305V/V158D/E296V/M298Q-FVII, S314E/L305V/V158T/E296V/M298Q-FVII, S314E/L305V/V158T/K337A/M298Q-FVII, S314E/L305V/V158T/E296V/K337A-FVII, S314E/L305V/V158D/K337A/M298Q-FVII, S314E/L305V/V158D/E296V/K337A-FVII, S314E/L305V/V158D/E296V/M298Q/K337A-FVII, S314E/L305V/V158T/E296V/M298Q/K337A-FVII, K316H/L305V/K337A-FVII, K316H/L305V/V158D-FVII, K316H/L305V/E296V-FVII, K316H/L305V/M298Q-FVII, K316H/L305V/V158T-FVII, K316H/L305V/K337A/V158T-FVII, K316H/L305V/K337A/M298Q-FVII, K316H/L305V/K337A/E296V-FVII, K316H/L305V/K337A/V158D-FVII, K316H/L305V/V158D/M298Q-FVII, K316H/L305V/V158D/E296V-FVII, K316H/L305V/V158T/M298Q-FVII, K316H/L305V/V158T/E296V-FVII, K316H/L305V/E296V/M298Q-FVII, К316H/L305V/V158D/E296V/M298Q-FVII, K316H/L305V/V158T/E296V/M298Q-FVII, K316H/L305V/V158T/K337A/M298Q-FVII, K316H/L305V/V158T/E296V/K337A-FVII, K316H/L305V/V158D/K337A/M298Q-FVII, K316H/L305V/V158D/E296V/K337A-FVII, K316H/L305V/V158D/E296V/M298Q/K337A-FVII, K316H/L305V/V158T/E296V/M298Q/K337A-FVII, K316Q/L305V/K337A-FVII, K316Q/L305V/V158D-FVII, K316Q/L305V/E296V-FVII, K316Q/L305V/M298Q-FVII, K316Q/L305V/V158T-FVII, K316Q/L305V/K337A/V158T-FVII, К316Q/L305V/K337A/M298Q-FVII, К316Q/L305V/K337A/E296V-FVII, K316Q/L305V/K337A/V158D-FVII, K316Q/L305V/V158D/M298Q-FVII, K316Q/L305V/V158D/E296V-FVII, K316Q/L305V/V158T/M298Q-FVII, K316Q/L305V/V158T/E296V-FVII, K316Q/L305V/E296V/M298Q-FVII, K316Q/L305V/V158D/E296V/M298Q-FVII, K316Q/L305V/V158T/E296V/M298Q-FVII, K316Q/L305V/V158T/K337A/M298Q-FVII, K316Q/L305V/V158T/E296V/K337A-FVII, К316Q/L305V/V158D/K337A/M298Q-FVII, К316Q/L305V/V158D/E296V/K337A-FVII, K316Q/L305V/V158D/E296V/M298Q/K337A-FVII, K316Q/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/K337A-FVII, F374Y/V158D-FVII, F374Y/E296V-FVII, F374Y/M298Q-FVII, F374Y/V158T-FVII, F374Y/S314E-FVII, F374Y/L305V-FVII, F374Y/L305V/K337A-FVII, F374Y/L305V/V158D-FVII, F374Y/L305V/E296V-FVII, F374Y/L305V/M298Q-FVII, F374Y/L305V/V158T-FVII, F374Y/L305V/S314E-FVII, F374Y/K337A/S314E-FVII, F374Y/K337A/V158T-FVII, F374Y/K337A/M298Q-FVII, F374Y/K337A/E296V-FVII, F374Y/K337A/V158D-FVII, F374Y/V158D/S314E-FVII, F374Y/V158D/M298Q-FVII, F374Y/V158D/E296V-FVII, F374Y/V158T/S314E-FVII, F374Y/V158T/M298Q-FVII, F374Y/V158T/E296V-FVII, F374Y/E296V/S314E-FVII, F374Y/S314E/M298Q-FVII, F374Y/E296V/M298Q-FVII, F374Y/L305V/K337A/V158D-FVII, F374Y/L305V/K337A/E296V-FVII, F374Y/L305V/K337A/M298Q-FVII, F374Y/L305V/K337A/V158T-FVII, F374Y/L305V/K337A/S314E-FVII, F374Y/L305V/V158D/E296V-FVII, F374Y/L305V/V158D/M298Q-FVII, F374Y/L305V/V158D/S314E-FVII, F374Y/L305V/E296V/M298Q-FVII, F374Y/L305V/E296V/V158T-FVII, F374Y/L305V/E296V/S314E-FVII, F374Y/L305V/M298Q/V158T-FVII, F374Y/L305V/M298Q/S314E-FVII, F374Y/L305V/V158T/S314E-FVII, F374Y/K337A/S314E/V158T-FVII, F374Y/K337A/S314E/M298Q-FVII, F374Y/K337A/S314E/E296V-FVII, F374Y/K337A/S314E/V158D-FVII, F374Y/K337A/V158T/M298Q-FVII, F374Y/K337A/V158T/E296V-FVII, F374Y/K337A/M298Q/E296V-FVII, F374Y/K337A/M298Q/V158D-FVII, F374Y/K337A/E296V/V158D-FVII, F374Y/V158D/S314E/M298Q-FVII, F374Y/V158D/S314E/E296V-FVII, F374Y/V158D/M298Q/E296V-FVII, F374Y/V158T/S314E/E296V-FVII, F374Y/V158T/S314E/M298Q-FVII, F374Y/V158T/M298Q/E296V-FVII, F374Y/E296V/S314E/M298Q-FVII, F374Y/L305V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/K337A/S314E-FVII, F374Y/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A-FVII, F374Y/L305V/E296V/M298Q/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A-FVII, F374Y/V158D/E296V/M298Q/S314E-FVII, F374Y/L305V/V158D/K337A/S314E-FVII, F374Y/V158D/M298Q/K337A/S314E-FVII, F374Y/V158D/E296V/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A-FVII, F374Y/L305V/V158D/M298Q/S314E-FVII, F374Y/L305V/V158D/E296V/S314E-FVII, F374Y/V158T/E296V/M298Q/K337A-FVII, F374Y/V158T/E296V/M298Q/S314E-FVII, F374Y/L305V/V158T/K337A/S314E-FVII, F374Y/V158T/M298Q/K337A/S314E-FVII, F374Y/V158T/E296V/K337A/S314E-FVII, F374Y/L305V/V158T/E296V/M298Q-FVII, F374Y/L305V/V158T/M298Q/K337A-FVII, F374Y/L305V/V158T/E296V/K337A-FVII, F374Y/L305V/V158T/M298Q/S314E-FVII, F374Y/L305V/V158T/E296V/S314E-FVII, F374Y/E296V/M298Q/K337A/V158T/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/S314E-FVII, F374Y/L305V/E296V/M298Q/V158T/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A/V158T-FVII, F374Y/L305V/E296V/K337A/V158T/S314E-FVII, F374Y/L305V/M298Q/K337A/V158T/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A/S314E-FVII, F374Y/L305V/V158D/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A/V158T/S314E-FVII,
F374Y/L305V/V158D/E296V/M298Q/K337A/S314E-FVII, S52А-фактора VII, S60А-фактора VII; R152Е-фактора VII, S344А-фактора VII, фактора VIIa, лишенного Gla домена; и P11Q/K33E- FVII, T106N-FVII, K143N/N145T-FVII, V253N-FVII, R290N/A292T-FVII, G291N-FVII, R315N/V317T-FVII, K143N/N145T/R315N/V317T-FVII; и FVII, имеющего замены, вставки или делеции в аминокислотной последовательности от 233Thr до 240Asn, FVII, имеющего замены, вставки или делеции в аминокислотной последовательности от 304Arg до 329Cys.
14. Способ очистки сериновой протеазы, содержащей GLA-остаток, которая представляет собой очищенный полипептид фактора VII, очищенный полипептид фактора IX или очищенный полипептид FX, в котором раствор указанной сериновой протеазы, содержащей GLA-остаток, подвергают нескольким стадиям очистки, где рН по крайней мере одной из стадий очистки имеет значение между 4,5 и 6,9, или имеет значение между 8,6 и 10, и где свободная концентрация ионов кальция выше 20 мМ или ниже 1 мМ.
15. Способ по п.14, где указанная концентрация свободных ионов кальция на одной из стадий очистки выше 20 мМ.
16. Способ по п.14, где концентрация свободных ионов кальция по крайней мере на одной из стадий очистки ниже 0,10 мМ.
17. Способ по п.16, где концентрация свободных ионов кальция по крайней мере на одной из стадий очистки ниже 0,09.
18. Способ по любому из пп.14-17, где концентрация свободных ионов Са2+ по крайней мере на одной из стадий очистки выше 0,025 мМ.
19. Способ по п.14, где указанную сериновую протеазу, содержащую GLA-остаток, очищают по крайней мере на одной из стадий очистки в присутствии дополнительного хелатора иона двухвалентного металла.
20. Способ по п.14, где указанную сериновую протеазу, содержащую GLA-остаток, очищают на стадии (iii) при значении рН, находящемся между 4,5 и 6,9.
21. Способ по п.20, где рН имеет значение между 4,7 и 6,8.
22. Способ по п.14, где указанную сериновую протеазу, содержащую GLA-остаток, очищают на стадии (iii) при значении рН, находящемся между 8,6 и 10.
23. Способ по п.20, где указанную сериновую протеазу, содержащую GLA-остаток, очищают по крайней мере на одной из стадий очистки в присутствии гистидина.
24. Способ по п.20, где указанная сериновая протеаза, содержащая GLA-остаток, является полипептидом фактора IX.
25. Способ по п.20, где указанная сериновая протеаза, содержащая GLA-остаток, является полипептидом фактора VII.
26. Способ по п.25, где указанный полипептид фактора VII является неизмененным фактором VII человека.
27. Способ по п.25, где протеолитическая активность указанного полипептида фактора VII выше протеолитической активности неизмененного FVIIa человека.
28. Способ по п.25, где указанный полипептид фактора VII является пептидом, связанным с фактором VII, выбранным из группы, состоящей из:
L305V-FVII, L305V/M306D/D309S-FVII, L305I-FVII, L305T-FVII, F374P-FVII, V158T/M298Q-FVII, V158D/E296V/M298Q-FVII, K337A-FVII, M298Q-FVII, V158D/M298Q-FVII, L305V/K337A-FVII, V158D/E296V/M298Q/L305V-FVII, V158D/E296V/M298Q/K337A-FVII, V158D/E296V/M298Q/L305V/K337A-FVII, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII, и S336G-FVII, L305V/K337A-FVII, L305V/V158D-FVII, L305V/E296V-FVII, L305V/M298Q-FVII, L305V/V158T-FVII, L305V/K337A/V158T-FVII, L305V/K337A/M298Q-FVII, L305V/K337A/E296V-FVII, L305V/K337A/V158D-FVII, L305V/V158D/M298Q-FVII, L305V/V158D/E296V-FVII, L305V/V158T/M298Q-FVII, L305V/V158T/E296V-FVII, L305V/E296V/M298Q-FVII, L305V/V158D/E296V/M298Q-FVII, L305V/V158T/E296V/M298Q-FVII, L305V/V158T/K337A/M298Q-FVII, L305V/V158T/E296V/K337A-FVII, L305V/V158D/K337A/M298Q-FVII, L305V/V158D/E296V/K337A-FVII, L305V/V158D/E296V/M298Q/K337A-FVII, L305V/V158T/E296V/M298Q/K337A-FVII, S314E/K316H-FVII, S314E/K316Q-FVII, S314E/L305V-FVII, S314E/K337A-FVII, S314E/V158D-FVII, S314E/E296V-FVII, S314E/M298Q-FVII, S314E/V158T-FVII, K316H/L305V-FVII, K316H/K337A-FVII, К316H/V158D-FVII, K316H/E296V-FVII, K316H/M298Q-FVII, К316H/V158T-FVII, K316Q/L305V-FVII, K316Q/K337A-FVII, К316Q/V158D-FVII, К316Q/E296V-FVII, К316Q/M298Q-FVII, K316Q/V158T-FVII, S314E/L305V/K337A-FVII, S314E/L305V/V158D-FVII, S314E/L305V/E296V-FVII, S314E/L305V/M298Q-FVII, S314E/L305V/V158Т-FVII, S314E/L305V/K337A/V158T-FVII, S314E/L305V/K337A/M298Q-FVII, S314E/L305V/K337A/E296V-FVII, S314E/L305V/K337A/V158D-FVII, S314E/L305V/V158D/M298Q-FVII, S314E/L305V/V158D/E296V-FVII, S314E/L305V/V158T/M298Q-FVII, S314E/L305V/V158T/E296V-FVII, S314E/L305V/E296V/M298Q-FVII, S314E/L305V/V158D/E296V/M298Q-FVII, S314E/L305V/V158T/E296V/M298Q-FVII, S314E/L305V/V158T/K337A/M298Q-FVII, S314E/L305V/V158T/E296V/K337A-FVII, S314E/L305V/V158D/K337A/M298Q-FVII, S314E/L305V/V158D/E296V/K337A-FVII, S314E/L305V/V158D/E296V/M298Q/K337A-FVII, S314E/L305V/V158T/E296V/M298Q/K337A-FVII, K316H/L305V/K337A-FVII, K316H/L305V/V158D-FVII, K316H/L305V/E296V-FVII, K316H/L305V/M298Q-FVII, K316H/L305V/V158T-FVII, K316H/L305V/K337A/V158T-FVII, K316H/L305V/K337A/M298Q-FVII, K316H/L305V/K337A/E296V-FVII, K316H/L305V/K337A/V158D-FVII, K316H/L305V/V158D/M298Q-FVII, K316H/L305V/V158D/E296V-FVII, K316H/L305V/V158T/M298Q-FVII, K316H/L305V/V158T/E296V-FVII, K316H/L305V/E296V/M298Q-FVII, К316H/L305V/V158D/E296V/M298Q-FVII, K316H/L305V/V158T/E296V/M298Q-FVII, K316H/L305V/V158T/K337A/M298Q-FVII,K316H/L305V/V158T/E296V/K337A-FVII, К316H/L305V/V158D/K337A/M298Q-FVII, K316H/L305V/V158D/E296V/K337A-FVII, K316H/L305V/V158D/E296V/M298Q/K337A-FVII, K316H/L305V/V158T/E296V/M298Q/K337A-FVII, K316Q/L305V/K337A-FVII, K316Q/L305V/V158D-FVII, K316Q/L305V/E296V-FVII, K316Q/L305V/M298Q-FVII, K316Q/L305V/V158T-FVII, K316Q/L305V/K337A/V158T-FVII, К316Q/L305V/K337A/M298Q-FVII, К316Q/L305V/K337A/E296V-FVII, K316Q/L305V/K337A/V158D-FVII, K316Q/L305V/V158D/M298Q-FVII, R316Q/L305V/V158D/E296V-FVII, K316Q/L305V/V158T/M298Q-FVII, K316Q/L305V/V158T/E296V-FVII, K316Q/L305V/E296V/M298Q-FVII, K316Q/L305V/V158D/E296V/M298Q-FVII, K316Q/L305V/V158T/E296V/M298Q-FVII, K316Q/L305V/V158T/K337A/M298Q-FVII,K316Q/L305V/V158T/E296V/K337A-FVII, K316Q/L305V/V158D/K337A/M298Q-FVII, K316Q/L305V/V158D/E296V/K337A-FVII, K316Q/L305V/V158D/E296V/M298Q/K337A-FVII, K316Q/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/K337A-FVII, F374Y/V158D-FVII, F374Y/E296V-FVII, F374Y/M298Q-FVII, F374Y/V158T-FVII, F374Y/S314E-FVII, F374Y/L305V-FVII, F374Y/L305V/K337A-FVII, F374Y/L305V/V158D-FVII, F374Y/L305V/E296V-FVII, F374Y/L305V/M298Q-FVII, F374Y/L305V/V158T-FVII, F374Y/L305V/S314E-FVII, F374Y/K337A/S314E-FVII, F374Y/K337A/V158T-FVII, F374Y/K337A/M298Q-FVII, F374Y/K337A/E296V-FVII, F374Y/K337A/V158D-FVII, F374Y/V158D/S314E-FVII, F374Y/V158D/M298Q-FVII, F374Y/V158D/E296V-FVII, F374Y/V158T/S314E-FVII, F374Y/V158T/M298Q-FVII, F374Y/V158T/E296V-FVII, F374Y/E296V/S314E-FVII, F374Y/S314E/M298Q-FVII, F374Y/E296V/M298Q-FVII, F374Y/L305V/K337A/V158D-FVII, F374Y/L305V/K337A/E296V-FVII, F374Y/L305V/K337A/M298Q-FVII, F374Y/L305V/K337A/V158T-FVII, F374Y/L305V/K337A/S314E-FVII, F374Y/L305V/V158D/E296V-FVII, F374Y/L305V/V158D/M298Q-FVII, F374Y/L305V/V158D/S314E-FVII, F374Y/L305V/E296V/M298Q-FVII, F374Y/L305V/E296V/V158T-FVII, F374Y/L305V/E296V/S314E-FVII, F374Y/L305V/M298Q/V158T-FVII, F374Y/L305V/M298Q/S314E-FVII, F374Y/L305V/V158T/S314E-FVII, F374Y/K337A/S314E/V158T-FVII, F374Y/K337A/S314E/M298Q-FVII, F374Y/K337A/S314E/E296V-FVII, F374Y/K337A/S314E/V158D-FVII, F374Y/K337A/V158T/M298Q-FVII, F374Y/K337A/V158T/E296V-FVII, F374Y/K337A/M298Q/E296V-FVII, F374Y/K337A/M298Q/V158D-FVII, F374Y/K337A/E296V/V158D-FVII, F374Y/V158D/S314E/M298Q-FVII, F374Y/V158D/S314E/E296V-FVII, F374Y/V158D/M298Q/E296V-FVII, F374Y/V158T/S314E/E296V-FVII, F374Y/V158T/S314E/M298Q-FVII, F374Y/V158T/M298Q/E296V-FVII, F374Y/E296V/S314E/M298Q-FVII, F374Y/L305V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/K337A/S314E-FVII, F374Y/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A-FVII, F374Y/L305V/E296V/M298Q/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A-FVII, F374Y/V158D/E296V/M298Q/S314E-FVII, F374Y/L305V/V158D/K337A/S314E-FVII, F374Y/V158D/M298Q/K337A/S314E-FVII, F374Y/V158D/E296V/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A-FVII, F374Y/L305V/V158D/M298Q/S314E-FVII, F374Y/L305V/V158D/E296V/S314E-FVII, F374Y/V158T/E296V/M298Q/K337A-FVII, F374Y/V158T/E296V/M298Q/S314E-FVII, F374Y/L305V/V158T/K337A/S314E-FVII, F374Y/V158T/M298Q/K337A/S314E-FVII, F374Y/V158T/E296V/K337A/S314E-FVII, F374Y/L305V/V158T/E296V/M298Q-FVII, F374Y/L305V/V158T/M298Q/K337A-FVII, F374Y/L305V/V158T/E296V/K337A-FVII, F374Y/L305V/V158T/M298Q/S314E-FVII, F374Y/L305V/V158T/E296V/S314E-FVII, F374Y/E296V/M298Q/K337A/V158T/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/S314E-FVII, F374Y/L305V/E296V/M298Q/V158T/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A/V158T-FVII, F374Y/L305V/E296V/K337A/V158T/S314E-FVII, F374Y/L305V/M298Q/K337A/V158T/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A/S314E-FVII, F374Y/L305V/V158D/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A/V158T/S314E-FVII,
F374Y/L305V/V158D/E296V/M298Q/K337A/S314E-FVII, S52А-фактора VII, S60А-фактора VII; R152Е-фактора VII, S344А-фактора VII, фактора VIIa, лишенного домена Gla; и P11Q/K33E-FVII, T106N-FVII, K143N/N145T-FVII, V253N-FVII, R290N/A292T-FVII, G291N-FVII, R315N/V317T-FVII, K143N/N145T/R315N/V317T-FVII; и FVII, имеющего замены, вставки или делеции в аминокислотной последовательности от 233Thr до 240Asn, FVII, имеющего замены, вставки или делеции в аминокислотной последовательности от 304Arg до 329Cys.
29. Способ стабилизации сериновой протеазы, содержащей GLA-остаток, которая представляет собой очищенный полипептид фактора VII, очищенный полипептид фактора IX или очищенный полипептид FX, в растворе, содержащем сериновую протеазу, содержащую GLA-остаток, в котором указанный раствор, содержащий сериновую протеазу, содержащую GLA-остаток, подвергают стадиям
i) добавления кальция до достижения концентрации свободных ионов кальция выше 20 мМ или ниже 0,10 мМ; и/или
ii) добавления ионов меди до достижения концентрации свободных ионов выше 0,025 мМ; и/или
iii) доведения рН раствора, содержащего сериновую протеазу, содержащую GLA-остаток, до значения между 4,5 и 6,9, или до значения между 8,6 и 10.
30. Способ по п.29, где полученная концентрация свободных ионов кальция ниже 0,10 мМ.
31. Способ по п.30, где полученная концентрация свободных ионов кальция ниже 0,09 мМ.
32. Способ по п.29, где полученная концентрация свободных ионов кальция выше 0,025 мМ.
33. Способ по п.29, где указанную сериновую протеазу, содержащую GLA-остаток, стабилизируют в присутствии дополнительного хелатора иона двухвалентного металла.
34. Способ по п.29, где указанную сериновую протеазу, содержащую GLA-остаток, очищают на стадии (iii) при значении рН между 4,5 и 6,9.
35. Способ по п.34, где рН имеет значение между 4,7 и 6,8.
36. Способ по п.29, где указанную сериновую протеазу, содержащую GLA-остаток, очищают на стадии (iii) при значении рН между 8,6 и 10.
37. Способ по п.34, где указанную сериновую протеазу, содержащую GLA-остаток, стабилизируют в присутствии гистидина.
38. Способ по п.29, где указанная сериновая протеаза, содержащая GLA-остаток, является полипептидом фактора IX.
39. Способ по п.29, где указанная сериновая протеаза, содержащая GLA-остаток, является полипептидом фактора VII.
40. Способ по п.39, где указанный полипептид фактора VII является неизмененным фактором VII человека.
41. Способ по п.39, где протеолитическая активность указанного полипептида фактора VII выше протеолитической активности неизмененного FVIIa человека.
42. Способ по п.39, где указанный полипептид фактора VII является полипептидом, связанным с фактором VII, выбранным из группы, состоящей из:
L305V-FVII, L305V/M306D/D309S-FVII, L305I-FVII, L305T-FVII, F374P-FVII, V158T/M298Q-FVII, V158D/E296V/M298Q-FVII, K337A-FVII, M298Q-FVII, V158D/M298Q-FVII, L305V/K337A-FVII, V158D/E296V/M298Q/L305V-FVII, V158D/E296V/M298Q/K337A-FVII, V158D/E296V/M298Q/L305V/K337A-FVII, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII, и S336G-FVII, L305V/K337A-FVII, L305V/V158D-FVII, L305V/E296V-FVII, L305V/M298Q-FVII, L305V/V158T-FVII, L305V/K337A/V158T-FVII, L305V/K337A/M298Q-FVII, L305V/K337A/E296V-FVII, L305V/K337A/V158D-FVII, L305V/V158D/M298Q-FVII, L305V/V158D/E296V-FVII, L305V/V158T/M298Q-FVII, L305V/V158T7E296V-FVII, L305V/E296V/M298Q-FVII, L305V/V158D/E296V/M298Q-FVII, L305V/V158T/E296V/M298Q-FVII, L305V/V158T/K337A/M298Q-FVII, L305V/V158T/E296V/K337A-FVII, L305V/V158D/K337A/M298Q-FVII, L305V/V158D/E296V/K337A-FVII, L305V/V158D/E296V/M298Q/K337A-FVII, L305V/V158T/E296V/M298Q/K337A-FVII, S314E/K316H-FVII, S314E/K316Q-FVII, S314E/L305V-FVII, S314E/K337A-FVII, S314E/V158D-FVII, S314E/E296V-FVII, S314E/M298Q-FVII, S314E/V158T-FVII, K316H/L305V-FVII, K316H/K337A-FVII, K316H/V158D-FVII, K316H/E296V-FVII, K316H/M298Q-FVII, K316H/V158T-FVII, K316Q/L305V-FVII, K316Q/K337A-FVII, К316Q/V158D-FVII, К316Q/E296V-FVII, К316Q/M298Q-FVII, K316Q/V158T-FVII, S314E/L305V/K337A-FVII, S314E/L305V/V158D-FVII, S314E/L305V/E296V-FVII, S314E/L305V/M298Q-FVII, S314E/L305V/V158T-FVII, S314E/L305V/K337A/V158T-FVII, S314E/L305V/K337A/M298Q-FVII, S314E/L305V/K337A/E296V-FVII, S314E/L305V/K337A/V158D-FVII, S314E/L305V/V158D/M298Q-FVII, S314E/L305V/V158D/E296V-FVII, S314E/L305V/V158T/M298Q-FVII, S314E/L305V/V158T/E296V-FVII, S314E/L305V/E296V/M298Q-FVII, S314E/L305V/V158D/E296V/M298Q-FVII, S314E/L305V/V158T/E296V/M298Q-FVII, S314E/L305V/V158T/K337A/M298Q-FVII, S314E/L305V/V158T/E296V/K337A-FVII, S314E/L305V/V158D/K337A/M298Q-FVII, S314E/L305V/V158D/E296V/K337A-FVII, S314E/L305V/V158D/E296V/M298Q/K337A-FVII, S314E/L305V/V158T/E296V/M298Q/K337A-FVII, K316H/L305V/K337A-FVII, K316H/L305V/V158D-FVII, K316H/L305V/E296V-FVII, K316H/L305V/M298Q-FVII, K316H/L305V/V158T-FVII, K316H/L305V/K337A/V158T-FVII, K316H/L305V/K337A/M298Q-FVII, K316H/L305V/K337A/E296V-FVII, K316H/L305V/K337A/V158D-FVII, K316H/L305V/V158D/M298Q-FVII, K316H/L305V/V158D/E296V-FVII, K316H/L305V/V158T/M298Q-FVII, К316H/L305V/V158T/E296V-FVII, К316H/L305V/E296V/M298Q-FVII, К316H/L305V/V158D/E296V/M298Q-FVII, К316H/L305V/V158T/E296V/M298Q-FVII, K316H/L305V/V158T/K337A/M298Q-FVII,K316H/L305V/V158T/E296V/K337A-FVII, K316H/L305V/V158D/K337A/M298Q-FVII, K316H/L305V/V158D/E296V/K337A-FVII, K316H/L305V/V158D/E296V/M298Q/K337A-FVII, K316H/L305V/V158T/E296V/M298Q/K337A-FVII, K316Q/L305V/K337A-FVII, K316Q/L305V/V158D-FVII, K316Q/L305V/E296V-FVII, K316Q/L305V/M298Q-FVII, K316Q/L305V/V158T-FVII, K316Q/L305V/K337A/V158T-FVII, К316Q/L305V/K337A/M298Q-FVII, К316Q/L305V/K337A/E296V-FVII, K316Q/L305V/K337A/V158D-FVII, K316Q/L305V/V158D/M298Q-FVII, K316Q/L305V/V158D/E296V-FVII, K316Q/L305V/V158T/M298Q-FVII, K316Q/L305V/V158T/E296V-FVII, K316Q/L305V/E296V/M298Q-FVII, К316Q/L305V/V158D/E296V/M298Q-FVII, К316Q/L305V/V158T/E296V/M298Q-FVII, K316Q/L305V/V158T/K337A/M298Q-FVII, K316Q/L305V/V158T/E296V/K337A-FVII, K316Q/L305V/V158D/K337A/M298Q-FVII, К316Q/L305V/V158D/E296V/K337A-FVII, K316Q/L305V/V158D/E296V/M298Q/K337A-FVII, K316Q/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/K337A-FVII, F374Y/V158D-FVII, F374Y/E296V-FVII, F374Y/M298Q-FVII, F374Y/V158T-FVII, F374Y/S314E-FVII, F374Y/L305V-FVII, F374Y/L305V/K337A-FVII, F374Y/L305V/V158D-FVII, F374Y/L305V/E296V-FVII, F374Y/L305V/M298Q-FVII, F374Y/L305V/V158T-FVII, F374Y/L305V/S314E-FVII, F374Y/K337A/S314E-FVII, F374Y/K337A/V158T-FVII, F374Y/K337A/M298Q-FVII, F374Y/K337A/E296V-FVII, F374Y/K337A/V158D-FVII, F374Y/V158D/S314E-FVII, F374Y/V158D/M298Q-FVII, F374Y/V158D/E296V-FVII, F374Y/V158T/S314E-FVII, F374Y/V158T/M298Q-FVII, F374Y/V158T/E296V-FVII, F374Y/E296V/S314E-FVII, F374Y/S314E/M298Q-FVII, F374Y/E296V/M298Q-FVII, F374Y/L305V/K337A/V158D-FVII, F374Y/L305V/K337A/E296V-FVII, F374Y/L305V/K337A/M298Q-FVII, F374Y/L305V/K337A/V158T-FVII, F374Y/L305V/K337A/S314E-FVII, F374Y/L305V/V158D/E296V-FVII, F374Y/L305V/V158D/M298Q-FVII, F374Y/L305V/V158D/S314E-FVII, F374Y/L305V/E296V/M298Q-FVII, F374Y/L305V/E296V/V158T-FVII, F374Y/L305V/E296V/S314E-FVII, F374Y/L305V/M298Q/V158T-FVII, F374Y/L305V/M298Q/S314E-FVII, F374Y/L305V/V158T/S314E-FVII, F374Y/K337A/S314E/V158T-FVII, F374Y/K337A/S314E/M298Q-FVII, F374Y/K337A/S314E/E296V-FVII, F374Y/K337A/S314E/V158D-FVII, F374Y/K337A/V158T/M298Q-FVII, F374Y/K337A/V158T/E296V-FVII, F374Y/K337A/M298Q/E296V-FVII, F374Y/K337A/M298Q/V158D-FVII, F374Y/K337A/E296V/V158D-FVII, F374Y/V158D/S314E/M298Q-FVII, F374Y/V158D/S314E/E296V-FVII, F374Y/V158D/M298Q/E296V-FVII, F374Y/V158T/S314E/E296V-FVII, F374Y/V158T/S314E/M298Q-FVII, F374Y/V158T/M298Q/E296V-FVII, F374Y/E296V/S314E/M298Q-FVII, F374Y/L305V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/K337A/S314E-FVII, F374Y/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A-FVII, F374Y/L305V/E296V/M298Q/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A-FVII, F374Y/V158D/E296V/M298Q/S314E-FVII, F374Y/L305V/V158D/K337A/S314E-FVII, F374Y/V158D/M298Q/K337A/S314E-FVII, F374Y/V158D/E296V/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A-FVII, F374Y/L305V/V158D/M298Q/S314E-FVII, F374Y/L305V/V158D/E296V/S314E-FVII, F374Y/V158T/E296V/M298Q/K337A-FVII, F374Y/V158T/E296V/M298Q/S314E-FVII, F374Y/L305V/V158T/K337A/S314E-FVII, F374Y/V158T/M298Q/K337A/S314E-FVII, F374Y/V158T/E296V/K337A/S314E-FVII, F374Y/L305V/V158T/E296V/M298Q-FVII, F374Y/L305V/V158T/M298Q/K337A-FVII, F374Y/L305V/V158T/E296V/K337A-FVII, F374Y/L305V/V158T/M298Q/S314E-FVII, F374Y/L305V/V158T/E296V/S314E-FVII, F374Y/E296V/M298Q/K337A/V158T/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/S314E-FVII, F374Y/L305V/E296V/M298Q/V158T/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A/V158T-FVII, F374Y/L305V/E296V/K337A/V158T/S314E-FVII, F374Y/L305V/M298Q/K337A/V158T/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A/S314E-FVII, F374Y/L305V/V158D/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A/V158T/S314E-FVII,
F374Y/L305V/V158D/E296V/M298Q/K337A/S314E-FVII, S52А-фактора VII, S60А-фактора VII; К152Е-фактора VII, S344А-фактора VII, фактора VIIa, лишенного домена Gla; и P11Q/K33E-FVII, T106N-FVII, K143N/N145T-FVII, V253N-FVII, R290N/A292T-FVII, G291N-FVII, R315N/V317T-FVII, K143N/N145T/R315N/V317T-FVII; и FVII, имеющего замены, вставки или делеции в аминокислотной последовательности от 233Thr до 240Asn, FVII, имеющего замены, вставки или делеции в аминокислотной последовательности от 304Arg до 329Cys.
| Способ изготовления сферических или конических шайб | 1978 |
|
SU770625A1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКА, ОБЛАДАЮЩЕГО ОПОСРЕДОВАННОЙ ФАКТОРОМ VII АКТИВНОСТЬЮ В СВЕРТЫВАНИИ КРОВИ | 1986 |
|
RU2122583C1 |
| US 5700914 А, 23.12.1997 | |||
| Индуктор линейного асинхронного двигателя | 1975 |
|
SU547932A1 |
| Колориметр | 1978 |
|
SU765669A1 |
Авторы
Даты
2009-08-20—Публикация
2004-03-18—Подача