Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса 3,4-дигидроизохинолина и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем.
Известен структурный аналог заявленных соединений, получаемый взаимодействием 5-фенилфуран-2,3-диона (I) с 3,3-пентаметилен-1-метил-3,4-дигидроизохинолином (II) в абсолютном бензоле или абсолютном хлороформе в течение 3-20 минут (Журнал органической химии. 1996. Вып. 32. С.319). Синтез структурного аналога (III) осуществляется по следующей схеме:
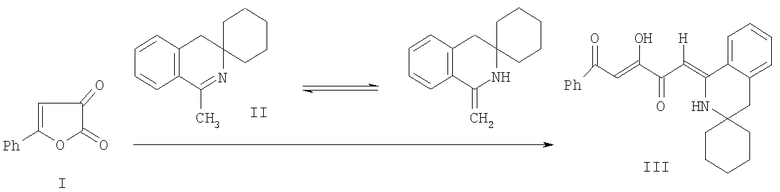
К недостаткам данного способа относится большая недоступность фурандионов в отличие от (Z)-алкил 4-арил-2-гидрокси-4-оксобут-2-еноатов (алкиловых эфиров ароилпировиноградных кислот), которые являются продуктами раскрытия цикла фурандионов спиртами и могут быть синтезированы конденсацией Кляйзена ацетофенонов с диалкилоксалатами.
Задачей изобретения является разработка более простого способа синтеза неописанных в литературе (2Z,5Z)-1-арил-3-гидрокси-5-(3,3-диметил-3,4-дигидроизохинолин-1(2H)-илиден)-пент-2-ен-1,4-дионов.
Поставленная задача осуществляется путем кипячения (Z)-алкил 4-арил-2-гидрокси-4-оксобут-2-еноатов (алкиловых эфиров ароилпировиноградных кислот) (IV a-д) с 1-метил-3,4-дигидроизохинолинами (II а, в), взятыми в соотношении 1:1 по схеме:
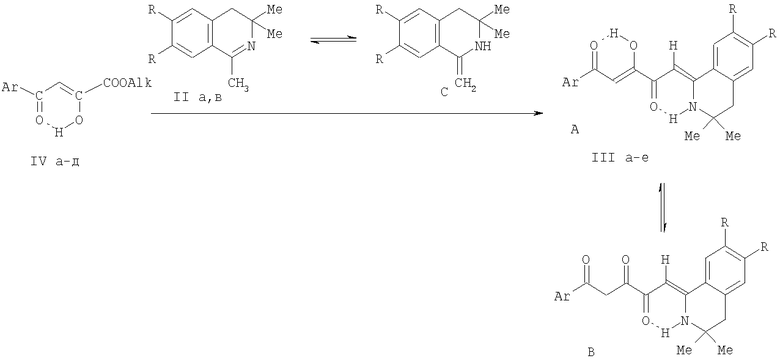
II: R=H (a), OMe (б); IV: Alk=Me. Ar=Ph (а), C6H4OMe-n (б), C6H4F-n (в), C6H4NO2-n (г), Alk=Et, Ar=C6H4NO2-n (д); III: R=Н, Ar=Ph (a), C6H4F-n (6), R=OMe, Ar=Ph (в), С6Н4ОМе-n (г), C6H4F-n (д), C6H4NO2-n (e)
Процесс ведут при температуре 60-65°С, а в качестве растворителя используют абсолютный хлороформ. Данная реакция сопровождается ацилированием группы β-СН туатомерной енаминоформы С изохинолинов (II а, б) сложноэфирной группой соединений (IV a-д), что является для них нехарактерным - обычно при реакциях соединений (IV a-д) с нуклеофилами происходит замещение у наиболее электрофильного α-углеродного атома.
Из патентной и технической литературы не были выявлены способы получения (2Z,5Z)-1-арил-3-гидрокси-5-(3,3-диметил-3,4-дигидроизохинолин-1(2H)-илиден)-пент-2-ен-1,4-дионов, имеющие сходные признаки с заявляемым способом, а именно не использовались исходные продукты (Z)-алкил 4-арил-2-гидрокси-4-оксобут-2-еноаты (алкиловые эфиры ароилпировиноградных кислот), которые являются более доступными, чем фурандионы, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. (2Z,5Z)-3-Гидрокси-5-(3,3-диметил-3,4-дигидроизохинолин-1(2H)-илиден)-1-фенилпент-2-ен-1,4-дион (IIIa).
Раствор 5.0 ммоль (Z)-метил 2-гидрокси-4-оксо-4-фенилбут-2-еноата (IVa) и 5.0 ммоль изохинолина (IIa) в 20 мл абсолютного хлороформа кипятили 5 ч, охлаждали, выпавший осадок соединения (IIIa) отфильтровывали, кристаллизовали из этанола. Выход, 89%. Т.пл. 146-148°С (разл.).
Найдено, %: С 75.99; Н 6.11; N 3.88. C22H21NO3.
Вычислено, %: С 76.06; Н 6.09; N 4.03.
Пример 2. (2Z,5Z)-3-Гидрокси-5-(3,3-диметил-3,4-дигидроизохинолин-1(2H)-илиден)-1-(4-фторфенил)пент-2-ен-1,4-дион (IIIб).
Раствор 5.0 ммоль (Z)-метил 2-гидрокси-4-оксо-4-(фторфенил)бут-2-еноата (IVб) и 5.0 ммоль изохинолина (IIa) в 20 мл абсолютного хлороформа кипятили 5 ч, охлаждали, выпавший осадок соединения (IIIб) отфильтровывали, кристаллизовали из этанола. Выход, 87%. Т.пл. 108-110°С (разл.).
Найдено, %: С 72.30; Н 5.58; N 3.70. C22H20NO3F.
Вычислено, %: С 72.32; Н 5.52; N 3.83.
Пример 3. (2Z,5Z)-3-Гидрокси-5-(3,3-диметил-6,7-диметокси-3,4-дигидроизохинолин-1(2H)-илиден)-1-фенилпент-2-ен-1,4-дион (IIIв).
Раствор 5.0 ммоль (Z)-метил 2-гидрокси-4-оксо-4-фенилбут-2-еноата (IVв) и 5.0 ммоль изохинолина (IIб) в 20 мл абсолютного хлороформа кипятили 5 ч, охлаждали, выпавший осадок соединения (IIIв) отфильтровывали, кристаллизовали из этилацетата. Выход, 92%. Т.пл. 174-176°С (разл.).
Найдено, %: С 70.57; Н 6.30; N 3.41. C24H25NO5.
Вычислено, %: С 70.75; Н 6.18; N 3.44.
Пример 4. (2Z,5Z)-3-Гидрокси-5-(3,3-диметил-6,7-диметокси-3,4-дигидроизохинолин-1(2H)-илиден)-1-(4-метоксифенил)пент-2-ен-1,4-дион (IIIг).
Раствор 5.0 ммоль (Z)-метил 2-гидрокси-4-оксо-4-(4-метоксифенил)бут-2-еноата (IVг) и 5.0 ммоль изохинолина (IIб) в 20 мл абсолютного хлороформа кипятили 5 ч, охлаждали, выпавший осадок соединения (IIIг) отфильтровывали, кристаллизовали из этанола. Выход, 91%. Т.пл. 153-155°С (разл.).
Найдено, %: С 68.64; Н 6.31; N 3.16. C25H27NO6.
Вычислено, %: С 68.64; Н 6.22; N 3.20.
Пример 5. (2Z,5Z)-3-Гидрокси-5-(3,3-диметил-6,7-диметокси-3,4-дигидроизохинолин-1(2H)-илиден)-1-(4-фторфенил)пент-2-ен-1,4-дион (IIIд).
Раствор 5.0 ммоль (Z)-метил 2-гидрокси-4-оксо-4-(4-фторфенил)бут-2-еноата (IVв) и 5.0 ммоль изохинолина (IIб) в 20 мл абсолютного хлороформа кипятили 5 ч, охлаждали, выпавший осадок соединения (IIIд) отфильтровывали, кристаллизовали из этанола. Выход, 91%. Т.пл. 173-175°С (разл.).
Найдено, %: С 67.72; Н 5.70; N 3.29. C24H24NO5F.
Вычислено, %: С 67.75; Н 5.69; N 3.29.
Пример 6. (2Z,5Z)-3-Гидрокси-5-(3,3-диметил-6,7-диметокси-3,4-дигидроизохинолин-1(2H)-илиден)-1-(4-нитрофенил)пент-2-ен-1,4-дион (IIIе).
Раствор 5.0 ммоль (Z)-метил 2-гидрокси-4-оксо-4-(4-нитрофенил)бут-2-еноата (IVг) и 5.0 ммоль изохинолина (IIб) в 20 мл абсолютного хлороформа кипятили 5 ч, охлаждали, выпавший осадок соединения (IIIе) отфильтровывали, кристаллизовали из этанола. Выход, 86%. Т.пл. 148-150°С (разл.).
Найдено, %: С 63.59; Н 5.41; N 6.03. C24H24N2O7.
Вычислено, %: С 63.71; Н 5.35; N 6.19.
Пример 7. (2Z,5Z)-3-Гидрокси-5-(3,3-диметил-6,7-диметокси-3,4-дигидроизохинолин-1(2H)-илиден)-1-(4-нитрофенил)пент-2-ен-1,4-дион (IIIe).
Раствор 5.0 ммоль (Z)-этил 2-гидрокси-4-оксо-4-(4-нитрофенил)бут-2-еноата (IVд) и 5.0 ммоль изохинолина (IIб) в 20 мл абсолютного хлороформа кипятили 5 ч, охлаждали, выпавший осадок соединения (IIIe) отфильтровывали, кристаллизовали из этанола. Выход 85%. Т.пл. 148-150°С (разл.).
Найдено, %: С 63.59; Н 5.41; N 6.03. C24H24N2O7.
Вычислено, %: С 63.71; Н 5.35; N 6.19.
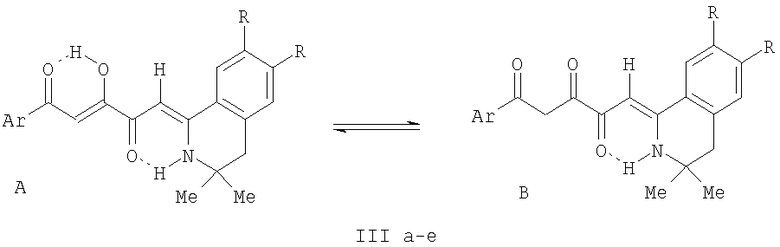
В ИК спектрах (вазелиновое масло) соединений (IIIа-е) присутствуют полосы валентных колебаний енольной группы ОН и группы NH, участвующих в образовании внутримолекулярных водородных связей (ВВС), в виде широкой полосы в области 3150-3195 см-1, карбонильных групп в положении 1 и 4, участвующих в образовании ВВС, в виде широкой полосы в области 1593-1603 см-1.
В спектрах ЯМР 1H растворов соединений (IIIа-е) в ДМСО-d6 кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют синглет шести протонов двух метальных групп в положении 3 изохинолинового фрагмента в области 1.30-1.32 м.д., синглет двух протонов группы СН2 в положении 4 изохинолинового фрагмента в области 2.84-2.99 м.д., синглет протона группы С5Н в области 6.35-6.60 м.д., синглет протона группы C2H в области 7.07-7.22 м.д., синглет протона группы NH в области 12.02-12.58 м.д., уширенный синглет протона енольной группы ОН в области 15.80-16.20 м.д., относящиеся к енольной форме А соединений (IIIа-е). Кроме того, в спектрах ЯМР 1H растворов соединений (IIIа-е) в ДМСО-d6 имеются минорные наборы сигналов дикетонной формы В: сигналы протонов ароматических колец и связанных с ними групп, синглет шести протонов двух метальных групп в положении 3 изохинолинового фрагмента в области 1.26-1.28 м.д., синглет двух протонов группы СН2 в положении 4 изохинолинового фрагмента в области 2.81-2.96 м.д., синглет двух протонов группы C2H2 в области 4.40-4.55 м.д., синглет протона группы С5Н в области 6.13-6.36 м.д., синглет протона группы NH в области 11.54-11.72 м.д. Спектральные характеристики соединений (IIIа-е) свидетельствуют о их существовании в растворе в ДМСО-d6 в виде смеси енольной формы А и дикетонной формы В в соотношении ~9:1.
Предлагаемый способ достаточно прост в осуществлении, одностадиен и позволяет получить (2Z,5Z)-1-арил-3-гидрокси-5-(3,3-диметил-3,4-дигидроизохинолин-1(2H)-илиден)-пент-2-ен-1,4-дионы практически с количественным выходом из (Z)-алкил 4-арил-2-гидрокси-4-оксобут-2-еноатов (алкиловых эфиров ароилпировиноградных кислот), которые являются более доступными соединениями, чем 5-арилфуран-2,3-дионы.
Изобретение относится к области органической химии, а именно к новым соединениям (2Z,5Z)-1-арил-3-гидрокси-5-(3,3-диалкил-3,4-дигидроизохинолин-1(2Н)-илиден)-пент-2-ен-1,4-дионам общей формулы:

III: R=H, Ar=Ph (a), C6H4F-n (б), R-OMe, Ar=Ph (в), C6H4OMe-n (г), C6H4F-n (д), C6H4NO2-n (e). Изобретение также относится к способу получения указанных соединений. Технический результат - получены новые соединения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем. 2 н.п. ф-лы.
1. (2Z,5Z)-1-арил-3-гидрокси-5-(3,3-диметил-3,4-дигидроизохинолин-1(2Н)-илиден)-пент-2-ен-1,4-дионы общей формулы
III: R=H, Ar=Ph (а), C6H4F-n (б), R-OMe, Ar-Ph (в), C6H4OMe-n (г), C6H4F-n (д), C6H4NO2-n (е).
2. Способ получения (2Z,5Z)-1-арил-3-гидрокси-5-(3,3-диалкил-3,4-дигидроизохинолин-1(2Н)-илиден)-пент-2-ен-1,4-дионов общей формулы

III: R=H, Ar=Ph (а), C6H4F-n (б), R=OMe, Ar=Ph (в), C6H4OMe-n (г), C6H4F-n (д), C6H4NO2-n (e), отличающийся тем, что (Z)-алкил 4-арил-2-гидрокси-4-оксобут-2-еноаты (алкиловые эфиры ароилпировиноградных кислот) (IVa-д)

IV: Alk=Me, Ar=Ph (а), C6H4OMe-n (б), C6H4F-n (в), C6H4NO2-n (г), Alk=Et,
Ar=C6H4NO2-n (д)
подвергают взаимодействию с 1-метил-3,4-дигидроизохинолинами (II а, б)
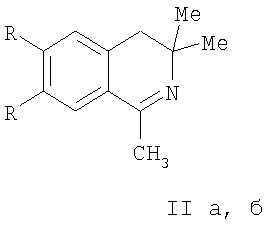
II: R=H (а), OMe (б).
| Шкляев Ю.В., Масливец А.Н | |||
| - Журнал органической химии, т.32, вып.2, 1996, с.319 | |||
| ПРОИЗВОДНЫЕ 3,4-ДИГИДРОИЗОХИНОЛИНА И ФАРМАЦЕВТИЧЕСКИЙ АГЕНТ, ВКЛЮЧАЮЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2001 |
|
RU2272030C2 |
Авторы
Даты
2009-11-27—Публикация
2008-07-04—Подача