ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому соединению тиазола. Настоящее изобретение дополнительно относится к фармацевтической композиции, включающей соединение тиазола.
УРОВЕНЬ ТЕХНИКИ
Последние исследования показали, что циклический аденозин-3',5'-монофосфат (cAMP), который действует как внутриклеточный вторичный мессенджер, регулирует активность клеток воспалительного инфильтрата, таких как лимфоциты, нейтрофилы, эозинофилы, тучные клетки и так далее. Известно, что cAMP разлагается до 5'-AMP, который не действует как мессенджер, под влиянием фосфодиэстеразы (PDE), и PDE корректирует внутримолекулярную концентрацию cAMP. Так как PDE имеет такую тесную зависимость с внутримолекулярной cAMP концентрацией, полагают, что регулирование PDE активности является эффективным при заболеваниях, для которых ожидается, что терапевтические действия проявляются в результате регулирования повышения или понижения cAMP концентрации (Непатентные документы 1 и 2).
Известны одиннадцать типов PDE изоферментов (PDEs 1-11), которые по их распределению in vivo отличаются для различных тканей (Непатентные документы 3 и 4). Как сообщают, ингибиторы, специфичные к PDE4, подавляют функции клеток воспалительного инфильтрата, и считают, что они полезны при конъюнктивитах, астме и подобных воспалительных аллергических заболеваниях и рассеянном склерозе, ревматизме суставов и подобных аутоиммунных заболеваниях (Непатентные документы 5-14).
До настоящего времени в качестве PDE ингибитора для лечения астмы использовали теофиллин. Однако известно, что теофиллин неспецифично ингибирует различные PDE изоферменты, и поэтому подавляет активность не только PDE4, но также PDE3 и других изоферментов. Предполагают, что PDE3 вызывает стимуляцию сердечной деятельности и/или оказывает центральное действие и положительное инотропное и хронотропное действия на сердце (Патентный документ 15). Поэтому применение теофиллина в качестве PDE ингибитора ставит проблему развития побочных эффектов.
Описано несколько соединений со специфической ингибиторной активностью по PDE 4 (Патентные документы 1 и 2). Однако такие PDE4 ингибиторы имеют проблемы в том, что они связывают рецептор с высоким сродством к ролипраму (HARBS) в центральной нервной системе и желудочно-кишечном тракте и дают такие побочные эффекты, как рвоту и тошноту, или имеют недостатки в том, что они проявляют недостаточную PDE4 ингибиторную активность. Поэтому известные до сих пор PDE4 ингибиторы не применяли в клинических целях в качестве терапевтических средств.
Принимая во внимание этот известный достигнутый уровень техники, разработка соединения, которое эффективно проявляет без побочных эффектов специфическую ингибиторную активность по PDE4 является желательной.
[Патентный документ 1] Japanese Unexamined Patent Publication No.1975-157360
[Патентный документ 2] Japanese Unexamined Patent Publication No. 2003-64057
[Непатентный документ 1] Trends Pharmacol. Sci. 18: 164-170, 1997
[Непатентный документ 2] Immunopharmacology 47: 127-162, 2000
[Непатентный документ 3] J. Allergy. Clin. Immunol. 108: 671-680, 2001
[Непатентный документ 4] Mol. Pharmacol. 64: 533-546, 2003
[Непатентный документ 5] Am. J. Respir. Crit. Care. Med. 157: 351-370, 1998
[Непатентный документ 6] Monaldi. Arch. Chest. Dis. 57: 48-64, 2002
[Непатентный документ 7] Arzneimittelforschung 44: 163-165, 1994
[Непатентный документ 8] Eur. J. Pharmacol. 229: 45-53,1992
[Непатентный документ 9] Inflammation 17: 25-31, 1993
[Непатентный документ 10] Nat. Med. 1: 244-248, 1995
[Непатентный документ 11] J. Neuroimmunol. 79: 54-61, 1997
[Непатентный документ 12] Clin. Exp. Immunol. 100: 126-132, 1995
[Непатентный документ 13] Clin. Exp. Immunol. 108: 415-419, 1997
[Непатентный документ 14] J. Immunol.159: 6253-6259, 1997
[Непатентный документ 15] Physiol. Rev. 76: 725-748, 1995
[Непатентный документ 16] J. Clin. Pathol. 54: 577-589, 2001
[Непатентный документ 17] Curr. Drug Targets Inflamm. Allergy 1: 377-392, 2002
[Непатентный документ 18] Curr. Opin. Pharmacol. 3: 449-455, 2003
[Непатентный документ 19] J. Infus. Nurs. 26: 319-325, 2003
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Проблемы, решаемые изобретением
Целью настоящего изобретения является решение вышеприведенных проблем известного уровня техники. В частности, целью настоящего изобретения является разработка нового соединения тиазола, которое имеет специфическую ингибиторную активность по PDE4, и фармацевтической композиции, включающей это соединение. Другой целью настоящего изобретения является разработка PDE4 ингибитора, который проявляет специфическую ингибиторную активность по PDE4. Дополнительной целью настоящего изобретения является разработка профилактического или терапевтического средства для атопического дерматита и способа лечения атопического дерматита.
Способы решения проблем
Авторы настоящего изобретения вели поиск нового соединения, которое обладает PDE4 ингибиторной активностью, и обнаружили, что соединение тиазола с новой структурой обладает высокой PDE4 ингибиторной активностью, которая является высокоспецифичной и не имеет отношения к активности связывания HARBS. Авторы изобретения дополнительно обнаружили, что соединение тиазола проявляет профилактическое и терапевтическое действия при атопическом дерматите из-за его PDE4 ингибиторной активности.
Авторы изобретения дополнительно обнаружили, что соединение тиазола также проявляет ингибиторную активность при продукции TNF-α и ингибиторную активность при продукции IL-4. При таких хронических воспалительных заболеваниях, как аутоиммунные заболевания и аллергические заболевания, цитокины, производимые иммуноцитами, известны в качестве важных медиаторов воспаления. Среди таких цитокинов, считают, что играют важную роль фактор некроза опухоли (TNF)-α и интерлейкин (IL)-4 (Непатентные документы 16-19). Соответственно соединения с ингибиторной активностью к продукции TNF-α или с ингибиторной активностью к продукции IL-4 являются клинически полезными.
Настоящее изобретение было создано в результате проведения дополнительного исследования на основе вышеприведенных выводов.
В настоящем изобретении предлагаются следующие соединения тиазола.
1. Соединение, представленное формулой (1), его оптический изомер или его соль:
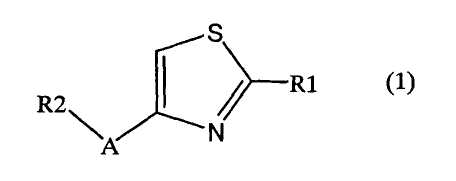
где R1 является ди-C1-6 алкоксифенильной группой;
R2 является любой одной из следующих групп (a)-(t):
(a) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (a-1) гидроксильных групп, (a-2) атомов галогена, (a-3) незамещенных или галогензамещенных C1-6 алкильных групп, (a-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (a-5) C1-6 алкокси-C1-6 алкоксигрупп, (a-6) амино-C1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-7) метилендиоксигрупп, (a-8) карбоксильных групп, (a-9) феноксигрупп, (a-10) C1-6 алкоксикарбонильных групп, (a-11) C1-6 алканоилоксигрупп, (a-12) C1-6 алканоильных групп, (a-13) цианогрупп, (a-14) нитрогрупп, (a-15) C1-6 алкилкарбамоильных групп, (a-16) аминосульфонильных групп, (a-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-18) C1-6 алканоиламиногрупп, (a-19) C1-6 алкилтиогрупп, (a-20) фенильных групп, (a-21) пиразолильных групп, (a-22) имидазолильных групп, (a-23) триазолильных групп, (a-24) морфолиногрупп, (a-25) пирролидинильных групп, (a-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами, и (a-27) фенил-C1-6 алкоксигрупп;
(b) нафтильной группой;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (c-1) гидроксильных групп, (c-2) C1-6 алкильных групп, (c-3) C1-6 алкоксигрупп, (c-4) фенил-C1-6 алкоксигрупп и (c-5) C1-6 алкоксикарбонильных групп;
(d) фурильной группой, в которой фурановое кольцо может быть замещено C1-6 алкильной группой или группами;
(e) тиенильной группой, в которой тиофеновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (e-1) атомов галогена, (e-2) C1-6 алкильных групп и (e-3) C1-6 алкоксигрупп;
(f) изоксазолильной группой, в которой изоксазолильное кольцо может быть замещено C1-6 алкильной группой или группами;
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами;
(h) пирролильной группой, в которой пиррольное кольцо может быть замещено C1-6 алкильной группой или группами;
(i) имидазолильной группой, в которой имидазольное кольцо может быть замещено C1-6 алкильной группой или группами;
(j) тетразолильной группой;
(k) пиразинильной группой;
(l) тиенотиенильной группой;
(m) бензотиенильной группой;
(n) индолильной группой, в которой индольное кольцо может быть замещено C1-6 алкоксигруппой или группами;
(o) бензимидазолильной группой, в которой бензимидазольное кольцо может быть замещено C1-6 алкильной группой или группами;
(p) индазолильной группой;
(q) хинолильной группой;
(r) 1,2,3,4-тетрагидрохинолильной группой, в которой 1,2,3,4-тетрагидрохинолиновое кольцо может быть замещено оксогруппой или группами;
(s) хиноксалинильной группой и
(t) 1,3-бензодиоксолильной группой и
A является одной из следующих групп (i)-(vi):
(i) -CO-B-, где B является C1-6 алкиленовой группой;
(ii) -CO-Ba-, где Ba является C2-6 алкениленовой группой;
(iii) -CH(OH)-B-, где B определено выше;
(iv) -CОCH(CООR3)-Bb-, где R3 является C1-6 алкильной группой и Bb является C1-6 алкиленовой группой и
(v) -Bс-, где Bс является C2-6 алкиленовой группой.
2. Соединение, оптический изомер или соль по пункту 1, где в формуле (1) R1 является 3,4-ди-C1-6 алкоксифенильной группой.
3. Соединение, оптический изомер или соль по пункту 1, где в формуле (1) R1 является 3,4-диметоксифенильной группой или 3,4-диэтоксифенильной группой.
4. Соединение, оптический изомер или соль по пунктам 1-3, где в формуле (1) R2 является (a) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (a-1) гидроксильных групп, (a-2) атомов галогена, (a-3) незамещенных или галогензамещенных C1-6 алкильных групп, (a-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (a-5) C1-6 алкокси-C1-6 алкоксигрупп, (a-6) амино-C1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-7) метилендиокси групп, (a-8) карбоксильных групп, (a-9) феноксигрупп, (a-10) C1-6 алкоксикарбонильных групп, (a-11) C1-6 алканоилоксигрупп, (a-12) C1-6 алканоильных групп, (a-13) цианогрупп, (a-14) нитрогрупп, (a-15) C1-6 алкилкарбамоильных групп, (a-16) аминосульфонильных групп, (a-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-18) C1-6 алканоиламиногрупп, (a-19) C1-6 алкилтиогрупп, (a-20) фенильных групп, (a-21) пиразолильных групп, (a-22) имидазолильных групп, (a-23) триазолильных групп, (a-24) морфолиногрупп, (a-25) пирролидинильных групп, (a-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами, и (a-27) фенил-C1-6 алкоксигрупп;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (c-1) гидроксильных групп, (c-2) C1-6 алкильных групп, (c-3) C1-6 алкоксигрупп, (c-4) фенил-C1-6 алкоксигрупп, и (c-5) C1-6 алкоксикарбонильных групп;
(d) фурильной группой, в которой фурановое кольцо может быть замещено C1-6 алкильной группой или группами;
(e) тиенильной группой, в которой тиофеновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (e-1) атомов галогена, (e-2) C1-6 алкильных групп и (e-3) C1-6 алкоксигрупп;
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами;
(h) пирролильной группой, в которой пиррольное кольцо может быть замещено C1-6 алкильной группой или группами; или
(i) имидазолильной группой, в которой имидазольное кольцо может быть замещено C1-6 алкильной группой или группами.
5. Соединение, оптический изомер или соль по пунктам 1-3, где в формуле (1), R2 является (a) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (a-1) гидроксильных групп, (a-2) атомов галогена, (a-3) незамещенных или галогензамещенных C1-6 алкильных групп, (a-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (a-5) C1-6 алкокси-C1-6 алкоксигрупп, (a-6) амино-C1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-7) метилендиоксигрупп, (a-8) карбоксильных групп, (a-9) феноксигрупп, (a-10) C1-6 алкоксикарбонильных групп, (a-11) C1-6 алканоилоксигрупп, (a-12) C1-6 алканоильных групп, (a-13) цианогрупп, (a-14) нитрогрупп, (a-15) C1-6 алкилкарбамоильных групп, (a-16) аминосульфонильных групп, (a-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-18) C1-6 алканоиламиногрупп, (a-19) C1-6 алкилтиогрупп, (a-20) фенильных групп, (a-21) пиразолильных групп, (a-22) имидазолильных групп, (a-23) триазолильных групп, (a-24) морфолиногрупп, (a-25) пирролидинильных групп, (a-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами и (a-27) фенил-C1-6 алкоксигрупп;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (c-1) гидроксильных групп, (c-2) C1-6 алкильных групп, (c-3) C1-6 алкоксигрупп, (c-4) фенил-C1-6 алкоксигрупп и (c-5) C1-6 алкоксикарбонильных групп; или
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами.
6. Соединение, оптический изомер или соль по пунктам 1-5, где в формуле (1), A является (i) -CO-B-, где B является метиленовой группой, этиленовой группой или триметиленовой группой; (ii) -CO-Ba-, где Ba является винилиденовой группой; (iii) -CH(OH)-B-, где B является метиленовой группой или этиленовой группой; (iv) -COCH(CООR3)-Bb-, где R3 является метильной группой, этильной группой или третбутильной группой и Bb является метиленовой группой или этиленовой группой; или (v) -Bс-, где Bс является этиленовой группой, триметиленовой группой или тетраметиленовой группой.
7. Соединение, оптический изомер или соль по пунктам 1-5, где в формуле (1), A является (i) -CO-B-, где B является этиленовой группой; (iii) -CH(OH)-B-, где B является этиленовой группой; (iv) -COCH(CООR3)-Bb-, где R3 является метильной группой и Bb является метиленовой группой; или (v) -Bс-, где Bс является триметиленовой группой.
8. Соединение, оптический изомер или соль по пункту 1, где в формуле (1), R1 является 3,4-ди-C1-6 алкоксифенильной группой; R2 является (a) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (a-1) гидроксильных групп, (a-2) атомов галогена, (a-3) незамещенных или галогензамещенных C1-6 алкильных групп, (a-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (a-5) C1-6 алкокси-C1-6 алкоксигрупп, (a-6) амино-C1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-7) метилендиоксигрупп, (a-8) карбоксильных групп, (a-9) феноксигрупп, (a-10) C1-6 алкоксикарбонильных групп, (a-11) C1-6 алканоилоксигрупп, (a-12) C1-6 алканоильных групп, (a-13) цианогрупп, (a-14) нитрогрупп, (a-15) C1-6 алкилкарбамоильных групп, (a-16) аминосульфонильных групп, (a-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-18) C1-6 алканоиламиногрупп, (a-19) C1-6 алкилтиогрупп, (a-20) фенильных групп, (a-21) пиразолильных групп, (a-22) имидазолильных групп, (a-23) триазолильных групп, (a-24) морфолиногрупп, (a-25) пирролидинильных групп, (a-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами, и (a-27) фенил-C1-6 алкоксигрупп;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (c-1) гидроксильных групп, (c-2) C1-6 алкильных групп, (c-3) C1-6 алкоксигрупп, (c-4) фенил-C1-6 алкоксигрупп и (c-5) C1-6 алкоксикарбонильных групп;
(d) фурильной группой, в которой фурановое кольцо может быть замещено C1-6 алкильной группой или группами;
(e) тиенильной группой, в которой тиофеновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (e-1) атомов галогена, (e-2) C1-6 алкильных групп и (e-3) C1-6 алкоксигрупп;
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами;
(h) пирролильной группой, в которой пиррольное кольцо может быть замещено одной или более C1-6 алкильной группами;
(i) имидазолильной группой, в которой имидазольное кольцо может быть замещено C1-6 алкильной группой или группами; и A является (i) -CO-B-, где B определено выше; (ii) -CO-Ba, где Ba определено выше; (iii) -CH(OH)-B-, где B определено выше; (iv) -COCH(CООR3)-Bb-, где R3 и Bb определены выше; или (v) -Bс-, где Bс определено выше.
9. Соединение, оптический изомер или соль по пункту 1, где в формуле (1) R1 является 3,4-ди-C1-6 алкоксифенильной группой;
R2 является (a) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (a-1) гидроксильных групп, (a-2) атомов галогена, (a-3) незамещенных или галогензамещенных C1-6 алкильных групп, (a-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (a-5) C1-6 алкокси-C1-6 алкоксигрупп, (a-6) амино-C1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-7) метилендиоксигрупп, (a-8) карбоксильных групп, (a-9) феноксигрупп, (a-10) C1-6 алкоксикарбонильных групп, (a-11) C1-6 алканоилоксигрупп, (a-12) C1-6 алканоильных групп, (a-13) цианогрупп, (a-14) нитрогрупп, (a-15) C1-6 алкилкарбамоильных групп, (a-16) аминосульфонильных групп, (a-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-18) C1-6 алканоиламиногрупп, (a-19) C1-6 алкилтиогрупп, (a-20) фенильных групп, (a-21) пиразолильных групп, (a-22) имидазолильных групп, (a-23) триазолильных групп, (a-24) морфолиногрупп, (a-25) пирролидинильных групп, (a-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами, и (a-27) фенил-C1-6 алкоксигрупп;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (c-1) гидроксильных групп, (c-2) C1-6 алкильных групп, (c-3) C1-6 алкоксигрупп, (c-4) фенил-C1-6 алкоксигрупп и (c-5) C1-6 алкоксикарбонильных групп;
(d) фурильной группой, в которой фурановое кольцо может быть замещено C1-6 алкильной группой или группами;
(e) тиенильной группой, в которой тиофеновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (e-1) атомов галогена, (e-2) C1-6 алкильных групп, и (e-3) C1-6 алкоксигрупп;
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами;
(h) пирролильной группой, в которой пиррольное кольцо может быть замещено C1-6 алкильной группой или группами;
(i) имидазолильной группой, в которой имидазольное кольцо может быть замещено C1-6 алкильной группой или группами; и
A является (i) -CO-B-, где B является метиленовой группой, этиленовой группой или триметиленовой группой; (ii) -CO-Ba-, где Ba является винилиденовой группой; (iii) -CH(OH)-B-, где B является метиленовой группой или этиленовой группой; (iv) -COCH(CООR3)-Bb-, где R3 является метильной группой, этильной группой или третбутильной группой и Bb является метиленовой группой или этиленовой группой; или (v) -Bс-, где Bс является этиленовой группой, триметиленовой группой или тетраметиленовой группой.
10. Соединение, оптический изомер или соль по пункту 1, где в формуле (1) R1 является 3,4-ди-C1-6 алкоксифенильной группой;
R2 является (a) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (a-1) гидроксильных групп, (a-2) атомов галогена, (a-3) незамещенных или галогензамещенных C1-6 алкильных групп, (a-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (a-5) C1-6 алкокси-C1-6 алкоксигрупп, (a-6) амино-C1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-7) метилендиоксигрупп, (a-8) карбоксильных групп, (a-9) феноксигрупп, (a-10) C1-6 алкоксикарбонильных групп, (a-11) C1-6 алканоилоксигрупп, (a-12) C1-6 алканоильных групп, (a-13) цианогрупп, (a-14) нитрогрупп, (a-15) C1-6 алкилкарбамоильных групп, (a-16) аминосульфонильных групп, (a-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-18) C1-6 алканоиламиногрупп, (a-19) C1-6 алкилтиогрупп, (a-20) фенильных групп, (a-21) пиразолильных групп, (a-22) имидазолильных групп, (a-23) триазолильных групп, (a-24) морфолиногрупп, (a-25) пирролидинильных групп, (a-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами, и (a-27) фенил-C1-6 алкоксигрупп;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (c-1) гидроксильных групп, (c-2) C1-6 алкильных групп, (c-3) C1-6 алкоксигрупп, (c-4) фенил-C1-6 алкоксигрупп и (c-5) C1-6 алкоксикарбонильных групп; или
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами; и
A является (i) -CO-B-, где B является этиленовой группой; (iii) -CH(OH)-B-, где B является этиленовой группой; (iv) -CОCH(CООR3)-Bb-, где R3 является метильной группой и Bb является метиленовой группой; или (v) -Bс-, где Bс является триметиленовой группой.
Настоящее изобретение дополнительно предлагает следующие применения для выше приведенных соединений тиазола.
11. Фармацевтическая композиция, включающая соединение, оптический изомер или соль по пунктам 1-10.
12. Ингибитор фосфодиэстеразы 4, включающий в качестве активного ингредиента соединение, оптический изомер или соль по пунктам 1-10.
13. Ингибитор продукции IFN-α, включающий в качестве активного ингредиента соль, оптический изомер или соль по пунктам 1-10.
14. Ингибитор продукции IL-4, включающий в качестве активного ингредиента соль, оптический изомер или соль по пунктам 1-10.
15. Профилактическое или терапевтическое средство для атопического дерматита, включающее в качестве активного ингредиента соль, оптический изомер или соль по пунктам 1-10.
16. Способ лечения атопического дерматита, включающий стадию введения человеку или животному млекопитающему эффективного количества соединения, оптического изомера или соли по пунктам 1-10.
17. Применение соединения, оптического изомера или соли по пунктам 1-10 для получения профилактического или терапевтического средства для атопического дерматита.
18. Применение соединения, оптического изомера или соли по пунктам 1-10 для получения ингибитора фосфодиэстеразы 4.
19. Применение соединения, оптического изомера или соли по пунктам 1-10 для получения ингибитора продукции IFN-α.
20. Применение соединения, оптического изомера или соли по пунктам 1-10 для получения ингибитора продукции IL-4.
ПРЕДПОЧТИТЕЛЬНЫЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение описано ниже более подробно.
(I) Соединение, представленное формулой (1)
В формуле (1) R1 представляет ди-C1-6 алкоксифенильную группу, то есть фенильную группу, замещенную двумя C1-6 линейными или разветвленными алкоксильными группами. Конкретные примеры включают 2,3-диметоксифенил, 2,4-диметоксифенил, 2,5-диметоксифенил, 2,6-диметоксифенил, 3,4-диметоксифенил, 3,5-диметоксифенил, 2,3-диэтоксифенил, 2,4-диэтоксифенил, 2,5-диэтоксифенил, 2,6-диэтоксифенил, 3,4-диэтоксифенил, 3,5-диэтоксифенил, 2,3-дипропоксифенил, 2,4-дипропоксифенил, 2,5-дипропоксифенил, 2,6-дипропоксифенил, 3,4-дипропоксифенил, 3,5-дипропоксифенил, 2,3-диизопропоксифенил, 2,4-диизопропоксифенил, 2,5-диизопропоксифенил, 2,6-диизопропоксифенил, 3,4-диизопропоксифенил, 3,5-диизопропоксифенил, 2,3-дибутоксифенил, 2,4-дибутоксифенил, 2,5-дибутоксифенил, 2,6-дибутоксифенил, 3,4-дибутоксифенил, 3,5-дибутоксифенил, 2,3-дипентоксифенил, 2,4-дипентоксифенил, 2,5-дипентоксифенил, 2,6-дипентоксифенил, 3,4-дипентоксифенил, 3,5-дипентоксифенил 2,3-дигексилоксифенил, 2,4-дигексилоксифенил, 2,5-дигексилоксифенил, 2,6-дигексилоксифенил, 3,4-дигексилоксифенил, 3,5-дигексилоксифенил и другие подобные. Предпочтительно, чтобы R1 в формуле (1) являлась 3,4-ди-C1-6 алкоксифенильной группой, более предпочтительно - 3,4-ди-C1-3 алкоксифенильной группой и особенно предпочтительно - 3,4-диметоксифенильной группой или 3,4-диэтоксифенильной группой.
В формуле (1) R2 представляет (a) фенильную группу, (b) нафтильную группу, (c) пиридильную группу, (d) фурильную группу, (e) тиенильную группу, (f) изоксазолильную группу, (g) тиазолильную группу, (h) пирролильную группу, (i) имидазолильную группу, (j) тетразолильную группу, (k) пиразинильную группу, (l) тиенотиенильную группу, (m) бензотиенильную группу, (n) индолильную группу, (o) бензимидазолильную группу, (p) имидазолильную группу, (q) хинолильную группу, (r) 3,4-дигидрокарбостирильную группу, (s) хиноксалинильную группу или (t) 1,3-бензодиоксолильную группу.
Когда R2 является (a) фенильной группой, фенильное кольцо фенильной группы может быть замещено одним или более членами, выбранными из группы, состоящей из (a-1) гидроксильных групп, (a-2) атомов галогена, (a-3) незамещенных или галогензамещенных C1-6 алкильных групп, (a-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (a-5) C1-6 алкокси-C1-6 алкоксигрупп, (a-6) амино-C1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-7) метилендиоксигрупп, (a-8) карбоксильных групп, (a-9) феноксигрупп, (a-10) C1-6 алкоксикарбонильных групп, (a-11) C1-6 алканоилоксигрупп, (a-12) C1-6 алканоильных групп, (a-13) цианогрупп, (a-14) нитрогрупп, (a-15) C1-6 алкилкарбамоильных групп, (a-16) аминосульфонильных групп, (a-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (a-18) C1-6 алканоиламиногрупп, (a-19) C1-6 алкилтиогрупп, (a-20) фенильных групп, (a-21) пиразолильных групп, (a-22) имидазолильных групп, (a-23) триазолильных групп, (a-24) морфолиногрупп, (a-25) пирролидинильных групп и (a-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами. Когда R2 является замещенной фенильной группой, число заместителей не ограничивается и может быть, например, от 1 до 5 и предпочтительно - от 1 до 3.
Когда R2 является (c) пиридильной группой, пиридиновое кольцо пиридильной группы может быть замещено одним или более членами, выбранными из группы, состоящей из (c-1) гидроксильных групп, (c-2) C1-6 алкильных групп, (c-3) C1-6 алкоксигрупп и (c-4) фенил-C1-6 алкоксигрупп. Когда R2 является замещенной пиридильной группой, число заместителей не ограничивается и может быть, например, от 1 до 4, и предпочтительно - от 1 до 3.
Когда R2 является (d) фурильной группой, фурановое кольцо фурильной группы может быть замещено C1-6 алкильной группой или группами. Когда R2 является замещенной фурильной группой, число заместителей не ограничивается и может быть, например, от 1 до 3 и предпочтительно - от 1 до 2.
Когда R2 является (e) тиенильной группой, тиофеновое кольцо тиенильной группы может быть замещено одним или более членами, выбранными из группы, состоящей из (e-1) атомов галогена, (e-2) C1-6 алкильных групп и (e-3) C1-6 алкоксигрупп. Когда R2 является замещенной тиенильной группой, число заместителей не ограничивается и может быть, например, от 1 до 3 и предпочтительно - от 1 до 2.
Когда R2 является (f) изоксазолильной группой, изоксазолильное кольцо изоксазолильной группы может быть замещено C1-6 алкильной группой или группами. Когда R2 является замещенной изоксазолильной группой, число заместителей не ограничивается и может быть, например, 1 или 2.
Когда R2 является (g) тиазолильной группой, тиазольное кольцо тиазолильной группы может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами. Когда R2 является замещенной тиазолильной группой, число заместителей не ограничивается и может быть, например, 1 или 2.
Когда R2 является (h) пирролильной группой, пиррольное кольцо пирролильной группы может быть замещено C1-6 алкильной группой или группами. Когда R2 является замещенной пирролильной группой, число заместителей не ограничивается и может быть, например, от 1 до 4, и предпочтительно - 1 или 2.
Когда R2 является (i) имидазолильной группой, имидазольное кольцо имидазолильной группы может быть замещено C1-6 алкильной группой или группами. Когда R2 является замещенной имидазолильной группой, число заместителей не ограничивается и может быть, например, от 1 до 3 и предпочтительно - 1 или 2.
Когда R2 является (o) бензимидазолильной группой, бензимидазольное кольцо бензимидазолильной группы может быть замещено C1-6 алкильной группой или группами. Когда R2 является замещенной бензимидазолильной группой, число заместителей не ограничивается и может быть, например, от 1 до 5 и предпочтительно - от 1 до 3.
Когда R2 является (n) индолильной группой, индольное кольцо индолильной группы может быть замещено C1-6 алкильной группой или группами. Когда R2 является замещенной индолильной группой, число заместителей не ограничивается и может быть, например, от 1 до 6 и предпочтительно - от 1 до 3.
Когда R2 является (r) 1,2,3,4-тетрагидрохинолильной группой, 1,2,3,4-тетрагидрохинолиновое кольцо 1,2,3,4-тетрагидрохинолильной группы может быть замещено оксогруппой или группами. Когда R2 является оксозамещенной 1,2,3,4-тетрагидрохинолильной группой, число оксогрупп не ограничивается и может быть, например, от 1 до 3 и предпочтительно - 1 или 2.
Термины, используемые в описании групп, представленных R2 в формуле (1), определяются следующим образом.
Атомы галогена включают атомы фтора, атомы хлора, атомы брома, атомы йода и так далее.
C1-6 алкильные группы являются линейными или разветвленными алкильными группами, имеющими от 1 до 6 углеродных атомов. Примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, третбутил, вторбутил, н-пентил, неопентил, н-гексил, изогексил, 3-метилпентил и так далее.
Незамещенные или галогензамещенные C1-6 алкильные группы являются линейными или разветвленными алкильными группами, имеющими от 1 до 6 углеродных атомов, определенными выше, или такими алкильными группами, замещенными от 1 до 7 атомами галогена. Примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, третбутил, вторбутил, н-пентил, неопентил, н-гексил, изогексил, 3-метилпентил, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, бромметил, дибромметил, дихлорфторметил, 2,2,2-трифторэтил, пентафторэтил, 2-хлорэтил, 3,3,3-трифторпропил, гептафторпропил, гептафторизопропил, 3-хлорпропил, 2-хлорпропил, 3-бромпропил, 4,4,4-трифторбутил, 4,4,4,3,3-пентафторбутил, 4-хлорбутил, 4-бромбутил, 2-хлорбутил, 5,5,5-трифторпентил, 5-хлорпентил, 6,6,6-трифторгексил, 6-хлоргексил и так далее.
C1-6 алкоксильные группы являются группами, состоящими из C1-6 алкильной группы, определенной выше, и кислорода. Примеры включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, третбутокси, вторбутокси, н-пентокси, неопентокси, н-гексилокси, изогексилокси, 3-метилпентокси и так далее.
Незамещенные или галогензамещенные C1-6 алкоксильные группы являются C1-6 алкоксильными группами, определенными выше, или такими алкоксильными группами, замещенными от 1 до 7 атомами галогена. Примеры включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, третбутокси, вторбутокси, н-пентокси, неопентокси, н-гексилокси, изогексилокси, 3-метилпентокси, фторметокси, дифторметокси, трифторметокси, хлорметокси, дихлорметокси, трихлорметокси, бромметокси, дибромметокси, дихлорфторметокси, 2,2,2-трифторэтокси, пентафторэтокси, 2-хлорэтокси, 3,3,3-трифторпропокси, гептафторпропокси, гептафторизопропокси, 3-хлорпропокси, 2-хлорпропокси, 3-бромпропокси, 4,4,4-трифторбутокси, 4,4,4,3,3-пентафторбутокси, 4-хлорбутокси, 4-бромбутокси, 2-хлорбутокси, 5,5,5-трифторпентокси, 5-хлорпентокси, 6,6,6-трифторгексилокси, 6-хлоргексилокси и так далее.
C1-6 алкокси-C1-6 алкоксильные группы являются C1-6 алкоксильными группами, замещенными от 1 до 7 C1-6 алкоксильными группами, определенными выше. Примеры включают метоксиметокси, 2-метоксиэтокси, 3-метоксипропокси, 4-ме6токсибутокси, 5-метоксипентокси, 6-метоксигексилокси, этоксиметокси, 1-этоксиэтокси, 2-этоксиэтокси, 3-этоксипропокси, 2-изопропоксиэтокси, третбутоксиметокси, 2-(третбутокси)этокси, 3-(третбутокси)пропокси, 6-(третбутокси)гексилокси, 4-(третбутокси)бутокси и так далее.
Амино-C1-6 алкоксильные группы, которые могут быть замещены C1-6 алкильной группой или группами, являются аминоалкоксильными группами, в которых алкоксильным фрагментом является C1-6 линейная или разветвленная алкоксильная группа и в которой от 1 до 2 C1-6 алкильных групп могут быть замещены на атоме азота. Примеры таких аминоалкоксигрупп включают аминометокси, 2-аминоэтокси, 1-аминоэтокси, 3-аминопропокси, 4-аминобутокси, 5-аминопентилокси, 6-аминогексилокси, 1,1-диметил-2-аминоэтокси, 2-метил-3-аминопропокси, метиламинометокси, 1-этиламиноэтокси, 2-пропиламиноэтокси, 3-изопропиламинопропокси, 4-изопропиламинобутокси, 4-бутиламинобутокси, 4-третбутиламинобутокси, 5-пентиламинопентилокси, 6-гексиламиногексилокси, диметиламинометокси, 2-диэтиламиноэтокси, 2-диметиламиноэтокси, (N-этил-N-пропиламино)метокси, 2-(N-метил-N-гексиламино)этокси и так далее.
C1-6 алкоксикарбонильные группы включают, например, метоксикарбонильную, этоксикарбонильную, пропоксикарбонильную, изопропоксикарбонильную, бутоксикарбонильную, третбутоксикарбонильную, пентилоксикарбонильную, гексилоксикарбонильную и другие C1-6 линейные- или разветвленные алкоксикарбонильные группы.
C1-6 алканоилоксигруппы включают, например, формилокси, ацетилокси, пропионилокси, бутирилокси, изобутирилокси, пентаноилокси, третбутилкарбонилокси, гексаноилокси, и другие C1-6 линейные или разветвленные алканоилоксигруппы.
C1-6 алканоильные группы включают, например, формильную, ацетильную, пропионильную, бутирильную, изобутирильную, пентаноильную, третбутилкарбонильную, гексаноильную и другие C1-6 линейные или разветвленные алканоильные группы.
C1-6 алкилкарбамоильные группы включают, например, метилкарбамоильную, этилкарбамоильную, пропилкарбамоильную, изопропилкарбамоильную, бутилкарбамоильную, третбутилкарбамоильную, пентилкарбамоильную, гексилкарбамоильную и другие C1-6 линейные или разветвленные алкилкарбамоильные группы.
Аминогруппы, которые могут быть замещены C1-6 алкильной группой или группами, включают, например, амино, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, третбутиламино, пентиламино, гексиламино, диметиламино, диэтиламино, дипропиламино, дибутиламино, дипентиламино, дигексиламино, N-метил-N-этиламино, N-этил-N-пропиламино, N-метил-N-бутиламино, N-метил-N-гексиламино и другие аминогруппы, которые могут иметь 1 или 2 C1-6 линейные или разветвленные алкильные группы в качестве заместителей.
C1-6 алканоиламинные группы включают, например, формиламинную, ацетиламинную, пропиониламинную, бутириламинную, изобутириламинную, пентаноиламинную, третбутилкарбониламинную, гексаноиламинную и другие C1-6 линейные или разветвленные алканоиламинные группы.
C1-6 алкилтиогруппы включают, например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, третбутилтио, пентилтио, гексилтио и другие C1-6 линейные или разветвленные алкилтиогруппы.
Пиперазинилкарбонильные группы, которые могут быть замещены C1-6 алкильной группой или группами, включают, например, пиперазинилкарбонильную, метилпиперазинилкарбонильную, этилпиперазинилкарбонильную, пропилпиперазинилкарбонильную, изопропилпиперазинилкарбонильную, изопропилпиперазинилкарбонильную, бутилпиперазинилкарбонильную, третбутилпиперазинилкарбонильную, пентилпиперазинилкарбонильную, гексилпиперазинилкарбонильную и другие пиперазинилкарбонильные группы, которые могут иметь C1-6 линейные или разветвленные алкильную группу или группы в качестве заместителей.
Фенил-C1-6 алкоксильные группы включают, например, бензилокси, фенетилокси, 3-фенилпропокси, 4-фенилбутокси, 5-фенилпентокси, 6-фенилгексилокси и так далее.
Предпочтительно, чтобы R2 в формуле (1) являлась (a) фенильной группой, (c) пиридильной группой, (d) фурильной группой, (e) тиенильной группой, (g) тиазолильной группой, (h) пирролильной группой или (i) имидазолильной группой и более предпочтительно - (a) фенильной группой, (c) пиридильной группой или (g) тиазолильной группой.
В формуле (1) A является (i) -CO-B-, где В является C1-6 алкиленовой группой, (ii) -CO-Ba-, где Ba является C2-6 алкиленовой группой, (iii) -CH(OH)-B-, где B определена выше, (iv) -CОCH(CООR3)-Bb-, где R3 является C1-6 алкильной группой и Bb является C1-6 алкиленовой группой или (v) -Bс-, где Bс является C2-6 алкиленовой группой. В A в Formula (1), B, Ba или Bb связаны с тиазольным кольцом.
Термины, используемые при описании групп, представленных A в формуле (1), определяются следующим образом.
C1-6 алкиленовые группы включают, например, метиленовую, этиленовую, триметиленовую, 2-метилтриметиленовую, 2,2-диметилтриметиленовую, 1-метилтриметиленовую, метилметиленовую, этилметиленовую, тетраметиленовую, пентаметиленовую, гексаметиленовую и другие C1-6 линейные или разветвленные алкиленовые группы.
C2-6 алкиленовые группы включают, например, этиленовую, триметиленовую, 2-метилтриметиленовую, 2,2-диметилтриметиленовую, 1-метилтриметиленовую, метилметиленовую, этилметиленовую, тетраметиленовую, пентаметиленовую, гексаметиленовую и другие C2-6 линейные или разветвленные алкиленовые группы.
C2-6 алкениленовые группы включают, например, винилиденовую, пропиленовую, бутениленовую и другие C2-6 линейные или разветвленные алкениленовые группы.
Термин "C1-6 алкильная группа", используемый при описании A в формуле (1), имеет такое же значение, как и для R2.
Предпочтительно, чтобы A в формуле (1) являлась (i) -CO-B-, где B является метиленовой группой, этиленовой группой или триметиленовой группой; (ii) -CO-Ba-, где Ba является винилиденовой группой; (iii) -CH(OH)-B-, где В является метиленовой группой или этиленовой группой, (iv) -CОCH(CООR3)-Bb-, где R3 является метильной группой, этильной группой или третбутильной группой и Bb является метиленовой группой или этиленовой группой; или (v) -Bс-, где Bс является этиленовой группой, триметиленовой группой или тетраметиленовой группой; и более предпочтительно - (i) -CO-B-, где B является этиленовой группой, (iii) -CH(OH)-B-, где В является этиленовой группой, (iv) -COCH(CООR3)-Bb-, где R3 является метильной группой и Bb является метиленовой группой или (v) -Bс-, где Bс является триметиленовой группой.
Соединение, представленное формулой (1), охватывает следующие соединения (1-1)-(1-3):
Соединение (1-1)
Соединение, в котором R1 является 3,4-ди-C1-6 алкоксифенильной группой, и предпочтительно - 3,4-диметоксифенильной группой или 3,4-диэтоксифенильной группой;
R2 является (a) фенильной группой, (c) пиридильной группой, (d) фурильной группой, (e) тиенильной группой, (g) тиазолильной группой, (h) пирролильной группой или (i) имидазолильной группой; и
A является (i) -CO-B-, (ii) -CO-Ba-, (iii) -CH(OH)-B-, (iv) -CОCH(CООR3)-Bb- или (v) -Bс-.
Соединение (1-2)
Соединение, в котором R1 является 3,4-ди-C1-6 алкоксифенильной группой, и предпочтительно - 3,4-диметоксифенильной группой или 3,4-диэтоксифенильной группой;
R2 является (a) фенильной группой, (c) пиридильной группой, (d) фурильной группой, (e) тиенильной группой, (g) тиазолильной группой, (h) пирролильной группой или (i) имидазолильной группой; и
A является (i) -CO-B-, где B является метиленовой группой, этиленовой группой или триметиленовой группой; (ii) -CO-Ba-, где Ba является винилиденовой группой; (iii) -CH(OH)-B-, где В является метиленовой группой или этиленовой группой, (iv) -CОCH(CООR3)-Bb-, где R3 является метильной группой, этильной группой или третбутильной группой и Bb является метиленовой группой или этиленовой группой; или (v) -Bс-, где Bс является этиленовой группой, триметиленовой группой или тетраметиленовой группой.
Соединение (1-3)
Соединение, в котором R1 является 3,4-ди-C1-6 алкоксифенильной группой, и предпочтительно - 3,4-диметоксифенильной группой или 3,4-диэтоксифенильной группой;
R2 является (a) фенильной группой, (c) пиридильной группой или (g) тиазолильной группой; и
A является (i) -CO-B-, где B является этиленовой группой, (iii) -CH(OH)-B-, где В является этиленовой группой, (iv) -CОCH(CООR3)-Bb-, где R3 является метильной группой и Bb является метиленовой группой, или (v) -Bс-, где Bс является триметиленовой группой.
Некоторые соединения, представленные формулой (1), имеют оптические изомеры. Некоторые соединения, представленные формулой (1), и их оптические изомеры образуют соли присоединения кислоты или соли присоединения основания. Настоящее изобретение охватывает оптические изомеры соединений, представленных формулой (1), а также соли соединений, представленных формулой (1), и их оптические изомеры.
Способ получения соединения формулы (1)
Соединение формулы (1), его оптические изомеры и его соли могут быть получены различными синтетическими способами, выбираемыми в соответствии с основным углеродным скелетом, типами заместителей и так далее. Типичные способы получения соединения формулы (1) описаны далее.
<Способ 1>
В способе 1 соединение формулы (1) получают взаимодействием соединения формулы (2) с соединением формулы (3),
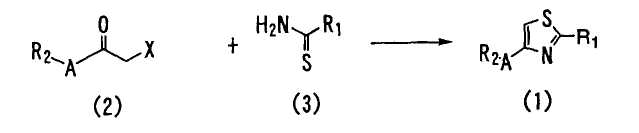
где R1, R2 и A определены выше; и X является атомом галогена.
Подходящим отношением соединения формулы (3) к соединению формулы (2) обычно является отношение от 0,5 до 5 моль, и предпочтительно - от 0,5 до 3 моль соединения формулы (3) на моль соединения формулы (2).
Реакцию соединения формулы (2) с соединением формулы (3) обычно проводят в соответствующем растворителе. Могут быть использованы разнообразные известные растворители, если только они не мешают реакции. Примеры используемых растворителей включают диметилформамид (DMF), диметилсульфоксид (DMSO), ацетонитрил и другие апротонные полярные растворители; ацетон, метилэтилкетон и другие кетоны; бензол, толуол, ксилол, тетралин, жидкий парафин и другие углеводородные растворители; метанол, этанол, изопропанол, н-бутанол, третбутанол и другие спирты; тетрагидрофуран (THF), диоксан, дипропиловый эфир, диэтиловый эфир, диметоксиэтан, диглим и другие простые эфиры; этилацетат, метилацетат и другие сложные эфиры; их смеси и так далее. Такие растворители могут содержать воду.
Реакцию соединения формулы (2) с соединением формулы (3) обычно осуществляют при непрерывном перемешивании при температуре от -20 до 200°C, и предпочтительно - от 0 до 150°C, в течение времени от 30 минут до 60 часов, и предпочтительно - от 1 до 30 часов.
Соединение формулы (3), используемое в качестве исходного реагента, является известным соединением. Формула (2) охватывает новые соединения. Способы получения соединений описываются далее.
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1).
<Способ 2>
В способе 2 соединение формулы (4) взаимодействует с соединением формулы (5) в присутствии основного соединения с получением соединения формулы (1), где A является -COCH(COOR3)-Bb- (далее обозначаемое как "соединение (1a)"),
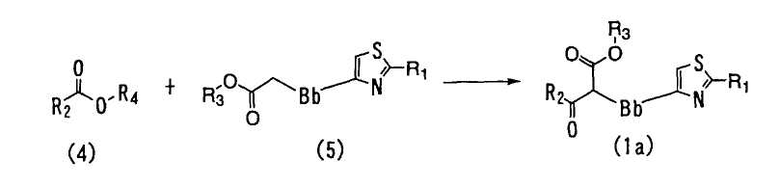
где R1, R2, R3 и Bb определены выше и R4 является C1-6 алкильной группой.
Отношение соединения формулы (5) к соединению формулы (4) обычно составляет от 0,5 до 5 моль, и предпочтительно - от 0,5 до 3 моль соединения формулы (5) на моль соединения формулы (4).
Реакцию соединения формулы (4) с соединением формулы (5) обычно проводят в соответствующем растворителе. Могут быть использованы разнообразные известные растворители, если только они не мешают реакции. Примеры используемых растворителей включают диметилформамид (DMF), диметилсульфоксид (DMSO), N-метилпирролидон (NMP) и другие апротонные полярные растворители; бензол, толуол, ксилол, тетралин, жидкий парафин и другие углеводородные растворители; метанол, этанол, изопропанол, н-бутанол, третбутанол и другие спирты; тетрагидрофуран (THF), диоксан, дипропиловый эфир, диэтиловый эфир, диметоксиэтан, диглим и другие простые эфиры; их смеси и так далее. Такие растворители могут содержать воду.
Реакцию соединения формулы (4) с соединением формулы (5) обычно проводят при непрерывном перемешивании при температуре от 0 до 200°C, и предпочтительно - от комнатной температуры до 150°C, в течение времени от 30 минут до 60 часов, и предпочтительно - от 1 до 50 часов.
Применяют разнообразные известные основные соединения, включая, например, щелочные металлы, гидриды металлов, алкоксиды металлов, карбонаты, гидрокарбонаты и другие неорганические основные соединения; ацетат и другие органические основные соединения и так далее.
Примеры щелочных металлов включают литий, натрий, калий и так далее. Примеры гидридов металлов включают гидрид натрия, гидрид калия и так далее. Примеры алкоксидов металлов включают метоксид натрия, этоксид натрия, третбутоксид калия, третбутоксид натрия и так далее. Примеры карбонатов включают карбонат натрия, карбонат калия и так далее. Примеры гидрокарбонатов включают гидрокарбонат натрия, гидрокарбонат калия и так далее. Неорганические основные соединения дополнительно включают амид натрия, диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия, н-бутиллитий, вторбутиллитий, метиллитий и так далее.
Примеры ацетатов включают ацетат натрия, ацетат калия и так далее. Другие примеры органических основных соединений включают триэтиламин, триметиламин, диизопропилэтиламин, пиридин, диметиланилин, 1-метилпирролидин, N-метилморфолин, 1,5-диазабицикло-[4.3.0]нонен-5 (DBN), 1,8-диазабицикло[5.4.0]ундецен-7 (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO), 2-третбутилимино-2-диэтиламино-1,3-диметил-пергидро-1,3,2-диазафосфорин (BEMP) и так далее.
Такое основное соединение применяют обычно в количестве от 0,1 до 5 моль, и предпочтительно - от 0,5 до 3 моль на моль соединения формулы (5).
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1a).
<Способ 3>
В способе 3 соединение формулы (1), в котором A является -COCH(COOR3)-Bb- (Compound (1a)), гидролизуют и декарбоксилируют с получением соединения формулы (1), в котором A является -CO-B- (далее обозначаемое как "соединение (1b)"),

где R1, R2, R3, B и Bb определены выше.
Гидролиз и декарбоксилирование соединения (1a) проводят в кислых условиях. Например, добавляют кислоту к суспензии или раствору соединения (1a) в соответствующем растворителе и образующуюся смесь перемешивают при температуре от 0 до 120°C. Применяемые растворители включают воду, спирты, такие как метанол, этанол, изопропанол, этиленгликоль и так далее, ацетонитрил, ацетон, толуол, DMF, DMSO, уксусную кислоту, трифторуксусную кислоту, их смеси и так далее. Применяемые кислоты включают трифторуксусную кислоту, уксусную кислоту и другие органические кислоты; соляную кислоту, бромноватую кислоту, бромистоводородную кислоту, серную кислоту и другие неорганические кислоты и так далее. Органическая кислота, такая как трифторуксусная кислота, уксусная кислота или другая подобная, может также использоваться в качестве реакционного растворителя. Температура реакции обычно составляет от 0 до 120°C, предпочтительно - от комнатной температуры до 100°C, и более предпочтительно - от комнатной температуры до 80°C. Время реакции обычно составляет от 30 минут до 24 часов, предпочтительно - от 30 минут до 12 часов, и более предпочтительно - от 1 до 8 часов.
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1b).
<Способ 4>
В способе 4 соединение формулы (6) взаимодействует с соединением формулы (7) с получением соединения формулы (1), в котором A является -CO-B- (далее обозначаемое как "соединение (1b)"),
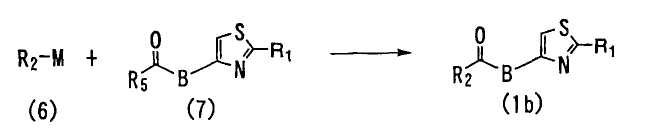
где R1, R2 и B определены выше; R5 является C1-6 алкоксигруппой или CH3ОN(CH3)- M является атомом лития или -MgX; и X является атомом галогена.
Отношение соединения формулы (7) к соединению формулы (6) обычно составляет от 0,5 до 5 моль, и предпочтительно - от 0,5 до 3 моль соединения формулы (7) на моль соединения формулы (6).
Реакцию соединения формулы (6) с соединением формулы (7) обычно проводят в соответствующем растворителе, который может быть выбран из большого числа известных растворителей, если только растворитель не мешает реакции. Примеры таких растворителей включают бензол, толуол, ксилол, тетралин, жидкий парафин и другие углеводородные растворители; тетрагидрофуран (THF), диоксан, дипропиловый эфир, диэтиловый эфир, диметоксиэтан, диглим и другие простые эфиры, их смеси и так далее.
Реакцию соединения формулы (6) с соединением формулы (7) обычно проводят при непрерывном перемешивании при температуре от -100 до 200°C, и предпочтительно - от -100 до 100°C, в течение времени от 30 минут до 60 часов, предпочтительно - от 1 до 50 часов.
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация, и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1b).
<Способ 5>
В способе 5 соединение формулы (1b) реагирует в присутствии восстановителя с получением соединения формулы (1), в которой A является -CH(OH)-B- (далее обозначаемое как "соединение (1с)"),
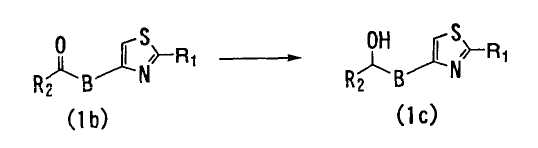
где R1, R2 и B определены выше.
Примеры растворителей, используемых в вышеприведенной реакции, включают воду; метанол, этанол, изопропанол, бутанол, третбутанол, этиленгликоль и другие низшие спирты; этилацетат, метилацетат и другие сложные эфиры; диэтиловый эфир, тетрагидрофуран, диоксан, моноглим, диглим и другие простые эфиры; бензол, толуол, ксилол и другие ароматические углеводороды; дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод и другие галогенированные углеводороды; их смеси и так далее.
Примеры используемых восстановителей включают боргидрид натрия, гидрид лития алюминия, гидрид диизобутилалюминия и другие восстановители на основе гидридов и смеси таких восстановителей на основе гидридов.
Когда восстановитель на основе гидрида используют в качестве восстановителя, температура реакции обычно составляет от -80 до 100°C, и предпочтительно - от -80 до 70°C, и реакция заканчивается в течение времени от 30 минут до 100 часов. Количество используемого восстановителя на основе гидрида составляет обычно от 1 до 20 моль, и предпочтительно - от 1 до 6 моль на моль соединения (1b). В частности, когда в качестве восстановителя используют гидрид лития алюминия, предпочтительно, чтобы в качестве растворителя использовался простой эфир, такой как диэтиловый эфир, тетрагидрофуран, диоксан, моноглим, диглим или другой подобный, или ароматический углеводород, такой как бензол, толуол, ксилол или другой подобный.
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1с).
<Способ 6>
В способе 6 соединение формулы (6) взаимодействует с соединением формулы (8) с получением соединения формулы (1c),
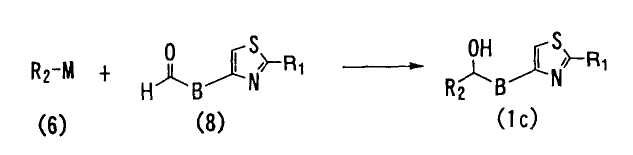
где R1, R2, В и M определены выше.
Реакцию в способе 6 осуществляют при таких же реакционных условиях, что и для реакции в способе 4.
<Способ 7>
В способе 7 соединение (1c) реагирует в соответствующем растворителе в присутствии окислителя с получением соединения (1b),

где R1, R2 и B определены выше.
Растворитель для использования в способе 7 может быть выбран из большого числа известных растворителей, если только он не мешает реакции. Примеры используемых растворителей включают диметилформамид (DMF), диметилсульфоксид (DMSO), N-метилпирролидон (NMP), ацетонитрил и другие апротонные полярные растворители; бензол, толуол, ксилол, тетралин, жидкий парафин и другие углеводородные растворители; этилацетат, метилацетат и другие сложные эфиры; тетрагидрофуран (THF), диоксан, дипропиловый эфир, диэтиловый эфир, диметоксиэтан, диглим и другие простые эфиры; дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод и другие галогенированные углеводороды; их смеси и так далее. Такие растворители могут содержать воду.
В способе 7 окислитель может быть выбран из большого многообразия известных окислителей. Примеры используемых окислителей включают диметилсульфоксид (DMSO)-триоксид серы-пиридин, диметилсульфоксид (DMSO)-оксалилхлорид-триэтиламин, хлорохромат пиридиния (PCC), хромовую кислоту, диоксид марганца и так далее.
Количество используемого окислителя составляет обычно от 1 до 20 моль, и предпочтительно - от 1 до 6 моль на моль соединения (1с).
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1b).
<Способ 8>
В способе 8 соединение формулы (8) взаимодействует с соединением формулы (9) в присутствии основного соединения с получением соединения формулы (1), в котором A является -CO-Ba- (далее обозначаемое как "соединение (1d)"),
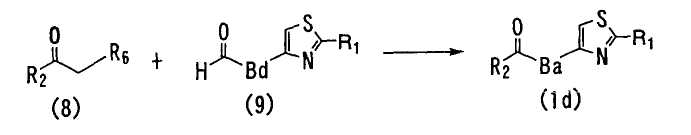
где R1, R2 и Ba определены выше; R6 является атомом водорода или -PO(OR7)2; Bd является -(CH2)n-; n является целым числом от 0 до 4; и R7 является C1-6 алкильной группой.
Отношение соединения формулы (9) к соединению формулы (8) обычно составляет от 0,5 до 5 моль, и предпочтительно - от 0,5 до 3 моль соединения формулы (9) на моль соединения формулы (8).
Реакцию соединения формулы (8) с соединением формулы (9) обычно проводят в соответствующем растворителе. Может быть использовано большое число известных растворителей, если только они не мешают реакции. Примеры используемых растворителей включают диметилформамид (DMF), диметилсульфоксид (DMSO), N-метилпирролидон (NMP) и другие апротонные полярные растворители; бензол, толуол, ксилол, тетралин, жидкий парафин и другие углеводородные растворители; метанол, этанол, изопропанол, н-бутанол, третбутанол и другие спирты; тетрагидрофуран (THF), диоксан, дипропиловый эфир, диэтиловый эфир, диметоксиэтан, диглим и другие простые эфиры; их смеси и так далее. Такие растворители могут содержать воду.
Реакцию соединения формулы (8) с соединением формулы (9) обычно проводят при непрерывном перемешивании при температуре от 0 до 200°C, и предпочтительно - от комнатной температуры до 150°C, в течение времени от 30 минут до 60 часов, и предпочтительно - от 1 до 50 часов.
Применяют большое число известных основных соединений, включая, например, щелочные металлы, гидриды металлов, алкоксиды металлов, карбонаты, гидрокарбонаты и другие неорганические основные соединения; ацетат и другие органические основные соединения и так далее.
Примеры щелочных металлов включают литий, натрий, калий и так далее. Примеры гидридов металлов включают гидрид натрия, гидрид калия и так далее. Примеры алкоксидов металлов включают метоксид натрия, этоксид натрия, третбутоксид калия, третбутоксид натрия и так далее. Примеры карбонатов включают карбонат натрия, карбонат калия и так далее. Примеры гидрокарбонатов включают гидрокарбонат натрия, гидрокарбонат калия и так далее. Неорганические основные соединения включают дополнительно к выше приведенным соединениям амид натрия, диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и так далее.
Примеры ацетатов включают ацетат натрия, ацетат калия и так далее. Примеры органических основных соединений, отличающихся от приведенных выше, включают триэтиламин, триметиламин, диизопропилэтиламин, пиридин, диметиланилин, 1-метилпирролидин, N-метилморфолин, 1,5-диазабицикло-[4.3.0]нонен-5 (DBN), 1,8-диазабицикло[5.4.0]ундецен-7 (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO), 2-третбутилимино-2-диэтиламино-1,3-диметил-пергидро-1,3,2-диазафосфолин (BEMP) и так далее.
Удобно использовать такое основное органическое соединение в количестве от 0,1 до 5 моль, и предпочтительно - от 0,5 до 3 моль на моль соединения, представленного формулой (8).
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1d).
<Способ 9>
В способе 9 соединение (1d) реагирует в присутствии восстановителя с получением соединения (1b),

где R1, R2, Ba и B определены выше.
Примеры восстановителей включают восстановители на основе водорода в присутствии таких катализаторов, как палладиевая чернь, палладированный уголь, оксид платины, платиновая чернь, никель Ренея и так далее.
При использовании восстановителя на основе водорода в присутствии катализатора обычно удобно проводить реакцию в атмосфере водорода при давлении от нормального атмосферного до 20 атм, и предпочтительно - от нормального атмосферного до 10 атм, или в присутствии донора водорода, такого как муравьиная кислота, муравьинокислый аммоний, циклогексен, гидрат гидразина или других подобных, обычно при температуре от -30 до 100°C, и предпочтительно - от 0 до 60°C. Реакцию обычно заканчивают в течение времени от 1 до 12 часов. Подходящее количество используемого восстановителя на основе водорода в присутствии катализатора обычно составляет от 0,1 до 40 частей по массе, и предпочтительно - от 1 до 20 частей по массе на 100 частей по массе соединения (Id).
Примеры растворителей, используемых в реакции в способе 9, включают воду; метанол, этанол, изопропанол, н-бутанол, третбутанол, этиленгликоль и другие низшие спирты; этилацетат, метилацетат и другие сложные эфиры; диметилформамид (DMF), N-метилпирролидон (NMP) и другие апротонные полярные растворители; диэтиловый эфир, тетрагидрофуран, диоксан, моноглим, диглим и другие простые эфиры; бензол, толуол, ксилол и другие ароматические углеводороды; их смеси и так далее.
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают методу выделения, такому как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1b).
<Способ 10>
В способе 10 соединение (1b) подвергают реакции восстановления с получением соединения формулы (1e) (далее обозначаемое как "соединение (1e)"),
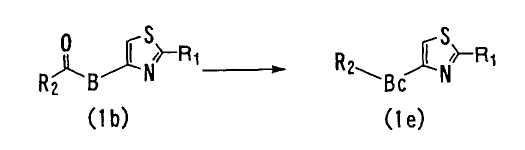
где R1, R2 и B определены выше; и Bс является C2-6 алкиленовой группой.
Большое разнообразие известных реакций восстановления может быть использовано в качестве реакции восстановления. Например, реакция восстановления может быть осуществлена в результате нагревания соединения в присутствии гидразина и основного соединения в соответствующем растворителе.
Примеры используемых растворителей включают воду; метанол, этанол, изопропанол, бутанол, третбутанол, этиленгликоль, диэтиленгликоль и другие низшие спирты; диметилформамид (DMF), N-метилпирролидон (NMP) и другие апротонные полярные растворители; диэтиловый эфир, тетрагидрофуран, диоксан, моноглим, диглим и другие простые эфиры; бензол, толуол, ксилол и другие ароматические углеводороды; их смеси и так далее.
Применяют большое разнообразие известных основных соединений, которое включает, например, гидриды металлов, алкоксиды металлов, гидроксиды, карбонаты, гидрокарбонаты и другие неорганические основные соединения и так далее.
Примеры гидридов металлов включают гидрид натрия, гидрид калия и так далее. Примеры алкоксидов металлов включают метоксид натрия, этоксид натрия, третбутоксид калия и так далее. Примеры гидроксидов включают гидроксид натрия, гидроксид калия и так далее. Примеры карбонатов включают карбонат натрия, карбонат калия и так далее. Примеры гидрокарбонатов включают гидрокарбонат натрия, гидрокарбонат калия и так далее. Неорганические основные соединения включают, кроме вышеприведенных соединений, амид натрия и другие подобные.
Удобно использовать такое основное соединение в количестве от 0,1 до 2 моль, предпочтительно - от 0,1 до 1 моль, и более предпочтительно - от 0,1 до 0,5 моль на моль соединения (1b).
Подходящей температурой реакции обычно является температура от 50 до 250°C, и предпочтительно - от 100 до 200°C, и реакцию заканчивают обычно в течение времени от 30 минут до 10 часов.
Получаемую таким образом реакционную смесь, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1е).
<Способ 11>
В способе 11 атом галогена в соединении формулы (If) (далее обозначаемое как "соединение (If)") замещают на циангруппу с получением соединения формулы (1g) (далее обозначаемое как "соединение (1g)"),
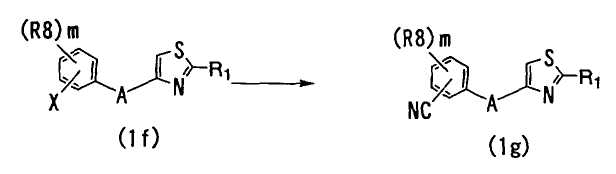
где R1, A и X определены выше; R8 является гидроксильной группой, незамещенной или галогензамещенной C1-6 алкильной группой, незамещенной или галогензамещенной C1-6 алкоксигруппой, C1-6 алкокси-C1-6 алкоксигруппой, фенил-C1-6 алкоксигруппой, амино-C1-6 алкоксигруппой, которая может быть замещена C1-6 алкильной группой, метилендиоксигруппой, карбоксильной группой, феноксигруппой, C1-6 алкоксикарбонильной группой, C1-6 алканоилоксигруппой, C1-6 алканоильной группой, цианогруппой, нитрогруппой, C1-6 алкилкарбамоильной группой, аминосульфонильной группой, аминогруппой, которая может быть замещена C1-6 алкильной группой или группами, C1-6 алканоиламиногруппой, C1-6 алкилтиогруппой, фенильной группой, пиразолильной группой, имидазолильной группой, триазолильной группой, морфолиногруппой, пирролидинильной группой или пиперазинилкарбонильной группой, которая может быть замещена C1-6 алкильной группой или группами; и m является целым числом от 0 до 4.
Большое разнообразие известных реакций замещения может быть использовано в качестве вышеназванной реакции замещения. Например, реакция замещения может быть осуществлена в результате нагревания соединения с цианидом в присутствии палладиевого катализатора в соответствующем растворителе.
Примеры палладиевых катализаторов включают тетракистрифенилфосфинпалладий и другие подобные. Соответствующее количество палладиевого катализатора обычно составляет от 0,001 до 0,4 моль, и предпочтительно - от 0,001 до 0,2 моль на моль соединения (If).
Примеры цианидов включают цианид цинка(II) и другие подобные. Обычно удобно использовать такой цианид в количестве от 0,1 до 5 моль, предпочтительно - от 0,5 до 3 моль, и более предпочтительно - от 0,5 до 1 моль на моль соединения (If).
Растворитель может быть выбран из большого разнообразия известных растворителей, если только они не мешают реакции. Примеры используемых растворителей включают диметилформамид (DMF), диметилсульфоксид (DMSO), ацетонитрил и другие апротонные полярные растворители; ацетон, метилэтилкетон и другие кетоны; бензол, толуол, ксилол, тетралин, жидкий парафин и другие углеводородные растворители; метанол, этанол, изопропанол, н-бутанол, третбутанол и другие спирты; тетрагидрофуран (THF), диоксан, дипропиловый эфир, диэтиловый эфир, диглим и другие простые эфиры; этилацетат, метилацетат и другие сложные эфиры; их смеси и так далее. Такие растворители могут содержать воду.
Реакцию соединения (If) с цианидом обычно проводят при температуре от -100 до 200°C, и предпочтительно - от -100 до 100°C, в течение времени от 30 минут до 60 часов, и предпочтительно - от 1 до 50 часов.
Реакционную смесь, получаемую в результате вышеприведенной реакции, например, охлаждают и подвергают такому методу выделения, как фильтрация, концентрирование, экстракция и/или другим подобным, для отделения неочищенного продукта реакции, который далее подвергают, если требуется, традиционному методу очистки, такому как колоночная хроматография, перекристаллизация и/или другому подобному, в результате чего выделяют и очищают соединение формулы (1g).
<Способ 12>
В способе 12 фрагмент карбоновой кислоты соединения формулы (1h) (далее обозначаемое как "соединение (1h)") подвергают реакции образования амидной связи с соединением формулы (10) (далее обозначаемое как "соединение 10") с образованием соединения формулы (1i) (далее обозначаемое как "соединение (1i)"),
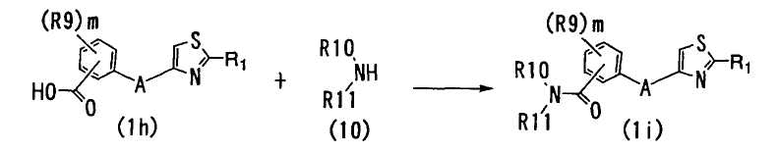
где R1, A и m определены выше; R9 является гидроксильной группой, атомом галогена, незамещенной или галогензамещенной C1-6 алкильной группой, незамещенной или галогензамещенной C1-6 алкоксигруппой, C1-6 алкокси-C1-6 алкоксигруппой, фенил-C1-6 алкоксигруппой, амино-C1-6 алкоксигруппой, которая может быть замещена C1-6 алкильной группой или группами; метилендиоксигруппой, феноксигруппой, C1-6 алкоксикарбонильной группой, C1-6 алканоилоксигруппой, C1-6 алканоильной группой, цианогруппой, нитрогруппой, C1-6 алкилкарбамоильной группой, аминосульфонильной группой, аминогруппой, которая может быть замещена C1-6 алкильной группой, C1-6 алканоиламиногруппой, C1-6 алкилтиогруппой, фенильной группой, пиразолильной группой, имидазолильной группой, триазолильной группой, морфолиногруппой, пирролидинильной группой, или пиперазинилкарбонильной группой, которая может быть замещена C1-6 алкильной группой или группами; и m является целым числом от 0 до 4; и R10 и R11 являются независимо каждая атомом водорода или C1-6 алкильной группой и могут быть связаны друг с другом через смежный атом азота и углеродный атом или атомы или другой атом азота с образованием пиперазинового кольца, которое может быть замещено C1-6 алкильной группой или группами.
Условия для известных реакций образования амидной связи могут быть использованы в реакции образования амидной связи в способе 12. Например, могут быть использованы следующие реакционные методы: (A) метод смешанного ангидрида кислоты, в котором карбоновая кислота (1h) взаимодействует с алкилгалогенкарбоксилатом с образованием смешанного ангидрида кислоты, который затем реагирует с соединением (10); (B) метод активного эфира, в котором карбоновую кислоту (1h) превращают в активированный эфир, такой как фениловый эфир, п-нитрофениловый эфир, N-гидроксисукцинимидный эфир, 1-гидроксмибензотриазольный эфир или другие подобные, или активированный амид с бензоксазолин-2-тионом, и активированный эфир или амид реагирует с соединением (10); (C) карбодиимидный метод, в котором карбоновую кислоту (1h) подвергают реакции конденсации с соединением (10) в присутствии активирующего агента, такого как дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид (WSC), карбонилдиимидазол или другого подобного; (D) другие методы, например, метод, в котором карбоновую кислоту (1h) превращают в карбоновый ангидрид при использовании дегидратирующего агента, такого как уксусный ангидрид, и карбоновый ангидрид затем взаимодействует с соединением (10), или метод, в котором эфир карбоновой кислоты (1h) с низшим спиртом взаимодействует с соединением (10) при высоком давлении и высокой температуре, метод, в котором галогенангидрид карбоновой кислоты (1h), то есть галогенид карбоновой кислоты, реагирует с соединением (10) и так далее.
Смешанный ангидрид кислоты, используемый в методе (А) смешанного ангидрида кислоты, может быть получен при помощи известной реакции Шоттена-Баумана, и полученный смешанный ангидрид кислоты, обычно не выделяемый, взаимодействует с соединением (10) с получением в результате соединения (1i). Реакцию Шоттена-Баумана осуществляют в присутствии основного соединения. Применяемые основные соединения включают соединения, традиционно используемые в реакции Шоттена-Баумана, такие как триэтиламин, триметиламин, пиридин, диметиланилин, N-этилдиизопропиламин, диметиламинопиридин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нонен-5 (DBN), 1,8-диазабицикло[5.4.0]ундецен-7 (DBU),
1,4-диазабицикло[2.2.2]-октан (DABCO) и другие органические основания; карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и другие карбонаты; гидроксид натрия, гидроксид калия, гидроксид кальция и другие гидроксиды металлов; гидрид калия, гидрид натрия, калий, натрий, амид натрия, алкоксиды металлов, такие как метоксид натрия и этоксид натрия, и другие неорганические основания и так далее. Реакцию обычно осуществляют при температуре от -20 до 100°C, и предпочтительно - от 0 до 50°C, обычно в течение времени от 5 минут до 10 часов, и предпочтительно - от 5 минут до 2 часов. Реакцию полученного смешанного ангидрида кислоты с соединением (10) обычно проводят при температуре от -20 до 150°C, и предпочтительно - от 10 до 50°C, обычно в течение времени от 5 минут до 10 часов, и предпочтительно - от 5 минут до 5 часов. Обычно метод смешанного ангидрида кислоты осуществляют в растворителе. Применяются растворители, которые традиционно используются в методах смешанного ангидрида кислоты. Примеры используемых растворителей включают хлороформ, дихлорметан, дихлорэтан, четыреххлористый углерод и другие галогенированные углеводороды; бензол, толуол, ксилол и другие ароматические углеводороды; диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диметоксиэтан и другие простые эфиры; метилацетат, этилацетат, изопропилацетат и другие сложные эфиры; N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид, гексаметилфосфортриамид и другие апротонные полярные растворители; их смеси и так далее. Примеры алкилгалогенкарбоксилатов, используемых в методе смешанного ангидрида кислоты, включают метилхлорформиат, метилбромформиат, этилхлорформиат, этилбромформиат, изобутилхлорформиат и так далее. В этом методе соединение (1h), алкилгалогенкарбоксилат и соединение (10) предпочтительно использовать в эквимолярных количествах, но каждый алкилгалогенкарбоксилат и соединение (1h) может также быть использовано в количестве от 1 до 1,5 моль на моль соединения (10).
Метод [C], в котором реакцию конденсации проводят в присутствии активирующего агента, может быть осуществлена в соответствующем растворителе в присутствии или отсутствие основного соединения. Растворители и основные соединения, применяемые в этом методе, включают те, которые упоминаются далее в качестве растворителей и основных соединений, применяемых в методе, в котором галогенид карбоновой кислоты взаимодействует с соединением (10), упомянутом выше в качестве одного из других методов (D). Соответствующее количество активирующего агента составляет, по меньшей мере, 1 моль, и предпочтительно - от 1 до 5 моль на моль соединения (10). При использовании WSC в качестве активирующего агента добавление 1-гидроксибензотриазола в реакционную систему позволяет проводить реакцию успешно. Реакцию обычно осуществляют при температуре от -20 до 180°C, и предпочтительно - от 0 до 150°C и обычно заканчивают в течение времени от 5 минут до 90 часов.
Когда применяют метод, в котором галогенид карбоновой кислоты взаимодействует с соединением (10), упомянутый выше как один из других методов (D), реакцию осуществляют в присутствии основного соединения в соответствующем растворителе. Используемые основные соединения включают большое разнообразие известных таких основных соединений, как те, которые используют в реакции Шоттена-Баумана, описанной выше. Используемые растворители включают в дополнение к тем, которые используют в способе смешанного ангидрида кислоты, метанол, этанол, изопропанол, пропанол, бутанол, 3-метокси-1-бутанол, этилцеллозольв, метилцеллозольв и другие спирты; ацетонитрил; пиридин; ацетон; воду и так далее. Отношение галогенида карбоновой кислоты к соединению (10) не ограничивается и может быть соответственно выбрано в широкой области. Обычно удобно использовать, например, по меньшей мере, 1 моль, и предпочтительно - от 1 до 5 моль галогенида карбоновой кислоты на моль соединения (10). Реакцию обычно осуществляют при температуре от -20 до 180°C, и предпочтительно - от 0 до 150°C и обычно заканчивают в течение времени от 5 минут до 50 часов.
Реакция образования амидной связи в способе 12 может также быть осуществлена в результате взаимодействия соединения (1h) с соединением (10) в присутствии фосфорсодержащего соединения, служащего в качестве конденсирующего агента, такого как трифенилфосфин, дифенилфосфинилхлорид, фенил-N-фенилфосфорамид хлорид, диэтилхлорфосфат, диэтилцианофосфат, азид дифенилфосфорной кислоты, хлорид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты и другие подобные.
Реакцию проводят в присутствии растворителя и основного соединения, используемых в методе, в котором галогенид карбоновой кислоты взаимодействует с соединением (10), обычно при температуре от -20 до 150°C, и предпочтительно - от 0 до 100°C и обычно заканчивают в течение времени от 5 минут до 30 часов. Удобно использовать каждый из конденсирующего агента и соединения (1h) в количествах, по меньшей мере, 1 моль, и предпочтительно - от 1 до 2 моль на моль соединения (10).
<Способ 13>
В способе 13 фрагмент карбоновой кислоты соединения (1h) подвергают реакции образования эфирной связи с соединением формулы (11) (далее обозначаемое как "соединение (11)") с получением соединения формулы (1j) (далее обозначаемое как "соединение 1j"),
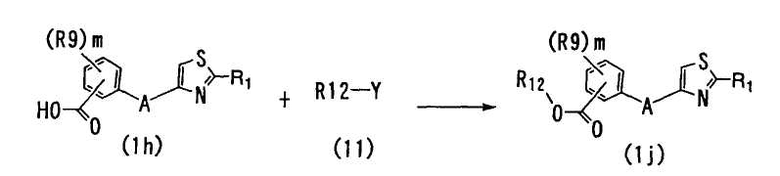
где R1, R9, A и m определены выше; R12 является C1-6 алкильной группой; и Y является гидроксильной группой или атомом галогена.
Условия для известных реакций образования эфирной связи могут быть использованы. Например, когда Y в соединении (11) является гидроксильной группой, реакция образования эфирной связи может быть осуществлена нагреванием соединения (1h) и соединения (11) в соответствующем растворителе в присутствии кислоты. Примеры используемых растворителей включают хлороформ, дихлорметан, дихлорэтан, четыреххлористый углерод и другие галогенированные углеводороды; бензол, толуол, ксилол и другие ароматические углеводороды; диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и другие простые эфиры; метилацетат, этилацетат, изопропилацетат и другие сложные эфиры; N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид, гексаметилфосфортриамид и другие апротонные полярные растворители; их смеси и так далее. Соединение (11) может также быть использовано в качестве растворителя. Примеры используемых кислот включают трифторуксусную кислоту и другие органические кислоты; соляную кислоту, бромноватую кислоту, бромистоводородную кислоту, серную кислоту и другие неорганические кислоты и так далее. Реакцию обычно осуществляют при температуре от 0 до 150°C, и предпочтительно - от комнатной температуры до 100°C и обычно заканчивают в течение времени от 0,5 до 30 часов.
Когда Y в соединении (11) является атомом галогена, реакцию в способе 13 осуществляют путем взаимодействия соединения (11) с соединением (1h) в соответствующем растворителе в присутствии основного соединения. Примеры используемых растворителей включают метанол, этанол, изопропанол, бутанол, третбутанол, этиленгликоль, диэтиленгликоль и другие низшие спирты; хлороформ, дихлорметан, дихлорэтан, четыреххлористый углерод и другие галогенированные углеводороды; бензол, толуол, ксилол и другие ароматические углеводороды; диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и другие простые эфиры; метилацетат, этилацетат, изопропилацетат и другие сложные эфиры; N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид, гексаметилфосфортриамид и другие апротонные полярные растворители; их смеси и так далее.
Примеры используемых основных соединений включают триэтиламин, триметиламин, пиридин, диметиланилин, N-этилдиизопропиламин, диметиламинопиридин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нонен-5 (DBN), 1,8-диазабицикло[5.4.0]ундецен-7 (DBU), 1,4-диазабицикло[2.2.2]-октан (DABCO) и другие органические основания; карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и другие карбонаты; гидроксид натрия, гидроксид калия, гидроксид кальция и другие гидроксиды металлов; гидрид калия, гидрид натрия, калий, натрий, амид натрия, алкоксиды металлов, такие как метоксид натрия и этоксид натрия, и другие неорганические основания и так далее. Подходящее отношение соединения (1h) к соединению (11) составляет, по меньшей мере, 1 моль, и предпочтительно - от 1 до 5 моль соединения (1h) на моль соединения (11). Реакцию обычно осуществляют при температуре от 0 до -150°C, и предпочтительно - от комнатной температуры до 100°C и обычно заканчивают в течение времени от 0,5 часа до 30 часов.
<Способ 14>
В способе 14 соединение формулы (1k) (далее обозначаемое как "соединение (1k)") алкилируют соединением формулы (12) (далее обозначаемое как "соединение (12)") с получением соединения формулы (11) (далее обозначаемое как "соединение 11"),
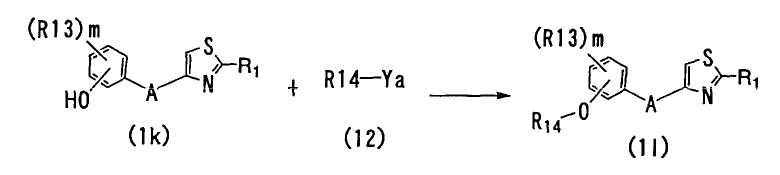
где R1, A и m определены выше; R13 является атомом галогена, незамещенной или галогензамещенной C1-6 алкильной группой, незамещенной или галогензамещенной C1-6 алкоксигруппой, C1-6 алкокси-C1-6 алкоксигруппой, фенил-C1-6 алкоксигруппой, амино-C1-6 алкоксигруппой, которая может быть замещена C1-6 алкильной группой, метилендиоксигруппой, карбоксильной группой, феноксигруппой, C1-6 алкоксикарбонильной группой, C1-6 алканоилоксигруппой, C1-6 алканоильной группой, цианогруппой, нитрогруппой, C1-6 алкилкарбамоильной группой, аминосульфонильной группой, аминогруппой, которая может быть замещена C1-6 алкильной группой или группами, C1-6 алканоиламиногруппой, C1-6 алкилтиогруппой, фенильной группой, пиразолильной группой, имидазолильной группой, триазолильной группой, морфолиногруппой, пирролидинильной группой, или пиперазинилкарбонильной группой, которая может быть замещена C1-6 алкильной группой или группами; R12 является C1-6 алкильной группой; Y является гидроксильной группой, атомом галогена или -OSО2-R13; R13 является C1-6 алкильной группой или фенильной группой, в которой фенильное кольцо может быть замещено C1-6 алкильной группой или группами, атомом или атомами галогена или нитрогруппой или группами; R14 является C1-6 алкильной группой или C1-6 алкокси-C1-6 алкоксигруппой; и Ya является атомом галогена.
В способе 14 реакция алкилирования может быть осуществлена взаимодействием соединения (Ik) с соединением (12), например, в соответствующем растворителе в присутствии основного соединения. Примеры используемых растворителей включают метанол, этанол, изопропанол, бутанол, третбутанол, этиленгликоль, диэтиленгликоль и другие низшие спирты; хлороформ, дихлорметан, дихлорэтан, четыреххлористый углерод и другие галогенированные углеводороды; бензол, толуол, ксилол и другие ароматические углеводороды; диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и другие простые эфиры; метилацетат, этилацетат, изопропилацетат и другие сложные эфиры; N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид, гексаметилфосфортриамид и другие апротонные полярные растворители; их смеси и так далее.
Примеры основных соединений включают триэтиламин, триметиламин, пиридин, диметиланилин, N-этилдиизопропиламин, диметиламинопиридин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нонен-5 (DBN), 1,8-диазабицикло[5.4.0]ундецен-7 (DBU), 1,4-диазабицикло[2.2.2]-октан (DABCO) и другие органические основания; карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и другие карбонаты; гидроксиды металлов, такие как гидроксид натрия, гидроксид калия, гидроксид кальция; гидрид калия, гидрид натрия, калий, натрий, амид натрия, алкоксиды металлов, такие как метоксид натрия и этоксид натрия, и другие неорганические основания и так далее. Соответствующее отношение соединения (12) к соединению (1k) составляет, по меньшей мере, 1 моль, и предпочтительно - от 1 до 5 моль соединения (12) на моль соединения (1k). Реакцию обычно осуществляют при температуре от 0 до 150°C, и предпочтительно - от комнатной температуры до 100°C, и обычно заканчивают в течение времени от 0,5 до 30 часов.
Способ получения соединения формулы (2)
Соединение формулы (2) (далее обозначаемое как "соединение (2)") для использования в качестве исходного реагента может быть получено, например, следующим способом 15 или 16.
<Способ 15>
В способе 15 соединение, представленное формулой (13) (далее обозначаемое как "соединение (13)"), галогенируют с получением соединения (2),

где R2, A и X определены выше. Реакция галогенирования соединения (13) может быть осуществлена в соответствующем растворителе в присутствии галогенирующего агента. Примеры используемых галогенирующих агентов включают бром, хлор и другие молекулярные галогены; хлористый йод; сульфурилхлорид; бромид меди и другие соединения меди; N-бромсукцинимид, N-хлорсукцинимид и другие N-галогенированные сукцинимиды; и так далее. Примеры используемых растворителей включают дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод и другие галогенированные углеводороды; уксусную кислоту; пропионовую кислоту и другие жирные кислоты; сероуглерод и так далее. Соответствующее количество галогенирующего агента составляет обычно от 1 до 10 моль, и предпочтительно - от 1 до 5 моль на моль соединения (13). Реакцию обычно осуществляют при температуре от 0°C до температуры кипения растворителя, и предпочтительно - от 0 до 100°C, и обычно завершают в течение времени от 5 минут до 20 часов.
<Способ 16>
В способе 16 соединение, представленное формулой (14) (далее обозначаемое как "соединение (14)"), галогенируют в присутствии воды в кислых условиях с получением соединения (2),

где R2, A и X определены выше. Реакцию галогенирования соединения (14) осуществляют в соответствующем растворителе в присутствии галогенирующего агента. Примеры используемых галогенирующих агентов включают бром, хлор и другие молекулярные галогены; хлористый йод; сульфурилхлорид; N-бромсукцинимид, N-хлорсукцинимид и другие N-галогенированные сукцинимиды; и так далее. Примеры используемых растворителей включают водный ацетонитрил. Примеры используемых кислот включают хлористоводородную кислоту, бромноватую кислоту, бромистоводородную кислоту, серную кислоту и другие неорганические кислоты, и другие подобные. Соответствующее количество галогенирующего агента составляет обычно от 1 до 10 моль, и предпочтительно - от 1 до 5 моль на моль соединения (14). Реакцию обычно осуществляют при температуре от 0°C до температуры кипения растворителя, и предпочтительно - от 0 до 100°C, и обычно завершают в течение времени от 5 минут до 20 часов.
(II) Лекарственные действия и применения
Соединения, представленные формулой (1), их оптические изомеры и их соли (далее обозначаемые вместе как "соединение настоящего изобретения"), проявляют специфическую ингибиторную активность по PDE4, и поэтому могут применяться в качестве активных ингредиентов PDE4 ингибиторов.
Соединение настоящего изобретения в силу его специфической ингибиторной активности по PDE4 может быть применено в качестве активного ингредиента фармацевтической композиции для применения в качестве профилактического или терапевтического средства при различных заболеваниях. Примеры заболеваний, при которых профилактическое или терапевтическое действия проявляются исходя из специфической ингибиторной активности по PDE4, включают острые или хронические (в частности, воспалительные и индуцированные аллергенами) заболевания дыхательных путей (например, бронхиальная астма и хронические обструктивные заболевания легких) различного происхождения; дерматозы (в частности, пролиферативного, воспалительного и аллергического типов) (например, псориаз, токсическая и аллергическая контактная экземы, атопический дерматит, гнездная алопеция и другие пролиферативные, воспалительные и аллергические дерматозы); заболевания, связанные с нервными дисфункциями, такими как расстройства процесса обучения, запоминания и познания, вызванные болезнью Альцгеймера, болезнью Паркинсона и так далее; заболевания, связанные с ментальными дисфункциями (например, маниакально-депрессивный психоз, шизофрения и синдром беспокойства); системные или локальные поражения суставов (например, остеоартроз колена и ревматизм суставов); диффузное воспаление в желудочно-кишечном тракте (например, болезнь Крона и язвенный колит); аллергические и/или хронические заболевания в области верхних дыхательных путей (полость глотки, носа) и прилегающих областей (околоносовая пазуха, глаз), вызванные ложными иммунологическими реакциями (например, аллергический ринит/синусит, хронический ринит/синусит и аллергические конъюнктивиты); и другие заболевания. Среди них для атопического дерматита соединение настоящего изобретения проявляет особенно высокое профилактическое или терапевтическое действия и поэтому может быть соответственно применено для предотвращения или лечения этого заболевания.
Когда соединение настоящего изобретения применяют в качестве PDE 4 ингибитора или профилактического или терапевтического средства для вышеупомянутых заболеваний, соединение может быть использовано в виде лекарственного препарата для перорального приёма, инъекции, лекарственного препарата для наружного применения или другого аналогичного препарата.
При пероральном применении соединение может быть в форме порошка, таблеток, гранул, капсул, сиропа, пленок, пастилок, жидкости или других подобных форм. Лекарственный препарат для перорального приёма может содержать фармацевтически приемлемую основу и/или носитель и фармацевтически приемлемые добавки, такие как связующие, вещества, способствующие разложению, скользящие вещества, смачивающие средства, буферы, консерванты, ароматизаторы и так далее, если требуется.
При применении в виде инъекции соединение может быть в форме водного раствора или суспензии, полученной растворением или суспендированием соединения в физиологическом растворе, водном растворе глюкозы или другом подобном.
При наружном применении соединение может быть в форме жидкости, масляного препарата, примочки, линимента, молочного лосьона, суспензии, крема, мази или других подобных. Препарат для наружного применения, если требуется, может содержать носитель, основу и/или добавки, которые традиционно применяют в препаратах для наружного применения. Примеры используемых добавок включают воду, масла, поверхностно-активные вещества, солюбилизирующие компоненты, эмульгаторы, окрашивающие вещества (красители, пигменты), вкусовые добавки, консерванты, антисептики, загустители, антиоксиданты, комплексоны, pH модификаторы, деодоранты и так далее.
Когда соединения настоящего изобретения применяют в качестве PDE4 ингибитора или профилактического или терапевтического средства при описанных выше заболеваниях, размер эффективной дозы и число доз соединения настоящего изобретения меняется в зависимости от типа соединения, возраста и массы пациента, которому дают соединение, симптома, цели применения и других факторов, и они не могут в целом быть определены. Например, для взрослого пациента в день количество, соответствующее от 0,1 до 1000 мг соединения настоящего изобретения, может быть введено или нанесено в виде разовой дозы или в виде двух или более разделённых доз.
Другим аспектом настоящего изобретения является способ лечения вышеупомянутых заболеваний, включающий стадию введения эффективного количества соединения настоящего изобретения человеку или животному млекопитающему.
Кроме того, соединение настоящего изобретения имеет ингибиторную активность при продукции TNF-α и ингибиторную активность при продукции IL-4 и поэтому может применяться в качестве активного ингредиента в ингибиторе продукции TNF-α и ингибитора продукции IL-4. Форма, путь введения, величина дозы и другие подобные моменты для ингибитора продукции TNF-α или ингибитора продукции IL-4, включающего соединение настоящего изобретения, являются такими же, как и в случае упомянутых выше PDE4 ингибитора и профилактического или терапевтического средства.
ПРИМЕРЫ
Следующие примеры приведены с целью иллюстрации настоящего изобретения, и они не ограничивают объем изобретения.
Справочный пример 1. Получение этил-2-бензоил-4-бром-4-пентеноата
Гидрид натрия (0,26 г, 6,0 ммоль) добавляли при охлаждении льдом к раствору (10 мл) этилбензоилацетата (1,0 мл, 5,77 ммоль) в DMF с последующим перемешиванием в течение 30 минут и затем добавляли 2,3-дибромпропен (0,63 мл, 5,77 ммоль). Образующуюся смесь перемешивали при комнатной температуре в течение 1,5 часов, добавляли к реакционной смеси воду и проводили три раза экстракцию этилацетатом. Органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: н-гексан/этилацетат=4/l). Растворитель отгоняли при пониженном давлении, получая в результате 1,55 г (выход: 86%) этил-2-бензоил-4-бром-4-пентеноата в виде бесцветного масла.
ЯМР δ ч/млн (CDCl3); 8,06-8,04 (2H, м), 7,63-7,60 (1H, м), 7,52-7,49 (2H, м), 5,71 (1H, д, J=1,8 Гц), 5,46 (1H, д, J=1,8 Гц), 4,81-4,79 (2H, м), 4,16 (2H, кв., J=7,1 Гц), 3,15-3,11 (2H, м), 1,18 (3H, т, J=7,1 Гц).
Справочный пример 2. Получение этил-2-бензоил-5-бром-4-оксопентаноата
N-бромсукцинимид (0,95 г, 5,3 ммоль) и каплю бромистоводородной кислоты добавляли к раствору этил-2-бензил-4-бром-4-пентеноата (1,5 г, 4,82 ммоль) в ацетонитриле (16 мл) и воде (4 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов и 40 минут. Реакционную смесь разбавляли диэтиловым эфиром и добавляли 5% водный раствор тиосульфата натрия для разделения смеси на слои. Органический слой промывали дважды насыщенным водным раствором гидрокарбоната натрия, промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: н-гексан/этилацетат=4/1). Растворитель отгоняли при пониженном давлении, получая в результате 0,91 г (выход: 58%) этил-2-бензоил-5-бром-4-оксопентеноата в виде бесцветного масла.
ЯМР δ ч/млн (CDCl3); 8,03-8,01 (2H, м), 7,63-7,59 (1H, м), 7,51-7,48 (2H, м), 4,93 (1H, дд, J=6,4 Гц, 7,5 Гц), 4,15 (2K, кв., J=7,1 Гц), 4,05 (2H, дд, J=13,0 Гц, 21,7 Гц), 3,43 (1H, дд, J=7,5 Гц, 18,1 Гц), 3,36 (1H, дд, J=6,4 Гц, 18,1 Гц), 1,16 (3H, т, J=7,1 Гц).
Справочный пример 3. Получение 4-хлорметил-2-(3,4-диэтоксифенил)тиазола
3,4-диэтокситиобензамид (30,0 г, 133 ммоль) суспендировали в этаноле (300 мл) и добавляли 1,3-дихлорацетон (12,8 мл, 135 ммоль) с последующим нагреванием с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры растворитель отгоняли при пониженном давлении и остаток экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/3). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смешанного растворителя этилацетат/н-гексан, получая в результате 26,9 г (выход: 68%) 4-хлорметил-2-(3,4-диэтоксифенил)тиазола в виде кристаллов призматической формы желтого цвета. Температура плавления: 81,5-82,3°C.
Справочный пример 4. Получение 2-(3,4-диэтоксифенил)тиазол-4-карбоксальдегида
N-метилморфолин-N-оксид (16,5 г, 141 ммоль) добавляли к раствору (200 мл) 4-хлорметил-2-(3,4-диэтоксифенил)тиазола (13,99 г, 47 ммоль) в ацетонитриле с последующим нагреванием с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры растворитель отгоняли при пониженном давлении и остаток экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/2). Растворитель отгоняли при пониженном давлении, получая в результате 11,2 г (выход: 86%) 2-(3,4-диэтоксифенил)тиазол-4-карбоксальдегида в виде твердого вещества желтого цвета. Температура плавления: 84,0-87,0°C.
Справочный пример 5. Получение 3-[2-(3,4-диэтоксифенил) тиазол-4-ил]пропионовой кислоты
Бром (55 мл, 1,07 моль) добавляли по каплям при охлаждении льдом к раствору (1,2 л) диметилацетилсукцината (200 г, 1,06 моль) в диэтиловом эфире. Полученную смесь перемешивали при комнатной температуре в течение ночи, растворитель отгоняли при пониженном давлении. К остатку добавляли уксусную кислоту (0,4 л) и концентрированную соляную кислоту (0,4 л) и образующуюся смесь перемешивали при комнатной температуре в течение 4,5 часов и дополнительно при 80°C в течение 3,5 часов. Растворитель отгоняли при пониженном давлении и к остатку добавляли 3,4-диэтокситиобензамид (215,5 г, 0,96 моль), диметоксиэтан (0,8 л) и воду (0,4 л) с последующим перемешиванием при 80°C в течение 1 часа. После охлаждения до комнатной температуры осажденные кристаллы отфильтровывали, промывали водой и сушили при 60°C, получая в результате 305,15 г (выход: 83%) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионовой кислоты в виде порошка светло-коричневого цвета. Температура плавления: 111,3-113,5°C.
Справочный пример 6. Получение метил-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионата
Раствор (2,3 л) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионовой кислоты (254,5 г) в метаноле охлаждали на льду и по каплям добавляли 58 мл тионилхлорида. После окончания добавления полученную смесь нагревали с обратным холодильником в течение 2 часов и охлаждали до комнатной температуры. Растворитель отгоняли при пониженном давлении и остаток экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/3). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смешанного растворителя этилацетат/н-гексан, получая в результате 219,35 г (выход: 68%) метил-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионата в виде порошка белого цвета. Температура плавления: 58,1-58,3°C.
Справочный пример 7. Получение 3-[2-(3,4-диэтоксифенил)]-тиазол-4-ил]-N-метокси-N-метилпропионамида
1-гидроксибензотриазол (22,91 г, 149,6 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (WSC) (28,68 г, 149,6 ммоль), N,O-диметилгидроксиламин гидрохлорид (13,93 г, 136 ммоль) и триэтиламин (41,7 мл, 299,2 ммоль) добавляли к раствору (1,0 л) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионовой кислоты (43,71 г, 136 ммоль) в дихлорэтане с последующим перемешиванием при комнатной температуре в течение 4 часов. Для разделения реакционной смеси на слои добавляли воду и водный слой затем подвергали экстракции дихлорметаном. Органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/3). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смешанного растворителя этилацетат/н-гексан, получая в результате 42,4 г (выход: 68%) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-N-метокси-N-метилпропионамида в виде бесцветных кристаллов призматической формы. Температура плавления: 72,0-73,0°C.
Пример 1. Получение (E)-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)пропенона
2-метоксиацетофенон (0,16 мл, 1,2 ммоль) добавляли к раствору (5 мл) 2-(3,4-диэтоксифенил)тиазол-4-карбоксальдегид (310,5 мг, 1,12 ммоль) в этаноле при комнатной температуре. Затем по каплям добавляли 1M водный раствор гидроксида калия (2,24 мл, 2,24 ммоль) при той же температуре. После перемешивания при комнатной температуре в течение 1 часа к реакционной смеси добавляли воду с последующей экстракцией дихлорметаном. Экстракт сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Остаток перекристаллизовывали из смеси этилацетат/н-гексан, получая в результате 400 мг (выход: 94%) (E)-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-мотоксифенил)пропенона в виде порошка желтого цвета. Температура плавления: 130-131°C.
Пример 2. Получение (E)-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)пропенона
Гидрид натрия (353,3 мг, 8,83 ммоль) добавляли к раствору (80 мл) диэтил-[2-(2-метоксифенил)-2-оксоэтил]фосфоната (2,30 г, 8,03 ммоль) в THF при комнатной температуре. После перемешивания при той же температуре в течение 30 минут добавляли 2-(3,4-диэтоксифенил)тиазол-4-карбоксальдегид (2,15 г, 7,75 ммоль), и образующуюся смесь перемешивали при комнатной температуре в течение 22 часов. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: н-гексан/этилацетат=от 3/1 до 2/1). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смеси этилацетат/н-гексан, получая в результате 1,62 г (выход: 51%) (E)-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)пропенона в виде кристаллов призматической формы желтого цвета. Температура плавления: 130-131°C.
Пример 3. Получение (E)-3-[2-(3,4-диметоксифенил)тиазол-4-ил]-1-(3,4-диацетоксифенил)пропенона
2-(3,4-диметоксифенил)тиазол-4-карбоксальдегид (450 мг, 1,81 ммоль) и (3,4-диацетоксибензоилметилен)трифенилфосфоран (900 мг, 1,81 ммоль) суспендировали в THF (25 мл) и суспензию нагревали с обратным холодильником в течение 20 часов. После охлаждения растворитель отгоняли при пониженном давлении, и остаток очищали на силикагеле колоночной хроматографией (элюент: дихлорметан). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смеси этилацетат/н-гексан, получая в результате 380 мг (выход: 44,9%) (E)-3-[2-(3,4-диметоксифенил)тиазол-4-ил]-1-(3,4-диацетоксифенил)пропенона в виде порошка желтого цвета. Температура плавления: 163-164°C.
Примеры 4-34
В соответствии со способом получения из примера 1 следующие соединения примеров 4-34 были получены (таблица 1). В
таблице 1 также приведены температуры плавления этих соединений.
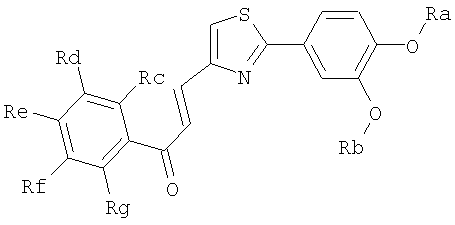
Примеры 35-36.
В соответствии со способом получения из примера 1 следующие соединения примеров 35 и 36 были получены (таблица 2). В таблице 2 также приведены физико-химические характеристики этих соединений.
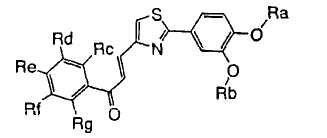
Примеры 37-42
В соответствии со способом получения из примера 1 следующие соединения примеров 37-42 были получены (таблица 3). В таблице 3 также приведены физико-химические характеристики этих соединений.
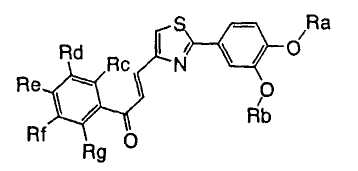
мер
(разложение)
Примеры 43-57
В соответствии со способом получения из примера 1 следующие соединения примеров 43-57 были получены (таблица 4). В таблице 4 также приведены физико-химические характеристики этих соединений.
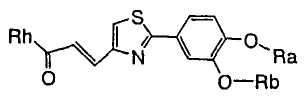
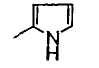
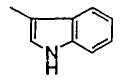
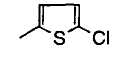
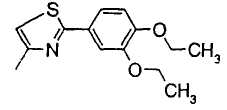
(разложение)
Пример 58. Получение метил-2-[2-(3,4-диэтоксифенил)тиазол-4-илметил]-3-(3-этоксипиридин-2-ил)-3-оксопропионата
Гидрид натрия (239 мг, 6,0 ммоль) и каплю метанола добавляли к раствору (10 мл) метил-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионата (1,0 г, 3,0 ммоль) и метил-3-этоксипиридин-2-карбоксилата (702 мг, 3,9 ммоль) в диметоксиэтане с последующим нагреванием с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и образующуюся смесь подвергали экстракции этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=2/3). Растворитель отгоняли при пониженном давлении, получая в результате 740 мг (выход: 51%) метил-2-[2-(3,4-диэтоксифенил)тиазол-4-илметил]-3-(3-этоксипиридин-2-ил)-3-оксопропионата в виде желтого масла.
1H-ЯМР δ ч/млн (CDCl3); 8,22 (1H, дд, J=1,3 Гц, 4,3 Гц), 7,44 (1H, д, J=2,1 Гц), 7,4-7,2 (3H, м), 6,92 (1H, с), 6,85 (1H, д, J=8,4 Гц), 5,29 (1H, т, J=7,4 Гц), 4,2-4,0 (6H, м), 3,65 (3H, с), 3,6-3,4 (2H, м), 1,5-1,4 (9H, м).
Пример 59. Получение этил-2-[2-(3,4-диэтоксифенил)тиазол-4-илметил]-3-оксо-3-фенилпропионата
3,4-диэтокситиобензамид (0,63 г, 2,8 ммоль) добавляли к раствору (20 мл) этил-2-бензоил-5-бром-4-оксопентаноата (0,90 г, 2,8 ммоль) в этаноле с последующим нагреванием с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры растворитель отгоняли при пониженном давлении и остаток подвергали экстракции этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, получая в результате 1,43 г (выход: 65%) этил-2-[2-(3,4-диэтоксифенил)тиазол-4-илметил]-3-оксо-3-фенилпропионата в виде масла желтого цвета.
ЯМР δ ч/млн (CDCl3); 8,06-8,05 (2H, м), 7,58-7,55(1H, м), 7,47-7,44 (2H, м), 7,40 (1H, д, J=2,0 Гц), 7,36 (1H, дд, J=2,0 Гц, 8,4 Гц), 6,90 (1H, с), 6,86 (1H, д, J=8,4 Гц), 5,06-5,03 (1H, м), 4,17-4,07 (6H, м), 3,50-3,49 (2H, м), 1,47(6H, т, J=7,0 Гц), 1,15 (3H, т, J=7,2 Гц).
Примеры 60-66
В соответствии со способом получения из примера 58 следующие соединения примеров 60-66 были получены (таблица 5). В таблице 5 также приведены физико-химические характеристики этих соединений.
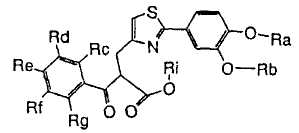
мер
Примеры 67-71
В соответствии со способом получения из примера 58 следующие соединения примеров 67-71 были получены (таблица 6). В таблице 6 также приведены физико-химические характеристики этих соединений.
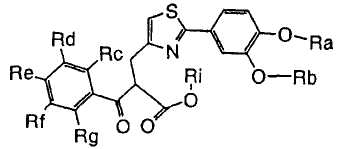
Примеры 72-75
В соответствии со способом получения из примера 58 следующие соединения примеров 72-75 были получены (таблица 7). В таблице 7 также приведены физико-химические характеристики этих соединений.
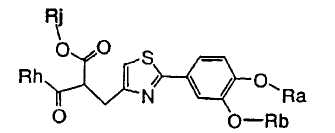
Примеры 76-82
В соответствии со способом получения из примера 58 следующие соединения примеров 76-82 были получены (таблица 8). В таблице 8 также приведены физико-химические характеристики этих соединений.


Примеры 83-86
В соответствии со способом получения из примера 58 следующие соединения примеров 83-86 были получены (таблица 9). В таблице 9 также приведены физико-химические характеристики этих соединений.
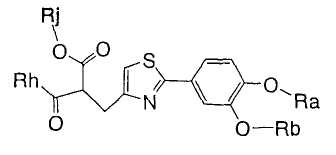
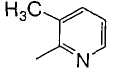
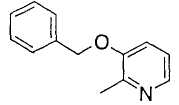
Пример 87. Получение 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-этоксипиридин-2-ил)-1-пропанона
Метил-2-[2-(3,4-диэтоксифенил)тиазол-4-илметил]-3-(3-этоксипиридин-2-ил)-3-оксопропионат (730 мг, 1,5 ммоль) добавляли к смеси уксусной кислоты (4,5 мл) и хлористоводородной кислоты (1,5 мл) с последующим нагреванием с перемешиванием при температуре от 100 до 110°C в течение 6 часов. После охлаждения до комнатной температуры реакционную смесь добавляли к водному раствору карбоната натрия (5,3 г, 0,05 моль) и образующуюся смесь подвергали экстракции этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=3/4). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из этанола, получая в результате 475 г (выход: 74%) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-этоксипиридин-2-ил)-1-пропенона в виде бесцветных игольчатых кристаллов. Температура плавления: 66,7-68,2°C.
Пример 88. Получение 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропанона
Триэтиламин (0,19 мл, 1,36 ммоль) и комплекс пиридина с триоксидом серы (0,11 г, 0,68 ммоль) добавляли к раствору (5 мл) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропан-1-ола (0,14 г, 0,34 ммоль) в DMSO, и образующуюся смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и проводили три раза экстракцию диэтиловым эфиром. Органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле тонкослойной колоночной хроматографией (элюент: дихлорметан /метанол=10/1). Растворитель отгоняли при пониженном давлении, получая 120 мг (выход: 86%) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропанона в виде бесцветного масла. Масло перекристаллизовывали из безводного этанола, получая в результате 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропанон в виде игольчатых кристаллов желтого цвета. Температура плавления: 7,2-79,7°C.
Пример 89. Получение 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)-1-пропанона
(E)-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)пропенон (1,62 г, 4,0 ммоль) растворяли в смешанном растворителе из этилацетата (40 мл), метанола (10 мл) и DMF (10 мл) и добавляли 400 мг 10% палладий/углерод для проведения каталитического восстановления в атмосфере водорода при комнатной температуре и атмосферном давлении в течение 4 часов. Реакционную смесь фильтровали, растворитель отгоняли под пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=3/2-1/1). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из диэтилового эфира, получая в результате 750 мг (выход: 46%) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)-1-пропанона в виде бесцветных кристаллов призматической формы. Температура плавления: 68,9-69,3°C.
Пример 90. Получение 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-тиазол-2-ил-1-пропанона
Раствор (2 мл) тиазола (129 мг, 1,5 ммоль) в THF охлаждали до -70°C и добавляли н-бутиллитий (2,44M раствор в гексане) (0,62 мл, 1,5 ммоль) и образующуюся смесь перемешивали при -70єC в течение 30 минут. К реакционной смеси добавляли раствор (4 мл) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-N-метокси-N-метилпропионамида (500 мг, 1,4 ммоль) в THF с последующим перемешиванием при -70°C в течение 3 часов. После нагревания до комнатной температуры к реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/5). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из этанола, получая в результате 350 мг (выход: 66%) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-тиазол-2-ил-1-пропанона в виде бесцветных игольчатых кристаллов. Температура плавления: 93,1-94,4°C.
Примеры 91-108
В соответствии со способом получения из примера 87 следующие соединения примеров 91-108 были получены (таблица 10). В таблице 10 также приведены физико-химические характеристики этих соединений.
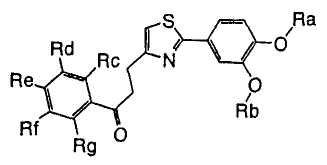
Примеры 109-114.
В соответствии со способом получения из примера 87 следующие соединения примеров 109-114 были получены (таблица 11). В таблице 11 также приведены физико-химические характеристики этих соединений.
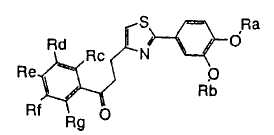
Примеры 115-147.
В соответствии со способом получения из примера 87 следующие соединения примеров 115-147 были получены (таблица 12). В таблице 12 также приведены физико-химические характеристики этих соединений.

Примеры 148-152.
В соответствии со способом получения из примера 87 следующие соединения примеров 149-152 были получены (таблица 13). В таблице 13 также приведены физико-химические характеристики этих соединений.

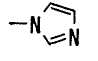
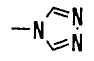
Примеры 153-157
В соответствии со способом получения из примера 87 следующие соединения примеров 153-157 были получены (таблица 14). В таблице 14 также приведены физико-химические характеристики этих соединений.
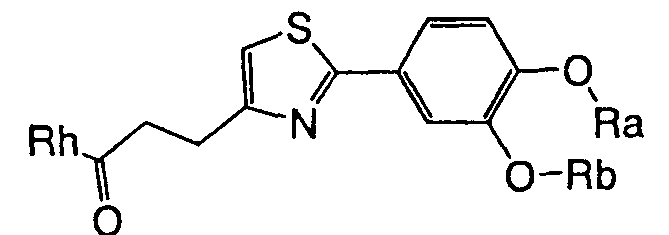
Примеры 158-167.
В соответствии со способом получения из примера 87 следующие соединения примеров 158-167 были получены (таблица 15). В таблице 15 также приведены физико-химические характеристики этих соединений.
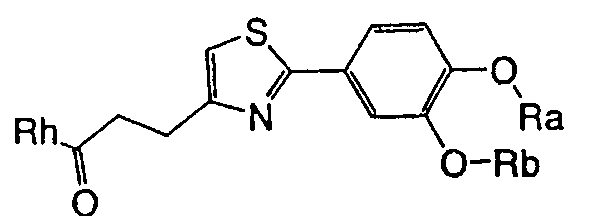
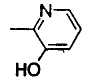
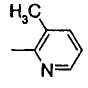
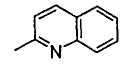
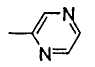
Пример 168.
В соответствии со способом получения из примера 87 следующие соединение примера 168 было получено (таблица 16). В таблице 16 также приведены физико-химические характеристики этого соединения.
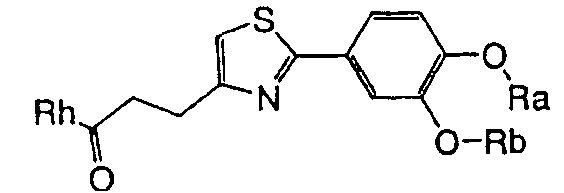

Примеры 169-178.
В соответствии со способом получения из примера 87 следующие соединения примеров 169-178 были получены (таблица 17). В таблице 17 также приведены физико-химические характеристики этих соединений.
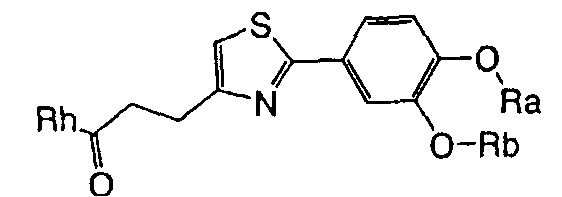
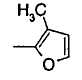
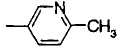
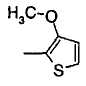
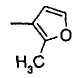
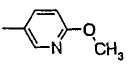
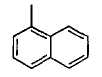
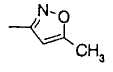
Примеры 179-185.
В соответствии со способом получения из примера 87 следующие соединения примеров 179-185 были получены (таблица 18). В таблице 18 также приведены физико-химические характеристики этих соединений.

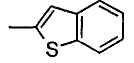
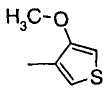
Пример 186. Получение 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)-1-пропанола
Боргидрид натрия (20 мг, 0,53 ммоль) добавляли к смешанному раствору 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)-1-пропанона (458 мг, 1,11 ммоль) в THF (10 мл) и метаноле (10 мл) при комнатной температуре и образующуюся смесь перемешивали при этой же температуре в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=2/1). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смешанного растворителя диэтиловый эфир/н-гексан, получая в результате 336 мг (выход: 73%) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)-1-пропанола в виде порошка белого цвета. Температура плавления: 78,2-79°C.
Пример 187. Получение 3-[2-(3, 4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропанол дигидрохлорида.
В соответствие со способом получения из примера 186 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропанол дигидрохлорид был получен. Температура плавления: 161,0-161,5°C.
Пример 188. Получение 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропанола
Раствор 2-бром-3-метоксипиридина (1,65 г, 8,78 ммоль) в THF охлаждали до -78°C и добавляли по каплям 5,23 мл (8,16 ммоль) 1,57 н раствора н-бутиллития в н-гексане. Образующуюся смесь перемешивали при той же самой температуре в течение 45 минут и добавляли по каплям раствор (15 мл) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропиональдегида (1,34 г, 4,39 ммоль) в THF. После перемешивания при той же самой температуре в течение 30 минут температуру смеси поднимали до -30°C в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/1). Растворитель отгоняли при пониженном давлении и остаток очищали препаративной тонкослойной колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан=1/2)). Растворитель отгоняли при пониженном давлении, получая в результате 470 мг (выход: 26%) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропанола в виде масла желтого цвета.
Примеры 189-208.
В соответствии со способом получения из примера 186 следующие соединения примеров 189-208 были получены (таблица 19). В таблице 19 также приведены физико-химические характеристики этих соединений.
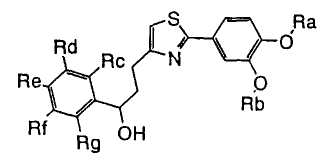
Примеры 209-225.
В соответствии со способом получения из примера 186 следующие соединения примеров 209-225 были получены (таблица 20). В таблице 20 также приведены физико-химические характеристики этих соединений.
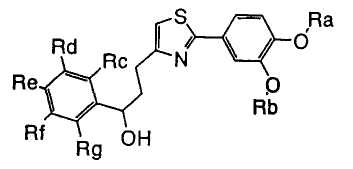
Примеры 226-237.
В соответствии со способом получения из примера 186 следующие соединения примеров 226-237 были получены (таблица 21). В таблице 21 также приведены физико-химические характеристики этих соединений.
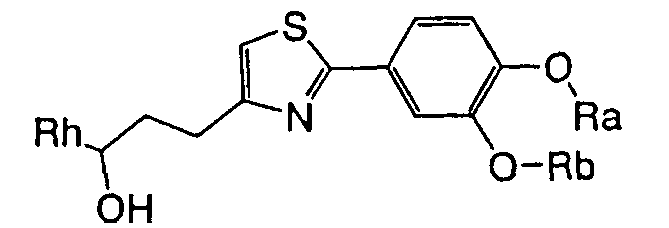
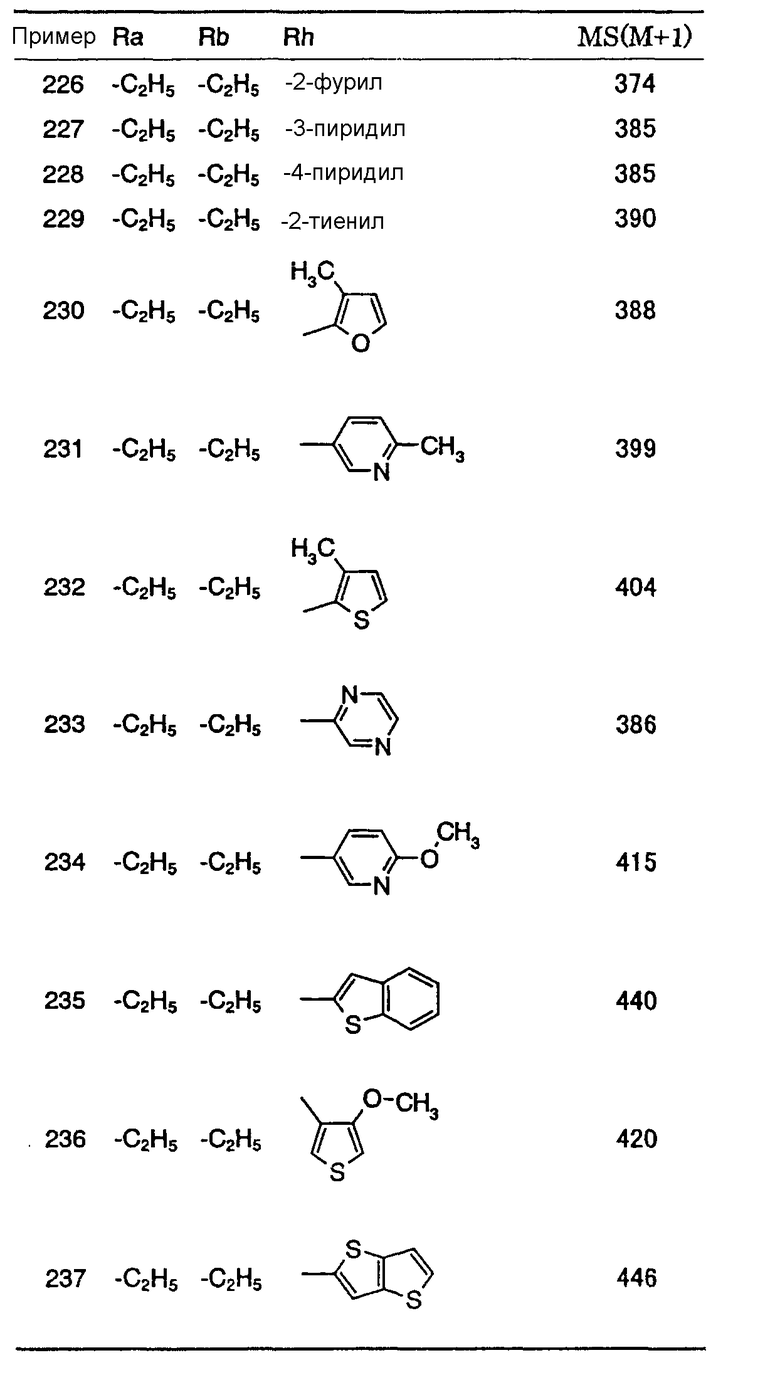
Пример 238.
Получение 2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропил}-3-метоксипиридин дигидрохлорида
Гидрат гидразина (0,18 мл, 3,6 ммоль) и гидроксид калия (136 мг, 2,4 ммоль) добавляли к раствору (5 мл) 3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-метоксипиридин-2-ил)-1-пропанона (500 мг, 1,2 ммоль) в диэтиленгликоле и образующуюся смесь нагревали до 150°C и перемешивали в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=3/4). Растворитель отгоняли при пониженном давлении и остаток растворяли в 4 мл этанола. Добавляли 1 н. раствор соляной кислоты в этаноле (1,6 мл), растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смешанного растворителя этанол/этилацетат, получая в результате 320 мг (выход: 73%) 2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропил}-3-метоксипиридин дигидрохлорида в виде порошка белого цвета. Температура плавления: 169,4-171,2°C.
Пример 239. Получение 2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионил}бензонитрила
Цианид цинка(II) (с чистотой 60%) (140 мг, 0,7 ммоль) и тетракис(трифенилфосфин)палладий (19 мг, 0,016 ммоль) добавляли к раствору (1 мл) 1-(2-бромфенил)-3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропан-1-она (150 мг, 0,33 ммоль) в DMF и смесь перемешивали при нагревании в атмосфере аргона при 100°C в течение 2 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду и этилацетат, образующуюся смесь фильтровали через целит и фильтрат разделяли на слои. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=3/4. Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из этанола, получая в результате 70 мг (выход: 53%) 2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионил}бензонитрила в виде бесцветных иглольчатых кристаллов. Температура плавления: 113,7-114,8°C.
Пример 240. Получение метил-2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионил}бензоата
Гидрокарбонат натрия (79 мг, 0,94 ммоль) и метилйодид (0,04 мл, 0,56 ммоль) добавляли к раствору (4 мл) 2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионил}бензойной кислоты (200 мг, 0,47 ммоль) в DMF с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и проводили экстракцию этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/3). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из этанола, получая в результате 190 мг (выход: 92%) метил-2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионил}бензоата в виде бесцветных иглольчатых кристаллов. Температура плавления: 91,7-92,9°C.
Пример 241. Получение 2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионил}-N,N-диметилбензамида
1-(3-диметиламинопропил)-3-этилкарбодиимид (WSC) (54 мг, 0,29 ммоль), 1-гидроксибензотриазол (HOBT) (43 мг, 0,29 ммоль) и 50% водный раствор диметиламина (0,025 мл, 0,29 ммоль) добавляли при комнатной температуре к раствору (2 мл) 2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионил}бензойной кислоты (100 мг, 0,24 ммоль) в DMF с последующим перемешиванием при такой же температуре в течение 2 часов. К реакционной смеси добавляли воду и проводили экстракцию этилацетатом. Органический слой промывали насыщенным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором в этом порядке и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, и остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/3)). Растворитель отгоняли при пониженном давлении, получая в результате 65 мг (выход: 61%) 2-{3-[2-(3,4-диэтоксифенил)тиазол-4-ил]пропионил}-N,N-диметилбензамида в виде бесцветного масла.
ЯМР δ ч/млн (CDCl3); 7,88 (1H, д, J=7,4 Гц), 7,6-7,3 (4H, м), 7,3-7,2 (1H, м), 6,9-6,8 (2H, м), 4,2-4,1 (4H, м), 3,45 (2H, т, J=7,3 Гц), 3,20 (2H, т, J=7,2 Гц), 3,14 (3H, с), 2,76 (3H, с), 1,5-1,4 (6H, м).
Пример 242. Получение 3-[2-(3,4-диметоксифенил)тиазол-4-ил]-1-(3,4-диацетоксифенил)пропанона
Уксусный ангидрид добавляли по каплям (2 мл, 20 ммоль) при комнатной температуре к раствору (4 мл) 3-[2-(3,4-диметоксифенил)тиазол-4-ил]-1-(3,4-дигидроксифенил)пропанона (320 мг, 0,78 ммоль) в пиридине при комнатной температуре с последующим перемешиванием при той же самой температуре в течение 1 часа. К реакционной смеси добавляли метанол (10 мл), перемешивали при комнатной температуре в течение 1 часа и растворитель отгоняли при пониженном давлении. Затем добавляли воду и проводили экстракцию этилацетатом. Остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смешанного растворителя этилацетат/н-гексан, получая в результате 195 мг (выход: 54%) 3-[2-(3,4-диметоксифенил)тиазол-4-ил]-1-(3,4-дигидроксифенил) пропанона в виде бесцветных иглольчатых кристаллов. Температура плавления: 128-128,5°C.
Пример 243. Получение 3-[2-(3,4-диметоксифенил)тиазол-4-ил]-1-(3,4-диэтоксифенил)пропанона
Этилйодид (0,48 мл, 6,0 ммоль) и карбонат калия (0,62 г, 4,5 ммоль) добавляли при комнатной температуре к раствору (7 мл) 3-[2-(3,4-диметоксифенил)тиазол-4-ил]-1-(3,4-дигидроксифенил) пропанона (0,58 г, 1,5 ммоль) в DMF с последующим перемешиванием при 60°C в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли этилацетат, образующуюся смесь фильтровали и растворитель отгоняли при пониженном давлении. Остаток очищали на силикагеле колоночной хроматографией (элюент: этилацетат/н-гексан=1/2). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смешанного растворителя этилацетат/н-гексан, получая в результате 290 мг (выход: 44%) 3-[2-(3,4-диметоксифенил)тиазол-4-ил]-1-(3,4-диэтоксифенил) пропанона в виде порошка белого цвета. Температура плавления: 141,3-142,4°C.
Примеры 244-247.
В соответствии со способом получения из примера 186 следующие соединения примеров 244-247 были получены (таблица 22).
Пример 248.
В соответствии со способом получения из примера 58 следующее соединение было получено.
Метил-2-[2-(3,4-диэтоксифенил)тиазол-4-илметил]-2-(3-этоксипиридин-2-ил)-3-оксобутират.
ЯМР δ ч/млн (CDCl3); 8,22 (1H, дд, J=1,4 Гц, 4,3 Гц), 7,5-7,3 (4H, m), 6,9-6,8 (2H, m),4,8-4,6 (1H, м), 4,2-4,0 (4H, м), 3,90 (3H, с), 3,65 (3H, с), 3,0-2,8 (2H, м), 2,6-2,3 (2H, м), 1,5-1,4 (6H, м).
Пример 249.
В соответствии со способом получения из примера 87 следующее соединение было получено.
3-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(3-этоксипиридин-2-ил)-1-бутанон.
ЯМР δ ч/млн (CDCl3); 8,30-8,20 (1H, м), 7,51 (1H, д, J=1,8 Гц), 7,5-7,3 (3H, м), 6,9-6,8 (2H, м), 4,3-4,1 (4H, м), 3,89 (3H, с), 3,20 (2H, т, J=7,3 Гц), 2,91 (2H, т, J=7,5 Гц), 2,2-2,1 (2H, м), 1,5-1,4 (6H, м).
Пример 250.
В соответствии со способом получения из примера 90 следующее соединение было получено.
2-[2-(3,4-диэтоксифенил)тиазол-4-ил]-1-(2-метоксифенил)-этанон.
ЯМР δ ч/млн (CDCl3); 7,79 (1H, дд, 1,8, 7,7 Гц), 7,49 (1H, д, J=2,1 Гц), 7,49-7,46 (1H, м), 7,42 (1H, дд, J=2,1, 8,4 Гц), 7,06 (1H, с), 7,03-7,00 (1H, м), 6,98 (1H, д, J=8,4 Гц), 6,88 (1H, д, J=8,4 Гц), 4,55 (2H, с), 4,18 (2H, кв., J=7,0 Гц), 4,14(2H, кв., J=7,0 Гц), 3,92 (3H, с), 1,48 (3H, т, J=7,0 Гц), 1,47(3H, т, J=7,0 Гц).
Тестовый пример 1. Испытание на ингибиторную активность по фосфодиэстеразе (PDE)4.
С использованием соединений примеров 1, 78, 87, 88, 99, 100, 106, 107, 158, 162, 165, 167, 174, 175, 187, 227, 238 и 239 в качестве испытуемых соединений следующее испытание было проведено для оценки их ингибиторной активности по фосфодиэстеразе (PDE)4.
(1) Приготовление массы плазмид
Плазмиды, содержащие гены, кодированные для человеческой PDE4D (HPDE4D) (хранящиеся в Otsuka America Pharmaceutical, Inc., Maryland Research Laboratories), трансформировали в кишечную палочку и массу культивировали. Плазмиды затем очищали с помощью набора EndoFreeTM Plasmid Mxi Kit (Qiagen).
(2) Экспрессия массы и очистка PDE4D
Линии COS-7 клеток, полученные из почки африканских зеленых мартышек (RCB 0539), пересеивали в среде DMEM, содержащей 100 единиц/мл пенициллина, 100 мкм/мл стрептомицина и 10% FBS. Плазмиды, приготовленные в (1), трансфецировали в клетки, используя LipofeсtAMINETM 2000 Reagent (далее обозначаемый как "LF2000", продукт фирмы Invitroge) в соответствии с прилагаемым протоколом. Для сравнения, pcDNA3.1 трансфецировали в качестве контрольного вектора. COS-7 клетки засевали в чашках Петри диаметром 10 см накануне трансфекции, с тем чтобы клетки достигали 90% конфлуентности в день проведения трансфекции. Двенадцать микрограмм плазмид, разбавленных 0,9 мл OPTI-MEM I (Invitrogen), (раствор плазмиды; раствор A), и 30 мкл LF2000, разбавленных 0,9 мл OPTI-MEM I, (LF2000 раствор; раствор B), получали на чашку Петри и выдерживали при комнатной температуре в течение 5 минут. Растворы A и B затем смешивали вместе и выдерживали при комнатной температуре в течение 20 минут. Смесь добавляли к культивированным клеткам и инкубировали в течение ночи при 37°C в атмосфере 5% CO2. Культуральную среду меняли на следующий день, инкубирование продолжали в течение ночи и собирали клетки с помощью следующей методики. Сначала клетки промывали один раз PBS (Sigma) и добавляли на чашку Петри 2 мл раствора Trypsin-EDTA (Sigma), распределяли по чашке и удаляли. Затем выдерживали клетки при 37°C в течение от 2 до 3 минут, выделяли их из чашки Петри и суспендировали в среде. Суспензию помещали в центрифужную пробирку, и центрифугировали при 200g и 4°C в течение 5 минут. Надосадочную жидкость затем удаляли. Клетки далее промывали PBS и хранили при -80°C. К сохраненным клеткам добавляли KHEM буфер (50 мМ Hepes, 50 мМ KCl, 10 мМ EGTA, 1,92 мМ MgCl2, pH 7,2), содержащий 1 мМ DTT, 40 мкг/мл PMST, 156 мкг/мл бензамидина, 1 мкг/мл апротинина, 1 мкг/мл леупептина, 1 мкг/мл пепстатина A, и 1 мкг/мл антипаина, и образующуюся смесь помещали в стеклянный гомогенизатор и гомогенизировали на льду. Клеточную суспензию центрифугировали при 100g и 4°C в течение 5 минут, и надосадочную жидкость затем центрифугировали при 100000g в течение 1 часа. Затем надосадочную жидкость переносили в новые пробирки в качестве раствора фермента PDE4D и хранили в морозильнике для сверхнизких температур. Затем измеряли концентрацию белка в растворе фермента PDE4D.
(3) Определение коэффициента разбавления раствора фермента PDE4D
Раствор фермента PDE4D, приготовленный в (2), разбавляли в 10, 25, 50, 100, 200, 400 и 800 раз с помощью 20 мМ Tris-HCl (pH 7,4) и измеряли PDE4D активности разбавленных растворов фермента методом, описанным в (4), для определения оптимального коэффициента разбавления и получения раствора фермента PDE4D, в котором распавшийся cAMP составлял от 10 до 30% от общего cAMP.
(4) Измерение ингибиторной активности по PDE4D.
Необходимое количество каждого из испытуемых соединений взвешивали и растворяли в 100% DMSO c получением концентрации 10 мМ. Полученные растворы хранили в морозильнике в качестве исходных растворов испытуемых соединений. Перед измерением ингибиторной активности исходные растворы размораживали, разбавляли в два раза с помощью 100% DMSO до концентрации 5 мМ и затем разбавляли с помощью 100% DMSO с получением растворов испытуемых веществ с концентрациями, уменьшающимися последовательно в 10 раз. Каждый раствор испытуемого вещества добавляли в 1,2 мл пробирку, содержащую 23 мкл 20 мМ Tris-HCl (pH 7,4). Добавляли при охлаждении на льду двадцать пять микролитров раствора фермента PDE4D при оптимальном коэффициенте разбавления, определенном в (3), и добавляли 50 мкл раствора субстрата, который содержал 2 мкМ [3H]cAMP, получаемого разбавлением с помощью 20 мМ Tris-HCl (pH 7,4), содержащим 10 мМ MgCl2. Конечная концентрация DMSO в реакционной смеси составляла 2%. После перемешивания смесь инкубировали при 30°C в течение 10 минут. После завершения инкубации пробирки помещали в кипящую водяную баню в течение 3 минут для прекращения реакции. Пробирки охлаждали на льду и добавляли 25 мкл 0,2 мкг/мл раствора змеиного яда. После перемешивания проводили инкубацию при 30°C в течение 10 минут. После завершения инкубации, добавляли 0,4 мл раствора смолы Dowex 1x8, приготавливаемого с использованием смеси EtOH:H2O (1:1). После перемешивания смесь выдерживали при комнатной температуре в течение, по меньшей мере, 1 часа. Пятьдесят микролитров каждой надосадочной жидкости в пробирках помещали в лунку планшета Topcount и планшет сушили в течение 3 ночей. Радиоактивность [3H] (cpm) измеряли с использованием Topcount. Определяя радиоактивность [3H] как X cpm, радиоактивность [3H]cAMP, добавляемую в реакционную систему, как T cpm, и концентрацию белка в реакционной смеси как Y мг/мл, активность PDE4D в реакционной смеси находили из следующего уравнения:
Чтобы найти ингибиторную активность PDE4D испытуемых веществ, cpm в отсутствие испытуемых веществ, из которого вычитали cpm в отсутствие фермента, принимали за 100% и степени ингибирования испытуемых веществ выражали как проценты от контрольного значения. Затем вычисляли значение IC50 (концентрация, при которой происходит ингибирование активности PDE4 на 50%) каждого испытуемого вещества.
Результаты приведены в таблице 23. Эти результаты показывают, что соединения, представленные формулой (1), обладают отличной ингибиторной активностью по PDE4.
Тестовый пример 2. Измерение ингибиторной активности продукции TNF-α
Для оценки ингибиторной активности продукции TNF-α проводили следующие испытания.
(1) Выделение мононуклеарных клеток периферической крови человека.
Образец периферической крови получали от здорового взрослого донора, который дал на это официальное согласие. Тридцать миллилитров предварительно гепаринизированного образца крови помещали в пробирку Leucosep (Greiner), содержащую 16 мл раствора для выделения лимфоцитов (Nakarai Chemical, Ltd.) под фильтрующей перегородкой, и центрифугировали при 1000g в течение 15 минут.
Собирали промежуточный слой, соответствующий фракции мононуклеарных клеток, в 50 мл центрифужную пробирку и промывали дважды средой RPMI 1640. После окрашивания трипановым синим определяли количество жизнеспособных микроорганизмов и доводили до коцентрации 2×106 клеток/мл с помощью среды RPMI 1640.
(2) Индуцирование продукции TNF-α
LPS кишечной палочки E.coli (Serotype 055:B5), который был растворен в среде RPMI 1640 до концентрации 5 мг/мл, стерилизованный фильтрацией и сохраняемый в морозильнике, размораживали и разбавляли средой RPMI 1640 до 10 мкг/мл. Испытуемые соединения растворяли в DMSO для получения растворов с концентрацией в 50 раз больше концентрации конечного использования. Один микролитр каждого из растворов со ступенчатой концентрацией испытуемого вещества, 149 мкл среды RPMI 1640, 50 мкл раствора LPS (конечная концентрация: 1 мкг/мл), 50 мкл фетальной бычьей сыворотки и 50 мл суспензии мононуклеарных клеток периферической крови помещали в каждую лунку 48-луночного планшета и инкубировали при 37°C в течение 24 часов.
(3) Измерение концентрации TNF-α
После завершения инкубации из каждой лунки собирали культуральную надосадочную жидкость и измеряли концентрацию TNF-α в надосадочной жидкости методом ELISA (Human TNF-α Eli-pair, Diaclone). Концентрацию TNF-α, вызываемую LPS стимуляцией в отсутствие испытуемых соединений, принимали за 100% и степени ингибирования испытуемыми соединениями выражали как проценты от контрольного значения и вычисляли величину IC50 (концентрация, при которой происходит ингибирование продукции TNF-α на 50%) для каждого испытуемого соединения.
Результаты приведены в таблице 24. Эти результаты показали, что соединения, представленные формулой (1), обладают ингибиторной активностью по продукции TNF-α.
Тестовый пример 3. Измерение ингибиторной активности продукции IL-4
Для оценки ингибиторной активности продукции IL-4 проводили следующие испытания.
(1) Выделение клеток селезенки мыши
В брюшной полости самцов мышей линии BALB/c в возрасте от шести до десяти недель делали разрез с использованием анестезии эфиром и удаляли селезенки. Селезенки делили на кусочки, продавливая через сетку с использованием стеклянного пестика, и клетки селезенки суспендировали в среде RPMI 1640. Суспензию фильтровали через Cell Strainer и центрифугировали при 100g в течение 10 минут. Дебрис суспендировали в растворе эритроцитов (0,75% хлористый аммоний, 17 мМ буфер трис-хлористоводородная кислота) и центрифугировали. Затем для ресуспендирования клеток к дебрису добавляли среду RPMI 1640. После центрифугирования клетки дважды промывали и количество жизнеспособных микроорганизмов определяли путем окрашивания трипановым синим и доводили до концентрации 2×106 клеток/мл с помощью среды RPMI 1640.
(2) Индуцирование продукции IL-4
ConA, растворенную в растворе клеточной культуры (среда RPMI 1640, содержащая 10% фетальной бычьей сыворотки) до концентрации 5 мг/мл, стерилизованную фильтрацией и сохраняемую в морозильнике, размораживали и разбавляли раствором клеточной культуры до 50 мкг/мл. Испытуемые соединения растворяли в DMSO для получения растворов с концентрацией в 10 раз больше концентрации конечного использования. Пятьдесят микролитров каждого из растворов со ступенчатой концентрацией испытуемого вещества, 150 мкл раствора клеточной культуры, 50 мкл раствора ConA (конечная концентрация: 5 мкг/мл) и 20 мкл суспензии клеток селезенки мыши помещали в каждую лунку 48-луночного планшета и инкубировали при 37°C в течение 48 часов.
(3) Измерение концентрации IL-4
После завершения инкубации из каждой лунки собирали культуральную надосадочную жидкость и измеряли концентрацию IL-4 в надосадочной жидкости методом ELISA (mouse IL-4 EIA kit, BD Pharmingen). Концентрацию IL-4, вызываемую ConA стимуляцией в отсутствие испытуемых соединений, принимали за 100% и степени ингибирования испытуемыми соединениями выражали как проценты от контрольного значения и вычисляли величину IC50 для каждого испытуемого соединения как концентрацию испытуемого соединения, при которой происходит ингибирование продукции IL-4 на 50%.
Пример лекарственной формы 1. Мазь
Один грамм соединения настоящего изобретения диспергировали в 10 г жидкого парафина с получением дисперсии. Основу готовили путем нагревания и смешивания 3 г парафина, 5 г белого пчелиного воска и 81 г медицинского вазелина и охлаждали, и затем, когда основа охлаждалась до 60°С, добавляли вышеназванную дисперсию. После смешивания, смесь охлаждали с получением мази.
Пример лекарственной формы 2. Крем
Один грамм соединения настоящего изобретения диспергировали в водном растворе, содержащем 10 г очищенной воды и 1 г полиоксиэтиленового гидрированного касторового масла 60, с получением дисперсии. Готовили при нагревании эмульсионную основу, включающую 25 г медицинского вазелина, 20 г стеарилового спирта, 12 г пропиленгликоля, 3 г полиоксиэтиленового гидрированного касторового масла 60, 1 г глицерилмоностеарата, 0,1 г метилпараоксибензоата, 0,1 г пропилпараоксибензоата и 26,8 г очищенной воды. Полученную эмульсионную основу охлаждали, и затем, когда основа охлаждалась до 60°С, добавляли вышеназванную дисперсию. После смешивания смесь охлаждали с получением крема.
[Промышленное применение]
Соединение настоящего изобретения проявляет специфическую ингибиторную активность по РDЕ4 и поэтому может применяться в качестве активного ингредиента ингибитора РDЕ4.
Кроме того, соединение настоящего изобретения в силу его специфической ингибиторной активности по РDЕ4 может применяться в качестве профилактического или терапевтического средства при атопическом дерматите и многих других заболеваниях.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-6-НИТРОИМИДАЗО [2,1-b] ОКСАЗОЛА ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2004 |
|
RU2365593C2 |
| СОЕДИНЕНИЕ ОКСАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2006 |
|
RU2418793C2 |
| НОВЫЕ РАСТВОРИМЫЕ В ВОДЕ ПРОЛЕКАРСТВА | 2005 |
|
RU2413731C2 |
| N,N-ЗАМЕЩЕННЫЕ 3-АМИНОПИРРОЛИДИНОВЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПОВТОРНОГО ПОГЛОЩЕНИЯ МОНОАМИНОВ | 2006 |
|
RU2574406C2 |
| КАРБОСТИРИЛЬНОЕ СОЕДИНЕНИЕ | 2005 |
|
RU2430920C2 |
| ПРОИЗВОДНОЕ 1-ЗАМЕЩЕННОГО 4-НИТРОИМИДАЗОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2324682C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА | 1994 |
|
RU2124511C1 |
| АГЕНТ ДЛЯ ИНГИБИРОВАНИЯ СИГНАЛЬНОЙ ФУНКЦИИ ЦИТОКИНИНА | 2007 |
|
RU2477046C2 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
| ПИРИДИЛДИМЕТИЛСУЛЬФОНОВОЕ ПРОИЗВОДНОЕ | 2006 |
|
RU2404968C2 |
Настоящее изобретение относится к соединениям формулы (1), его оптическим изомерам и фармацевтически приемлемым солям. В формуле (1)

R1 является ди-С1-6 алкоксифенильной группой; А является одной из следующих групп (i)-(vi): (i) -СО-В-, где В является C1-6 алкиленовой группой; (ii) -CO-Ba-, где Ва является С2-6 алкениленовой группой; (iii) -CH(OH)-B-; (iv) -COCH((C)OOR3)-Bb-, где R3 является С1-6 алкильной группой и Вb является C1-6 алкиленовой группой. Значения остальных радикалов указаны в формуле изобретения. Изобретение также относится к фармацевтической композиции, обладающей свойствами ингибитора фосфодиэстеразы PDE4, включающей соединение изобретения; к ингибитору фосфодиэстеразы 4, включающему в качестве активного ингредиента соединение изобретения; к профилактическому или терапевтическому средству для атопического дерматита, включающему в качестве активного ингредиента соединение изобретения. 4 н. и 4 з.п. ф-лы, 24 табл.
1. Соединение, представленное формулой (1), его оптический изомер, или его фармацевтически приемлемая соль
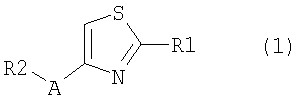
где R1 является ди-С1-6 алкоксифенильной группой;
R2 является любой одной из следующих групп (a)-(t):
(a) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (а-1) гидроксильных групп, (а-2) атомов галогена, (а-3) незамещенных или галогензамещенных C1-6 алкильных групп, (а-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (а-5) C1-6 алкокси-С1-6 алкоксигрупп, (а-6) амино-С1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (а-7) метилендиоксигрупп, (а-8) карбоксильных групп, (а-9) феноксигрупп, (а-10) C1-6 алкоксикарбонильных групп, (а-11) C1-6 алканоилоксигрупп, (а-12) C1-6 алканоильных групп, (а-13) цианогрупп, (а-14) нитрогрупп, (а-15) C1-6 алкилкарбамоильных групп, (а-16) аминосульфонильных групп, (а-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (а-18) C1-6 алканоиламиногрупп, (а-19) C1-6 алкилтиогрупп, (а-20) фенильных групп, (а-21) пиразолильных групп, (а-22) имидазолильных групп, (а-23) триазолильных групп, (а-24) морфолиногрупп, (а-25) пирролидинильных групп, (а-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами, и (а-27) фенил-С1-6 алкоксигрупп;
(b) нафтильной группой;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (с-1) гидроксильных групп, (с-2) C1-6 алкильных групп, (с-3) C1-6 алкоксигрупп, (с-4) фенил-С1-6 алкоксигрупп, и (с-5) C1-6 алкоксикарбонильных групп;
(d) фурильной группой, в которой фурановое кольцо может быть замещено C1-6 алкильной группой или группами;
(e) тиенильной группой, в которой тиофеновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (е-1) атомов галогена, (е-2) C1-6 алкильных групп, и (е-3) С1-6 алкоксигрупп;
(f) изоксазолильной группой, в которой изоксазолильное кольцо может быть замещено С1-6 алкильной группой или группами;
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп, и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами;
(h) пирролильной группой, в которой пиррольное кольцо может быть замещено C1-6 алкильной группой или группами;
(i) имидазолильной группой, в которой имидазольное кольцо может быть замещено C1-6 алкильной группой или группами;
(j) тетразолильной группой;
(k) пиразинильной группой;
(l) тиенотиенильной группой;
(m) бензотиенильной группой;
(n) индолильной группой, в которой индольное кольцо может быть замещено C1-6 алкоксигруппой или группами;
(о) бензимидазолильной группой, в которой бензимидазольное кольцо может быть замещено C1-6 алкильной группой или группами;
(р) индазолильной группой;
(q) хинолильной группой;
(r) 1,2,3,4-тетрагидрохинолильной группой, в которой 1,2,3,4-тетрагидрохинолиновое кольцо может быть замещено оксогруппой или группами;
(s) хиноксалинильной группой; и
(t) 1,3-бензодиоксолильной группой; и
А является одной из следующих групп (i)-(vi):
(i) -СО-В-, где В является C1-6 алкиленовой группой;
(ii) -СО-Ва-, где Ва является C2-6 алкениленовой группой;
(iii) -CH(OH)-B-, где В определено выше;
(iv) -COCH((C)OOR3)-Bb-, где R3 является C1-6 алкильной группой и Вb является
C1-6 алкиленовой группой.
2. Соединение, оптический изомер, или фармацевтически приемлемая соль по п.1, где в формуле (1) R1 является 3,4-ди-С1-6 алкоксифенильной группой.
3. Соединение, оптический изомер или фармацевтически приемлемая соль по п.1, где в формуле (1) R2 является (а) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (а-1) гидроксильных групп, (а-2) атомов галогена, (а-3) незамещенных или галогензамещенных C1-6 алкильных групп, (а-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (а-5) C1-6 алкокси-С1-6 алкоксигрупп, (а-6) амино-С1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (а-7) метилендиоксигрупп, (а-8) карбоксильных групп, (а-9) феноксигрупп, (а-10) C1-6 алкоксикарбонильных групп, (а-11) C1-6 алканоилоксигрупп, (а-12) C1-6 алканоильных групп, (а-13) цианогрупп, (а-14) нитрогрупп, (а-15) C1-6 алкилкарбамоильных групп, (а-16) аминосульфонильных групп, (а-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (а-18) C1-6 алканоиламиногрупп, (а-19) C1-6 алкилтиогрупп, (а-20) фенильных групп, (а-21) пиразолильных групп, (а-22) имидазолильных групп, (а-23) триазолильных групп, (а-24) морфолиногрупп, (а-25) пирролидинильных групп, (а-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами, и (а-27) фенил-С1-6 алкоксигрупп;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (с-1) гидроксильных групп, (с-2) С1-6 алкильных групп, (с-3) C1-6 алкоксигрупп, (с-4) фенил-С1-6 алкоксигрупп, и (с-5) C1-6 алкоксикарбонильных групп;
(d) фурильной группой, в которой фурановое кольцо может быть замещено C1-6 алкильной группой или группами;
(e) тиенильной группой, в которой тиофеновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (е-1) атомов галогена, (е-2)
C1-6 алкильных групп, и (е-3) C1-6 алкоксигрупп;
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп, и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами;
(h) пирролильной группой, в которой пиррольное кольцо может быть замещено C1-6 алкильной группой или группами; или
(i) имидазолильной группой, в которой имидазольное кольцо может быть замещено C1-6 алкильной группой или группами.
4. Соединение, оптический изомер, или фармацевтически приемлемая соль по п.1, где в формуле (1) А является (i) -СО-В-, где В является метиленовой группой, этиленовой группой или триметиленовой группой; (ii) -СО-Ва-, где Ва является винилиденовой группой; (iii) -CH(OH)-B-, где В является метиленовой группой или этиленовой группой; (iv) -COCH(COOR3)-Bb-, где R3 является метильной группой, этильной группой или третбутильной группой и Bb является метиленовой группой или этиленовой группой.
5. Соединение, оптический изомер, или фармацевтически приемлемая соль по п.1, где в формуле (1) R1 является 3,4-ди-С1-6 алкоксифенильной группой;
R2 является (а) фенильной группой, в которой фенильное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (а-1) гидроксильных групп, (а-2) атомов галогена, (а-3) незамещенных или галогензамещенных C1-6 алкильных групп, (а-4) незамещенных или галогензамещенных C1-6 алкоксигрупп, (а-5) C1-6 алкокси-С1-6 алкоксигрупп, (а-6) амино-С1-6 алкоксигрупп, которые могут быть замещены C1-6 алкильной группой или группами, (а-7) метилендиоксигрупп, (а-8) карбоксильных групп, (а-9) феноксигрупп, (а-10) C1-6 алкоксикарбонильных групп, (а-11) C1-6 алканоилоксигрупп, (а-12) C1-6 алканоильных групп, (а-13) цианогрупп, (а-14) нитрогрупп, (а-15) C1-6 алкилкарбамоильных групп, (а-16) аминосульфонильных групп, (а-17) аминогрупп, которые могут быть замещены C1-6 алкильной группой или группами, (а-18) C1-6 алканоиламиногрупп, (а-19) C1-6 алкилтиогрупп, (а-20) фенильных групп, (а-21) пиразолильных групп, (а-22) имидазолильных групп, (а-23) триазолильных групп, (а-24) морфолиногрупп, (а-25) пирролидинильных групп, (а-26) пиперазинилкарбонильных групп, которые могут быть замещены C1-6 алкильной группой или группами, и (а-27) фенил-С1-6 алкоксигрупп;
(c) пиридильной группой, в которой пиридиновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (с-1) гидроксильных групп, (с-2) C1-6 алкильных групп, (с-3) C1-6 алкоксигрупп, (с-4) фенил-С1-6 алкоксигрупп, и (с-5) C1-6 алкоксикарбонильных групп;
(d) фурильной группой, в которой фурановое кольцо может быть замещено C1-6 алкильной группой или группами;
(e) тиенильной группой, в которой тиофеновое кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (е-1) атомов галогена, (е-2)
C1-6 алкильных групп, и (е-3) C1-6 алкоксигрупп;
(g) тиазолильной группой, в которой тиазольное кольцо может быть замещено одним или более членами, выбранными из группы, состоящей из (g-1) C1-6 алкильных групп, и (g-2) фенильных групп, которые могут быть замещены C1-6 алкоксигруппой или группами;
(h) пирролильной группой, в которой пиррольное кольцо может быть замещено C1-6 алкильной группой или группами;
(i) имидазолильной группой, в которой имидазольное кольцо может быть замещено C1-6 алкильной группой или группами; и
А является (i) -СО-В-, где В определено выше; (ii) -CO-Ba, где Ва определено выше; (iii) -СН(ОН)-В-, где В определено выше; (iv) -СОСН (COOR3)-Bb-, где R3 и Bb определены выше.
6. Фармацевтическая композиция, обладающая свойствами ингибитора фосфодиэстеразы PDE4, включающая соединение, оптический изомер, или фармацевтически приемлемую соль по п.1 и фармацевтически приемлемый носитель.
7. Ингибитор фосфодиэстеразы 4, включающий в качестве активного ингредиента соединение, оптический изомер или фармацевтически приемлемую соль по п.1.
8. Профилактическое или терапевтическое средство для атопического дерматита, включающее в качестве активного ингредиента соединение, оптический изомер или фармацевтически приемлемую соль по п.1.
| ПРОИЗВОДНЫЕ 2-ЗАМЕЩЕННОГО ФЕНИЛ-2-ОКСАЗАЛИНА ИЛИ 2-ЗАМЕЩЕННОГО ФЕНИЛ-2-ТИАЗОЛИНА И ИНСЕКТИЦИДНАЯ И/ИЛИ АКАРИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1990 |
|
RU2029766C1 |
| WO 9412461 A1, 09.06.1994 | |||
| WO 9808830 A1, 05.03.1998 | |||
| МТЕЙТШ-ИХНИ-г :кдЯ|БИБЛИОТЕКА | 0 |
|
SU310370A1 |
Авторы
Даты
2010-01-20—Публикация
2005-05-16—Подача