Область техники, к которой относится изобретение
Данное изобретение относится к получению производных глицерола и соответствующих промежуточных продуктов, более конкретно - к способу региоселективного получения производных глицерола, отвечающих нижеследующей Формуле 1, с высокими эффективностью и выходом.

Производные глицерола с Формулой 1 являются рацемическими или оптически активными соединениями, где R1 и R2 представлены остатками жирных кислот, включающих 16-22 атомов углерода и отличающихся друг от друга.
Уровень техники
Известно, что одно из соединений с Формулой 1, а именно 1-пальмитоил-2-линолеил-3-ацетилглицерол (PLA), который выделяют из хлороформных экстрактов оленьих рогов, обладает способностью стимулировать пролиферацию стволовых клеток гематопоэтического ряда и мегакариоцитов (патент Кореи 10-0283010). В качестве процессов получения соединений с Формулой 1 известны метод синтеза из глицерола и метод ацетолиза фосфатидилхолина (заявка на патент Кореи 10-2000-0045168). Однако метод синтеза соединений с формулой 1 из глицерола не является региоселективным и потому требует стадий разделения и очистки путем колоночной хроматографии после каждой стадии реакции. А именно, целевое соединение (PLA) может быть получено путем стадий выделения 1-пальмитоил-глицерола при помощи колоночной хроматографии из продукта взаимодействия глицерола и пальмитиновой кислоты и последующей этерификации выделенного 1-пальмитоил-глицерола. Этот метод имеет те недостатки, что выход очень низкий (3,21% из глицерола) и нужно использовать эквивалентное количество дорогого реагента - 4-диметиламинопиридина (DMAP) при низкой температуре (около 0°С). С другой стороны при ацетолизе фосфатидилхолина выход составляет около 74,5%, но при этом нужно большое количество дорогого фосфатидилхолина. Таким образом, этот метод не подходит для производства целевого соединения в большом количестве.
Для того чтобы региоселективно синтезировать производное глицерола, этерифицированное различными жирными кислотами по 1-му и 2-му положениям и несущее ацетильную группу в 3-м положении молекулы глицерола, в рамках обычного метода производства осуществляется следующий процесс. Вначале региоселективно этерифицируется 1-е положение глицерола. Затем защищается гидроксильная группа в 3-м положении и во 2-е положение вводится другая эфирная группировка. Этот процесс позволяет региоселективно этерифицировать 1-е, 2-е и 3-е положения молекулы глицерола. Однако когда защитная группа в 3-м положении удаляется для того, чтобы его этерифицировать, эфирная группировка из 2-го положения может мигрировать в 3-е (J.Org.Chem., 52(22), 4973-4977, 1987.
Раскрытие изобретения
Техническая задача
Соответственно, целью данного изобретения является предоставление способа региоселективного получения производных глицерола с хорошими производительностью и выходом.
Другой целью данного изобретения является предоставление способа региоселективного получения производных глицерола, не имеющего проблемы миграции функциональной группы.
Еще одной целью данного изобретения является предоставление простого способа региоселективного получения производных глицерола и промежуточных продуктов для получения производных глицерола.
Техническое решение
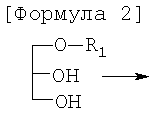
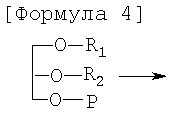
Для достижения этих и других целей данное изобретение предоставляет способ региоселективного получения 1-R1-2-R2-3-ацетилпроизводных глицерола со следующей Формулой 1, включающий стадии: получение 1-R1-3-(защитная группа)-глицерола с Формулой 3 путем введения защитной группы в 3-е положение 1-R1-глицерола с Формулой 2; получение 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4 путем введения группы R2 во 2-е положение 1-R1-3-(защитная группа)-глицерола с Формулой 3; одновременное осуществление реакции удаления защитной группы и реакции ацетилирования 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4.




Соединения с Формулами 1-4 являются рацемическими или оптически активными соединениями, где R1 и R2 - это остатки жирных кислот, включающих 16-22 атомов углерода и отличающихся друг от друга; Р- тритильная или триалкилсилильная группа в качестве защитной группировки. В триалкилсилильной группе алкил включает 1-5 атомов углерода.
Данное изобретение также предоставляет промежуточные продукты с Формулой 3 или 4 для получения производных глицерола с Формулой 1. Предпочтительно R1 является остатком пальмитиновой кислоты, R2 - остатком линолевой кислоты, Р - тритильной или триалкилсилильной группой.
Осуществление изобретения
Более полная оценка данного изобретения и тем самьм многих сопутствующих преимуществ достигается путем отсылки к следующему детальному описанию (раскрытие изобретения).
При получении производных 1-R1-2-R2-3-ацетил-глицерола с Формулой 1 по данному изобретению миграция функциональной группы предотвращается путем одновременного осуществления реакции удаления защитной группировки и реакции ацетилирования после введения защитной группировки в промежуточный продукт. Способ региоселективного получения производного 1-R1-2-R2-3-ацетилглицерола с Формулой 1 согласно данному изобретению показан в нижеследующей Реакции 1.
[Реакция 1]


В Реакции 1 R1, R2 - это остатки жирных кислот, содержащие 16-22 атомов углерода и отличающиеся друг от друга, P - тритильная или триалкилсилильная группа в качестве защитной группировки. Алкил в триалкилсилильной группе содержит 1-5 атомов углерода. Тритильная группа может быть замещенной или незамещенной;
предпочтительный вариант триалкилсилильной группы - трет-бутилдиметилсилил. Соединения в Реакции 1 могут быть рацемическими или оптически активными.
Как показано в Реакции 1, для того чтобы получить производное 1-R1-2-R2-3-ацетилглицерол с Формулой 1, во-первых, получают 1-R1-3-(защитная группа)-глицерол с Формулой 3 путем введения защитной группировки (Р) в 3-е положение 1-R1-глицерола с Формулой 2. 1-R1-глицерол с Формулой 2, являющийся исходным веществом в Реакции 1, может быть рацемическим или оптически активным.
Соединение для введения защитной группы должно избирательно защищать первичную спиртовую группу, и защитная группа не должна влиять на реакцию ацетилирования в ходе удаления защиты. Примеры соединений для введения защитной группы включают тритилхлорид или трет-бутилдиметилсилилхлорид; предпочтительное количество соединения для введения защитной группы составляет 1-1,1 эквивалента относительно 1-R1-глицерола с Формулой 2. Если количество соединения для введения защитной группы меньше 1 эквивалента, реакция защиты может протекать неэффективно, а если количество соединения для введения защитной группы больше 1,1 эквивалента, в реакцию может вступать гидроксильная группа во 2-м положении производного глицерола.
Когда в качестве защитной группы используется тритил, 1-R1-3-(защитная группа)-глицерол с Формулой 3 может быть предпочтительно получен в присутствии пиридина в качестве растворителя или в присутствии неполярного апротонного органического растворителя и органического основания. Когда используется пиридин, он служит одновременно и растворителем, и основанием; предпочтительна температура реакции 40-60°С. При температуре ниже 40°С реакция может протекать неэффективно; при температуре выше 60°С тритильная группа может включаться во 2-е положение глицерола. Предпочтительное количество пиридина составляет 5-10 эквивалентов относительно 1-R1-глицерола с Формулой 2. Когда используются органический растворитель и органическое основание, предпочтительная температура реакции - от 0°С до комнатной. Примеры неполярного апротонного органического растворителя включают дихлорметан, тетрагидрофуран, этилацетат и их смеси; примеры органического основания включают триэтиламин, трибутиламин, 1,8-диазабицикло[5,4,0]-7-ундецен (DBU) и их смеси. Предпочтительное количество органического основания - 1-2 эквивалента относительно 1-R1-глицерола с Формулой 2; предпочтительное количество органического растворителя 5-10-кратно (по объему) относительно веса 1-R1-глицерола с Формулой 2 (т.е. 5-10 мл/г). Когда количество пиридина или органического растворителя меньше вышеприведенного диапазона, может оказаться трудно перемешивать реакционную смесь; превышение вышеприведенного диапазона количества пиридина или органического растворителя нежелательно по экономическим соображениям, а дополнительных преимуществ не дает. Кроме того, когда количество органического основания меньше 1 эквивалента относительно 1-R-1-глицерола, реакция может протекать неэффективно, а количество органического основания больше 2 эквивалентов экономически нежелательно и не дает дополнительных преимуществ.
Когда защитной группой является триалкилсилил, например, трет-бутилдиметилсилил, соединение 1-R1-3-(защитная группа)-глицерол с Формулой 3 может быть предпочтительно получено в присутствии апротонного органического растворителя и органического основания при температуре от 0°С до комнатной. Примеры апротонных органических растворителей включают дихлорметан, тетрагидрофуран, этилацетат, диметилформамид и их смеси; примеры органических оснований включают имидазол, триэтиламин и их смеси. Предпочтительное количество органического основания составляет 1-2 эквивалента относительно 1-R1-глицерола с Формулой 2; предпочтительное количество органического растворителя составляет 5-10-кратное (по объему) относительно веса 1-R1-глицерола с Формулой 2 (т.е. 5-10 мл/г). Когда количество органического основания меньше 1 эквивалента относительно 1-R1-глицерола, реакция может протекать неэффективно; когда количество органического основания больше 2 эквивалентов, это экономически нежелательно, а дополнительных преимуществ не дает. Кроме того, когда количество органического растворителя меньше вышеприведенного диапазона, может оказаться трудно перемешивать реакционную смесь; превышение вышеприведенного диапазона количества органического растворителя нежелательно по экономическим соображениям, а дополнительных преимуществ не дает.
В 1-R1-3-(защитная группа)-глицероле с Формулой 3 только 2-е положение доступно для дополнительной реакции этерификации. Таким образом, группа R2 может быть введена путем взаимодействия R2-OH с 1-R1-3-(защитная группа)-глицеролом. Предпочтительно реакция может осуществляться в присутствии апротонного органического растворителя, катализатора и водоотнимающего средства при температуре от 0°С до комнатной. Примеры апротонных органических растворителей включают гексан, гептан, дихлорметан, этилацетат, тетрагидрофуран и их смеси; катализатором может быть, например, диметиламинопиридин (DMAP); водоотнимающим средством может служить дициклогексилкарбодиимид (DCC). Альтернативно, вместо R2-OH может использоваться активированная жирная кислота R2; примеры таких активированных соединений включают эфир, амид и хлорангидрид жирной кислоты R2.
Что касается реакционноспособности, легкости очистки, степени чистоты и цвета получаемого 1-R1-2-R2-3 -(защитная группа)-глицерола с Формулой 4, более предпочтительно сочетание R2-OH и дициклогексилкарбодиимида (DCC). Предпочтительное количество DCC составляет 1-1,1 эквивалента относительно 1-R1-3-(защитная группа)-глицерола с Формулой 3. Когда количество DCC меньше 1 эквивалента, реакция может протекать неэффективно; когда его количество превышает 1,1 эквивалента, это экономически нежелательно, а дополнительных преимуществ не дает. Реакция с использованием дициклогексилкарбодиимида может осуществляться в апротонном органическом растворителе, таком как гексан, гептан, этилацетат, дихлорметан, тетрагидрофуран и т.п. Однако для более легкого удаления побочного продукта, а именно дициклогексилмочевины, предпочтительно использовать гексан или гептан. Предпочтительное количество органического растворителя составляет 5-10-кратное по объему относительно веса 1-R1-3 -(защитная группа)-глицерола с Формулой 3. Также предпочтительное количество диметиламинопиридина (DMAP) составляет 0,5-1 мол.% относительно числа молей l-R1-3-(защитная группа)-глицерола. Когда количество диметиламинопиридина (DMAP) меньше 0,5 мол.%, реакция может протекать дольше; когда количество DMAP больше 1 мол.%, это экономически нежелательно, а дополнительных преимуществ не дает. Предпочтительное количество жирной кислоты R2 или ее активированной формы (в дальнейшем называемых совокупно жирной кислотой R2) составляет 1-1,1 эквивалента относительно 1-R1-3-(защитная группа)-глицерола с Формулой 3. Когда количество жирной кислоты R2 меньше 1 эквивалента, реакция может протекать недостаточно; когда количество жирной кислоты R2 превышает 1,1 эквивалента, это экономически нежелательно, а дополнительных преимуществ не дает.
Когда осуществляется реакция удаления защитной группировки, группа R2 во 2-м положении незащищенной молекулы 1-R1-2-R2-глицерола может легко мигрировать в 3-е положение. В этом случае в ходе следующей реакции ацетилирования образуется побочный продукт, подвижность которого (Rf) сходна с таковой целевого продукта с Формулой 1. Таким образом, затрудняется очистка 1-R1-2-R2-3-ацетил-глицерола с Формулой 1. Для решения этой проблемы по данному изобретению реакцию удаления защитной группы и реакцию ацетилирования осуществляют одновременно. При использовании в качестве защитной группы тритила или триалкилсилила реакция удаления защитной группы и реакция ацетилирования 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4 осуществляются одновременно при помощи кислоты Льюиса и уксусного ангидрида или при помощи ацетилирующего агента. Примеры кислоты Льюиса включают хлорид цинка (ZnCl2), хлорид олова (SnCl2), трифторид бора - диэтиловый эфир (ВF3 Et2O) и их смеси; примеры ацетилирующего агента включают ацетилбромид, ацетилхлорид и их смеси. Предпочтительное количество кислоты Льюиса составляет 1-5 эквивалентов относительно 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4. Предпочтительное количество уксусного ангидрида или ацетилирующего агента составляет 1-20 эквивалентов относительно 1-R1-2-R2-3-(защитная группа)-глицерола. Когда количества кислоты Льюиса, уксусного ангидрида и ацетилирующего агента меньше приведенного диапазона, реакция может протекать недостаточно; когда количества кислоты Льюиса, уксусного ангидрида или ацетилирующего агента превышают данный диапазон, это экономически нежелательно, а дополнительных преимуществ не дает. Реакция может осуществляться в присутствии апротонного органического растворителя; предпочтительное количество растворителя 5-10-кратно по объему относительно веса 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4. Примеры апротонного органического растворителя включают гексан, гептан, дихлорметан, толуол, этилацетат, ацетонитрил и их смеси. Альтернативно реакция может осуществляться безо всякого растворителя.
Также при использовании в качестве защитной группировки тритила 1-R1-2-R2-3-(защитная группа)-глицерол с Формулой 4 может быть лишен защитной группы и триалкилсилирован, например при помощи триметилсилилиодида (TMSI). После триалкилсилирования реакция ацетилирования может осуществляться, например, при помощи ацетилхлорида и кислоты Льюиса, которая выбирается из группы, состоящей из хлорида цинка (ZnCl2), хлорида олова (SnCl2), трифторида бора - диэтиловый эфир (ВF3Еt2O) и их смесей или при помощи одного только ацетилбромида. А именно 1-R1-2-R2-3-ацетилглицерол с Формулой 1 может быть получен путем следующих стадий: а) получение 1-R1-2-R2-3-триметилсилил-глицерола с использованием триметилсилилиодида (TMSI) для удаления защитной группировки и триметилсилилирования 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4; б) добавление ацетилхлорида и кислоты Льюиса или добавление ацетилбромида. Триметилсилилиодид (TMSI) может использоваться непосредственно (реактив) или может быть получен путем реакций иодид натрия/триметилсилилхлорид (NaI/TMSCI) либо гексаметилдисилазан/иод (HMDS/I2) в реакционном растворителе. 1-R1-2-R2-3-ацетил-глицерол с Формулой 1, который образуется на конечной стадии, может быть выделен и очищен путем колоночной хроматографии (гексан или гептан: этилацетат =36:1 по объему). Вышеупомянутая реакция может осуществляться в присутствии апротонного органического растворителя, который выбирается из группы, включающей дихлорметан, этилацетат, ацетонитрил и их смеси. Предпочтительное количество органического растворителя 5-10-кратно по объему относительно веса 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4. Предпочтительные количества кислоты Льюиса, триметилсилилиодида (TMSI) и ацетилхлорида с ацетилбромидом (вместе) составляют соответственно 1-5, 1-5 и 1-20 эквивалентов относительно 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4. Когда количества кислоты Льюиса, триметилсилилиодида (TMSI) и ацетилхлорида с ацетилбромидом (вместе) меньше приведенного диапазона, реакция может протекать недостаточно; когда количества кислоты Льюиса, триметилсилилиодида (TMSI) и ацетилхлорида с ацетилбромидом (вместе) превышают указанный диапазон, это экономически нежелательно, а дополнительных преимуществ не дает.
Данное изобретение также предоставляет промежуточные продукты со следующими Формулами 3 и 4 для получения производного глицерола с Формулой 1.


Соединения с Формулами 3 и 4 являются рацемическими или оптически активными; здесь R1 и R2 - остатки жирных кислот, содержащих 16-22 атомов углерода и отличающихся друг от друга. Предпочтительно R1 - это остаток пальмитиновой кислоты, R2 - линолевой кислоты, Р - тритил или триалкилсилил в качестве защитной группы, где алкил в триалкилсилиле включает 1-5 атомов углерода.
Ниже для лучшего понимания данного изобретения приводятся предпочтительные примеры, однако они его не ограничивают.
Пример 1. Получение 1-пальмитоил-3-тритилглицерола
В реакционный сосуд объемом 1 л помещали 33,0 г 1-пальмитоил-глицерола, 48 мл пиридина и 31,3 г тритилхлорида. Реакционную смесь нагревали до 60°С при перемешивании, и реакция протекала в течение 3 часов. По завершении реакции в реакционную смесь медленно добавляли охлажденную воду (240 мл). После этого реакционную смесь перемешивали еще 1 час, затем фильтровали. Полученный плотный материал промывали охлажденной водой (120 мл) и высушивали при 40°С. В результате получалось 57,3 г 1-пальмитоил-3-тритил-глицерола (выход: 100%). {1Н ЯМР (400 МГц, СDСl3): 0,89-0,93 (t,3H), 1,21-1,31 (m, 24H), 1,57-1,61 (m, 2H), 2,31 (t, 2H), 3,25 (d, 2H), 3,97-4,02 (m, 1H), 4,16-4,27 (m, 2H), 7,22-7,47 (m, 15H)}
Пример 2. Получение 1-пальмитоил-3-трет-бутилдиметилсилил-глицерола
В реакционный сосуд объемом 1 л помещали 33,0 г 1-пальмитоил-глицерола, 330 мл дихлорметана и 13,6 г имидазола. Реакционную смесь охлаждали до 0°С. Затем добавляли 18,0 г трет-бутилдиметилсилилхлорида, и смесь перемешивали еще 2 часа. После фильтрования реакционной смеси растворитель отгоняли при пониженном давлении и для экстракции добавляли 165 мл очищенной воды и 150 мл гептана. Отделившийся слой органических соединений снова экстрагировали очищенной водой (80 мл), после чего органический слой обезвоживали безводным сульфатом магния и отфильтровывали. После этого растворитель отгоняли под пониженным давлением. В результате получался 1-пальмитоил-3-трет-бутилдиметилсилил-глицерол (выход: 100%). {1Н ЯМР (400 МГц, СDСl3):0,78-0,83 (m, 18Н), 1,18-1,31 (m, 24Н), 1,50-1,56 (m, 2Н), 2,24 (t, 2H), 3,51-3,60 (m, 2Н), 3,76-3,79 (р, 1Н), 4,04-4,10 (m, 2Н)}.
Пример 3. Получение 1-пальмитоил-2-линолеил-3-тритил-глицерола
В реакционный сосуд объемом 1 л помещали 57,3 г 1-пальмитоил-3-тритил-глицерола, полученного в Примере 1, 300 мл гептана, 29,4 г линолевой кислоты и 0,122 г диметиламинопиридина. В реакционную смесь добавляли 21,7 г дициклогексилкарбодиимида и перемешивали в течение 3 часов при комнатной температуре. Отфильтровав дициклогексилмочевину, получали гептановый раствор 1-пальмитоил-2-линолеил-3-тритил-глицерола (ожидаемый выход: 100%). {1Н ЯМР (400 МГц, СDСl3):0,92-0,95(m,6Н), 1,33-1,43(m,36Н),1,60(m,2Н), 1,69(m,2Н), 2,09-2,11(m,4Н), 2,26(t,2H), 2,27(t,2H), 2,83(t,2H), 3,31(m,2H), 4,24-4.42(m,4H), 5,31-5,41(m,5Н), 7,21-7,49(m,15Н)}.
Пример 4. Получение 1-пальмитоил-2-линолеил-3-трет-бутилдиметилсилил-глицерола
В реакционный сосуд объемом 1 л помещали 44,4 г 1-пальмитоил-3-трет-бутилдиметилсилил-глицерола, полученного в Примере 2, 225 мл гептана, 29,4 г линолевой кислоты и 0,122 г диметиламинопиридина. В реакционную смесь добавляли 21,7 г дициклогексилкарбодиимида и перемешивали в течение 3 часов при комнатной температуре. Отфильтровав дициклогексилмочевину, получали гептановый раствор 1-пальмитоил-2-линолеил-3-трет-бутилдиметилсилил-глицерола (ожидаемый выход: 100%). {1Н ЯМР (400 МГц, CDCl3): 0,76-0,81(m,21H), 1,16-1,27(m,36H), 1,50-1,52(m,4H), 1,95(q,4H), 2,17-2,21(m,4H), 2,65(t,2H), 3,62(d,2H), 4,02-4,28(m,4H), 4,96-5,27(m,5H)}.
Пример 5. Получение 1-пальмитоил-2-линолеил-3-ацетил-глицерола
[Способ получения 1]
Растворитель из гептанового раствора 1-пальмитоил-2-линолеил-3-тритил-глицерола, полученного в Примере 3, отгоняли под пониженным давлением и оставшийся материал растворяли в 800 мл ацетонитрила. Затем туда добавляли 22 г хлорида олова и 206 мл уксусного ангидрида и перемешивали в течение 24 часов при комнатной температуре. После концентрирования реакционной смеси для экстракции добавляли 800 мл очищенной воды и 400 мл гептана. Отделившийся слой органического материала промывали 400 мл очищенной воды, промытый материал обезвоживали безводным сульфатом магния и фильтровали. Путем колоночной хроматографии с силикагелем (Si-60, 230-400 меш; гептан:этилацетат-36:1 по объему) было получено 36,4 г 1-пальмитоил-2-линолеил-3-ацетил-глицерола. (Теоретические количества: 63,5 г, выход: 57,4%). {1Н ЯМР (400 МГц, СDСl3):0,85-0,91(m,6Н), 1,21-1,31(m,38Н), 1,62(m,4Н), 2,03(m,4Н), 2,03(m4Н), 2,007(s,3H), 2,37(m,4H), 2,78(m,2Н), 4,14-4,29(m,4Н), 5,23-5,34(m,5Н)}.
[Способ получения 2]
1-Пальмитоил-2-линолеил-3-ацетал-глицерол в количестве 40,1 г был получен таким же путем, как описано в Способе получения 1, за исключением того, что вместо 22 г хлорида олова было взято 15,2 мл трифторида бора - диэтилового эфира (BF3Et2O), a перемешивание продолжалось 3 часа. (Теоретические количества: 63,5 г; выход: 63,1%).
[Способ получения 3]
Из гептанового раствора 1-пальмитоил-2-линолеил-3-тритил-глицерола, который был получен в Примере 3, удаляли растворитель путем перегонки под пониженным давлением. Затем к оставшемуся материалу добавляли 123 г ацетилбромида и перемешивали 6 часов при комнатной температуре. В реакционную смесь приливали 400 мл гептана, после чего туда по каплям добавляли 400 мл охлажденной очищенной воды для экстрагирования слоя органического материала. Отделившийся слой органического материала промывали 100 мл насыщенного раствора бикарбоната натрия и 400 мл очищенной воды; затем промытый слой органического материала обезвоживали безводным сульфатом магния и фильтровали.
1-Пальмитоил-2-линолеил-3-ацетил-глицерол в количестве 46,7 г был получен в результате колоночной хроматографии с силикагелем (Si-60, 230-400 меш) с гептаном и этилацетатом в соотношении 36:1 по объему. (Теоретические количества: 63,5 г, выход: 73,6%.)
[Способ получения 4]
1-Пальмитоил-2-линолеил-3-ацетил-глицерол в количестве 43,0 г был получен таким же путем, как описано в Способе получения 3, за исключением того, что растворитель из гептанового раствора 1-пальмитоил-2-линолеил-3-тритил-глицерола, который был получен в Примере 3, не отгоняли под пониженным давлением. (Теоретические количества: 63,5 г, выход: 67,7%.)
[Способ получения 5]
1-Пальмитоил-2-линолеил-3-ацетил-глицерол в количестве 26,3 г был получен таким же путем, как описано в Способе получения 3, за исключением того, что вместо 123 г ацетилбромида использовали 157 г ацетилхлорида и перемешивание продолжалось 12 часов. (Теоретические количества: 63,5 г, выход: 41,4%.)
[Способ получения 6]
Из гептанового раствора 1-пальмитоил-2-линолеил-3-тритил-глицерола, полученного в Примере 3, отгоняли растворитель под пониженным давлением. Затем к оставшемуся материалу добавляли 800 мл ацетонитрила, 74,9 г иодида натрия (NaI) и 54,3 г триметилсилилхлорида (TMSCL) и перемешивали 2 часа при комнатной температуре. В реакционную смесь добавляли 68,1 г безводного хлорида цинка (ZnCl2) и 157 г ацетилхлорида и перемешивали в течение 2 часов. Из реакционной смеси удаляли растворитель путем перегонки под пониженным давлением и добавляли к оставшемуся материалу 400 мл гептана. Затем туда по каплям прибавляли 400 мл охлажденной очищенной воды для экстрагирования слоя органического материала. Отделившийся слой органического материала промывали 100 мл насыщенного раствора бикарбоната натрия и 400 мл очищенной воды; затем промытый слой обезвоживали безводным сульфатом магния (MgSO4) и фильтровали. 1-Пальмитоил-2-линолеил-3-ацетил-глицерол в количестве 33,3 г был получен путем колоночной хроматографии с силикагелем (Si-60, 230-400 меш) с гептаном и этилацетатом в соотношении 36:1 по объему. (Теоретические количества: 63,5 г, выход: 52,4%.)
[Способ получения 7]
1-Пальмитоил-2-линолеил-3-ацетил-глицерол в количестве 36,9 г был получен таким же путем, как описано в Способе получения 6, за исключением того, что вместо 68,1 г безводного хлорида цинка и 157 г ацетилхлорида использовалось 123 г ацетилбромида и перемешивание проводилось в течение 3 часов. (Теоретические количества: 63,5 г, выход: 58,1%.)
[Способ получения 8]
К гептановому раствору 1-пальмитоил-2-линолеил-3-трет-бутил-диметилсилил-глицерола, полученного в Примере 4, добавляли 123 г ацетилбромида и реакционную смесь перемешивали 12 часов при комнатной температуре. В реакционную смесь приливали 400 мл гептана и по каплям добавляли 400 мл охлажденной очищенной воды для экстрагирования слоя органического материала. Отделившийся слой органического материала промывали 100 мл насыщенного раствора бикарбоната натрия и 400 мл очищенной воды; затем промытый слой обезвоживали безводным сульфатом магния (MgSO4) и фильтровали. 1-Пальмитоил-2-линолеил-3-ацетил-глицерол в количестве 178 г был получен путем колоночной хроматографии с силикагелем (Si-60, 230-400 меш) с гептаном и этилацетатом в соотношении 36:1 по объему. (Теоретические количества: 63,5 г, выход: 28%.)
[Способ получения 9]
1-Пальмитоил-2-линолеил-3-ацетил-глицерол в количестве 284 г был получен таким же путем, как описано в Способе получения 8, за исключением того, что вместо 123 г ацетилбромида использовались 50 мл дихлорметана, 206 мл уксусного ангидрида и 15,2 мл трифторида бора - диэтилового эфира (ВF3Еt2O). (Теоретическое количество: 63,5 г, выход: 44,7%.)
[Способ получения 10]
При использовании в качестве начального материала оптически активного (R)-1-пальмитоил-глицерола и оптически активного (S)-1-пальмитоил-глицерола и осуществлении Примеров 1 и 3 соответственно, были получены гептановые растворы (R)-1-пальмитоил-2-линолеил-3-тритил-глицерола и (S)-1-пальмитоил-2-линолеил-3-тритил-глицерола. За исключением того, что вместо рацемического 1-пальмитоил-2-линолеил-3-тритил-глицерола использовались оптически активные соединения, было получено 45,8 г (S)-1-пальмитоил-2-линолеил-3-ацетил-глицерола и 45,8 г (R)-1-пальмитоил-2-линолеил-3-ацетил-глицерола таким же путем, как описано в Способе получения 3. (Теоретические количества: 63,5 г, выход: 72,1%.) (R)-энантиомер: {1Н ЯМР (400 МГц, СDСl3): 0,85-0,92(m,6H), 1,20-1,33 (m,38H), 1,62(m,4H), 2,03(m,4H), 2,07(s,3H), 2,36(m,4H), 2,77(m,2H), 4,14-4,3 1(m,4H), 5,23-5,36(m,5H)}, (S)-энантиомер: {1Н ЯМР (400 МГц, CDCl3): 0,85-0,92(m,6H), 1,21-1,33(m,38H), 1,63(m,4H), 2,02(m,4H), 2,07(s,3H). 2,37(m,4H), 2,78(m,2H), 4,12-4,28(m,4H),5,21-5,35(m,5H)}.
Промышленное применение
Как описано выше, способ региоселективного получения производных глицерола и соответствующих промежуточных продуктов согласно данному изобретению может давать производные глицерола с высокими эффективностью и выходом без мигрирования функциональной группы. Также в способе по данному изобретению сводится к минимуму стадия очистки с использованием колоночной хроматографии с силикагелем.
Изобретение относится к усовершенствованному способу региоселективного получения производного глицерола с высокими эффективностью и выходом. Способ региоселективного получения производного 1-R1-2-R2-3-ацетил-глицерола со следующей Формулой 1 включает стадии: получения 1-R1-3-(защитная группа)-глицерола с Формулой 3 путем введения защитной группы в 3-е положение 1-R1 -глицерола с Формулой 2; получения 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4 путем введения группы R2 во 2-е положение 1-R1-3-(защитная группа)-глицерола с Формулой 3, где группу R2 вводят путем взаимодействия R2-OH с 1-R1-3-(защитная группа)-глицеролом в присутствии апротонного органического растворителя, катализатора и водоотнимающего средства; апротонный органический растворитель выбирают из группы, состоящей из гексана, гептана, дихлорметана, этилацетата, тетрагидрофурана и их смесей; и катализатором является диметиламинопиридин; а водоотнимающим средством служит дициклогексилкарбодиимид; одновременного удаления защитной группы и ацетилирования 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4, где реакцию удаления защитной группы и реакцию ацетилирования осуществляют с использованием кислоты Льюиса и уксусного ангидрида или с использованием ацетилирующего агента; кислоту Льюиса выбирают из группы, состоящей из хлорида цинка (ZnCl2), хлорида олова (SnCl2), трифторида бора-диэтилового эфира (ВF3Еt2O) и их смесей; ацетилирующий агент выбирают из группы, состоящей из ацетилхлорида, ацетилбромида и их смесей, где соединения с Формулами 1-4 являются рацемическими или оптически активными; R1 - остаток пальмитиновой кислоты, R2 - остаток линолевой кислоты; Р - тритил или триалкилсилил в качестве защитной группы; алкил в триалкилсилиле является алкильной группой, содержащей 1-5 атомов углерода, где в том случае, когда защитной группой является тритил, 1-R1-3-(защитная группа)-глицерол получают в присутствии пиридинового растворителя при температуре 40-60°С или в присутствии неполярного апротонного органического растворителя и органического основания при температуре от 0°С до комнатной; неполярный апротонный органический растворитель выбирают из группы, состоящей из пиридина, дихлорметана, тетрагидрофурана, этилацетата и их смесей; органическое основание выбирают из группы, состоящей из триэтиламина, трибутиламина, 1,8-диазабицикло[5,4,0]-7-ундецена (DBU) и их смесей, а в том случае, когда защитной группой является триалкилсилил, 1-R1-3-(защитная группа)-глицерол получают в присутствии апротонного органического растворителя и органического основания при температуре от 0°С до комнатной; апротонный органический растворитель выбирают из группы, состоящей из дихлорметана, тетрагидрофурана, этилацетата, диметилформамида и их смесей; и органическое основание выбирают из группы, состоящей из имидазола, триэтиламина и их смесей.




3 н. и 5 з.п. ф-лы.
1. Способ региоселективного получения производного 1-R1-2-R2-3-ацетил-глицерола со следующей Формулой 1, включающий стадии:
получение 1-R1-3 -(защитная группа)-глицерола с Формулой 3 путем введения защитной группы в 3-е положение 1-R1-глицерола с Формулой 2; получение 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4 путем введения группы R2 во 2-е положение 1-R1-3-(защитная группа)-глицерола с Формулой 3, где группу R2 вводят путем взаимодействия R2-OH с 1-R1-3-(защитная группа)-глицеролом в присутствии апротонного органического растворителя, катализатора и водоотнимающего средства; апротонный органический растворитель выбирают из группы, состоящей из гексана, гептана, дихлорметана, этилацетата, тетрагидрофурана и их смесей; и катализатором является диметиламинопиридин; а водоотнимающим средством служит дициклогексилкарбодиимид;
одновременное удаление защитной группы и ацетилирование 1-R1-2-R2-3-(защитная группа)-глицерола с Формулой 4, где реакцию удаления защитной группы и реакцию ацетилирования осуществляют с использованием кислоты Льюиса и уксусного ангидрида или с использованием ацетилирующего агента; кислоту Льюиса выбирают из группы, состоящей из хлорида цинка (ZnCl2), хлорида олова (SnCl2), трифторида бора-диэтилового эфира (ВF3Еt2O) и их смесей; ацетилирующий агент выбирают из группы, состоящей из ацетилхлорида, ацетилбромида и их смесей,




где соединения с Формулами 1-4 являются рацемическими или оптически активными; R1 - остаток пальмитиновой кислоты, R2 - остаток линолевой кислоты; Р - тритил или триалкилсилил в качестве защитной группы; алкил в триалкилсилиле является алкильной группой, содержащей 1-5 атомов углерода,
где в том случае, когда защитной группой является тритил, 1-R1-3-(защитная группа)-глицерол получают в присутствии пиридинового растворителя при температуре 40-60°С или в присутствии неполярного апротонного органического растворителя и органического основания при температуре от 0°С до комнатной; неполярный апротонный органический растворитель выбирают из группы, состоящей из пиридина, дихлорметана, тетрагидрофурана, этилацетата и их смесей; органическое основание выбирают из группы, состоящей из триэтиламина, трибутиламина, 1,8-диазабицикло[5,4,0]-7-ундецена (DBU) и их смесей,
а в том случае, когда защитной группой является триалкилсилил, 1-R1-3-(защитная группа)-глицерол получают в присутствии апротонного органического растворителя и органического основания при температуре от 0°С до комнатной; апротонный органический растворитель выбирают из группы, состоящей из дихлорметана, тетрагидрофурана, этилацетата, диметилформамида и их смесей; и органическое основание выбирают из группы, состоящей из имидазола, триэтиламина и их смесей.
2. Способ региоселективного получения производного глицерола по п.1, где Р - тритильная или трет-бутилдиметилсилильная группа.
3. Способ региоселективного получения производных глицерола по п.1, где количества пиридина и органического основания составляют соответственно 5-10 и 1-2 эквивалента относительно 1-R1-глицерола, количество органического растворителя 5-10-кратно по объему относительно веса 1-R1-глицерола; и количество соединения для введения тритила составляет 1-1,1 эквивалента относительно 1-R1-глицерола.
4. Способ региоселективного получения производных глицерола по п.1, где количество органического основания составляет 1-2 эквивалента относительно 1-R1-глицерола, количество органического растворителя 5-10-кратно по объему относительно веса 1-R1-глицерола, и количество соединения для введения триалкилсилила составляет 1-1,1 эквивалента относительно 1-R1-глицерола.
5. Способ региоселективного получения производного глицерола по п.1, где реакцию удаления защитной группы и реакцию ацетилирования осуществляют в присутствии либо в отсутствие апротонного органического растворителя, который выбирают из группы, состоящей из гексана, гептана, дихлорметана, толуола, этилацетата, ацетонитрила и их смесей.
6. Способ региоселективного получения производных глицерола по п.1, где количество кислоты Льюиса составляет 1-5 эквивалентов, количество уксусного ангидрида или апетилирующего агента составляет 1-20 эквивалентов относительно 1-R1-2-R2-3-(защитная группа)-глицерола.
7. Промежуточное соединение Формулы 3

где R1 - это остаток жирной кислоты, содержащей 16-22 атомов углерода;
Р - тритил.
8. Промежуточное соединение Формулы 4

где R1 и R2 - остатки жирных кислот, содержащих 16-22 атомов углерода, и отличаются друг от друга; Р - тритил.
| С.Е.Burgos et al | |||
| «A New, Asymmetric Synthesis of Lipids and Phospholipids», J | |||
| Org | |||
| Chem., 1987, 52, c.4973-4977 | |||
| Шкив для канатной передачи | 1920 |
|
SU109A1 |
Авторы
Даты
2010-06-20—Публикация
2006-07-18—Подача