Область техники, к которой относится изобретение
Данное изобретение относится к способу получения 1-пальмитоил-3-ацетилглицерина и способу получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина с использованием этого соединения, а конкретнее к способу получения 1-пальмитоил-3-ацетилглицерина с высокой чистотой и с высоким выходом без стадии очистки с использованием колоночной хроматографии, а также к способу получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина с высокой чистотой и с высоким выходом с использованием 1-пальмитоил-3-ацетилглицерина в качестве основного промежуточного соединения.
Уровень техники
Рац-1-пальмитоил-2-линолеоил-3-ацетилглицерин является одним из компонентов оленьих рогов и известен как один из наиболее активных компонентов, оказывающих стимулирующее рост действие на гемопоэтические стволовые клетки и мегакариоциты, которые можно получить из хлороформных экстрактов оленьего рога (патент Кореи №10-0283010). В патенте Кореи №10-0291743 раскрываются два способа получения рац-1-пальмитоил-2-линолеоил-3-ацетилглицерина - (a) способ синтеза этого соединения из глицерина и (b) способ с использованием ацетолиза фосфатидилхолина. Однако реакция по способу (a) не является региоселективной. В соответствии с этим 1-пальмитоилглицерин следует выделять из продукта взаимодействия глицерина и пальмитиновой кислоты с использованием колоночной хроматографии. Выделенный 1-пальмитоилглицерин ацетилируют и снова выделяют с использованием колоночной хроматографии. Затем осуществляют реакцию линолеолирования вышеуказанного продукта реакции и снова выполняют стадию разделения с использованием колоночной хроматографии для получения целевого соединения рац-1-пальмитоил-2-линолеоил-3-ацетилглицерина. Так как реакция по способу (a) не является региоселективной, продукт реакции на каждой реакционной стадии необходимо выделять и очищать с использованием колоночной хроматографии, и общий выход целевого соединения является очень низким (примерно 3,21% по глицерину). Кроме того, при взаимодействии по способу (a) используется этерификация по Штеглиху (Steglich) с использованием дициклогексилкарбодиимида (DCC), и может происходить побочная реакция, при которой ацильная группа перемещается в аддукт DCC и карбоновой кислоты. Для того чтобы подавить побочную реакцию, следует использовать дорогостоящий катализатор 4-диметиламинопиридин (DMAP) в количестве свыше одного эквивалента. Однако побочную реакцию подавить полностью нельзя, в качестве побочного продукта образуется дициклогесилмочевина, и этот побочный продукт трудно удалить полностью фильтрацией и экстракцией.
Для того чтобы региоселективно синтезировать производное глицерина с эфирными группами различных кислот в положениях 1 и 2 глицерина и с ацетильной группой в положении 3 глицерина, обычно осуществляют следующий процесс. Сначала региоселективно вводят эфирную группу в положение 1 глицерина. Затем после защиты гидроксильной группы в положении 3 глицерина, которая более реакционноспособна, чем гидроксильная группа в положении 2 глицерина, следует ввести эфирную группу в положение 2 глицерина. Таким способом можно региоселективно ввести эфирные группы в положения глицерина 1, 2 и 3. Однако когда удаляют защитную группу в положении 3 глицерина для введения эфирной группы в положение 3, существует проблема, что эфирная группа в положении 2 глицерина переходит в положение 3 глицерина (J. Org. Chem., 52(22), 4973~4977, 1987). Также указанный способ имеет недостатки в том, что необходимо вводить защитную группу, и защитную группу следует удалять, за счет чего общая реакция требует нескольких реакционных стадий.
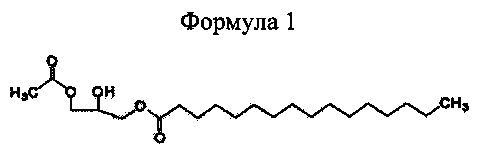
Однако когда для синтеза 1-пальмитоил-2-линолеоил-3-ацетилглицерина используют производное глицерина с эфирной группой в положении 1 глицерина и ацетильной группой в положении 3 глицерина, например 1-пальмитоил-3-ацетилглицерин, представленный приведенной далее формулой 1, вышеуказанные недостатки удается устранить. Поэтому существует потребность в получении рацемического или оптически активного и чистого 1-пальмитоил-3-ацетилглицерина.
Формула 1
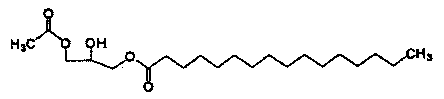
Раскрытие изобретения
Техническая проблема
Соответственно, целью данного изобретения является новый способ получения рацемического или оптически активного 1-пальмитоил-3-ацетилглицерина высокой степени чистоты и с высоким выходом без осуществления процесса разделения и очистки с использованием колоночной хроматографии.
Другой целью данного изобретения является новый способ получения рацемического или оптически активного 1-пальмитоил-2-линолеоил-3-ацетилглицерина высокой степени чистоты и с высоким выходом с использованием 1-пальмитоил-3-ацетилглицерина в качестве промежуточного соединения без процесса разделения и очистки с использованием колоночной хроматографии.
Решение проблемы
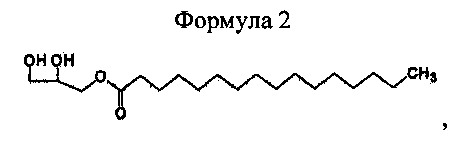
Для достижения вышеуказанных целей настоящее изобретение описывает способ получения 1-пальмитоил-3-ацетилглицерина, включающий стадии получения реакционной смеси, включающей 1-пальмитоил-3-ацетилглицерин, представленный приведенной далее формулой 1, путем взаимодействия 1-пальмитоилглицерина, представленного приведенной далее формулой 2, и ацетилирующего агента; и выделения оптически активного 1-пальмитоил-3-ацетилглицерина путем кристаллизации реакционной смеси в насыщенном углеводородном растворителе, имеющем 5-7 атомов углерода.
Формула 1
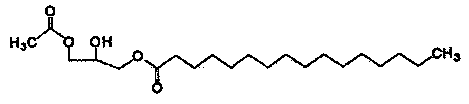
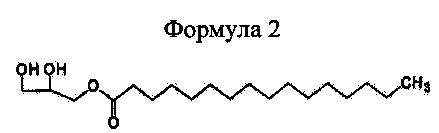
Формула 2
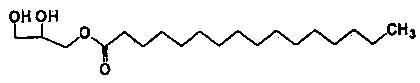
Соединения приведенных выше формул 1 и 2 являются рацемическими или оптически активными соединениями.
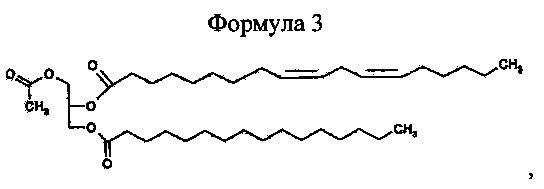
Настоящее изобретение также относится к способу получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина, включающему стадии получения смешанного ангидрида путем взаимодействия линолевой кислоты и пивалоилхлорида в неполярном органическом растворителе в присутствии органического основания и получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина, представленного приведенной далее формулой 3, путем взаимодействия 1-пальмитоил-3-ацетилглицерина и смешанного ангидрида в присутствии 4-диметиламинопиридина.
Формула 3
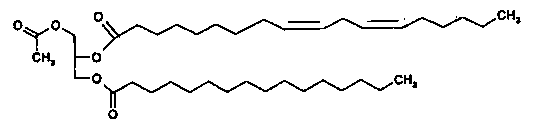
Соединение приведенной выше формулы 3 является рацемическим или оптически активным соединением.
Эффект, достигаемый в настоящем изобретении
Способом получения 1-пальмитоил-3-ацетилглицерина по настоящему изобретению можно получить 1-пальмитоил-3-ацетилглицерин (рацемическое или оптически активное соединение) высокой степени чистоты и с высоким выходом простыми стадиями (стадия ацетилирования и стадия кристаллизации) без выделения и процесса очистки с использованием колоночной хроматографии. Также способом получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина по настоящему изобретению можно получить 1-пальмитоил-2-линолеоил-3-ацетилглицерин (рацемическое или оптически активное соединение) высокой степени чистоты и с высоким выходом (свыше 98%) с использованием 1-пальмитоил-3-ацетилглицерина в качестве промежуточного соединения, используя пивалоилхлорид в качестве реагента сочетания, без выделения и процесса очистки с использованием колоночной хроматографии. Соответственно, способы по настоящему изобретению подходят для массового производства.
Метод действия изобретения
Полнее оценить настоящее изобретение и лучше понять многие присущие ему преимущества можно, обратившись к приведенному далее подробному описанию.
Способом получения 1-пальмитоил-3-ацетилглицерина и способом получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина с использованием методов по настоящему изобретению получают 1-пальмитоил-2-линолеоил-3-ацетилглицерин (рацемическое или оптически активное соединение) и его промежуточное соединение 1-пальмитоил-3-ацетилглицерин (рацемическое или оптически активное соединение) высокой степени чистоты и с высоким выходом без выделения и процесса очистки с использованием колоночной хроматографии.
Для того чтобы получить 1-пальмитоил-3-ацетилглицерин приведенной далее формулы 1 согласно настоящему изобретению, сначала получают реакционную смесь, включающую 1-пальмитоил-3-ацетилглицерин, путем взаимодействия исходных материалов 1-пальмитоилглицерина приведенной далее формулы 2 и ацетилирующего агента (реакция ацетилирования).
Формула 1
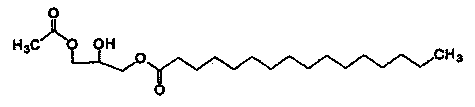
Формула 2
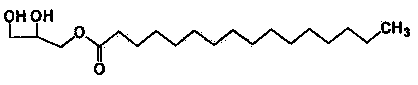
Соединения приведенных выше формул 1 и 2 являются рацемическими или оптически активными соединениями.
Когда осуществляют реакцию ацетилирования, кроме 1-пальмитоил-3-ацетилглицерина образуются побочные продукты 1-пальмитоил-2-ацетилглицерин и 1-пальмитоил-2,3-диацетилглицерин. Из детального исследования механизмов реакций авторы настоящего изобретения обнаружили, что 1-пальмитоил-2-ацетилглицерин образуется за счет конкурентных реакций гидроксильных групп в положениях 2 и 3 1-пальмитоилглицерина на начальной стадии реакции ацетилирования, и гидроксильная группа в положении 3 полученного побочного продукта 1-пальмитоил-2-ацетилглицерина также ацетилируется в конкурентной реакции гидроксильной группы в положении 3 исходного вещества 1-пальмитоилглицерина с образованием 1-пальмитоил-2,3-диацетилглицерина как побочного продукта.
Соответственно, авторы настоящего изобретения попытались уменьшить число соединений, присутствующих в реакционной смеси после завершения реакции, с использованием механизма реакции. Более конкретно, авторы изобретения регулировали количество ацетилирующего агента, используемого в реакции ацетилирования, так чтобы побочный продукт 1-пальмитоил-2-ацетилглицерин полностью превращался в 1-пальмитоил-2,3-диацетилглицерин, а исходное вещество (1-пальмитоилглицерин) отсутствовало, и при этом реакционная смесь включала бы только два соединения: 1-пальмитоил-3-ацетилглицерин и побочный продукт 1-пальмитоил-2,3-диацетилглицерин. В противоположность этому, в обычном способе реакционная смесь включает 4 типа соединений (1-пальмитоил-3-ацетилглицерин, 1-пальмитоил-2-ацетилглицерин, 1-пальмитоил-2,3-диацетилглицерин и непрореагировавший 1-пальмитоилглицерин). В реакции ацетилирования по настоящему изобретению очень важным является уменьшение количеств исходного материала и побочного 1-пальмитоил-2-ацетилглицерина. Если они остаются в реакционной смеси, они не удаляются в процессе очистки (стадия кристаллизации), осуществляемом для очистки и получения чистого 1-пальмитоил-3-ацетилглицерина. Поэтому в конце синтеза 1-пальмитоил-2-линолеоил-3-ацетилглицерина могут образоваться побочные продукты 1-пальмитоил-2,3-линолеоилглицерин или 1-пальмитоил-2-ацетил-3-линолеоилглицерин. Побочные продукты приходится удалять с использованием колоночной хроматографии, что делает стадию очистки весьма трудоемкой.
Примеры ацетилирующего агента, используемого в настоящем изобретении, включают ацетилхлорид, ацетилбромид, их смеси и тому подобное. Количество ацетилирующего агента составляет 1,3-1,4 эквивалента, предпочтительно, 1,31-1,35 эквивалентов, относительно 1-пальмитоилглицерина. Когда количество ацетилирующего агента меньше 1,3 эквивалентов в расчете на 1-пальмитоилглицерин, в реакционной смеси могут остаться непрореагировавший 1-пальмитоилглицерин и 1-пальмитоил-2-ацетилглицерин. Когда количество ацетилирующего агента больше 1,4 эквивалентов в расчете на 1-пальмитоилглицерин, образовавшийся 1-пальмитоил-3-ацетилглицерин ацетилируется далее с образованием 1-пальмитоил-2,3-диацетилглицерина, что может привести к снижению выхода 1-пальмитоил-3-ацетилглицерина.
Реакция ацетилирования может быть осуществлена в растворителе и в присутствии органического основания. Примеры органических оснований включают пиридин и т.п. Количество органического основания составляет 1,3-5 эквивалентов, предпочтительно 2-4,5 эквивалента, предпочтительнее 3-4 эквивалента относительно 1-пальмитоилглицерина. Когда количество органического основания меньше 1,3 эквивалентов в расчете на 1-пальмитоилглицерин, кислоты, образовавшиеся во время реакции ацетилирования, могут быть нейтрализованы не полностью. Когда количество органического основания превышает 5 эквивалентов в расчете на 1-пальмитоилглицерин, не достигается никаких дополнительных преимуществ. Примеры растворителей включают неполярные и апротонные растворители, такие как дихлорметан, ацетон, этилацетат, их смеси и т.п., и предпочтительно включают дихлорметан. Количество растворителя составляет 5-10 крат, предпочтительно 8-10 крат по объему относительно массы 1-пальмитоилглицерина (объем/масса). Когда количество растворителя слишком мало, реакционная смесь может перемешиваться неравномерно из-за соли, оседающей во время реакции. Когда количество растворителя слишком велико, не достигается никаких дополнительных преимуществ.
На следующей стадии с целью выделения 1-пальмитоил-3-ацетилглицерина реакционную смесь кристаллизуют в насыщенном углеводородном растворителе, имеющем 5-7 атомов углерода. Когда реакционную смесь, включающую 1-пальмитоил-3-ацетилглицерин и побочный продукт 1-пальмитоил-2,3-диацетилглицерин, растворяют в насыщенном углеводородном растворителе, имеющем 5-7 атомов углерода (например, пентане, гексане, гептане и т.п., предпочтительно гексане), и смесь охлаждают до температуры кристаллизации 0-15°C, предпочтительно 5-10°C, 1-пальмитоил-2,3-диацетилглицерин, имеющий высокую растворимость в растворителе, остается в растворе, а 1-пальмитоил-3-ацетилглицерин выкристаллизовывается в чистой форме. Кристаллизованный 1-пальмитоил-3-ацетилглицерин отфильтровывают и получают 1-пальмитоил-3-ацетилглицерин, который при комнатной температуре находится в твердой форме, с относительно высоким выходом (например, 60-65%) и с высокой чистотой с использованием простого процесса. Полученный 1-пальмитоил-3-ацетилглицерин не содержит примесей, образующих побочные продукты при синтезе 1-пальмитоил-2-линолеоил-3-ацетилглицерина. Количество насыщенного углеводорода составляет 2,5-5 крат, предпочтительно 3-4 крат по объему относительно массы реакционной смеси (объем/масса). Когда количество растворителя насыщенного углеводорода слишком мало, реакционную смесь трудно перемешивать в процессе кристаллизации. Когда количество растворителя насыщенного углеводорода слишком велико, выход 1-пальмитоил-3-ацетилглицерина может снизиться.
Для того чтобы получить 1-пальмитоил-2-линолеоил-3-ацетилглицерин приведенной далее формулы 3 по настоящему изобретению (a) получают 1-пальмитоил-3-ацетилглицерин формулы 1 вышеописанным способом получения 1-пальмитоил-3-ацетилглицерина, (b) в присутствии органического основания линолевую кислоту и пивалоилхлорид вводят во взаимодействие в неполярном органическом растворителе, и получают смешанный ангидрид (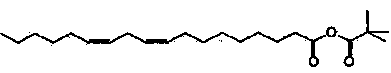 ), который является активной формой линолевой кислоты, (c) в присутствии 4-метиламинопиридина (DMAP) 1-пальмитоил-3-ацетилглицерин формулы 1 и смешанный ангидрид вводят во взаимодействие и получают 1-пальмитоил-2-линолеоил-3-ацетилглицерин приведенной далее формулы 3.
), который является активной формой линолевой кислоты, (c) в присутствии 4-метиламинопиридина (DMAP) 1-пальмитоил-3-ацетилглицерин формулы 1 и смешанный ангидрид вводят во взаимодействие и получают 1-пальмитоил-2-линолеоил-3-ацетилглицерин приведенной далее формулы 3.
Формула 3
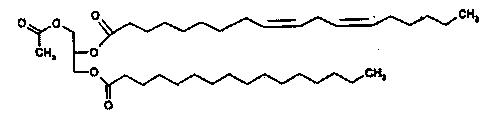
Соединение приведенной выше формулы 3 представляет собой рацемическое или оптически активное соединение.
Стадию взаимодействия линолевой кислоты и пивалоилхлорида (стадию (b)) можно легко осуществить в обычном неполярном органическом растворителе, но предпочтительно ее осуществляют в насыщенном углеводородном растворителе, имеющем 5-7 атомов углерода, таком как пентан, гексан, гептан, их смесь и т.п., учитывая легкость очистки продукта и возможность присутствия остаточного растворителя в продукте. Органическое основание используют для нейтрализации хлороводородной кислоты (HCl), образовавшейся при взаимодействии линолевой кислоты и пивалоилхлорида, и для нейтрализации пиваловой кислоты, образовавшейся при взаимодействии смешанного ангидрида и 1-пальмитоил-3-ацетилглицерина. Примеры органических оснований включают триэтиламин и т.п.
На стадии взаимодействия линолевой кислоты и пивалоилхлорида (стадия (b)) количество линолевой кислоты составляет 1-1,05 эквивалента, предпочтительно 1,01-1,04 эквивалента относительно 1-пальмитоил-3-ацетилглицерина. Количество пивалоилхлорида меньше количества линолевой кислоты или равно ему. Например, количество пивалоилхлорида составляет 0,97-1 эквивалент, предпочтительно 0,98-0,99 эквивалентов относительно линолевой кислоты. Когда количество линолевой кислоты меньше 1 эквивалента относительно 1-пальмитоил-3-ацетилглицерина в ходе получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина может остаться непрореагировавший 1-пальмитоил-3-ацетилглицерин. Когда количество линолевой кислоты превышает 1,05 эквивалентов в расчете на 1-пальмитоил-3-ацетилглицерин, не достигаются никакие дополнительные преимущества, и может быть затруднено удаление остаточной (непрореагировавшей) линолевой кислоты. Когда количество пивалоилхлорида выходит из указанного выше интервала, пивалоилхлорид взаимодействует с 1-пальмитоил-3-ацетилглицерином с образованием побочных продуктов, или может быть затруднено удаление непрореагировавшей линолевой кислоты. Количество органического основания составляет 2-3 эквивалента, предпочтительно 2,1-2,3 эквивалента относительно 1-пальмитоилглицерина. Когда количество органического основания выходит из указанного выше интервала, может быть затруднена нейтрализация хлороводородной кислоты (HCl) и пиваловой кислоты, образующихся в ходе реакции, и никаких дополнительных преимуществ не достигается. Количество неполярного органического растворителя составляет 1-15 крат, предпочтительно 11-12 крат по объему относительно массы 1-пальмитоил-3-ацетилглицерина (объем/масса). Когда количество неполярного органического растворителя меньше 10 крат по объему относительно массы 1-пальмитоил-3-ацетилглицерина, может быть затруднено перемешивание реакционной смеси. Когда количество неполярного органического растворителя больше 15 крат по объему относительно массы 1-пальмитоил-3-ацетилглицерина, никаких дополнительных преимуществ не достигается.
Взаимодействие линолевой кислоты и пивалоилхлорида (стадия (b)) осуществляют при температуре 15-25°C, предпочтительно при температуре 20-24°C, и время взаимодействия составляет 30-60 минут, предпочтительно 40-50 минут. Когда температура реакции и время реакции выходят за вышеуказанные пределы, реакция может протекать медленно или же могут оставаться непрореагировавшие соединения, в то время как никаких дополнительных преимуществ не достигается.
Стадию взаимодействия смешанного ангидрида и 1-пальмитоил-3-ацетилглицерина (стадию (c)) осуществляют путем добавления 1-пальмитоил-3-ацетилглицерина и катализатора 4-диметиламинопиридина (DMAP) к реакционной смеси, включающей смешанный ангидрид, и проведения реакции смешанного ангидрида и 1-пальмитоил-3-ацетилглицерина при температуре 20-40°C, предпочтительно 25-35°C, в течение 4-10 часов, предпочтительно 5-6 часов. 1-Пальмитоил-2-линолеоил-3-ацетилглицерин формулы 3, полученный на вышеуказанной стадии, можно получить с высокой чистотой - свыше 98%, и с высоким выходом - свыше 70%, с использованием простого способа очистки путем обычных экстракции и адсорбции, не проводя очистки с использованием колоночной хроматографии.
Количество 4-диметиламинопиридина составляет 1-10 мольных частей, предпочтительно 1,1-5 мольных частей на 100 мольных частей 1-пальмитоил-3-ацетилглицерина. Когда количество 4-диметиламинопиридина меньше 1 мольной части на 100 мольных частей 1-пальмитоил-3-ацетилглицерина, реакция может не протекать или протекать медленно. Когда количество 4-диметиламинопиридина превышает 10 мольных частей, никаких дополнительных преимуществ не достигается. Когда температура реакции ниже 20°C, реакция осуществляется медленно. Когда температура реакции выше 40°C, могут образовываться побочные продукты, а дополнительные преимущества отсутствуют. Кроме того, когда время реакции менее 4 часов, реакция может пройти не полностью и могут остаться непрореагировавшие соединения. Когда время реакции превышает 10 часов, никаких дополнительных преимуществ не достигается.
Далее приведены предпочтительные примеры, предназначенные для более полного понимания настоящего изобретения. Следующие далее примеры приводятся только для иллюстрации настоящего изобретения, и настоящее изобретение не ограничивается приведенными примерами.
Пример 1. Получение рац-1-пальмитоил-3-ацетилглицерина
Рац-1-пальмитоилглицерин (250,0 г) добавляют в дихлорметан (2500 мл), и к смеси добавляют пиридин (183,4 мл). Температуру реакционной смеси повышают до 34-35°C для полного растворения рац-1-пальмитоилглицерина, и температуру снова понижают до 25°C. К реакционной смеси при 20-25°C постепенно добавляют ацетилхлорид (77,2 г), и осуществляют реакцию в течение 1 часа при перемешивании. По завершении реакции к смеси добавляют воду (H2O, 1250 мл) и концентрированную хлороводородную кислоту (к-HCl, 125,8 мл) для регулирования pH на уровне примерно 2-3 и для стимулирования разделения фаз. Органический слой отделяют, и к органическому слою добавляют безводный сульфат магния (MgSO4, 28 г) и перемешивают в течение 10 минут. Затем сульфат магния удаляют фильтрацией, и фильтрат концентрируют при пониженном давлении. К остатку добавляют гексан (845 мл), остаток охлаждают до 0-5°C и перемешивают для выпадения в осадок кристаллического соединения. После выдерживания кристаллического соединения в течение примерно 30 минут кристаллическое соединение отфильтровывают и сушат при 30°C, и получают рац-1-пальмитоил-3-ацетилглицерин (172,25 г). {Выход 61%, т.пл. 42~43,5°C. 1H ЯМР (250 МГц, CDCl3): δ 0,88 (τ, J=7,5 Гц, 3H), 1,16-1,25 (м, 24H), 1,62 (м, 2H), 2,06 (с, 3H), 2,37 (т, J=7,5 Гц, 2H), 2,43 (д, J=4,25 Гц, 1H), 4,03-4,21 (м, 5H)}.
Пример 2. Получение (R)-1-пальмитоил-3-ацетилглицерина
За исключением использования (R)-1-пальмитоилглицерина вместо рац-1-пальмитоилглицерина, (R)-1-пальмитоил-3-ацетилглицерин получают так же, как в примере 1. {Выход 60%, т.пл. 37~37,5°C. [α]D=-0,83 (c=0,65, EtOH), 1H ЯМР (250 МГц, CDCl3): δ 0,88 (τ, J=7,5 Гц, 3H), 1,17-1,25 (м, 24H), 1,62 (м, 2H), 2,07 (с, 3H), 2,37 (т, J=7,5 Гц, 2H), 2,43 (д, J=4,25 Гц, 1H), 4,03-4,22 (м, 5H)}.
Пример 3. Получение рац-1-пальмитоил-2-линолеоил-3-ацетилглицерина К гексану (28,9 мл) добавляют линолевую кислоту (99%, 2,89 г) и пивалоилхлорид (1,262 мл), и к раствору при температуре 20-25°C постепенно добавляют триэтиламин (2,857 мл). Реакционную смесь перемешивают в течение 30 минут, и получают смешанный ангидрид. После добавления к реакционной смеси, включающей смешанный ангидрид, рац-1-пальмитоил-3-ацетилглицерина (3,726 г), полученного в примере 1, и 4-диметиламинопиридина (DMAP, 61 мг), реакционную смесь перемешивают в течение 6 часов при 25-35°C, выполняют процесс очистки, такой как экстракция и адсорбция, и получают рац-1-пальмитоил-2-линолеоил-3-ацетилглицерин (4,63 г, выход 72,9%).
Пример 4. Получение (R)-1-пальмитоил-2-линолеоил-3-ацетилглицерина
За исключением использования вместо рац-1-пальмитоил-3-ацетилглицерина (R)-1-пальмитоил-3-ацетилглицерина, полученного в примере 2, (R)-1-пальмитоил-2-линолеоил-3-ацетилглицерин получают так же, как в примере 3 (выход 70,39%).
Изобретение относится к способу получения 1-пальмитоил-3-ацетилглицерина, включающему стадии получения реакционной смеси, включающей 1-пальмитоил-3-ацетилглицерин формулы 1, путем взаимодействия 1-пальмитоилглицерина формулы 2, и ацетилирующего агента; и выделения 1-пальмитоил-3-ацетилглицерина путем кристаллизации реакционной смеси в насыщенном углеводородном растворителе, имеющем 5-7 атомов углерода; где количество ацетилирующего агента составляет 1,3-1,4 эквивалента в расчете на 1-пальмитоилглицерин, причем соединения формул 1 и 2 являются рацемическими или оптически активными соединениями. Изобретение также относится к способу получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина, включающему стадии получения реакционной смеси, включающей 1-пальмитоил-3-ацетилглицерин формулы 1, путем взаимодействия 1-пальмитоилглицерина формулы 2 и ацетилирующего агента; выделения 1-пальмитоил-3-ацетилглицерина путем кристаллизации реакционной смеси в насыщенном углеводородном растворителе, имеющем 5-7 атомов углерода, получения смешанного ангидрида путем взаимодействия линолевой кислоты и пивалоилхлорида в неполярном органическом растворителе в присутствии органического основания; и получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина формулы 3 путем взаимодействия 1-пальмитоил-3-ацетилглицерина и указанного смешанного ангидрида в присутствии 4-диметиламинопиридина; где количество ацетилирующего агента составляет 1,3-1,4 эквивалента в расчете на 1-пальмитоилглицерин, причем соединения приведенных выше формул 1, 2 и 3 являются рацемическими или оптически активными соединениями. Способы позволяют получать 1-пальмитоил-3-ацетилглицерин с высокой чистотой и с высоким выходом без очистки с использованием колоночной хроматографии, а также 1-пальмитоил-2-линолеоил-3-ацетилглицерин с высокой чистотой и с высоким выходом.
2 н. и 6 з.п. ф-лы, 4 пр.
1. Способ получения 1-пальмитоил-3-ацетилглицерина, включающий стадии:
получения реакционной смеси, включающей 1-пальмитоил-3-ацетилглицерин
формулы 1,

путем взаимодействия 1-пальмитоилглицерина формулы 2,

и ацетилирующего агента; и
выделения 1-пальмитоил-3-ацетилглицерина путем кристаллизации реакционной смеси в насыщенном углеводородном растворителе, имеющем 5-7 атомов углерода;
где количество ацетилирующего агента составляет 1,3-1,4 эквивалента в расчете на 1-пальмитоилглицерин,
причем соединения формул 1 и 2 являются рацемическими или оптически активными соединениями.
2. Способ получения 1-пальмитоил-3-ацетилглицерина по п. 1, в котором ацетилирующий агент выбирают из группы, состоящей из ацетилхлорида, ацетилбромида и их смесей.
3. Способ получения 1-пальмитоил-3-ацетилглицерина по п. 1, в котором количество насыщенного углеводородного растворителя составляет 2,5-5 крат по объему относительно массы реакционной смеси (объем/масса), и температура кристаллизации составляет 0-15°C.
4. Способ получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина, включающий стадии:
получения реакционной смеси, включающей 1-пальмитоил-3-ацетилглицерин формулы 1,
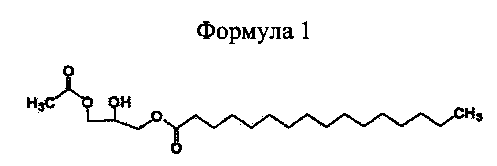
путем взаимодействия 1-пальмитоилглицерина формулы 2
и ацетилирующего агента;
выделения 1-пальмитоил-3-ацетилглицерина путем кристаллизации реакционной смеси в насыщенном углеводородном растворителе, имеющем 5-7 атомов углерода,
получения смешанного ангидрида путем взаимодействия линолевой кислоты и пивалоилхлорида в неполярном органическом растворителе в присутствии органического основания; и
получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина формулы 3

путем взаимодействия 1-пальмитоил-3-ацетилглицерина и указанного смешанного ангидрида в присутствии 4-диметиламинопиридина;
где количество ацетилирующего агента составляет 1,3-1,4 эквивалента в расчете на 1-пальмитоилглицерин,
причем соединения приведенных выше формул 1, 2 и 3 являются рацемическими или оптически активными соединениями.
5. Способ получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина по п. 4, в котором ацетилирующий агент выбирают из группы, состоящей из ацетилхлорида, ацетилбромида и их смесей.
6. Способ получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина по п. 4, в котором количество насыщенного углеводородного растворителя составляет 2,5-5 крат по объему относительно массы реакционной смеси (объем/масса), и температура кристаллизации составляет 0-15°C.
7. Способ получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина по п. 4, в котором количество линолевой кислоты составляет 1-1,05 эквивалентов относительно 1-пальмитоил-3-ацетилглицерина, количество пивалоилхлорида составляет 0,97-1 эквивалент относительно линолевой кислоты, количество органического основания составляет 2-3 эквивалента относительно 1-пальмитоилглицерина, количество неполярного органического растворителя составляет 10-15 крат по объему относительно массы 1-пальмитоил-3-ацетилглицерина, и количество 4-диметиламинопиридина составляет 1-10 мольных частей на 100 мольных частей 1-пальмитоил-3-ацетилглицерина.
8. Способ получения 1-пальмитоил-2-линолеоил-3-ацетилглицерина по п. 4, в котором органическое основание представляет собой триэтиламин, а неполярный органический растворитель выбирают из группы, состоящей из насыщенных углеводородных растворителей, имеющих 5-7 атомов углерода, и их смесей.
| С.В | |||
| Пономарева и др | |||
| "Техника эксперимента в органической химии" методическое пособие, Москва, 1998, найдено в Интернет http://www.chem.msu.su/rus/teaching/ponomar/glava3.html#1 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| So-Yeop Han et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2015-10-27—Публикация
2012-09-24—Подача