Настоящее изобретение относится к защищенной от применения не по назначению пероральной лекарственной форме с контролируемым высвобождением действующего вещества, представляющего собой (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, для однократного приема в сутки, которая содержит указанное действующее вещество и/или одну или несколько его фармацевтически приемлемых солей и/или производных (А), по меньшей мере один синтетический или природный полимер (В), необязательно образующие замедляющую высвобождение действующего вещества матрицу материалы, необязательно физиологически совместимые вспомогательные вещества (Б) и необязательно воск (Г) и в которой компонент (В) и возможно присутствующий компонент (Г) обладают сопротивлением разрушению по меньшей мере по 500 Н.
Подобное действующее вещество наряду со своим исключительно высоким болеутоляющим действием потенциально является также объектом его немедицинского употребления, т.е. оно может использоваться с целью вызвать эффекты, не соответствующие его применению по прямому назначению. Так, например, это действующее вещество используется пристрастившимися к нему или злоупотребляющими им людьми с целью вызвать подобные опьянению эйфорические состояния.
Подобные содержащие указанное действующее вещество лекарственные формы часто используют при длительных курсах лечения, например, при обусловленных опухолями болях или хронических болях. Важное значение прежде всего при длительном лечении имеет обеспечение пациенту хорошего качества жизни. К мерам, призванным повысить качество жизни пациента, относится помимо прочего применение лекарственных форм, допускающих возможность их однократного приема в сутки. Однако такие лекарственные формы с замедленным высвобождением из них действующего вещества (ретард-формы или дюрантные препараты) из-за относительно высокого содержания в них действующего вещества особо привлекательны для пристрастившихся к нему или злоупотребляющих им людей, стремящихся максимально быстро вызвать у себя желаемые, подобные опьянению эйфорические состояния.
Поскольку, однако, лекарственные ретард-формы, которые содержат указанное действующее вещество, потенциально являющееся объектом его немедицинского употребления, даже при их пероральном приеме в преднамеренно больших количествах обычно не приводят к требуемому результату, в частности наступлению так называемого "кайфа", такие лекарственные формы, например, в виде таблеток или капсул, в целях их немедицинского употребления измельчают, например, в ступке, и вдыхают полученный порошок либо из полученного таким путем порошка экстрагируют действующее вещество с помощью преимущественно водной жидкости и полученный раствор, иногда после его фильтрации через вату или целлюлозу, вводят себе парентерально, обычно внутривенно. При введении действующего вещества в организм таким способом по сравнению с пероральным приемом, а также по сравнению с вдыханием действующего вещества в немедицинских целях дополнительно ускоряется его поступление ("приток") в организм с достижением требуемого результата, а именно: наступлением так называемого быстрого "прихода" или "кайфа".
Для предотвращения немедицинского употребления лекарственных действующих веществ в US 4070494 было предложено добавлять к лекарственной форме набухающее вещество. Такое вещество при добавлении воды для экстракции содержащегося в лекарственной форме действующего вещества набухает, образуя гель, который связывает действующее вещество, количество которого в отделенном от геля фильтрате в результате оказывается лишь на незначительном уровне.
Еще один подход по предотвращению немедицинского употребления действующих веществ путем их парентерального введения в организм предложен в публикации WO 95/20947, в которой описана многослойная таблетка, которая по отдельности содержит в разных ее слоях действующее вещество, потенциально являющееся объектом его немедицинского употребления, и по меньшей мере один гелеобразователь.
Другой подход по предотвращению немедицинского употребления действующих веществ путем их парентерального введения в организм предложен в публикации WO 03/015531 А2. В этой публикации описана лекарственная форма, содержащая аналгетический опиоид и краситель в качестве аверсивного (вызывающего отвращение) средства. Благодаря такому красителю лекарственная форма при совершении с ней недопустимых манипуляций окрашивается в цвет, при виде которого человек должен воздерживаться от дальнейшего применения такой лекарственной формы.
Еще одна известная возможность, призванная затруднить немедицинское употребление действующих веществ, заключается в добавлении к лекарственной форме антагониста действующего вещества, например, налоксона или налтексона, или средств, которые вызывают физиологические защитные реакции, например, корня ипекакуаны, иначе называемого рвотным корнем.
Поскольку, однако, лекарственные формы с контролируемым высвобождением действующего вещества для возможности его введения в организм в немедицинских целях в большинстве случаев требуется, как и ранее, измельчать в порошок, в основу настоящего изобретения была положена задача осложнить предшествующее немедицинскому применению действующего вещества измельчение в порошок лекарственной формы с контролируемым высвобождением (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола обычно имеющимися в распоряжении подручными средствами, соответственно воспрепятствовать подобному измельчению лекарственной формы и тем самым предложить лекарственную форму для указанного действующего вещества, которая при ее применении по прямому назначению проявляла бы требуемое терапевтическое действие при ее однократном приеме в сутки, но содержащееся в которой действующее вещество невозможно было бы перевести в пригодную для его немедицинского введения в организм форму путем простого измельчения такой лекарственной формы в порошок.
Указанная задача решается с помощью предлагаемой в изобретении, защищенной от применения не по назначению, пероральной лекарственной формы с контролируемым высвобождением (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола для однократного приема в сутки, которая наряду с действующим веществом и/или одним или несколькими его фармацевтически приемлемыми соединениями, предпочтительно солями, сольватами или производными, предпочтительно сложными эфирами, простыми эфирами или амидами, а также соответствующими стереоизомерами и/или их соответствующими фармацевтически приемлемыми соединениями или производными (А) содержит по меньшей мере один синтетический и/или природный полимер (В), по меньшей мере одно замедляющее высвобождение действующего вещества вспомогательное вещество (Д), необязательно по меньшей мере одно другое физиологически совместимое вспомогательное вещество (Б) и необязательно воск (Г) и в которой компонент (В) и возможно присутствующий компонент (Г) обладают сопротивлением разрушению по меньшей мере по 500 Н, предпочтительно по меньшей мере по 750 Н.
Благодаря применению компонента (В) и необязательно компонента (Г) с указанным минимальным сопротивлением разрушению (измеряемым по описанной ниже методике), предпочтительно в таких количествах, при которых и лекарственная форма имеет такое же минимальное сопротивление разрушению, составляющее по меньшей мере 500 Н, предпочтительно по меньшей мере 750 Н, удается воспрепятствовать измельчению лекарственной формы в порошок с помощью обычных подручных средств и тем самым значительно затруднить, соответственно пресечь последующее применение содержащегося в ней действующего вещества не по назначению, предпочтительно его немедицинского употребления путем назального или парентерального введения в организм.
Обусловлено это тем, что без достаточного измельчения лекарственной формы исключается возможность безопасного парентерального, прежде всего внутривенного, или назального введения содержащегося в ней действующего вещества в организм либо экстракция из нее содержащегося в ней действующего вещества продолжается слишком долго, соответственно при ее пероральном приеме в немедицинских целях не происходит или происходит лишь недостаточное наступление "кайфа" из-за отсутствия спонтанного высвобождения из нее действующего вещества.
Под измельчением лекарственной формы в порошок согласно настоящему изобретению подразумевается ее измельчение до порошкообразного состояния обычными, имеющимися в распоряжении подручными средствами, такими, например, как ступка и пестик, молоток, колотушка или иные обиходные средства, позволяющие с приложением соответствующего усилия измельчать твердые материалы в порошок.
В соответствии с этим предлагаемая в изобретении лекарственная форма пригодна для предотвращения применения (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола не по назначению путем его парентерального, назального и/или перорального введения в организм. Указанное действующее вещество известно как обладающее аналгетическим действием лекарственное вещество из ЕР 0693475 А1.
Действующее вещество (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол может при этом использоваться как таковое, т.е. в виде свободного основания, или же в виде одной из его фармацевтически приемлемых солей, сольватов, фармацевтически приемлемого производного, прежде всего амида, сложного эфира или простого эфира, и/или соответствующих стереоизомеров и/или их соответствующих фармацевтически приемлемых соединений. Способ получения этого действующего вещества также известен из ЕР 0693475 А1.
Содержание действующего вещества в предлагаемой в изобретении лекарственной форме предпочтительно должно составлять от 0,5 до 80 мас.%, более предпочтительно от 10 до 40 мас.%, наиболее предпочтительно от 5 до 50 мас.%.
Обычно предлагаемая в изобретении лекарственная форма содержит (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол как таковой и/или в виде его фармацевтически приемлемого соединения в количестве от 2,5 до 1000 мг, прежде всего от 5 до 800 мг, наиболее предпочтительно от 5 до 600 мг, в пересчете на (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол и на одну дозированную лекарственную форму, соответственно на одну дозированную единицу.
К фармацевтически приемлемым солям действующего вещества согласно изобретению относятся соли, физиологически совместимые при их фармацевтическом применении, прежде всего при их соответствующем назначению введении в организм млекопитающих или человека, прежде всего человека. В качестве таких фармацевтически приемлемых солей могут использоваться, например, соли с неорганическими или органическими кислотами, такие как предпочтительно гидрохлорид, гидробромид, сахаринат, сульфат, а также соль с метансульфоновой кислотой, муравьиной кислотой, уксусной кислотой, щавелевой кислотой, янтарной кислотой, винной кислотой, миндальной кислотой, фумаровой кислотой, молочной кислотой, лимонной кислотой, глутаминовой кислотой и/или аспарагиновой кислотой, а наиболее предпочтительно использовать в качестве соли гидрохлорид.
Для придания предлагаемой в изобретении лекарственной форме необходимого сопротивления разрушению используют по меньшей мере один синтетический, полусинтетический и/или природный полимер (В) с сопротивлением разрушению, измеренным в соответствии с представленной ниже в настоящем описании методикой, по меньшей мере 500 Н, предпочтительно 750 Н. В предпочтительном варианте для этого используют по меньшей мере один полимер, выбранный из группы, включающей полиалкиленоксиды, предпочтительно полиметиленоксид, полиэтиленоксид и полипропиленоксид, полиолефины, предпочтительно полиэтилен и полипропилен, поливинилхлорид, поликарбонаты, полистиролы, поли(мет)акрилаты, их сополимеры и смеси по меньшей мере двух представителей указанных выше классов полимеров или смеси по меньшей мере двух указанных полимеров. Особенно предпочтительно применять растворимый или набухающий в воде полимер. Предпочтительны при этом высокомолекулярные, термопластичные полиалкиленоксиды. Наиболее предпочтительны полиэтиленоксиды с молекулярной массой, определенной путем реологических измерений, по меньшей мере 0,5 млн, предпочтительно по меньшей мере 1 млн, наиболее предпочтительно от 1 до 15 млн. Вязкость таких полимеров при 25°С при измерении на 5%-ном по массе водном растворе полимера с помощью вискозиметра Брукфилда, модель RVF (шпиндель № 2, скорость вращения 2 об/мин), составляет от 4500 до 17600 сП, при измерении на 2%-ном по массе водном растворе полимера с помощью указанного вискозиметра (но с использованием шпинделя № 1, соответственно 3 и при скорости его вращения 10 об/мин) составляет от 400 до 4000 сП, соответственно при измерении на 1%-ном по массе водном растворе полимера с помощью указанного вискозиметра (но с использованием шпинделя №2 и при скорости его вращения 2 об/мин) составляет от 1650 до 10000 сП (см. Handbook of Pharmaceutical Excipients, Raymond С.Rowe и др., 4-е изд., 2003, с.460).
Для приготовления предлагаемой в изобретении лекарственной формы подобные полимеры предпочтительно использовать в виде порошков. Они могут быть растворимыми или набухающими в воде.
Компонент (В) предпочтительно использовать в количестве от 20 до 99,9 мас.%, более предпочтительно в количестве по меньшей мере 35 мас.%, наиболее предпочтительно в количестве по меньшей мере 50 мас.%, в пересчете на всю массу лекарственной формы.
В качестве вспомогательных веществ (Б) можно использовать обычно применяемые при приготовлении твердых лекарственных форм вспомогательные вещества. В предпочтительном варианте к ним относятся пластификаторы, такие как полиэтиленгликоль, вспомогательные вещества, влияющие на высвобождение действующего вещества, о чем более подробно сказано ниже, предпочтительно гидрофобные или гидрофильные, более предпочтительно гидрофильные, полимеры, наиболее предпочтительно гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза, и/или антиокислители. Для применения в качестве антиокислителей пригодны аскорбиновая кислота, бутилгидроксианизол, бутилгидрокситолуол, соли аскорбиновой кислоты, монотиоглицерин, фосфористая кислота, витамин С, витамин Е и его производные, бисульфит натрия, наиболее предпочтительно бутилгидрокситолуол (БГТ) или бутилгидроксианизол (БГА) и α-токоферол.
Антиокислитель предпочтительно использовать в количестве от 0,01 до 10 мас.%, более предпочтительно от 0,03 до 5 мас.%, в пересчете на всю массу лекарственной формы.
Для придания предлагаемой в изобретении лекарственной форме необходимого сопротивления разрушению наряду с указанными выше полимерами дополнительно можно использовать, кроме того, по меньшей мере один природный, полусинтетический или синтетический воск (Г) с сопротивлением разрушению, измеренным в соответствии с представленной ниже в настоящем описании методикой, по меньшей мере 500 Н, предпочтительно 750 Н. Предпочтительны при этом воски с температурой размягчения, составляющей по меньшей мере 60°С. Более предпочтительны карнаубский воск и пчелиный воск. Наиболее предпочтителен карнаубский воск. Карнаубский воск представляет собой природный воск, который получают из листьев карнаубы (восконосной пальмы) и температура размягчения которого составляет по меньшей мере 90°С. Восковой компонент при его дополнительном использовании предпочтительно применять совместно с по меньшей мере одним полимером (В), предпочтительно полиэтиленоксидом, в таких количествах, чтобы сопротивление лекарственной формы разрушению, измеренное в соответствии с представленной ниже в настоящем описании методикой, составляло по меньшей мере 500 Н, предпочтительно по меньшей мере 750 Н.
Предлагаемые в изобретении лекарственные формы отличаются тем, что их благодаря их твердости невозможно измельчить в порошок обычными, имеющимися в распоряжении подручными средствами, такими как ступка и пестик. Тем самым практически полностью исключается возможность немедицинского употребления содержащегося в них действующего вещества путем его перорального, парентерального, прежде всего внутривенного, или назального введения в организм. Вместе с тем предлагаемые в изобретении лекарственные формы с целью предотвратить любое их возможное применение не по назначению в одном из предпочтительных вариантов могут содержать в качестве вспомогательных веществ (Б) дополнительные затрудняющие, соответственно предотвращающие немедицинское употребление входящего в их состав действующего вещества средства.
Так, в частности, предлагаемая в изобретении, защищенная от применения не по назначению лекарственная форма наряду с входящим согласно изобретению в ее состав действующим веществом, по меньшей мере одним полимером (В) и возможно по меньшей мере одним воском (Г) может также содержать в качестве вспомогательных веществ (Б) по меньшей мере один из следующих компонентов (а)-(е):
(а) по меньшей мере одно раздражающее полость носа и/или глотки вещество,
(б) по меньшей мере одно повышающее вязкость средство (загуститель), которое в извлеченном из лекарственной формы с помощью минимально необходимого количества водной жидкости экстракте, предпочтительно в виде извлеченного из лекарственной формы водного экстракта, образует гель, который в предпочтительном варианте при его добавлении в дополнительное количество водной жидкости остается визуально различим,
(в) по меньшей мере один антагонист для применяемого действующего вещества,
(г) по меньшей мере одно рвотное средство,
(д) по меньшей мере один краситель в качестве аверсивного средства,
(е) по меньшей мере одно горькое вещество.
Каждый из вышеуказанных компонентов (а)-(е) индивидуально пригоден для дополнительной защиты предлагаемой в изобретении лекарственной формы от применения не по назначению. Так, в частности, компонент (а) предпочтительно использовать для защиты лекарственной формы от немедицинского употребления содержащегося в ней действующего вещества путем его назального, перорального и/или парентерального, предпочтительно внутривенного, введения в организм, компонент (б) предпочтительно использовать в целях воспрепятствовать немедицинскому употреблению действующего вещества путем его парентерального, преимущественно внутривенного, и/или назального введения в организм, компонент (в) предпочтительно использовать для защиты от немедицинского употребления действующего вещества путем его назального и/или парентерального, преимущественно внутривенного, введения в организм, компонент (г) предпочтительно использовать для защиты от немедицинского употребления действующего вещества путем его парентерального, преимущественно внутривенного, и/или перорального и/или назального введения в организм, компонент (д) предпочтительно использовать в качестве визуального отталкивающего средства для защиты от немедицинского употребления действующего вещества путем его перорального или парентерального введения в организм, а компонент (е) предпочтительно использовать для защиты от немедицинского употребления действующего вещества путем его перорального или назального введения в организм. Предлагаемое в изобретении использование по меньшей мере одного из указанных выше компонентов в дополнение к остальным ингредиентам предлагаемых в изобретении лекарственных форм позволяет дополнительно осложнить их применение не по назначению.
В одном из вариантов предлагаемая в изобретении лекарственная форма может также содержать комбинацию из двух или более компонентов (а)-(е), предпочтительно комбинацию из компонентов (а), (б) и необязательно (в) и/или (е) и/или (д), соответственно из компонентов (а), (б) и необязательно (г) и/или (е) и/или (д).
В другом варианте предлагаемая в изобретении лекарственная форма может содержать все компоненты (а)-(е).
Если предлагаемая в изобретении лекарственная форма содержит в качестве дополнительной ее защиты от применения не по назначению компонент (а), то в качестве раздражающих полость носа и/или глотки веществ согласно изобретению могут использоваться все те вещества, которые при соответствующем попадании в организм через полость носа и/или глотки провоцируют ответную реакцию организма, которая либо проявляется в возникновении столь неприятных ощущений, например, жжения, что пропадает дальнейшее желание или становится невозможным продолжить введение соответствующего действующего вещества в организм, либо на физиологическом уровне препятствует приему соответствующего действующего вещества, например, проявляется в повышенном выделении носового секрета или чиханье. Подобные, обычно раздражающие полость носа и/или глотки вещества и при их парентеральном, прежде всего внутривенном, попадании в организм вызывают очень неприятные ощущения вплоть до появления невыносимых болей, отбивая всякое желание или делая невозможным дальнейшее введение соответствующего действующего вещества в организм.
К наиболее пригодным для применения в предусмотренных изобретением целях раздражающим полость носа и/или глотки веществам относятся вещества, которые вызывают жжение, зуд, позыв к чиханию, повышенное выделение секрета или одновременно оказывают по меньшей мере два таких раздражающих действия. Соответствующие вещества и их обычно применяемые количества известны специалистам в данной области либо могут быть определены путем проведения простых предварительных опытов.
Основу раздражающего полость носа и/или глотки вещества, используемого в качестве компонента (а), предпочтительно составляет одно или несколько раздражающих ("жгучих") веществ из по меньшей мере одного содержащего его(их) лекарственного или употребляемого в пищу растения либо одна или несколько содержащих его(их) частей такого растения.
Соответствующие лекарственные или употребляемые в пищу растения, содержащие раздражающие вещества, известны специалистам в данной области и описаны, например, в книге "Pharmazeutische Biologic - Drogen und ihre Inhaltsstoffe", Prof. Dr.Hildebert Wagner, 2-е, переработанное, изд., изд-во Gustav Fischer Verlag, Stuttgart-New York, 1982, c.82 и далее. Соответствующие разделы этой книги тем самым включены в настоящее описание в качестве ссылки и являются его частью.
Под лекарственной формой подразумевается отдельная, соответственно отделяемая разовая дозированная форма (дозированная единица), как, например, таблетка или капсула.
В предпочтительном варианте к предлагаемой в изобретении лекарственной форме можно добавлять в качестве компонента (а) одно или несколько раздражающих веществ из по меньшей мере одного соответствующего содержащего его(их) лекарственного или употребляемого в пищу растения, выбранного из группы, включающей Allii sativi Bulbus, Asari Rhizoma c. Herba, Calami Rhizoma, Capsici Fructus (стручковый перец), Capsici Fructus acer (кайенский перец), Curcumae longae Rhizoma, Curcumae xanthorrhizae Rhizoma, Galangae Rhizoma, Myristicae Semen, Piperis nigri Fructus (перец), Sinapis albae (Erucae) Semen, Sinapis nigri Semen, Zedoariae Rhizoma и Zingiberis Rhizoma, наиболее предпочтительно из группы, включающей Capsici Fructus (стручковый перец), Capsici Fructus acer (кайенский перец) и Piperis nigri Fructus (перец).
Под раздражающими веществами из содержащих их лекарственных или употребляемых в пищу растений предпочтительно подразумеваются о-метокси(метил)фенольные соединения, амиды кислот, горчичные масла или сульфидные соединения либо их производные.
По меньшей мере одно раздражающее вещество из содержащих его лекарственных или употребляемых в пищу растений наиболее предпочтительно выбирать из группы, включающей миристицин, элемицин, изоэвгенол, α-асарон, сафрол, джинджиролы, ксанторизол, капсаициноиды, предпочтительно капсаицин, производные капсаицина, такие как N-ваниллил-9Е-октадеценамид, дигидрокапсаицин, нордигидрокапсаицин, гомокапсаицин, норкапсаицин и номоркапсаицин, пиперин, предпочтительно транс-пиперин, глюкозинолаты, предпочтительно на основе нелетучих горчичных масел, наиболее предпочтительно на основе n-гидроксибензилированного горчичного масла, содержащего метилмеркаптогруппы горчичного масла или метилсульфонилированного горчичного масла, и производные указанных веществ.
В предпочтительном варианте содержание частей соответствующих лекарственных или употребляемых в пищу растений, содержащих раздражающие вещества, в предлагаемой в изобретении лекарственной форме может составлять от 0,01 до 30 мас.%, наиболее предпочтительно от 0,1 до 0,5 мас.%, в каждом случае в пересчете на всю массу дозированной лекарственной формы.
При использовании же одного или нескольких раздражающих веществ из соответствующих лекарственных или употребляемых в пищу растений содержание такого(-их) вещества(веществ) в предлагаемой в изобретении дозированной лекарственной форме предпочтительно должно составлять от 0,001 до 0,005 мас.% в пересчете на всю ее массу.
Другая возможность воспрепятствовать применению предлагаемой в изобретении лекарственной формы не по назначению состоит в добавлении к ней по меньшей мере одного повышающего вязкость средства в качестве еще одного компонента (б), который предотвращает немедицинское употребление входящего в состав лекарственной формы действующего вещества и который в минимально необходимом количестве водной жидкости, предпочтительно в виде извлеченного из лекарственной формы водного экстракта, образует гель, безопасное введение которого в организм маловероятно и который в предпочтительном варианте при его добавлении в дополнительное количество водной жидкости остается визуально различим.
Выражение "визуально различимый" согласно настоящему изобретению означает, что образовавшийся при добавлении минимально необходимого количества водной жидкости содержащий действующее вещество гель при его добавлении, предпочтительно с помощью инъекционной иглы, в дополнительное количество водной жидкости с температурой 37°С практически не растворяется в ней и сохраняет свою целостность и не поддается простым путем диспергированию, после которого стало бы возможным его парентеральное, прежде всего внутривенное, безопасное введение в организм. В предпочтительном варианте подобный гель должен оставаться визуально различим по меньшей мере в течение одной минуты, более предпочтительно в течение по меньшей мере десяти минут.
Повышение вязкости экстракта с образованием геля приводит к ухудшению его проходимости через иглу, соответственно его инъецируемости или даже полностью делает невозможным его инъекцию. Остающийся визуально различимым образовавшийся гель при его добавлении в дополнительное количество водной жидкости, например, при впрыскивании в кровь, сначала сохраняет форму практически сплошной нити, которая хотя и дробится при механическом воздействии на сравнительно мелкие фрагменты, однако не поддается диспергированию или даже растворению, после которого стало бы возможным парентеральное, прежде всего внутривенное, безопасное введение такого геля в организм. Тем самым в сочетании с по меньшей мере одним другим возможным компонентом (а), (г)-(е) применение гелеобразующего компонента благодаря подобному его свойству дополнительно приводит к появлению неприятного жжения, возникновению рвоты, приданию лекарственной форме или извлеченному из нее экстракту неприятного вкуса и/или приданию лекарственной форме или извлеченному из нее экстракту отталкивающего внешнего вида.
Поэтому внутривенное введение соответствующего геля с высокой вероятностью привело бы к закупорке сосудов и тем самым к нанесению серьезного вреда здоровью.
Для проверки того или иного повышающего вязкость средства на его пригодность для применения в предлагаемой в изобретении лекарственной форме в качестве компонента (б) действующее вещество смешивают с повышающим вязкость средством и суспендируют в 10 мл воды при температуре 25°С. Если при этом образуется гель, который отвечает указанным выше условиям, то соответствующее повышающее вязкость средство пригодно для применения в предлагаемых в изобретении лекарственных формах в целях дополнительного предотвращения, соответственно предупреждения немедицинского употребления содержащихся в них действующих веществ.
При добавлении к предлагаемой в изобретении лекарственной форме компонента (б) в качестве него предпочтительно использовать одно или несколько повышающих вязкость средств, выбранных из группы, включающей микрокристаллическую целлюлозу с 11 мас.% натриевой соли карбоксиметилцеллюлозы (Avicel® RC 591), натриевую соль карбоксиметилцеллюлозы (Blanose®, CMC-Na С300Р®, Frimulsion BLC-5®, Tyiose C300 P®), полиакриловую кислоту (Carbopol® 980 NF, Carbopol 981), камедь плодов рожкового дерева (Cesagum® LA-200, Cesagum® LID/150, Cesagum® LN-1), пектины, предпочтительно из цитрусовых плодов или яблок (Cesapectin® HM Medium Rapid Set), крахмал восковидной кукурузы (C*Gel 04201®), альгинат натрия (Frimulsion ALG (E401)®), гуаровую камедь (Frimulsion ВМ®, Polygum 26/1-75®), ι-каррагинан (Frimulsion D021®), камедь карайи, геллановую камедь (Kelcogel F®, Kelcogel LT100®), галактоманнан (Meyprogat 150®), камедь тары (Polygum 43/1®), пропиленгликольальгинат (Protanal-Ester SD-LB®), гиалуронат натрия, трагант, камедь тары (Vidogum SP 200®), велановую камедь (К1А96), представляющую собой получаемый ферментативным путем полисахарид, и ксантаны, такие как ксантановая камедь (Xantural 180®). Наиболее предпочтительны при этом ксантаны. Приведенные в скобках обозначения представляют собой торговые наименования, под которыми выпускаются и поставляются на рынок соответствующие материалы. Для соблюдения указанных выше условий повышающее(-ие) вязкость средство(-а) в целом достаточно использовать в количестве от 0,1 до 20 мас.%, наиболее предпочтительно от 0,1 до 15 мас.%, в пересчете на всю массу лекарственной формы.
Содержание повышающих вязкость средств при их использовании в качестве компонента (б) в предлагаемой в изобретении лекарственной форме предпочтительно должно составлять не менее 5 мг в пересчете на каждую дозированную лекарственную форму, т.е. на каждую дозированную единицу.
В наиболее предпочтительном варианте осуществления настоящего изобретения в качестве компонента (б) используют те повышающие вязкость средства, которые преимущественно при экстракции из лекарственной формы минимально необходимым количеством водной жидкости образуют гель с пузырьками воздуха в его объеме. Подобные гели внешне выглядят мутными, служа дополнительным визуальным предостережением, удерживающим от их парентерального введения в организм.
Повышающим вязкость средством, которое при добавлении минимально необходимого количества водной жидкости образует гель, в некоторых случаях дополнительно может служить также компонент (В).
Повышающие вязкость средства и остальные ингредиенты предлагаемой в изобретении лекарственной формы можно также располагать в ней пространственно отдельно друг от друга.
Предлагаемая в изобретении лекарственная форма для предупреждения ее применения не по назначению и для защиты от такого применения не по назначению может далее содержать компонент (в), а именно: один или несколько антагонистов используемого действующего вещества, при этом в предпочтительном варианте такой(-ие) антагонист(-ы) присутствует(-ют) в предлагаемой в изобретении лекарственной форме пространственно отдельно от остальных ее ингредиентов и при ее применении по прямому назначению не должен(-ны) проявлять никакого действия.
Соответствующие антагонисты для предупреждения немедицинского употребления содержащегося в предлагаемой в изобретении лекарственной форме действующего вещества известны специалистам в данной области и могут содержаться в предлагаемой в изобретении лекарственной форме как таковые либо в виде соответствующих производных, прежде всего сложных или простых эфиров, или же в виде соответствующих физиологически совместимых соединений, прежде всего в виде их солей или сольватов.
В качестве антагониста предпочтительно использовать вещество из группы, включающей налоксон, налтрексон, налмефен, налид и налмексон, в каждом случае необязательно в виде соответствующего физиологически совместимого соединения, прежде всего в виде основания, соли или сольвата. Соответствующие антагонисты, если в состав предлагаемой в изобретении лекарственной формы предусмотрено включение компонента (в), предпочтительно использовать в количестве не менее 1 мг, более предпочтительно в количестве от 3 до 100 мг, наиболее предпочтительно в количестве от 5 до 50 мг, из расчета на одну лекарственную форму, т.е. на одну дозированную единицу.
Указанные антагонисты предпочтительно включать в состав предлагаемой в изобретении лекарственной формы в обычной, известной специалистам в данной области терапевтической дозировке, а наиболее предпочтительно - в дозировке, которая из расчета на одну дозированную единицу в 2-3 раза превышает обычную дозировку.
Предлагаемая в изобретении лекарственная форма для предупреждения ее применения не по назначению и для защиты от такого применения не по назначению может также содержать компонент (г), которым является по меньшей мере одно рвотное средство, которое в предпочтительном варианте должно присутствовать в предлагаемой в изобретении лекарственной форме пространственно отдельно от остальных ее ингредиентов и при ее применении по прямому назначению не должно проявлять в организме никакого действия.
Соответствующие рвотные средства для дополнительного предотвращения применения предлагаемой в изобретении лекарственной формы не по назначению известны специалистам в данной области и могут содержаться в предлагаемой в изобретении лекарственной форме как таковые либо в виде соответствующих производных, прежде всего сложных или простых эфиров, или же в виде соответствующих физиологически совместимых соединений, прежде всего в виде их солей или сольватов.
В составе предлагаемой в изобретении лекарственной формы в предпочтительном варианте можно использовать рвотное средство на основе одного или нескольких веществ, содержащихся в корне ипекакуаны (рвотном корне), предпочтительно на основе содержащегося в нем эметина, и описанных, например, в книге "Pharmazeutische Biologie - Drogen и ihre Inhaltsstoffe", Prof. Dr.Hildebert Wagner, 2-е, переработанное, изд., изд-во Gustav Fischer Verlag, Stuttgart, New York 1982. Соответствующие разделы этой книги тем самым включены в настоящее описание в качестве ссылки и являются его частью.
В предпочтительном варианте предлагаемая в изобретении лекарственная форма может содержать в качестве компонента (г) рвотное средство эметин, предпочтительно в количестве не менее 3 мг, более предпочтительно не менее 10 мг, наиболее предпочтительно в количестве не менее 20 мг, из расчета на одну лекарственную форму, т.е. на одну дозированную единицу.
Равным образом в другом предпочтительном варианте в качестве рвотного средства в предлагаемой в изобретении лекарственной форме для ее дополнительной защиты от применения не по назначению можно использовать апоморфин, предпочтительно в количестве не менее 3 мг, более предпочтительно не менее 5 мг, наиболее предпочтительно не менее 7 мг, из расчета на одну дозированную единицу.
Если предлагаемая в изобретении лекарственная форма содержит компонент (д) в качестве еще одного препятствующего ее применению не по назначению вспомогательного вещества, то подобный краситель прежде всего при попытке экстрагировать из лекарственной формы действующее вещество для его парентерального, преимущественно внутривенного, введения в организм придает соответствующему водному раствору интенсивную окраску, которая может вызвать зрительный отталкивающий эффект. Подобное изменение окраски позволяет воспрепятствовать немедицинскому употреблению действующего вещества и путем его приема внутрь, которому обычно предшествует водная экстракция действующего вещества из содержащей его лекарственной формы. Соответствующие красители, а также количества, в которых их требуется использовать для достижения необходимого зрительного отталкивающего эффекта, рассмотрены в публикации WO 03/015531, соответствующие разделы которой тем самым включены в настоящее описание в качестве ссылки и являются его частью.
Если предлагаемая в изобретении лекарственная форма содержит в качестве еще одного препятствующего ее применению не по назначению вспомогательного вещества компонент (е), то подобная добавка, представляющая собой по меньшей мере одно горькое вещество, позволяет благодаря вызываемому им ухудшению вкуса лекарственной формы дополнительно воспрепятствовать немедицинскому употреблению содержащегося в ней действующего вещества путем его перорального и/или назального введения в организм.
Соответствующие горькие вещества, а также их необходимые для достижения требуемого эффекта количества описаны в заявке US 2003/0064099, соответствующие разделы которой тем самым включены в настоящее описание в качестве ссылки и являются его частью. В качестве горьких веществ предпочтительно применять ароматические масла, предпочтительно масло перечной мяты, эвкалиптовое масло, масло горького миндаля, ментол, ароматические вещества плодов, предпочтительно ароматические вещества цитронов, апельсинов, лимонов, грейпфрутов или смеси ароматических веществ указанных плодов, и/или бензоат денатония (Bitrex®), особенно предпочтительно бензоат денатония.
Для обеспечения возможности приема предлагаемой в изобретении лекарственной формы один раз в сутки она должна представлять собой ретард-форму с по меньшей мере частично замедленным (ретардированным) высвобождением из нее действующего вещества, ретардация высвобождения которого может обеспечиваться с помощью обычных, известных специалистам в данной области материалов и способов, например, за счет внедрения действующего вещества в замедляющую его высвобождение матрицу или за счет нанесения одного или нескольких замедляющих его высвобождение покрытий. Вместе с тем при регулируемом высвобождении действующего вещества всегда должно обеспечиваться соблюдение указанных выше условий, т.е., например, при применении лекарственной формы по прямому назначению практически полное высвобождение действующего вещества из нее должно завершаться еще до того момента, как возможно содержащиеся в ней компонент (в) и/или компонент (г) начнут проявлять свое отрицательное действие на организм. Так, в частности, замедленное высвобождение действующего вещества из содержащей его лекарственной формы должно обеспечивать сохранение аналгетического действия в течение по меньшей мере 24 ч после приема лекарственной формы.
Если для регулирования высвобождения действующего вещества из предлагаемой в изобретении лекарственной формы используют по меньшей мере одно замедляющее его высвобождение покрытие, то его можно выполнять из обычных, известных специалистам в данной области материалов.
В одном из предпочтительных вариантов предлагаемых в изобретении лекарственных форм в качестве замедляющего высвобождение действующего вещества покрытия используют покрытие предпочтительно на основе либо не растворимого в воде, необязательно модифицированного природного и/или синтетического полимера, либо природного, полусинтетического или синтетического воска, либо жира, либо жирного спирта, либо смеси по меньшей мере двух вышеуказанных материалов.
Для получения замедляющего высвобождение действующего вещества покрытия в качестве не растворимых в воде полимеров предпочтительно использовать поли(мет)акрилаты, более предпочтительно поли(С1-С4)алкил(мет)акрилаты, поли(С1-С4)диалкиламино-(С1-С4)алкил(мет)акрилаты и/или их сополимеры, наиболее предпочтительно сополимеры этилакрилата и метилметакрилата с молярным соотношением между мономерами 2:1 (Eudragit NE30D®), сополимеры этилакрилата, метилметакрилата и триметиламмонийэтилметакрилатхлорида с молярным соотношением между мономерами 1:2:0,1 (Eudragit RS ®), сополимеры этилакрилата, метилметакрилата и триметиламмонийэтилметакрилатхлорида с молярным соотношением между мономерами 1:2:0,2 (Eudragit RL®) или смесь по меньшей мере двух таких вышеуказанных сополимеров. Подобные материалы для нанесения покрытий выпускаются и поставляются на рынок в виде 30%-ных по массе водных синтетических латексов, т.е. в виде продуктов Eudragit RS30D®, Eudragit NE30D®, соответственно Eudragit RL30D®, и их предпочтительно как таковые использовать также в качестве материалов для нанесения замедляющих высвобождение действующего вещества покрытий.
Равным образом в качестве не растворимых в воде полимеров для нанесения замедляющего высвобождение действующего вещества покрытия на предлагаемую в изобретении лекарственную форму в другом предпочтительном варианте можно использовать поливинилацетаты, необязательно в сочетании с другими вспомогательными веществами. Такие материалы выпускаются и поставляются на рынок в виде водной дисперсии, содержащей 27 мас.% поливинилацетата, 2,5 мас.% повидона и 0,3 мас.% лаурилсульфата натрия (продукт Kollicoat SR 30 D®).
В следующем предпочтительном варианте в качестве замедляющих высвобождение действующего вещества покрытий предлагаемой в изобретении лекарственной формы используют покрытия на основе не растворимых в воде производных целлюлозы, предпочтительно на основе алкилцеллюлоз, таких как этилцеллюлоза, или сложных эфиров целлюлозы, таких как ацетат целлюлозы. Покрытия из этилцеллюлозы или ацетата целлюлозы предпочтительно наносить из водных псевдолатексных дисперсий. Водные псевдолатексы этилцеллюлозы выпускаются и поставляются на рынок в виде 30%-ных по массе дисперсий (Aquacoat®) или в виде 25%-ных по массе дисперсий (Surelease®).
При использовании замедляющего высвобождение действующего вещества покрытия на основе не растворимого в воде, необязательно модифицированного природного и/или синтетического полимера соответствующая дисперсия или раствор для нанесения покрытия в целях снижения ее/его минимально необходимой температуры пленкообразования может наряду с соответствующим полимером содержать также обычный, известный специалистам в данной области физиологически совместимый пластификатор.
К пригодным для применения в указанных целях пластификаторам относятся, например, липофильные диэфиры алифатической или ароматической дикарбоновой кислоты с С6-С40 и алифатического спирта с C1-C8, такие как дибутилфталат, диэтилфталат, дибутилсебацинат или диэтилсебацинат, гидрофильные или липофильные эфиры лимонной кислоты, такие как триэтилцитрат, трибутилцитрат, ацетилтрибутилцитрат или ацетилтриэтилцитрат, полиэтиленгликоли, пропиленгликоли, сложные эфиры глицерина, такие как триацетин, Myvacet® (ацетилированные моно- и диглицериды, от C23H44O5 до C25H47O7), триглицериды со средней длиной цепи (Miglyol®), олеиновая кислота или смеси по меньшей мере двух указанных пластификаторов. В состав водных дисперсий продукта Eudragit RS® и возможно продукта Eudragit RL® предпочтительно включать триэтилцитрат.
Содержание пластификаторов в замедляющем высвобождение действующего вещества покрытии предлагаемой в изобретении лекарственной формы предпочтительно должно составлять от 5 до 50 мас.%, более предпочтительно от 10 до 40 мас.%, наиболее предпочтительно от 10 до 30 мас.%, в пересчете на количество используемого полимера. В некоторых случаях, например, при использовании покрытия на основе ацетата целлюлозы, пластификаторы можно использовать и в больших количествах.
Замедляющее высвобождение действующего вещества покрытие может, кроме того, содержать другие обычные, известные специалистам в данной области вспомогательные вещества, такие, например, как скользящие вещества, предпочтительно тальк или моностеарат глицерина, красители, предпочтительно оксиды железа или диоксид титана, или поверхностно-активные вещества, в частности Tween 80®.
Характеристики высвобождения действующего вещества можно далее регулировать обычными, известными специалистам в данной области способами, например, варьированием толщины покрытия или за счет применения других вспомогательных веществ в качестве компонентов покрытия. В качестве примера соответствующих вспомогательных веществ можно назвать гидрофильные или рН-зависимые порообразователи, такие как натриевая соль карбоксиметилцеллюлозы, ацетофталат целлюлозы, ацетосукцинат гидроксипропилметилцеллюлозы, лактоза, полиэтиленгликоль или маннит либо водорастворимые полимеры, в частности поливинилпирролидон или водорастворимые целлюлозы, предпочтительно гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза.
Для контролируемого высвобождения используемого действующего вещества предлагаемые в изобретении лекарственные формы дополнительно могут иметь также устойчивое к действию желудочного сока покрытие, которое растворяется в зависимости от значения рН. При наличии такого покрытия предлагаемая в изобретении лекарственная форма проходит через желудок без растворения в нем и начинает растворяться и высвобождать действующее вещество лишь в кишечнике.
В качестве устойчивого к действию желудочного сока покрытия предпочтительно использовать покрытие на основе сополимеров метакриловой кислоты/алкилметакрилатов, предпочтительно метилметакрилата или этилметакрилата, с молярным соотношением между соответствующими мономерами от 1:1 до 1:2, в частности продукты Eudragit L®, Eudragit S®, Eudragit L30D-55®.
Замедляющее высвобождение действующего вещества покрытие можно наносить обычными, известными специалистам в данной области методами, такими, например, как метод нанесения покрытий распылением растворов, дисперсий или суспензий, метод нанесения покрытий из расплава или метод нанесения порошковых покрытий. Растворы, дисперсии или суспензии можно использовать в виде водных или органических растворов или дисперсий. Предпочтительно при этом применение водных дисперсий. В качестве органических растворителей можно использовать спирты, например, этанол или изопропанол, кетоны, например, ацетон, и сложные эфиры, например, этилацетат, а предпочтительно использовать спирты и кетоны. Методы нанесения покрытий известны из уровня техники и описаны, например, у Н.Sucker, Georg Thieme Verlag, 1991, c.347 и далее. Соответствующие разделы этой публикации тем самым включены в настоящее описание в качестве ссылки и являются его частью.
Если предлагаемая в изобретении лекарственная форма представлена в дисперсном (сыпучем) виде, то замедляющее высвобождение действующего вещества покрытие предпочтительно наносить способом, при осуществлении которого дисперсные формы (частицы), содержащие действующее вещество, после их получения покрывают в псевдоожиженном слое соответствующими полимерами и при необходимости другими вспомогательными веществами из водных и/или органических сред, предпочтительно из водных сред, и в предпочтительном варианте нанесенное покрытие одновременно сушат в псевдоожиженном слое при обычных температурах.
Покрытие на основе поли(мет)акрилата предпочтительно сушить при температуре в пределах от 30 до 50°С, наиболее предпочтительно от 35 до 45°С. Покрытия же на основе целлюлозы, например, этилцеллюлозы, предпочтительно сушить при температуре в пределах от 50 до 80°С, наиболее предпочтительно от 55 до 65°С. При необходимости покрытие после сушки можно для обеспечения стабильных характеристик высвобождения действующего вещества дополнительно подвергать термостатированию.
Замедленное высвобождение действующего вещества из предлагаемой в изобретении лекарственной формы можно также обеспечить за счет внедрения действующего вещества в замедляющую его высвобождение матрицу.
В качестве материалов для образования замедляющей высвобождение действующего вещества матрицы предпочтительно использовать физиологически совместимые гидрофильные полимеры, предпочтительно простые эфиры целлюлозы, сложные эфиры целлюлозы и/или акриловые смолы. Наиболее предпочтительно использовать этилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, поли(мет)акриловую кислоту и/или ее производные, такие как ее соли, амиды или эфиры.
Равным образом в качестве образующих матрицу материалов можно использовать гидрофобные материалы, такие как гидрофобные полимеры, воски, жиры, жирные кислоты с длинной цепью, жирные спирты или соответствующие сложные или простые эфиры либо смеси указанных материалов. К особенно предпочтительным для применения в качестве матрицы гидрофобным материалам относятся моно- или диглицериды жирных кислот с С12-С30 и/или жирные спирты с C12-С30, и/или воски либо смеси указанных материалов.
В качестве образующих матрицу материалов можно также использовать смеси указанных выше гидрофильных и гидрофобных материалов.
В предпочтительном варианте материалом для образования замедляющей высвобождение действующего вещества матрицы может также служить компонент (б), представляющий собой повышающее вязкость средство, если только это допускает структура предлагаемой в изобретении лекарственной формы.
Помимо этого и компонент (В), а также возможно предусмотренный компонент (Г), которые согласно изобретению используются для придания лекарственной форме необходимого сопротивления разрушения, составляющего по меньшей мере 500 Н, предпочтительно по меньшей мере 750 Н, могут служить дополнительными материалами, образующими замедляющую высвобождение действующего вещества матрицу.
Соответствующие материалы и способы, используемые для ретардации высвобождения действующего вещества из предлагаемых в изобретении лекарственных форм, а также для нанесения маскирующих неприятный вкус лекарственного вещества и/или устойчивых к действию желудочного сока покрытий, известны, например, из книги "Coated Pharmaceutical Dosage Forms - Fundamentals, Manufacturing Techniques, Biopharmaceutical Aspects, Test Methods and Raw Materials", Kurt H. Bauer, K. Lehmann, Hermann P.Osterwald, Rothgang, Gerhart, 1-е изд., изд-во Medpharm Scientific Publishers, 1998. В соответствии с этим указанная публикация включена в настоящее описание в качестве ссылки и составляют его часть.
Предлагаемые в изобретении лекарственные формы пригодны для перорального, вагинального или ректального, предпочтительно перорального, однократного в сутки введения в организм человека и животного.
Предлагаемая в изобретении лекарственная форма может быть представлена в дисперсном (сыпучем) виде, предпочтительно в виде микротаблеток, микропеллетов, гранулятов, сфероидов, крупинок или пеллетов, необязательно в расфасованном в капсулы или в спрессованном в таблетки виде. В предпочтительном варианте размер частиц, соответственно полидисперсность указанных дисперсных лекарственных форм лежит в пределах от 0,1 до 3 мм, наиболее предпочтительно от 0,5 до 2 мм. В зависимости от требуемых свойств лекарственной формы для ее приготовления в некоторых случаях можно также использовать обычные вспомогательные вещества (Б).
В следующем предпочтительном варианте предлагаемая в изобретении лекарственная форма представлена в виде таблетки, капсулы или в виде пероральной осмотической терапевтической системы (ПОТС), предпочтительно при использовании по меньшей мере одного дополнительного препятствующего применению лекарственной формы не по назначению компонента (а)-(е).
Предлагаемую в изобретении защищенную от применения не по назначению твердую лекарственную форму предпочтительно приготавливать способом, заключающимся в том, что компонент (А), компонент (В), возможно используемый компонент (Г), по меньшей мере один из возможно используемых дополнительных, препятствующих применению лекарственной формы не по назначению компонентов (а)-(е) и возможно используемые другие вспомогательные вещества (Б), такие как предпочтительно образующие замедляющую высвобождение действующего вещества матрицу материалы, смешивают между собой, при этом компоненты (а)-(е) при необходимости отдельно смешивают с компонентом (В) и возможно используемым компонентом (Г), и из полученной смеси, соответственно из полученных смесей, в некоторых случаях после ее, соответственно их гранулирования, путем приложения усилия с предварительным или одновременным тепловым воздействием формуют лекарственную форму.
Гранулирование можно осуществлять методом гранулирования из расплава или влажного гранулирования.
Для приготовления указанной(-ых) смеси(-ей) компонентов предлагаемой в изобретении лекарственной формы используют известный смеситель. Такой смеситель может представлять собой, например, валковый смеситель, вибросмеситель, работающий с созданием сдвигового усилия смеситель или смеситель принудительного перемешивания.
Из полученной(-ых) смеси(-ей), предпочтительно непосредственно после ее(их) приготовления, путем приложения усилия с предварительным и/или одновременным тепловым воздействием формуют предлагаемую в изобретении лекарственную форму. Так, например, из смеси путем непосредственного таблетирования можно формовать таблетки. При непосредственном таблетировании с одновременным тепловым воздействием прессуемую смесь с помощью таблеточной формы, т.е. нижнего (неподвижного) пуансона, верхнего (подвижного) пуансона и матрицы, кратковременно нагревают по меньшей мере до температуры размягчения полимерного компонента (В) и при этом спрессовывают. При непосредственном таблетировании с предварительным тепловым воздействием прессуемый материал нагревают непосредственно перед таблетированием по меньшей мере до температуры размягчения полимерного компонента (В) и затем спрессовывают с помощью таблеточной формы.
Полученную(-ые) смесь(-и) из компонента (А), компонента (В), возможно используемого компонента (Г), возможно используемых компонентов (а)-(е) и возможно используемых других вспомогательных веществ (Б), прежде всего образующих замедляющую высвобождение действующего вещества матрицу материалов, можно также сначала подвергать гранулированию и лишь затем формовать из полученного гранулята путем приложения усилия с предварительным или одновременным тепловым воздействием предлагаемую в изобретении лекарственную форму.
В другом варианте можно также из полученной смеси, содержащей действующее вещество и/или одну или несколько его фармацевтически приемлемых солей (А), а также возможно используемые физиологически совместимые вспомогательные вещества (Б), такие как компоненты (а)-(е), возможно используемые образующие замедляющую высвобождение действующего вещества матрицу материалы, по меньшей мере один синтетический или природный полимер (В) и возможно используемый воск (Г), формовать путем приложения усилия лекарственную форму, при необходимости разделять полученные формованные заготовки на части, при необходимости классифицировать их по размерам и после или во время нагрева до по меньшей мере температуры размягчения компонента (В) сохранять действие приложенного усилия до тех пор, пока формованные заготовки не достигнут твердости, при которой их сопротивление разрушению составляет по меньшей мере 500 Н, предпочтительно по меньшей мере 750 Н, после чего формованные заготовки можно при необходимости снабжать оболочкой или при необходимости снабжать замедляющим высвобождение действующего вещества покрытием и затем все формованные заготовки можно вновь смешивать между собой. Подобная технология описана в заявке РСТ/ЕР 2004/014679, соответствующие разделы которой тем самым включены в настоящее описание в качестве ссылки и являются его частью. Для специалиста в данной области очевидно, что при применении антиокислителей при приготовлении предлагаемой в изобретении лекарственной формы таким способом в некоторых случаях можно отказаться от создания и поддержания в процессе ее изготовления атмосферы инертного газа.
Помимо этого необходимый нагрев смеси и/или формованных заготовок до или во время приложения усилия, необходимого для придания лекарственной форме минимального сопротивления разрушению, соответственно минимальной твердости, составляющей по меньшей мере 500 Н, предпочтительно 750 Н, можно обеспечить ультразвуком. Соответствующая технология описана в заявке РСТ/ЕР 2005/004225, соответствующие разделы которой тем самым включены в настоящее описание в качестве ссылки и являются его частью.
При включении в состав предлагаемой в изобретении лекарственной формы компонента (в), и/или компонента (г) и/или компонента (е) каждый из них необходимо использовать в такой форме или в столь низкой дозировке, чтобы при применении лекарственной формы по прямому назначению практически полностью исключить возможность проявления каждым из них причиняющего вред пациенту или снижающего эффективность действующего вещества действия.
При включении в состав предлагаемой в изобретении лекарственной формы компонента (г) и/или компонента (е) дозировку каждого из них необходимо подбирать с таким расчетом, чтобы каждый из них при применении лекарственной формы по прямому назначению путем ее приема внутрь не вызывал никакой отрицательной реакции организма. При попадании же указанных компонентов в организм в количествах, превышающих их предусмотренную дозировку, например, в случае непреднамеренного приема лекарственной формы в слишком больших количествах, прежде всего детьми, или же в случае ее применения не по назначению, они вызывают тошноту, соответственно позывы на рвоту, соответственно неприятные вкусовые ощущения. Конкретную дозу компонента (г) и/или компонента (е), при которой пациент при применении лекарственной формы по прямому назначению путем ее приема внутрь все еще остается толерантен к каждому из этих компонентов, можно определить путем проведения простых предварительных опытов.
Если же для защиты предлагаемой в изобретении лекарственной формы от применения не по назначению вне зависимости от практически полной невозможности ее измельчения в порошок предусмотрено применение компонента (в), и/или компонента (г), и/или компонента (е), то каждый из таких компонентов предпочтительно использовать в столь высокой дозировке, чтобы при применении лекарственной формы не по прямому назначению он проявлял ярко выраженное отрицательное действие на организм. В предпочтительном варианте обеспечить соблюдение этого условия удается за счет пространственного отделения по меньшей мере применяемого действующего вещества от компонента (в), и/или компонента (г), и/или компонента (е) предпочтительно путем включения действующего вещества в состав по меньшей мере одной дозированной субъединицы (X), а компонента (в) и/или компонента (г) и/или компонента (е) - в состав по меньшей мере одной другой дозированной субъединицы (Y), в которой компоненты (в), (г) и (е) при применении лекарственной формы по прямому назначению не проявляют при приеме внутрь и/или при попадании в организм своего действия, при этом в обеих дозированных субъединицах применяются идентичные остальные компоненты лекарственной формы, прежде всего компонент (В) и возможно используемый компонент(Г).
При включении в состав предлагаемой в изобретении лекарственной формы по меньшей мере двух компонентов (в) и (г), соответственно (е) они могут содержаться в одной и той же дозированной субъединице (Y) или в разных дозированных субъединицах (Y). В предпочтительном варианте все компоненты (в), (г) и (е) при их использовании включают в состав одной и той же дозированной субъединицы (Y).
При пространственном разделении на дозированную(-ые) субъединицу(-ы) (X) и дозированную(-ые) субъединицу(-ы) (Y) и вне зависимости от взаимного расположения этих дозированных субъединиц в лекарственной форме дозированная субъединица (X), содержащая действующее вещество, представляет собой ретард-форму, благодаря контролируемому, замедленному высвобождению действующего вещества из которой обеспечивается возможность его однократного приема в сутки.
Под дозированными субъединицами согласно настоящему изобретению подразумеваются твердые формы, каждая из которых наряду с обычными, известными вспомогательными веществами содержит действующее вещество, возможно используемый воск (Г) и при необходимости по меньшей мере один из возможно используемых компонентов (а) и/или (б), и/или (д), соответственно каждая из которых содержит по меньшей мере один полимер (В) и антагонист(-ы), и/или рвотное(-ые) средство(-а), и/или компонент (д), и/или компонент (е) и при необходимости по меньшей мере один из возможно используемых компонентов (а) и/или (б), а также при необходимости содержит материалы, образующие замедляющую высвобождение действующего вещества матрицу. При этом следует отметить, что каждую из указанных выше дозированных субъединиц приготавливают описанным выше способом.
Существенное преимущество, связанное с отделением в предлагаемой в изобретении лекарственной форме применяемого действующего вещества от компонентов (в), соответственно (г), соответственно (е) путем включения того и других в состав разных дозированных субъединиц (X) и (Y), состоит в том, что при применении лекарственной формы по прямому назначению компонент (в), и/или компонент (г), и/или компонент (е) при приеме внутрь и/или при попадании в организм практически не высвобождаются из содержащих их дозированных субъединиц или высвобождаются из них лишь в столь малых количествах, при которых они не проявляют никакого причиняющего вред пациенту или снижающего эффективность лечения действия, либо при прохождении через организм пациента высвобождаются из содержащих их дозированных субъединиц только в тех местах, где они не резорбируются в достаточной для проявления ими своего действия степени. В предпочтительном варианте компонент (в), и/или компонент (г), и/или компонент (е) при применении лекарственной формы по прямому назначению практически не высвобождаются в организме пациента или не ощущаются им.
Для специалиста в данной области очевидно, что эти указанные выше условия могут варьироваться в зависимости от конкретно применяемых компонентов (в), (г) и/или (е), а также от состава и типа дозированных субъединиц, соответственно лекарственной формы. Оптимальные для каждой конкретной лекарственной формы ее состав и тип можно определить путем проведения простых предварительных опытов. Решающее же значение имеет лишь включение в состав каждой конкретной дозированной субъединицы полимера (В) и при необходимости компонента (Г) и ее приготовление описанным выше способом.
Если вопреки ожиданиям подобную предлагаемую в изобретении лекарственную форму, которая содержит компонент (в), и/или компонент (д), и/или компонент (г), и/или компонент (е) в дозированных субъединицах (Y), и удастся в целях немедицинского употребления действующего вещества измельчить в порошок и экстрагировать из него действующее вещество с помощью пригодного для этого экстрагента, то наряду с действующим веществом в экстракте будет присутствовать и соответствующий компонент (в), и/или (д), и/или (е), и/или (г) в форме, в которой его невозможно простым путем отделить от действующего вещества, и поэтому он при применении полученного из лекарственной формы экстракта, прежде всего при его пероральном и/или парентеральном введении в организм, будет уже при приеме внутрь и/или при попадании в организм проявлять свое действие, причем один из компонентов (в), и/или (г), и/или (е) дополнительно вызовет соответствующую отрицательную реакцию организма, а компонент (д) при попытке экстрагировать действующее вещество вызовет визуально отталкивающее изменение окраски и таким путем воспрепятствует применению лекарственной формы не по назначению.
Предлагаемая в изобретении лекарственная форма с пространственным отделением в ней действующего вещества от компонентов (в), (г) и/или (д), предпочтительно за счет включения того и других в состав разных дозированных субъединиц, может иметь самую разнообразную структуру, при этом соответствующие дозированные субъединицы могут иметь в предлагаемой в изобретении лекарственной форме любое пространственное расположение друг относительно друга при условии соблюдения указанных выше условий касательно высвобождения компонента (в) и/или компонента (г), с одной стороны, и высвобождения действующего вещества, а именно: контролируемого его высвобождения для возможности его однократного приема в сутки, с другой стороны.
Для специалиста в данной области очевидно, что компонент (а) и/или компонент (б) при его, соответственно, их использовании в предлагаемой в изобретении лекарственной форме в предпочтительном варианте можно включать в состав не только каждой из соответствующих дозированных субъединиц (X) и (Y), но и в состав самостоятельных дозированных субъединиц (Y'), соответствующих дозированным субъединицам (X) и (Y), при условии, что форма приготовления таких самостоятельных дозированных субъединиц не сказывается отрицательно при применении лекарственной формы по прямому назначению на ее защите от применения не по назначению и на высвобождении из нее действующего вещества на протяжении 24 ч и содержит в своем составе полимер (В), а сами эти дозированные субъединицы получают описанным выше способом.
В одном из предпочтительных вариантов дозированные субъединицы (X) и (Y), составляющие предлагаемую в изобретении лекарственную форму, представлены в дисперсной форме, предпочтительно в виде микротаблеток, микрокапсул, микропеллетов, гранулятов, сфероидов, крупинок или пеллетов, при этом и дозированная субъединица (X), и дозированная субъединица (Y) должны иметь одну и ту же форму, т.е. внешний вид, чтобы дозированную субъединицу (X) невозможно было отделить от дозированной субъединицы (Y) путем, например, механической сортировки. В предпочтительном варианте размер указанных микротаблеток, микрокапсул, микропеллетов, гранулятов, сфероидов, крупинок или пеллетов должен лежать в пределах от 0,1 до 3 мм, наиболее предпочтительно от 0,5 до 2 мм.
Дозированные субъединицы (X) и (Y), представленные в дисперсной форме, в предпочтительном варианте можно также расфасовывать в капсулы или спрессовывать в таблетки, при этом завершающая стадия приготовления подобного рода лекарственных форм должна обеспечивать сохранение дозированных субъединиц (X) и (Y) и в готовой лекарственной форме.
Соответствующие дисперсные дозированные субъединицы (X) и (Y) не только должны иметь идентичную внешнюю форму, но и должны быть визуально не отличимы одна от другой, чтобы их невозможно было отделить друг от друга путем простой сортировки. Для этого на дозированные субъединицы обоих типов можно, например, наносить идентичные покрытия, которые наряду с подобной функцией, состоящей в придании дозированным субъединицам обоих типов одинакового внешнего вида, могут выполнять и другие функции, например, ретардацию высвобождения действующего вещества или придавать дозированным субъединицам каждого конкретного типа устойчивость к действию желудочного сока и/или маскировать их возможно неприятный вкус.
В следующем предпочтительном варианте осуществления настоящего изобретения дозированные субъединицы (X) и (Y) предлагается располагать слоями друг относительно друга.
В этом варианте слои из дозированных субъединиц (X) и (Y) предпочтительно располагать друг относительно друга в предлагаемой в изобретении лекарственной форме вертикально или горизонтально, при этом в лекарственной форме может также присутствовать один или несколько слоев из дозированных субъединиц (X) и один или несколько слоев из дозированных субъединиц (Y), и поэтому наряду с предпочтительными последовательностями расположения слоев типа (X)-(Y), соответственно (X)-(Y)-(X) возможны и любые иные последовательности расположения слоев, в том числе и в сочетании со слоями, содержащими компонент (а) и/или компонент (б).
Равным образом предпочтительна предлагаемая в изобретении лекарственная форма, в которой дозированная субъединица (Y) образует сердцевину, которая полностью заключена в оболочку из замедляющей высвобождение действующего вещества дозированной субъединицы (X) и которая может быть отделена от нее разделительным слоем (Z). Такую же структуру предпочтительно использовать и в указанных выше дисперсных формах, причем в этом случае обе дозированные субъединицы (X) и (Y), а также возможно предусмотренный между ними разделительный слой (Z), который по своей твердости должен удовлетворять соответствующим изобретению требованиям, приготавливают в одной и той же дисперсной форме.
В следующем предпочтительном варианте дозированная субъединица (X) образует в предлагаемой в изобретении лекарственной форме сердцевину, заключенную в оболочку из дозированной субъединицы (Y), которая имеет по меньшей мере один канал, ведущий от сердцевины лекарственной формы к ее поверхности.
Между слоем из дозированной субъединицы (X) и слоем из дозированной субъединицы (Y) предлагаемая в изобретении лекарственная форма для пространственного отделения дозированной субъединицы (X) от дозированной субъединицы (Y) может иметь по одному или нескольким разделительным слоям (Z), предпочтительно по одному разделительному слою (Z), который в некоторых случаях может быть образован набухающим материалом.
Предлагаемая в изобретении лекарственная форма с по меньшей мере частичным вертикальным или горизонтальным расположением в ней слоев из дозированных субъединиц (X) и (Y), а также возможно предусмотренного между ними разделительного слоя (Z) предпочтительно должна быть представлена в виде таблетки, соэкструдата или ламината.
При этом в наиболее предпочтительном варианте свободная поверхность дозированной субъединицы (Y) полностью и в некоторых случаях по меньшей мере часть свободной поверхности дозированной(-ых) субъединицы(субъединиц) (X), а также в некоторых случаях по меньшей мере часть свободной поверхности возможно предусмотренного(-ых) разделительного(-ых) слоя(-ев) (Z) могут быть покрыты по меньшей мере одним препятствующим высвобождению компонента (в), и/или компонента (д), и/или компонента (г), и/или компонента (е) барьерным слоем (Z'). Такой барьерный слой (Z') по своей твердости также должен удовлетворять соответствующим изобретению требованиям.
Равным образом особенно предпочтительна предлагаемая в изобретении лекарственная форма с вертикальным или горизонтальным расположением слоев из дозированных субъединиц (X) и (Y) и по меньшей мере одного расположенного между ними "выталкивающего" слоя ("push"-слоя) (р), а также возможно предусмотренного разделительного слоя (Z), у которой все свободные поверхности состоящей из дозированных субъединиц (X) и (Y), "выталкивающего" слоя ("push"-слоя) и возможно предусмотренного разделительного слоя (Z) слоистой структуры покрыты полупроницаемым покрытием (Е), которое проницаемо для среды, в которую высвобождается действующее вещество, т.е. обычно для физиологической жидкости, но в основном не проницаемо для действующего вещества и для компонента (в), и/или компонента (г), и/или компонента (е) и которое в зоне дозированной субъединицы (X) имеет по меньшей мере одно отверстие для высвобождения действующего вещества.,
Соответствующая лекарственная форма, которая известна под названием пероральной осмотической терапевтической системы (ПОТС), равно как и пригодные для ее изготовления материалы и способы ее изготовления описаны помимо прочего в патентах US 4612008, US 4765989 и US 4783337. В соответствии с этим указанные патенты включены в настоящее описание в качестве ссылки и составляют его часть.
Из уровня техники известна также осмотическая лекарственная форма, содержащая аналгетический опиоид и краситель в качестве аверсивного средства (WO 03/015531). Такая лекарственная форма в предпочтительном варианте представляет собой таблетку с сердцевиной, состоящей из двух слоев, один из которых содержит опиоид, а другой представляет собой "выталкивающий" слой ("push"-слой), который содержит краситель в качестве аверсивного средства. В соответствии с этим указанная публикация включена в настоящее описание в качестве ссылки и составляет его часть.
В следующем предпочтительном варианте дозированная субъединица (X) в предлагаемой в изобретении лекарственной форме имеет вид таблетки, у которой ее боковая грань и необязательно одна из обеих основных поверхностей покрыта барьерным слоем (Z'), содержащим компонент (в), и/или компонент (г), и/или компонент (е).
Для специалиста в данной области очевидно, что используемые в каждом случае для приготовления предлагаемой в изобретении лекарственной формы вспомогательные вещества, включаемые в состав дозированной(-ых) субъединицы (субъединиц) (X), соответственно (Y), а также возможно предусмотренного(-ых) разделительного(-ых) слоя(-ев) (Z) и/или барьерного(-ых) слоя(-ев) (Z'), выбираются в зависимости от расположения указанных субъединиц и слоев в предлагаемой в изобретении лекарственной форме, от предусмотренного пути ее введения в организм, а также в зависимости от используемого действующего вещества, соответственно от конкретного вещества, используемого в качестве возможно предусмотренного компонента (а), и/или компонента (б), и/или компонента (д) и в качестве компонента (в), и/или компонента (г), и/или компонента (е), при обязательном соблюдении условия, согласно которому должно обеспечиваться высвобождение действующего вещества из лекарственной формы на протяжении 24 ч. Материалы, обладающие необходимыми в каждом конкретном случае свойствами, известны специалистам в данной области.
При заключении в предлагаемой в изобретении лекарственной форме дозированной субъединицы (Y) в препятствующую высвобождению из нее компонента (в), и/или компонента (г), и/или компонента (е) оболочку, предпочтительно в виде барьерного слоя, для приготовления такой дозированной субъединицы можно использовать обычные, известные специалистам в данной области материалы при условии включения в ее состав по меньшей мере одного полимера (В) и при необходимости компонента (Г) для соблюдения требований, предъявляемых к твердости предлагаемой в изобретении лекарственной формы.
Если же применение соответствующего барьерного слоя (Z') для предотвращения высвобождения компонента (в), и/или компонента (г), и/или компонента (е) не предусмотрено, то материалы для приготовления дозированных субъединиц (Y) должны выбираться с таким расчетом, чтобы практически полностью исключить высвобождение соответствующего компонента (в) и/или компонента (г) из дозированной субъединицы (Y). В предпочтительном варианте для соблюдения этого требования можно использовать перечисленные ниже материалы, которые могут использоваться и для образования барьерного слоя.
К предпочтительным в этом отношении материалам относятся материалы, выбранные из группы, включающей алкилцеллюлозы, гидроксиалкилцеллюлозы, глюканы, склероглюканы, маннаны, ксантаны, сополимеры поли[бис-(n-карбоксифенокси)пропана и себациновой кислоты, предпочтительно в молярном соотношении 20:80 (выпускаемые под названием Polifeprosan 20®), карбоксиметилцеллюлозы, простые эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, полимеры на основе (мет)акриловой кислоты, а также ее эфиров, полиамиды, поликарбонаты, полиалкилены, полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, поливиниловые спирты, простые поливиниловые эфиры, сложные поливиниловые эфиры, галогенированные поливинилы, полигликолиды, полисилоксаны, а также полиуретаны и их сополимеры или смеси.
К наиболее пригодным для приготовления дозированных субъединиц (Y) материалам относятся материалы, выбранные из группы, включающей метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы (с низкой, средней или высокой молекулярной массой), ацетопропионат целлюлозы, ацетобутират целлюлозы, ацетофталат целлюлозы, карбоксиметилцеллюлозу, триацетат целлюлозы, натриевый сульфат целлюлозы, полиметилметакрилат, полиэтилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полигексилметакрилат, полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат, полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат, полиоктатдецилакрилат, полиэтилен, полиэтилен низкой плотности, полиэтилен высокой плотности, полипропилен, полиэтиленгликоль, полиэтиленоксид, полиэтилентерефталат, поливиниловый спирт, поливинилизобутиловый эфир, поливинилацетат и поливинилхлорид.
К наиболее пригодным для применения в указанных выше целях сополимерам относятся сополимеры, выбранные из группы, включающей сополимеры бутилметакрилата и изобутилметакрилата, сополимеры метилвинилового эфира и малеиновой кислоты с высокой молекулярной массой, сополимеры метилвинилового эфира и моноэтилового эфира малеиновой кислоты, сополимеры метилвинилового эфира и малеинового ангидрида, а также сополимеры винилового спирта и винилацетата.
К числу других пригодных для выполнения барьерного слоя материалов относятся наполненный крахмалом поликапролактон (WO 98/20073), алифатические полиэфирамиды (DE 19753534 A1, DE 19800698 A1, ЕР 0820698 A1), алифатические и ароматические полиэфируретаны (DE 19822979), полигидроксиалканоаты, прежде всего полигидроксибутираты и полигидроксивалериаты, казеин (DE 4309528), полилактиды и сополилактиды (ЕР 0980894 А1). Указанные публикации в соответствии с этим включены в настоящее описание в качестве ссылки и составляют его часть.
Рассмотренные выше материалы можно при необходимости использовать в смеси с другими обычными известными специалистам в данной области вспомогательными веществами, предпочтительно вспомогательными веществами, выбранными из группы, включающей глицерилмоностеарат, полусинтетические производные триглицеридов, полусинтетические глицериды, гидрированное касторовое масло, глицерилпальмитостеарат, глицерилбегенат, поливинилпирролидон, желатин, стеарат магния, стеариновую кислоту, стеарат натрия, тальк, бензоат натрия, борную кислоту и коллоидный кремнезем, жирные кислоты, замещенные триглицериды, глицериды, полиоксиалкиленгликоли и их производные.
При наличии в предлагаемой в изобретении лекарственной форме разделительного слоя (Z) его, равно как и не заключенную в оболочку дозированную субъединицу (Y) предпочтительно выполнять из указанных выше для барьерного слоя материалов. Для специалиста в данной области очевидно, что регулировать высвобождение действующего вещества, соответственно компонента (в) и/или компонента (г) из соответствующей дозированной субъединицы можно также варьированием толщины разделительного слоя.
Предлагаемая в изобретении лекарственная форма представляет собой лекарственную форму с контролируемым высвобождением из нее действующего вещества на протяжении по меньшей мере 24 ч и тем самым пригодна для однократного в сутки введения в организм.
Методика определения сопротивления разрушению
Для проверки пригодности того или иного материала для применения в качестве компонента (В) или (Г) из проверяемого материала при температуре, равной по меньшей мере температуре его размягчения, определяемой по ДСК-диаграмме материала, прессуют при усилии прессования, равном 150 Н, таблетку диаметром 10 мм и толщиной (высотой) 5 мм. Затем в соответствии с методом определения сопротивления таблеток разрушению, опубликованным в европейской фармакопее 1997-го года издания, c.143, 144, метод № 2.9.8, с использованием описанного ниже оборудования определяют сопротивление изготовленных таким путем таблеток разрушению. В качестве измерительного оборудования используют машину для испытания материалов типа "Zwick Z 2.5" фирмы Zwick с максимальным развиваемым усилием Fmax, равным 2,5 кН, с ходом поперечины, равным максимум 1150 мм и выставляемым с помощью регулировочного механизма, состоящего из колонны и ходового винта, со свободным рабочим пространством сзади, равным 100 мм, со скоростью испытания, регулируемой в пределах от 0,1 до 800 мм/мин, и с программным обеспечением "testControl". Для измерений используют пуансон с ввинчиваемыми вставками и цилиндром (диаметром 10 мм) и месдозу с максимальным измеряемым усилием Fmax в 1 кН, с диаметром 8 мм, с точностью измерения согласно стандарту ISO 7500-1, соответствующей классу 0.5, начиная с 10 Н, и классу 1, начиная с 2 В, и с выдаваемым производителем проверочным сертификатом М согласно стандарту DIN 55350-18 (рассчитываемое по методике фирмы Zwick максимальное суммарное усилие Fmax, равное 1,45 кН) (все оборудование фирмы Zwick GmbH & Со. KG, Ульм, Германия, со следующими номерами для заказа: BTC-FR 2.5 ТН. D09 для испытательной машины, BTC-LC 0050N. Р01 для месдозы и ВО 70000 S06 для центрирующего приспособления).
На прилагаемом к описанию чертеже в упрощенном виде схематично показано устройство для измерения сопротивления таблеток разрушению и, в частности, показано используемое для этого юстировочное приспособление (6) для выверки положения таблетки (4) до и в процессе измерения. Для проведения измерений таблетку (4) помещают между верхней нажимной пластиной (1) и нижней нажимной пластиной (3) не показанного на чертеже устройства для приложения нагрузки и фиксируют с помощью двух состоящих из двух частей зажимов (2), каждый из которых после выставления необходимого для закрепления и центрирования анализируемой таблетки расстояния (5) прочно соединяют с верхней, соответственно нижней нажимной пластиной (не показано). Для регулирования расстояния (5) обе части каждого из зажимов можно сдвигать или раздвигать в горизонтальном направлении перемещением по соответствующей нажимной пластине, на которой они установлены.
К стойким к разрушению под воздействием определенной механической нагрузки относят также таблетки, которые при приложении заданного усилия не разрушаются, но в некоторых случаях пластически деформируются.
Описанным выше методом измерений, которым можно испытывать не только таблетки, но и отличные от них лекарственные формы, определяли сопротивление предлагаемых в изобретении лекарственных форм разрушению.
Ниже изобретение поясняется на примере. Все рассмотренные в этом примере пояснения носят исключительно иллюстративный характер и не ограничивают объем изобретения.
Пример 1
Изготовление защищенной от применения не по назначению таблетки. содержащей (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол
Гидрохлорид действующего вещества, порошковый полиэтиленоксид и гидроксипропилметилцеллюлозу (Metholose 90 SH 100 000) в качестве материала, который образует замедляющую высвобождение действующего вещества матрицу, смешивали между собой в указанных ниже в таблице 1 количествах в гравитационном смесителе. Таблеточную форму, состоящую из матрицы и верхнего и нижнего пуансонов диаметром 13 мм, нагревали в сушильном шкафу до 90°С. Затем в нагретой таблеточной форме спрессовывали по 600 мг порошковой смеси, сохраняя необходимое усилие прессования по меньшей мере в течение 15 с.
Сопротивление таблеток разрушению определяли описанным выше методом. При воздействии на таблетки усилием в 500 Н не происходило никакого их разрушения. Помимо этого таблетки невозможно было измельчить ни молотком, ни с помощью ступки и пестика.
Определение высвобождения действующего вещества из изготовленных таблеток in vitro
Характеристики высвобождения гидрохлорида действующего вещества из изготовленных таблеток in vitro определяли в аппарате с плосколопастной мешалкой и с утяжелителем (приспособлением, препятствующим всплытию анализируемой лекарственной формы) в соответствии с методом, описанным в европейской фармакопее. Температура среды, в которую высвобождалось действующее вещество, составляла 37°С, а скорость вращения мешалки равнялась 75 мин-1. В качестве среды, в которую высвобождалось действующее вещество, использовали желудочный сок с рН 6,8 в количестве 600 мл. Количество высвободившегося в растворяющую среду гидрохлорида действующего вещества определяли в заданные, указанные ниже моменты времени с помощью спектральной фотометрии.
Высвободившееся к соответствующему моменту времени количество гидрохлорида действующего вещества указано ниже в таблице 2 в процентном выражении в пересчете на все количество гидрохлорида действующего вещества.
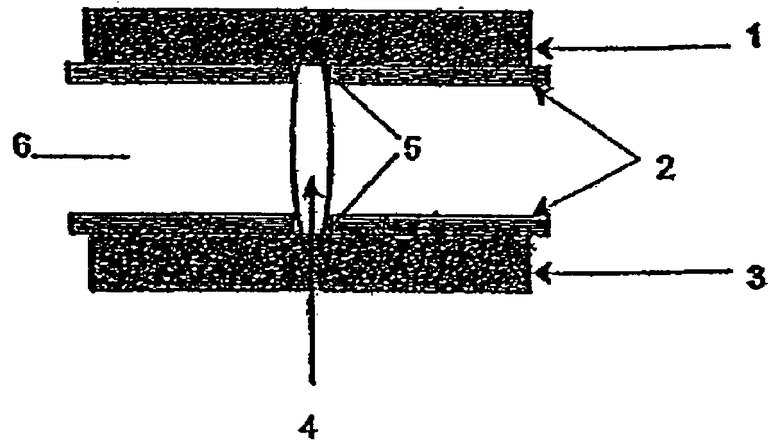
Заявленное изобретение относится к химико-фармацевтической промышленности и касается защищенной от применения не по назначению, пероральной лекарственной формы с контролируемым высвобождением из нее (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола для однократного приема в сутки, которая содержит указанное действующее вещество и/или одну или несколько его фармацевтически приемлемых солей (А), по меньшей мере один синтетический и/или природный полимер (В), замедляющее высвобождение действующего вещества вспомогательное вещество, необязательно другие физиологически совместимые вспомогательные вещества (Б), обладающая сопротивлением разрушению по меньшей мере 500 Н. Такая лекарственная форма может также содержать по меньшей мере один из следующих, препятствующих ее применению не по назначению компонентов (а)-(е): (а) по меньшей мере одно раздражающее полость носа и/или глотки вещество, (б) по меньшей мере одно повышающее вязкость средство, (в) по меньшей мере один антагонист для действующего вещества, потенциально являющегося объектом его немедицинского употребления, (г) по меньшей мере одно рвотное средство, (д) по меньшей мере один краситель в качестве аверсивного средства, (е) по меньшей мере одно горькое вещество. 4 н. и 32 з.п. ф-лы, 2 табл., 1 ил.
1. Защищенная от применения не по назначению пероральная лекарственная форма с сопротивлением разрушению по меньшей мере 500 Н и с контролируемым высвобождением из нее (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола для ежедневного однократного приема, отличающаяся тем, что она содержит
указанное действующее вещество и/или по меньшей мере одну его фармацевтически приемлемую соль или по меньшей мере одно его фармацевтически приемлемое производное (А),
по меньшей мере один синтетический полимер (В), выбранный из группы, включающей полиалкиленоксиды, полиэтилены, полипропилены, поливинилхлориды, поликарбонаты, полистиролы, поли(мет)акрилаты, их сополимеры и смеси из по меньшей мере двух представителей указанных классов полимеров или указанных полимеров,
необязательно по меньшей мере один образующий замедляющую высвобождение действующего вещества матрицу материал и/или
необязательно по меньшей мере одно замедляющее высвобождение действующего вещества покрытие и
по меньшей мере одно другое физиологически совместимое вспомогательное вещество (Б),
где компонент (В) проявляет сопротивление разрушению по меньшей мере 500 Н, присутствует в количестве по меньшей мере 20 мас.% в пересчете на всю массу лекарственной формы и образует замедляющую высвобождение действующего вещества матрицу, в которую внедрено действующее вещество.
2. Лекарственная форма по п.1, отличающаяся тем, что соль действующего вещества представляет собой гидрохлорид, сульфат, гидробромид либо сахаринат действующего вещества или соль действующего вещества с метансульфоновой кислотой, муравьиной кислотой, уксусной кислотой, щавелевой кислотой, янтарной кислотой, винной кислотой, миндальной кислотой, фумаровой кислотой, молочной кислотой, лимонной кислотой, глутаминовой кислотой либо аспарагиновой кислотой.
3. Лекарственная форма по п.1 или 2, отличающаяся тем, что соль действующего вещества представляет собой гидрохлорид действующего вещества.
4. Лекарственная форма по п.1, отличающаяся тем, что производное действующего вещества представляет собой соответствующий сложный эфир, простой эфир и/или соответствующий амид.
5. Лекарственная форма по п.1, отличающаяся тем, что она содержит соответствующие стереоизомеры действующего вещества.
6. Лекарственная форма по п.1, отличающаяся тем, что она представлена в виде таблетки.
7. Лекарственная форма по п.1, отличающаяся тем, что она представлена в дисперсном виде, предпочтительно в виде микротаблеток, микропеллетов, гранулятов, сфероидов, крупинок или пеллетов, необязательно в спрессованном в таблетки или в расфасованном в капсулы виде.
8. Лекарственная форма по п.1, отличающаяся тем, что полиалкиленоксид представляет собой полиметиленоксид, полиэтиленоксид и/или полипропиленоксид.
9. Лекарственная форма по п.1, отличающаяся тем, что в качестве полимера (В) она содержит высокомолекулярный полиэтиленоксид.
10. Лекарственная форма по п.1, отличающаяся тем, что полимер (В) представляет собой растворимый или набухающий в воде полимер.
11. Лекарственная форма по п.1, отличающаяся тем, что полиэтиленоксид (В) имеет молекулярную массу по меньшей мере 0,5 млн.
12. Лекарственная форма по п.11, отличающаяся тем, что молекулярная масса полиэтиленоксида (В) составляет по меньшей мере 1 млн.
13. Лекарственная форма по п.11, отличающаяся тем, что молекулярная масса полиэтиленоксида (В) составляет от 1 до 15 млн.
14. Лекарственная форма по п.1, отличающаяся тем, что содержание полимерного компонента (В) составляет от 35 до 99,9 мас.%, предпочтительно по меньшей мере 50 мас.%, более предпочтительно по меньшей мере 60 мас.%, в пересчете на всю массу лекарственной формы.
15. Лекарственная форма по п.1, отличающаяся тем, что она дополнительно содержит по меньшей мере один природный, полусинтетический и/или синтетический воск с температурой размягчения по меньшей мере 60°С.
16. Лекарственная форма по п.1, отличающаяся тем, что действующее вещество присутствует в замедляющей его высвобождение матрице.
17. Лекарственная форма по п.16, отличающаяся тем, что компонент (В) при его использовании также служит компонентом, образующим замедляющую высвобождение действующего вещества матрицу.
18. Лекарственная форма по п.1, отличающаяся тем, что материалом, образующим замедляющую высвобождение действующего вещества матрицу, служит по меньшей мере одно вспомогательное вещество (Б).
19. Лекарственная форма по п.1, отличающаяся тем, что она имеет покрытие, предпочтительно замедляющее высвобождение действующего вещества и/или маскирующее вкус покрытие.
20. Лекарственная форма по п.1, отличающаяся тем, что она в качестве вспомогательного вещества (Б) содержит по меньшей мере один из следующих, препятствующих ее применению не по назначению компонентов (а)-(е):
(а) по меньшей мере одно раздражающее полость носа и/или глотки вещество,
(б) по меньшей мере одно повышающее вязкость средство, которое в извлеченном с помощью минимально необходимого количества водной жидкости экстракте, преимущественно в виде полученного из лекарственной формы экстракта, образует гель, который предпочтительно при его добавлении в дополнительное количество водной жидкости остается визуально различим,
(в) по меньшей мере один антагонист для действующего вещества, потенциально являющегося объектом его немедицинского употребления,
(г) по меньшей мере одно рвотное средство,
(д) по меньшей мере один краситель в качестве аверсивного средства,
(е) по меньшей мере одно горькое вещество.
21. Лекарственная форма по п.20, отличающаяся тем, что раздражающее вещество, используемое в качестве компонента (а), вызывает жжение, зуд, позыв к чиханию, повышенное выделение секрета или одновременно оказывает по меньшей мере два таких раздражающих действия.
22. Лекарственная форма по п.20, отличающаяся тем, что основу раздражающего вещества, используемого в качестве компонента (а), составляет одно или несколько раздражающих веществ из по меньшей мере одного содержащего его(их) лекарственного или употребляемого в пищу растения.
23. Лекарственная форма по п.22, отличающаяся тем, что содержащее раздражающие вещества лекарственное или употребляемое в пищу растение представляет собой по меньшей мере одно лекарственное или употребляемое в пищу растение, выбранное из группы, включающей Allii sativi Bulbus, Asari Rhizoma c.Herba, Calami Rhizoma, Capsici Fructus (стручковый перец), Capsici Fructus acer (кайенский перец), Curcumae longae Rhizoma, Curcumae xanthorrhizae Rhizoma, Galangae Rhizoma, Myristicae Semen, Piperis nigri Fructus (перец), Sinapis albae (Erucae) Semen, Sinapis nigri Semen, Zedoariae Rhizoma и Zingiberis Rhizoma, наиболее предпочтительно по меньшей мере одно лекарственное или употребляемое в пищу растение, выбранное из группы, включающей Capsici Fructus (стручковый перец), Capsici Fructus acer (кайенский перец) и Piperis nigri Fructus (перец).
24. Лекарственная форма по п.22, отличающаяся тем, что раздражающее вещество из содержащего его лекарственного или употребляемого в пищу растения представлено в виде о-метокси(метил)фенольного соединения, амида кислоты, горчичного масла или сульфидного соединения либо является производным одного из подобных соединений.
25. Лекарственная форма по п.22, отличающаяся тем, что раздражающее вещество из содержащего его лекарственного или употребляемого в пищу растения представляет собой по меньшей мере одно вещество, выбранное из группы, включающей миристицин, элемицин, изоэвгенол, β-асарон, сафрол, джинджиролы, ксанторизол, капсаициноиды, предпочтительно капсаицин, пиперин, предпочтительно транс-пиперин, глюкозинолаты, предпочтительно на основе нелетучих горчичных масел, наиболее предпочтительно на основе n-гидроксибензилированного горчичного масла, содержащего метилмеркаптогруппы горчичного масла или метилсульфонилированного горчичного масла, и одно из производных указанных веществ.
26. Лекарственная форма по п.20, отличающаяся тем, что компонент (б) представляет собой по меньшей мере одно повышающее вязкость средство, выбранное из группы, включающей микрокристаллическую целлюлозу с 11 мас.% натриевой соли карбоксиметилцеллюлозы (Avicel® RC 591), натриевую соль карбоксиметилцеллюлозы (Blanose®, CMC-Na С300Р®, Frimulsion BLC-5®, Tyiose C300 P®), полиакриловую кислоту (Carbopol® 980 NF, Carbopol® 981), камедь плодов рожкового дерева (Cesagum® LA-200, Cesagum® LID/I 50, Cesagum® LN-1), пектины из цитрусовых плодов или яблок (Cesapectin® HM Medium Rapid Set), крахмал восковидной кукурузы (С* Gel 04201®), альгинат натрия (Frimulsion ALG (Е401)®), гуаровую камедь (Frimulsion ВМ®, Polygum 26/1-75®), ι-каррагинан (Frimulsion D021®), камедь карайи, геллановую камедь (Kelcogel F®, Kelcogel LT100®), галактоманнан (Meyprogat 150®), камедь тары (Polygum 43/1®), пропиленгликольальгинат (Protanal-Ester SD-LB®), яблочный пектин, гиалуронат натрия, трагант, камедь тары (Vidogum SP 200®), велановую камедь (К1А96), представляющую собой получаемый ферментативным путем полисахарид, и ксантановую камедь (Xantural 180®).
27. Лекарственная форма по п.20, отличающаяся тем, что компонент (в) представляет собой по меньшей мере один антагонист опиоида.
28. Лекарственная форма по п.20, отличающаяся тем, что основу рвотного средства, используемого в качестве компонента (г), составляет одно или несколько веществ, содержащихся в корне ипекакуаны (рвотном корне), предпочтительно содержащийся в нем эметин, и/или апоморфин.
29. Лекарственная форма по п.20, отличающаяся тем, что компонент (д) представляет собой по меньшей мере один физиологически совместимый краситель.
30. Лекарственная форма по п.20, отличающаяся тем, что компонент (е) представляет собой по меньшей мере одно горькое вещество, выбранное из группы, включающей ароматические масла, предпочтительно масло перечной мяты, эвкалиптовое масло, масло горького миндаля, ментол и их смеси, ароматические вещества плодов, предпочтительно ароматические вещества цитронов, апельсинов, лимонов, грейпфрутов и смеси из по меньшей мере двух указанных ароматических веществ плодов, бензоат денатония и смеси из по меньшей мере двух указанных горьких веществ.
31. Лекарственная форма по п.20, отличающаяся тем, что действующее вещество (А) пространственно отделено от компонента (в), и/или компонента (г), и/или компонента (е), предпочтительно непосредственно не контактируют с указанным(-и) компонентом(-ами), при этом действующее вещество, соответственно действующие вещества (А) предпочтительно содержится/содержатся в по меньшей мере одной дозированной субъединице (X), а компонент (в), и/или компонент (г), и/или компонент (е) - в по меньшей мере одной другой дозированной субъединице (Y), в которой компонент (в), и/или компонент (г), и/или компонент (е) при применении лекарственной формы по прямому назначению не проявляет/проявляют своего действия при попадании в организм, соответственно при приеме внутрь.
32. Способ приготовления лекарственной формы по одному из пп.1-31, отличающийся тем, что компонент (А), компонент (В), возможно используемый компонент (Б), а также возможно используемые материалы, образующие замедляющую высвобождение действующего вещества матрицу, смешивают между собой, при этом возможно используемые компоненты (а)-(е) при необходимости отдельно смешивают между собой с добавлением компонента (В), и из полученной смеси, соответственно из полученных смесей, в некоторых случаях после ее, соответственно их гранулирования, путем приложения усилия с предварительным или одновременным тепловым воздействием формуют лекарственную форму и при необходимости снабжают ее замедляющим высвобождение действующего вещества покрытием.
33. Способ по п.32, отличающийся тем, что гранулирование проводят по методу гранулирования из расплава.
34. Способ по п.32, отличающийся тем, что гранулирование проводят по методу влажного гранулирования.
35. Способ приготовления лекарственной формы по одному из пп.1-31, отличающийся тем, что
а) из смеси, содержащей компонент (А), компонент (В), возможно используемый компонент (Б) и возможно используемые материалы, образующие замедляющую высвобождение действующего вещества матрицу, а также возможно используемые компоненты (а)-(е) и при необходимости приготовленной в виде отдельной смеси, путем приложения усилия формуют формованные заготовки,
б) полученные формованные заготовки при необходимости разделяют на части и при необходимости классифицируют по размерам,
в) до или во время нагрева до по меньшей мере температуры размягчения компонента (В) сохраняют действие приложенного к формованным заготовкам усилия до тех пор, пока они не достигнут твердости, при которой их сопротивление разрушению составляет по меньшей мере 500 Н,
г) формованные заготовки при необходимости снабжают покрытием, предпочтительно замедляющим высвобождение действующего вещества и/или маскирующим вкус покрытием, и затем формованные заготовки вновь смешивают между собой.
36. Лекарственная форма, получаемая способом по одному из пп.32-35.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Под ред | |||
| проф | |||
| В.И.Чуешова | |||
| Промышленная технология лекарств, в 2-х томах | |||
| - Харьков: "Основа", Издательство УкрФА, 1999, с.354 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2010-07-10—Публикация
2005-06-29—Подача