Изобретение относится к медицине, конкретно к новому химическому соединению, а именно к производному пространственно затрудненных аминоалкилфенолов формулы (1), которое обладает высоким антиаритмическим действием, связанным с блокадой катехоламиновых рецепторов, и проявляет антигипертензивную активность.

В настоящее время достигнуты значительные успехи в разработке как антиаритмических, так и антигипертензивных препаратов, относящихся к различным классам химических соединений. В то же время для усовершенствования терапии и профилактики различного рода сердечно-сосудистых заболеваний необходимо создание новых лекарственных средств, эффективно действующих в значительно меньших дозах, чем известные.
Заявляемое соединение относится по структуре к группе ароматических биологически активных соединений, содержащих в соседних положениях алифатической цепочки заместителя гидроксильную и аминогруппу [Б.Ф.Хоффман. Средства, активирующие адренорецепторы, и другие симпатомиметрические средства. В книге Б.Г.Кангцунг. Базовая и клиническая фармокология. 2000. Т.1 С.151-189.]. Близким аналогом по биологическому действию является метопролол, который является кардиоселективным β1-адреноблокатором без внутренней симпатомиметической активности [Лекарственные препараты зарубежных фирм в России. Справочник. М.: Астрафармсервис.1993. Метопролол. С.381-382]. Этот препарат оказывает антигипертензивное, антиангинальное и антиаритмическое действие, понижает автоматизм синусового узла, уменьшает ЧСС, замедляет AV-проводимость, снижает сократимость и возбудимость миокарда, уменьшает минутный объем сердца, снижает потребность миокарда в кислороде, а также подавляет стимулирующее влияние катехоламинов на сердце при физической и психоэмоциональной нагрузке [В.И.Подзоликов, В.В.Самойленко, К.К.Осадчий, Л.А.Стрижаков. Применение метопролола CR/ZOK в кардиологической практике. // Терапевтический архив. 2000. №9. С.78-80].
Задачей изобретения является создание нового химического соединения, обладающего низкодозной высокой антиаритмической активностью по отношению к различным видам аритмий и проявляющего в низких концентрациях дополнительно антигипертензивный эффект.
Поставленная задача решается новым химическим соединением формулы 1, обладающим высокой антиаритмической активностью.
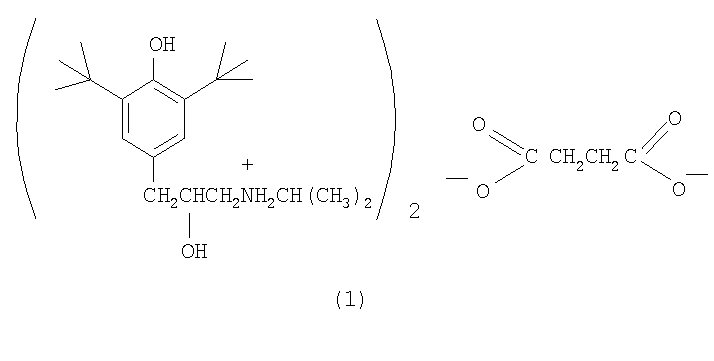
Соединение (1) синтезировано химическим путем в три стадии исходя из промышленно доступного 2,6-ди-трет-бутилфенола.
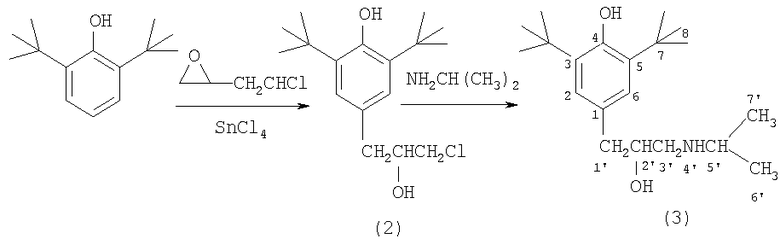
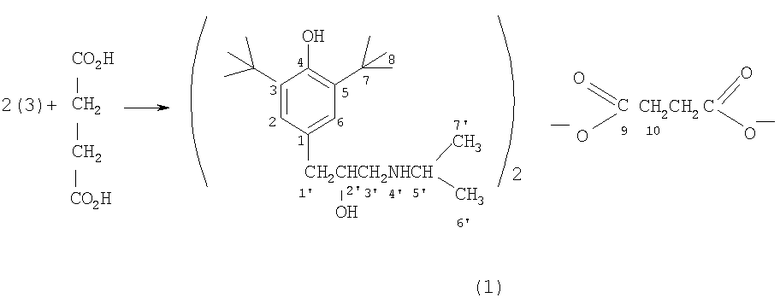
На первой стадии к раствору 2,6-ди-трет-бутилфенола в трихлорэтилене при температуре около 0°С порциями добавляют этиленхлоргидрин и четыреххлористое олово. Полученное с выходом 52% соединение (2) нагревают далее с изопропиламином, что приводит к амину (3) с 50%. Конечный продукт, сукцинат (1), получен с выходом 85% смешиванием растворов амина (3) и янтарной кислоты в ацетоне, из которого сукцинат (1) выпадает в виде белых кристаллов.
Биологическая активность соединения (1) изучалась путем определения токсичности, антиаритмической активности на моделях хлоридкальциевой и адреналиновой аритмии, а также антигипертензивного эффекта.
Острую токсичность определяли на белых беспородных мышах массой 18-22 г при пероральном введении в дозах от 50 мг/кг до 1 г/кг. Параметры токсичности рассчитывали по методу Кербера. LD50 для соединения (1) они составили 158 мг/кг и LD100-200 мг/кг.
Для исследования антиаритмической активности заявляемого соединения были использованы стандартные модели экспериментальных аритмий: адреналиновая (0,3 мг/кг, внутривенно) и хлоридкальциевая (250 мг/кг, внутривенно) на крысах. Для определения величины активности оценивали параметры электрокардиограммы [значения частоты сердечных сокращений и амплитуду зубца RR]. Полученные данные представлены в таблице 1.
Из данных табл.1 видно, что введение агента в дозе 0,0015 мг/кг предотвращает развитие аритмии, вызванной введением адреналина, и восстанавливает ЭКГ до нормы у 50% крыс. Исследование антиаритмической активности на хлоридкальциевой аритмии показало эффективность изучаемого агента в 50% случаях в дозе 1,5 мг/кг. В этом случае его эффективность в два раза выше, чем у метопролола.
Введение исследуемого агента в дозе 0,015 мг/кг блокирует развитие адреналиновой аритмии у 100% исследуемых животных. Как видно из таблицы, по сравнению с препаратом сравнения он показывает в целом более выраженные антиаритмические свойства.
Антигипертензивный эффект определяли при внутривенном введении агента в бедренную вену во время мониторинга давления путем введения датчика в сонную артерию крыс линии Вистар массой 180-220 г. Полученные результаты приведены в табл.2.
Из таблицы 2 видно, что агент снижает давление в дозе 0,015 мг/кг на 12% от исходной величины у крыс с нормальным артериальным давлением. Снижение давления наблюдалось через 5 минут после введения исследуемого вещества в бедренную вену. Увеличение дозы соединения (1) в этом эксперименте не приводит к более заметному снижению артериального давления у животных.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение сукцината ди-3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидрокси-1-(N-изопропиламино)пропана (1).
Стадия А. Получение 3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидроксихлорпропана-1 (2). В стеклянную колбу с мешалкой и капельной воронкой помещают раствор 20 г 2,6-ди-трет-бутилфенола в 20 мл трихлорэтилена. К охлажденному раствору до -3°С прибавляют при перемешивании 4 мл перегнанного SnCl4 и при этой температуре в течение 30 минут в реактор медленно прибавляют 6 мл эпихлоргидрина. В реактор помещают новую порцию 4 мл SnCl4 и при температуре 0-3°С в течение 30 минут в реактор прибавляют новую порцию раствора 5 мл эпихлоргидрина в 4 мл трихлорэтилена, следя за тем, чтобы температура в реакторе не повышалась выше 5-7°С. В реактор вводят новую порцию 4 мл SnCl4 и в течение 40 минут в реактор вводят раствор 5 мл эпихлоргидрина в 4 мл трихлорэтилена при температуре в реакторе не выше 5°С. Затем реакционную массу выдерживают при перемешивании при температуре 10-15°С в течение 20 мин, после чего в реактор небольшими порциями вводят 20 мл охлажденной воды, следя за тем, чтобы температура реакционной массы не превышала комнатную. Органический слой отделяют, промывают водой до нейтральной реакции и упаривают растворитель. Из полученного масла отгоняют под вакуумом 4,6 г не вступившего в реакцию 2,6-ди-трет-бутилфенола. Кубовый остаток - масло (20 г) - растворяют в 10 мл петролейного эфира и полученный раствор выдерживают сутки при температуре -15°С. Осадок отфильтровывают и промывают 10 мл охлажденного петролейного эфира. Получают 13,9 г 3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидрокси-1-хлорпропана (2). Объединенные фильтраты упаривают и перегоняют под вакуумом, собирая 3,7 г фракции с т.кип. 160°С/1 мм рт.ст. Ее кристаллизуют из гексана и получают дополнительно 2,1 г соединения (2) с т.пл. 97-98°С. Общий выход соединения (2) 16 г (53%). Найдено, %: С 68. 56; Н 9.34; Cl 11.90. ММ (хромато-масс-спектрометрически) 283. Вычислено, %: С 68,5; Н 9.1; Cl 11,9. ММ 283. ПМР-спектр (в CDCI3: 1,45 с.18 Н (две трет-С4Н9-группы); 2.31 с. 1H (-СНОН); 2.81 д. 2Н (PhCH 2); 3.5-3.7 м. (-CH 2Cl); 4.02 м. 1Н (-CHOHCH2Cl); 5.16 с. 1Н (ArOH); 7.03 с. 2Н (Ar-H).
Стадия Б. Получение 3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидрокси-1-(N-изопропиламино) пропана (3). В стальной вращающийся автоклав вместимостью 0,2 л помещают раствор 9,18 г (0,03 мол) (4-(3-хлор-2-гидроксипропил)-2,6-ди-трет-бутилфенола (2) в 30 мл изопропанола, 20 мл изопропиламина (0,23 мол). Содержимое выдерживают при вращении 12 часов при температуре 100°С. Затем упаривают на ротационном испарителе и получают 8,5 г твердого коричневого остатка, который растворяют в метил-трет-бутиловом эфире и встряхивают в течение 5 минут с раствором 1,3 г NaOH в 10 мл воды. Органический слой упаривают и получают смесь кристаллов с маслом, из которого масло отделяют на фильтре. Твердый остаток кристаллизуют из петролейного эфира и получают 5 г (выход 50%) белых кристаллов соединения (3), т.пл. 90-91°С. Найдено, %: С 74,10; Н 11,20; N 4,26. М 321 (хромато-масс-спектрометрически). Вычислено, %: С 74,6: Н 10,9; N 4,35. С20Н35О2 N. М 321,2668. ПМР - спектр в (CD3)2SO, δ, м.д., J/Гц): 0,95 (д. J=7.5, 6Н, (СН3)2СН-); 1,40 (с.18 Н 2С4Н9-трет.); 2,6-2,7 (т. J=7.0, 2Н ArCH2-); 3,5-3,6 (м. 1Н -СН2 СНОН-) Спектр 13С в растворе (CD3)2SO, δ, м.д.): С6' и С7' 22,8; С7 30,47; С8 34,30; С1' 41,72; С3' 48,19; С5' 53,9; С2' 70,92; С3 и С5 125,29; С1 130,17; С2 и С6 138,67; С4 151,85.
Стадия В. Получение сукцината ди-3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидрокси-1-(N-изопропиламино)пропана (1). При температуре 50°С при перемешивании готовят раствор 4,0 г соединения (3) в 20 мл изопропанола. К нему прибавляют раствор 0,72 г янтарной кислоты в 20 мл изопропанола и смесь растворов выдерживают при перемешивании 1 ч при 50°С, а затем оставляют на ночь при комнатной температуре. Выпавший осадок отфильтровывают, промывают 5 мл изопропанола и сушат на воздухе. Получают 4,0 г (85%) белого вещества - сукцината (1), растворяющегося при комнатной температуре в воде. Т.пл. 186-189°С. Найдено, %: С 68,70; Н 10,00; N 3,68. М 761 (методом парофазной осмометрии). C44H76O8N2. Вычислено, %: С 69,00; Н 10,00; N 3,60. М 760,1. ИК-спектр в KBr, v/см-1: 651,8 (ср.), 1137 (ср.), 1155 (ср.), 1382 (c.), 1435 (c.), 1638,5 (ср.), 2456 (ср.), 2915 (c.), 3641 (ср.).
ПМР-спектр в растворе CD3OD(δ, м.д., J/Гц): 1,30 (т. J=6,5, 6Н, 2СН3, Н6' и Н7'), 1,45 (с. 18Н 2C4H9-трет. Н9), 2,50 (с.4Н -СН2СН2-, Н10), 2,71-2,81 (кв. кв. 2Н, Н1'), 2,84-2,90 (д.д. J=11, 1Н, Н3'), 2,29-3,05 (д.д. J1=4, J2=11, 1H, Н3'), 3,28-3,34 (м. 1Н, Н5'), 4,00-4,08 (м., 1Н, Н2'), 4,93 (с. 1Н, ArOH), 7,06(с. 2Н, Н2 и Н6).
Спектр 13С в растворе (CD3OD, δ м.д.): С6' 19,2; С7' 19,7; С7 30,8; С10 34,4; С8 35,4; С1' 42,9; С3' 50,9; С5' 51,3; С2' 70,0; С3 и С5 126,8; C1 l29,4; С2 и С6 139,4; С4 153,9; С9 181,7.
Пример 2. Изучение антиаритмической активности сукцината ди-3-(3,5-трет-бутил-4-гидроксифенил)-2-гидрокси-1-(N-изопропиламино)пропана.
Опыты проводили на наркотизированных (тиопентал натрия в дозе 30 мг/кг внутрибрюшинно) половозрелых самцах крыс массой 190-220 г. Все манипуляции проводили в соответствии с правилами и принципами гуманного обращения с животными. Опыты проводились в одно и то же время с 900 до 1200. Для выполнения исследований животных разделяли на группы по 10 особей в каждой. Изучение антиаритмической активности агента проводили при внутривенном введении агента в дозах 1,5 мг/кг, 0,015 мг/кг и 0,0015 мг/кг. Аритмию вызывали путем однократного введения в бедренную вену 10% раствора CaCl2 в дозе 250 мг/кг или адреналина гидрохлорида (АГ) в дозе 0,3 мг/кг. Данные дозы CaCl2 и АГ являются летальными для крыс в 100% случаях.
Запись ЭКГ проводилась в течение 10 мин. ЭКГ регистрировали во втором стандартном отведении на приборе фирмы «LabLinc V» model v75-11. Оценивали длительность интервалов RR, PQ, QRS, QT, зубца Р; амплитуду зубцов Р, Т, R. Обработка данных велась программой "Statistica 6.0", используя параметрический анализ Стьюдента. В качестве отклонения от среднего значения использовалась средняя статистическая ошибка. Полученные данные представлены в таблице 1.
Пример 3. Изучение антигипертензивных свойств сукцината ди-3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидрокси-1-(N-изопропиламино) пропана.
Измерение артериального давления проводили в остром эксперименте путем введения канюли в сонную артерию. Регистрацию показателей вели с помощью прибора фирмы «Coulbourn instruments)) (США). Обработку данных вели с помощью программы "Statistica 6.0" посредством усреднения основных показателей систолического и диастолического артериального давления. В качестве отклонения от среднего значения использовалась средняя статистическая ошибка, в качестве критерия достоверности был взят t-критерий Стьюдента. Полученные данные представлены в таблице 2.
Из данных следует, что соединение в одной и той же низкой дозе 0,015 мг/кг является эффективным антиаритмическим и антигипертензивным агентом.
Таким образом, новое соединение - сукцинат ди-3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидрокси-1-(N-изопропиламино) пропана - обладает высокой антиаритмической активностью на моделях хлоридкальцевой и андреналиновой аритмии. Соединение проявляет достоверную антиаритмическую активность на модели адреналиновой аритмии в дозе 0.0015 мг/кг. Кроме того, соединение обладает антигипертензивной активностью в дозе 0.015 мг/кг.
Способ получения заявляемого соединения (1) отличается доступностью реагентов и простотой технологического оформления. Как само соединение (1), так и промежуточные соединения его синтеза (2) и (3) - являются новыми.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФТОРИРОВАННЫЕ 4-ФУРФУРИЛ-3,4-ДИГИДРО-2Н-БЕНЗО[1,4]ТИАЗИН-1,1-ДИОКСИДЫ, ОБЛАДАЮЩИЕ ВЫСОКОЙ АРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2626239C1 |
| БИС-(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИФЕНИЛ)ПРОПИЛ)СЕЛЕНИД, ОБЛАДАЮЩИЙ АНТИОКСИДАНТНОЙ И ГИПОГЛИКЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2586067C1 |
| ГИДРОБРОМИД 5`-БРОМЛАППАКОНИТИНА, ОБЛАДАЮЩИЙ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2295524C1 |
| 16-{2-БЕНЗОИЛАМИНО-2-[(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИФЕНИЛ)-АЛКИЛКАРБАМОИЛ]ВИНИЛ}-ЛАБДАТРИЕНЫ С АНТИОКСИДАНТНЫМИ, ГЕПАТОПРОТЕКТОРНЫМИ И ГЕМОСТИМУЛИРУЮЩИМИ СВОЙСТВАМИ | 2007 |
|
RU2346940C1 |
| СПОСОБ СНИЖЕНИЯ ЧАСТОТЫ СЕРДЕЧНЫХ СОКРАЩЕНИЙ, ВКЛЮЧАЮЩИЙ ВВЕДЕНИЕ АГОНИСТА РЕЦЕПТОРА АДЕНОЗИНА А ВМЕСТЕ С БЕТА-БЛОКАТОРОМ, БЛОКАТОРОМ КАЛЬЦИЕВЫХ КАНАЛОВ ИЛИ СЕРДЕЧНЫМ ГЛИКОЗИДОМ | 2003 |
|
RU2332220C2 |
| ОТВЕРЖДАЕМАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТЕРМОЛАТЕНТНОЕ ОСНОВАНИЕ | 2009 |
|
RU2487867C2 |
| Способ получения N- (3- алкиламинопропил) -N @ - фенилмочевины или их фармакологически приемлемых солей /его варианты/ | 1980 |
|
SU1344245A3 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ МЕТАСТАЗИРОВАНИЯ В ЛЕГКИХ | 2021 |
|
RU2765955C1 |
| (1-ГИДРОКСИ-4,5-ДИМЕТИЛ-1Н-ИМИДАЗОЛ-2-ИЛ)(ФЕНИЛ)МЕТАНОНОКСИМ, ПРОЯВЛЯЮЩИЙ АНТИАРИТМИЧЕСКИЕ СВОЙСТВА | 2012 |
|
RU2478622C1 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ МЕТАСТАЗИРОВАНИЯ В ЛЕГКИХ | 2021 |
|
RU2762730C1 |
Изобретение относится к медицине, конкретно к новому соединению - сукцинату ди-3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидрокси-1-(N-изопропиламино)пропана (1), обладающему антиаритмической и антигипертензивной активностью.
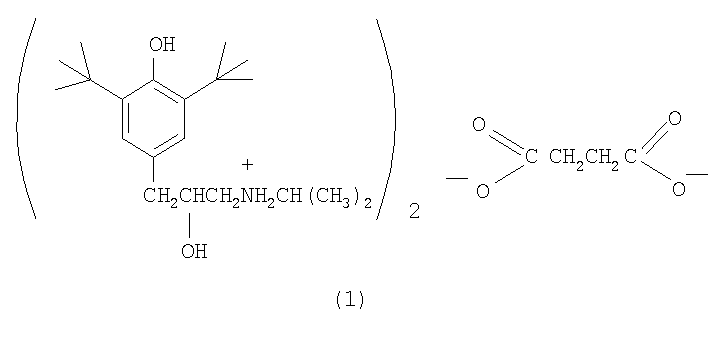
Соединение (1) синтезировано в три стадии. На первой стадии к раствору 2,6-ди-трет-бутилфенола в трихлорэтилене добавляют этиленхлоргидрин и четыреххлористое олово. Полученное соединение нагревают далее с изопропиламином, что приводит к образованию соответствующего амина. Конечный продукт, сукцинат (1), получен смешиванием растворов амина и янтарной кислоты в ацетоне, из которого сукцинат (1) выпадает в виде белых кристаллов. 2 табл.
Сукцинат ди-3-(3,5-ди-трет-бутил-4-гидроксифенил)-2-гидрокси-1-(N-изопропиламино)пропана формулы (I):

обладающий антиаритмической активностью.
| Способ получения 1-изопропиламино-3-фенокси-2-пропанола | 1983 |
|
SU1321371A3 |
| Способ получения 1-изопропиламино-3- @ 4-(2-метоксиэтил)-фенокси @ -2-пропанола | 1982 |
|
SU1170968A3 |
Авторы
Даты
2010-08-10—Публикация
2008-12-03—Подача