Мутации в гене HFE (6р21.3) приводят к развитию наследственного, или классического гемохроматоза, клиническими последствиями которого являются цирроз печени, диабет, сердечная недостаточность и пигментация кожи. Одну треть смертей у гомозиготных носителей вызывает гепатоцеллюлярная карцинома. Тяжелые последствия наследственного гемохроматоза тем не менее можно предотвратить, так как состояние больных легко поддается коррекции на ранних стадиях развития болезни, если удается обнаружить мутации, приводящие к развитию данного заболевания. Клинически наследственный гемохроматоз на ранних стадиях диагностируется плохо.
Гемохроматоз (наследственный, или классический) является аутосомно-рецессивным заболеванием (1). Ген HFE экспрессируется по двум аллелям, и таким образом у гетерозиготных носителей мутаций могут также развиваться признаки заболевания (1). В то же время, если человек придерживается особой диеты, ограничивающей поступление железа в организм, признаки заболевания могут отсутствовать. Мутации в гене HFE - явление довольно распространенное. Считается, что среди наследственных заболеваний классический гемохроматоз - одно из самых распространенных заболеваний. Среди мутаций, связанных с развитием гемохроматоза, самой изученной является мутация C282Y. Среди причин развития рака печени данная мутация стоит на первом месте (8,8%) при условии ее гомозиготного состояния (2). В группе больных с циррозом печени гомозиготные носители по данной мутации встречаются в 2,6% случаев (3). Распространенность гемохроматоза в США (штат Юта), по некоторым данным, определяется как 5,6%, при этом гомозиготы составляют 0,3%, а гетерозиготы 10,6% (3). По другим данным частота встречаемости заболевания колеблется от 1:333 до 1:500 (4,5). Встречаемость мутантных аллелей в Европе в отдельных популяциях составляет 29,7%, 5,2% и 3% для H63D, C282Y и S65C соответственно (6). Мутация 2ЕХ+4Т>С в сайте сплайсинга второго экзона большинством исследователей считается обычным полиморфизмом, однако единого мнения на этот счет нет. Вместе с тем известно, что замена 4-го нуклеотида Т на С в донорном сайте сплайсинга находится в неустойчивом сцеплении с мутациями S65C и H63D.
УРОВЕНЬ ТЕХНИКИ
Известны различные подходы к определению точечных мутаций в генах, в том числе и в гене HFE, в которых используются характеристики плавления дуплексов (7-10). Наиболее близким аналогом настоящего изобретения можно считать способ, предложенный Marzilliano N. et al. (8). Данный способ предназначен для идентификации мутаций H63D и C282Y путем аллель-специфической амплификации соответствующих участков гена в присутствии интеркалирующего красителя Sybr Green 1 и последующей регистрации конечного продукта по кривым плавления ампликонов. Основным недостатком прототипа является его недостаточная разрешающая способность в части различения гомо- и гетерозигот, а также ограничение анализа лишь двумя мутациями, которые известны как предрасполагающие к развитию заболевания.
В способе по изобретению указанные недостатки устраняются благодаря а) включению в анализ третьей мутации S65C и полиморфизма 2ЕХ+4Т>С, который выполняет роль дополнительного контроля на наличие мутаций H63D и S65C, и б) раздельному получению копий мутантного и нормального аллелей для каждой из исследуемых мутаций. Это позволяет повысить разрешающую способность метода и соответственно точность диагностики.
Процедура тестирования сводится к следующему. В одном амплификаторе одновременно проводят ПЦР для восьми проб, полученных из одного образца ДНК, с аллель-специфическими праймерами.
Каждая реакция производится в отдельной пробирке или отдельной ячейке 96-луночной ПЦР панели, где присутствуют компоненты той или иной тест-системы. Испытуемый образец ДНК, полученный с использованием любого известного способа выделения с применением любого коммерческого набора (в частности "GFX Genomic Blood DNA Purificftion Kit" / Amersham/) добавляется по 2 мкл в каждую из восьми реакционную смесь. Одновременно в том же приборе и в тех же условиях проводятся реакции с контрольными ДНК, в которых наличие/отсутствие мутаций заранее подтверждено независимым методом.
Тест выполняется с использованием олигонуклеотидов, имеющих последовательности:
gct-cca-cac-ggc-gac-tct-cat-g-3' - 63Н /праймер, идентифицирующий нормальный аллель 63 Hys (1)
gct-cca-cac-ggc-gac-tct-cat-c-3' - 3D
/праймер, идентифицирующий мутантный аллель 63 Asp (2)
acg-tgg-atg-acc-agc-tgt-tcg-tgt-t-3' - 63F /общий праймер для тест-систем (1 и 2)
gct-gtt-cgt-gtt-cta-tga-tca-tga-ga-3' - 65S /праймер, идентифицирующий нормальный аллель 65 Ser (3)
gct-gtt-cgt-gtt-cta-tga-tca-tga-gt-3' - 65C /праймер/, идентифицирующий мутантный аллель 63 Cis (4)
tgc-agc-cac-atc-tgg-ctt-gaa-3' - 65R /общий праймер для тест-систем (3 и 4)
tgg-gga-aga-gca-gag-ata-tac-gtg-3' - 282С /праймер, идентифицирующий нормальный аллель 282 Cis (5)
tgg-gga-aga-gca-gag-ata-tac-gta-3' - 282Y /праймер, идентифицирующий мутантный аллель 282 Tyr (6)
ggc-act-cct-ctc-aac-ccc-caa-tag-3' - 282R /общий праймер для тест-систем (5 и 6)
cac-aac-cac-agc-aag-ggt-at-3' - 2ЕХ+4FТ /праймер, идентифицирующий нормальный аллель (7)
aca-acc-aca-gca-agg-gta-c-3' - 2EX+4FC /праймер, идентифицирующий мутантный аллель (8)
gaa-aag-ctc-tga-caa-cct-cag-gaa-3' -2EX+4R /общий праймер для тест-систем (7 и 8)
Реакционная смесь объемом 50 мкл состоит из:
10-кратный буфер - 5 мкл
дАТФ, дЦТФ, дГТФ, дТТФ - каждого по 5 мМ
специфические праймеры - каждого по 12 pMol
Taq ДНК полимераза - 5 ед
флуоресцентный интеркалирующий краситель Sibr Green в конечной концентрации 1:10000-1:100000
ДНК - 2 мкл
Н2O до 50 мкл
35 циклов реакция протекают по схеме:
95°C-30 сек
68°С-30 сек
72°С-1 мин
на любом амплификаторе с размером ячейки 0,2 мл (Циклотемп 107/ МГТУ им. Баумана).
Регистрация результатов производится по кривой плавления в амплификаторе с оптическим модулем, позволяющим регистрировать флуоресценцию с длиной волны 520 нм. Устанавливается шаг нагрева модуля от 60°С до 95°С - 1°С/мин. Точка диссоциации ампликонов находится в области 82-85°С. Результат эксперимента учитывается по наличию пика, соответствующего точке диссоциации контрольной ДНК, наличие/отсутствие мутаций в которой заранее подтверждено независимым способом. Несмотря на возможность вычисления температуры плавления для ампликонов (11), сопоставление результатов тестов испытуемой ДНК и контрольной необходимы, поскольку эмпирические данные редко в точности совпадают с расчетными показателями, кроме того, они могут варьировать в результате изменения условий реакций, которые трудно абсолютно идентично выдержать от теста к тесту.
При наличии пика, соответствующего ПЦР продукту в пробирке с тест-системой на мутацию C282Y - соответствующий мутантный аллель присутствует в испытуемой ДНК. Если при этом нет пика, идентифицирующего не мутантный аллель, то мутация C282Y находится в гомозиготном положении. При гомозиготном положении мутации в пробирке с тест-системой на нормальный аллель (С282) продукт ПЦР будет отсутствовать и соответственно не будет сигнала диссоциации продукта ПЦР.
При гетерозиготном положении мутации C282Y в испытуемой ДНК пики плавления ДНК будут регистрироваться в пробирках с тест-системами на нормальный аллель и на мутантный аллель.
Отсутствие ПЦР фрагмента в пробирке с тест-системой на мутацию C282Y при одновременном наличии специфичного продукта ПЦР в пробирке на нормальный аллель, определяемого по соответствию кривой диссоциации фрагмента контрольной нормальной ДНК, свидетельствует о том, что оба аллеля тестируемой ДНК кодируют цистеин на 282 позиции белка (ген HFE), т.е. мутация отсутствует.
Аналогичным образом оцениваются результаты тестирования на мутации H63D, S65C, а также полиморфизм 2ЕХ+4Т>С.
ПРИМЕРЫ РАБОТЫ ТЕСТ-СИСТЕМ.
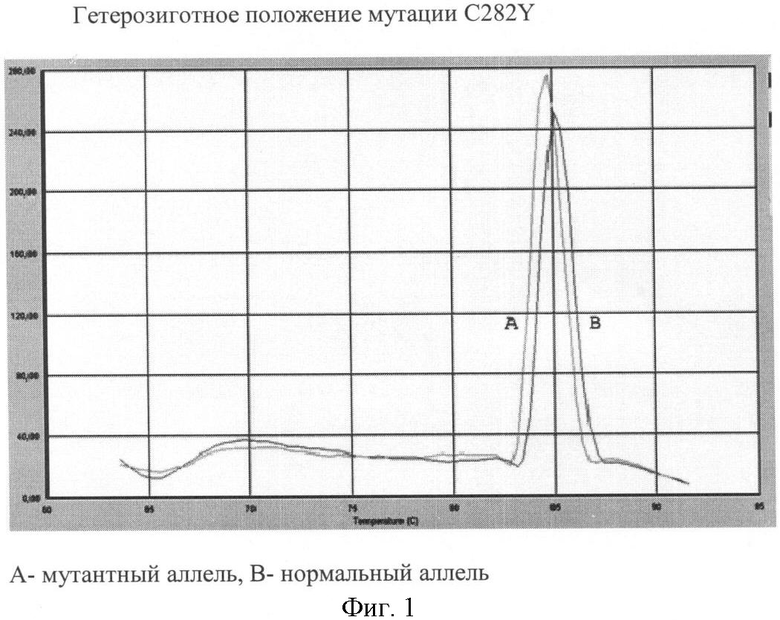
Вариант №1 (фиг.1)
- ДНК мишень содержит мутацию C282Y в гетерозиготном положении. Тест-системы на нормальный и на мутантный аллель продуцируют ПЦР продукты, что регистрируется по наличию двух кривых диссоциации 84.7 - 85.1°С.
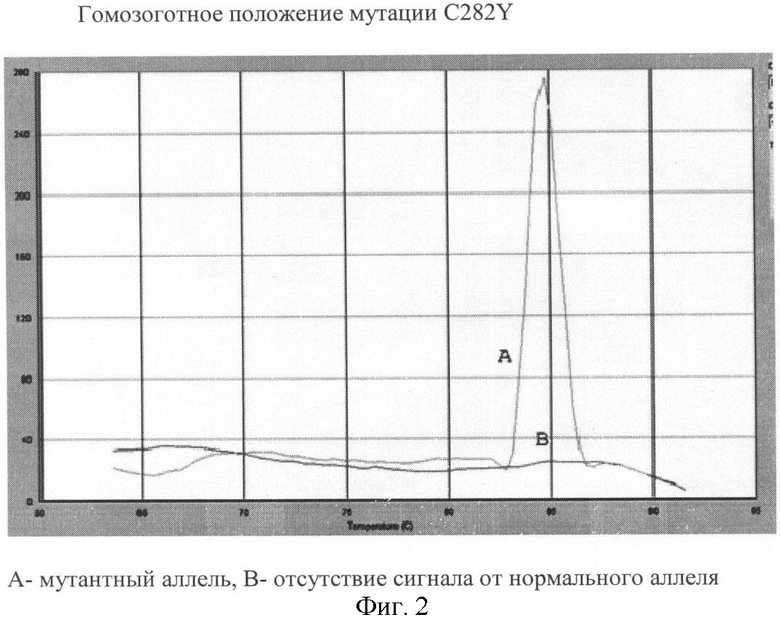
Вариант №2 (фиг.2)
- ДНК мишень содержит мутацию C282Y в гомозиготном положении. Тест-система на мутантный аллель продуцирует ПЦР продукт, что регистрируется по наличию кривой диссоциации 84.7°С. Тогда как пик диссоциации не регистрируется в пробирке с тест-системой на нормальный аллель.
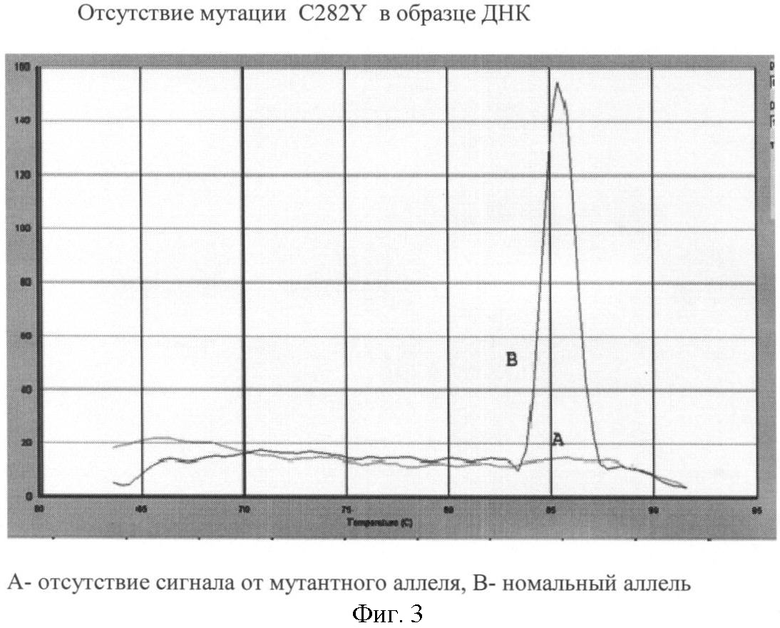
Вариант №3 (фиг.3)
- ДНК мишень не содержит мутацию C282Y. Тест-система на нормальный аллель продуцирует ПЦР продукт, что регистрируется по наличию кривой диссоциации 85°С. Тогда как пик диссоциации не регистрируется в пробирке с тест-системой на мутантный аллель.
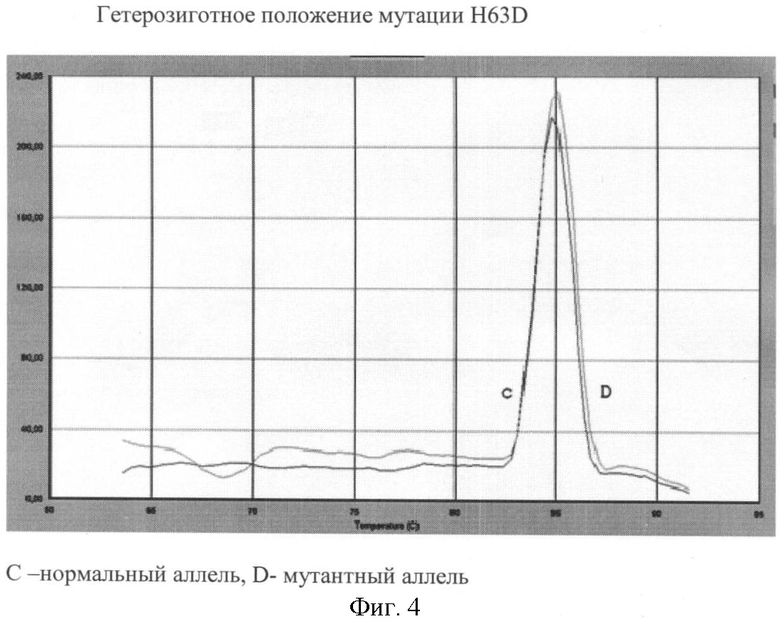
Вариант №4 (фиг.4)
- ДНК мишень содержит мутацию H63D в гетерозиготном положении. Тест-системы на нормальный и на мутантный аллель продуцируют ПЦР продукты, что регистрируется по наличию двух кривых диссоциации 84.7 - 85.1°С.
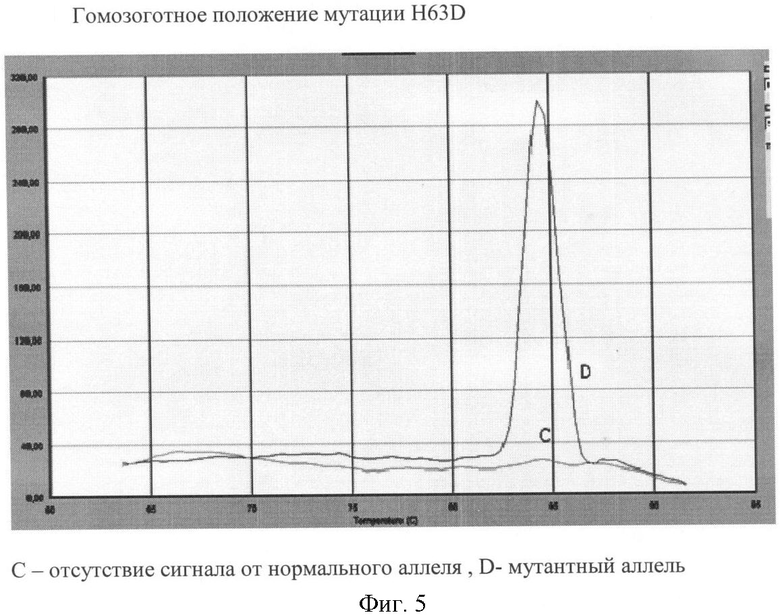
Вариант №5 (фиг.5)
- ДНК мишень содержит мутацию H63D в гомозиготном положении. Тест-система на мутантный аллель продуцирует ПЦР продукт, что регистрируется по наличию кривой диссоциации 84.8°С. Тогда как пик диссоциации не регистрируется в пробирке с тест-системой на нормальный аллель.
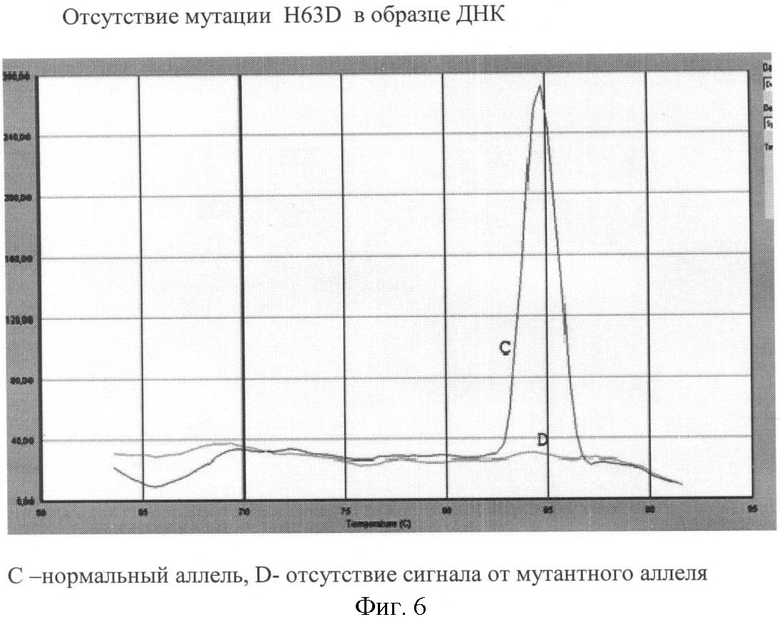
Вариант №6 (фиг.6)
- ДНК мишень не содержит мутацию H63D. Тест-система на нормальный аллель продуцирует ПЦР продукт, что регистрируется по наличию кривой диссоциации 85°С. Тогда как пик диссоциации не регистрируется в пробирке с тест-системой на мутантный аллель.
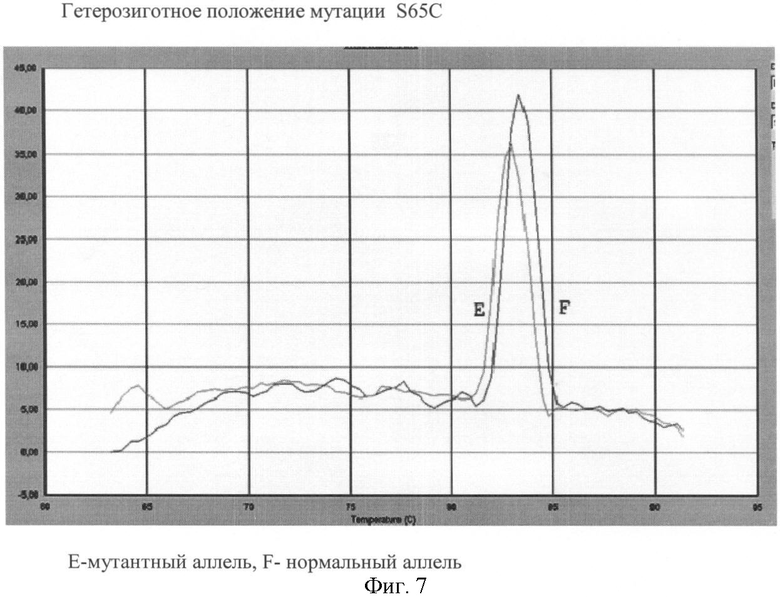
Вариант №7 (фиг.7)
- ДНК мишень содержит мутацию S65C в гетерозиготном положении. Тест-системы на нормальный и на мутантный аллель продуцируют ПЦР продукты, что регистрируется по наличию двух кривых диссоциации 83.8°С.
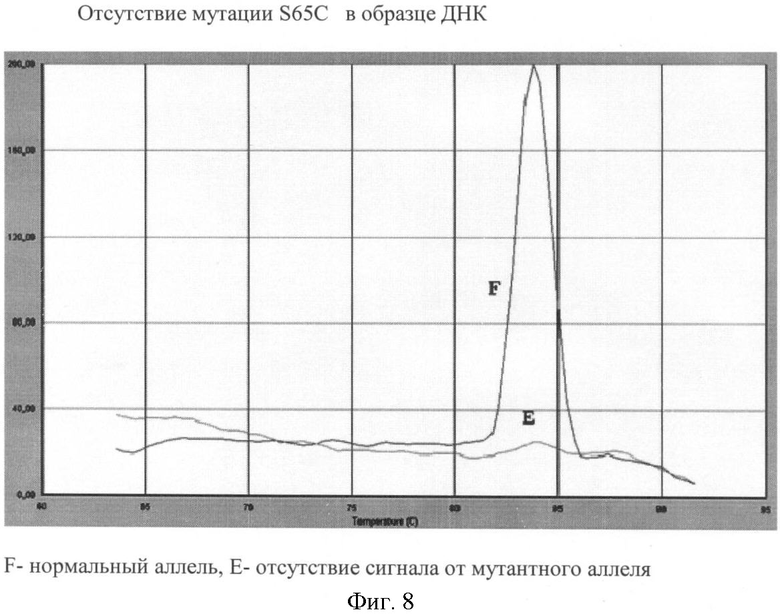
Вариант №8 (фиг.8)
- ДНК мишень не содержит мутацию S65C. Тест-система на нормальный аллель продуцирует ПЦР продукт, что регистрируется по наличию кривой диссоциации 83.8°С. Тогда как пик диссоциации не регистрируется в пробирке с тест-системой на мутантный аллель.
(Мутация S65C является редким событием, поэтому нам не удалось среди тестируемых образцов ДНК обнаружить данную мутацию в гомозиготном положении).
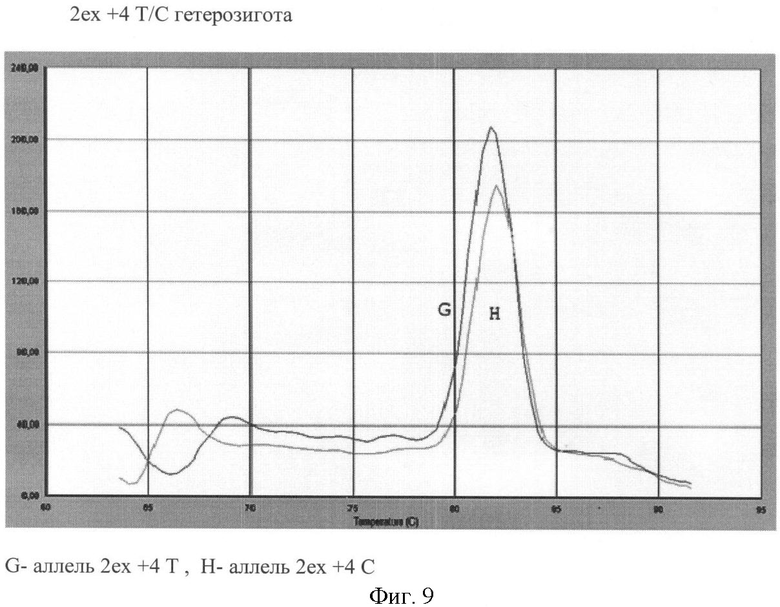
Вариант №9 (фиг.9)
- ДНК мишень содержит полиморфизм 2ех+4Т>С в гетерозиготном положении. Тест-системы на аллель 2ех+4Т и аллель 2ех+4С продуцируют ПЦР продукты, что регистрируется по наличию двух кривых диссоциации 82-82.6°С.
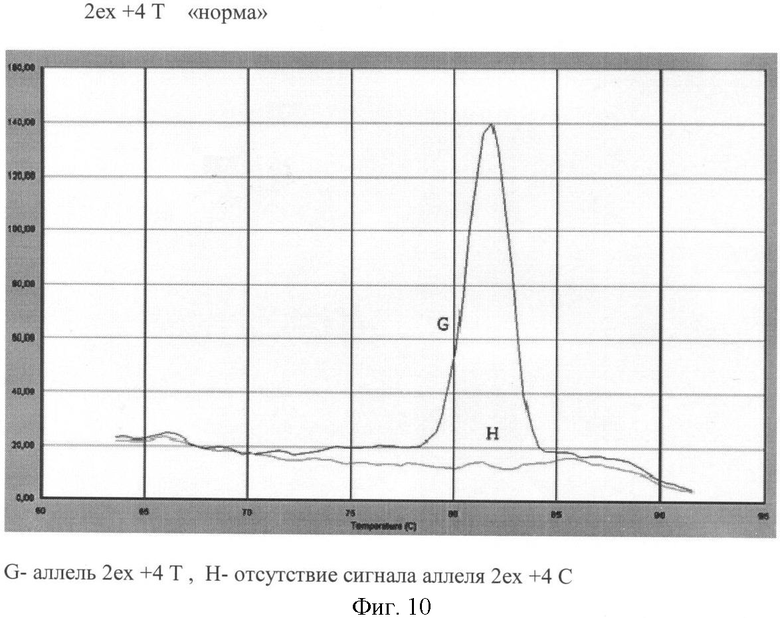
Вариант №10 (фиг.10)
- ДНК мишень содержит аллель 2ех+4Т в гомозиготном положении. Тест-система на аллель 2ех+4Т продуцирует ПЦР продукт, что регистрируется по наличию кривой диссоциации 82.6°С. Тогда как продукт ПЦР в пробирке с тест-системой на аллель 2ех+4С отсутствует (нет кривой диссоциации).
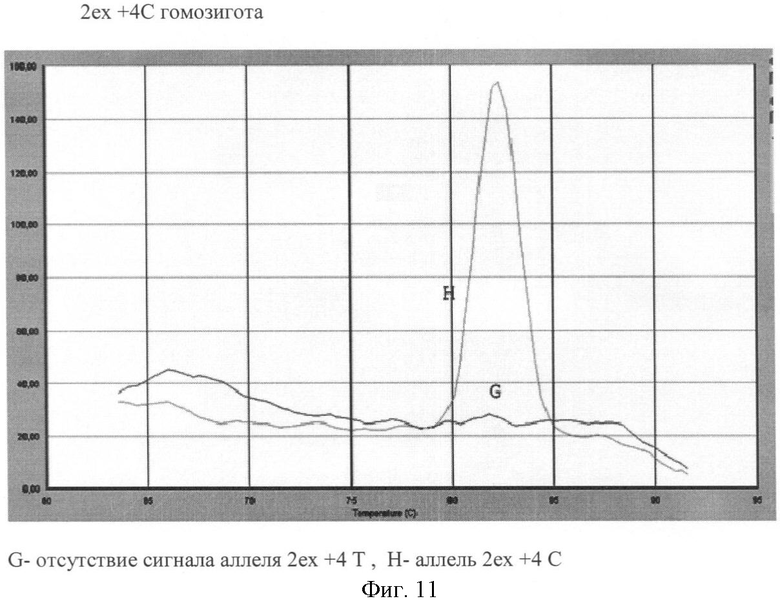
Вариант №11 (фиг.11)
- ДНК мишень содержит аллель 2ех+4С в гомозиготном положении. Тест-система на аллель 2ех+4С продуцирует ПЦР продукт, что регистрируется по наличию кривой диссоциации 82.6°С. Тогда как продукт ПЦР в пробирке с тест-системой на аллель 2ех+4Т отсутствует (нет кривой диссоциации).
Источники информации
1. Borecki et al. // Am. J. Hum. Genet. 47: 542-550, 1990.
2. Willis et al. // Gut 46:401-404, 2000.
3. Cartwright et al. // New Eng. J. Mod. 301: 175-179, 1979.
4. Beaumont et al. // New Eng. J. Med. 301: 169-174, 1979.
5. MacSween&Scott et al. //. J. Clin. Path. 26: 936-942, 1973.
6. de Juan et al. // Europ. J. Hum. Genet. 9: 961-964, 2001.
7. Smillie D.//J.Clin. Pathol: Mol. Pathol., 51, 232-236, 1998.
8. Marzilliano N. //Haematol, 85, 9, 990-991, 2000.
9. Papp A. et al. // Biotech. 34, 5, 1068-1072, 2003.
10. Germer S.& Higuchi R. // Gen. Res. 9, 72-78, 1999.
11. Lew M. et al. //Clin. Chem., 50, 7, 1156-1164, 2004.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОДНОВРЕМЕННОГО ДНК-ТЕСТИРОВАНИЯ НА НАЛИЧИЕ ПОЛИМОРФИЗМОВ Н63D И C282Y В ГЕНЕ HFE, СВЯЗАННЫХ С НАСЛЕДСТВЕННЫМ ГЕМОХРОМАТОЗОМ | 2006 |
|
RU2304170C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОБЪЕДИНЕННЫХ ФРАГМЕНТОВ ДНК В ПЦР (ВАРИАНТЫ) | 2010 |
|
RU2441919C2 |
| СПОСОБ ДЕТЕКЦИИ ДЕЛЕЦИИ У КРЫС ЛИНИИ DAT | 2023 |
|
RU2811140C1 |
| СПОСОБ ОДНОВРЕМЕННОЙ ГЕНОДИАГНОСТИКИ ДВУХ МУТАНТНЫХ АЛЛЕЛЕЙ, ВЫЗЫВАЮЩИХ CVM И BLAD У КРУПНОГО РОГАТОГО СКОТА, И ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2015 |
|
RU2601151C2 |
| НАБОР ПОСЛЕДОВАТЕЛЬНОСТИ ПРАЙМЕРОВ И АЛЛЕЛЬ-СПЕЦИФИЧЕСКИХ ЗОНДОВ ДЛЯ ОДНОВРЕМЕННОЙ ГЕНОДИАГНОСТИКИ ДВУХ МУТАНТНЫХ АЛЛЕЛЕЙ, ВЫЗЫВАЮЩИХ CVM И BLAD У КРУПНОГО РОГАТОГО СКОТА | 2015 |
|
RU2577990C1 |
| Тест-система для выявления однонуклеотидной замены (A→G) позиции 383 гена CD18, ассоциированной с дефицитом адгезии лимфоцитов у коров (BLAD), с помощью специфических олигонуклеотидных праймеров в полимеразной цепной реакции | 2019 |
|
RU2731058C1 |
| СПОСОБ ГЕНОДИАГНОСТИКИ МУТАНТНОГО АЛЛЕЛЯ, ВЫЗЫВАЮЩЕГО КОРОТКИЙ ПОЗВОНОЧНИК ИЛИ БРАХИСПИНУ У КРУПНОГО РОГАТОГО СКОТА, И ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2016 |
|
RU2664454C2 |
| Способ поиска мутаций гена ATP7B для постановки диагноза болезни Вильсона (Вильсона-Коновалова) | 2023 |
|
RU2821573C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ МУТАЦИИ В ГЕНЕ BTPKD СОБАКИ ДОМАШНЕЙ (CANIS LUPUS FAMILIARIS), ВЫЗЫВАЮЩЕЙ ПОЛИКИСТОЗ ПОЧЕК | 2020 |
|
RU2763933C1 |
| СПОСОБ АНАЛИЗА СОМАТИЧЕСКИХ МУТАЦИЙ В ГЕНЕ PI3K С ИСПОЛЬЗОВАНИЕМ LNA-БЛОКИРУЮЩЕЙ МУЛЬТИПЛЕКСНОЙ ПЦР И ПОСЛЕДУЮЩЕЙ ГИБРИДИЗАЦИЕЙ С ОЛИГОНУКЛЕОТИДНЫМ БИОЛОГИЧЕСКИМ МИКРОЧИПОМ (БИОЧИПОМ) | 2013 |
|
RU2549682C1 |
Изобретение относится к области молекулярной биологии и может быть использовано в медицинской практике при диагностике наследственного гемохроматоза (НГХ). Предложен простой в исполнении способ одновременной идентификации трех основных мутаций (S65C, H63D, C282Y) в гене HFE, связанных с развитием НГХ, и полиморфизма 2 EX+4Т>С, используемого в качестве дополнительного контроля на наличие мутаций S65C и H63D. Способ предусматривает проведение аллель-специфической ПЦР в присутствии красителя Sybr Green 1, в которой мутантный и нормальный аллели получают в различных реакционных сосудах, и определение конечного продукта путем анализа кривых температурной диссоциации ампликонов. 11 ил.
Способ одновременного определения основных мутаций в гене HFE, связанных с наследственным гемохроматозом, предусматривающий ПЦР-амплификацию участков гена, которые включают сайты определяемых мутаций, в присутствии интеркалирующего красителя Sybr Green 1 и последующую идентификацию мутаций по кривым диссоциации полученных фрагментов ДНК, отличающийся тем, что одновременно тестируют три мутации S65C, H63D и C282Y, а также полиморфизм 2 EX+4Т>С, используемый в качестве дополнительного контроля на наличие мутаций S65C и H63D; каждое из четырех определений проводят в двух пробах, содержащих по два праймера, один из которых является одинаковым, а другой обеспечивает амплификацию либо нормального, либо мутантного аллеля, используя при этом следующие специфические олигонуклеотиды:
(1) gctccacacggcgactctcatg-3' (праймер, идентифицирующий нормальный аллель 63 His),
(2) gctccacacggcgactctcatc-3' (праймер, идентифицирующий мутантный аллель 63 Asp),
acgtggatgaccagctgttcgtgtt-3' (праймер, общий для проб (1) и (2));
(3) gctgttcgtgttctatgatcatgaga-3' (праймер, идентифицирующий нормальный аллель 65Ser),
(4) gctgttcgtgttctatgatcatgagt-3' (праймер, идентифицирующий мутантный аллель 65 Cis),
tgcagccacatctggcttgaa-3' (праймер, общий для проб (3) и (4));
(5) tggggaagagcagagatatacgtg-3' (праймер, идентифицирующий нормальный аллель 282Cis),
(6) tggggaagagcagagatatacgta-3' (праймер, идентифицирующий мутантный аллель 282Туr),
ggcactcctctcaacccccaatag-3' (праймер, общий для проб (5) и (6));
(7) cacaaccacagcaagggtat-3' (праймер, идентифицирующий нормальный аллель 2ЕХ+4Т),
(8) acaaccacagcaagggtac-3' (праймер, идентифицирующий мутантный аллель 2ЕХ+4С),
gaaaagctctgacaacctcaggaa-3' (праймер, общий для проб (7) и (8)).
| MARZILIANO N | |||
| et al | |||
| Haematologica, 2000, 85(9), 990-991 | |||
| SMILLIE D., J.Clin | |||
| Pathol:Mol.Pathol., 1998, 51, 232-236 | |||
| GERMER S., HIGUCHI R., Genome Research, 1999, 9, 72-78 | |||
| LIEW M | |||
| et al | |||
| Clin | |||
| Chem., 2004, 50(7), 1156-1164. |
Авторы
Даты
2010-08-10—Публикация
2008-04-03—Подача