Изобретение относится к применяемым в области химии способам получения оксида циркония для производства катализаторов, используемых, например, в реакциях органического синтеза.
Известен (Патент РФ 2125969, C01G 25/02, С25В 1/00. Седнева Т.А., Тюлюнов И.П., Маслобоев В.А., опубликовано 10.02.1999) способ получения диоксида циркония из оксихлоридных растворов путем электрохимической и термической обработки, причем электрохимическую обработку раствора оксихлорида циркония осуществляют в катодной камере, которая отделена от катодной анионообменной, а от анодной - катионообменной мембранами при плотности тока 0,5-10,0 А/дм2 и рН католита 2,0-2,8, при этом среднюю камеру первоначально заполняют дистиллированной водой, а анодную - 1-5%-ным раствором какой-либо кислородсодержащей кислоты.
Недостатком данного способа является большой расход электроэнергии.
Известен способ получения оксида циркония для производства катализаторов (Кудрявский Ю.П., Зеленин В.И. и др. №2277968, B01J 21/06), включающий операции растворения соли циркония в воде, обработку раствора щелочным реагентом, осаждение оксигидратов металлов, фильтрование, отделение маточного раствора от осадка, промывку осадка, его сушку, прокалку и гранулирование или таблетирование путем формирования.
Недостатком данного способа является необходимость длительной отмывки полученного осадка от хлорид-ионов.
Известен способ получения оксида циркония методом осаждения из водного раствора хлористого цирконила водным раствором аммиака при интенсивном перемешивании, постоянной температуре и постоянном рН. Концентрация раствора цирконила соответствовала содержанию ~110 г/л. Перед осаждением растворы хлористого цирконила нагревали. Полученные гели отмывают дистиллированной водой до отсутствия ионов Cl- в промывных водах. Осадок сушат сначала на воздухе, а затем в сушильном шкафу при 110°C в течение 15 ч. Термическую активацию гидроксида циркония проводят в кварцевом реакторе на воздухе при температурах в интервале 300-700°C в течение 3 ч (Шейнфайн Р.Ю., Маковская Т.Ф., Стась О.П. и др. Влияние условий получения на пористую структуру двуокиси циркония // Журнал коллоидной химии. - 1980. - Т.2. - №5. - С.1015-1019).
Недостатком данного способа является необходимость длительной отмывки полученного осадка от хлорид-ионов.
Наиболее близким по технической сущности - по совокупности существенных признаков и достигаемому при этом техническому результату - является известный (Производство катализаторов. Под. ред. И.П.Мухленова. Л.: «Химия». ЛО, 1989, с.92-105) способ получения оксида циркония для последующего производства катализаторов различного состава и назначения. Этот способ и принят за прототип.
Данный способ включает в себя операции приготовления исходного раствора путем растворения соли циркония в воде, обработку полученных исходных раствора щелочным реагентом, осаждение оксигидратов металлов, фильтрование суспензии, промывку осадка на фильтре водой, отмывку осадка от маточного раствора, сушку, прокалку, измельчение, гранулирование или таблетирование катализатора путем формования.
Недостатком данного способа является необходимость очистки полученного осадка от хлорид-ионов, которые неблагоприятно сказываются на величине удельной поверхности получаемого катализатора и его каталитической активности.
Технический результат предлагаемого способа - получение каталитически активной тетрагональной модификации оксида циркония (IV) ZrO2, не содержащей примесные анионы (хлорид-ионы), что освобождает от необходимости длительной промывки полученного осадка. При создании заявленного изобретения ставилась задача разработать ионообменный способ получения оксида циркония. Решение этой задачи включает выбор анионита, перевод анионита в нужную форму, контакт анионита с раствором соли циркония Zr (IV) в определенных условиях при определенной температуре, отделение и прокаливания продукта и регенерация анионита. Новым в данном способе является то, что в качестве реагента-осадителя используют анионит, который обеспечивает стационарное значение рН, что обеспечивает получение тетраганальной модификации образующегося продукта. Кроме того, полученный продукт не загрязняется катионами осадителя и анионами раствора.
При создании заявленного изобретения были использованы два анионита различной природы: гелевый сильноосновный анионит АВ-17-8 (анионит с полистирольной матрицей, содержащий четвертичные аммониевые основания - N+(CH3)3 (ГОСТ 20301-74)) и гелевый слабоосновной АН-31 (анионит с полиэтиленполиаминовой матрицей, содержащий вторичные =NH, третичные ≡N аминогруппы (ГОСТ 20301-74) в OH-, CO3-формах.
Перевод анионитов АВ-17-8 и АН-31 из хлоридной формы в OH-форму проводили, заливая исходные аниониты 1 М раствором NaOH (т:ж=1:3), затем 2 М раствором NaOH 5-6 раз, выдерживая каждую порцию в течение часа (последнюю порцию в течение суток). После чего аниониты промывали дистиллированной водой до отрицательной реакции на хлорид-ион. Полученные аниониты были высушены при температуре около 60°C, затем была определена полная обменная емкость (ПОЕ, моль-экв./г) по 0,1 М соляной кислоте.
Перевод анионитов АВ-17-8 и АН-31 из хлоридной формы в CO3-форму проводили следующим образом. Аниониты обрабатывали пять раз 0,5 М раствором Na2CO3 (m:ж=1:2), выдерживая каждую порцию по 1 часу (последнюю порцию - в течение суток). После чего аниониты промывали водой до рН=7 и хранили в набухшем состоянии под слоем воды, затем была определена полная обменная емкость (ПОЕ, моль-экв./мл) по 0, 1 М соляной кислоте.
Процесс осаждения гидроксида циркония можно описать следующим уравнением:
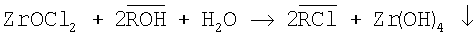
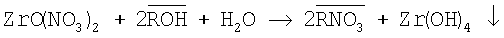
(надстрочная черта определяет фазу анионита).
Массу высушенного анионита (m) или объем набухшего ионита для синтеза рассчитывали по формуле

где  - концентрация исходного раствора циркония (ммоль/мл),
- концентрация исходного раствора циркония (ммоль/мл),  - объем раствора циркония (мл), ПОЕ - полная обменная емкость анионита, ммоль-экв.·г-1, φ - молярный избыток анионита (превышение количества молей его функциональных групп над количеством молей кобальта в растворе с учетом стехиометрии реакции).
- объем раствора циркония (мл), ПОЕ - полная обменная емкость анионита, ммоль-экв.·г-1, φ - молярный избыток анионита (превышение количества молей его функциональных групп над количеством молей кобальта в растворе с учетом стехиометрии реакции).
Навеску высушенного анионита в OH-форме или объем набухшего анионита в CO3-форме приводили в контакт с 10 мл раствора соли Zr (IV) (концентрация 0,5 М) и 20 мл дистиллированной воды при перемешивании на шейкере при определенной температуре. Фазы разделяли, пропуская их последовательно через сито с диаметром отверстия 0,25 мм (для отделения анионита) и центрифугированием (для отделения осадка), далее определяли концентрации циркония в маточном растворе.
Осадок Zr(OH)4 после промывания водой сушили при температуре 110°C, прокаливали при температуре 600°C для получения оксида циркония ZrO2.
Примеры осуществления предлагаемого способа
Пример 1. К 10 мл 0,5 М раствора ZrO(NO3)2 и 20 мл дистиллированной воды добавляют анионит АВ-17-8 в OH-форме. Раствор перемешивают на шейкере при температуре 20°C в течение 3 часов, значение рН 8 оставалось постоянным в ходе синтеза. После отделения осадка определяли концентрацию циркония в маточном растворе 7·10-4. Выход продукта 99,5%. Согласно данным химического анализа в синтезированном Zr(OH)4 отсутствует NO3 - (нитрат-ион определяли фотоколориметрически). По данным рентгенофазового анализа и ИК-спектроскопии полученный после прокаливания гидроксида циркония оксид ZrO2 имеет тетрагональную модификацию.
Пример 2. К 10 мл 0,5 М раствора ZrOCl2 и 20 мл дистиллированной воды добавляют анионит АВ-17-8 в ОН-форме. Раствор перемешивают на шейкере при температуре 80°C в течение 3 часов, значение pH 7 оставалось постоянным в ходе синтеза. После отделения осадка определяли концентрацию циркония в маточном растворе 7·10-4. Выход продукта 99,5%. Согласно данным химического анализа в синтезированном Zr(OH)4 отсутствует Cl- (хлорид-ион определяли аргентометрически). По данным рентгенофазового анализа и ИК-спектроскопии полученный после прокаливания гидроксида циркония оксид ZrO2 имеет тетрагональную модификацию.
Пример 3. К 10 мл 0,5 М раствора ZrOCl2 и 20 мл дистиллированной воды добавляют анионит АВ-17-8 в CO3-форме. Раствор перемешивают на шейкере при температуре 20°C в течение 3 часов, значение pH 8 оставалось постоянным в ходе синтеза. После отделения осадка определяли концентрацию циркония в маточном растворе 4·10-4. Выход продукта 99,5%. Согласно данным химического анализа в синтезированном Zr(OH)4 отсутствует Cl- (хлорид-ион определяли аргентометрически). По данным рентгенофазового анализа и ИК-спектроскопии полученный после прокаливания гидроксида циркония оксид ZrO2 имеет тетрагональную модификацию.
Пример 4. К 10 мл 0,5 М раствора ZrOCl2 и 20 мл дистиллированной воды добавляют анионит АН-31 в OH-форме. Раствор перемешивают на шейкере при температуре 20°C в течение 3 часов, значение pH 8 оставалось постоянным в ходе синтеза. После отделения осадка определяли концентрацию циркония в маточном растворе 4·10-4. Выход продукта 99,5%. Согласно данным химического анализа в синтезированном Zr(OH)4 отсутствует Cl- (хлорид-ион определяли аргентометрически). По данным рентгенофазового анализа и ИК-спектроскопии полученный после прокаливания гидроксида циркония оксид ZrO2 имеет тетрагональную модификацию.
Предлагаемый способ достаточно прост, не предполагает использования агрессивных сред, высоких температур и давлений. Используя его, можно получить каталитически активную тетрагональную модификацию оксида циркония (II) ZrO2, не содержащую примесные анионы (хлорид, нитрат-ионы), что освобождает от необходимости длительной промывки полученного осадка.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ОСНОВНОГО КАРБОНАТА КОБАЛЬТА (II) | 2010 |
|
RU2424190C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНЫХ ПОРОШКОВ ФЕРРИТА МЕДИ (II) | 2018 |
|
RU2699891C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОДИСПЕРСНЫХ ПОРОШКОВ ОКСИДА ИНДИЯ | 2015 |
|
RU2587083C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРАТА ОКСАЛАТА КОБАЛЬТА (II) | 2007 |
|
RU2384564C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРА ИЗОМЕРИЗАЦИИ Н-БУТАНА В ИЗОБУТАН | 2002 |
|
RU2236291C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРАТА ОКСАЛАТА НИКЕЛЯ(II) | 2008 |
|
RU2362763C1 |
| Способ получения нанокристаллического порошка на основе диоксида циркония | 2022 |
|
RU2793893C1 |
| ОКСИДНЫЙ КАТАЛИЗАТОР ДЛЯ ИЗОМЕРИЗАЦИИ ЛЕГКИХ БЕНЗИНОВЫХ ФРАКЦИЙ | 2012 |
|
RU2486005C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО ПОРОШКА ЖЕЛЕЗОИТТРИЕВОГО ГРАНАТА | 2012 |
|
RU2509625C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО ПОРОШКА КОБАЛЬТА | 2012 |
|
RU2483841C1 |
Изобретение относится к применяемым в области химии способам получения оксида циркония для производства катализаторов. Описан способ получения оксида циркония (IV) для производства катализаторов, включающий подготовку исходного реакционного водного раствора соли циркония (IV), осаждение из раствора гидроксида циркония, отделение полученного осадка гидроксида циркония от водного раствора, сушку и прокалку осадка при температуре 600°С, отличающийся тем, что осаждение проводят анионитом в ОН-форме. Технический результат - получение каталитически активной тетрагональной модификации оксида циркония (IV) ZrO2, не содержащей примесные анионы (хлорид-ионы), что освобождает от необходимости длительной промывки полученного осадка.
Способ получения оксида циркония (IV) для производства катализаторов, включающий подготовку исходного реакционного водного раствора соли циркония (IV), осаждение из раствора гидроксида циркония, отделение полученного осадка гидроксида циркония от водного раствора, сушку и прокалку осадка при температуре 600°С, отличающийся тем, что осаждение проводят анионитом в ОН-форме.
| Производство катализаторов | |||
| Способ получения оксида циркония для последующего производства катализаторов различного состава и назначения | |||
| / Под | |||
| ред | |||
| И.П.Мухленова | |||
| - Л.: Химия | |||
| ЛО, с.92-105, 1989 | |||
| СПОСОБ ПОЛУЧЕНИЯ ОКСИДА ЦИРКОНИЯ ДЛЯ ПРОИЗВОДСТВА КАТАЛИЗАТОРОВ | 2004 |
|
RU2277968C2 |
| JP 10114522 А, 06.05.1998 | |||
| Способ выделения компонента из газовой смеси кислорода с азотом или диоксида углерода с метаном | 1989 |
|
SU1836128A3 |
| WO 8707885 A1, 30.12.1987. | |||
Авторы
Даты
2010-09-27—Публикация
2008-12-24—Подача