Изобретение относится к биологии и медицине и может быть использовано в биохимии, фармакологии, экспериментальной физиологии и кардиологии.
Изучение Na+ -зависимого транспорта Са2+ в интактном, работающем сердце представляет пока трудно выполнимую экспериментальную задачу. Изменения концентрации Са2+ в перфузионных растворах крайне незначительны. Поэтому в большинстве научных работ основным объектом для измерения трансмембранных потоков Са2+ во время активировании Na+-Ca2+ обмена являлись изолированные кардиомиоциты или полоски миокарда [1, 2, 3]. Прирост или убыль внутриклеточного Са2+ обычно регистрируют путем введения в кардиомиоциты кальций-селективных биолюминесцентных реагентов, а также с помощью микроэлектродов, вводимых внутрь клеток.
Несомненно, такие процедуры являются высоко травматичными для миокардиальных клеток [4, 5]. Достоверность получаемых результатов в таких опытах весьма низкая и по ряду других причин.
Во-первых, изучение системы Na+-Ca2+ обмена на объектах производится после целого ряда жестких способов обработки ткани сердца, например с обработкой протеолитическим ферментом - трипсином, коллагеназой, эластазой и др., способных повредить данный ионообменный механизм [3].
Во-вторых, для предупреждения развития в кардиомиоцитах так называемого «кальциевого парадокса» [4, 10, 11] при выделении изолированных кардиомиоцитов исследователи применяют ряд веществ и условий, влияющих на активность мембранных белков ионотранспортных систем. Так, применяемые с этой целью «KB- среда» [5], таурин, фосфокреатин, АТФ [6], глутамат калия [7], высокая внеклеточная концентрация К+, низкий рН [8], ионы магния [9] нарушают трансмембранное распределение ионов Са2+ и Na+ и другие параметры ионного транспорта кардиомиоцитов [10, 11]. Такие изменения снижают ценность исследований на изолированных кардиомиоцитах. Например, ответы на гормональные воздействия у изолированных кардиомиоцитов значительно отличаются от ответных реакций целого сердца [12, 13].
В-третьих, как отмечалось выше, для измерения концентрации Са2+ в миоплазму вводят биолюминесцентные реагенты, которые обладают определенной токсичностью, а также связывая внутриклеточный Са2+, нарушают в кардиомиоцитах ключевые обменные процессы.
В-четвертых, имеется ряд трудностей при оценке концентрации Са2+ и калибровке внутриклеточной концентрации Са2+ непосредственно в микромолях. Так, в большинстве исследований концентрация Са2+ измеряется в отношении экстинкций при определенных длинах волн. Кроме того, при использовании некоторых красителей становится невозможным одновременная регистрация внутриклеточной концентрации ионов кальция и сокращений кардиомиоцитов [14].
На изолированных кардиомиоцитах невозможно одновременно наблюдать натрийзависимые потоки ионов Са2+ и электрофизиологическое состояние, сократимость отдельных камер сердца и изучать такие сложные явления, как аритмии.
В 1979 году Phillipson К. и Langer G. предприняли попытку изучения Na+-Са+ обмена на мультиклеточных препаратах правого желудочка кролика [15, 16, 17]. Для регистрации Na+ зависимого транспорта Са2+ в ткани он использовал радиоактивный изотоп 45Са2+ и изучал его распределение в ткани мышцы. Однако в дальнейшем эта группа исследователей продолжила работы по изучению Na+-Ca2+ обмена с помощью радиоактивного 45Са2+ на изолированных кардиомиоцитах [16, 17, 18]. Для изучения системы Na+-Ca2+ обмена авторы исследований одновременно удаляли Na+ и Са2+ [15, 16, 17, 18] и сравнивали кинетику транспорта Са2+ с экспериментами, в растворе которых присутствовал только Na+. Однако такой метод имеет ряд недостатков: методика сопряжена с большим разбросом данных, построенных на измерении радиоактивности 45Са2+; для проведения экспериментов необходимо применять высокую радиоактивность проб, которая влияет на состояние клеток сердца; Na+-Ca2+ обмен изучался косвенно - по разности динамики вымывания 45Са2+ во время перфузии бескальциевой средой и средой, не содержащей Na+ и Са2+.
Учитывая вышеупомянутые недостатки способа изучения Na+-Ca2+ обмена на изолированных кардиомиоцитах и изолированной ткани правого желудочка сердца кролика путем вымывания 45Са2+, нами предложен способ изучения Na+-Са2+ обмена на целом перфузируемом сердце с сохранением в нем электрической и механической активности.
Техническим результатом изобретения является количественная оценка натрий- зависимых потоков Са2+ с одновременным измерением функционального состояния сердца в условиях активирования Na+-Ca2+ обмена.
Технический результат изобретения достигается путем измерения количества Са2+ в оттекающем от изолированного работающего сердца перфузионном растворе и одновременной регистрации сокращений левого желудочка с электронограммой сердца в ответ на снижение внеклеточной концентрации хлорида натрия.
Гипонатриевый раствор должен содержать от 0 до 30 ммоль/л хлорида натрия. Результат полностью воспроизводим при замене хлорида натрия на хлорид аммония, сахарозу, маннит, мочевину или комбинацию этих веществ. Наиболее важным параметром, учитываемым при замене хлорида натрия на другое вещество является его физиологическая инертность и создание одинакового с хлоридом натрия осмотического давления. Важным является снижение концентрации Na+ до 30-0 мМ, инициирующее Na+-Ca2+ обмен. Активирование Na+-Ca2+ обмена снижением внеклеточной концентрации Na+ вызывает фибрилляцию желудочков сердца, повышение диастолического давления левого желудочка. Снижение концентрации Na+ выше 30 мМ уменьшает активирование Na+-Ca2+ обмена и возможность развития фибрилляции желудочков и повышения диастолического давления.
Исследование трех составляющих работы сердца, а именно спектрофотометрическое исследование концентрации ионов Са2+ электрической и механической его активности позволяет определить взаимосвязь вероятности наступления фибрилляции желудочков и рост диастолического давления в ответ на снижение концентрации Na+ во внеклеточной среде. Так, при скорости снижения внеклеточной концентрации Na+ 3,0 мМ/с фибрилляция желудочков сердца происходила в 100% случаев, а при скорости снижения внеклеточной концентрации Na+ 0,05 мМ/с фибрилляция желудочков сердца происходила в 40% случаев. При этом наблюдалось увеличение диастолического давления желудочков сердца выше 25 мм рт.ст. Возникновение фибрилляции желудочков сердца происходит только при поглощении Са2+ не менее 30 нмоль/г влажной массы при скорости снижения внеклеточной концентрации Na+ 3,0 мМ/с. Между поглощением Са2+ и ростом диастолического давления наблюдается нелинейная зависимость насыщающего характера.
Пример 1.
Эксперименты проводились на изолированных сердцах белых крыс линии Wistar, перфузированных по методу Лангендорфа, оксигенированным (t=37°С) раствором Рингера-Локка (мМ): NaCl - 140, NaHCO3 - 2,0; KCl - 3,0; трис-ОН (рН 7,4) - 5; CaCl2 - 0,6, глюкозы - 11. Под эфирным наркозом крыс декапитировали, вскрывали грудную клетку и сердце помещали в охлажденный раствор Рингера-Локка. В аорту вводили канюлю и начинали перфузию со скоростью 10 мл/мин на 1 г сырого веса исходным раствором в течение 15 минут для стабилизации сократительной функции и показателей энергетического состояния сердца.
Концентрацию Са2+ в оттекающем от сердца перфузионном растворе непрерывно измеряли в течение всего периода опыта. С помощью перистальтического насоса перфузионный раствор смешивали с металлоиндикатором на Са2+ - Арсеназо-III. Образовавшийся окрашенный продукт реакции пропускали через проточную кварцевую микрокювету, помещенную в регистрационный блок спектрофотометра СФ-46. Интенсивность окраски определяли при длине волны 660 нм.
Чувствительность измерения повышали путем сужения диапазона измерения концентрации кальция. При этом шкала регистратора настраивалась в пределах 0,02 экстинкции по шкале спектрофотометра. Это позволяло регистрировать изменения концентрации в перфузионной среде от 1 до 20 мкмоль/л CaCl2.
Инициацию натрийзависимого поглощения Са2+ изолированным сердцем крысы осуществляли путем снижения уровня Na+ в перфузионном растворе до 2 мМ. При этом хлорид натрия - 140 мМ заменяли на хлорид аммония (140 мМ).
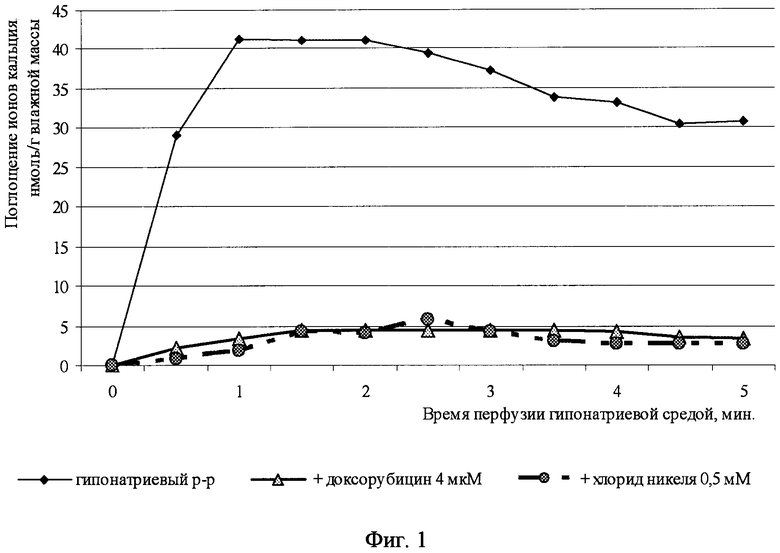
При замене хлорида натрия на хлорид аммония регистрировали интенсивное поглощение Са2+ сердцем из перфузионного раствора. Скорость поглощения составила 94±17 нмоль/с.г сырого веса ткани. Максимальное количество Са2+ за пять минут перфузии безнатриевой средой составило 360±74 нмоль/ г. (см. табл., фиг.1).
Параметры поглощения Са2+ изолированным сердцем крысы при замене хлорида натрия на хлорид аммония
Примененный нами способ позволяет наблюдать динамику поглощения Са2+ во времени (фиг.1).
Добавление в растворы специфического ингибитора Na+-Ca2+ обмена - хлорида никеля (NiCl2, 0,5 мМ) практически полностью блокировало накопление кальция изолированным сердцем крысы.
Доксорубицин, обладающий высокой кардиотоксичностью, в концентрации 4 мкмоль/л, также значительно прекращал аккумуляцию кальция сердцем при снижении концентрации хлорида натрия. О его специфическом влиянии на процесс Na+-Ca2+ обмена имеются указания в работе Carafoli E. 1982 (19).
Таким образом, приведенные в примере 1 данные свидетельствуют, что нами проведена регистрация именно Na+-Ca2+ обмена. Это позволяет утверждать, что выявленные нами на следующих этапах опытов изменения электрической и механической работы сердца связаны именно с Na+-Ca2+ обменом.
Пример 2.
Инициацию Na+ - зависимого поглощения Са2+ изолированным сердцем крысы осуществляют путем замены хлорида натрия (110 мМ из 140 мМ) смесью хлорида аммония (10 мМ) с сахарозой (260 мМ), методику приготовления - см. пример 1.
Опыты проводились на изолированных сердцах белых крыс линии Wistar, перфузированных по методу Лангендорфа оксигенированным (t=37°C) раствором Рингера-Локка, содержащем (мМ): NaCl - 140, NaHCO3 - 2,0; КСl - 5,0; трис-ОН - 2 (рН 7,4); CaCl2 - 0,6, глюкозу - 11. Под эфирным наркозом крыс декапитировали, вскрывали грудную клетку и сердце помещали в охлажденный раствор Рингера -Локка. В аорту вводили канюлю и начинали перфузию перистальтическим насосом со скоростью 10 мл/мин на 1 г исходным раствором в течение 15 минут для стабилизации сократительной функции и энергетического обмена. Для исключения внешнего температурного воздействия сердце перфузировали в термостатированной камере при t=37°С.
Инициацию Na+ - зависимого поглощения Са2+ изолированным сердцем крысы осуществляли путем замены хлорида натрия (110 мМ из 140 мМ) смесью хлорида аммония (10 мМ) с сахарозой (260 мМ).
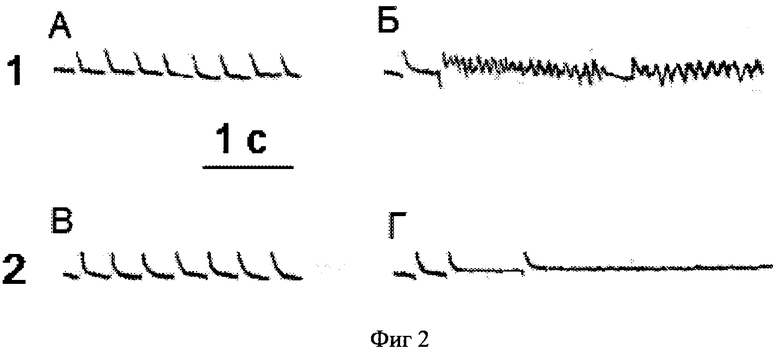
Проведенные исследования показали, что замена хлорида натрия на смесь хлорида аммония с сахарозой вызывает возникновение фибрилляции желудочков сердца (фиг.2). На записи 1 представлена электронограмма сердца исходная (А) и после переключения на гипонатриевый раствор (Б). При переключении раствора Рингера- Локка (А) на гипонатриевый раствор (Б) нормальный ритм (отрезок А) сменился фибрилляцией желудочков (отрезок Б). Использование специфического ингибитора Na+-Ca2+ обмена - хлорида никеля в концентрации 0,5 мМ предупреждало возникновение фибрилляции желудочков сердца (запись 2). При переключении раствора Рингера- Локка (В) на гипонатриевый раствор с 0,5 мМ хлорида никеля (Г) нормальный ритм (отрезок В) изменился, но фибрилляция желудочков не наступила (отрезок Г). Одновременно происходит повышение диастолического давления левого желудочка сердца крысы. Хлорид никеля (0,5 мМ) - специфичный блокатор Na+-Ca2+ обмена позволяет сохранить диастолическое давление на исходном уровне в течение всего периода перфузии сердца гипонатриевым раствором.
Предлагаемый нами способ одновременного спектрофотометрического изучения Na+ зависимых потоков Са2+ на целом изолированном сердце с одновременной регистрацией электронограммы и механограммы позволяет определить взаимосвязь вероятности наступления фибрилляции желудочков и рост диастолического давления в ответ на снижение концентрации Na+ во внеклеточной среде. Так, при скорости снижения внеклеточной концентрации Na+ 3,0 мМ/с фибрилляция желудочков сердца происходила в 100% случаев, а при скорости снижения внеклеточной концентрации Na+ 0,05 мМ/с фибрилляция желудочков сердца происходила в 40% случаев. При этом наблюдалось увеличение диастолического давления желудочков сердца выше 25 мм рт.ст. Возникновение фибрилляции желудочков сердца происходит только при поглощении Са2+ не менее 30 нмоль/г влажной массы при скорости снижения внеклеточной концентрации Na+ 3,0 мМ/с. Между поглощением Са2+ и ростом диастолического давления наблюдается нелинейная зависимость насыщающего характера.
Библиография
1. Reeves J., Sutko J. Sodium-calcium ion exchange in cardiac membrane vesicles. Proceedings National Academy of Sciences USA. 1979. 76. 590-594.
2. Sheu Shey-Shing, Blaustein M.P. Sodium/Calcium exchange and control of cell calcium and contractility in cardiac and vascular smooth muscles. The Heart and cardiovascular system. Second Edition. Eb. By Harry Forzard, Raven Press, N.Y., 1992 903-943.
3. Blaustein M.P. and Lederer J. Sodium/Calcium Exchange: Its Physiological Implications. Physiological Reviews, Vol.79, No. 3, July 1999, pp.763-854.
4. Пидопличко В.И., Верхратский А.Н. Электрофизиологические исследования одиночных клеток мышцы сердца. Киев, Наукова Думка, 1989, 234 с.
5. Isenberg G., Klokner U. Calcium tolerant ventricular myocytes prepared by preincubation in "KB- medium". Pfluger's Arch. 1982. 395. 1. 6-18.
6. Bkaily G., Sperelakis N., Doane J. A new method for preparation of isolated single adult myocytes. Amer. J. Physiol. 1984. 246 pt 2. N5. P 630-634.
7. Achenbach С., Wiemer J., Priser R. Isolation of adult ventricular myocytes for electrophysiolgical experiments. Basic Res. Cardiol. 1985. 80. suppl. 1. 161.
8. Sheels M., January C.T., Fozzard H. Isolation and characterization of single canine cardiac Purkinje cells. Circul. Res. 1983. 53(4). 544-548.
9. DiFranchesko D., Ferront A., Mazzanti M., Tromba C.Properties of the hyperpolariziting- activated current (if) in cells isolated from rabbit sino-atrial node. J.Physiol. (Great Britain). 1986. 377. 61-66.
10. Chapman R.A., Tunstall J. The calcium paradox of the heart. Prog.Biophys. Mol. Biol. 50.: 67-96. 1987.
11. Suleiman M.-S., Rodrigo G.C., Chapman R.A. Interdependence of intracellular taurine and sodium in guine-pig heart. Cardiovasc. Res. 26.:897-905. 1992.
12. Dow J.W., Harding N.G.L., Powell T. Isolated cardiac myocytes. Part 1. 1981. 15. 483-514.
13. Dow J.W., Harding N.G.L, Powell T. Isolated cardiac myocytes. Part 2. 1981. 15. 549-579.
14. Фабиато А., Баумгартен С.М. Методы регистрации освобождения кальция из саркоплазматического ретикулума скицированных миокардиальных клеток и соотношение между трансмембранным движением кальция и его высвобождением. Глава 11. Физиология и патофизиология сердца. Том 1. Москва. Медицина, 1988. 323-380.
15. Pierce G., Rich Т., Langer G. Transsarcolemmal Ca2+ movements in arterially perfused rabbit right ventricle measured with extracellular calcium-sensitive dyes. Circ. Res. 1984. 54. 461-467.
16. Langer G. Calcium and the heart: exchange at the tissue, cell and organelle level. FASEB J., 1992. 6. 893-902.
17. Langer G.A. Calcium and the heart. N.Y.Raven Press. 1983. 658 pages.
18. Langer G. Myocardial Calcium Compartaments. Trends Cardiovasc. Med. 1994. 4. 103-108.
19. Carafoli E. Calcium transport systems of heart sarcolemma vesicles. Naunyn - Schmiederberg's Arch. Pharmacol. 1982. 321: R7.
Описание к фигурам
Фиг.1. Динамика поглощения ионов кальция изолированным сердцем во время гипонатриевой перфузии.
По оси абсцисс отложено время перфузии гипонатриевой средой в минутах.
По оси ординат - поглощение ионов кальция, нмоль/г влажной массы
Фиг 2. Влияние ионов никеля как селективного ингибитора натрий-кальциевого обмена на воспроизводимость фибрилляции желудочков сердца крысы, вызываемой путем включения раствора, содержащего сахарозу 260 мМ и хлорид аммония 10 мМ.
Запись 1. При переключении раствора Рингера-Локка нормальный ритм (отрезок А) на гипонатриевый раствор сменился фибрилляцией желудочков (отрезок Б).
Запись 2. Использование специфического ингибитора Na+ -Ca2+ обмена - хлорида никеля в концентрации 0,5 мМ предупреждало возникновение фибрилляции желудочков сердца. При переключении раствора Рингера-Локка исходный нормальный ритм (отрезок В) на гипонатриевый раствор с 0,5 мМ хлорида никеля изменился, но фибрилляция желудочков не наступила (отрезок Г).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ НЕКОРОНАРОГЕННЫХ НЕКРОЗОВ МИОКАРДА | 2005 |
|
RU2366004C2 |
| Инозин как корректор антрациклиновой токсичности | 2018 |
|
RU2693825C1 |
| СПОСОБ ИЗМЕРЕНИЯ НАБУХАНИЯ КАРДИОМИОЦИТОВ ЦЕЛОГО СЕРДЦА ПРИ УДАЛЕНИИ Са ИЗ ВНЕКЛЕТОЧНОЙ СРЕДЫ В ЭКСПЕРИМЕНТЕ | 2006 |
|
RU2368956C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ СОКРАЩЕНИЙ СЕРДЦА ПОСЛЕ ОСТАНОВКИ В ДИАСТОЛЕ В ЭКСПЕРИМЕНТЕ | 2010 |
|
RU2424582C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ФИБРИЛЛЯЦИИ ЖЕЛУДОЧКОВ В ЭКСПЕРИМЕНТЕ | 2006 |
|
RU2309464C1 |
| СПОСОБ ОЦЕНКИ КАРДИОПРОТЕКТИВНОЙ АКТИВНОСТИ ФАРМАКОЛОГИЧЕСКИХ СРЕДСТВ | 2017 |
|
RU2643104C1 |
| КЛЕТОЧНЫЕ И ГЕННЫЕ СПОСОБЫ УЛУЧШЕНИЯ СЕРДЕЧНОЙ ФУНКЦИИ | 2012 |
|
RU2608957C2 |
| Композиция для лечения артериальной гипертензии и ассоциированных с ней патологий сердечно-сосудистой системы | 2019 |
|
RU2734281C1 |
| СПОСОБ ЗАЩИТЫ СЕРДЦА ОТ ИШЕМИИ В ЭКСПЕРИМЕНТЕ | 1996 |
|
RU2144825C1 |
| Фармакологическая композиция для компенсации артериальной гипертензии и ассоциированных с ней патологий сердечно-сосудистой системы | 2021 |
|
RU2792884C1 |
Изобретение относится к биологии и медицине и может быть использовано в биохимии, фармакологии, экспериментальной физиологии и кардиологии. Используют изолированное целое сердце. Регистрируют Na+ зависимые потоки Са+ в миокарде с использованием гипонатриевого раствора и поддержания изоосмотичности за счет добавления хлорида аммония, сахарозы, маннита, мочевины или комбинации этих веществ. При этом одновременно с определением ионных потоков регистрируют электронограмму и механограмму. При скорости снижения внеклеточной концентрации Na+ 3,0 мМ/с вероятность наступления фибрилляции желудочков сердца оценивают как 100%, а при скорости снижения внеклеточной концентрации Na+ 0,05 мМ/с - как 40%. Способ расширяет арсенал средств для одновременной регистрации Na+ зависимых потоков Са2+ и оценки функционального состояния целого изолированного сердца в эксперименте. 1 табл., 2 ил.
Способ экспериментального спектрофотометрического изучения Na+-зависимых потоков Са2+ в миокарде с использованием гипонатриевого раствора и поддержания изоосмотичности за счет добавления хлорида аммония, сахарозы, маннита, мочевины или комбинации этих веществ, отличающийся тем, что используют изолированное целое сердце; одновременно с определением ионных потоков регистрируют электронограмму и механограмму и при скорости снижения внеклеточной концентрации Na+ 3,0 мМ/с вероятность наступления фибрилляции желудочков сердца оценивают как 100%, а при скорости снижения внеклеточной концентрации Na+ 0,05 мМ/с - как 40%.
| АЛАБОВСКИИ В.В | |||
| и др | |||
| Влияние ионов натрия и магния на развитие «кальциевого парадокса» в сердечной мышце | |||
| Вопросы медицинской химии, 1995, 41, 6, 23-27 | |||
| 4-ФТОР-N-ИНДАН-2-ИЛБЕНЗАМИД И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКОГО АГЕНТА | 2002 |
|
RU2308946C2 |
| ЗАМЕЩЕННЫЕ N-(ИНДОЛ-2-КАРБОНИЛ)-ГЛИЦИНАМИДЫ И ИХ ПРОИЗВОДНЫЕ, СПОСОБЫ ЛЕЧЕНИЯ И ФАРМКОМПОЗИЦИЯ | 1996 |
|
RU2143424C1 |
| Крышка для букс железно дорожных вагонов | 1943 |
|
SU64243A1 |
| СТУДНЕВА И.М | |||
| и др | |||
| Влияние метаболических субстратов и манита на эффективность кардиоплегической защиты | |||
Авторы
Даты
2010-09-27—Публикация
2009-06-10—Подача