Настоящее изобретение относится к получению 10-деацетилбаккатина III, не содержащего 10-деацетил-2-дебензоил-2-пентеноилбаккатин III.
Удаление этой примеси выполняют преобразованием 10-деацетилбаккатина III в соответствующий 7,10-бис-трихлорацетат с последующей хроматографической очисткой и снятием защиты с гидроксигрупп. 10-деацетилбаккатин III, очищенный в соответствии с этим способом, может использоваться для удобного полусинтеза противоопухолевых лекарственных средств с таксановым остовом, избегая трудоемкие способы очистки от соответствующих 2-дебензоил-2-пентеноильных аналогов.
ВВЕДЕНИЕ
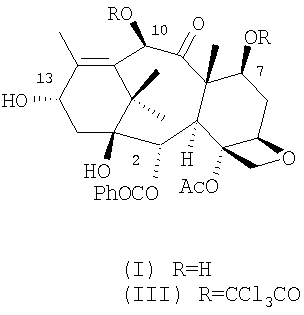
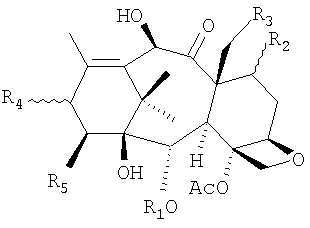
10-деацетилбаккатин III (I) представляет собой исходный продукт для полусинтеза лекарственных средств с сильной противоопухолевой активностью, таких как доцетаксел и паклитаксел. 10-деацетилбаккатин III выделяют экстракцией из растений рода Taxus. Продукт экстракции также содержит различное количество родственных соединений (смотрите таблицу), которое зависит от источника растительного сырья. В общем, содержащиеся в коммерчески доступном 10-деацетилбаккатине III примеси содержат дополнительную гидроксигруппу в 14- или 19-положении или имеют противоположную конфигурацию в 7- и 13-положениях.
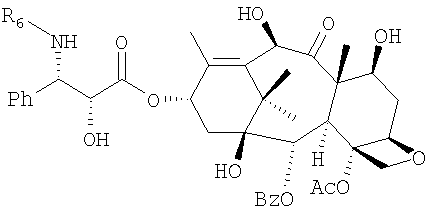
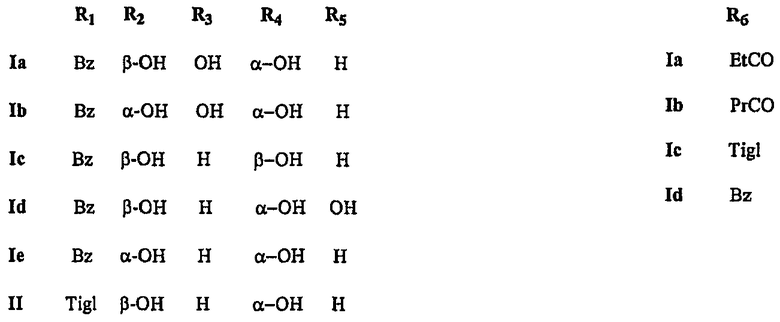
Другие примеси замещены по 13-положению фенилизосериновым остатком, аминогруппа которого соединена с остатком пропионовой, масляной, тиглиновой или бензойной кислоты. Более того, 10-деацетилбаккатин III содержит дополнительный метаболит (II), который вместо бензоильной группы в 2-положении содержит пентеноильный остаток, в частности, идентифицированный как остаток тиглиновой кислоты (В.Gabetta et al., J. Nat. Prod. 58, 1508, 1995). Обычно эта примесь, которая не может быть удалена кристаллизацией вследствие своей склонности к сокристаллизации с 10-деацетилбаккатином III, содержится в коммерческом 10-деацетилбаккатине III в количестве 0,3-1%. Более того, дорогостоящие способы хроматографической очистки позволяют достичь лишь частичного и неудовлетворительного уменьшения его содержания.
Если противоопухолевое лекарство получают из 10-деацетилбаккатина III, то эта примесь претерпевает тот же процесс полусинтеза, что и 10-деацетилбаккатин III, и является источником 2-дебензоил-2-пентеноильного производного, удаление которого является чрезвычайно сложным.
Поэтому, например, в американской фармакопее в полусинтетическом паклитакселе допускается содержание значимых количеств (до 0,7%) 2-дебензоил-2-пентеноилпаклитаксела.
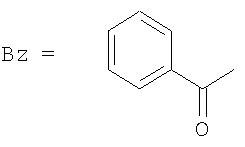
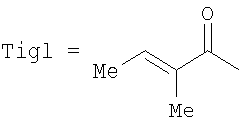
Способ получения производных таксана из 10-деацетилбаккатина III, включающий стадию одновременной защиты гидроксильных групп в 7- и 10-положениях 10-деацетилбаккатина III трихлорацетильными группами, раскрыт в WO 02/44161, WO 02/12215 и WO 00/52003.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу очистки 10-деацетилбаккатина III от 10-деацетил-2-дебензоил-2-пентеноилбаккатина III (II), где пентеноильный остаток представляет собой остаток тиглиновой кислоты. Поэтому 10-деацетилбаккатин III, очищенный в соответствии с настоящим изобретением, позволяет получать не содержащие соответствующих примесей противоопухолевые лекарственные средства с таксановым остовом, содержащие в 2-положении пентеноильный остаток вместо бензоильного остатка.
10-деацетилбаккатин III может быть легко преобразован в 7,10-бис-трихлорацетильное производное (III). Преобразование может быть осуществлено обработкой активированными производными трихлоруксусной кислоты в соответствии с известными способами этерификации. Предпочтительно, III получают взаимодействием с трихлорацетилхлоридом при температуре приблизительно 0°С, предпочтительно при температуре от -5 до +5°С, с использованием в качестве растворителя пиридина или смеси пиридин/дихлорметан. По методу ВЭЖХ-анализа показано, что (III) содержит в качестве примесей приблизительно 2% соответствующих 10- и 7-моноацилированных продуктов, а также 7,10-бис-трихлорацетат (II) в качестве примеси в количестве, пропорциональном количеству (II) в 10-деацетилбаккатине III, используемом в качестве исходного материала.
К удивлению было обнаружено, что хроматографическое поведение бис-трихлорацетильного производного второй примеси (II) значительно отличалось от поведения бис-трихлорацетил-10-деацетилбаккатина III (III).
Фактически, если продукты трихлорацетилирования подвергают колоночной хроматографии на малых количествах силикагеля, предпочтительно в количестве 10-20 массовых частей, более предпочтительно в количестве 15 массовых частей, и элюируют дихлорметаном или смесью дихлорметан/этилацетат, то 7,10-бис-трихлорацетил-10-деацетилбаккатин III (III) элюируется, а соответствующий 2-дебензоил-2-пентеноильный аналог удерживается на неподвижной фазе вместе с моноацилированными продуктами. Эти примеси могут быть извлечены с использованием растворителя с большей по сравнению с дихлорметаном полярностью, например, ацетона или метанола.
Полученный 7,10-бис-трихлорацетилбаккатин III (III), полученный с хроматографической чистотой более 99%, может использоваться как таковой для полусинтеза противоопухолевых лекарственных средств этерификацией по 13-положению активированной подходящим образом боковой цепью. Фактически, его преимущество заключается в наличии трихлорацетильных защитных групп в 7- и 10-положениях в дополнение к отсутствию 2-дебензоил-2-пентеноильного аналога. Это отменяет дополнительную и нежелательную этерификацию выбранной боковой цепью в 7- и/или 10-положениях и образование примесей, которые не могут быть легко удалены иным путем. Поэтому этерификация 13-положения подходящей боковой цепью с последующим удалением защитных групп в 7- и 10-положении и в боковой цепи позволяет получать доцетаксел или его предшественников (содержащих подходящую защищенную боковую цепь), не содержащих ди(фенилизосеринил)-аналогов.
С другой стороны, 10-деацетилбаккатин III, не содержащий 2-дебензоил-2-пентеноильный аналог и другие примеси, может быть восстановлен из продукта (III) (очищенного, как описано выше) обработкой щелочью, предпочтительно взаимодействием с гидроксидом аммония в таком подходящем растворителе, как метанол, смесь метанол/дихлорметан или тетрагидрофуран. 10-деацетилбаккатин III с хроматографической чистотой более 99%, не содержащий в качестве примеси соединение (II), получают кристаллизацией из такого подходящего растворителя, как ацетонитрил, ацетон или метанол.
Поэтому полученный 10-деацетилбаккатин III может быть использован для удобного получения полусинтетического паклитаксела, не содержащего 2-дебензоил-2-пентеноил-паклитаксел. Паклитаксел может быть получен по любому способу, который позволяет преобразовывать 10-деацетилбаккатин III в N-дебензоилпаклитаксел с последующим бензоилированием. Удобный способ получения N-дебензоилпаклитаксела раскрыт, например, в заявке на выдачу патента США №2005/0049297.
Настоящее изобретение более подробно проиллюстрировано в представленных ниже примерах.
Пример 1 - 10-деацетил-7,10-бис-трихлорацетилбаккатин III (III)
10-деацетилбаккатин III (15 г), содержащий в качестве примеси 0,4% 2-дебензоил-2-пентоильный аналог, обрабатывали 6,6 мл трихлорацетилхлорида в 60 мл пиридина при 0-5°С в течение 1 часа при перемешивании. Смесь разбавляли 100 мл метиленхлорида и 100 мл 4 н. хлористоводородной кислоты. Разделяли фазы, и промывали органическую фазу 100 мл 4 н. хлористоводородной кислоты, а затем 500 мл воды, насыщенной хлоридом натрия. Органическую фазу концентрировали досуха, и поглощали остаток 100 мл толуола. Твердое вещество (24,9 г) извлекали фильтрацией, повторно растворяли в 125 мл метиленхлорида и очищали колоночной хроматографией на Kieselgel 60 Merck (375 г), элюируя метиленхлоридом. Содержащие III фракции собирали и добавляли к ним толуол; полученный осадок отфильтровывали и сушили в вакууме при 50°С с получением 17,8 г III чистотой более 99% (по методу ВЭЖХ). Анализ ВЭЖХ-МС не показал наличия бис-трихлорацетата (II).
Пример 2 - 10-деацетилбаккатин III, не содержащий 2-дебензоил-2-пентеноильный аналог
10-деацетил-7,10-бис-трихлорацетилбаккатин III (17,8 г), полученный, как описано в примере 1, растворяли в инертной атмосфере в 36 мл тетрагидрофурана и обрабатывали 3,9 мл концентрированного гидроксида аммония при перемешивании в течение 30 минут. Раствор разбавляли ацетонитрилом, а затем концентрировали до образования зародышей кристаллизации, после чего продукт фильтровали и перекристаллизовывали из ацетона с получением 10 г 10-деацетилбаккатина III чистотой более 99% (по методу ВЭЖХ), не содержащего 2-дебензоил-2-пентеноилбаккатин III.
Пример 3 - Паклитаксел, не содержащий 2-дебензоил-2-пентеноильного аналога
N-дебензоилпаклитаксел (700 г) получали, как описано в примерах V-VII заявки на выдачу патента США 2005/0049297 А1, используя в качестве исходного материла 10-DAB III, очищенный в соответствии с представленным выше примером 2 (а потому не содержащий 2-дебензоил-2-пентеноильный аналог), после чего растворяли в 14 л ацетонитрила, добавляли 120 мл триэтиламина и обрабатывали 107 мл бензоилхлорида.
Реакционную смесь перемешивали при комнатной температуре в течение получаса и разбавляли 21 л воды, содержащей 0,1% уксусной кислоты.
Твердые вещества фильтровали, промывали 3 л смеси вода/ацетонитрил (3/2) и сушили в вакууме при 50°С. Получали приблизительно 700 сухого твердого вещества, из которого кристаллизацией из циклогексана/ацетона (2/1) и сушки в вакууме получали 600 г паклитаксела, не содержащего 2-дебензоил-2-пентеноилпаклитаксел.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУСИНТЕТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ 10-ДЕАЦЕТИЛ-N-ДЕБЕНЗОИЛПАКЛИТАКСЕЛА | 2005 |
|
RU2384578C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДОЦЕТАКСЕЛА | 2005 |
|
RU2510395C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПАКЛИТАКСЕЛА | 2001 |
|
RU2276147C2 |
| ПРОИЗВОДНЫЕ 10-ДЕАЦЕТИЛБАККАТИНА III И 10-ДЕАЦЕТИЛ-14β-ГИДРОКСИБАККАТИНА III, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2152936C1 |
| ПРОИЗВОДНЫЕ 10-ДЕАЦЕТИЛ-14-БЕТА-ГИДРОКСИБАККАТИНА III, СПОСОБ ИХ ПОЛУЧЕНИЯ И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ | 1996 |
|
RU2161615C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТАКСАНОВ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2233276C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БАККАТИНА III | 2001 |
|
RU2264394C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСАНА | 2001 |
|
RU2275365C2 |
| 10-ДЕЗАЦЕТОКСИТАКСОЛ ИЛИ ЕГО ПРОИЗВОДНЫЕ | 1992 |
|
RU2114836C1 |
| С-4 КАРБОНАТСОДЕРЖАЩИЕ ТАКСАНЫ | 2000 |
|
RU2243223C2 |
Изобретение относится к способу получения 10-деацетилбаккатина III, чистотой более 99%, не содержащего 10-деацетил-2-дебензоил-2-пентеноилбаккатин III. Предложенный способ включает: а) обработку неочищенного 10-деацетилбаккатина III активированным производным трихлоруксусной кислоты; b) проведение хроматографии на силикагеле и элюирование 7,10-бис-трихлорацетил-10-деацетилбаккатина III дихлорметаном или смесью дихлорметан/этилацетат; и с) обработку 10-деацетил-7,10-бис-трихлорацетилбаккатина III щелочью с последующей кристаллизацией. Изобретение также относится к получению паклитаксела, который включает получение 10-деацетилбаккатина III предложенным способом и последующее его преобразование в N-дебензоилпаклитаксел с последующим его бензоилированием. Технический результат - удобный полусинтез противоопухолевых средств с таксановым остовом, который позволяет избежать трудоемкие способы очистки от соответствующих 2-дебензоил-2-пентеноильных аналогов. 2 н. и 5 з.п. ф-лы, 1 табл.
1. Способ получения 10-деацетилбаккатина Ш, чистотой более 99%, не содержащего 10-деацетил-2-дебензоил-2-пентеноилбаккатин III, который включает:
a) обработку неочищенного 10-деацетилбаккатина III активированным производным трихлоруксусной кислоты;
b) проведение хроматографии на силикагеле и элюирование 7,10-бис-трихлорацетил-10-деацетилбаккатина III дихлорметаном или смесью дихлорметан/этилацетат;
c) обработку 10-деацетил-7,10-бис-трихлорацетилбаккатина III щелочью с последующей кристаллизацией.
2. Способ по п.1, в котором стадию а) выполняют взаимодействием с трихлорацетилхлоридом при температуре от -5 до +5°С в пиридине или в смеси пиридин/дихлорметан.
3. Способ по п.1 или 2, в котором хроматографию продукта трихлорацетилирования проводят с использованием от 10 до 20 мас.ч. силикагеля относительно массы неочищенного 7,10-бис-трихлорацетил-10-деацетилбаккатина III, полученного по п.1 или 2.
4. Способ по п.1, в котором после стадии b) следует извлечение соответствующей 2-дебензоил-2-пентеноильной примеси и продуктов моноацилирования с использованием более полярного по сравнению с дихлорметаном растворителя, такого как ацетон или метанол.
5. Способ по п.1, в котором обработку щелочью на стадии с) выполняют взаимодействием с гидроксидом аммония в растворителе, выбранном из метанола, смеси метанол/дихлорметан или тетрагидрофуран.
6. Способ по п.1 или 5, в котором кристаллизацию 10-деацетилбаккатина III выполняют с растворителем, выбранным из ацетонитрила, ацетона или метанола.
7. Способ получения паклитаксела, который включает получение 10-деацетилбаккатина III по любому из пп.1-6 и его преобразование в N-дебензоилпаклитаксел с последующим бензоилированием.
| US 20040049060 A1, 11.03.2004 | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ СЪЕМА ПОЧАТКОВ С ВЕРЕТЕН ПРЯДИЛЬНОЙ МАШИНЫ | 0 |
|
SU244161A1 |
| Державка для тангенциального резца | 1935 |
|
SU52003A1 |
| WO 2002122215 A, 14.02.2002 | |||
| ПРОИЗВОДНЫЕ ПАКЛИТАКСЕЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ТОРМОЖЕНИЯ РОСТА ОПУХОЛИ | 1996 |
|
RU2162082C2 |
| RU 93053760 A, 27.12.1996 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПАКЛИТАКСЕЛЯ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ЕГО ЧАСТИЧНОГО СИНТЕЗА | 1998 |
|
RU2213739C2 |
| US 5453520 A, 26.09.1995. | |||
Авторы
Даты
2011-01-20—Публикация
2006-04-07—Подача