Изобретение относится к медицинской вирусологии и может быть использовано в практическом здравоохранении для профилактики заболеваемости гриппом среди взрослых и детей с помощью живой гриппозной интраназальной вакцины из штамма вируса гриппа типа А, семейства Orthomyxoviridae, рода Influenzavirus A, A/17/Брисбен/07/28 (H1N1).
В результате появления в циркуляции нового дрейфового варианта - вируса гриппа А/Брисбен/59/2007 (H1N1), известный вакцинный штамм А/17/Новая Каледония/99/145 (H1N1) - прототип [Патент РФ №2183672 от 20.06.2002. - Опубл. БИ 2002. - №17] - утратил антигенную актуальность. Вследствие этого он не может вызвать защитную реакцию во время эпидемии, вызванной штаммами вируса гриппа, подобными А/Брисбен/59/2007 (H1N1).
Задачей, на решение которой направлено заявляемое изобретение, является получение вакцинного штамма актуальной антигенной разновидности на основе современного эпидемического вируса А/Брисбен/59/2007 (H1N1) для производства живой гриппозной вакцины. Вакцина должна быть пригодна для взрослых и для детей, то есть соответствовать нормативным требованиям, предъявляемым к вакцинным штаммам Фармакопейной статьей ФСП 42-0417-4097-03 на живую гриппозную вакцину для интраназального применения.
Целью изобретения было получение промышленно значимого и антигенно актуального реассортантного вакцинного штамма. Для его получения выбраны два родительских штамма вируса гриппа: эпидемический штамм вируса гриппа А/Брисбен/59/2007 (H1N1) и безвредный для человека холодоадаптированный донор аттенуации А/Ленинград/134/17/57 (H2N2).
Применяемые в настоящее время штаммы для живых гриппозных вакцин получают методом генетической реассортации эпидемически актуальных вирусов с холодоадаптированными штаммами - донорами аттенуации [Александрова Г.И. Применение метода генетической рекомбинации для получения вакцинных штаммов вируса гриппа // Вопр. Вирусол - 1977. - №4 - С.387-395].
Донор аттенуации А/Ленинград/134/17/57 (H2N2) - холодоадаптированный (са) и температурочувствительный (ts) штамм вируса гриппа, разрешенный для получения безвредных живых интраназальных вакцин для взрослых и детей [Александрова Г.И. Новое в эпидемиологии и профилактике вирусных инфекций. Л., 1968. - С.66-83].
Донор аттенуации А/Ленинград/134/17/57 (H2N2), характеризующийся устаревшей антигенной структурой, был ранее получен из эпидемического вируса А/Ленинград/13 4/57 (H2N2) методом холодовой адаптации [Александрова Г.И., Климов А.И. Живая вакцина против гриппа. - СПб.: Наука. - 1994. - 151 с.], в результате чего он стал безвредным для человека, т.е. приобрел способность бессимптомно размножаться в верхних дыхательных путях привитых лиц, вызывая выработку противовирусного иммунитета.
Целью реассортации является получение штамма с вакцинной формулой генома 6:2. Гены, кодирующие поверхностные белки вируса гриппа гемагглютинин (НА) и нейраминидазу (NA), наследуются от антигенно-актуального циркулирующего эпидемического (пандемического) штамма, а шесть генов, кодирующих внутренние и неструктурные белки (РВ2, РВ1, PA, NP, M, NS) - от безвредного донора аттенуации.
На основе донора аттенуации А/Ленинград/134/17/57 (H2N2) и эпидемического штамма А/Новая Каледония/20/99 (H1N1) был создан вакцинный штамм А/17/Новая Каледония/99/145 (H1N1) - прототип. Работа с иным эпидемическим штаммом требует подбора оптимальных условий реассортации, иного числа пассажей при отборе клонов, оптимизации методики их отбора и оценки их фенотипических свойств.
Получение вакцинного штамма. Вакцинный штамм А/17/Брисбен/07/28 (H1N1) получен методом генетической реассортации эпидемического вируса А/Брисбен/5 9/2007 (H1N1) с донором аттенуации А/Ленинград/134/17/57 (H2N2) посредством одновременного инфицирования развивающихся куриных эмбрионов (РКЭ) смесью родительских вирусов в эквивалентных инфекционных дозах, с последующей селекцией клонов с заданными свойствами при пониженной до 25°С температуре инкубации в присутствии антисыворотки к донору аттенуации. Клоны дополнительно очищены трехкратным клонированием методом предельных разведений в присутствии антисыворотки к донору при пониженной (25°С) и оптимальной (32°С) температурах инкубации. Чистые клоны проверены по фенотипическим характеристикам (ts-, са-фенотип) и по формуле генома на соответствие вакцинному штамму.
Для анализа состава генома реассортантных клонов использовали следующие методы:
а) Реакцию торможения гемагглютинации (РТГА), позволяющую определить принадлежность поверхностного антигена - гемагглютинина (НА) одному из родительских вирусов [Методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа. МУК 3.3.2.175 8-03].
б) Метод рестрикционного анализа ДНК копий генов [Klimov A.I., Сох N.J. PCR restriction analysis of genome composition and stability of cold-adapted reassortant live influenza vaccines // J. Virol. Methods. - 1995. - Vol.52. - №1-2. - P.41-49], основанный на амплификации относительно коротких участков РНК длиной около 150-300 нуклеотидов, включающих уникальные нуклеотидные последовательности, характерные только для донора аттенуации А/Ленинград/134/17/57 (H2N2), но не для современных эпидемических вирусов гриппа. Обработку амплифицированных фрагментов ДНК производят специфическими рестриктазами с их последующим электрофорезом в 1,7%-ном агарозном геле, содержащем 0,5 мкг/мл этидиума бромида. Это позволяет четко дифференцировать принадлежность генов исследуемых реассортантных штаммов к эпидемическому вирусу или донору аттенуации.
Антигенная характеристика вакцинного штамма. Полученный нами вакцинный штамм А/17/Брисбен/07/28 (H1N1) в РТГА идентичен эпидемическому вирусу А/Брисбен/59/2007 (H1N1) антисывороткой к которому полностью нейтрализуется.
Рестрикционным методом также установлено, что вакцинный штамм А/17/Брисбен/07/28 (H1N1) унаследовал оба гена, кодирующие поверхностные белки - гемагглютинин (НА) и нейраминидазу (NA) - от эпидемического вируса А/Брисбен/59/2007 (H1N1).
Формула генома. Формула генома 6:2 вакцинного штамма А/17/Брисбен/07/28 (H1N1) подтверждена методом RT-PCR с помощью специфических праймеров. Вакцинный штамм А/17/Брисбен/07/28 (H1N1) унаследовал все шесть генов, кодирующих внутренние белки (РВ1, РВ2, PA, NP, M, NS), от донора аттенуации А/Ленинград/134/17/57 (H2N2).
На фиг.1, в качестве примера, представлена рестрикция ДНК-копии фрагмента гена РА эндонуклеазой Asn I. 1-я дорожка - ДНК маркер молекулярного веса IX; 2-я дорожка - эпидемический вирус А/Брисбен/59/2007 (H1N1); 3-я дорожка - донор аттенуации А/Ленинград/134/17/57 (H2N2); 4-я дорожка - кандидат в вакцинные штаммы А/17/Брисбен/07/28 (H1N1). В РА гене донора аттенуации А/Ленинград/134/17/57 (H2N2) в позиции нуклеотида 107 имеется замена Т→С по сравнению с современными эпидемическими штаммами, приведшая к аминокислотной замене лейцина эпидемических вирусов на пролин у донора аттенуации. Донор аттенуации А/Ленинград/134/17/57 (H2N2) имеет на этом участке сайт рестрикции для экзогенной рестриктазы Asn I. У эпидемических вирусов этот рестрикционный сайт отсутствует. Т.о., обработка всех исследуемых фрагментов ДНК данным ферментом приводит к разрезанию участка гена РА на два более мелких фрагмента, если он происходит от донора аттенуации А/Ленинград/134/17/57 (H2N2). У гена, кодирующего белок РА эпидемического вируса, расщепления не происходит.
Результаты рестрикционного анализа всех генов вакцинного штамма А/17/Брисбен/07/28 (H1N1) представлены в табл.1.
Оценку фенотипических свойств вакцинного штамма А/17/Брисбен/07/28 (H1N1) проводили путем его параллельного титрования в РКЭ при разных температурах. Было показано, что вакцинный вирус является температурочувствительным (разность в показателях инфекционной активности при температуре инкубации 32°С и 39°С составляет 7,5 lg ЭИД50/0,2 мл) и холодоадаптированным (разность в показателях инфекционной активности при температуре инкубации 32°С и 25°С равна 2,0 lg ЭИД50/0,2 мл), что свидетельствует о его безвредности для человека, поскольку по этим показателям он идентичен донору аттенуации А/Ленинград/134/17/57 (H2N2).
Оценку токсичности вакцинного штамма А/17/Брисбен/07/28 (H1N1) определяли путем подкожного и внутрибрюшинного введения вирусного материала мышам. Для этого группе из 12 мышей (самцов линии СВА весом 18-20 граммов) вводили соответствующим способом 0,5 мл вируссодержащей аллантоисной жидкости с титром 8.0 lg ЭИД50/0.2 мл и оценивали патогенность вируса по проценту выживших мышей в течение 7 дней после введения вируса. Вакцинный штамм А/17/Брисбен/07/28 (H1N1) в эксперименте на мышах оказался полностью безвредным - 100% мышей выжили в течение всего периода наблюдения.
В результате проведенных доклинических исследований установлено, что заявляемый вакцинный штамм живой гриппозной вакцины А/17/Брисбен/07/28 (H1N1) характеризуется сочетанием полезных признаков, необходимых вакцинному штамму: антигенной специфичностью эпидемического вируса А/Брисбен/59/2007 (H1N1), структурой генома 6:2, оптимальной для реассортантных вакцинных штаммов, а также характерной для донора аттенуации температурочувствительностью и холодоадаптированностью, что коррелирует с аттенуацией для человека. Штамм аттенуирован и безвреден для мышей.
Морфология штамма полиморфная, типичная для вируса гриппа.
Штамм А/17/Брисбен/07/28 (H1N1) ареактогенен для взрослых и для детей при интраназальном введении.
Таким образом, вакцинный штамм А/17/Брисбен/07/28 (H1N1) по биологическим свойствам и показателям реактогенности соответствует требованиям, предъявляемым к вакцинным штаммам Фармакопейной статьей ФСП 42-0417-4097-03 на живую гриппозную вакцину для интраназального применения.
Полученный штамм А/17/Брисбен/07/28 (H1N1) депонирован в коллекции вирусов ФГУН «Государственный НИИ стандартизации и контроля медицинских биологических препаратов имени Л.А.Тарасевича» Роспотребнадзора (ФГУН ГИСК им. Л.А.Тарасевича Роспотребнадзора, Россия RU, 119002, город Москва, Сивцев-Вражек, дом 41) под №789 и имеет характеристики, представленные в паспорте штамма.
ПАСПОРТ ШТАММА
1. Название штамма А/17/Брисбен/07/28 (H1N1).
2. Серия: серия 1 (первая).
3. Метод получения - реассортация; характеристика родительских вирусов:
а) эпидемический вирус: А/Брисбен/59/2007 (H1N1).;
б) донор аттенуации: А/Ленинград/134/17/57 (H2N2).
4. Количество пассажей: 6 в процессе реассортации.
5. Характеристика штамма до лиофилизации:
а) оптимальные условия репродукции: 32°С, 48 часов;
б) гемагглютинирующая активность: 1:512;
в) инфекционная активность: 8.5 lg ЭИД50/0,2 мл;
г) чувствительность к ингибиторам: ингибитороустойчивый в РТГА с нормальной лошадиной сывороткой;
д) разность в показателях инфекционной активности при 32°С/39°С:
7.5 lg ЭИД50/0,2 мл;
е) разность в показателях инфекционной активности при 32°С/25°С:
2,0 lg ЭИД50/0,2 мл;
ж) структура генома реассортанта по данным рестрикционного анализа амплифицированных в RT-PCR фрагментов вирусных РНК:
гены от эпидемического вируса: НА, NA;
гены от донора аттенуации: РВ2, РВ1, PA, NP, M, NS.
6. Характеристика штамма после лиофилизации:
а) дата лиофилизации: 11 апреля 2008 г.;
б) объем материала в ампуле: 1,0 мл;
в) количество доз в ампуле: 4;
г) инфекционная активность: 8,0 lg ЭИД50/0.2 мл;
д) гемагглютинирующая активность: 1:256.
7. Рекомендуемое разведение при вакцинации: 1:2.
8. Антигенная специфичность гемагглютинина:
гемагглютинин в РТГА идентичен вирусу А/Брисбен/59/2007 (H1N1), крысиной антисывороткой к которому полностью нейтрализуется.
9. Безвредность для мышей при подкожном и внутрибрюшинном введении: безвреден.
10. Бактериологический контроль: - стерилен.
11. Контроль на посторонние вирусы: посторонние вирусы отсутствуют.
ХАРАКТЕРИСТИКА ШТАММА
Инфекционная активность штамма А/17/Брисбен/07/28 (H1N1) при репродукции в развивающихся куриных эмбрионах при 32°С в течение 48 часов - 8,5 lg ЭИД50/0,2 мл.
Гемагглютинирующая активность - 1:512.
Штамм проявляет генетическую стабильность аттенуирующих мутаций и биологических признаков после 5 пассажей на куриных эмбрионах (при использовании больших заражающих доз).
ШТАММ А/17/БРИСБЕН/07/28 (H1N1)
АРЕАКТОГЕНЕН ДЛЯ ВЗРОСЛЫХ ЛИЦ
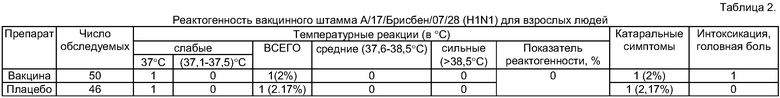
Пример 1. При вакцинации 50 взрослых лиц интраназально реассортантным вакцинным штаммом А/17/Брисбен/07/28 (H1N1) с инфекционной активностью 8,0 lg ЭИД50/0,2 мл в разведении 1:2 в объеме 0,5 мл сильных температурных реакций с повышением температуры свыше 38,6°С, средних температурных реакций с повышением температуры до 37,6-38,5°С и температурных реакций слабой степени выраженности (до 37,1-37,2°С) не наблюдалось. У одного человека (2% случаев) отмечены на второй день кашель, насморк, головная боль, температура 37°С. В группе из 46 лиц, получившей плацебо, сильных, средних и слабых температурных реакций не наблюдалось. У одного человека в день вакцинации отмечались температура 37°С, слабость, недомогание. У другого пациента на второй день диагностирован острый ринофарингит (2,17% случаев). Результаты обследования приведены в табл.2.
Показатель реактогенности (разница в проценте средних реакций у привитых вакциной и получивших плацебо) составил 0%.
ШТАММ А/17/БРИСБЕН/07/28 (H1N1)
АРЕАКТОГЕНЕН ДЛЯ ДЕТЕЙ 3-14 ЛЕТ
До 2004 года реассортантные вакцинные штаммы живой гриппозной вакцины для детей и для взрослых готовили на двух разных донорах аттенуации. Вакцинные штаммы живой гриппозной вакцины для взрослых готовили на доноре аттенуации А/Ленинград/134/17/57 (H2N2) [Александрова Г.И., Климов А.И. Живая вакцина против гриппа. - СПб.: Наука. - 1994. - 151 с.], а вакцинные штаммы живой гриппозной вакцины для детей - на более аттенуированном доноре А/Ленинград/134/47/57 (H2N2) [Александрова Г.И., Климов А.И. Живая вакцина против гриппа. - СПб.: Наука, - 1994. - 151 с.]. В 2003 году Комитет медицинских иммунобиологических препаратов счел целесообразным рекомендовать «Вакцину гриппозную аллантоисную интраназальную живую сухую для взрослых» для иммунизации детей в возрасте 3-6 лет с внесением соответствующих изменений в «Инструкцию по применению» препарата [Инструкция по применению вакцины гриппозной аллантоисной интраназальной живой сухой. Утверждена Главным санитарным врачом РФ Г.Г.Онищенко 16.06.2004].
Нами была изучена реактогенность вакцинного штамма А/17/Брисбен/07/28 (H1N1) на детях.
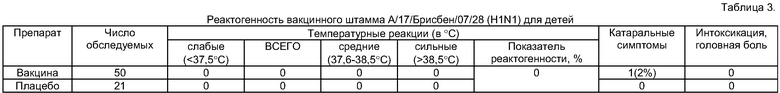
Пример 2. Группу из 50 детей в возрасте 3-14 лет вакцинировали интраназально в объеме 0,5 мл реассортантным вакцинным штаммом А/17/Брисбен/07/28 (H1N1) с инфекционной активностью 8,0 lg ЭИД50/мл в разведении 1:2. Результаты исследований приведены в табл.3. Сильных температурных реакций с повышением температуры свыше 38,5°С, средних температурных реакций с повышением температуры в диапозоне 37,6-38,5°С и слабых температурных реакций (до 37,5°С) не отмечено. Легкие катаральные симптомы наблюдались у 1 ребенка (2% случаев). Показатель реактогенности составил 0%.
Испытания на волонтерах подтвердили, что вакцинный штамм А/17/Брисбен/07/28 (H1N1) по показателям реактогенности соответствует требованиям, предъявляемым к вакцинным штаммам Фармакопейной статьей ФСП 42-0417-4097-03 на живую сухую гриппозную аллантоисную вакцину для интраназального применения.
Полезным свойством вакцинного штамма вируса гриппа А/17/Брисбен/07/28 (H1N1) является его пригодность для наработки живой гриппозной вакцины. Предлагаемый по изобретению вакцинный штамм вируса гриппа А/17/Брисбен/07/28 (H1N1) может быть использован для профилактики гриппа как у взрослых, так и у детей с трехлетнего возраста, что подтверждают результаты изучения его реактогенности для разных возрастных групп.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А/17/СОЛОМОНОВЫ ОСТРОВА/06/9 (H1N1) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ВЗРОСЛЫХ И ДЛЯ ДЕТЕЙ | 2010 |
|
RU2422518C1 |
| ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А/17/БРИСБЕН/07/1 (H3N2) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ВЗРОСЛЫХ И ДЛЯ ДЕТЕЙ | 2010 |
|
RU2416640C1 |
| ШТАММ ВИРУСА ГРИППА А/17/ВИКТОРИЯ/2011/89 (H3N2) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ВЗРОСЛЫХ И ДЛЯ ДЕТЕЙ | 2012 |
|
RU2532844C2 |
| ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А/17/КАЛИФОРНИЯ/2009/38 (H1N1) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ВЗРОСЛЫХ И ДЛЯ ДЕТЕЙ | 2009 |
|
RU2413765C1 |
| ШТАММ ВИРУСА ГРИППА A/17/НОВАЯ КАЛЕДОНИЯ/99/145(H1N1) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ВЗРОСЛЫХ | 2000 |
|
RU2183672C1 |
| ШТАММ ВИРУСА ГРИППА A/47/НОВАЯ КАЛЕДОНИЯ/99/156(H1N1) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ДЕТЕЙ | 2000 |
|
RU2185437C1 |
| ШТАММ ВИРУСА ГРИППА А/17/ПЕКИН/95/25(H1N1) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ВЗРОСЛЫХ | 1999 |
|
RU2159811C1 |
| Реассортантный штамм вируса гриппа А/17/Дарвин/2018/154 (H1N1)pdm09 для производства живой гриппозной интраназальной вакцины для взрослых и для детей | 2023 |
|
RU2825670C1 |
| Вакцинный штамм вируса гриппа А/17/БРИСБЕН/2018/8175 (H1N1) pdm09 для производства живой гриппозной интраназальной вакцины для взрослых и для детей | 2019 |
|
RU2735291C1 |
| ШТАММ ВИРУСА ГРИППА ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ И ИНАКТИВИРОВАННОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2011 |
|
RU2464309C1 |
Вакцинный штамм вируса гриппа А/17/Брисбен/07/28 (H1N1) - реассортант, полученный путем скрещивания эпидемического вируса А/Брисбен/59/07 (H1N1) с холодоадаптированным температурочувствительным вирусом А/Ленинград/134/17/57 (H2N2) - донором аттенуации, безвредным для людей. Штамм А/17/Брисбен/07/28 (H1N1) активно размножается в развивающихся куриных эмбрионах при оптимальной температуре 32°С. Штамм характеризуется температурочувствительностью и холодоадаптированностью. Реассортант унаследовал гены, кодирующие поверхностные антигены вируса гемагглютинин (НА) и нейраминидазу (NA), от эпидемического родительского вируса и шесть генов, кодирующих внутренние негликозилированные белки, от донора аттенуации. Штамм А/17/Брисбен/07/28 (H1N1) ареактогенен для взрослых и для детей при интраназальном введении. Вакцинный штамм вируса гриппа А/17/Брисбен/07/28 (H1N1) по показателям реактогенности соответствует требованиям, предъявляемым Фармакопейной статьей ФСП 42-0417-4097-03 к вакцинным штаммам для живой сухой гриппозной аллантоисной вакцины для интраназального применения. 1 ил., 3 табл.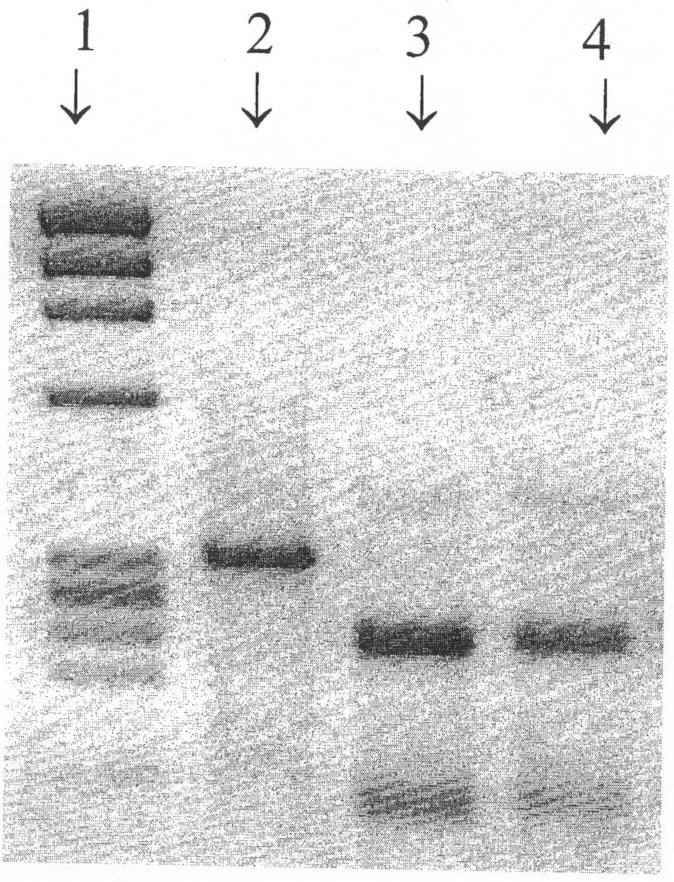
Штамм вируса гриппа А/17/Брисбен/07/28 (H1N1), депонированный в ФГУН «Государственный НИИ стандартизации и контроля медицинских биологических препаратов имени Л.А.Тарасевича» Роспотребнадзора (ФГУН ГИСК им. Л.А.Тарасевича Роспотребнадзора) под №789, используемый для получения живой гриппозной интраназальной пандемической вакцины для взрослых и для детей.
Авторы
Даты
2011-04-20—Публикация
2010-01-11—Подача