Изобретение относится к соединениям замещенного ксантина. Главным образом, настоящее изобретение имеет отношение к 1,3,7-тризамещенной композиции метилксантиновым соединениям, особенно к производным теофиллина.
В последнее время арсенал применяемых в клинике противоопухолевых средств значительно расширился, однако большинство из них остаются малоэффективными и высокотоксичными.
В настоящее время стало очевидным, что методология подходов разработки новых перспективных химиотерапевтических соединений направленного действия с заранее заданными свойствами должна базироваться на фундаментальных исследованиях особенностей метаболизма опухолевой клетки.
В этом отношении обмен полиаминов (ПА), являющихся эссенциальными факторами процессов клеточного роста (Seiler N. Polyamine metabolism // Digestion 46 Suppl. - 1990. - V.2. - P.319-330) и дифференцировки (Heby, О. Role of polyamines in the control of cell proliferation and differentiation // Differentiation - 1981. - V.19 (1). - P.1-20) с учетом активности трансглутаминазы (ТГ) (Lentini A. and Beninati S. Differentiation therapy of cancer: transglutaminase as differentiative tool // Minerva Biotec. - 2002. - V.14 (2). - P.159-64) может служить удобной и надежной мишенью для поиска и конструирования противоопухолевых агентов, в частности в качестве специфических ингибиторов ТГ и регуляторов активности ключевых ферментов обмена ПА.
Индукция орнитиндекарбоксилазы (ОДК) - ключевого фермента синтеза полиаминов (ПА) - оказалась одним из самых ранних молекулярных проявлений активирования метаболизма клеток, готовящихся к делению, росту и дифференцировке.
Окисленные до иминоальдегидов ПА ингибировали рост асцитного рака Эрлиха, инактивировали вирус гриппа и вирус болезни Newcastia и Sendai, подавляя синтез белка и нуклеиновых кислот.
Существует тесная взаимосвязь между синтезом ПА и процессами роста и дифференцировки злокачественных клеток, поскольку рост и пролиферация обеспечиваются высоким уровнем синтеза ПА, а переход клеток от пролиферации к дифференциации сопровождается снижением активности ОДК и внутриклеточной концентрации ПА.
Индукторы дифференциации снижали внутриклеточное содержание путресцина (Пут) и спермидина (Сд).
Ингибиторы биосинтеза ПА подавляли рост и вызывали дифференцировку опухолевых клеток (меланогенез в клетках меланомы мышей). Химическая регуляция обмена ПА обеспечивает защиту не только от тех заболеваний, которые являются следствием воздействия бактерий, вирусов и других патогенов, но и от рака, а также болезненных состояний, являющихся следствием иммунного дисбаланса, случайного инфицирования или аутоиммунных нарушений.
Была высказана гипотеза о том, что аналоги ПА способны замещать эндогенные ПА в клетке в участках связывания. Это приводит к нарушению функций внутриклеточных ПА. Исследования ограничились аналогами ПА алифатической структуры (Wallace НМ, Praser AV. Polyamine analogues as anticancer drugs // Biochem Soc Trans. - 2003 Apr. - V.31(2). - P.393-6). Однако предварительные результаты показали, что онкопротекторной активностью могут обладать также гетероциклические соединения, в частности пуриновые алкалоиды (Lentini A, Kleinman HК, Mattioli P, Autuori-Pezzoli V, Nicolini L, Pietrini A, Abbrazzese A, Cardinali M, Beninati S. Inhibition of melanoma pulmonary metastasis by methylxanthines due to decreased invasion and proliferation. Melanoma Res 8: 131-137, 1998).
Среди многих классов соединений, обладающих способностью к контролированию заболевания, аналогами изобретения следует считать нуклеозиды, которые хорошо известны в данной области техники. Так, например, 7-тио-8-оксогуанозин описан D.F.Smee с сотр. в Journal of Biological Response Modifiers, 9, 24-32, 1990, как агент, проявляющий антивирусную активность при испытании на мышах. Активность такого соединения основана на его способности к активации NK и В клеток в иммунной системе и к индукции интерферона. Однако последующие исследования антивирусной активности на людях, сообщенные Р.G.Higgins с сотр. в Antiviral Chemistry and Chemotheropy, 2, 61-63, 1991, дали лишь малообнадеживающие результаты. Одной из проблем оказалось отсутствие оральной биопригодности. Известны другие нуклеозиды, синтезированные с целью разработки усовершенствованных медикаментозных препаратов. Так, например, H.F.Smee с сотр. сообщили в Antimicrobial Agents and Chemotheropy, 35, 152-157, 1991, что 7-деазагуанозин обладает значительной иммуностимуляторной и противовирусной активностью при оральном применении. Однако эти результаты носили предварительный характер. Для многих нуклеозидных соединений токсичность оказалась важным обстоятельством. Известны нуклеозидные иммуностимуляторы, базирующиеся на инозине и других аналогичных гипоксантинсодержащих соединениях. Изопринозин, инозинсодержащий комплекс, исследовали на иммуномодуляторную активность, и C.D.Simone с сотр. ссылаются на это соединение, как на "золотой стандарт" в статье Thymus, 19, 51-55, 1992. Хотя изопринозин обладает очень низкой токсичностью, он не является эффективным иммуномодулятором и для улучшения его иммунофармакологических свойств было синтезировано большое число его аналогов, о чем сообщается J.W.Hadden с сотр. в International Journal of Immounophormacology, 13, 49-54, 1991.
Монофосфат метилинозина не является достаточно активным иммуномодулятором, не обладает активностью индуктора клеточной дифференцировки.
Известен гипоксантин, содержащий L-аргинин, ковалентно связанный через пентаметиленовый мостик. Такое соединение, ST 789 (гипоксантин пентилоксикарбонил L-аргинин, ранее обозначаемый как PCF 39) было подробно описано в последнем выпуске Thymus 19, s.1-112 (1992). L-ST 789 дополнительно раскрыт в заявке на Европейский патент #91830248, публикация #464009 от 2 января 1992 г. Аналоги ST 789 также описаны в Европейских публикациях, в которых олигопептиды, состоящие из L-аминокислот природного происхождения, заменяют L-аргинин. Однако пуриновая часть таких молекул сохраняет гипоксантин.
Такие соединения были нетоксичными, но, в лучшем случае, обладали умеренной иммуностимуляторной активностью. Нет сведений относительно способности ST 789 или его аналогов к стимуляции такой важной подгруппы иммунных клеток, как цитотоксичные Т лимфоциты (СД8+Т клетки). Такая подгруппа играет ключевую роль в защите организма от вирусных инфекций и рака. Однако нет сведений относительно активности в качестве индуктора клеточной дифференцировки у этих производных ксантина. Р. Cornaglia-Ferraris International Journal of Immunopharmacology, 13,1005-1012, 1991, описывает еще один аналог ST 789. В таком соединении L-аргинин заменяли на бомбезин карбокси терминальный дипептидный L-лейцил L-метионин. В качестве пуриновой основы по-прежнему использовался гипоксантин. Фактически для такого класса соединений, в которых пуриновое основание ковалентно связано метиленовой цепочкой с аминокислотой или олигопептидом, имеется очень мало данных о соединениях, включающих пуриновое основание, отличное от гипоксантина. Кроме этого, в связи с требованиями к физиологически активным аминокислотам для млекопитающих систем, во всех работах, известных к настоящему времени, описываются аминокислоты (природной) L-конфигурации. Однако не приводится сведений о существенной биологической активности. Левамизол представляет собой другой иммунорегулирующий агент, используемый против злокачественной меланомы. Известно, что левамизол вызывает серьезную тромбоцитопению после начала иммуногенной левамизольной терапии злокачественной меланомы [Med. Pediator. Oncol. Apr., 1995, 24 (4), 262-264].
Наиболее близким является изобретение по патенту №2191189 «Производные замещенного пуринила, обладающие иммуномодуляторной активностью, фармацевтическая композиция и способ замедления роста опухоли». Изобретение относится к производным замещенного пуринила, обладающим иммуномодуляторной, в частности иммуностимуляторной, активностью как in vivo, так и in vitro и не проявляющих токсичности, к фармацевтической композиции и способу замедления роста опухоли.
Обзор имеющихся литературных данных показывает, что имеется необходимость в соединениях, обладающих способностью регулировать скорость клеточной и опухолевой пролиферации и дифференцировки опосредованно через систему обмена полиаминов, с низкой токсичностью, что и является задачей изобретения.
Сущность изобретения заключается в том, что обеспечивается соединение, обладающее значительной способностью к торможению опухолевой пролиферации и индукции дифференциации опухолевых клеток in vitro.
Главным образом, предлагается соединение, обладающее пониженным уровнем цитотоксичности.
Согласно другому аспекту изобретения предусматривается онкопротекторное соединение, понижающее уровень ПА в клетках мышиной меланомы B16-F10 как необходимое условие торможения скорости клеточной пролиферации. Согласно еще одному аспекту изобретения предусматривается онкопротекторное соединение, повышающее активность ТГ в клетках мышиной меланомы B16-F10 как существенный показатель активации процесса клеточной дифференциации.
Согласно еще одному аспекту изобретения предусматривается онкопротекторное соединение, повышающее уровень образования меланина в клетках мышиной меланомы B16-F10 как существенный показатель активации процесса клеточной дифференциации.
Другой аспект настоящего изобретения охватывает соединение, выполняющее функции агента, контролирующего процесс клеточной дифференциации в клетках мышиной меланомы B16-F10.
Настоящее изобретение относится к соединениям общей формулы (1) Производные ксантина

где (1) R1 означает СН3, R3 - СН3; R3 - галогены F, Cl, Br, I; R4 - водород;
(2) R1 означает СН3, R2 - СН3; R3 - водород, галогены F, Cl, Br, I; R4-CH2COOH;
(3) R1 означает водород, R2 - СН3; R3 - галогены F, Cl, Br, I; R4 - СН3
или их фармацевтически приемлемым производным, в которой R1 выбирают из группы, состоящей из водорода и СН3, R2 - это СН3, R3 выбирают из группы, состоящей из водорода, галогенов F, Cl, Br, I и R4 выбирают из группы, состоящей из водорода и СН2СООН.
В соответствии с одним из аспектов настоящего изобретения обеспечивается соединение формулы (1), в которой R4 представляет собой Н.
Согласно другому аспекту изобретения предусматривается соединение формулы (1), в которой R4 представляет собой СН2СООН.
Согласно другой альтернативе настоящего изобретения в том случае, когда R1 представляет собой Н.
Более предпочтительно R1 может представлять собой СН3.
В соответствии с еще одним альтернативным решением настоящего изобретения R2 может быть выбрано как СН3.
В соответствии с еще одним альтернативным решением настоящего изобретения R3 может быть выбрано из группы галогенов, состоящей из Cl, Br, I и F.
Предпочтительно, чтобы R3 представляло собой Н. Предпочтительно, чтобы R3 представляли собой Cl или Br. Более предпочтительно, когда R3 может представлять собой I или F. Наиболее предпочтительно, когда соединение изобретения отвечает общей формуле (1), в которой R1 и R2 каждый представляет собой СН3, а R4 представляет собой СН2СООН, или предпочтительными являются фармацевтически приемлемые производные такого соединения. Предпочтительные соединения настоящего изобретения выбирают из группы следующих соединений (таблица 1).
Пуриновые алкалоиды - метилированные производные ксантина
1. Цитотоксичность исследуемых веществ
Результаты исследования цитотоксичности тестируемых веществ суммированы в таблицах 1-3. Вещества, значения цитотоксичности которых не превышают 30%, оказывают допустимый токсический эффект на клетки. Посчитана также токсичность действия растворителя (раствора подкисленного ДМСО) на клетки, значение которого берется за контроль.
Цитотоксичность 8-Сl-ТФ в концентрациях 50 µМ, 500 µМ и 1 мМ после 24, 48 и 72 часов инкубации с клетками мышиной меланомы линии B16-F10
Цитотоксичность 8-Вr-ТФ в концентрациях 50 µМ, 500 µМ и 1 мМ после 24, 48 и 72 часов инкубации с клетками мышиной меланомы линии B16-F10
Цитотоксичность ТФ-7-Ац в концентрациях 50 µМ, 500 µM и 1 мМ после 24, 48 и 72 часов инкубации с клетками мышиной меланомы линии B16-F10
Производные ТФ оказывали незначительное токсическое влияние на клетки мышиной меланомы B16-F10. Наиболее цитотоксичным проявило себя вещество 8-Вг-ТФ.
2. Влияние исследуемых веществ на пролиферацию клеток мышиной меланомы линии В16-F10
На фиг.1 и 2 показано влияние производных метилксантина и производных ТФ на пролиферацию клеток мышиной меланомы линии B16-F10. Примечание: Результаты представлены в виде М±m для 4 проб.
Оценка влияния тестируемых веществ на пролиферацию клеток мышиной меланомы линии B16-F10 проводилась путем сравнения количества клеток после инкубации с одним из веществ с заданной концентрацией в течение 24, 48 и 72 часов с контрольными клетками (без обработки веществами). Все вещества группы производных метилксантина снижали уровень роста клеток мышиной меланомы B16-F10. Наиболее активным оказался ТФ в концентрации 1 мМ на протяжении всего периода инкубирования. Производные ТФ также вызывали значительное снижение клеточного роста культуры клеток мышиной меланомы B16-F10. Более сильные антипролиферативные свойства показали вещества ТФ-7-Ац и 8-Сl-ТФ в концентрации 1 мМ.
3. Влияние испытуемых веществ на уровень образования полиаминов в клетках мышиной меланомы B16-F10
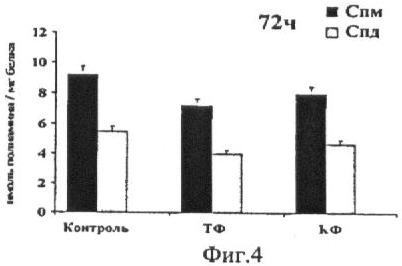
На фиг.3 и 4 показаны уровни ПА в контрольных клетках мышиной меланомы B16-F10 и в клетках, инкубированных с ТФ и КФ в концентрациях 1 мМ в течение 48 и 72 часов. Примечание: Результаты представлены в виде М±m для 3 проб.
Проводилось исследование лизата клеток мышиной меланомы B16-F10, предварительно инкубированных в течение 48 и 72 часов с 1 мМ растворами ТФ и КФ и производных ТФ. Были посчитаны уровни ПА в пробах.
Диаграммы, отражающие результаты хроматографического измерения содержания ПА в клетках мышиной меланомы B16-F10, предварительно инкубированных с 1 мМ растворами ТФ и КФ в течение 48 (фиг.3) и 72 часов (фиг.4), показывают наличие незначительного понижения уровней ПА. Снижение уровней См и Сд наблюдалось лишь в течение 48 часов воздействия веществ. Далее количество ПА в клетках практически не менялось.
На фиг.5 и 6 показаны уровни ПА в контрольных клетках мышиной меланомы B16-F10 и в клетках, инкубированных с производными ТФ в концентрациях 1 мМ в течение 48 и 72 часов. Примечание: Результаты представлены в виде М±m для 3 проб.
Производные ТФ в концентрации 1 мМ также оказывали противоопухолевое влияние, понижая уровни ПА. Самым активным образом проявил себя 8-Вr-ТФ, уменьшая уровень См более чем на 40% и Сд более чем в два раза, после 48 и 72 часов инкубации клеток меланомы с веществами. Хлорпроизводное (8-Сl-ТФ) в той же концентрации было менее активным, чем 8-Вr-ТФ. Тем не менее, оно намного превышало онкопротекторную активность ТФ, вызывая существенное снижение содержания См и Сд, после 48 и 72 часов воздействия на клетки.
На фиг.7 и 8 показано влияние производных метилксантина и производных ТФ на активность ТГ «in vivo» в клетках мышиной меланомы B16-F10. Примечание: Результаты представлены в виде М±m для 5 проб.
Следует отметить, что все три производных метилксантина являются активаторами ТГ. При этом ТФ наиболее эффективно действовал на ТГ, удваивая ее активность (фиг.7).
По сравнению с ТФ его производные почти в два раза увеличивали активность ТГ, после 72 часов инкубирования с клетками мышиной меланомы B16-F10 (фиг.8). Интересно, что после 48 часов инкубации особого эффекта на активацию ТГ эти вещества не оказывали.
4. Влияние испытуемых веществ на уровень образования меланина в клетках мышиной меланомы B16-F10
На фиг.9 и 10 показано влияние производных метилксантина и производных ТФ на уровень образования меланина в клетках мышиной меланомы B16-F10. Примечание: Результаты представлены в виде М±m для 5 проб.
Значительное влияние на уровень образования меланина в клетках мышиной меланомы B16-F10 оказали производные метилксантина в концентрации 1 мМ (фиг.9), повышая его во много раз уже через 48 часов инкубации. Наиболее активным образом из этой группы веществ проявил себя ТФ.
Производные ТФ в концентрации 1 мМ резко увеличивали уровни образования меланина в клетках лишь через 72 часа инкубации (фиг.10), это говорит об их относительно замедленном действии по сравнению с ТФ.
5. Влияние испытуемых веществ на активность трансглутаминазы в клетках мышиной меланомы B16-F10
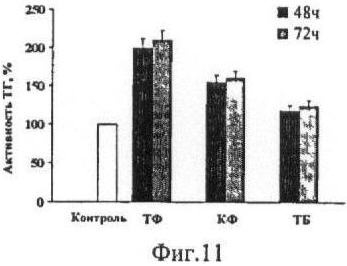
На фиг.11 и 12 показано влияние производных метилксантина и производных ТФ на активность ТГ «in vivo» в клетках мышиной меланомы B16-F10. Примечание: Результаты представлены в виде М±m для 5 проб.
Следует отметить, что все три производных метилксантина являются активаторами ТГ. При этом ТФ наиболее эффективно действовал на ТГ, удваивая ее активность (фиг.11).
По сравнению с ТФ его производные почти в два раза увеличивали активность ТГ, после 72 часов инкубирования с клетками мышиной меланомы В16-P10 (фиг.12). Интересно, что после 48 часов инкубации особого эффекта на активацию ТГ эти вещества не оказывали.
Исследовали влияние производных метилксантина и ТФ на активность ТГ «in vitro». Ни одно из протестированных веществ прямого действия на активность ТГ не оказало.
Полученные результаты по количественной оценке влияния тестируемых веществ на активность ТГ и уровни меланина подтверждают предположение о том, что антипролиферативный эффект может быть вызван посредством индукции клеточной дифференциации.
6. Влияние тестируемых веществ на дифференцировку клеток мышиной меланомы B16-F10
На фиг.13 и 14 показано влияние ТФ на дифференцировку клеток мышиной меланомы B16-F10:
фиг.13 - контрольные клетки мышиной меланомы B16-F10;
фиг.14 - дифференцированные клетки мышиной меланомы B16-F10 под действием 1 мМТФ.
При инкубировании клеток мышиной меланомы B16-F10 с 1 мМ раствором ТФ одновременно с торможением скорости деления и роста клеток наблюдались начало дифференцировки клеток, что подтверждалось появлением отростков, похожих на дендриты и аксоны нейронов, а также заметное потемнение клеток. Это говорит об увеличении уровня внутриклеточного меланина.
Техническим результатом изобретения является то, что было обнаружено, что соединения изобретения обладают in vitro низкой цитотоксичностью. Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью понижать уровень полиаминов в опухолевых клетках. Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью повышать активность трансглутаминазы в опухолевых клетках. Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью повышать уровень образования меланина в клетках мышиной меланомы B16-F10.
Кроме этого, было обнаружено, что соединения настоящего изобретения неожиданно оказались активными агентами, препятствующими опухолевой пролиферации, они активировали дифференциацию в клетках мышиной меланомы B16-F10.
Соединения настоящего изобретения могут быть получены с использованием хорошо известных синтетических методов. Так, например, можно использовать методику синтеза, описанную R.Stradi с сотр., в II Farmaco, 45, 39-47, 1990, при условии, что атом хлора в хлорпуриновом интермедиате должен быть замещен соответствующим заместителем, отличным от гидроксила.
В соответствии с дополнительным техническим решением настоящего изобретения обеспечивается способ лечения иммунодефицита или регулирования опухолевого роста, включающий стадию применения фармацевтически приемлемого количества соединения изобретения. Предпочтительно, такие опухоли включают злокачественную меланому.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ФЛУОРЕНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНОЙ АКТИВНОСТЬЮ, МОДУЛЯТОРЫ КЛЕТОЧНОЙ ДИФФЕРЕНЦИРОВКИ, СПОСОБ ЗАМЕДЛЕНИЯ СКОРОСТИ ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК, СПОСОБ ИНДУКЦИИ ДИФФЕРЕНЦИАЦИИ В КЛЕТКАХ МЕЛАНОМЫ МЫШЕЙ | 2008 |
|
RU2409568C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЗАМЕДЛЕНИЯ СКОРОСТИ ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК | 2008 |
|
RU2429232C2 |
| ТЕРАПЕВТИЧЕСКИЕ ХИНОНЫ | 2005 |
|
RU2411229C2 |
| ПРОИЗВОДНЫЕ АЗАИНДОЛА-ИНДОЛА, СПОСОБЫ ИХ ИЗГОТОВЛЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2008 |
|
RU2486184C2 |
| Способ экспериментальной биотерапии меланомы В16/F10 | 2022 |
|
RU2779698C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ ИЛИ АНТАГОНИСТ АДЕНОЗИНОВОГО РЕЦЕПТОРА | 2000 |
|
RU2239455C2 |
| СПОСОБ ТРАНСЭТЕРИФИКАЦИИ ДЛЯ ПОЛУЧЕНИЯ СИНТЕТИЧЕСКОГО ПРОИЗВОДНОГО ХЛОРОФИЛЛА ИЛИ БАКТЕРИОХЛОРОФИЛЛА | 2000 |
|
RU2250905C2 |
| Способ образования опухолевых узлов меланомы в организме экспериментальных животных | 2022 |
|
RU2796892C1 |
| СПОСОБЫ ОСВЕТЛЕНИЯ КОЖИ | 2013 |
|
RU2628871C2 |
| НЕНАСЫЩЕННЫЕ ЖИРНЫЕ ГИДРОКСИКИСЛОТЫ И ИХ ПРИМЕНЕНИЕ В ДЕРМАТОКОСМЕТОЛОГИИ | 2006 |
|
RU2440328C2 |












Изобретение относится к новому средству, обладающему свойствами замедления скорости пролиферации опухолевых клеток, таких как клетки мышиной меланомы В16-F10. Средство согласно настоящему изобретению представляет собой производные ксантина формулы (1)

где R1 означает СН3, R2 - СН3; R3 - галогены: F, Cl, Br, I; R4 - водород; R1 означает СН3, R2 - СН3; R3 - водород, галогены: F, Сl, Br, I; R4 - CH2COOH; R1 означает водород, R2 - СН3; R3 - галогены: F, Сl, Br, I; R4 - СН3. Предпочтительными соединениями указанного средства являются 8-хлортеофиллин, 8-бромтеофиллин и теофиллин-7-ацетат. Изобретение также относится к способу замедления скорости пролиферации опухолевых клеток и способу индукции дифференциации в клетках мышиной меланомы B16-F10. Каждый из способов включает введение эффективного количества указанного средства в эффективном количестве, предпочтительно в количестве 1 мМ. 3 н. и 5 з.п. ф-лы, 4 табл., 14 ил.
1. Средство, обладающее свойствами замедления скорости пролиферации опухолевых клеток, таких как клетки мышиной меланомы B16-F10, представляющее собой производные ксантина формулы (1) 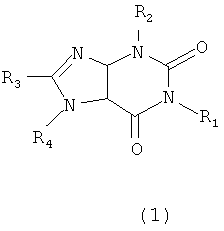
где R1 означает СН3, R2 - СН3; R3 - галогены: F, Cl, Br, I; R4 - водород;
R1 означает СН3, R2 - СН3; R3 - водород, галогены: F, Cl, Br, I; R4-CH2COOH;
R1 означает водород, R2 - СН3; R3 - галогены: F, Cl, Br, I; R4 - СН3.
2. Средство по п.1, в котором R1 и R2 представляют каждый независимо друг от друга СН3, а R3 означает Сl и R4 означает Н (8-хлортеофиллин).
3. Средство по п.1, в котором R1 и R2 представляют каждый независимо друг от друга СН3, а R3 означает Br и R4 означает Н (8-бромтеофиллин).
4. Соединение по п.1, в котором R1 и R2 представляют каждый независимо друг от друга СН3, а R3 означает Н и R4 означает СН2СООН (теофиллин-7-ацетат).
5. Способ замедления скорости пролиферации опухолевых клеток, включающий введение эффективного количества активного соединения, отличающийся тем, что в качестве активного соединения вводят соединение по любому из пп.1-4.
6. Способ по п.5, отличающийся тем, что указанное соединение вводят в количестве 1 мМ.
7. Способ индукции дифференциации в клетках мышиной меланомы В16-F10, включающий введение эффективного количества активного соединения, отличающийся тем, что в качестве активного соединения вводят соединение по любому из пп.1-4.
8. Способ по п.7, отличающийся тем, что указанное соединение вводят в количестве 1 мМ.
| LENTINI A | |||
| et al., Theophylline administration markedly reduces hepatic and pulmonary implantation of B16-F10 melanoma cells in mice; Melanoma Research (2000), 10(5), 435-443; (см | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| LENTINI A | |||
| et al., Evaluation of the efficacy of potential antineoplastic drugs on tumour metastasis by a | |||
Авторы
Даты
2011-07-20—Публикация
2008-12-29—Подача