Изобретение относится к соединениям замещенного флуорена. Главным образом, настоящее изобретение имеет отношение к 4-азафлуорензамещенной композиции 1-амино(галогено)-2-галогено-4-азафлуоренонов-9 соединениям, особенно к производным 1-амино(галогено)-9-иминоалкил(арил)-4-азафлуоренов.
В последнее время арсенал применяемых в клинике противоопухолевых средств значительно расширился, однако большинство из них остаются малоэффективными и высокотоксичными.
В настоящее время стало очевидным, что методология подходов разработки новых перспективных химиотерапевтических соединений направленного действия с заранее заданными свойствами должна базироваться на фундаментальных исследованиях особенностей метаболизма опухолевой клетки.
В этом отношении обмен полиаминов (ПА), являющихся эссенциальными факторами процессов клеточного роста (Seiler N. Polyamine metabolism // Digestion 46 Suppl. - 1990. - V.2. - Р.319-330) и дифференцировки (Heby, О. Role of polyamines in the control of cell proliferation and differentiation // Differentiation - 1981. - V.19 (1). - P.1-20) с учетом активности трансглутаминазы (ТГ) (Lentini A. and Beninati S. Differentiation therapy of cancer: transglutaminase as differentiative tool // Minerva Biotec. - 2002. - V.14 (2). - P.159-64) может служить удобной и надежной мишенью для поиска и конструирования противоопухолевых агентов, в частности, в качестве специфических ингибиторов ТГ и регуляторов активности ключевых ферментов обмена ПА.
Индукция орнитиндекарбоксилазы (ОДК) - ключевого фермента синтеза полиаминов (ПА) - оказалась одним из самых ранних молекулярных проявлений активирования метаболизма клеток, готовящихся к делению, росту и дифференцировке.
Окисленные до иминоальдегидов ПА ингибировали рост асцитного рака Эрлиха, инактивировали вирус гриппа и вирус болезни Newcastla и Sendai, подавляя синтез белка и нуклеиновых кислот.
Существует тесная взаимосвязь между синтезом ПА и процессами роста и дифференцировки злокачественных клеток, поскольку рост и пролиферация обеспечиваются высоким уровнем синтеза ПА, а переход клеток от пролиферации к дифференциации сопровождается снижением активности ОДК и внутриклеточной концентрации ПА.
Индукторы дифференциации снижали внутриклеточное содержание путресцина (Пут) и спермидина (Сд).
Ингибиторы биосинтеза ПА подавляли рост и вызывали дифференцировку опухолевых клеток (меланогенез в клетках меланомы мышей).
Химическая регуляция обмена ПА обеспечивает защиту не только от тех заболеваний, которые являются следствием воздействия бактерий, вирусов и других патогенов, но и от рака, а также болезненных состояний, являющихся следствием иммунного дисбаланса, случайного инфицирования или аутоиммунных нарушений.
Была высказана гипотеза о том, что аналоги ПА способны замещать эндогенные ПА в клетке в участках связывания. Это приводит к нарушению функций внутриклеточных ПА. Исследования ограничились аналогами ПА алифатической структуры (Wallace HM, Fraser AV. Polyamine analogues as anticancer drugs // Biochem Soc Trans. - 2003 Apr. - V.31(2). - P.393-6). Однако предварительные результаты показали, что онкопротекторной активностью могут обладать также гетероциклические соединения, в частности пуриновые алкалоиды (Lentini A, Kleinman HK, Mattioli P, Autuori-Pezzoli V, Nicolini L, Pietrini A, Abbruzzese A, Cardinali M, Beninati S. Inhibition of melanoma pulmonary metastasis by methylxanthines due to decreased invasion and proliferation. Melanoma Res 8: 131-137, 1998).
Среди многих классов соединений, обладающих способностью к контролированию заболевания, аналогами изобретения можно считать нуклеозиды, которые хорошо известны в данной области техники. Так, например, 7-тио-8-оксогуанозин описан D.F.Smee с сотр. в Journal of Biological Response Modifiers, 9, 24-32, 1990, как агент, проявляющий антивирусную активность при испытании на мышах. Однако последующие исследования антивирусной активности на людях, сообщенные Р.G.Higgins с сотр. в Antiviral Chemistry and Chemotheropy, 2, 61-63, 1991, дали лишь малообнадеживающие результаты.
Известно изобретение по заявке №2004104349, опубл. 27.03.2005 «Химические соединения», заявитель ГЛЭКСО ГРУП ЛИМИТЕД (GB), основной индекс МПК C07D 471/00. Предлагают производные пиридинового цикла использовать для лечения состояний, медиированных рилизинг-фактором кортикотропина, для лечения депрессии и тревоги, при лечении синдрома раздражения кишечника и воспалительной болезни кишечника. Однако нет сведений об антипролиферативной активности и способности к индукции дифференциации. Известно изобретение по патенту №2328497 «Конденсированные производные пиримидина и лекарственное средство, обладающее активностью в отношении CRF», основной индекс МПК C07D 487/04. Соединения предлагают для приготовления лекарственного средства для лечения или профилактики нарушений, опосредованных рецептором CRF. Сведения о других видах биологической активности отсутствуют.
Известно изобретение по заявке №2005121908, опубл. 27.01.2006 «Производные 3Н-ХИНАЗОЛИН-4-ОНА», заявитель Ф.ХОФФМАНН-ЛЯ РОШ АГ (СН), основной индекс МПК C07D 239/00. Предлагают лекарственное средство для лечения и профилактики заболеваний, медиаторами при которых являются ингибиторы моноаминоксидазы В, болезни Альцгеймера и старческого слабоумия (деменции). Другие виды биологической активности не указаны.
Известно изобретение по заявке №2006128581, опубл. 20.02.2008 «Производные пирролопиримидина и пирролотриазина», заявитель Тайсо Файсомасьютикал ко., Лтд. (JP), основной индекс МПК C07D 487/04. Производные пирролопиримидина или пирролотриазина предлагают использовать для производства терапевтического средства в качестве антагониста КРФ рецепторов. Сведения о других видах биологической активности отсутствуют. Наиболее близким является изобретение по патенту №2315050 «Полициклические соединения, обладающие противоопухолевой активностью», основной индекс МПК C07D 471/04. Новые полициклические соединения обладают противоопухолевой активностью. Сведения об активности в качестве индукторов дифференцировки опухолевых клеток отсутствуют.
Обзор имеющихся литературных данных показывает, что имеется необходимость в соединениях, обладающих способностью регулировать скорость клеточной и опухолевой пролиферации и дифференцировки опосредованно через систему обмена полиаминов, с низкой токсичностью, что и является задачей изобретения.
Техническим результатом настоящего изобретения является получение соединения, обладающего значительной способностью к торможению опухолевой пролиферации и индукции дифференциации опухолевых клеток in vitro. Главным образом, предлагается соединение, обладающее пониженным уровнем цитотоксичности.
Согласно другому аспекту изобретения предусматривается онкопротекторное соединение, понижающее уровень ПА в клетках мышиной меланомы B16-F10 как необходимое условие торможения скорости клеточной пролиферации. Согласно еще одному аспекту изобретения предусматривается онкопротекторное соединение, повышающее активность ТГ в клетках мышиной меланомы B16-F10 как существенный показатель активации процесса клеточной дифференциации.
Согласно еще одному аспекту изобретения предусматривается онкопротекторное соединение, повышающее уровень образования меланина в клетках мышиной меланомы B16-F10 как существенный показатель активации процесса клеточной дифференциации.
Другой аспект настоящего изобретения охватывает соединение, выполняющее функции агента, контролирующего процесс клеточной дифференциации в клетках мышиной меланомы B16-F10.
Настоящее изобретение относится к соединениям общей формулы 1 производным 4-азафлуорена
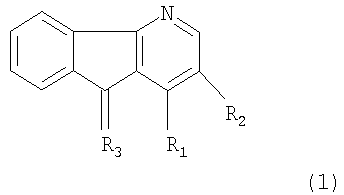
где
(1) R1 означает NH2-группу, R2 - водород; R3 - кислород,
(2) R1 означает NН2-группу, R2 - галогены F, Cl, Br, I; R3 - кислород,
(3) R1 означает NН2-группу, R2 - водород; R3 - иминоалкильную группу =N-алкил, где алкил C1-C12 (нормального и разветвленного строения),
(4) R1 означает NH2-группу, R1 - водород; R3 - иминоарильную группу =N-арил, где арил: фенил, замещенный фенил, нафтил, замещенный нафтил,
(5) R1 означает NH2-группу, R2 - водород; R3 - иминогетероарильная группа =N-гетероарил, где гетероарил: пиридин, замещенный пиридин, хинолин, замещенный хинолин,
(6) R1 означает Br, R2 - водород, а R3 - кислород,
(7) R1 представляет NH2-группу, R2 - водород, а R3 - фениламин.
В соответствии с одним из аспектов настоящего изобретения обеспечивается соединение формулы 1, в которой R1 представляет собой NH2-группу.
Согласно другому аспекту изобретения предусматривается соединение формулы 1, в которой R2 представляет собой Н.
Согласно другой альтернативе настоящего изобретения предусматривается соединение формулы 1 в том случае, когда R3 представляет собой кислород.
Более предпочтительно R3 может представлять собой Н.
В соответствии с еще одним альтернативным решением настоящего изобретения R2 может быть выбрано из группы галогенов, состоящей из С1, Br, I и F.
Предпочтительно, чтобы R2 представляли собой Сl или Br.
Более предпочтительно, когда R2 может представлять собой I или F.
Предпочтительно, чтобы R3 представляло собой иминоалкильную группу =N-алкил, где алкил C1-C12 (нормального и разветвленного строения).
В соответствии с еще одним альтернативным решением настоящего изобретения R3 может быть выбран как иминоарильная группа =N-арил, где арил: фенил, замещенный фенил, нафтил, замещенный нафтил.
Более предпочтительно, когда R3 может представлять собой иминогетероарильную группу =N-гетероарил, где гетероарил: пиридин, замещенный пиридин, хинолин, замещенный хинолин.
Наиболее предпочтительно, когда соединение изобретения отвечает общей формуле 1, в которой R1 NH2-группа, R2 - водород, а R3 представляет собой кислород, или предпочтительными являются фармацевтически приемлемые производные такого соединения.
Предпочтительные соединения настоящего изобретения выбирают из группы следующих соединений.
Производные бензимидазола и азафлуорена (группа А)
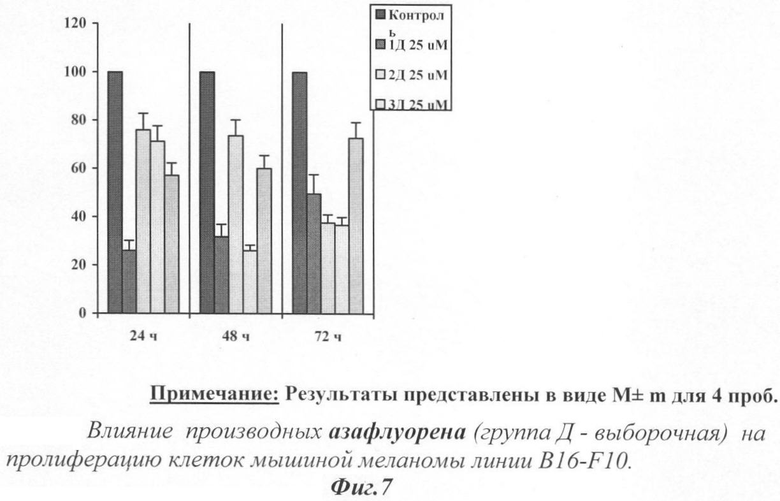
Структурные формулы производных азафлуорена (группа Д - выборочная)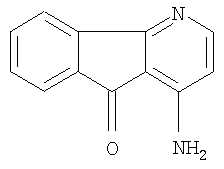
1 -амино-4-азафлуоренон-9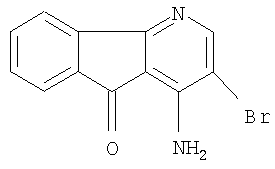
1-амино-2-бром-4-азафлуоренон-9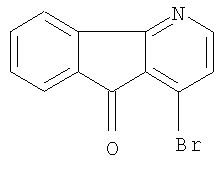
1-бром-4-азафлуоренон-9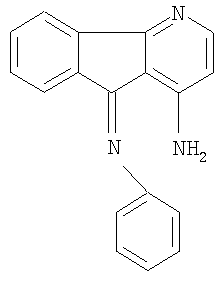
1-амино-9-фениламино-4-азафлуорен
Описание графических изображений
Бесклеточный уровень.
Тест-система из регенерирующей печени крыс.
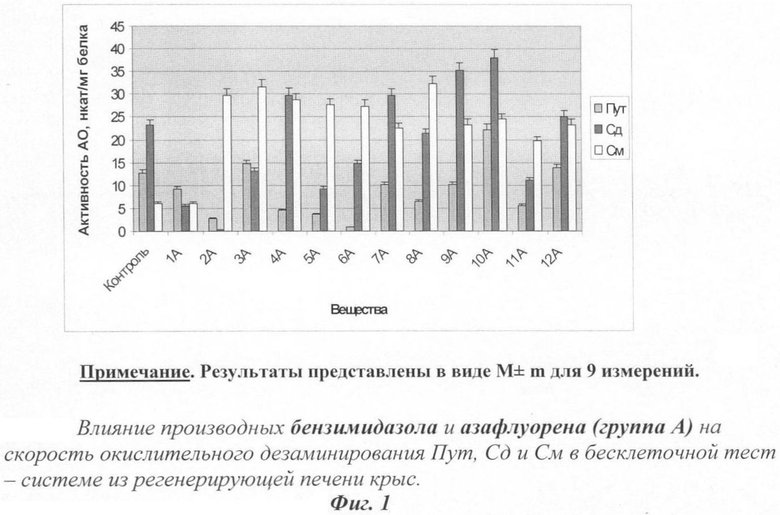
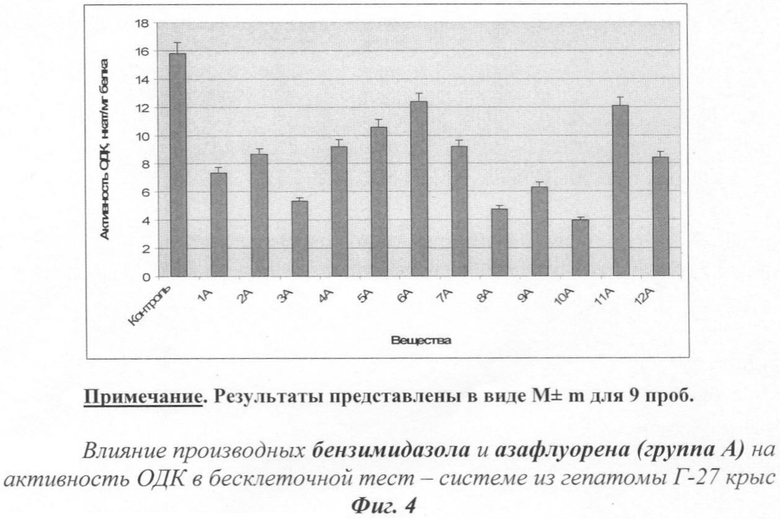
На фиг.1 показано действие производных бензимидазола и азафлуорена на активность аминоксидаз.
Количественная оценка влияния синтетических веществ из исследуемых групп на обмен ПА в бесклеточной тест-системе из регенерирующей печени крыс определялась по характеру и величине их действия на активность аминоксидаз - ПАО и ДАО. Полученные экспериментальные данные представлены на фиг.1. Полученные результаты свидетельствуют о том, что все исследованные вещества группы А, кроме 1А, существенно увеличивают распад См. Окисление Пут ускоряют соединения 3А, 10А и 12А, а Сд - 4А, 7А, 9А и 10А.
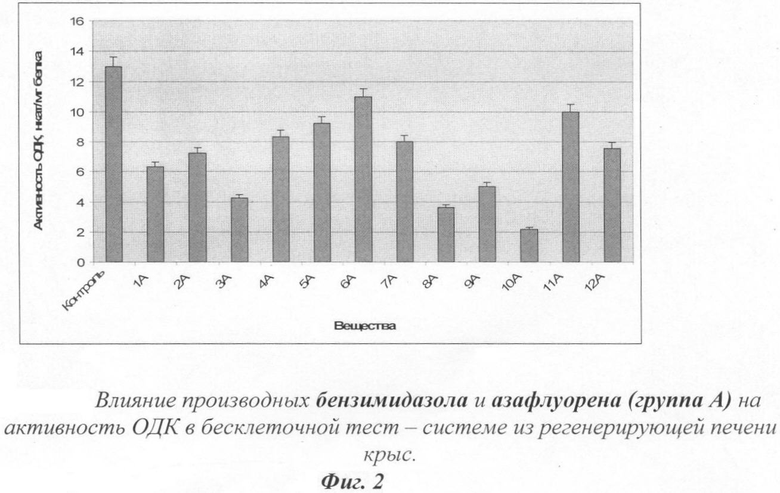
На фиг.2 показано действие производных бензимидазола и азафлуорена на активность орнитиндекарбоксилазы.
Влияние тестируемых веществ из группы А на обмен ПА в ткани регенерирующей печени оценивались по характеру и силе их действия на скорость синтеза ПА. Результаты этой серии опытов представлены в табл.3 и на фиг.2.
Влияние производных бензимидазола и азафлуорена (группа А) на активность ОДК в бесклеточной тест-системе из регенерирующей печени крыс
*Статистически достоверные отличия от контроля, Р<0,05
Следует отметить, что все исследованные вещества проявили ингибирующее действие на активность ОДК. Самыми активными оказались вещества 1А, 3А, 8А и 10А.
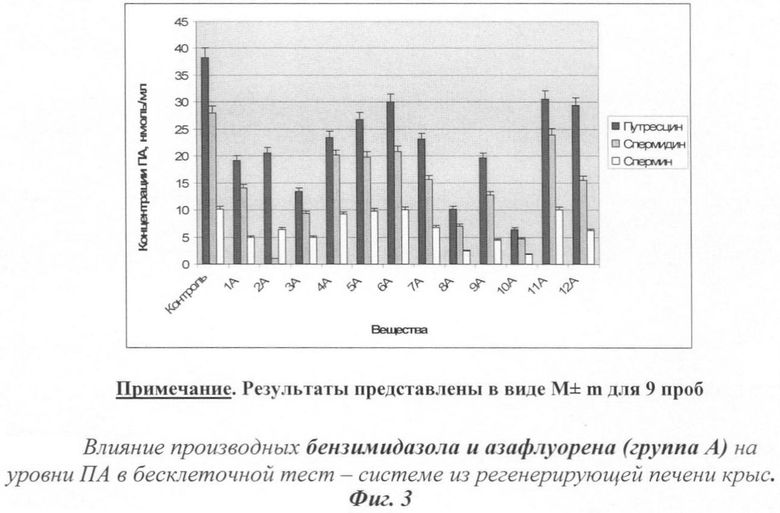
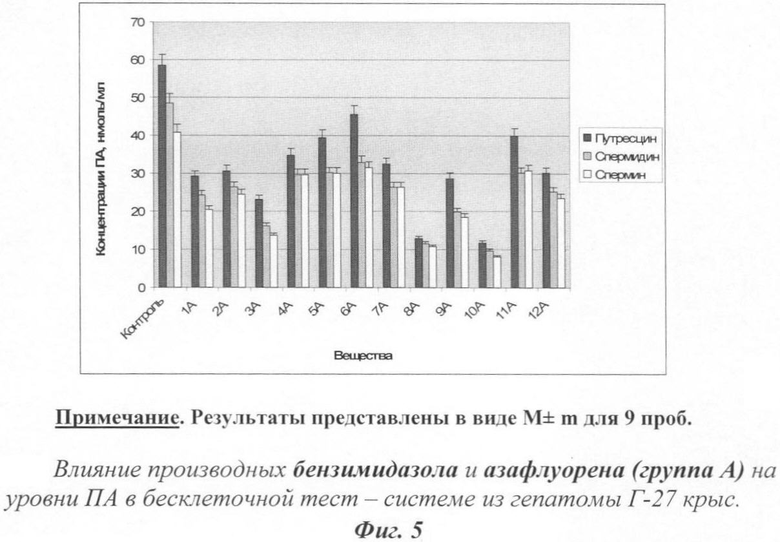
На фиг. 3 показано действие производных бензимидазола и азафлуорена на уровни полиаминов.
Уровни ПА рассматривались как интегральные показатели изменения баланса скорости распада и синтеза ПА под влиянием тестируемых веществ. Результаты представлены на фиг.3.
Все исследованные соединения вызывали снижение уровней Пут и ПА. Наиболее эффективными оказались 3А, 8А и 10А.
Тест-система из гепатомы Г-27 крыс.
На фиг.4 показано действие производных бензимидазола и азафлуорена на активность орнитиндекарбоксилазы.
Количественная оценка влияния тестируемых соединений на скорость синтеза ПА в бесклеточной тест-системе из гепатомы Г-27 крыс проводилась аналогичным образом. Результаты этой серии опытов представлены в табл.4 и на фиг.4.
Влияние производных бензимидазола и азафлуорена (группа А) на активность ОДК в бесклеточной тест-системе из гепатомы Г-27 крыс
*Статистически достоверные отличия от контроля, Р<0,05
Полученные данные указывают на то, что все исследованные вещества проявили ингибирующее действия на активность ОДК. Наиболее эффективными ингибиторами оказались вещества 3А, 8А, 9А и 10А. На фиг.5 действие производных бензимидазола и азафлуорена на уровни полиаминов.
Все протестированные вещества группы А так же, как и в серии опытов с регенерирующей печенью, вызывали понижение уровней ПА (фиг.5). Соединения 3А, 8А, 9А и 10А были наиболее активными.
Клеточный уровень.
На фиг.6 показана цитотоксичность исследуемых веществ. Результаты исследования цитотоксичности тестируемых веществ суммированы в таблицах 5-8. Вещества, значения цитотоксичности которых не превышают 30%, оказывают допустимый токсический эффект на клетки. Посчитана также токсичность действия растворителя (раствора подкисленного ДМСО) на клетки, значение которого берется за контроль.
Цитотоксичность вещества №1Д в концентрациях 5 µМ, 25 µМ и 100 µM после 24, 48 и 72 часов инкубации с клетками мышиной меланомы линии В 16-F10
Цитотоксичность вещества №2Д в концентрациях 5 µМ и 25 µМ после 24, 48 и 72 часов инкубации с клетками мышиной меланомы линии B16-F10
Цитотоксичностъ вещества №3Д в концентрациях 5 µМ и 25 µМ после 24, 48 и 72 часов инкубации с клетками мышиной меланомы линии B16-F10
Цитотоксичность вещества №4Д в концентрациях 5 µМ и 100 µМ после 24, 48 и 72 часов инкубации с клетками мышиной меланомы линии B16-F10
Вещества группы Д проявили также низкие показатели цитотоксичности во всех случаях, кроме вещества 4Д, где токсичность превышала предельно допустимые значения.
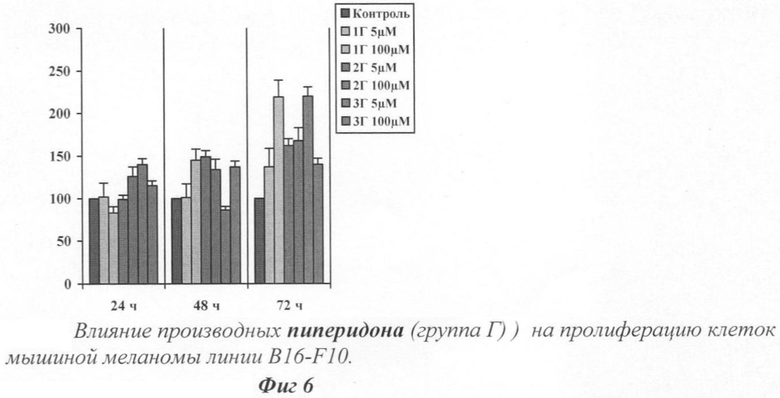
На фиг.7 показано влияние исследуемых веществ на пролиферацию клеток мышиной меланомы линии B16-F10.
Оценка влияния тестируемых веществ на пролиферацию клеток мышиной меланомы линии B16-F10 проводилась путем сравнения количества клеток после инкубации с одним из веществ с заданной концентрацией в течение 24, 48 и 72 часов с контрольными клетками (без обработки веществами). Результаты представлены на фиг.6.
Все вещества группы производных 4-азафлуорена снижали уровень роста клеток мышиной меланомы B16-F10 (фиг.6).
После 24, 48 и 72 часов инкубации вещества группы Д (фиг.7) существенно снижали скорость роста клеток мышиной меланомы B16-F10. Самой высокой антипролиферативной активностью обладало вещество 1Д в концентрации 25 мкМ, а также 3Д в той же концентрации, после 48 и 72 часов инкубации.
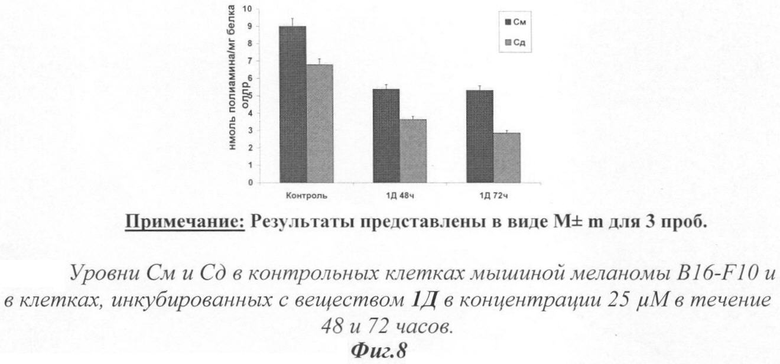
На фиг.8 показано влияние испытуемых веществ на уровень образования полиаминов в клетках мышиной меланомы B16-F10.
Проводилось исследование лизата клеток мышиной меланомы B16-F10, предварительно инкубированных в течение 48 и 72 часов с 25 мкМ раствором вещества 1Д. Были посчитаны уровни ПА в пробах. Результаты представлены на фиг.7. Уровни ПА, выраженные в нмоль/мг белка, даны в зависимости от времени инкубации. Количество См в клетках под влиянием вещества 1Д в концентрации 25 мкМ снизилось на 40,7% после 48 часов инкубации и на 41,1% после 72 часов по сравнению с его уровнем в контрольных клетках.
Вещество 1Д вызвало понижение уровней Сд на 47%, действуя 48 часов, и на 57,3% после 72 часов действия по сравнению с контролем.
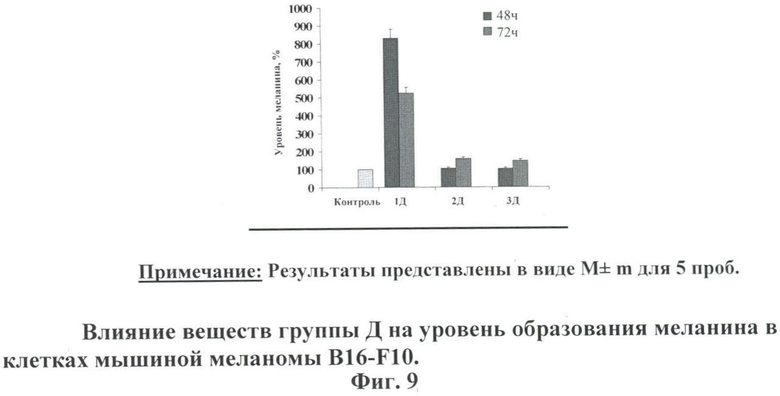
На фиг.9 показаны уровни образованного меланина в клетках мышиной меланомы B16-F10, после 48 и 72 часов инкубации с веществами группы Д в концентрации 25 мкМ.
По сравнению с контрольными клетками в клетках, обработанных веществами 2Д и 3Д, уровень меланина практически не изменялся после 48 часов инкубации и незначительно увеличивался после 72 часов инкубации. Резкое и многократное возрастание количества выработанного меланина наблюдалось у клеток, обработанных веществом 1Д.
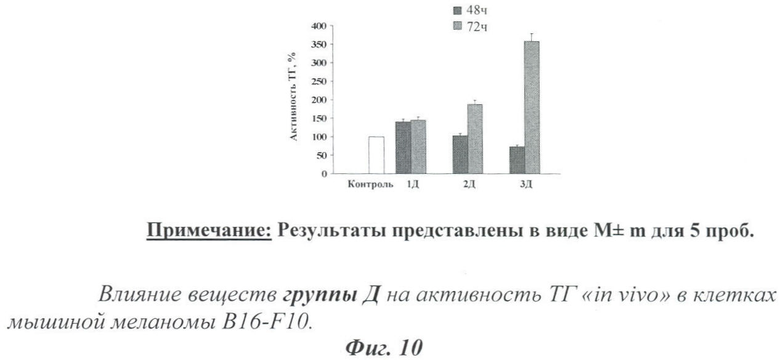
На фиг.10 показано влияние испытуемых веществ на активность ТГ в клетках мышиной меланомы B16-F10.
Из диаграммы видно, что все три вещества группы Д увеличивали активность ТГ после 72 часов инкубирования с клетками мышиной меланомы B16-F10. При этом после 48 часов активировало фермент лишь 1Д, остальные два вещества проявили свойства ингибиторов ТГ.
Полученные результаты по количественной оценке влияния тестируемых веществ на активность ТГ и уровни меланина подтверждают предположение о том, что антипролиферативный эффект может быть вызван посредством индукции клеточной дифференциации.
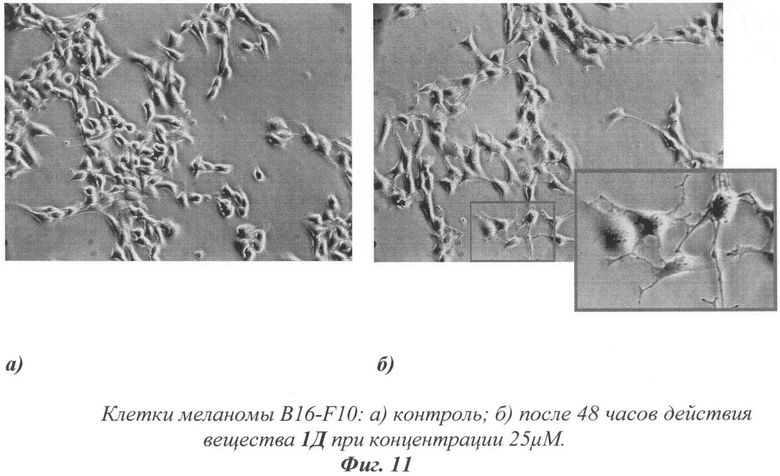
На фиг.11 показано влияние тестируемых веществ на дифференцировку клеток мышиной меланомы B16-F10
На фотографиях, сделанных оптическим микроскопом (фиг.11), можно наблюдать появление видимых морфологических изменений в клетках, обработанных раствором вещества 1Д. В клетках, инкубированных 48 часов с веществом 1Д 25 мкМ четко заметны признаки дифференцировки - появление цитозольных отростков, схожих с дендритами нейронов (эмбриональное происхождение этой ткани - нейроэктодерма). Внешне клетки выглядят намного темнее по сравнению с контролем, что объясняется повышенной выработкой в них меланина.
Техническим результатом использования изобретения является следующее.
Было обнаружено, что соединения изобретения обладают in vitro низкой цитотоксичностью.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью повышать активность ди- и полиаминоксидаз.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью понижать активность орнитиндекарбоксилазы, в частности, в опухолевых клетках.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью понижать уровень полиаминов в тканях с усиленной клеточной и опухолевой пролиферацией.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью понижать уровень полиаминов в опухолевых клетках.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью повышать активность трансглутаминазы в опухолевых клетках.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью повышать уровень образования меланина в клетках мышиной меланомы В16-F10.
Кроме этого было обнаружено, что соединения настоящего изобретения неожиданно оказались активными агентами, препятствующими опухолевой пролиферации, и активировали дифференциацию в клетках мышиной меланомы B16-F10.
Соединения настоящего изобретения могут быть получены с использованием хорошо известных синтетических методов. Так, например, можно использовать методику синтеза, по которой производные в п.1 (1)-(5) получены в результате химических модификаций 1-амино-4-азафлуорена, который синтезирован по методике, описанной в статье ХГС. - 2002. - №12. - С.1682-1689. А.В.Варламов, А.Н.Левов, Ф.Тозе, А.И.Чернышев, В.В.Давыдов, М.А.Рябов, О.Е.Егорова. «Аминирование 4-азафлуорена в условиях реакции Чичибабина. Некоторые химические превращения 1-амино-4-азафлуорена.
Выявлен дополнительный технический результат настоящего изобретения: обеспечивается способ лечения иммунодефицита или регулирования опухолевого роста, включающий стадию применения фармацевтически приемлемого количества соединения изобретения. Предпочтительно такие опухоли включают злокачественную меланому.


Изобретение относится к соединениям замещенного флуорена, а именно к
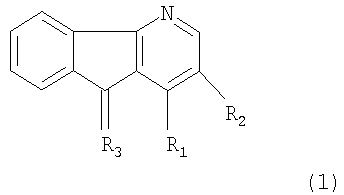
соединению формулы (1),
где R1 представляет собой NH2-группу или атом Br; R2 представляет собой водород или галоген; R3 выбран из следующей группы: кислород, иминоалкильная группа =N-алкил, где алкил C1-C12 (нормального и разветвленного строения), иминоарильная группа =N-арил, где арил: фенил, нафтил, иминогетероарильная группа =N-гетероарил, где гетероарил: пиридин, хинолин, фениламин. А также к способу замедления скорости пролиферации опухолевых клеток, включающему введение в среду приемлемого количества активного соединения формулы (1), и к способу индукции дифференциации в клетках меланомы мышей B16-F10. Технический результат: получены и описаны новые соединения, которые могут быть активными агентами, препятствующими опухолевой пролиферации, и активировать дифференциацию в клетках мышиной меланомы B16-F10. 3 н. и 8 з.п. ф-лы, 8 табл., 11 ил.
1. 4-Азафлуорены общей формулы (1) или его фармацевтически приемлемые производные

где R1 представляет собой NH2-группу или атом Вr;
R2 представляет собой водород или галоген;
R3 выбран из следующей группы: кислород, иминоалкильная группа=N-алкил, где алкил C1-C12 (нормального и разветвленного строения), иминоарильная группа=N-арил, где арил: фенил, нафтил, иминогетероарильная группа=N-гетероарил, где гетероарил: пиридин, хинолин, фениламин, за исключением следующих соединений:
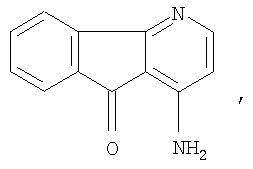
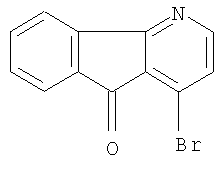
2. Производные флуорена, по п.1,
где R1 означает NН2-группу, R2 - галогены F, Cl, Br, I; R3 - кислород.
3. Производные флуорена, по п.1,
где R1 означает NH2-группу, R2 - водород; R3 - иминоалкильная группа=N-алкил, где алкил C1-C12 (нормального и разветвленного строения).
4. Производные флуорена, по п.1,
где R1 означает NH2-группу, R2 - водород; R3 - иминоарильная группа=N-арил, где арил: фенил, замещенный фенил, нафтил, замещенный нафтил.
5. Производные флуорена, по п.1,
где R1 означает NH2-группу, R2 - водород; R3 - иминогетероарильная группа=N-гетероарил, где гетероарил: пиридин, замещенный пиридин, хинолин, замещенный хинолин.
6. Производные флуорена, по п.1,
где R1 представляет NH2-группу, R2 - Br, а R3 - кислород.
7. Производные флуорена, по п.1,
где R1 представляет NH2-группу, R2 - водород, а R3 - фениламин.
8. Способ замедления скорости пролиферации опухолевых клеток, включающий введение в среду приемлемого количества активного соединения, отличающийся тем, что в качестве активного соединения вводят соединение по любому из пп.1-7.
9. Способ по п.8, отличающийся тем, что указанное соединение вводят в количестве 25 мкМ.
10. Способ индукции дифференциации в клетках меланомы мышей В16-F10, включающий введение в среду приемлемого количества активного соединения, отличающийся тем, что в качестве активного соединения вводят соединение по любому из пп.1-7.
11. Способ по п.10, отличающийся тем, что указанное соединение вводят в количестве 25 мкМ.
| ЭЛЕКТРИЧЕСКАЯ МАШИНА С ИСПАРИТЕЛЬНОЙ СИСТЕМОЙ ОХЛАЖДЕНИЯ | 0 |
|
SU340025A1 |
| STN Online RN 618885-00-0 20.11.2003 | |||
| JP 9012555 А, 14.01.1997 | |||
| Производные 3-метил-2-азафлуоренона-9,обладающие свойствами ингибиторов глутатионредуктазы | 1982 |
|
SU1074870A1 |
Авторы
Даты
2011-01-20—Публикация
2008-12-19—Подача