Изобретение относится к соединениям замещенного урацила. Главным образом, настоящее изобретение имеет отношение к гетероциклическим соединениям, содержащим 1,3-диазольные ядра, некомпенсированные с другими ядрами с 1-й двойной связью в ядре.
В процессе совершенствования методов лечения злокачественных новообразований человека на первый план в проблеме современной химиотерапии выдвигается разработка и направленный синтез новых высокоэффективных противоопухолевых агентов. В последнее время арсенал применяемых в клинике противоопухолевых средств значительно расширился, однако большинство из них остаются малоэффективными и высокотоксичными. В настоящее время стало очевидным, что методология подходов разработки новых перспективных химиотерапевтических соединений направленного действия с заранее заданными свойствами должна базироваться на фундаментальных исследованиях особенностей метаболизма опухолевой клетки.
В этом отношении обмен полиаминов (ПА), являющихся эссенциальными факторами процессов клеточного роста (Seller N. Polyamine metabolism // Digestion 46 Suppl. - 1990. - V.2. - Р.319-330) и дифференцировки (Heby О. Role of polyamines in the control of cell proliferation and differentiation // Differentiation. - 1981. - V.19 (1). - P.1-20), может служить удобной и надежной мишенью для поиска и конструирования противоопухолевых агентов, в частности, в качестве специфических регуляторов активности ключевых ферментов обмена ПА.
Индукция орнитиндекарбоксилазы (ОДК) - ключевого фермента синтеза полиаминов (ПА), оказалась одним из самых ранних молекулярных проявлений активирования метаболизма клеток, готовящихся к делению, росту и дифференцировке.
Окисленные до иминоальдегидов ПА ингибировали рост асцитного рака Эрлиха, инактивировали вирус гриппа и вирус болезни Newcastla и Sendai, подавляя синтез белка и нуклеиновых кислот.
Существует тесная взаимосвязь между синтезом ПА и процессами роста и дифференцировки злокачественных клеток, поскольку рост и пролиферация обеспечиваются высоким уровнем синтеза ПА, а переход клеток от пролиферации к дифференциации сопровождается снижением активности ОДК и внутриклеточной концентрации ПА.
Индукторы дифференциации снижали внутриклеточное содержание путресцина (Пут) и спермидина (Сд).
Ингибиторы биосинтеза ПА подавляли рост и вызывали дифференцировку опухолевых клеток (меланогенез в клетках меланомы мышей).
Химическая регуляция обмена ПА обеспечивает защиту не только от тех заболеваний, которые являются следствием воздействия бактерий, вирусов и других патогенов, но и от рака, а также болезненных состояний, являющихся следствием иммунного дисбаланса, случайного инфицирования или аутоиммунных нарушений.
Предварительные результаты (Сяткин С.П., Березов Т.Т. Обмен полиаминов в злокачественных опухолях. // Вестник АМН СССР. - 1982. - №3. - С.10-21) и данные литературы показывают, что изменения в митотической активности тканей определенным образом коррелируют с уровнем ПА. Так, при усиленном делении клеток (регенерация, опухоль) наблюдается повышение уровня ПА. Поэтому обмен ПА удобен для изучения пролиферативной активности тканей и биологических свойств веществ, влияющих на нее.
Ранее было показано наличие двух различных механизмов увеличения уровней полиаминов в тканях с «нормально» и «патологически» усиленной клеточной пролиферацией (Сяткин С.П. Диссертация на соискание ученой степени доктора биологических наук «Полиамины и лизосомы как система опосредованной регуляции химическими веществами процессов клеточной пролиферации и опухолевого роста» // Москва. - 1998. - С.208). Так, в ткани гепатомы это происходит за счет резкого снижения или полной утраты ди- и полиаминоксидазной активности в большей степени, чем в результате повышения активности орнитиндекарбоксилазы. В регенерирующей печени увеличение уровня полиаминов зависит от резкого возрастания скорости синтеза этих веществ, поскольку скорость их распада путем окислительного дезаминирования при этом остается постоянной. Следовательно, вещества, активирующие орнитиндекарбоксилазу и ингибирующие окислительное дезаминирование полиаминов, проявляют канцерогенные свойства. И наоборот, химические соединения, блокирующие синтез путресцина и ПА и активирующие процесс их окислительного распада, могут стать потенциальными противоопухолевыми средствами.
Полученные ранее результаты позволяют предполагать наличие канцерогенных свойств у веществ, которые активируют синтез и подавляют распад полиаминов. Наоборот, канцеростатические свойства, если вещество подавляет синтез и активирует распад полиаминов. Пролиферативные свойства, если вещество активирует синтез полиаминов.
Известны противоопухолевые свойства природных веществ (антибиотики растительного происхождения), включающих комбинации полиаминовых фрагментов как в циклических, так и в алифатических частях молекул (Семенов А.А. Природные противоопухолевые соединения (структура и механизм действия).- Новосибирск, Наука, 1979. - с.222).
Была высказана гипотеза о том, что аналоги ПА способны замещать эндогенные ПА в клетке в участках связывания. Это приводит к нарушению функций внутриклеточных ПА. Исследования ограничились аналогами ПА алифатической структуры (Wallace HM, Fraser AV. Polyamine analogues as anticancer drugs // Biochem Soc Trans. - 2003 Apr. - V.31(2). - P.393-6). Однако предварительные результаты показали, что онкопротекторной активностью могут обладать также гетероциклические соединения, в частности пуриновые алкалоиды (Lentini A, Kleinman HK, Mattioli P, Autuori-Pezzoli V, Nicolini L, Pietrini A, Abbruzzese A, Cardinali M, Beninati S. Inhibition of melanoma pulmonary metastasis by methylxanthines due to decreased invasion and proliferation. Melanoma Res 8: 131-137, 1998).
Среди многих классов соединений, обладающих способностью к контролированию заболевания, аналогами изобретения можно считать нуклеозиды, которые хорошо известны в данной области техники. Так, например, 7-тио-8-оксогуанозин описан D.F.Smee с сотр. в Journal of Biological Response Modifiers, 9, 24-32, 1990, как агент, проявляющий антивирусную активность при испытании на мышах. Однако последующие исследования антивирусной активности на людях, сообщенные Р. G. Higgins с сотр. в Antiviral Chemistry and Chemotheropy, 2, 61-63, 1991, дали лишь малообнадеживающие результаты.
Известно изобретение по заявке №2004104349 «Химические соединения», по которому предлагают производные пиридинового цикла использовать для лечения состояний, медиированных рилизинг-фактором кортикотропина, для лечения депрессии и тревоги, при лечении синдрома раздражения кишечника и воспалительной болезни кишечника. Однако нет сведений об антипролиферативной активности и способности к индукции дифференциации. Известно изобретение по патенту №2328497 «Конденсированные производные пиримидина и лекарственное средство, обладающее активностью в отношении CRF». Соединения предлагают для приготовления лекарственного средства для лечения или профилактики нарушений, опосредованных рецептором CRF. Сведения о других видах биологической активности отсутствуют.
Известно изобретение по заявке №2005121908, опубл. 27.01.2006 «Производные 3Н-ХИНАЗОЛИН-4-ОНА», заявитель Ф.ХОФФМАНН-ЛЯ РОШ AГ (CH), по которому предлагают лекарственное средство для лечения и профилактики заболеваний, медиаторов при которых являются ингибиторы моноаминоксидазы В, болезни Альцгеймера и старческого слабоумия (деменции). Другие виды биологической активности не указаны.
Известно изобретение по заявке №2006128581 «Производные пирролопиримидина и пирролотриазина». Производные пирролопиримидина или пирролотриазина предлагают использовать для производства терапевтического средства в качестве антагониста КРФ рецепторов. Сведения о других видах биологической активности отсутствуют.
Наиболее близким является изобретение по патенту №2315050 «Полициклические соединения, обладающие противоопухолевой активностью». Новые полициклические соединения обладают противоопухолевой активностью. Сведения об активности в качестве индукторов дифференцировки опухолевых клеток отсутствуют.
Задачей авторов изобретения является синтез соединений, обладающих способностью регулировать скорость клеточной и опухолевой пролиферации опосредованно через систему обмена полиаминов, с низкой токсичностью.
Сущность изобретения: в соответствии с настоящим изобретением обеспечивается соединение, обладающее значительной способностью к торможению клеточной и опухолевой пролиферации in vitro. Главным образом, предлагается соединение, обладающее пониженным уровнем цитотоксичности.
Согласно другому аспекту изобретения предусматривается онкопротекторное соединение, понижающее уровень ПА в клетках карциномы яичника человека (линии CaOv), как необходимое условие торможения скорости клеточной пролиферации.
Согласно еще одному аспекту изобретения предусматривается онкопротекторное соединение, повышающее активность ди- и полиаминоксидаз в бесклеточной тест-системе из регенерирующей печени крыс как существенный показатель торможения процесса опухолевой пролиферации.
Согласно еще одному аспекту изобретения предусматривается онкопротекторное соединение, понижающее уровень образования путресцина и ПА в бесклеточных тест-системах из тканей с повышенным митотическим индексом (гепатома и регенерирующая печень) как существенный показатель активации процесса торможения клеточной и опухолевой пролиферации. Другой аспект настоящего изобретения охватывает соединение, ингибирующее активность орнитиндекарбоксилазы, как необходимое условие торможения скорости клеточной и опухолевой пролиферации. Настоящее изобретение относится к соединениям общей формулы 1
Производные бис(5-метиламинометилурацил)полиметилена
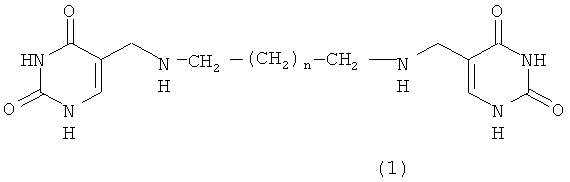
где n=1-4
n=1
5-[3-(2,4-dioxo-l,2,3,4-tetrahydro-5-pyrimidinylmethylamino)propylaminomethyl]-1,2,3,4-tetrahydro-2,4-pyrimidinedione
n=2
5-[4-(2,4-dioxo-1,2,3,4-tetrahydro-5-pyrimidinylmethylamino)butylaminomethyl]-1,2,3,4-tetrahydro-2,4-pyrimidinedione
n=3
5-[5-(2,4-dioxo-1,2,3,4-tetrahydro-5-pyrimidinylmethylamino)pentylaminomethyl]-1,2,3,4-tetrahydro-2,4-pyrimidinedione
n=4
5-[6-(2,4-dioxo-1,2,3,4-tetrahydro-5-pyrimidinylmethylamino)hexylaminomethyl]-1,2,3,4-tetrahydro-2,4-pyrimidinedione
В соответствии с одним из аспектов настоящего изобретения обеспечивается соединение формулы 1, в которой n=1-4.
Согласно другому аспекту изобретения предусматривается соединение формулы 1, в которой n=1.
Согласно другой альтернативе настоящего изобретения n=2.
Более предпочтительно n=2.
В соответствии с еще одним альтернативным решением настоящего изобретения n=3.
Более предпочтительно, когда n=4.
Предпочтительные соединения настоящего изобретения выбирают из группы следующих соединений:
1,3-бис(урацилил-5-метилен)триметилендиамин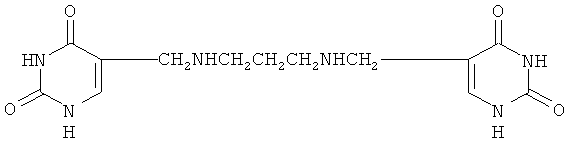
1,4-бис(урацилил-5-метилен)тетраметилендиамин
1,6 бис(урацилил-5-метилен)гексаметилендиамин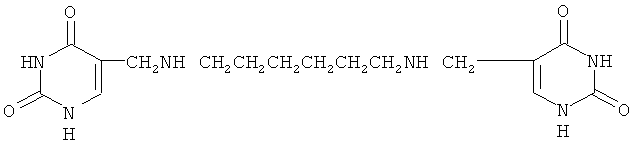
Способ замедления скорости пролиферации опухолевых клеток, включающий введение в среду приемлемого количества активного соединения, причем в качестве активного соединения вводят любое из указанных соединений.
Бесклеточный уровень.
Тест-система из регенерирующей печени крыс.
1. Действие производных диаминов, модифицированных азотистыми основаниями на активность аминоксидаз.
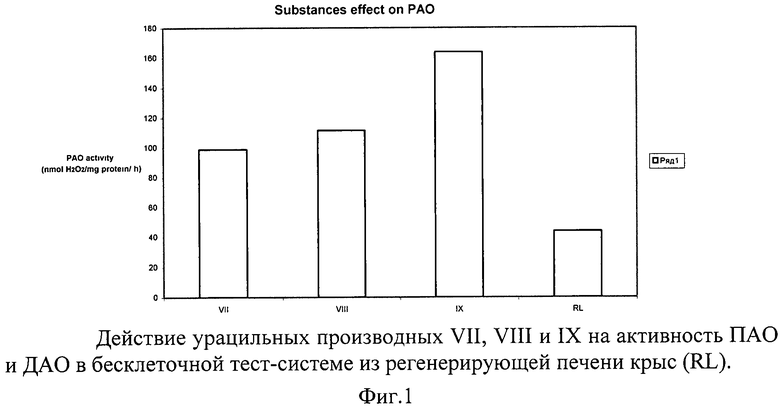
Количественная оценка влияния синтетических веществ из исследуемой группы на обмен ПА в бесклеточной тест-системе из регенерирующей печени крыс (RL) определялась по характеру и величине их действия на активность аминоксидаз - ПАО и ДАО. Полученные экспериментальные данные представлены на фиг.1 и в табл.2.
*- достоверные отличия от контроля, Р≤0.05. а) - знак "+" обозначает увеличение скорости распада путресцина и ПА.
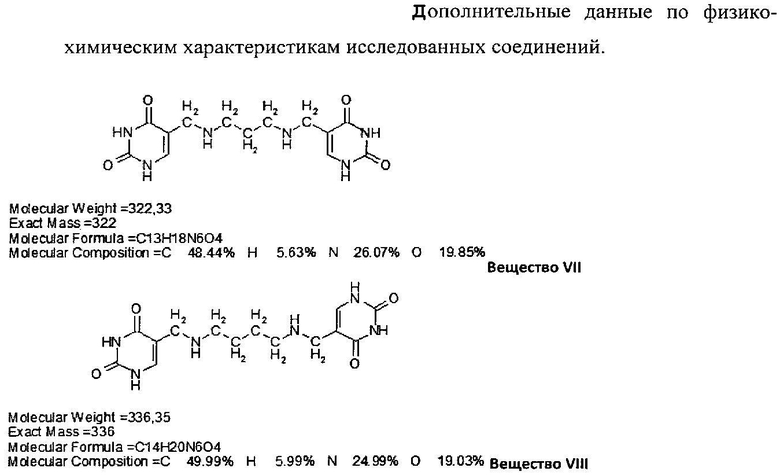
Данные, представленные на фиг.1 и в табл.2 свидетельствуют, что все урацильные производные: вещества VII, VIII и IX - существенно увеличивают распад ПА под действием полиаминоксидазы (ПАО) и окисление путресцина диаминоксидазой (ДАО).
2. Действие производных диаминов, модифицированных азотистыми основаниями на активность орнитиндекарбоксилазы.
*- достоверные отличия от контроля, Р≤0.05. а) - знак "+" обозначает увеличение скорости биосинтеза путресцина и ПА.
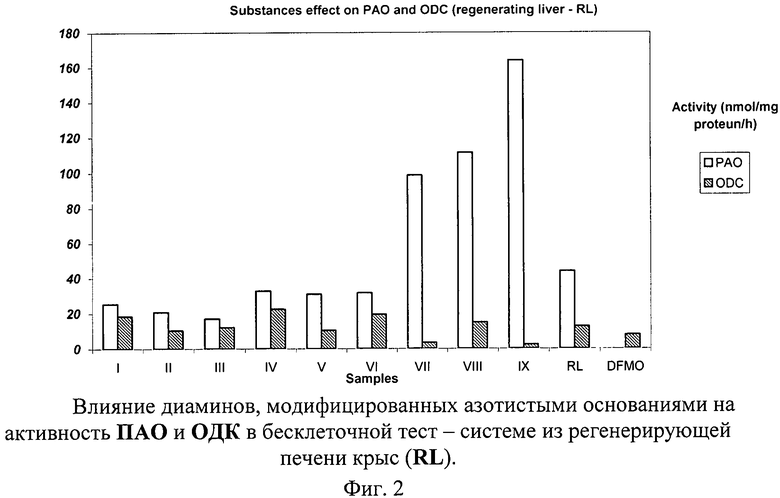
Влияние тестируемых веществ на обмен ПА в ткани регенерирующей печени оценивались по характеру и силе их действия на скорость синтеза ПА. Результаты этой серии опытов представлены в табл.3 и на фиг.2.
Следует отметить, что исследованные вещества VII и IX проявили ингибирующее действие на активность ОДК. Эти же вещества существенно активировали окислительный распад ПА. Оба эти действия направлены на снижение уровней ПА.
3. Действие производных диаминов, модифицированных азотистыми основаниями на уровни полиаминов.
Уровни ПА рассматривались как интегральные показатели изменения баланса скорости распада и синтеза ПА под влиянием тестируемых веществ. Результаты представлены в табл.4.
Урацильные производные диаминов: VII, VIII и IX - понижали уровни ПА более эффективно, чем ДФМО - общепризнанный ингибитор ОДК (ключевой фермент синтеза ПА).
Тест-система из гепатомы Г-27 крыс.
4. Действие производных диаминов, модифицированных азотистыми основаниями на активность орнитиндекарбоксилазы.
Количественная оценка влияния тестируемых соединений на скорость синтеза ПА в бесклеточной тест-системе из гепатомы Г-27 крыс проводилась аналогичным образом. Результаты этой серии опытов представлены в табл.5.
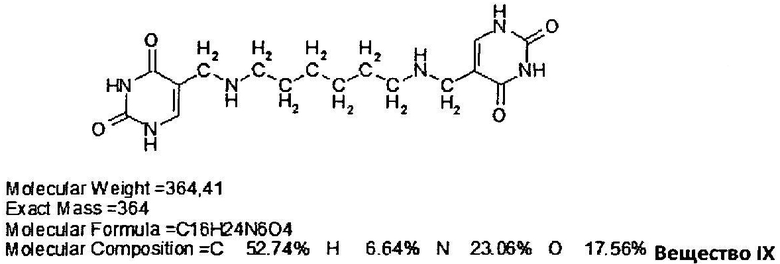
Полученные данные указывают на то, что все исследованные урацильные производные диаминов: VII, VIII и IX - проявили ингибирующее действие на активность ОДК в существенно большей степени, чем специфический ингибитор - ДФМО. Эти же соединения наиболее эффективно ингибиторами синтез ПА, проявляя онкопротекторные свойства.
5. Действие производных диаминов, модифицированных азотистыми основаниями на уровни полиаминов.
Все протестированные урацильные производные диаминов: VII, VIII и IX -так же, как и в серии опытов с регенерирующей печенью, вызывали понижение уровней ПА (табл.6). Однако в тест-системе из опухолевой ткани они существенно превосходили в эффективности своего действия известный ингибитор - ДФМО.
Клеточный уровень.
6. Цитотоксичность исследуемых веществ. Результаты исследования цитотоксичности тестируемых веществ суммированы в таблице 7. Вещества, значения цитотоксичности которых не превышают 30%, оказывают допустимый токсический эффект на клетки.
Проверка цитотоксической активности на основании данных по синтезу ДНК, в частности по включению меченного тимидина в ДНК опухолевых клеток (табл.7), показала отсутствие цитотоксической активности у бис(урацилил)-алкилдиаминов (VII, VIII и IX). Это выгодно выделяло данный класс аналогов в свете современного поиска малотоксичных противоопухолевых агентов. 7. Влияние испытуемых веществ на уровень образования полиаминов в опухолевых клетках карциномы яичника.
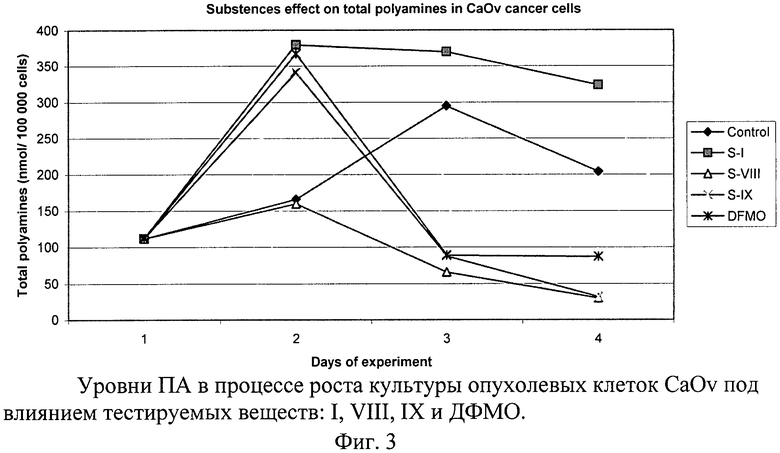
Проводилось исследование лизата клеток CaOv, предварительно инкубированных в течение 2, 3 и 4 суток с раствором тестируемых веществ. Были посчитаны уровни ПА в пробах. Результаты представлены на фиг.3. Уровни ПА даны в зависимости от времени инкубации.
На 4-е сутки роста опухолевых клеток в культуре ткани бис(урацилил)-алкилдиамины (VIII и IX) вызывали понижение уровней ПА в большей степени, чем ДФМО.
8. Влияние исследуемых веществ на пролиферацию опухолевых клеток CaOv.
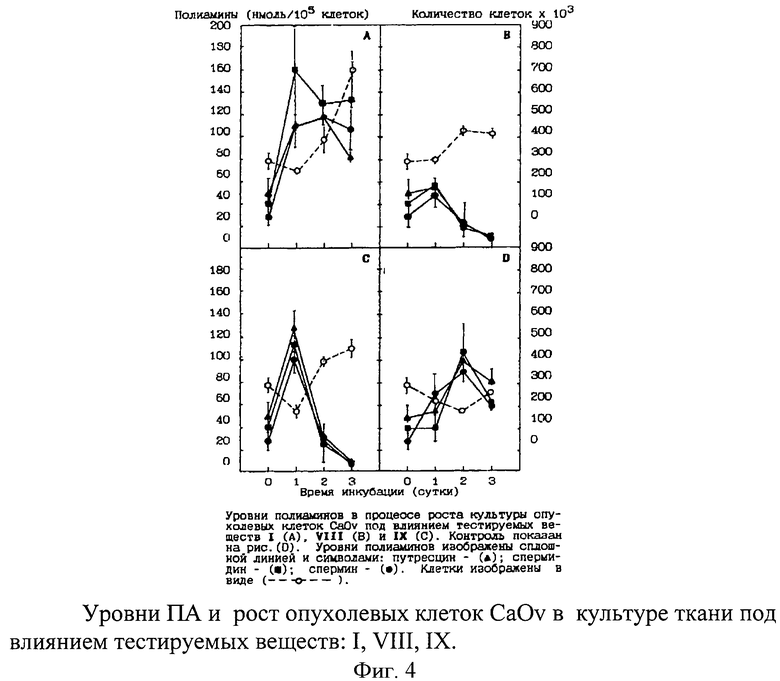
Оценка влияния тестируемых веществ на пролиферацию опухолевых клеток карциномы яичника (CaOv) проводилась путем сравнения количества клеток после инкубации с одним из веществ с заданной концентрацией в течение 24, 48 и 72 часов с контрольными клетками (без обработки веществами). Результаты представлены на фиг.4.
Существенное ингибирующее действие на синтез ПА наблюдалось лишь на третьи сутки инкубации раковых клеток яичника с веществами VIII и IX, в то время как вещество I в этих же условиях не вызывало заметного снижения уровней ПА в клетках (фиг.4). Наблюдаемое снижение уровней ПА и торможение клеточной пролиферации культуры CaOv под влиянием бис-(урацилил)-аналогов можно, очевидно, объяснить как ингибирующим действием этих веществ на синтез ПА в опухолевой клетке, так и возможным участием этих аналогов в «летальном синтезе» ДНК. Таким образом, технический эффект изобретения заключается в том, что было обнаружено, что соединения изобретения обладают in vitro низкой цитотоксичностью.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью повышать активность ди- и полиаминоксидаз.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью понижать активность орнитиндекарбоксилазы, в частности, в опухолевых клетках.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью понижать уровень полиаминов в тканях с усиленной клеточной и опухолевой пролиферацией.
Неожиданно было обнаружено, что соединения изобретения обладают in vitro способностью понижать уровень полиаминов в опухолевых клетках. Кроме этого было обнаружено, что соединения настоящего изобретения неожиданно оказались активными агентами, препятствующими пролиферации опухолевых клеток карциномы яичника человека. В соответствии с дополнительным техническим решением настоящего изобретения обеспечивается способ лечения иммунодефицита или регулирования опухолевого роста, включающий стадию применения фармацевтически приемлемого количества соединения изобретения. Предпочтительно, такие опухоли включают карциному яичника человека.
2. «Методики испытаний для каждого из тестов, для которых приведены показатели активности соединений».
1. Количественный анализ основных показателей обмена полиаминов в бесклеточных тест-системах
Опухолевые ткани печени
Исследования особенностей регуляции обмена ПА в опытах in vivo выполняли на самцах беспородных белых крыс массой 120-180 г и самцах мышей линии СЗНА, масса которых не превышала 18-20 г.
Из экспериментальных опухолей были использованы перевиваемые гепатомы 22а, 61, 60, 48 и 46, первично индуцированные у мышей линии СЗНА ортоаминоазотолуолом и гепатома Г-27, первично индуцированная у нелинейных белых крыс нитрозодиэтиламином (НДЭА).
Гепатоканцерогенез индуцировали НДЭА. Были исследованы также малигнизирующая, регенерирующая, нормальная печень, печень животных с опухолями и печень крыс при хроническом введении нитрозопиперидина (НП). Канцероген вводили внутрибрюшинно 1 раз в неделю в течение 2 месяцев из расчета 100 мг на 1 кг массы животного. Суммарная доза, полученная каждым животным, составила 154 мг НДЭА. НП вводили внутрибрюшинно 3 раза в неделю в течение 3 месяцев: 1-й месяц - из расчета 3 мг/кг, 2-й -5 мг/кг, 3-й - 15 мг/кг. После 29 инъекций суммарная доза составила 41,1 мг НП на каждое животное.
В экспериментах использовали белых беспородных крыс-самцов массой 100-130 г, содержащихся на стандартном рационе вивария РУДН со свободным доступом к воде.
Для анализов были выбраны две модельные бесклеточные тест-системы из тканей с сохраненной и утраченной системой контроля за скоростью клеточной пролиферации. Использованные тест-системы позволяют исследовать влияние аналогов полиаминов как на регенерирующую, так и на опухолевую ткань. В качестве тканей с повышенным митотическим индексом использовали регенерирующую печень здоровых крыс и солидную гепатому крыс Г-27.
Регенерирующая печень здоровых крыс
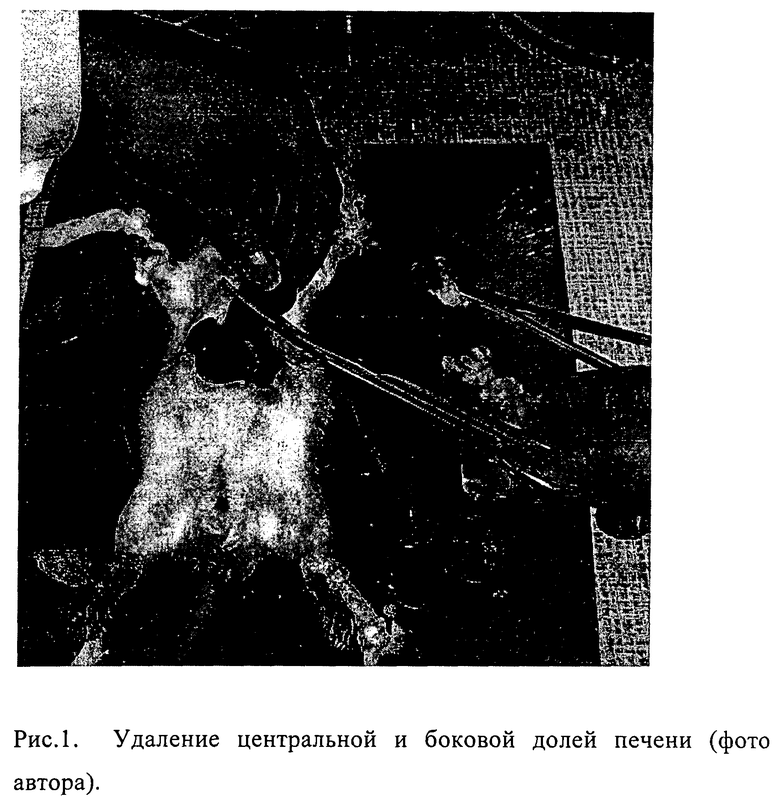
Для получения бесклеточной тест-системы выполняли стандартную парциальную гепатэктомию по методике Higgins, Anderson(1931).
1. Под эфирным наркозом крысам проводили лапаротомию, у основания левой боковой и центральной долей печени накладывали лигатуру, доли удаляли (Рис.1). Такая операция приводила к хорошо выраженной регенерации оставшейся части печени в течение последующих 18-20 часов. В эти сроки животных умерщвляли декапитацией и извлекали малые участки регенерирующей печени для исследования.
2. Эти участки обескровливали на льду физиологическим раствором с температурой 2-4°С для исключения погрешностей определения активности ферментов и уровня полиаминов за счет примеси гемоблобина, затем взвешивали.
3. Обескровленные участки печени взвешивали и гомогенизировали на холоду с буфером.
4. Гомогенат ткани ультрацентрифугировали при 20000 g в течение 15 минут при 2-4°С.
5. Супернатант полученного 33% гомогената использовали для определения активности ОДК и уровня полиаминов или по определению активности полиаминоксидаз.
Пролиферирующая ткань гепатомы крыс Г27
Получали штамм гепатомы Г-27 из Банка опухолевых штаммов ГУ Российский онкологический Научный Центр им. Н.Н. Блохина РАМН. Ампулы с биологическим материалом транспортировали к месту перевивки в жидком азоте. Штамм гепатомы пассировался на крысах, как было описано ранее И.Н.Швембергер (1970). Перевивали гепатому крысам подкожно по 50 мг взвеси опухолевой ткани в 0,5 мл питательной среды. Пассировали опухоль 2-3 раза на белых беспородных крысах-самцах в течение 2-3 недель. Затем крыс забивали декапитацией и выделяли опухоль. В опытах использовали 2-3 пассажа in vivo. Образцы опухолевой ткани для исследования готовили следующим образом. Ткань опухоли, освобожденную от некротических масс, суспендироли со стерильным физиологическим раствором на холоду в стерильных условиях. Перевивали полученную суспензию крысам подкожно по 50 мг взвеси на крысу.
В полученных образцах определяли активности ОДК и уровень полиаминов. Остаток опухолевого материала использовали для последующих перевивок. Ткань гомогенизировали с охлажденным 50 мМ фосфатным буфером рН 6,6, содержащим дитиотриэтол 0,1 мМ и пиридоксальфосфат 0,4 мМ. Измельчение ткани проводили в металлическом охлажденном прессе. Полученную массу взвешивали. Затем проводили гомогенизацию в лабораторном стеклянном гомогенизаторе с предварительно охлажденным тефлоновым пестиком. Смесь центрифугировали в ультрацентрифуге с ускорением 20000 об/мин при t=4°C в течение 15 минут. Полученные таким образом бесклеточные тест-системы по составу химических компонентов были максимально приближены к внутриклеточной среде и содержали необходимые компоненты для определения активности ОДК, ДАО, ПАО и уровня полиаминов и, кроме того, содержали минимум компонентов, способных помешать определению.
1.1. Определение активности ДАО и ПАО
Диаминоксидаза - диамин: кислород - оксидоредуктаза (дезаминирующая, пиридоксальфосфатсодержащая, КФ 1.4.3.6.) - окисляет субстраты с поглощением кислорода и образованием аммиака, перекиси водорода и соответствующего альдегида
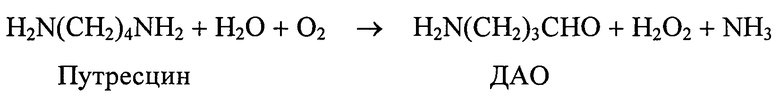
При окислительном дезаминировании ПА также образуются лабильные иминоальдегиды, аммиак и перекись водорода
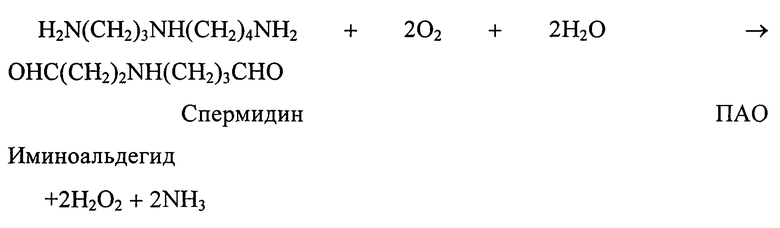
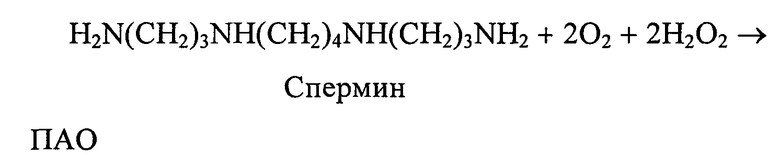
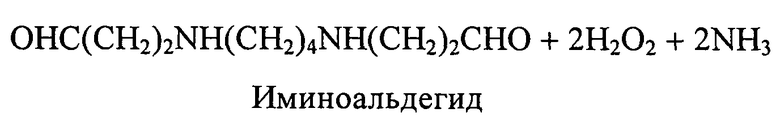
Известные методы, основанные на прямом определении поглощения кислорода и освобождения аммиака, микротитровании перекиси водорода, определении убыли субстрата в процессе реакции требуют большого количества биоматериала, длительного периода инкубации и показывают относительно низкую чувствительность.
Для определения скорости окислительного дезаминирования ди- и полиаминов из большого числа различных методов в качестве прототипа выбрали спектрофотометрический метод измерения активности гистидазы в плазме крови кролика в модификации Gordon и Peters (1967). В основе метода лежит измерение окрашенного продукта, который образуется при окислении о-дианизидина перекисью водорода, образующейся в аминоксидазной реакции. Катализатором о-дианизидиновой реакции служила пероксидаза. Провели замену о-дианизидиного основания на его гидрохлоридное производное. Это позволило использовать данный краситель не в спиртовом, а в водном растворе.
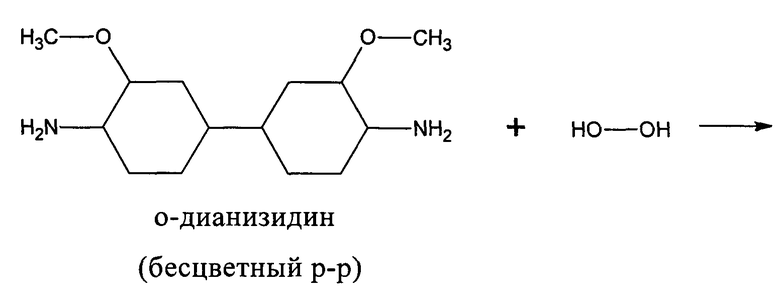
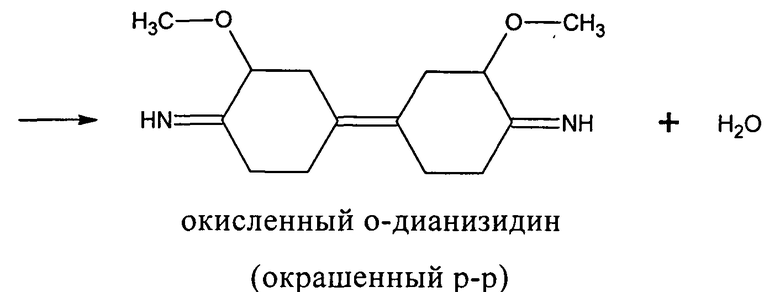
Существенное преимущество данного метода перед известными заключалось в удалении из реакционной среды перекиси водорода и аммиака - сильных, неконкурентных ингибиторов окислительного дезаминирования.
Нижняя граница чувствительности метода составила ±0.1 нмоль и воспроизводимости ±0.1 нмоль.
В качестве источника фермента использовали супернатант гомогената, полученный центрифугированием при 15000 об/мин в течение 20 мин (L7-55 Ultracentrifuge "Beckman"). Активность ДАО (амин: кислородоксидоредуктаза, дезаминирующая, пиридоксальсодержащая, КФ 1.4.3.6) и ПАО определяли спектрофотометрическим микрометодом (Таблица 1). В качестве субстрата использовали путресцин-2НС1, спермидин-3НСl и спермин-4НСl, полученные нами из свободных ПА фирмы "Fluka" (Швейцария).
За единицу активности принимали преобразование 1 нмоля субстрата, окисленного за 1 ч при 37°С. Удельную активность фермента выражали в единицах активности на 1 мг белка.
1.2. Определение активности ОДК и уровней полиаминов
Совместное определение активности ключевого фермента синтеза полиаминов - ОДК и уровней полиаминов проводилось методом ВЭЖХ. Предварительный этап анализа по данным показателям заключался в следующем. Реакционная среда в 0,5 мл конечного объема содержала орнитин («Реахим», Россия) в концентрации 80 мМ, пиридоксальфосфат («Реанал», Венгрия) - 4 мМ, дитиотриэтол ("Serva", ФРГ) 20 мМ в 50 мМ фосфатном буфере рН 6,6. В реакционную среду добавляли тестируемые вещества до конечной концентрации 0,1 мМ и 0,3 мл супернатанта 33% гомогената гепатомы Г-27 или регенерирующей печени. Инкубация с веществами длилась 1 час при температуре 37°С. Затем реакция останавливалась добавлением 0,1 мл 0,2 М раствора хлорной кислоты. Осадок отделяли центрифугированием при 6000 об/мин в течение 5 минут. Для дальнейшего исследования использовали надосадочную жидкость. Полученные таким образом пробы хранились при температуре около 0°С. Дальнейшие операции были связаны с подготовкой проб к определению концентрации полиаминов и активности ОДК методом ВЭЖХ. Для этого сначала проводилось бензоилирование проб. Бензоилирующим агентом был бензоилхлорид. Реакцию можно представить в виде следующей схемы:
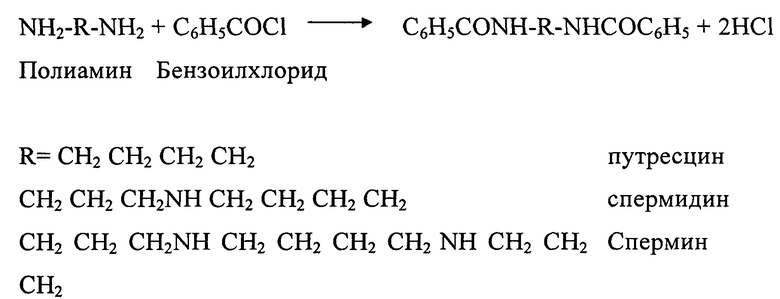
В полученные ранее пробы добавлялся 2N раствор NaOH, смесь интенсивно перемешивали в течение 1 минуты. Затем добавляли бензоилхлорид и вновь активно перемешивали в течение 2 минут. Полученную смесь выдерживали в условиях комнатной температуры в течение 1-2 часов. Реакцию прекращали добавлением NaCl. Образовавшиеся бензоильные производные полиаминов экстрагировали шестью порциями этилового эфира по 30 мл. Эфирные экстракты объединяли, эфир выпаривали досуха. Бензоильные производные полиаминов помещали в полиэтиленовые эппендорфы.
Далее проводили определение концентрации бензоилированных производных полиаминов методом ВЭЖХ на приборе «Милихром 5-3». Исходный метод определения количественного содержания полиаминов в биологических тканях с применением в качестве элюента для градиентного элюирования смеси метанол - вода был модифицирован Сяткиным С.П. и Голомазовой К.А. В отличие от исходного метода ВЭЖХ, где в качестве элюента использовался токсичный метанол, в данной модификации использовалась система ацетонитрил-вода. Это позволило снизить токсичность метода. Определение проводилось в режиме градиентного элюирования, при этом содержание ацетонитрила менялось от 10% до 100%, всего было 4 ступеней (0-10% ацетонитрила, 10-50% ацетонитрила, 50-80% ацетонитрила и 80-100% ацетонитрила). При определении использовалась колонка с обращенной фазой С18. Длина волны составляла 254 нм. Скорость потока 80 мкл/мин. Общее время анализа 1 пробы составляло около 17 минут. В таблица 9 представлен режим градиентного элюирования смесью ацетонитрила и воды. Все режимы элюирования и объемные отношения смеси были подобраны нами заново.
Объем регенерации колонки составлял 300 мкл, что учитывалось при составлении программы элюирования (закладывалось в программу при задании объема последней по порядку набора ступени элюирования), объем буфера 1 и буфера 2 - 0,5 мкл, объем вводимой пробы - 0,2 мкл.
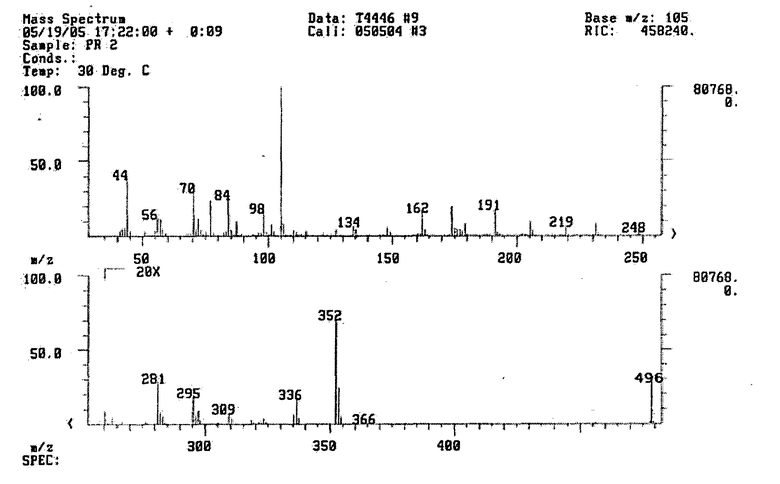
Рис.2. Хромато-масс-спектр бензоильных производных полиаминов (стандарт).
Расчет концентраций бензоильных производных полиаминов производился исходя из концентрации стандартных растворов бензоильных производных полиаминов. Стандартные бензоильные производные полиаминов получали самостоятельно, проводя реакцию бензоилирования стандартных субстанций полиаминов по указанной выше методике. Контроль качества полученных веществ (по показателям состав и количественный выход) проводился с помощью метода хромато-масс-спектрометрии. На Рис.2 приведен Хромато-масс-спектр стандартных производных полиаминов (время бензоилирования 2 часа).
Далее проводилась ВЭЖХ стандартных производных полиаминов, при этом отмечались их времена удерживания и концентрации исходя из площадей их пиков. На Рис.3 приведена хроматограмма, полученная методом ВЭЖХ на приборе «Милихром 5-3», стандартных производных полиаминов.
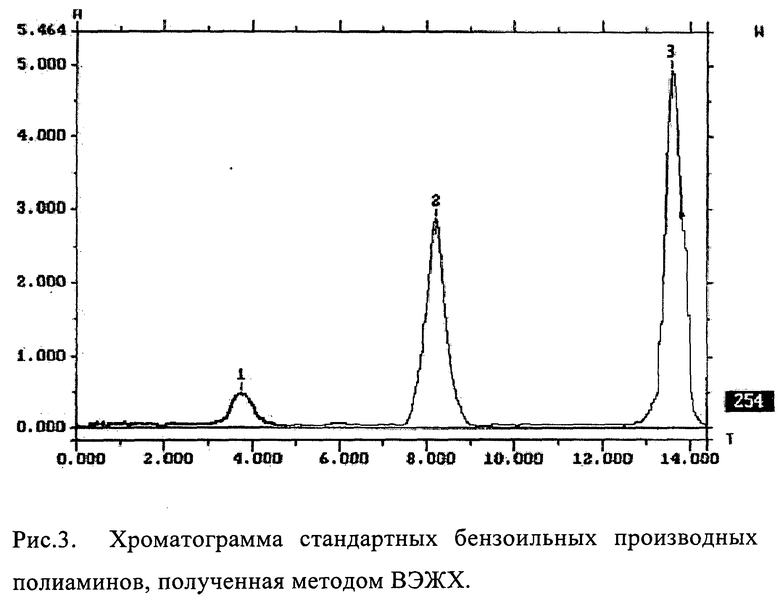
Определение проводилось при длине волны 254 нм. На Рис.3 указаны времена выхода бензоильных производных полиаминов в минутах. Пики 1, 2 и 3 - это соответственно пики производных путресцина, спермидина и спермина. Затем проводилась ВЭЖХ анализируемых образцов и рассчитывались их концентрации в пробе. По концентрациям производных полиаминов расчитывалась удельная активность ОДК в анализируемых образцах.
1.3. Количественное определение белка в бесклеточных тест-системах.
Для расчета удельных активностей ОДК и аминоксидаз, выраженных в нанокаталах на миллиграмм белка, проводилось определение концентрации белка в каждой пробе ткани как гепатомы Г-27, так и регенерирующей печени. Определение проводилось по методу Lowry (1951) в модификации С.П. Сяткина. Порядок проведения определения белка представлен в таблице 10
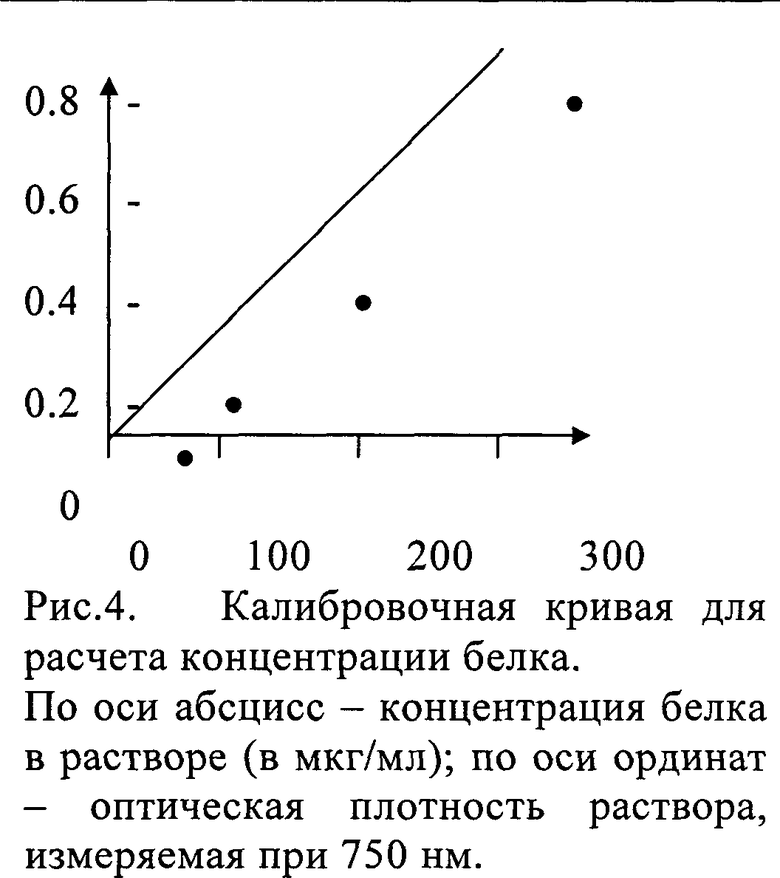
В связи с высоким содержанием липо- и гликопротеинов в ткани метод определения белка по Лоури модифицировали следующим образом. Применили дезоксихолат. Это сократило время анализа и исключило потерю белка, входящего в состав липо- и гликопротеинов. Для более полного растворения белка концентрацию NaOH увеличили с 0.1 М до 1 М. Заменили тартрат на цитрат натрия. Стабильность реактива С повышали тем, что реактив А готовили на воде, а не на 0.1 М NaOH. Оптимальным соотношение концентраций детергента и белка в пробе было 1:100. Калибровочная зависимость сохраняла линейный характер до концентрации 250 мкг/мл белка в пробе.
Полученная оптическая плотность растворов сравнивалась с таковой для стандартных растворов с известной концентрацией белка и по калибровочной кривой (Рис.4) рассчитывалась концентрация белка в анализируемой пробе.
2. Количественный анализ основных факторов пролиферации и дифференциации на клеточной модели
2.1. Клеточные культуры
Культуры опухолевых клеток
Объектом исследования второго этапа скрининга тестируемых веществ служили культуры опухолевых клеток. Исследовали влияние ингибиторов полиаминсинтезирующих ферментов на скорость роста трансформированных фибробластов мышей линии СЗН и на содержание в этих клетках ПА. Количественное определение Пут и ПА проводили методом внешних стандартов путем высокоэффективной жидкостной хроматографии дансильных производных этих веществ (С.П.Сяткин, Т.Т.Березов, Н.Я.Гридина и др., 1991).
Фибробласты мышей линии СЗН
Клетки линии L выращивали на питательной среде Игла с глутамином и 10% сывороткой крови крупного рогатого скота. В каждый флакон вносили 8000 клеток на 2 мл питательной среды.
Использовали 105 флаконов. В каждую из 4 экспериментальных групп было выделено по 15 флаконов. Первая группа была контрольной. Остальные три группы подвергали воздействию ДФМО, МГБГ и ДФМО совместно с МГБГ соответственно. Конечная концентрация исследованных соединений в культуральной среде составила 10 М. Первую смену среды культивирования и введение исследуемых веществ в новую культуральную среду осуществляли на 4-е сутки после начального посева клеток. Через сутки из каждой группы брали по 3 флакона, подсчитывали количество клеток в камере Горяева, взвесь клеток центрифугировали при 1500 об/мин и осадок использовали для определения Пут и ПА методом ВЭЖХ. Во всех оставшихся флаконах меняли среду культивирования и вносили указанные вещества в исходном количестве. Последующие 2 суток поступали аналогичным образом. После 4-х суток культуры ткани L-клеток росли еще 3 дня, но без смены среды и добавления химических соединений.
Клетки карциномы яичника человека
Для клеток карциномы яичника человека (линии CaOv) в суточных культурах заменяли питательную среду 199 средой Игла с 10% сывороткой крупного рогатого скота без глутамина и вместе с ней вносили тестируемые вещества в необходимых для экспериментов концентрациях.
Радиометрическая индикация цитотоксичности веществ
Оценку биологической активности потенциальных противоопухолевых агентов проводили радиометрическим методом индикации цитотоксического эффекта (Добрынин и др., 1974). Показателем цитотоксической активности веществ служило угнетение включения Н-тимидина в ДНК клеток под действием исследуемых веществ.
Показатель темпа роста культуры (ср)
Для оценки токсического действия аналогов ПА использовали показатель темпа роста культуры (ф), который вычисляли как разность In (количество клеток в момент времени г) и In (начальное количество клеток), деленную на время роста t. Оценку потенциальной противоопухолевой активности испытуемых веществ проводили в баллах.
Статистический анализ
В зависимости от критериев оценки противоопухолевой активности параметра тест-систем получают определенную дискретную оценку в баллах в пределах от 0 до 10 для каждого вещества. Затем оценки параметров суммируются по определенному критерию оценки и веществам присваивается суммарный балл, который и расценивается как мощность потенциального противоопухолего действия тестируемого вещества по заданному критерию оценки.
Статистический анализ полученных данных проводили с помощью t-критерия Стьюдента (Афифи А., Эйзен С., 1982). Различия считались достоверными при р<0.05. Простой корреляционнный анализ проводили вычисляя выборочный коэффициент корреляции r с учетом 95% доверительного интервала как описано эанее (Афифи А., Эйзен С., 1982; Сепетилев Д, 1968). Промежуточные значения коэффициента корреляции 0<r<1 указывали о наличии связи между двумя изучаемыми величинами в более или менее сильной степени.
Первый столбец в таблице 11 соответствует каталожным номерам синтеза, принятым в 90-е годы в Латвийском ИОС (Таблица 11).
Синтез проводили в полном соответствии с процедурами и схемами, указанными в литературных источниках.
1. Bitonti A.J, Dumont J.A., Bush Т.Е., Stemerick D.M., Edwards M.L., McCann P.P. Bis(benzyl) polyamine analogs as novel substrates for polyamine oxidase // J. Biol. Chem. - 1990. V.265. P.382-388.
2. Israel M., Zoll E.G., Muhammad N., Modest E.J. Synthesis and anti-tumor evaluation of the presumed cytotoxicmetabolites of spermine and N,N-bis(3-aminopropyl)nonane-l,9-diamine // J. Med. Chem. - 1973. - V.16. - P.l-5.
3. M. Yu. Lidak, R. A. Paegle, M. G. Plata, K. Ya. Pets, Yu.-P.-Shvachkin. New pyrimidyl-N-d-amino acids // Chem. Heterocyclic Compd. (1968) 4 (2), 281.
4. Каулиня Л.Т., Ягупольский Л.М., Кондратенко Н.В., Вечирко Е.П., Берзиня А.Э., Силиня В.Н., Лиепиньш Э.Э., Лидак М.Ю., Жук Р.А. Аналоги пиримидиннуклеозидов [Сообщ.] 17. Синтез 1-[5(2)-фторметилтетрагидрофурил-2]урацилов=Analogs of pyrimidine nucleosides. 17. Synthesis of 1-[5(2)-fluoromethyltetrahydro-2-furyl]uracils. Химия гетероцикл.соед., 1982(2), 256-259; Chem.Heterocycl. Сотр. (Engl. Ed.). 1982, 18(2), 202-205.
5. Лулле И.Ж. Каган Т.И. Паэгле Р.А. Лидак М.Ю. Синтез N-(урацилил-1-алкил)полиметилендиаминов=Synthesis of N-(uracilylalkyl) polymethilenediamines. Химия гетероцикл.соед., 1983(11), 1540-1544; Chem.Heterocycl. Соmр. (Engl. Ed.). 1983,19(11), 1224-1228.
6. Лулле И.Ж. Паэгле Р.А. Мажейка И.Б. Лидак М.Ю. Синтез урацилил-1-алкиламинов и их трансформация в бициклические системы=Synthesis of (1-uracilyl)alkylamines and their transformation to two-ring systems. Химия гетероцикл.соед. 1983(4), 535-542; Chem.Heterocycl. Соmp. (Engl. Ed.). 1983, 19(4), 439-446.
7. Паэгле Р.А. Лулле И.Ж. Поритере С.Е. Лидак М.Ю. Синтез и свойства производных bеtа-(урацилил-1)-аlрhа-гидроксипропионовых кислот=Synthesis and properties of beta-(1-uracilyl)-alpha-hydroxypropionic acid derivatives. Химия гетероцикл.соед. 1990(7), 954-959; Chem.Heterocycl. Соmp. (Engl. Ed.). 1990, 26(7), 796-800.
 Д
Д
Растворы в горячей воде с каплей ДМСО, рН 4
Растворы в горячей воде с каплей ДМСО, рН 4
Растворы в горячей воде с каплей ДМСО, рН 4
Изобретение относится к новому средству, обладающему свойствами ингибитора образования полиаминов для снижения скорости пролиферации опухолевых клеток. Средство представляет собой производные бис(5-метиламинометилурацил)полиметилена формулы (I) или его фармацевтически приемлемые соли
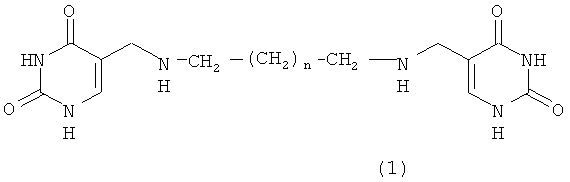
В частности, средство представляет собой соединения, выбранные из группы:
5-[4-(2,4-диоксо-1,2,3,4-тетрагидро-5-пиримидинилметиламино)пропиламинометил]-1,2,3,4-тетрагидро-2,4-пиримидиндион (n=1); 5-[4-(2,4-диоксо-1,2,3,4-тетрагидро-5-пиримидинилметиламино)бутиламинометил]-1,2,3,4-тетрагидро-2,4-пиримидиндион (n=2); 5-[4-(2,4-диоксо-1,2,3,4-тетрагидро-5-пиримидинилметиламино)пентиламинометил]-1,2,3,4-тетрагидро-2,4-пиримидиндион (n=3) и 5-[4-(2,4-диоксо-1,2,3,4-тетрагидро-5-пиримидинилметиламино)гексиламинометил]-1,2,3,4-тетрагидро-2,4-пиримидиндион (n=4). Было обнаружено, что соединения изобретения обладают in vitro способностью повышать активность ди- и полиаминоксидаз, понижать активность орнитиндекарбоксилазы, в частности, в опухолевых клетках, в частности опухолевых клеток карциномы яичника человека. Соединения изобретения обладают in vitro низкой цитотоксичностью. Изобретение также относится к способу замедления скорости пролиферации опухолевых клеток с использованием соединений формулы(1). 2 н. и 4 з.п. ф-лы, 4 ил., 11 табл., 4 рис.
1. Средство обладающее свойствами ингибитора образования полиаминов для снижения скорости пролиферации опухолевых клеток, представляющее собой производные бис(5-метиламинометилурацил)полиметилена формулы 1
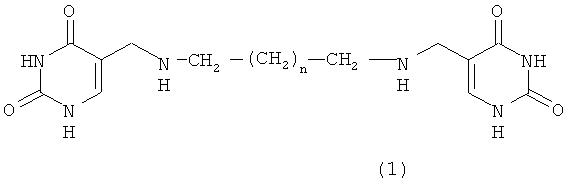
где n=1-4.
2. Средство по п.1, представляющее собой
5-[4-(2,4-диоксо-1,2,3,4-тетрагидро-5-пиримидинилметиламино)пропиламинометил]-1,2,3,4-тетрагидро-2,4-пиримидиндион (n=1).
3. Средство по п.1, представляющее собой
5-[4-(2,4-диоксо-1,2,3,4-тетрагидро-5-пиримидинилметиламино)бутиламинометил]-1,2,3,4-тетрагидро-2,4-пиримидиндион (n=2).
4. Средство по п.1, представляющее собой
5-[4-(2,4-диоксо-1,2,3,4-тетрагидро-5-пиримидинилметиламино)пентиламинометил]-
1,2,3,4-тетрагидро-2,4-пиримидиндион (n=3).
5. Средство по п.1, представляющее собой
5-[4-(2,4-диоксо-1,2,3,4-тетрагидро-5-пиримидинилметиламино)гексиламинометил]-1,2,3,4-тетрагидро-2,4-пиримидиндион (n=4).
6. Способ замедления скорости пролиферации опухолевых клеток, включающий введение эффективного количества активного соединения, отличающийся тем, что в качестве активного соединения вводят соединение по любому из пп.1-5.
| SASAKI, I.et al "Interaction between nucleic acids and metal complexes | |||
| I | |||
| Synthesis of polyimines and polyamines derived from uracil", Nouveau Journal de Chimie, 1982, 6(7-8), 341-4 | |||
| Способ получения производныхАлКилЕНдиАМиНА или иХ КиСлОТНО-АддиТиВНыХ СОлЕй | 1979 |
|
SU841587A3 |
| RU 1487657 A1, 27.03.2000. | |||
Авторы
Даты
2011-09-20—Публикация
2008-12-29—Подача