Предлагаемое изобретение относится к области органической химии и химии природных соединений, конкретно - химии экдистероидов (гормонов линьки и метаморфоза насекомых и ракообразных).
Экдистероиды структурно близки к брассиностероидам - фитостероидам с высокой гормональной активностью. Основное их отличие - в циклическом фрагменте стеринового остова - кольце В. Одним из перспективных путей трансформаций экдистероидов в соединения, родственные брассиностероидам, является преобразование кольца В путем восстановления его двойной связи, сопряженной с кето-функцией.
Полученные таким образом 7,8-дигидроаналоги экдистероидов структурно близки к брассиностероидам типа кастастерон - высокоактивным фитогормонам, стимуляторам роста и развития растений [2] [Ковганко Н.В., Кашкан Ж.Н., Чернов Ю.Г., Ананич С.К., Соколов С.Н., Сурвилло В.Л., ХПС, 2003, 5, 335].
Все известные пути синтеза производных брассиностероидов многостадийны, а суммарные выходы целевых продуктов малы, поэтому получение их из 20-гидроксиэкдизона - природного экдистероида, выделяемого из растения Serratula coronata, представляется эффективной находкой.
Не удается восстановить двойную связь экдистероидов, например, действием щелочных металлов в жидком аммиаке - методом, широко используемым для превращения циклических сопряженных енонов в насыщенные кетоны [3, 4] [Dryden Jr., H.L. Organic reactions in steroids chemistry. Reduction of steroids by metalammonia solutions: Fried J. New York. 1972; v.1, p.1-60, Caine D. Organic reations. Reduction and related reactions of α,β-unsaturated carbonyl Compounds with metals in liquid ammonia; J. New York, 1976, v.23, p. 1-258].
Сообщалось о получении 7,8-дигидроаналогов 20-гидроксиэкдизона и его производных путем восстановления алюмогидридом лития [5] [Одиноков В.Н., Афонькина С.Р., Шафиков Р.В., Савченко Р.Г., Галяутдинов И.В., Халилов Л.М., Шашков А.С., ЖОрХ, 2007, 43, 830]. Однако выходы 7,8-дигидроаналогов не превышали 35%, поскольку наряду с целевыми соединениями (продукты 1,4-восстановления) получались продукты восстановления кетогруппы (1,2-восстановления).
Не удается селективно восстановить двойную связь, сопряженную с кетогруппой в кольце В экдистероидов, и путем гидрирования в присутствии катализаторов (палладиевых, никелевых, платиновых). В обычных условиях каталитического гидрирования вместо восстановления Δ7-связи экдистероидов происходила ее миграция, что приводило к образованию сложной смеси соединений [6, 7] [Odinokov V.N., Galyautdinov I.V., Ibragimova A.Sh., Veskina N.A., Khalilov L.M., Dolgushin F.M., Starikova Z.A. Mendeleev Commun., 2008, 18, 291], [Werawattanametin K, Podimnang V., Suksamram A., J. Nat. Prod. 1986, 49, 365].
Наиболее близким к предлагаемому изобретению является способ гидрирования экдистероидов в спирте с использованием 3-кратного весового избытка палладиевого катализатора по отношению к субстрату и 20-кратного мольного избытка 25% раствора нитрита натрия [8] [Suksamrarn A., Tanachatchairatana Т., Sirigam С., Tetrahedron, 2002, 58, 6033-6037]. Следует отметить, что недостатком данного способа гидрирования является использование большого количества дорогого палладиевого катализатора.
Задачей изобретения является разработка простого, эффективного и воспризводимого метода получения 7,8-дигидроаналов экдистероидов - предшественников аналогов брассиностероидов.
Решение поставленной задачи было достигнуто путем гидрирования метанольного раствора, содержащего исходный субстрат - 20-гидроксиэкдизон 1 или его диацетонид 2, 6-кратный мольный избыток Na и катализатор Pd/C. Для этого в стеклянный реактор загружали навеску соединений 1 или 2 в метаноле, к нему прибавляли 1-6-кратный мольный избыток натрия (предпочтительно 6-кратный). Реакционную смесь выдерживали 0.5 ч, прибавляли Pd/C (не менее 1:1 по весу к исходному субстрату) и барботировали водород при комнатной температуре. Таким путем 20-гидроксиэкдизон 1 и его диацетонид 2 были превращены в соответствующие 7,8-дигидроаналоги 3 и 4. При этом выход целевых соединений достигал 90%. Схема 1
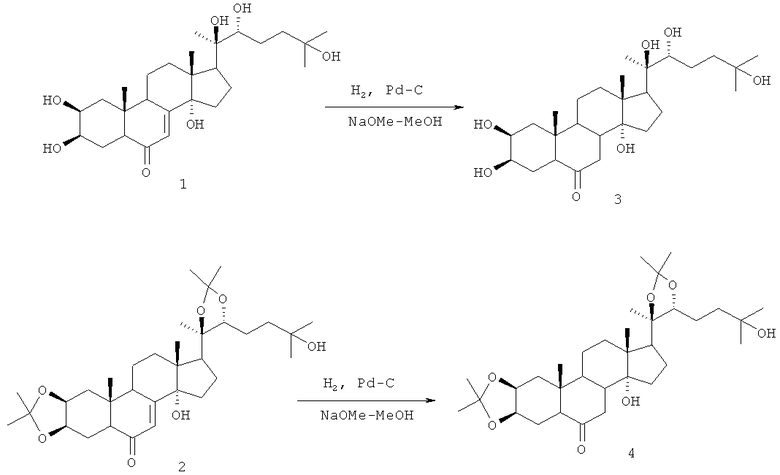
Для получения целевых 7,8-дигидроаналогов экдистероидов необходимо соблюдать указанную последовательность ведения процесса. Если экдистероид вносить в предварительно приготовленный раствор метилата натрия и затем добавить катализатор, то гидрирование Δ7-связи не происходит. Обязательным является также барботирование водорода через реакционную смесь в присутствии катализатора, тогда как только обработка натрием раствора экдистероида в метаноле, содержащем катализатор, не позволяет получить соответствующий 7,8-дигидроаналог. При уменьшении количества катализатора до 1% от веса субстрата и количества Na (для получения метилата) до эквимольного выход целевых соединений снижается.
Успех, достигнутый в синтезе 7,8-дигидроаналогов экдистероидов путем каталитического гидрирования метанольного раствора субстратов (1, 2), содержащего избыток натрия, по-видимому, можно объяснить енолизацией 6-кетогруппы экдистероида под действием основания (MeONa), а последующее гидрирование натрий-диенолята приводит к натрий-еноляту, который при обработке раствором хлористого аммония превращается в целевой 7,8-дигидроаналог.
Достоинствами предлагаемого способа гидрирования экдистероидов по отношению к прототипу являются:
1. Существенное уменьшение количества палладиевого катализатора (в 3 раза).
2. Высокая селективность и выход целевых 7,8-дигидроаналогов экдистероидов.
3. Воспроизводимость результатов.
Сущность способа демонстрируется следующими примерами.
Пример 1. К раствору 0.44 г (0.9 ммоль) 20-гидроксиэкдизона 1 в 15 мл абсолютного метанола добавили 0.12 г натрия (5,4 ммоль) и перемешивали 30 минут. Затем прибавили 0.45 г катализатора 10% Pd-C и через реакционную смесь барботировали при размешивании водород из баллона в течение 3 ч при комнатной температуре. Реакционную смесь отфильтровали, добавили 3 мл воды, нейтрализовали насыщенным раствором хлорида аммония и экстрагировали бутиловым спиртом (3×40 мл), экстракт упарили. Сухой остаток растворили в метаноле и хроматографировали на колонке (7 г SiO2, элюент - смесь (20:1) хлороформ-метанол). Выделили 0.398 г (90%) соединения 3. Т.пл 150-151°С, [α]D 20 + 20.4 (с 1.159, МеОН).
Лит. данные: т.пл. 153-155°С, ИК-, УФ-, ЯМР 1Н и 13С идентичны приведенным в работе [8].
Пример 2. К раствору 0.15 г (0.3 ммоль) 20-гидроксиэкдизона 1 в 10 мл абсолютного метанола добавили натрия 0.021 г (0.9 ммоль) и перемешивали 30 минут. Затем прибавили 0,001 г Pd-C и барботировали в реакционную смесь водород в течение 3 ч при комнатной температуре, далее обрабатывали, как описано в примере 1, получив 0.01 г (67%) исходного соединения 1 и 0.04 г (27%) соединения 3.
Пример 3. К раствору 0.15 г (0.3 ммоль) 20-гидроксиэкдизона 1 в 10 мл абсолютного метанола добавили 0.007 г (0.3 ммоль) натрия и перемешивали 30 минут. Затем прибавили 0.45 г Pd/C и барботировали в реакционную смесь водород в течение 3 ч и далее обрабатывали, как описано в примере 1, получив 0.92 г (61%) исходного соединения 1 и 0.05 г (33%) соединения (3).
Пример 4. К раствору 0.4 г (0.7 ммоль) соединения (2) в 15 мл абсолютного метанола при перемешивании добавили 0.1 г (4.2 ммоль) натрия, перемешивали при комнатной температуре 30 минут. Затем прибавили 0.4 г катализатора 10% Pd-C и через реакционную смесь барботировали при размешивании водород в течение 3 ч при комнатной температуре, далее обрабатывали, как описано выше в примере 1. Выход дигидроаналога 4 0.37 г (92%), Rf 0.51 (CHCl3-МеОН, 10:1), т.пл. 276-278°С, [α]D 20 + 14.2° (с 11.97, CHCl3).
Лит. данные: т.пл. 275-277°С, ИК-, УФ-, ЯМР 1Н и 13С идентичны приведенным в работе [5].
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛПЕРЕГРУППИРОВАННОГО ЭКДИСТЕРОИДА - 2,3:20,22-ДИАЦЕТОНИДА 9α,13α-ЭПОКСИ-14β-МЕТИЛ-13-ДЕМЕТИЛ-14-ДЕЗОКСИ-7,8-ДИГИДРО-20-ГИДРОКСИЭКДИЗОНА | 2010 |
|
RU2443709C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-МОНОАЦЕТОНИДА 20-ГИДРОКСИЭКДИЗОНА | 2007 |
|
RU2351604C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА (6-ГИДРОКСИ-2,5,7,8-ТЕТРАМЕТИЛХРОМАН-2-ИЛ)АЦЕТАЛЬДЕГИДА С 20-ГИДРОКСИЭКДИЗОНОМ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИОКСИДАНТНОГО СРЕДСТВА, ИНГИБИРУЮЩЕГО ПРОЦЕСС ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ | 2010 |
|
RU2490267C2 |
| ВОССТАНОВЛЕНИЕ СВЯЗЕЙ С-О С ПОМОЩЬЮ КАТАЛИТИЧЕСКОГО ГИДРИРОВАНИЯ С ПЕРЕНОСОМ ВОДОРОДА | 2012 |
|
RU2599127C2 |
| БЕНЗОКОНДЕНСИРОВАННЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНОГО ПРОДУКТА | 1992 |
|
RU2114110C1 |
| ПАЛЛАДИЕВЫЙ КАТАЛИЗАТОР ГИДРИРОВАНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2323776C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ ТРАНС-4- КЕТОПЕРГИДРОХИНОЛИНА ИЛИ ЕГО ПРОИЗВОДНЫХ | 1973 |
|
SU385964A1 |
| Способ получения палладийсодержащего катализатора гидрирования ацетиленовых соединений | 2022 |
|
RU2814116C1 |
| СПОСОБ ПОЛУЧЕНИЯ O-ХЛОРАНИЛИНА | 2015 |
|
RU2606394C1 |
| Способ гидрирования ацетиленовых спиртов (варианты) | 2020 |
|
RU2734459C1 |
Изобретение относится к области органической химии и химии природных соединений, конкретно - химии экдистероидов (гормонов линьки и метаморфоза насекомых и ракообразных). Описан способ получения 7,8-дигидроаналогов экдистероидов путем каталитического гидрирования экдистероидов в метанольном растворе, содержащем 1:6-кратный избыток металлического Na в присутствии катализатора Pd/C (1:1 к весу субстрата). Полученные таким образом 7,8-дигидроаналоги экдистероидов структурно близки к брассиностероидам типа кастастерон - высокоактивным фитогормонам, стимуляторам роста и развития растений. 2 з.п. ф-лы.
1. Способ получения 7,8-дигидроаналогов экдистероидов гидрированием 20-гидроксиэкдизона или его производных в присутствии катализатора Pd/C в токе водорода при комнатной температуре, отличающийся тем, что катализатор Pd/C используют в количестве 100% на исходное соединение, реакцию проводят, загружая катализатор в предварительно приготовленный раствор экдистероида в метаноле, к которому добавляют 1-6 моль Na в расчете на экдистероид и перемешивают в течение 0,5 ч.
2. Способ по п.1, отличающийся тем, что в качестве производного 20-гидроксиэкдизона используют его диацетонид.
3. Способ по п.1, отличающийся тем, что мольное соотношение экдистероид: Na составляет 1-1÷6, предпочтительно 1:6.
| ОДИНОКОВ В.Н., АФОНЬКИНА С.Р | |||
| и др | |||
| // ЖОрх, 2007, 43, с.830 | |||
| SUKSAMRARN A., et al | |||
| // Tetrahedron, 2002, 58, p.6033-6037 | |||
| Р.Г.САВЧЕНКО, Я.Р.УРАЗАЕВА и др | |||
| // ЖОрх, 2010, 46, вып.1, с.147-149. |
Авторы
Даты
2011-11-27—Публикация
2010-03-30—Подача