Область техники, к которой относится изобретение
Настоящее изобретение относится к способам получения фосфитилированных соединений с использованием специфических активаторов, особенно, к синтезу фосфорамидитов.
Предшествующий уровень техники
Олигонуклеотиды являются ключевыми соединениями в науках о жизни, имеющими важные значения в различных областях. Их, например, применяют в качестве зондов в области анализа генной экспрессии, в качестве праймеров в ПЦР или для секвенирования ДНК.
Кроме того, существует также ряд потенциальных терапевтических применений, включая, например, антисмысловые олигонуклеотиды.
Ряд химических модификаций вводили в олигонуклеотиды для увеличения их применимости в диагностике, в качестве исследовательских реагентов и в качестве терапевтических средств, например, для стабилизации против нуклеаз.
Синтез олигонуклеотидов может быть осуществлен с использованием как способов в фазе раствора, так и твердофазных способов. Предпочтительный способ в настоящее время представляет собой способ посредством твердофазного синтеза, в котором олигонуклеотид получают на твердой подложке и олигонуклеотид растет посредством последовательного добавления нуклеотидов.
Растущее количество применений требует более высоких количеств олигонуклеотидов; следовательно, существует насущная потребность в разработке улучшенного синтетического способа.
Для общего обзора, см. например, “Antisense - From Technology to Therapy” Blackwell Science (Oxford, 1997).
Один известный тип билдинг-блоков в синтезе олигонуклеотидов представляет собой фосфорамидиты; см., например, S.L. Beaucage, M.H. Caruthers, Tetrahedron Letters 1859 (1981) 22. Эти фосфорамидиты нуклеозидов, дезоксирибонуклеозидов и производные тех и других являются доступными для приобретения. При обычном твердофазном синтезе применяют 3'-О-фосфорамидиты, но в других синтетических методиках также применяют 5'-O и 2'-О-фосфорамидиты. Одной стадией при получении этих фосфорамидитов нуклеозидов является фосфитилирование (защищенных) нуклеозидов. Наиболее часто, гидроксильная группа и аминогруппы и другие функциональные группы, присутствующие в нуклеозиде, защищают перед фосфитилированием оставшейся 3'-, 5'- или 2'-O гидроксильной группы. Известно несколько путей для получения мономерных (нуклеозидов) и полимерных (нуклеотидов или олигонуклеотидов) фосфорамидитов. Известные способы приводят очень часто к проблемам в химии или безопасности. Для применения этой химии для крупномасштабного синтеза (100 кг - 1000 кг) эффективность по затратам должна улучшаться.
Традиционно, фосфитилирование нуклеозидов осуществляют обработкой защищенных нуклеозидов фосфитилирующим реагентом, таким как хлор-(2-цианоэтокси)-N,N-диизопропиламинофосфин, который является очень реакционно-способным и не требует активатора или 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидит (бис-фос или бис-амидитный реагент), который требует активатора.
Активатором, наиболее часто используемым в реакции фосфитилирования, является 1Н-тетразол.
При использовании 1Н-тетразола существуют характерные проблемы, особенно, при проведении крупномасштабного синтеза. Например, известно, что 1Н-тетразол является взрывоопасным и токсичным. В соответствии с инструкцией по технике безопасности (MSDS) 1Н-тетразол (1Н-тетразол, 98%) может оказывать вредное воздействие при вдыхании, поглощении внутрь и всасывании через кожу.
Кроме того, 1Н-тетразол является дорогим, особенно, при крупномасштабном синтезе он оказывает существенное воздействие на затраты при синтезе олигонуклеотидов.
MSDS также утверждает, что 1Н-тетразол может взрываться при нагреве выше его температуры плавления, равной 155°С, и может образовывать очень чувствительные взрывчатые соединения с металлами. В случае крупномасштабного синтеза в реакторе 1Н-тетразол будет представлять большую опасность для людей и окружающей среды.
В дополнение, известно, что 1Н-тетразол требует специального обращения во время хранения, применения и утилизации.
1Н-тетразол и родственные производные, например 5-этилтио-1Н-тетразол, 5-бензилтио-1Н-тетразол, обладают также возможностью для разрушения целевой молекулы. Поэтому отщепление чувствительной к кислоте защитной группы изложено в различных публикациях (Krotz et al, Tetrahedron Letters, 1997, 38, 3875).
Неблагоприятное снятие кислотолабильной защитной группы также известно при применении хлор-(2-цианоэтокси)-N,N-диизопропиламинофосфина. Кроме тенденции отщепления применяемых защитных групп этот фосфитилирующий агент будет приводить к большим количествам 3'-3'-изомеров. Полученные в результате амидиты должны быть очищены посредством хроматографической стадии с высокими временными и материальными затратами.
Особенно в применении для фосфитилирования олигомерных фосфорамидитов известные способы приводят в результате, в основном, к разложению или сложным смесям целевой молекулы и побочных продуктов.
Применение бис-фос с некоторыми активаторами в целом известно для мономерных нуклеозидных амидитов, но в случае олигонуклеотидов низкая реакционная способность делает этот подход очень усложненным.
Низкая реакционная способность приводит также к длительному времени реакции (2-6 ч). Попытка избежать длительного времени реакции потребует применения обширного избытка фосфитилирующего агента и активатора. В конце этот вид управления реакцией также потребует дополнительных стадий очистки.
ЕР 0906917 А2 и Hayakawa et al., J. Am. Chem Soc. 120 (1998) 12395-12401 раскрывают применение трифлата имидазолия для синтеза фосфорамидитов. Выход и чистоту описанного синтеза не смогли повторить.
Кроме того, способ Hayakawa осуществлялся с применением активатора, который был получен, выделен и очищен раздельно. После очистки чувствительного к воде активатора необходимо хранить этот активатор в абсолютно сухих условиях.
Чувствительность и низкая реакционная способность этого активатора будут приводить в результате к усложненному манипулированию, которое является трудным для крупномасштабного синтеза амидитов.
Во всех экспериментах с этим активатором Hayakawa полученные в результате амидиты должны быть очищены посредством высокозатратной хроматографической стадии.
Однако во всех случаях результат реакции фосфитилирования был неполным и неэффективным, и, следовательно, стадия очистки всегда является основным требованием.
Фосфитилирование чувствительных олигонуклеотидов заканчивается, в основном, разложением.
Выходы и степень чистоты описанных синтезов не могут быть повторены, вследствие того, что применяемые трифлаты имидазолия имеют высоконуклеофильный характер и высокую гидроскопическую тенденцию. Эти свойства в конечном результате при работе с основными количествами приводят к разложению и гидролизу. Описанные активаторы выделяют и применяют в их чистой форме.
Этот способ синтеза амидитов требует флэш-хроматографии для очистки целевого соединения.
В дополнение, Hayakawa применял данное соединение для образования межнуклеотидной связи (конденсация амидита с нуклеозидом).
Hayakawa et al., J. Org. Chem. 61 (1996) 7996-7997 раскрывает применение трифлата бензимидазолия для конденсации фосфорамидита с нуклеозидом.
Hayakawa et al., J. Am. Chem. Soc. 123 (2001) 8165-8176 раскрывает применение комплексов кислота/азол для конденсации фосфорамидита с нуклеозидом.
Arnold et al., Collect. Czech. Chem. Commun. 54 (1989) 523-532 раскрывает автоматизированный хлоридитный и амидитный синтез олигодезоксирибонуклеотидов и inter alia применение 1-метилимидазола в конденсации фосфорамидита с нуклеозидом.
Краткое изложение сущности изобретения
Целью настоящего изобретения является предоставить способ получения фосфитилированных соединений, в котором преодолеваются, по меньшей мере, некоторые из недостатков предшествующего уровня техники.
Дополнительной целью изобретения является предоставить активатор, имеющий улучшенные свойства по сравнению с активаторами предшествующего уровня техники.
Дополнительной целью изобретения является предоставить смесь активатор/добавка, имеющую улучшенные свойства по сравнению с активаторами предшествующего уровня техники. В одном аспекте настоящее изобретение предоставляет способ получения фосфитилированного соединения, включающий стадию:
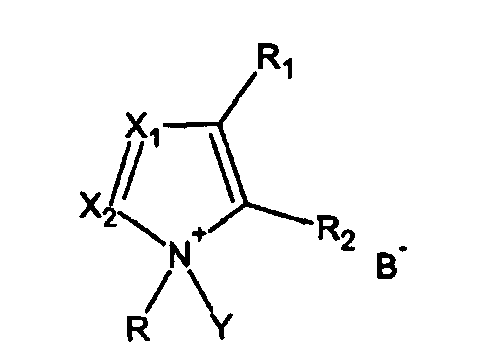
- взаимодействия гидроксилсодержащего соединения с фосфитилирующим агентом в присутствии активатора, имеющего формулу I
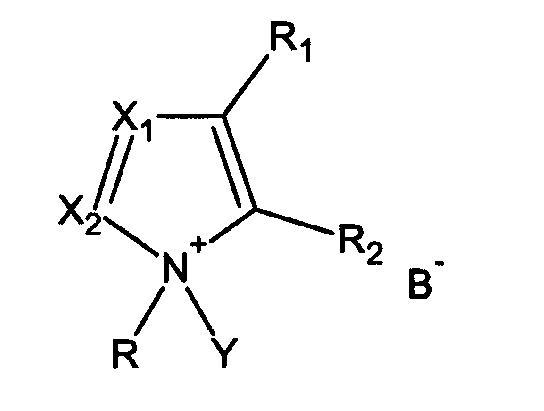
где
R = алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил
R1, R2 = или Н, или вместе образуют 5-6-членный цикл,
Х1, Х2 = независимо или N, или СН,
Y = H или Si(R4)3, где R4 = алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
B = депротонированная кислота.
Активатор может применяться стехиометрически или каталитически (3-50 мол.%, предпочтительно 10-30 мол.%) или в избытке (до 300 мол.%).
В предпочтительном варианте осуществления активатор имеет формулу, выбранную из группы, состоящей из

где
Y определен выше,
R представляет собой метил, фенил или бензил.
Получение этих активаторов, например, описано в Hayakawa et al, J. Am. Chem. Soc. 123 (2001) 8165-8176.
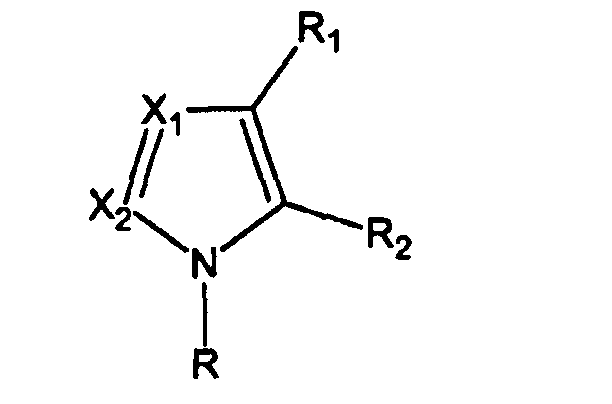
В одном варианте осуществления активатор применяют в сочетании с добавкой. Добавки могут быть выбраны из непротонированной формы соединений, имеющих формулу I, и других гетероциклических оснований, например пиридина. Подходящие отношения между активатором и добавкой составляют от 1:1 до 1:10.
В одном предпочтительном варианте осуществления активатор может быть получен, следуя методике “in situ”. В этом случае активатор не будет выделен, что приводит к улучшенным результатам реакции. Гидролиз или разложение целевой молекулы подавляется.
Для фосфитилирования с высоким выходом в 3'- и/или 5'-положении олигонуклеотидов (ди-, три-, тетра-, пента-, гекса-, гепта- и октамеров) получение in-situ активатора и сочетание с добавкой является предпочтительным.
Как описано выше, фосфитилирование является особенно применимым в синтезе олигонуклеотидов и билдинг-блоков фосфорамидитов. Следовательно, в предпочтительном варианте осуществления гидроксилсодержащее соединение содержит фрагмент сахара, например нуклеозид или олигомер, являющийся его производным. Такие нуклеозиды представляют собой, например, аденозин, цитозин, гуанозин и урацил, дезоксиаденозин, дезоксигуанозин, дезокситимидин, дезоксицитозин и их производные, необязательно содержащие защитные группы.
Способ настоящего изобретения является особенно применимым для фосфитилирования олигонуклеотидов (ди-, три-, тетра-, пента-, гекса-, гепта- и октамеров). Такие фосфитилированные олигонуклеотиды применяют, например, в синтезе крупных олигонуклеотидов посредством концепции фрагментной конденсации.
Обычно, их подходящим образом защищают по их гетероциклической функциональности и по их гидроксилнесущим группам, за исключением одной, которую нужно фосфитилировать. В типовом случае, диметокситритил, монометокситритил или силилсодержащие защитные группы (например, TBDMS) используют в качестве защитных групп для 5'ОН-группы, обеспечивая фосфитилирование 3'-ОН группы.
Также, 3'-ОН группа может быть защищена защитной группой (LEV, TBDMS и т.д.) и незащищенная 5'-ОН позволит провести 5'-О-фосфитилирование нуклеозидов или нуклеотидов.
Способы фосфитилирования могут применяться в синтезе 3'- или 5'-фосфорамидитов с идентичными результатами.
Полученная в результате целевая молекула реакции фосфитилирования представляет собой в одном варианте осуществления фосфорамидит и имеет структуру:
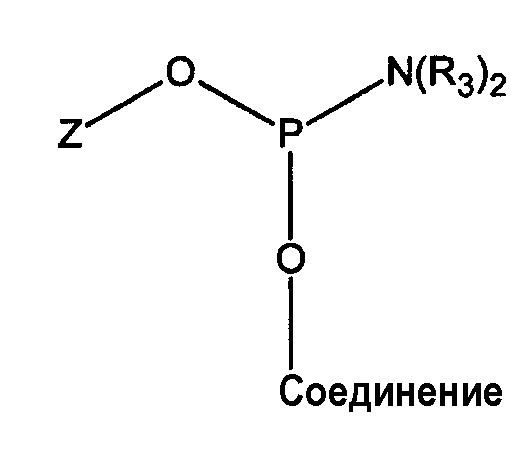
Z представляет собой уходящую группу, например, CH3, C2H5, CH2C6H5, -CH2CH2CN, -CH2CH=CHCH2CN, пара-CH2C6H4CH2CN, -(CH2)2-5N(H)COCF3, -CH2CH2Si(C6H5)2CH3 или -CH2CH2N(CH3)COCF3 и где R3 представляет собой алкил, имеющий от 1 до приблизительно 6 атомов углерода; или R3 представляет собой гетероциклоалкильный или гетероциклоалкенильный цикл, содержащий от 4 до 7 атомов и имеющий до 3 гетероатомов, выбранных из азота, серы и кислорода, и “соединение” представляет собой остальную часть гидроксисодержащего соединения, например нуклеозид, нуклеотид или олигонуклеотид.
В этом случае атом P(III) соединен с двумя кислородными атомами (или образует две связи Р-О) и один атом азота (образующий одну связь Р-N), который принадлежит аминогруппе, предпочтительно, диизопропиламина, диэтиламина или других вторичных аминов.
Реакция конденсации фосфорамидита с другой гидроксильной группой другой молекулы (соединение А) будет приводить к сложному триэфиру фосфита структуры:
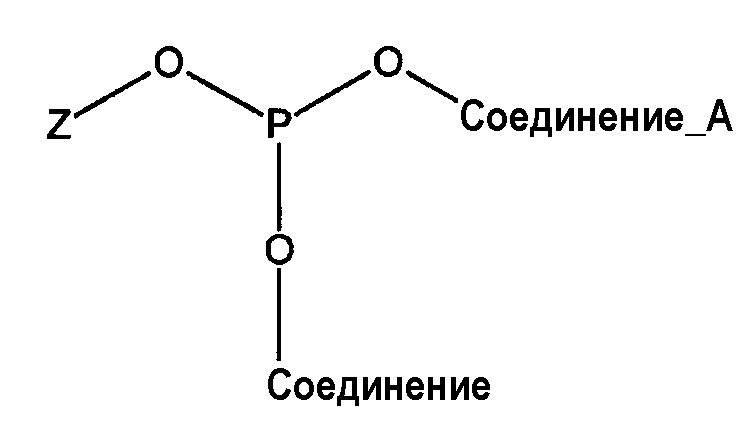
В этом случае атом P(III) имеет соединения с тремя кислородными атомами (образуя три связи Р-О) и не имеет связи с азотом.
В целом, фосфитилирующий агент может быть тем же самым, что и в реакциях фосфитилирования с использованием 1Н-тетразола.
В предпочтительном варианте осуществления он имеет формулу

где Z представляет собой уходящую группу, например, CH3, C2H5, CH2C6H5,
-CH2CH2CN, -CH2CH=CHCH2CN, пара-CH2C6H4CH2CN, -(CH2)2-5N(H)COCF3,
-CH2CH2Si(C6H5)2CH3 или -CH2CH2N(CH3)COCF3 и R1 и R2 независимо представляют собой вторичные аминогруппы N(R3)2, где R3 представляет собой алкил, имеющий от 1 до приблизительно 6 атомов углерода; или R3 представляет собой гетероциклоалкильный или гетероциклоалкенильный цикл, содержащий от 4 до 7 атомов и имеющий до 3 гетероатомов, выбранных из азота, серы и кислорода.
Типичный фосфитилирующий агент представляет собой 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидит.
Другие предпочтительные фосфитилирующие агенты представляют собой производные оксафосфолидина, как описано в N. Ok et al., J. Am. Chem. Soc. 2003, 125, 8307-8317, включенной в качестве ссылки. Этот фосфитилирующий агент позволяет проводить синтез олигонуклеотидов, где межнуклеотидная связь может быть преобразована в фосфотиоаты стереоселективным образом. Такие диастереоселективно синтезированные межнуклеотидные фосфотиоатные связи имеют обещающее значение для применения фосфотиоатов в качестве антисмысловых лекарств.
Подходящими примерами депротонированных кислот В- являются трифлат, трифторацетат, дихлорацетат, мезил, тозил, о-хлорфенолят. Кислоты с рКа менее 4,5 являются предпочтительными. Предпочтительно, они имеют низкую нуклеофильность.
В одном варианте осуществления реакцию проводят в присутствии молекулярных сит или других связывающих воду реагентов. В целом, воду следует исключить или фиксировать посредством осушающей среды во время реакции.
Возможно сочетать активатор настоящего изобретения с фосфитилирующим агентом и добавлять гидроксильный компонент позже. Также возможно сочетать активатор с гидроксилсодержащим соединением и затем добавлять фосфитилирующий агент.
В случае применения добавки, активатор смешивают с гидроксикомпонентом перед добавлением фосфитилирующего агента.
Для генерации активатора “in situ” выбранную кислоту предпочтительно добавляют после добавления добавки в условиях контролируемой температуры реакции.
Фосфитилирующий агент может быть добавлен перед добавлением выбранной кислоты или после добавления.
По отношению к добавлению кислоты и фосфитилирующего агента нуклеозидный компонент может быть добавлен в конце или в начале.
В предпочтительном варианте осуществления соответствующее основание активатора, гидроксилсодержащее соединение и фосфитилирующий агент объединяют и кислоту добавляют для начала реакции.
Дополнительная цель изобретения состоит в применении активатора, имеющего формулу I
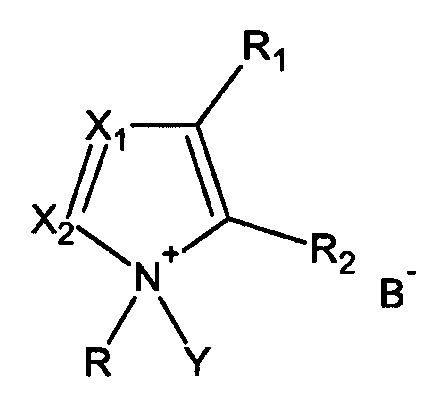
где
R = алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
R1, R2 = или Н, или вместе образуют 5-6-членный цикл,
Х1, Х2 = независимо или N, или СН,
Y = H или Si(R4)3, где R4 = алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
B = депротонированная кислота,
в качестве активатора для фосфитилирования гидроксилсодержащих соединений фосфитилирующим агентом.
Дополнительной целью изобретения является сочетание активатора и непротонированного основания (добавки), которое будет создавать равновесие между обоими видами. Полученное в результате равновесие проявляет улучшенные свойства по сравнению с активаторами предшествующего уровня техники.
Особенно в соединении с использованием ацетона активатор/катализатор не будет проявлять известные побочные реакции (разложение или образование 3'-3'- или 5'-5'-гомологов). Ацетон также обладает способностью растворять эдукты и реагенты.
В соответствии с предшествующим уровнем техники, в случае более долгого времени реакции высвобождение диизопропиламина и присутствие активированного Бис-Фос приводит к разложению целевого соединения (детритилирование, СЕ-расщепление, депуринирование или отщепление других защитных групп). Присутствие ацетона и специфический состав активатора снижает данные тенденции.
Присутствие ацетона гасит активность любого количества диизопропиламина (DIPA), который высвобождается в процессе фосфитилирования. Это можно использовать для фосфитилирования более коротких или более длинных олигонуклеотидов со сходными результатами (без разложения). Другие кетоновые соединения, имеющие формулу Rx-C(=O)-Ry, где Rx и Ry независимо представляют собой C1-C6 алкил или вместе образуют циклоалкил, также могут применяться, поскольку они способны образовывать еноляты в присутствии, например, аминов, имеющих CH2-группу в α-положении.
В дополнение, применение ацетона обеспечивает более долгое время реакции без отщепления 5'-О-защитной группы. В обоих случаях применение ацетона будет защищать различные защитные группы и позволит избежать тенденции депуринирования.
Ацетон обладает также лучшим профилем токсичности и улучшенными природоохранными свойствами по сравнению с, например, ацетонитрилом и является недорогим.
Дополнительная цель, следовательно, состоит в применении ацетона в качестве реакционной среды или сорастворителя в синтезе фосфорамидитов.
Сочетание активатора с определенным количеством добавок поддерживает более высокую эффективность способа фосфитилирования более длинных и чувствительных олигонуклеотидов (3' или 5' без защитных групп).
Типично, реакционная способность реагента увеличивается, чтобы синтез заканчивался через 2-5 мин.
При использовании способов настоящего изобретения отпадает необходимость в дополнительной стадии очистки.
Полученные в результате мономерные и олигомерные амидиты могут применяться для твердо- и жидкофазного синтеза олигонуклеотидов.
Активатор или сочетание активатор/добавка являются особенно применимыми для синтеза фосфорамидита аденозина, фосфорамидита цитозина, фосфорамидита гуанозина и фосфорамидита урацила, фосфорамидита дезоксиаденозина, фосфорамидита дезоксигуанозина, фосфорамидита дезокситимидина, фосфорамидита дезоксицитозина, а также фосфорамидатов олигонуклеотидов, имеющих формулу Xn, где каждый Х выбран из А, dA, C, dC, G, dG, U, dT и n=2-30, предпочтительно 2-12, более предпочтительно 2-8 или 2-6 и их производных, содержащих защитные группы.
Как используется в данном документе, термин олигонуклеотиды охватывает также олигонуклеозиды, аналоги олигонуклеотидов, модифицированные олигонуклеотиды, нуклеотидные миметики и т.п. в виде РНК и ДНК. В целом, эти соединения содержат остов из связанных мономерных субъединиц, где каждая связанная мономерная субъединица непосредственно или опосредованно присоединена к фрагменту гетероциклического основания. Связи, соединяющие мономерные субъединицы, мономерные субъединицы и фрагменты гетероциклического основания могут изменяться по структуре, давая возможность образования множества вариантов для полученных в результате соединений.
Модификации, известные в данной области, представляют собой модификацию гетероциклических оснований, сахара или связей, соединяющих мономерные субъединицы. Вариации межнуклеотидных связей, например, описаны в WO 2004/011474, начиная с конца стр.11, и включены в качестве ссылки.
Типичными производными являются фосфортиоаты, фосфордитиоаты, метил и алкилфосфонаты и фосфоноацетопроизводные.
Дополнительные типичные модификации имеют место по фрагменту сахара. Либо рибозу замещают на различный сахар или одно или более положений замещают другими группами, такими как F, O-алкил, S-алкил, N-алкил. Предпочтительными вариантами осуществления являются 2'-метил и 2'-метоксиэтокси. Все эти модификации известны в данной области.
Что касается фрагмента гетероциклического основания, существует ряд других синтетических оснований, которые используют в данной области, например, 5-метилцитозин, 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6- или 2-алкильные производные аденина и гуанина, 2-тиоурацил. Такие модификации также раскрыты в WO 2004/011474, начиная со стр.21.
При использовании в синтезе эти основания обычно имеют защитные группы, например, N-6-бензиладенин, N-4-бензилцитозин или N-2-изобутирилгуанин. В общем случае, все реакционно-способные группы, участие которых в дальнейшей реакции не предусмотрено, должны быть защищены, особенно, гидроксильные группы сахара.
В вариантах осуществления, относящихся к синтезу олигонуклеотидного фосфорамидита, является полезным проводить реакцию в присутствии ацетона или других кетонов, таких как ацетон, бутанон, пентанон, гексанон, циклогексанон, которые могут использоваться либо в качестве реакционной среды, или в качестве сорастворителя для других растворителей.
Изобретение далее поясняется посредством следующих неограничивающих примеров.
Пример 1
Синтез 5'-O-DMTr-T-3'-О-фосфорамидита с использованием метилимидазолий трифторацетата
5,0 г 5'-O-DMTr-T-3'-ОН (9,2 ммоль, 1,0 экв.) и 2,34 г метилимидазолий трифторацетата (11,9 ммоль, 1,3 экв.) растворяют в 100 мл дихлорметана и добавляют 3 г молекулярного сита 3Е и смесь перемешивают в течение 10 мин. Добавляют 3,8 мл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (11,9 мл, 1,3 экв.). Реакция проходит полностью через 2 ч. Выход (определен по ВЭЖХ): 95%.
Пример 2
Синтез 5'-O-DMTr-dG iBu -3'-О-фосфорамидита с использованием бензилимидазолий трифторацетата
322 мг метилимидазолий трифторацетата (1,64 ммоль, 1,05 экв.) и 1,0 г 5'-O-DMTr-dGiBu-3'-ОН (1,56 ммоль, 1,0 экв.) растворяют в 10 мл дихлорметана и добавляют 500 мг молекулярного сита 3Е. Через 30 мин 0,52 мл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (1,64 ммоль, 1,05 экв.) и 0,1 мл ацетона добавляют к перемешиваемому раствору. Реакция проходит полностью через 30 мин. Выход (определен по ВЭЖХ): 74%.
Пример 3
Синтез 5'-O-DMTr-dC Bz -3'-О-фосфорамидита с использованием метилимидазолий трифторацетата
9,51 г 5'-O-DMTr-dCBz-3'-ОН (15 ммоль, 1,0 экв.) растворяют в 80 мл ацетона и 80 мл ацетонитрила. 6,17 г метилимидазолий трифторацетата (32 ммоль, 2,1 экв.) и 9,64 г 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (32 ммоль, 2,1 экв.) добавляют к перемешиваемому раствору. Реакция проходит полностью через 30 мин. Добавляют 500 мл этилацетата, раствор экстрагируют дважды 250 мл NaHCO3-раствора и 250 мл насыщенного солевого раствора. Органический слой сушат MgSO4 и упаривают досуха. Остаток растворяют в 40 мл дихлорметана, добавляют 250 мл пентана, супернатант декантируют и остаток сушат при пониженном давлении с образованием бесцветной пены. Выход (12,0 г, 14,4 ммоль): 96%, чистота (определена по ВЭЖХ): 93%.
Пример 4
Синтез 5'-O-DMTr-dA Bz -3'-О-фосфорамидита с использованием бензилимидазолий трифторацетата
38 мг бензилимидазолий трифторацетата (0,14 ммоль, 1,5 экв.) растворяют в 5 мл ацетонитрила и добавляют 300 мг молекулярного сита 3Е. Добавляют 145 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (0,46 ммоль, 5,0 экв.). Через 30 мин добавляют 61 мг 5'-O-DMTr-dABz-3'-OH (0,09 ммоль, 1,0 экв.) и раствор перемешивают в течение ночи. Реакция проходит полностью через 17 час. Выход (определен по ВЭЖХ): 91%.
Пример 5
Синтез 5'-O-DMTr-dC Bz -3'-О-фосфорамидита с использованием каталитического количества метилимидазолий трифторацетата
500 мг 5'-O-DMTr-dCBz-3'-OH (0,79 ммоль, 1,0 экв.) растворяют в 18 мл дихлорметана и 1 мл ДМФА, добавляют 3 г молекулярного сита 3Е. 50 мг метилимидазолий трифторацетата (0,17 ммоль, 0,2 экв.) и 276 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (0,87 ммоль, 1,1 экв.) добавляют к перемешиваемому раствору. Реакция проходит полностью через 24 ч. Выход (определен по ВЭЖХ): 89%.
Пример 6
Синтез 5'-O-DMTr-dG iBu -3'-О-фосфорамидита с использованием каталитического количества бензилимидазолий трифторацетата
5 мг бензилимидазолий трифторацетата (0,02 ммоль, 0,2 экв.) растворяют в 5 мл ацетонитрила и добавляют 300 мг молекулярного сита 3Е. 145 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (0,46 ммоль, 5,0 экв.) добавляют к перемешиваемому раствору. Через 1 ч добавляют 60 мг 5'-O-DMTr-dGiBu-3'-OH (0,09 ммоль, 1,0 экв.) и раствор перемешивают в течение ночи. Реакция проходит полностью через 48 час. Выход (определен по ВЭЖХ): 90%.
Пример 7
Синтез 5'-O-DMTr-T-3'-О-фосфорамидита с использованием каталитического количества бензилимидазолий трифторацетата
50 мг бензилимидазолий трифторацетата (0,18 ммоль, 0,18 экв.) и 500 мг 5'-O-DMTr-T-3'-OH (0,92 ммоль, 1,0 экв.) растворяли в 28 мл дихлорметана и добавляют 3 г молекулярного сита 3Е. 350 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (1,0 ммоль, 1,1 экв.) добавляют к перемешиваемому раствору. Реакция проходит полностью через 25 час. Выход (определен по ВЭЖХ): 90%.
Пример 8
Синтез 5'-O-DMTr-T-Р(S)-dC Bz -3-фосфорамидита с использованием метилимидазолий трифторацетата
100 мг 5'-O-DMTr-T-Р(S)-dCBz-3'-OH (0,10 ммоль, 1,0 экв.) и 24,4 мг метилимидазолий трифторацетата (0,11 ммоль, 1,1 экв.) растворяют в 10 мл дихлорметана, добавляют 200 мг молекулярного сита 4Е. 32 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (0,10 ммоль, 1,0 экв.) добавляют к перемешиваемому раствору. Реакция проходит полностью через 24 час. Выход (определен по ВЭЖХ): 60%.
Пример 9
Синтез 5'-O-DMTr-dC Bz -P(S)-dG iBu -3'-О-фосфорамидита с использованием метилимидазолий трифторацетата
100 мг 5'-O-DMTr-dCBz-P(S)-dGiBu-3'-ОН (0,09 ммоль, 1,0 экв.) и 17,8 мг метилимидазолий трифторацетата (0,09 ммоль, 1,0 экв.) растворяют в 10 мл дихлорметана, добавляют 200 мг молекулярного сита 4Е. 28 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (0,09 ммоль, 1,0 экв.) добавляют к перемешиваемому раствору. Реакция проходит полностью через 3 ч. Выход (определен по ВЭЖХ): 56%.
Пример 10
Синтез 5'-O-DMTr-dG iBu -P(O)-dG iBu -3'-О-фосфорамидита с использованием метилимидазолий трифторацетата
106 мг 5'-O-DMTr-dGiBu-P(O)-dGiBu-3'-ОН (0,10 ммоль, 1,0 экв.) и 30 мг метилимидазолий трифторацетата (0,15 ммоль, 1,5 экв.) растворяют в 10 мл ацетона, добавляют 500 мг молекулярного сита 3Е. Через 30 мин 34 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (0,11 ммоль, 1,1 экв.) добавляют к перемешиваемому раствору. Реакция проходит полностью через 4 ч. Выход (определен по ВЭЖХ): 55%.
Пример 11
Синтез 5'-O-DMTr-T-P(S)-dC Bz -P(S)-T-P(S)-dC Bz -P(S)-dC Bz -P(S)-dC Bz -3'-О-фосфорамидита с использованием метилимидазолий трифторацетата
10 мг 5'-O-DMTr-T-P(S)-dCBz-P(S)-T-P(S)-dCBz-P(S)-dCBz-P(S)-dCBz-3'-ОН (3,6 мкмоль, 1,0 экв.) и 1,4 мг метилимидазолий трифторацетата (7,2 мкмоль, 2,0 экв.) растворяют в 0,5 мл ацетона и 0,5 мл ацетонитрила, добавляют 50 мг молекулярного сита 3Е. Через 30 мин 5,8 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (18,1 мкмоль, 5,0 экв.) добавляют к перемешиваемому раствору. Реакция проходит полностью через 5 час. Выход (определен по ВЭЖХ): 71%.
Пример 12
Синтез 5'-O-DMTr-dT-3'-О-фосфорамидита посредством генерации in situ N-метилимидазолий трифторацетата
1,00 г 5'-O-DMTr-dT-3'-ОН (1,84 ммоль, 1,0 экв.) растворяют в 2 мл дихлорметана и 2 мл ацетона. Добавляют 300 мг N-метилимидазола (3,68 ммоль, 291 мкл, 2,0 экв.) и 665 мг 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (2,21 ммоль, 700 мкл, 1,2 экв.) с последующим добавлением 1,00 г молекулярного сита 3Е. К этой перемешиваемой суспензии по каплям добавляют 230 мг трифторуксусной кислоты (2,02 ммоль, 159 мкл, 1,1 экв) в 1 мл дихлорметана. Реакция проходит полностью через 3 ч. Выход (определен по ВЭЖХ): 99%.
Пример 13
Синтез 5'-O-DMTr-dG iBu -3'-О-фосфорамидита посредством генерации in situ N-метилимидазолий трифторацетата
1,00 г 5'-O-DMTr-dGiBu-3'-ОН (1,56 ммоль, 1,0 экв.) растворяют в 2 мл дихлорметана и 2 мл ацетона. Добавляют 255 мг N-метилимидазола (3,11 ммоль, 247 мкл, 2,0 экв.) и 563 мг 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (1,87 ммоль, 593 мкл, 1,2 экв.) с последующим добавлением 1,00 г молекулярного сита 3Е. К этой перемешиваемой суспензии по каплям добавляют 195 мг трифторуксусной кислоты (1,72 ммоль, 135 мкл, 1,1 экв.) в 1 мл дихлорметана. Реакция проходит полностью через 5 час. Выход (определен по ВЭЖХ): 88%.
Пример 14
Синтез 5'-O-DMTr-dG iBu -3'-О-фосфорамидита с использованием смеси N-метилимидазолий трифторацетата-N-метилимидазола
1,00 г 5'-O-DMTr-dGiBu-3'-ОН (1,56 ммоль, 1,0 экв.) растворяют в 2 мл дихлорметана и 2 мл ацетона. Добавляют 2,00 г молекулярного сита 3Е, 367 мг N-метилимидазолий трифторацетата (1,87 ммоль, 1,2 экв.) и 383 мг N-метилимидазола (4,68 ммоль, 371 мкл, 3,0 экв) с последующим добавлением 563 мг 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (1,87 ммоль, 593 мкл, 1,2 экв.). Реакция проходит полностью через 20 мин. Выход (определен по ВЭЖХ): 90%.
Пример 15
Синтез 5'-O-DMTr-dC Bz -3'-О-фосфорамидита с использованием смеси N-метилимидазолий трифторацетата-N-метилимидазола
1,00 г 5'-O-DMTr-dGiBu-3'-ОН (1,56 ммоль, 1,0 экв.) растворяют в 2 мл дихлорметана и 2 мл ацетона. Добавляют 2,00 г молекулярного сита 3Е, 367 мг N-метилимидазолий трифторацетата (1,87 ммоль, 1,2 экв.) и 383 мг N-метилимидазола (4,68 ммоль, 371 мкл, 3,0 экв) с последующим добавлением 563 мг 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (1,87 ммоль, 593 мкл, 1,2 экв.). Реакция проходит полностью через 20 мин. Выход (определен по ВЭЖХ): 90%.
Пример 16
Синтез 5'-O-DMTr-dC Bz -P(O)-dA Bz -3'-О-фосфорамидита посредством генерации in situ метилимидазолий трифторацетата
100 мг 5'-O-DMTr-dC Bz-P(O)-dABz-3'-ОН (90,7 мкмоль, 1,0 экв.) растворяют в 200 мкл дихлорметана и 200 мкл ацетона. Добавляют 15 мг N-метилимидазола (180 мкмоль, 14 мкл, 2,0 экв.) и 54,6 мг 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (181 мкмоль, 57 мкл, 2,0 экв.) с последующим добавлением 100 мг молекулярного сита 3Е. К этой перемешиваемой суспензии по каплям добавляют 100 мкл 1М раствора трифторуксусной кислоты в дихлорметане. Реакция проходит полностью через 30 мин. Выход (определен по ВЭЖХ): 90%.
Пример 17
Синтез 5'-О-фосфорамидита-dT-P(O)-dG iBu -P(O)-dG iBu -3'-O-Lev с использованием N-метилимидазолий трифторацетата
2,0 г 5'-НО-dT-P(O)-dGiBu-P(O)-dGiBu-3'-O-Lev (1,6 ммоль, 1,0 экв.) растворяют в 80 мл ацетона, добавляют 500 мг метилимидазолий трифторацетата (2,5 ммоль, 1,56 экв.) и 4,0 г молекулярного сита 3Е. Добавляют 2,76 мл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (2,62 г, 8,7 ммоль, 5 экв.) и через 30 мин перемешивания фосфорамидит осаждают добавлением 300 мл н-гептана. Выход (определен по ВЭЖХ): 72%.
Пример 18
Синтез 5'-О-фосфорамидита-dC Bz -P(O)-dA Bz -3'-O-Lev с использованием N-метилимидазолий трифторацетата
1,0 г 5'-НО-dCBz-P(O)-dABz-3'-O-Lev (1,1 ммоль, 1,0 экв.) и 326 мг метилимидазолий трифторацетата (1,66 ммоль, 1,5 экв.) растворяют в 8 мл ацетона и добавляют 10 мл дихлорметана и 2,0 г молекулярного сита 3Е. Добавляют 700 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (664 мг, 2,2 ммоль, 2 экв.) и через 1 ч перемешивания фосфорамидит осаждают добавлением 50 мл н-гептана. Выход (определен по ВЭЖХ): 78%.
Пример 19
Синтез 5'-О-фосфорамидита-T-P(O)-dC Bz -P(O)-dC Bz -P(O)-dC Bz -3'-O-Lev с использованием N-метилимидазолий трифторацетата
20 мг 5'-НО-T-P(O)-dCBz-P(O)-dCBz-P(O)-dCBz-3'-O-Lev (11,6 мкмоль, 1,0 экв.) и 4,3 мг N-метилимидазолий трифторацетата (22 мкмоль, 1,9 экв.) растворяют в 2 мл ацетона и добавляют 40 мг молекулярного сита 3Е. Добавляют 15 мкл 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (14 мг, 47 ммоль, 4 экв.) и через 1 ч перемешивания фосфорамидит осаждают добавлением 3 мл н-гептана. Выход (определен по ВЭЖХ): 86%.
Пример 20
Синтез 5'-O-TBDPS-dT-3'-О-фосфорамидита с использованием N-метилимидазолий трифторацетата
510 мг 5'-O-DMTr-dT-3'-OH (1,06 ммоль, 1,0 экв.) растворяют в 20 мл ацетона и при перемешивании добавляют 251 мг N-метилимидазолий трифторацетата (1,27 ммоль, 1,2 экв.), 1,0 г молекулярного сита 3Е и 383 мг 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (403 мкл, 1,27 ммоль, 1,2 экв.). Реакция проходит полностью через 30 мин. Выход (определен по ВЭЖХ): 88%.
Пример 21
Синтез 5'-O-TBDMS-dG iBu -3'-О-фосфорамидита с использованием N-метилимидазолий трифторацетата
1 мг 5'-O-TBDMS-dG iBu -3'-OH (2,21 ммоль, 1,0 экв.) растворяют в 20 мл ацетона и при перемешивании добавляют 875 мг N-метилимидазолий трифторацетата (4,42 ммоль, 2 экв.), 2,0 г молекулярного сита 3Е и 3,33 г 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидита (3,5 мл, 11 ммоль, 5 экв.). Реакция проходит полностью через 30 мин. Выход (определен по ВЭЖХ): 88%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕЗ ОЛИГОНУКЛЕОТИДОВ | 2006 |
|
RU2465280C2 |
| НОВЫЕ АНАЛОГИ 2`, 5`-ОЛИГОАДЕНИЛАТА ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2311422C2 |
| МИМЕТИКИ ПОЛИ (ADP-РИБОЗЫ) И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2559873C2 |
| ОЛИГОНУКЛЕОТИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2088588C1 |
| ПРОИЗВОДНОЕ ФОСФОРАМИДИТА И СПОСОБ ПОЛУЧЕНИЯ ОЛИГО-РНК | 2005 |
|
RU2415862C2 |
| ОЧИСТКА ОЛИГОНУКЛЕОТИДОВ | 2006 |
|
RU2401272C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТИОФОСФАТНЫХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ТЕРАПЕВТИЧЕСКОГО ПРИМЕНЕНИЯ | 2024 |
|
RU2836132C1 |
| Способ триэфирного синтеза олигонуклеотидов | 1984 |
|
SU1351938A1 |
| НУКЛЕОЗИДЫ С МОДИФИЦИРОВАННЫМИ САХАРАМИ И ОЛИГОНУКЛЕОТИДЫ | 1995 |
|
RU2145964C1 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ НУКЛЕОЗИДЫ И ОЛИГОМЕРЫ, ПОЛУЧЕННЫЕ ИЗ НИХ | 2017 |
|
RU2824141C2 |
Настоящее изобретение относится к способу получения фосфорамидитов и может быть использовано в синтезе олигонуклеотидов. Предложенный способ включает взаимодействие гидроксилсодержащего соединения, содержащего фрагмент сахара, с фосфитилирующим агентом в присутствии активатора, имеющего формулу I
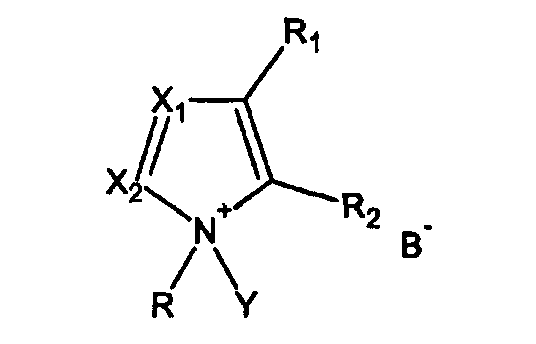
где R = алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил, R1, R2 = или Н, или вместе образуют 5-6-членный цикл, X1, X2 = независимо или N, или СН, Y = Н или Si(R4)3 где R4 = алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил, В = трифторацетат, дихлорацетат, мезил, тозил, о-хлорфенолят. Технических результат - разработка нового способа получения фосфорамидитов. 4 н. и 13 з.п. ф-лы.
1. Способ получения фосфорамидита, включающий стадию:
взаимодействия гидроксилсодержащего соединения, содержащего фрагмент сахара, с фосфитилирующим агентом в присутствии активатора, имеющего формулу I

где R - алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
R1, R2 - или Н, или вместе образуют 5-6-членный цикл,
X1, Х2 - независимо или N, или СН,
Y - Н или Si(R4)3, где R4 - алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
В - трифторацетат, дихлорацетат, мезил, тозил, о-хлорфенолят.
2. Способ по п.1, где активатор имеет формулу, выбранную из группы, состоящей из
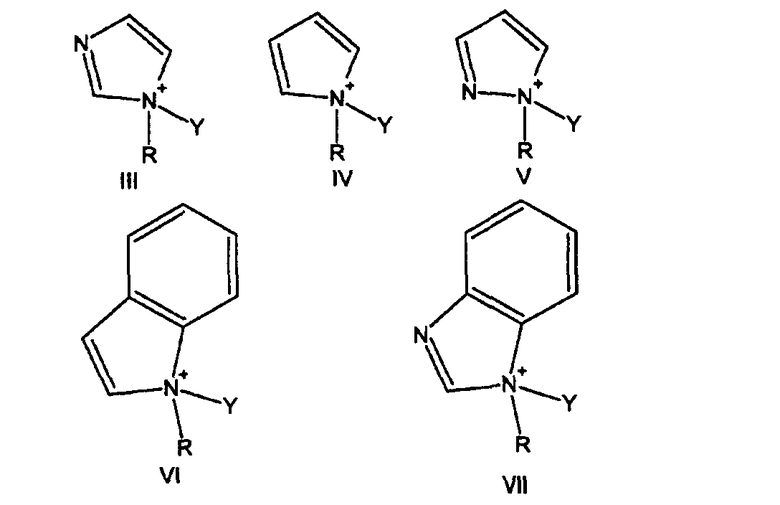
Y определен в п.1,
R представляет собой метил, фенил или бензил.
3. Способ по п.1 или 2, где гидроксилсодержащее соединение представляет собой нуклеозид или олигомер, являющийся его производным.
4. Способ по п.1 или 2, где гидроксилсодержащее соединение представляет собой 5'-O-защищенный нуклеозид, имеющий 3'-гидроксильную группу или 3'-O-защищенный нуклеозид, имеющий 5'-гидроксильную группу.
5. Способ по п.1 или 2, где активатор получают in situ и применяют без очистки.
6. Способ по п.1 или 2, где реакция происходит в присутствии смеси активатора, имеющего формулу I, и соответствующего основания формулы VIII
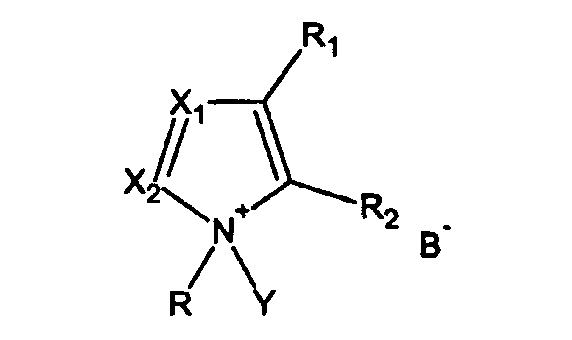
где R1, R2, X1, X2 и R определены в п.1.
7. Способ по п.7, где соответствующее основание приводится в контакт с гидроксилсодержащим соединением и фосфитилирующим агентом и добавляют кислоту H+B-.
8. Способ по п.1 или 2, где фосфитилирующий агент имеет формулу II

где Z представляет собой уходящую группу, a R1 и R2 независимо являются вторичными аминогруппами или атомами галогена.
9. Способ п.8, где фосфитилирующий агент представляет собой 2-цианоэтил-N,N,N',N'-тетраизопропилфосфордиамидит.
10. Способ по п.1 или 2, где реакция происходит в присутствии ацетона.
11. Применение активатора, имеющего формулу I
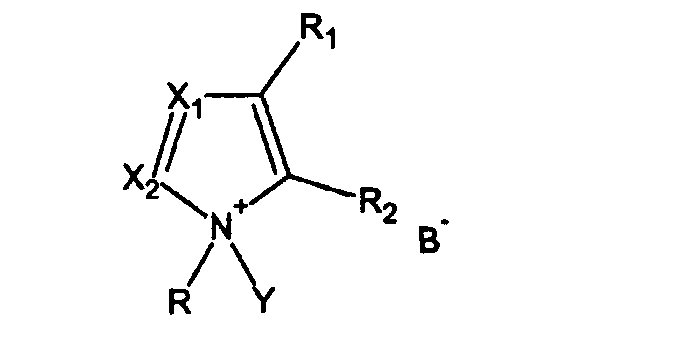
где R - алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
R1, R2 - или Н, или вместе образуют 5-6-членный цикл,
X1, Х2 - независимо или N, или СН,
Y - Н или Si(R4)3, где R4 - алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
В - трифторацетат, дихлорацетат, мезил, тозил, о-хлорфенолят,
в качестве активатора для фосфитилирования гидроксилсодержащих соединений, содержащих фрагмент сахара, фосфитилирующим агентом для получения фосфорамидита.
12. Применение по п.11 для синтеза фосфорамидита аденозина, фосфорамидита цитозина, фосфорамидита гуанозина и фосфорамидита урацила, фосфорамидита дезоксиаденозина, фосфорамидита дезоксигуанозина, фосфорамидита дезокситимидина, фосфорамидита дезоксицитозина, а также фосфорамидитов олигонуклеотидов, имеющих формулу Xn, где каждый Х выбирают из A, dA, С, dC, G, dG, U, dT, и n=2-8, предпочтительно 2-6, и их производных, содержащих защитные группы.
13. Смесь активатора, имеющего формулу I
где R - алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
R1, R2 - или Н, или вместе образуют 5-6-членный цикл,
Х1, Х2 - независимо или N, или СН,
Y - Н или Si(R4)3, где R4 - алкил, циклоалкил, арил, аралкил, гетероалкил, гетероарил,
В - трифторацетат, дихлорацетат, мезил, тозил, о-хлорфенолят,
с добавкой, имеющей формулу VIII
где R, R1, R2, X1, X2 определены как для формулы I, или пиридином при молярном соотношении от 1:1 до 1:10 (моль:моль).
14. Применение смеси по п.13 в качестве активатора для фосфитилирования гидроксилсодержащих соединений, содержащих фрагмент сахара, фосфитилирующим агентом для получения фосфорамидита.
15. Применение смеси по п.14 для синтеза фосфорамидита аденозина, фосфорамидита цитозина, фосфорамидита гуанозина и фосфорамидита урацила, фосфорамидита дезоксиаденозина, фосфорамидита дезоксигуанозина, фосфорамидита дезокситимидина, фосфорамидита дезоксицитозина, а также фосфорамидитов олигонуклеотидов, имеющих формулу Xn, где каждый Х выбирают из A, dA, С, dC, G, dG, U, dT, и n=2-8, предпочтительно 2-6, и их производных, содержащих защитные группы.
16. Применение кетонов, имеющих формулу Rx-C(=O)-Ry, где Rx и Ry представляют собой независимо С1-С6 алкил или вместе образуют циклоалкил, в качестве реакционной среды или сорастворителя в синтезе фосфорамидитов способом по пп.1-10.
17. Применение по п.16, где кетон представляет собой ацетон, бутанон, пентанон, гексанон, циклогексанон или их смесь.
| Химическая энциклопедия | |||
| / Под ред | |||
| И.Н.Кнунянца | |||
| - М., 1990, т.2, «кетоны» | |||
| YOSHIHIRO HAYAKAWA еt al | |||
| - Journal of American chemical society, 2001, 123, №34, 8165-8176 | |||
| LUBOS ARNOLD et al | |||
| - Collect | |||
| Czech | |||
| Chem | |||
| Commun., 1989, Vol.54, 523-532 | |||
| SHIGENORI IWAI et al | |||
| - Nucleic Acids Research, 1999, 27, №11, 2299-2303 | |||
| YOSHIHIRO |
Авторы
Даты
2012-01-20—Публикация
2005-12-15—Подача